PRAVILNIKO MERAMA ZA OTKRIVANJE, SPREČAVANJE ŠIRENJA I SUZBIJANJE ŠTETNOG ORGANIZMA CLAVIBACTER MICHIGANENSIS (SMITH) DAVIS ET AL. SPP. SEPEDONICUS (SPIECKERMANN ET KOTTHOFF) DAVIS ET AL. PROUZROKOVAČA PRSTENASTE TRULEŽI KRTOLA KROMPIRA, NAČINU ODREĐIVANJA GRANICA ZARAŽENOG, UGROŽENOG I PODRUČJA BEZ ŠTETNIH ORGANIZAMA, USLOVIMA ZA OKONČANJE NALOŽENIH MERA, KAO I NAČINU OBAVEŠTAVANJA O PREDUZETIM MERAMA I PRESTANAK MERA("Sl. glasnik RS", br. 103/2009) |
Ovim pravilnikom propisuju se mere za otkrivanje, sprečavanje širenja i suzbijanje štetnog organizma Clavibacter michiganensis (Smith) Davis et al. Spp. sepedonicus (Spieckermann et Kotthoff) Davis et al., prouzrokovača prstenaste truleži krtola krompira, način određivanja granica zaraženog, ugroženog i područja bez štetnog organizma, uslovima za okončanje naloženih mera, kao i načinu obaveštavanja o preduzetim merama i prestanak mera.
II MERE OTKRIVANJA ŠTETNOG ORGANIZMA
Radi otkrivanja štetnog organizma Clavibacter michiganensis (Smith) Davis et al. Spp. sepedonicus (Spieckermann et Kotthoff) Davis et al., prouzrokovača prstenaste truleži krtola krompira (u daljem tekstu: štetni organizam) sprovodi se poseban nadzor nad štetnim organizmom koji obuhvata preglede biljaka i krtola krompira (Solanum tuberosum L.) i preglede propisanih objekata.
Broj, poreklo, metod i vreme uzimanja uzoraka prilikom pregleda biljaka i krtola krompira i propisanih objekata određuje se u zavisnosti od specifičnih sistema proizvodnje krompira i biologije štetnog organizma.
Pri pregledu biljaka krompira u polju u toku vegetacije vrši se vizuelni pregled na prisustvo štetnog organizma, uzimaju se uzorci biljaka i dostavljaju ovlašćenoj laboratoriji (u daljem tekstu: laboratorija) radi laboratorijskog ispitivanja.
Pri pregledu krtola krompira, uzimaju se uzorci krtola semenskog krompira i ostalog krompira koji nije namenjen sadnji (u daljem tekstu: merkantilni krompir), prvenstveno iz lotova u skladištima i distributivnim centrima radi obavljanja vizuelnog pregleda sečenjem krtola, odnosno dostavljanja laboratoriji radi laboratorijskog ispitivanja. Semenski krompir mora da potiče direktno od materijala proizvedenog u skladu sa zvaničnim programom kontrole i za koji je laboratorijskim ispitivanjem utvrđeno da nije zaražen štetnim organizmom.
Laboratorijsko ispitivanje iz st. 1. i 2. ovog člana sprovodi se u skladu sa međunarodno prihvaćenim procedurama na način opisan u Prilogu ovog pravilnika - Šema testiranja za dijagnostiku, detekciju i identifikaciju prouzrokovača prstenaste truleži krompira (u daljem tekstu: Prilog), koji je odštampan uz ovaj pravilnik i čini njegov sastavni deo.
Sumnja na pojavu štetnog organizma postoji ako su vizuelno uočeni tipični simptomi bolesti ili je rezultat jednog od brzih testova provere (screening test) pozitivan.
Da bi se potvrdila ili otklonila sumnja na pojavu štetnog organizma, sprovode se dalja laboratorijska ispitivanja na način opisan u Prilogu od strane ovlašćene laboratorije.
Prilikom sprovođenja laboratorijskih ispitivanja na odgovarajući način čuvaju se uzorkovane krtole i, kada je to moguće, uzorkovane biljke, preostali ekstrakt i dodatno pripremljen materijal za brze testove provere (screening testa), npr. stakalca za imunofluorescenciju i svu relevantnu dokumentaciju.
Sačuvani uzorak krtola omogućava i ispitivanje sortnosti u slučajevima kada je to potrebno.
Kada je laboratorijskim ispitivanjem potvrđeno prisustvo štetnog organizma, najmanje mesec dana od dana potvrđene zaraze čuva se na odgovarajući način uzorak veštački zaraženih test biljaka plavog patlidžana i izolovana kultura štetnog organizma.
U slučaju sumnje na pojavu štetnog organizma, preduzimaju se sledeće mere:
1) zabrana premeštanja svih lotova ili pošiljaka krompira iz kojih su uzeti uzorci;
2) dodatne preventivne mere radi sprečavanja širenja štetnog organizma, u zavisnosti od procenjenog stepena rizika.
Dodatne preventivne mere iz stava 1. tačka 2) ovog člana mogu uključiti nadzor nad premeštanjem svih ostalih krtola ili biljaka povezanih sa sumnjivom pojavom, unutar i van objekata, ograničavanje upotrebe moguće zaraženih mašina i opreme.
Ako držalac bilja, biljnih proizvoda i propisanih objekata ili bilo koja druga osoba uoči simptome zaraze ili posumnja na pojavu štetnog organizma, obavezan je da o tome odmah obavesti Ministarstvo.
III NAČIN ODREĐIVANJA GRANICA ZARAŽENOG, UGROŽENOG I PODRUČJA BEZ ŠTETNOG ORGANIZMA, MERE ZA SPREČAVANJE ŠIRENJA I SUZBIJANJE ŠTETNOG ORGANIZMA I USLOVI ZA OKONČANJE NALOŽENIH MERA
Način određivanja granica zaraženog, ugroženog i područja bez štetnog organizma
Kada se na osnovu rezultata laboratorijskog ispitivanja potvrdi prisustvo štetnog organizma određuju se granice zaraženog, ugroženog ili područja bez štetnog organizma, tako što se:
1) označava kao zaražene krtole ili biljke, pošiljke, odnosno lotovi, mašine, prevozna sredstva, skladišta ili njihovi delovi i drugi objekti i predmeti, uključujući i materijal za pakovanje, iz kojih je svaki od uzoraka uzet, kao i mesta proizvodnje i parcele sa kojih potiču biljke i krtole;
2) određuje obim moguće zaraze evidentiranjem činjenica o svim kontaktima u proizvodnom procesu sa izvorom zaraze (pre i posle vađenja krtola) u cilju određivanja obima moguće zaraze i širenja štetnog organizma;
3) razgraničava zaraženo, ugroženo i područje bez štetnog organizma na osnovu označene i potvrđene zaraze, obima moguće zaraze, kao i mogućeg širenja štetnog organizma.
Određivanje obima moguće zaraze vrši se evidentiranjem:
1) krtola ili biljaka proizvedenih na mestu proizvodnje koje je označeno kao zaraženo;
2) drugih mesta proizvodnje koja su u bilo kakvoj vezi sa krtolama ili biljkama koje su označene kao zaražene, kao i zajednički korišćene opreme i objekata;
3) krtola ili biljaka koje su proizvedene na mestima proizvodnje iz tačke 2) ovoga člana ili su se nalazile na tim mestima istovremeno sa krtolama i biljkama koje su označene kao zaražene;
4) prostora i objekata u kojima se obavlja manipulacija krompira koji potiče sa mesta proizvodnje iz tač. 1) do 3) ovog člana;
5) mašina, prevoznih sredstava, skladišta ili njihovih delova, kao i drugih objekata ili predmeta, uključujući i materijal za pakovanje, koji su mogli da dođu u dodir sa krtolama ili biljkama koje su označene kao zaražene;
6) krtola ili biljaka koje su bile uskladištene ili u dodiru sa nekim od propisanih objekata ili sa predmetima iz tačke 5) ovog člana, pre njihovog čišćenja i dezinfekcije;
7) krtola ili biljaka koje se smatraju moguće zaraženim zbog klonske povezanosti sa krtolama ili biljkama koje su označene kao zaražene, iako su rezultati testiranja negativni. Sprovodi se i test sortnosti da bi se proverio identitet zaraženih i klonski srodnih krtola ili biljaka krompira;
8) mesta proizvodnje krtola ili biljaka iz tačke 7) ovog člana.
Određivanje mogućeg širenja štetnog organizma vrši se na osnovu blizine drugih mesta proizvodnje krompira i drugih biljaka domaćina, kao i zajedničke proizvodnje i upotrebe zaliha semenskog krompira.
Partije krompira koje su klonski srodne sa krtolama ili biljkama koje su označene kao zaražene podležu obaveznom laboratorijskom ispitivanju, u skladu sa Prilogom.
Mere za sprečavanje širenja i suzbijanje štetnog organizma
Krtole ili biljke koje su označene kao zaražene se uništavaju, odnosno spaljuju ili na drugi način odlažu na mestu za odlaganje otpada na kome ne postoji rizik od širenja štetnog organizma.
Ako je utvrđeno da ne postoji rizik od širenja štetnog organizma krtole ili biljke koje su označene kao zaražene mogu se upotrebljavati i to:
1) kao hrana za životinje posle termičke obrade na način koji ne ostavlja nikakvu mogućnost preživljavanja štetnog organizma;
2) industrijski prerađivati, pod uslovom da se direktno dopreme do mesta prerade na kome postoji oprema za odlaganje otpada čijim korišćenjem je otklonjena opasnost od širenja štetnog organizma i koje ima sistem za čišćenje i dezinfekciju prevoznih sredstava koja napuštaju mesto prerade;
3) podvrgavati i drugim merama pod uslovom da nema opasnosti od širenja štetnog organizma.
Krtole ili biljke koje se smatraju moguće zaraženim štetnim organizmom i krtole ili biljke krompira koje su klonski povezane sa onima koje su označene kao zaražene bez obzira na rezultate testiranja ne smeju se koristiti za sadnju, već se mogu:
1) upotrebiti kao merkantilni krompir namenjen ishrani, pri čemu krompir mora da bude pakovan na mestima koja raspolažu odgovarajućom opremom za odlaganje otpada i koji je pakovan za direktnu isporuku bez prepakivanja. Sa semenskim krompirom dozvoljeno je rukovati na tim istim mestima samo ako se radi odvojeno ili nakon čišćenja i dezinfekcije, ili
2) upotrebiti kao merkantilni krompir namenjen industrijskoj preradi, uz direktnu i brzu isporuku do pogona za preradu, koji mora da raspolaže odgovarajućom opremom za odlaganje otpada i sistemom za čišćenje i dezinfekciju prevoznih sredstava koja napuštaju mesto prerade, ili
3) upotrebiti ili odložiti na neki drugi način pod uslovom da nema opasnosti od širenja štetnog organizma.
Otpad koji je nastao kao rezultat sprovođenja mera iz čl. 10. i 11. ovog pravilnika i otpad koji nastaje tokom rukovanja, odstranjivanja i prerade zaraženih partija krompira odlaže se tako da se izbegne svaka opasnost od širenja štetnog organizma, i to:
1) otpaci krompira (uključujući odbačeni krompir i koru) i svi drugi čvrsti otpaci koji su u vezi s krompirom (uključujući zemlju, kamenje i druge ostatke) uklanjaju se na sledeći način:
- odlaganjem na za to službeno odobrenom mestu, na kojem ne postoji opasnost od nekontrolisanog širenja štetnog organizma u okolinu, npr. ispiranjem kroz pore zemlje do poljoprivrednog zemljišta. Otpaci se prevoze direktno do određenog mesta u zatvorenom prevoznom sredstvu tako da ne postoji opasnost od gubitka otpada,
- spaljivanjem,
- primenom neke druge mere za koje je utvrđeno da ne postoji opasnost od širenja štetnog organizma;
2) tečni otpad nastao u preradi koji sadrži čvrste čestice se filtrira ili obrađuje postupkom sedimentacije radi uklanjanja čvrstih čestica koje na način iz stava 1. tačka 1) ovog člana.
Tečni deo otpada neophodno je:
1) zagrejati na temperaturi od najmanje 60°C u trajanju najmanje 30 minuta ili
2) odstraniti pod službenim nadzorom na način koji onemogućava da otpaci dođu na bilo koji način u dodir sa poljoprivrednim zemljištem ili izvorima vode koja može biti korišćena za navodnjavanje poljoprivrednog zemljišta.
Mašine, prevozna sredstva, skladišta i njihovi delovi i drugi objekti i predmeti, uključujući i materijal za pakovanje, koji su označeni kao zaraženi ili se smatraju zaraženima moraju da se očiste i dezinfikuju primenom odgovarajućih metoda za čišćenje i dezinfekciju kojima se otklanja opasnost od širenja štetnog organizma.
U slučaju kada materijal za pakovanje iz stava 1. ovog člana nije moguće očistiti i dezinfikovati tako da se otkloni opasnost od širenja štetnog organizma nalaže se njegovo uništavanje.
Na polju koje je označeno kao zaraženo sprovode se sledeće mere:
1) za vreme od najmanje tri vegetacione godine posle godine u kojoj je utvrđena zaraza zabranjena je sadnja krtola i biljaka kao i setva semena krompira u botaničkom smislu i drugih biljaka domaćina štetnog organizma ili useva za koje je utvrđeno da omogućuju širenje štetnog organizma i uklanjanje samoniklih biljaka krompira i drugih biljaka domaćina štetnog organizma. U prvoj sezoni proizvodnje krompira koja sledi posle perioda iz stava 1. ovog člana, pod uslovom da na polju najmanje dve poslednje vegetacione godine tokom sprovođenja pregleda nisu pronađene samonikle biljke krompira i druge biljke domaćini, dozvoljava se proizvodnja isključivo merkantilnog krompira i sprovodi laboratorijsko ispitivanje krtola prilikom vađenja. U sezoni proizvodnje krompira koja sledi posle sezone iz stava 2. ovog člana, dozvoliće se, uz odgovarajući plodored, koji mora biti najmanje dvogodišnji za proizvodnju semenskog krompira, proizvodnja semenskog ili merkantilnog krompira, uz sprovođenje pregleda;
2) tokom četiri vegetacione godine posle godine u kojoj je utvrđena zaraza sprovode se mere održavanja polja na ugaru ili korišćenje polja kao trajnog pašnjaka sa intenzivnom ispašom ili čestom niskom kosidbom i uklanjanje samoniklih biljaka krompira i drugih samoniklih biljaka domaćina štetnog organizma.
Posle sprovođenja mera iz stava 1. tačka 2) ovog člana, u sledećoj vegetacionoj godini dozvoliće se proizvodnja semenskog ili merkantilnog krompira, uz laboratorijsko ispitivanje izvađenih krtola ako na polju koje je označeno kao zaraženo u toku sprovođenja pregleda nisu pronađene samonikle biljke krompira i druge biljke domaćini najmanje dve uzastopne vegetacione godine.
Na ostalim poljima unutar mesta proizvodnje koje je označeno kao zaraženo u vegetacionoj godini koja sledi posle godine u kojoj je utvrđena zaraza zabranjuje se sadnja krtola i biljaka krompira, kao i setva semena krompira u botaničkom smislu i nalaže uklanjanje samoniklih biljaka domaćina štetnog organizma.
Izuzetno od stava 1. ovog člana, ako je pre sadnje utvrđeno da je otklonjena opasnost od samoniklih biljaka krompira, može se dozvoliti sadnja sertifikovanog semenskog krompira namenjenog isključivo proizvodnji merkantilnog krompira uz obavezno laboratorijsko ispitivanje izvađenih krtola.
U drugoj i trećoj vegetacionoj godini koje slede posle godine u kojoj je zaraza utvrđena, posle sprovođenja mera iz st. 1. i 2. ovog člana dozvoliće se sadnja isključivo sertifikovanog semenskog krompira za semensku ili merkantilnu proizvodnju.
Pored mera iz st. 1, 2. i 3. ovog člana najmanje tri vegetacione godine sprovodi se uklanjanje samoniklih biljaka krompira i drugih biljaka domaćina štetnog organizma ako su prisutne, kao i laboratorijsko ispitivanje izvađenog krompira sa svakog polja.
U zaštićenim prostorima na mestu proizvodnje koje je označeno kao zaraženo koji su namenjeni proizvodnji bilja nije dozvoljena sadnja krtola i biljaka krompira kao i setva semena krompira u botaničkom smislu, sve dok se ne sprovedu mere uništavanja štetnog organizma i ne uklone ostaci biljaka domaćina, pri čemu se kao minimalna mera sprovodi zamena supstrata za gajenje, čišćenje i dezinfekcija proizvodne jedinice i celokupne opreme.
Posle sprovođenja mera iz stava 1. ovog člana dozvoliće se sadnja isključivo sertifikovanog semenskog krompira ili mini-krtola ili mikro biljaka dobijenih iz kulture biljnog tkiva koje potiču iz testiranih izvora.
Radi praćenja zdravstvenog stanja bilja, biljnih proizvoda i propisanih objekata u zaraženom ili ugroženom području i utvrđivanja uslova za prestanak naloženih mera, pored sprovođenja mera iz čl. 10. do 16. ovog pravilnika, u toku najmanje tri vegetacione godine koje slede posle godine u kojoj je zaraza utvrđena:
1) vrši se nadzor mesta na kojima se proizvode, skladište, nalaze ili dorađuju krtole krompira, uključujući i parcele, površine, uređaje i opremu;
2) vrši se sadnja unutar zaraženog ili ugroženog područja, isključivo sertifikovanog semenskog krompira i obavezno ispitivanje posle vađenja semenskog krompira koji je proizveden na moguće zaraženim mestima proizvodnje;
3) na svim proizvodnim površinama unutar zaraženog i ugroženog područja sa proizvedenim semenskim krompirom postupa se odvojeno od merkantilnog krompira ili se vrši čišćenje i dezinfekcija objekata, uređaja i opreme između postupanja sa semenskim i merkantilnim krompirom.
IV NAČIN OBAVEŠTAVANJA O PREDUZETIM MERAMA I PRESTANAK MERA
Podaci i informacije o potvrđenoj zarazi, kao i podaci i informacije o prestanku mera dostavljaju se međunarodnim organizacijama i drugim državama u skladu sa međunarodnom konvencijom i sporazumima obavezujućim za Republiku Srbiju.
Ministarstvo će dostaviti službenom telu nadležnom za zaštitu bilja države u kojoj postoji opasnost od širenja zaraze sledeće podatke:
1) naziv sorte krompira i partije;
2) namenu (merkantilni ili semenski), i kada je moguće, kategoriju semenskog krompira;
3) naziv i adresu pošiljaoca i primaoca;
4) datum dospeća partije krompira;
5) veličinu isporučene partije krompira;
6) kopiju fitocertifikata.
Ovaj pravilnik stupa na snagu osmog dana od dana objavljivanja u "Službenom glasniku Republike Srbije".
ŠEMA TESTIRANJA ZA DIJAGNOSTIKU, DETEKCIJU I IDENTIFIKACIJU PROUZROKOVAČA PRSTENASTE TRULEŽI KROMPIRA
OBLAST PRIMENE ŠEME TESTIRANJA
Prikazana šema testiranja opisuje različite postupke uključene u:
1) dijagnozu prstenaste truleži na krtolama i biljkama krompira;
2) detekciju Clavibacter michiganensis ssp. sepedonicus u uzorcima krtola krompira i biljkama;
3) identifikaciju Clavibacter michiganensis ssp. sepedonicus (C. m. subsp. sepedonicus).
I OPŠTA NAČELA
U poglavljima III-XI ovog priloga se nalaze standardni protokoli za pojedine metode, potvrđeni i odobreni reagensi i pojedinosti vezane za pripremu materijala za testiranje i referentnog materijala. U Poglavlju III ovog priloga se nalazi i spisak laboratorija uključenih u proces optimizacije i validacije protokola.
S obzirom da protokoli uključuju metode detekcije karantinskog organizma, što podrazumeva i upotrebu živih referentnih kultura C.m. subsp. sepedonicus, procedura se mora izvoditi u propisanim karantinskim uslovima sa odgovarajućim objektima za odlaganje, čuvanje i uništavanje otpada u skladu sa Pravilnikom.
Parametri testiranja moraju obezbediti ujednačene i ponovljive nivoe detekcije C.m. subsp. sepedonicus prema propisanim pragovima osetljivosti pojedinih metoda.
Obavezna je precizna priprema pozitivnih kontrola.
Testiranje u skladu sa zahtevanim pragom osetljivosti podrazumeva pravilno postavljanje, održavanje i kalibriranje opreme, pažljivo rukovanje i čuvanje reagenasa kao i preduzimanje mera za sprečavanje kontaminacije između uzoraka, npr. razdvajanje pozitivnih kontrola od uzoraka za testiranje. Kako bi se izbegle administrativne ili druge greške, moraju se primenjivati standardi kontrole kvaliteta, posebno pri označavanju uzoraka i vođenju dokumentacije.
Sumnja na prisustvo patogena u uzorku podrazumeva pozitivan rezultat testa provere uzorka, kao što je prikazano u dijagramima toka.
Ako je rezultat prvog testa provere (IF ili PCR/FISH) pozitivan, tada se sumnja na prisustvo C.m. subsp. sepedonicus i potrebno je primeniti i drugi test provere. Ako je rezultat i drugog testa pozitivan, tada je sumnja potvrđena i testiranje se nastavlja prema opisanoj šemi. Ako je rezultat drugog testa negativan, tada se smatra da C.m. subsp. sepedonicus nije prisutna u uzorku.
Pozitivan rezultat IF testa se definiše kao pozitivno očitavanje IF testa potvrđeno i drugim testom provere (PCR/FISH).
Potvrđeno prisustvo patogena podrazumeva izolaciju i identifikaciju čiste kulture C.m. ssp. sepedonicus i potvrdu patogenosti.
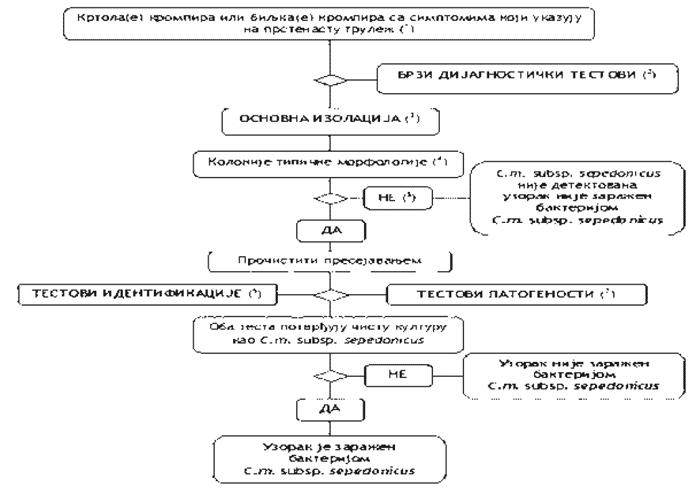
1.1. Šema utvrđivanja prisustva prouzrokovača prstenaste truleži u krtolama i biljkama krompira sa tipičnim simptomima prstenaste truleži (Šema 1)
Postupak testiranja se primenjuje za krtole i biljke krompira sa tipičnim simptomima ili simptomima koji izazivaju sumnju na prisustvo prouzrokovača prstenaste truleži. Postupak uključuje test provere, izolaciju patogena iz zaraženog sprovodnog tkiva na hranljivu podlogu i, u slučaju pozitivnog rezultata, identifikaciju čiste kulture C. m. subsp. sepedonicus.

Šema 1.
1) opis simptoma naveden je u tački 2. ovog poglavlja;
2) odgovarajući testovi su:
- IF test (tačka 4. ovog poglavlja);
- PCR test (tačka 6. ovog poglavlja);
- FISH test (tačka 5. ovog poglavlja);
3) iako je izolacija patogena iz biljnog materijala sa tipičnim simptomima primenom metode razređenja i zasejavanja na hranljivu podlogu jednostavna, ovaj postupak može biti značajno otežan u uzorcima u poodmakloj fazi infekcije. Saprofitne bakterije koje se razvijaju na obolelom tkivu mogu prerasti ili inhibirati patogena na hranljivoj podlozi. Zato se preporučuje korišćenje i neselektivne i selektivne hranljive podloge (najbolje MTNA) ili primena biološkog testa iz tačke 7. ovog poglavlja;
4) opis tipične morfologije kolonije naveden je u tački 8. ovog poglavlja;
5) ako je rezultat izolacije negativan, ali su simptomi bolesti tipični, tada je potrebno ponoviti postupak izolacije patogena;
6) pouzdana identifikacija čiste kulture C. m. subsp. sepedonicus postiže se primenom testova navedenih u tački 9. ovog poglavlja;
7) test patogenosti opisan je u tački 10. ovog poglavlja.
1.2. Šema za utvrđivanje prisustva i identifikaciju C. m. subsp. sepedonicus u uzorcima krtola krompira bez vidljivih simptoma (Šema 2)
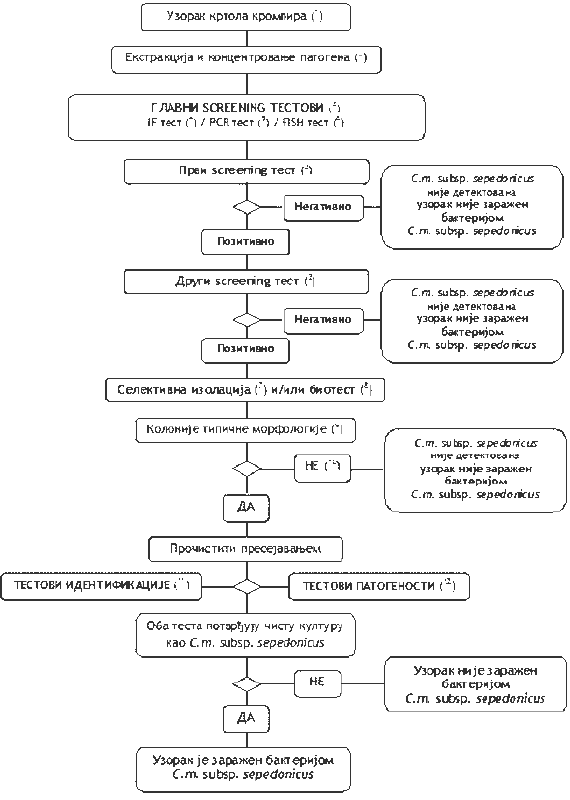
Šema 2.
1) standardna veličina uzorka je 200 krtola - ako na raspolaganju nema 200 krtola, postupak se može sprovesti i na manjim uzorcima;
2) metode ekstrakcije i koncentrovanja patogena opisane su u tački 3. ovog poglavlja;
3) ako su rezultati najmanje dva testa, koji se temelje na različitim biološkim načelima, pozitivni, potrebno je izvršiti izolaciju i potvrditi prisustvo patogena. Izvršiti bar jedan test provere. Kada je rezultat testa negativan, smatra se da je uzorak negativan. U slučaju da je rezultat tog testa pozitivan, potrebno je izvršiti drugi ili više testova provere, koji se temelje na različitim biološkim načelima, kako bi se potvrdio pozitivan rezultat. Ako su rezultati ostalih testova negativni, smatra se da je taj uzorak negativan. Dalje testiranje nije potrebno;
4) test imunofluorescencije (IF): Koristiti poliklonalna antitela za IF test, a dodatna monoklonalna antitela omogućavaju veću specifičnost (tačka 4. ovog poglavlja);
5) PCR test. Koristiti potvrđene i odobrene reagense i protokole za PCR (tačka 6. ovog poglavlja);
6) FISH test: Koristiti potvrđene reagense i protokole (tačka 5. ovog poglavlja);
7) selektivna izolacija: U mnogim slučajevima, korišćenje MTNA ili NCP-88 hranljivih podloga i 1/100 razređenja resuspendovanog taloga je odgovarajuća metoda za direktnu izolaciju C. m. subsp. sepedonicus. Tipične kolonije se pojavljuju tri do deset dana posle zasejavanja na hranljivu podlogu, kada ih je moguće prečistiti i identifikovati patogena. Pažljivim vađenjem i pripremom konusa pupčanog dela krtole krompira izbegava se pojava saprofitnih bakterija sa krtola krompira, koje na hranljivoj podlozi konkurišu koloniji C. m. subsp. sepedonicus i mogu je prerasti. Ako se patogen ne može izolovati na hranljivoj podlozi, potrebno je ponoviti postupak izolacije korišćenjem biljaka iz biološkog testa (tačka 8. ovog poglavlja);
8) biološki test se koristi za izolaciju C. m. subsp. sepedonicus iz ekstrakta selektivnim obogaćivanjem u biljkama plavog patlidžana (Solanum melongena). Test zahteva optimalne uslove inkubacije, kao što je navedeno u ovoj metodi. Tokom primene ovog testa, najverovatnije je da neće doći do pojave bakterija koje inhibiraju rast i razvoj C.m. subsp. sepedonicus na hranljivim podlogama MTNA ili NCP-88 (tačka 7. ovog poglavlja);
9) tipična morfologija kolonije opisana je u tački 8. ovog poglavlja;
10) gajenje bakterijske kulture ili biološki test mogu biti neuspešni zbog kompeticije ili inhibicije saprofitnim bakterijama. Ako se u testovima provere dobiju jasno pozitivni rezultati, a rezultati izolacije su negativni, ponoviti testove izolacije iz istog resuspendovanog taloga ili ponoviti uzimanje sprovodnog tkiva na mestu vezivanja stolona kod krtola iz istog uzorka i, ako je potrebno, testirati dodatne uzorke;
11) pouzdana identifikacija čistih kultura C. m. subsp. sepedonicus postiže se izvođenjem testova opisanih u tački 9. ovog poglavlja;
12) test patogenosti opisan je u tački 10. ovog poglavlja.
Načelo - Postupak testiranja namenjen je za otkrivanje prisustva skrivene zaraze u krtolama krompira.
Pozitivan rezultat najmanje dva testa provere, temelji se na različitim biološkim načelima, dopunjuje se izolacijom patogena, posle čega, u slučaju izolacije tipičnih kolonija, sledi potvrda čiste kulture C. m. subsp. sepedonicus. Pozitivan rezultat samo jednog od testova provere nije dovoljan da bi se uzorak smatrao verovatno zaraženim.
Testovi provere i izolacija moraju omogućiti nivo osetljivosti detekcije 103 do 104 ćelija/ml resuspendovanog taloga, uključenog kao pozitivna kontrola u svakoj seriji testova.
1.3. Šema za utvrđivanje prisustva i identifikaciju C. m. ssp. sepedonicus u uzorcima biljaka krompira bez simptoma (Šema 3)
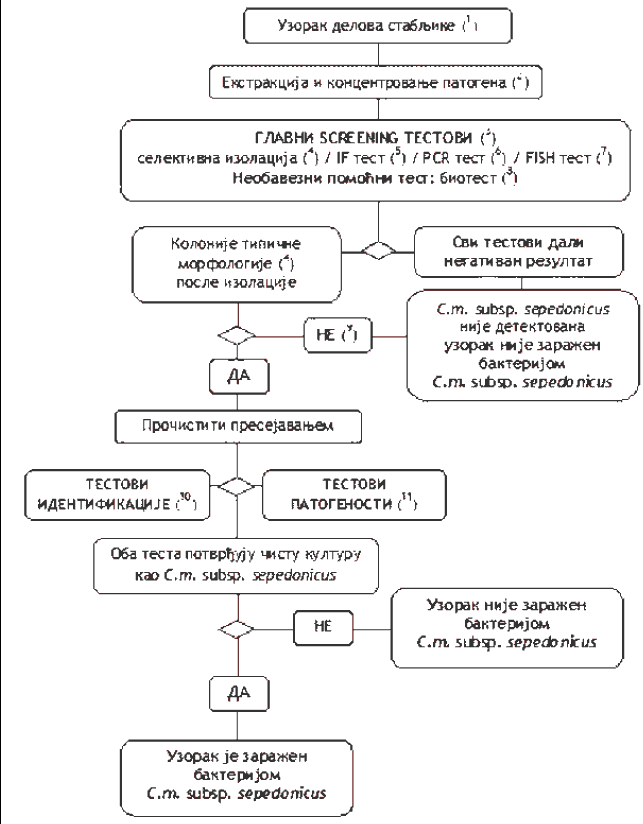
Šema 3.
1) preporučene veličine uzoraka navedene su u tački 3. podtačka 3.2. ovog poglavlja;
2) ekstrakcija patogena i metode koncentrovanja opisane su u tački 3. podtačka 3.2. ovog poglavlja;
3) ako su rezultati najmanje dva testa, koji se temelje na različitim biološkim načelima, pozitivni, potrebno je izvršiti izolaciju i potvrdu prisustva patogena. Izvršiti bar jedan test provere. Kada je rezultat testa negativan, smatra se da je uzorak negativan. U slučaju da je rezultat tog testa pozitivan, potrebno je izvršiti drugi ili više testova provere, koji se temelje na različitim biološkim načelima, kako bi se potvrdio pozitivan rezultat. Ako su rezultati ostalih testova negativni, smatra se da je taj uzorak negativan. Dalje testiranje nije potrebno;
4) selektivna izolacija i tipična morfologija kolonije opisani su u tački 8. ovog poglavlja;
5) IF test opisan je u tački 4. ovog poglavlja;
6) PCR testovi opisani su u tački 6. ovog poglavlja;
7) FISH test opisan je u tački 5. ovog poglavlja;
8) biološki test opisan je u tački 7. ovog poglavlja;
9) gajenje bakterijske kulture ili biološki test mogu biti neuspešni zbog kompeticije ili inhibicije saprofitnim bakterijama. Ako se u testovima provere dobiju jasno pozitivni rezultati, a rezultati izolacije su negativni, ponoviti testove izolacije iz istog resuspendovanog taloga ili ponoviti uzimanje sprovodnog tkiva na mestu vezivanja stolona kod krtola iz istog uzorka i, ako je potrebno, testirati dodatne uzorke;
10) pouzdana identifikacija čistih kultura C. m. subsp. sepedonicus postiže se izvođenjem testova opisanih u tački 9. ovog poglavlja;
11) test patogenosti opisan je u tački 10. ovog poglavlja.
2. Vizuelni pregled za otkrivanje simptoma prstenaste truleži
U evropskim klimatskim uslovima simptomi se retko pronalaze u polju i to često tek na kraju sezone. Osim toga, simptomi su često prikriveni ili se mogu zameniti sa simptomima drugih biljnih bolesti, starenja biljaka ili mehaničkim oštećenjima. Zato se simptomi mogu vrlo lako prevideti prilikom pregleda u polju. Simptomi uvenuća se razlikuju od onih kod prouzrokovača mrke truleži; uvenuće je obično sporo i u početku ograničeno na ivice listova. Mladi zaraženi listovi često nastavljaju rast, mada u zaraženim delovima sporije, što dovodi do formiranja listova neobičnog oblika. Zbog blokade sprovodnog tkiva u donjem delu stabljike, na listovima se, između lisnih nerava često pojavljuju hlorotične, žuto-narandžaste površine. Vremenom propadaju zaraženi delovi lista, listovi, pa čak i stabljike. Često dolazi samo do smanjenja veličine listova i krtola. Povremeno su biljke zakržljale.
Fotografije različitih simptoma mogu se pronaći na web stranici: http://forum.europa.eu.int/Public/irc/sanco/Home/main.
U najranijoj fazi pojave simptoma, tkivo krtole je staklasto ili prozirno, bez omekšavanja oko sprovodnog tkiva, posebno u blizini pupčanog dela krtole. U pupčanom delu krtole, prsten sprovodnog sistema može biti malo tamniji od uobičajenog. Prvi lako uočljiv simptom je žućkasta boja sprovodnog prstena, a kada se krtola blago stisne, iz sprovodnih sudova izlaze male količine materije siraste konzistencije, koja sadrži milione bakterija. Moguć je razvoj pojave braon (smeđe, mrke) boje sprovodnog tkiva i simptomi na krtoli su u ovom stadijumu slični simptomima mrke truleži koju prouzrokuje Ralstonia solanacearum. U početku, simptomi su ograničeni na jedan deo sprovodnog prstena, ne obavezno blizu pupka, a kasnije se postepeno proširuju na ceo prsten. Kako infekcija napreduje, dolazi do potpunog propadanja sprovodnog tkiva; spoljni i unutrašnji deo krtole se mogu razdvojiti. U kasnijim fazama infekcije, na površini krtola pojavljuju se pukotine, koje su često crvenkasto-smeđe po ivicama. Nedavno je u Evropi zabeleženo nekoliko slučajeva pojave simptoma gde je središte krtole trunulo istovremeno sa sprovodnim prstenom što je dovelo do sekundarnog napada patogena sa stvaranjem unutrašnjih šupljina i nekroza. Prisustvo sekundarnih gljiva ili bakterija može prikriti simptome, usled čega može biti teško, čak i nemoguće, razlikovati uznapredovale simptome prstenaste truleži od drugih truleži krtola. Moguća je pojava i netipičnih simptoma prstenaste truleži. Fotografije različitih simptoma mogu se pronaći na web stranici http://forum.europa.eu.int/Public/irc/sanco/Home/main.
Napomena:
- standardna veličina uzorka je 200 krtola po testu. Intenzivnije uzorkovanje zahteva izvođenje većeg broja testova na uzorcima te veličine. Veći broj krtola u uzorku dovešće do inhibicije ili će otežati tumačenje rezultata. Postupak se može primeniti i za uzorke sa manje od 200 krtola, kada je na raspolaganju manje krtola;
- validacija svih metoda za utvrđivanje prisustva patogena, koje su opisane u daljem tekstu, bazira se na testiranju uzoraka od 200 krtola;
- ekstrakt krompira koji je opisan u daljem tekstu može se koristiti i za utvrđivanje prisustva prouzrokovača mrke truleži krompira, bakterije Ralstonia solanacearum.
Procedura koja prethodi pripremi uzorka: oprati krtole, upotrebiti odgovarajuća dezinfekciona sredstva (pri korišćenju PCR testa upotrebiti jedinjenja hlora radi uklanjanja eventualno prisutne DNK patogena) i deterdžente između svakog uzorka, osušiti krtole na vazduhu.
Postupak pranja je posebno koristan ali ne i obavezan za slučajeve obrade uzoraka sa većom količinom zemlje, pri izvođenju PCR testa ili procedure direktne izolacije.
3.1.1. Čistim i dezinfikovanim skalpelom ili nožem za povrće ukloniti pokožicu sa pupčanog dela krtole tako da se vide sprovodni sudovi. Pažljivo izrezati mali konusni deo sprovodnog tkiva na pupčanom delu zahvatajući što manje okolnog, nesprovodnog tkiva (videti web stranu: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
Napomena:
Sve krtole sa potencijalno sumnjivim simptomima prstenaste truleži odvojiti posebno i testirati.
Ako se prilikom vađenja konusa iz pupčanog dela uoče potencijalni simptomi prstenaste truleži, krtole treba vizuelno pregledati. Svaku presečenu krtolu sa ovakvim simptomima treba ostaviti dva dana na sobnoj temperaturi, a potom čuvati u karantinskim uslovima (na 4 do 10°C) do sprovođenja testiranja. Sve krtole u uzorku (uključujući i one sa sumnjivim simptomima) treba čuvati na način propisan ovim pravilnikom.
3.1.2. Izvađene konuse iz pupčanog dela krtole koji sadrže delove sprovodnog tkiva staviti u sterilne posude koje se mogu zapečatiti i/ili hermetički zatvoriti (ako su posude već upotrebljavane, moraju se temeljno očistiti i dezinfikovati upotrebom sredstava na bazi jedinjenja hlora). Uzorke je poželjno odmah obraditi. Ako to nije moguće, potrebno je čuvati ih u posudi bez dodatka pufera, najduže 72 sata u frižideru ili najduže 24 sata na sobnoj temperaturi. Tokom čuvanja dolazi do sušenja i suberizacije sržnog dela konusa, kao i do rasta i razvoja saprofita, što može ometati utvrđivanje prisustva bakterije prouzrokovača prstenaste truleži.
3.1.3. Izvađene konuse iz pupčanog dela krtole obraditi korišćenjem jednog od sledećih postupaka:
a) izvađene konuse prekriti dovoljnom količinom (oko 40 ml) ekstrakcionog pufera (Poglavlje V ovog priloga) i ultracentrifugirati na 50 do 100 obrtaja/min, četiri sata na temperaturi ispod 24°C ili 16 do 24 sata uz hlađenje;
b) izvađene konuse homogenizovati sa dovoljnom količinom (oko 40 ml) ekstrakcionog pufera (Poglavlje V ovog priloga), bilo u mešalici (npr. Waring ili Ultra Thurax) bilo drobljenjem u zatvorenoj kesi za maceraciju za jednokratnu upotrebu (npr. kese Stomacher ili Bioreba od čvrstog politena, 150 mm x 250 mm, sterilizovane zračenjem) koristeći gumeni čekić ili odgovarajući aparat za maceriranje (npr. Homex).
Napomena:
Ako se uzorci homogenizuju u blenderu, postoji velika opasnost od njihove unakrsne kontaminacije. Preduzeti mere opreza u cilju sprečavanja nastajanja aerosola ili prosipanja tokom ekstrakcije. Za svaki uzorak upotrebiti sterilizovane nožiće i posude. Tokom procedure PCR-a, sprečiti prenos DNK na kontejnere ili aparaturu za maceriranje. Za PCR test preporučuje se maceriranje uzoraka u kesicama za jednokratnu upotrebu i dalje korišćenje epruveta i tuba za jednokratnu upotrebu.
3.1.4. Odliti supernatant. Ako je previše mutan, razbistriti ga ultracentrifugiranjem na manjem broju obrtaja (najviše 180 g/ 10 minuta na temperaturi od 4 do 10°C) ili vakuumskom filtracijom (40 do 100 µm) tokom koje se filter dodatno ispira ekstrakcionim puferom (oko 10 ml) (Poglavlje V ovog priloga).
3.1.5. Izvršiti koncentrisanje frakcije bakterije centrifugiranjem na 7000 g 15 minuta (ili 10.000 g 10 minuta) na temperaturi od 4 do 10ºC, posle čega se pažljivo, bez mešanja sa talogom odliva supernatant.
3.1.6. Resuspendovati talog u 1,5 ml pelet pufera (pufera za rastvaranje taloga) (Poglavlje V ovog priloga). Od ove količine koristiti 500 µl za testiranje na prisustvo C. m. subsp. sepedonicus, 500 µl za testiranje na prisustvo Ralstonia solanacearum i 500 µl kao referentni materijal za čuvanje. U poslednji, referentni deo od 500 µl dodati sterilni glicerol u konačnoj koncentraciji od 10 do 25% (v/v), promešati i čuvati na temperaturi od -16 do -24°C (nedeljama) ili na -68 do -86°C (mesecima). Delove odvojene za utvrđivanje prisustva bakterija, tokom testiranja čuvati na temperaturi od 4 do 10°C. Ne preporučuje se višestruko zamrzavanje i odmrzavanje. U slučaju potrebe za transportom uzoraka, isti dostaviti u prenosivom frižideru u roku od 24 do 48 sati.
3.1.7. Važno je da se sve pozitivne kontrole C. m. subsp. sepedonicus i uzorci drže odvojeno da bi se izbegla kontaminacija. Ovo se odnosi i na IF pločice i druge testove.
Napomena:
Za otkrivanje latentnih populacija C. m. subsp. sepedonicus preporučuje se testiranje zbirnih uzoraka. Postupak se može pogodno primeniti na zbirne uzorke sa najviše 200 delova stabljike (uzimanje uzoraka tokom sprovođenja nadzora se mora temeljiti na statistički reprezentativnom uzorku ispitivane biljne populacije).
3.2.1. Čistim dezinfikovanim nožem ili makazama za rezidbu odrezati 1 do 2 cm donjeg dela svake stabljike, odmah iznad površine zemljišta. Delove stabljike dezinfikovati kratkim potapanjem u 70% etanol i odmah osušiti upijajućim papirom. Staviti delove stabljike u zatvorenu sterilnu posudu.
3.2.2. Obraditi delove stabljike pomoću jednog od sledećih postupaka:
a) delove stabljike prekriti dovoljnom količinom (približno 40 ml) ekstrakcionog pufera (Poglavlje V ovog priloga) i ultracentrifugirati na 50 do 100 obrtaja/min četiri sata na temperaturi ispod 24°C ili 16 do 24 sata uz hlađenje;
b) delove stabljike izmacerirati u čvrstoj kesi za maceraciju (npr. Stomacher ili Bioreba) sa odgovarajućom količinom ekstrakcionog pufera (Poglavlje V ovog priloga) koristeći gumeni čekić ili odgovarajuću opremu za maceriranje (npr. Homex). Ako to nije moguće, delove stabljike čuvati u frižideru najduže 72 sata ili na sobnoj temperaturi najduže 24 sata.
3.2.3. Nakon 15 minuta taloženja, odliti supernatant.
3.2.4. Dalje izbistravanje ekstrakta ili koncentrovanje frakcije bakterija obično nije potrebno, ali se može postići filtriranjem i/ili centrifugiranjem.
3.2.5. Podeliti čisti ili koncentrovani ekstrakt uzorka na dva jednaka dela. Jednu polovinu čuvati na temperaturi od 4 do 10°C tokom testiranja, a drugu polovinu ostaviti za slučaj upotrebe u dodatnim testiranjima: u ekstrakt se dodaje 10-25% (v/v) sterilnog glicerola i čuva na temperaturi od -16 do -24°C (nedeljama) ili na -68 do -86°C (mesecima).
Načelo - Upotreba IF testa kao glavnog testa provere preporučuje se zbog njegove dokazane ujednačenosti u postizanju zahtevanih pragova osetljivosti metode.
Kada se IF test koristi kao glavni test provere i ako je IF očitavanje pozitivno, dodatno se kao drugi test koristi PCR ili FISH test. Kada se IF test koristi kao drugi test provere i IF očitavanje je pozitivno, dalja testiranja u cilju kompletiranja analiza se izvode prema dijagramu toka.
Napomena:
Kada se IF test koristi kao glavni test provere, uvek koristiti poliklonalna antitela. U slučaju pozitivnog IF očitavanja s poliklonalnim antitelima, dalja provera upotrebom monoklonalnih antitela može povećati specifičnost, ali i umanjiti osetljivost testa.
Upotrebiti antitela za referentni soj C. m. subsp. sepedonicus. Preporučuje se određivanje titra za svaku novu seriju antitela. Titar se definiše kao najveće razređenje u kome dolazi do optimalne reakcije pri testiranju suspenzije koja sadrži 105 do 106 ćelija po ml odgovarajućeg soja C. m. subsp. sepedonicus uz korišćenje fluorescein-izotiocijanat (FITC) konjugata u skladu s preporukama proizvođača. Nerazređena poliklonalna i monoklonalna antitela treba da imaju IF titar najmanje 1:2000. Tokom testiranja koristiti radna razređenja antitela, koja su blizu ili jednaka titru. Koristiti potvrđena i odobrena antitela (videti web stranicu: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
Testiranje treba izvršiti na sveže pripremljenim ekstraktima uzoraka, a po potrebi, testiranje se može uspešno izvršiti i na ekstraktima koji su bili čuvani na temperaturi od -68 do -86°C sa dodatkom glicerola. Glicerol ukloniti dodavanjem 1 ml pelet pufera (pufera za rastvaranje taloga), ponovnim centrifugiranjem na 7000 g u trajanju od 15 minuta i resuspendovanjem taloga u jednakoj zapremini pelet pufera. Ovaj deo procedure često nije potreban, naročito ako su uzorci fiksirani na mikroskopska IF stakla plamenom.
Na odvojenim mikroskopskim staklima pripremiti pozitivnu kontrolu i to homologni ili neki drugi referentni izolat C. m. subsp. sepedonicus, rastvoren u ekstraktu krompira i po izboru u puferu.
Na istoj IF pločici treba, gde god je to moguće, koristiti i pozitivnu kontrolu koju čini prirodno zaraženo tkivo (liofilizovano ili zamrznuto na -16 do -24°C).
Negativnu kontrolu mogu predstavljati i delovi ekstrakta uzoraka koji su u ranijem testiranju pokazali negativan rezultat.
Koristiti mikroskopske pločice sa više bunarčića, po mogućnosti sa 10 otvora prečnika najmanje 6 mm.
Primeniti identičan postupak testiranja na uzorke i na pozitivne i negativne kontrole.
4.1. Pripremiti IF pločice za testiranje jednim od sledećih postupaka:
a) za taloge sa relativno malom količinom nataloženog skroba: u prvi bunarčić pipetom odmeriti standardnu zapreminu razređenja od 1/100 resuspendovanog taloga krompira (15 µl je dovoljno za bunarčiće prečnika 6 mm - povećati zapreminu za veće bunarčiće). Potom u ostale bunarčiće u istom redu pipetom odmeriti sličnu zapreminu nerazređene suspenzije (1/1) taloga. Drugi red se može koristiti kao duplikat prvog ili za drugi uzorak kako je prikazano na Šemi 4;
b) za ostale suspenzije taloga: pripremiti decimalna razređenja (1/10 i 1/100) resuspendovanog taloga u puferu za talog. U jedan red bunarčića pipetom odmeriti standardnu zapreminu resuspendovanog taloga i svakog razređenja (15 µl je dovoljno za bunarčiće prečnika 6 mm - povećati zapreminu za veće). Drugi red se može koristiti kao duplikat prvog ili za drugi uzorak kao što je prikazano na Šemi 5.
4.2. Ostaviti da se kapljice osuše na sobnoj temperaturi ili ih zagrevati do temperature od 40 do 45°C. Ćelije bakterija fiksirati na IF pločicu zagrevanjem (15 minuta na 60°C), provlačenjem kroz plamen, 95%-tnim etanolom ili prema posebnim uputstvima proizvođača antitela.
Ukoliko je to neophodno, fiksirane pločice se mogu čuvati zamrznute u desikatoru u kraćem vremenskom intervalu (najviše do tri meseca).
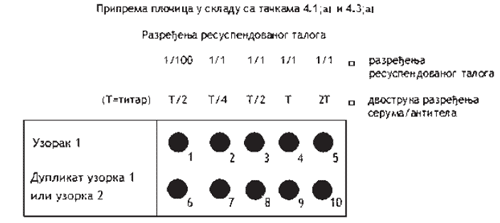
Šema 4.
4.3. IF postupak:
a) U skladu sa postupkom za pripremu pločica za testiranje kako je opisano u 4.1 a): pripremiti dvostruki niz razređenja antitela u IF puferu. Prvi bunarčić mora imati 1/2 titra (T/2), a ostali 1/4 titra (T/4), 1/2 titra (T/2), titar (T) i dvostruki titar (2T);
b) u skladu s postupkom za pripremu pločica za testiranje kako je opisano u 4.1 b):
Pripremiti radno razređenje antitela u IF puferu. Radno razređenje utiče na specifičnost.

Šema 5.
4.3.1. Poređati pločice na navlaženi papir. Svaki bunarčić potpuno ispuniti razređenjem antitela. Zapremina antitela mora biti jednaka zapremini nanesenog ekstrakta.
Ukoliko ne postoje posebna uputstva proizvođača antitela, potrebno je slediti sledeću proceduru:
4.3.2. Inkubirati prekrivene pločice na vlažnom papiru 30 minuta na sobnoj temperaturi (18 do 25°C).
4.3.3. Kapljice sa svake pločice otresti i pločice pažljivo isprati IF puferom. Potopiti pločice u IF pufer-Tween (Poglavlje V ovog priloga) pa u IF pufer, u trajanju od po pet minuta. Sprečiti stvaranje aerosola ili prenos kapljica jer bi moglo doći do unakrsne kontaminacije uzoraka. Pločice pažljivo osušiti upijajućim papirom.
4.3.4. Poređati pločice na navlaženi upijajući papir. Bunarčiće popuniti razređenim FITC konjugatom koji se koristi za određivanje titra. Zapremina konjugata nanesenog na bunarčić mora biti jednaka zapremini nanesenog antitela.
4.3.5. Inkubirati pokrivene pločice na vlažnom papiru, 30 minuta na sobnoj temperaturi (18 do 25°C).
4.3.6. Otresti kapljice konjugata sa pločica. Isprati i oprati pločice kako je prethodno opisano (4.3.3). Pločice pažljivo osušiti.
4.3.7. Na svaki bunarčić pipetom naneti 5-10 µl 0,1 M glicerola sa fosfatnim puferom (Poglavlje V ovog priloga) ili komercijalno dostupno sredstvo protiv izbleđivanja i staviti pokrovno staklo.
4.4. Očitavanje IF testa:
4.4.1. Pregledati pripremljene pločice pod epifluorescentnim mikroskopom sa odgovarajućim filterima za ekscitaciju FITC-a, pod uljnom ili vodenom imerzijom i uvećanjem od 500-1000 x. Pregledati svaki bunarčić uzduž i popreko, pod pravim uglom i duž spoljne ivice. Za uzorke u kojima je vidljiv mali broj ćelija ili ih uopšte nema pregledati najmanje 40 mikroskopskih vidnih polja.
Prvo treba pregledati pločicu s pozitivnom kontrolom. Ćelije moraju biti izrazito fluorescentne i potpuno obojene na utvrđenom titru antitela ili radnog razređenja. U slučaju da kod obojenosti dođe do odstupanja, IF test se mora ponoviti.
4.4.2. Utvrditi da li jasno fluorescentne ćelije koje se uočavaju u bunarčićima imaju morfologiju karakterističnu za C. m. subsp. sepedonicus (videti web stranicu: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
Intenzitet fluorescencije mora biti jednak ili bolji od onog koji daje pozitivni kontrolni izolat, pri jednakom razređenju antitela. Zanemariti nepotpuno obojene ili slabo fluorescentne ćelije.
Ukoliko se posumnja na kontaminaciju, test se mora ponoviti (npr. ako zbog kontaminacije pufera sve pločice u seriji pokazuju pozitivne ćelije ili ako su pozitivne ćelije pronađene (izvan bunarčića) na površini pločice).
4.4.3. Postoji nekoliko problema u vezi sa specifičnošću testa imunofluorescencije. U koncentrovanom ekstraktu izdvojenih konusa pupčanih delova krtole ili delova stabljike uvek se očekuje i prisustvo populacija fluorescentnih ćelija sa netipičnom morfologijom ili unakrsna reakcija sa saprofitnim bakterijama slične veličine i građe kao C. m. subsp. sepedonicus.
4.4.4. Prilikom očitavanja u obzir se uzimaju samo fluorescentne ćelije tipične veličine i morfologije u titru ili radnom razređenju antitela kako je opisano u tački 4. podtačka 4.3. ovog poglavlja.
4.4.5. Tumačenje očitavanja IF testa:
a) ukoliko se utvrdi prisustvo jasno fluorescentnih ćelija karakteristične morfologije, odrediti prosečan broj tipičnih ćelija po mikroskopskom vidnom polju i izračunati broj tipičnih ćelija po ml resuspendovanog taloga (Poglavlje VI ovog priloga).
Očitavanje IF testa je pozitivno za uzorke koji imaju najmanje 5 x 103 tipičnih ćelija po ml resuspendovanog taloga. Ovakav uzorak se smatra potencijalno kontaminiranim i potrebno je izvršiti dalje testiranje;
b) očitavanje IF testa je negativno za uzorke koji imaju manje od 5 x 103 ćelija po ml resuspendovanog taloga i uzorak se smatra negativnim. Nije potrebno dalje testiranje.
Načelo - ukoliko se u FISH testu kao prvom testu provere dobije pozitivan rezultat, IF test se koristi kao drugi obavezni test provere. Ako se FISH test koristi kao drugi test provere i ako se njime dobije pozitivan rezultat, za postavljanje konačne dijagnoze treba obaviti dalje testiranje prema dijagramu toka.
Napomena:
Koristiti potvrđene i odobrene oligo-probe specifične za bakteriju C. m. subsp. sepedonicus (Poglavlje IX ovog priloga). Preliminarna testiranja primenom ove metode treba da omoguće ponovljivu detekciju najmanje 103 do 104 ćelija C. m. subsp. sepedonicus po ml dodatih ekstraktu uzorka prethodno dokazanog kao negativnog.
Postupak treba izvršiti na sveže pripremljenim ekstraktima uzoraka, ali se uspešno može primeniti i na ekstrakt uzorka koji je bio čuvan sa glicerolom na temperaturi od -16 do -24°C ili od -68 do -86°C.
Za negativnu kontrolu upotrebiti delove ekstrakta uzoraka koji su u ranijem testiranju na C. m. subsp. sepedonicus dokazani kao negativni.
Za pozitivnu kontrolu pripremiti suspenzije koje sadrže 105 do 106 ćelija/ml 0,01M fosfatnog pufera (PB) C. m. subsp. sepedonicus (npr. soj NCPPB 4053, ili PD 406) iz kulture stare 3 do 5 dana (za pripremu videti Poglavlje IV ovog priloga). Pripremiti odvojene pločice za pozitivnu kontrolu sa homologim ili nekim drugim referentnim izolatom C. m. subsp. sepedonicus, rastvorenim u ekstraktu krompira, kao što je navedeno u Poglavlju IV ovog priloga.
Korišćenje eubakterijske oligo-probe obeležene FITC-om omogućava kontrolu procesa hibridizacije jer će se obojiti sve eubakterije prisutne u uzorku.
Kontrolni materijal testirati primenom iste procedure kao i uzorke.
5.1. Fiksiranje ekstrakta krompira
Sledeći protokol se zasniva na proceduri Wullings i sar., (1998):
5.1.1. Pripremiti rastvor za fiksiranje (Poglavlje IX ovog priloga).
5.1.2. Pipetom odmeriti 100 µl ekstrakta svakog uzorka u Eppendorf epruvetu pa centrifugirati osam minuta na 7000 g.
5.1.3. Ukloniti supernatant i rastvoriti talog u 500 µl fiksativa pripremljenog najviše 24 sata ranije, promešati i inkubirati preko noći na 4°C. Alternativni fiksativ je 96% etanol. Pri tome je potrebno rastvoriti talog u 50 µl 0,01M PB i 50 µl 96% etanola, promešati i inkubirati na 4°C 30 do 60 minuta.
5.1.4. Centrifugirati osam minuta na 7000 g, ukloniti supernatant i resuspendovati talog u 75 µl 0,01M PB (Poglavlje V ovog priloga).
5.1.5. U bunarčiće čistih pločica naneti 16 µl fiksiranih suspenzija kako je prikazano na Šemi 6. Na svaku pločicu naneti dva različita, nerazređena uzorka i upotrebiti 10 µl za pripremanje razređenja 1:100 (u 0,01M PB). Preostali fiksirani rastvor uzorka (49 µl) čuvati na -20°C posle dodavanja jednake zapremine 96%-tnog etanola. Ako FISH test treba ponoviti, centrifugiranjem ukloniti etanol i dodati jednaku zapreminu 0,01 PB (uz mešanje).
Prikaz pločice za FISH test

Šema 6.
5.1.6. Pločice osušiti na vazduhu (ili u sušnici na 37°C) pa ih fiksirati provlačenjem kroz plamen. Na ovom koraku se može prekinuti postupak i nastaviti sledeći dan. Pločice treba čuvati na sobnoj temperaturi u suvom prostoru bez prašine.
5.2. Predhibridizacija i hibridizacija
5.2.1. Pripremiti rastvor lizozima koji sadrži 10 mg lizozima (Sigma L-6876) u 10 ml pufera (100mM Tris-HCl, 50mM EDTA, pH 8,0). Taj se rastvor može čuvati, ali se samo jednom sme zamrznuti i odmrznuti. Svaki uzorak dobro prekriti sa približno 50 µl rastvora lizozima i inkubirati deset minuta na sobnoj temperaturi. Zatim samo jednom potopiti pločicu u demineralizovanu vodu i pažljivo osušiti filter papirom.
Alternativno, umesto lizozima dodati 50 µl 40 do 400 µg ml-1 proteinaze K u puferu (20 mM Tris-HCl, 2mM CaCl2, pH 7,4) na svaki bunarčić i inkubirati na 37°C 30 minuta.
5.2.2. Dehidrataciju ćelija izvršiti uzastopnim potapanjem pločica u 50%-tni, 80%-tni i 90%-tni etanol, u trajanju od po jednog minuta. Pločice postaviti na držač i osušiti na vazduhu.
5.2.3. Pripremiti vlažnu komoru za inkubaciju tako što se dno hermetički zatvorene kutije prekriva upijajućim ili filter papirom potopljenim u 1x hybmix (Poglavlje IX ovog priloga). Kutiju prethodno inkubirati u aparatu za hibridizaciju nukleinskih kiselina na 55°C najmanje deset minuta.
5.2.4. Pripremiti rastvor za hibridizaciju i to 45 µl po pločici (Poglavlje IX ovog priloga) i prethodno inkubirati pet minuta na 55°C.
5.2.5. Staviti pločice na termoblok na 45°C i naneti po 10 µl hibridizovanog rastvora na svaki od četiri bunarčića.
5.2.6. Staviti dva pokrovna stakalca (24 x 24 mm) na svaku pločicu pazeći pri tom da u bunarčićima ne ostane vazduh. Staviti pločicu u prethodno zagrejanu vlažnu komoru i hibridizovati u mraku (preko noći) u aparatu za hibridizaciju na 55°C.
5.2.7. Pripremiti tri posude sa 1 l Ultra čiste vode, 1L 1x hybmix (334 ml 3x hybmix i 666 ml Ultra čiste vode) i 1L 1/2x hybmix (167 ml 3x hybmix i 833 ml Ultra čiste vode). Svaku posudu prethodno inkubirati u vodenom kupatilu na 55°C.
5.2.8. Skinuti pokrovna stakalca, a predmetne pločice staviti na držač.
5.2.9. Višak probe ukloniti inkubiranjem u trajanju od 15 minuta na 55°C u posudi sa 1x hybmix.
5.2.10. Preneti držač pločica u rastvor za pranje (1/2 x hybmix) i inkubirati još 15 minuta.
5.2.11. Pločice nakratko uroniti u Ultra čistu vodu i staviti na filter papir. Višak vlage ukloniti filter papirom. U svaki bunarčić pipetom naneti 5 do 10 µl zaštitnog rastvora protiv izbleđivanja (npr. Vectashield, Vecta Laboratories, CA, USA ili ekvivalentna) pa celu predmetnu pločicu pokriti velikim pokrovnim staklom (24 x 60 mm).
5.3.1. Pločice pregledati pod epifluorescentnim mikroskopom, korišćenjem uljane imerzije, s uvećanjem 630 ili 1000 x. Sa filterom prikladnim za fluorescein-izotiocijanat (FITC), eubakterijske ćelije (uključujući većinu gram negativnih ćelija) se u uzorku vide kao fluorescentno zelene. Upotrebom filtera za tetrametilrodamin-5-izotiocijanat, ćelije C. m. subsp. sepedonicus, obojene sa Cy3, vide se kao fluorescentno crvene. Uporediti morfologiju ćelija uzorka s morfologijom ćelija pozitivnih kontrola. Ćelije moraju biti jasno fluorescentne i u potpunosti obojene. Ako dođe do odstupanja u obojenosti, FISH test se mora ponoviti. Pregledati svaki bunarčić uzduž i popreko pod normalnim uglom i duž spoljne ivice. Za uzorke u kojima je vidljiv mali broj ćelija ili ih uopšte nema pregledati najmanje 40 mikroskopskih vidnih polja.
5.3.2. Uočiti da li su vidljive jasno fluorescentne ćelije u bunarčićima morfologije karakteristične za C.m. subsp. sepedonicus (vidi web stranicu: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
Intenzitet fluorescencije mora biti jednak ili jači nego kod pozitivne kontrole. Ćelije koje nisu u potpunosti obojene ili su slabe fluorescencije se ne uzimaju u obzir.
5.3.3. Ukoliko postoji sumnja da je došlo do kontaminacije, test se mora ponoviti (npr. sve pločice u seriji zbog kontaminacije pufera pokazuju pozitivne ćelije ili su pozitivne ćelije pronađene izvan bunarčića, na površini pločice).
5.3.4. Postoji nekoliko problema u vezi sa specifičnošću FISH testa. U koncentrovanom ekstraktu izdvojenih konusa pupčanih delova krtole ili stabljike uvek se očekuje i prisustvo populacija fluorescentnih ćelija sa netipičnom morfologijom ili unakrsna reakcija sa saprofitnim bakterijama slične veličine i građe kao C. m. subsp. sepedonicus, mada znatno ređe nego kod IF testa.
5.3.5. U obzir se uzimaju samo fluorescentne ćelije tipične veličine i morfologije.
5.3.6. Tumačenje rezultata FISH testa:
a) rezultati FISH testa smatraju se važećim ako se u svim pozitivnim i ni u jednoj negativnoj kontroli primenom FISH filtra uočava prisustvo jasno zelenih fluorescentnih ćelija čija je veličina i morfologija tipična za C. m. subsp. sepedonicus i ako se primenom filtera za rodamin uočavaju jasne crvene fluorescentne ćelije. Ako se uoče jasne ćelije karakteristične morfologije, odrediti prosečni broj tipičnih fluorescentnih ćelija po mikroskopskom vidnom polju i izračunati broj tipičnih ćelija po ml resuspendovanog taloga (Poglavlje VI ovog priloga). Potencijalno pozitivnim se smatraju uzorci sa najmanje 5 x 103 tipičnih ćelija po ml resuspendovanog taloga i potrebna su im dalja testiranja. Negativnim se smatraju uzorci s manje od 5 x 103 tipičnih ćelija po ml resuspendovanog taloga;
b) FISH test je negativan ako se primenom filtera za rodamin ne uoče snažno fluorescentne crvene ćelije čija je veličina i morfologija tipična za C. m. subsp. sepedonicus, pod uslovom da se primenom filtera za rodamin uoče tipične izrazito fluorescentne crvene ćelije u preparatima pozitivne kontrole.
Načela - kada se upotrebom PCR testa kao prvog testa provere dobije pozitivan rezultat, IF test se koristi kao drugi obavezni test provere. Ako se korišćenjem PCR testa kao drugog testa provere dobije pozitivan rezultat, za postavljanje konačne dijagnoze treba obaviti dalje testiranje prema dijagramu toka.
Korišćenje ove metode kao glavnog testa provere preporučuje se samo ukoliko je dostupna specijalizovana ekspertiza.
Napomena:
Preliminarna testiranja primenom ove metode treba da omoguće ponovljivu detekciju najmanje 103 do 104 ćelija C. m. subsp. sepedonicus po ml koje su dodate ekstraktu uzorka prethodno dokazanog kao negativnog.
Za postizanje najvećeg stepena osetljivosti i specifičnosti u svim laboratorijima, potrebno je izvođenje ogleda za standardizaciju (optimizaciju) metode. Koristiti potvrđene i odobrene reagense i protokole za PCR. Poželjno je odabrati metod koji podleže internoj kontroli. Preduzeti odgovarajuće mere opreza kako bi se izbegla kontaminacija uzorka ciljnom DNK. PCR test treba da obavljaju iskusni stručnjaci, u specijalizovanim laboratorijima za molekularnu biologiju.
Negativne kontrole (za ekstrakciju DNK i PCR postupak) treba uvek u postupku obraditi poslednje kako bi se utvrdilo da li je eventualno došlo do bilo kakvog prenošenja DNK.
U PCR test uključiti sledeće negativne kontrole:
- ekstrakt uzorka u kome prethodno tokom testiranja nije dokazano prisustvo C. m. subsp. Sepedonicus;
- pufer korišćen za ekstrakciju bakterije i DNK iz uzorka;
- PCR-reakcioni miks.
U PCR test uključiti sledeće pozitivne kontrole:
- alikvote resuspendovanih taloga u koje je dodata C. m. subsp. sepedonicus (Poglavlje IV ovog priloga);
- suspenziju od 106 ćelija po ml virulentnog izolata C. m. subsp. sepedonicus u vodi (npr. NCPPB 2140 ili NCPPB 4053);
- ako je moguće, u PCR testu koristiti i DNK ekstrahovan iz pozitivnih kontrolnih uzoraka.
Da bi se izbegla moguća kontaminacija, pozitivne kontrole pripremiti prostorno odvojeno od uzoraka za testiranje.
S obzirom da primena PCR protokola zahteva korišćenje ekstrakta uzoraka sa što manje zemlje, pre početka procedure izvođenja testa, uzorke krompira je poželjno dobro oprati.
Pozitivnu i negativnu kontrolu koristiti na prethodno opisan način. Kontrolni materijal pripremiti na isti način kao i uzorke.
Dostupne su različite metode prečišćavanja ciljane DNK iz kompleksnih supstrata uzorka u cilju uklanjanja inhibitora PCR reakcije i drugih enzimskih reakcija i metode koncentrovanja ciljane DNK u ekstraktu uzorka.
Metoda koja sledi je standardizovana za korišćenje sa potvrđenom i odobrenom PCR metodom u (Poglavlje VIII ovog priloga).
a) Metoda prema Pastriku (2000):
1. Pipetom odmeriti 220 µl lizis pufera [100 mM NaCl, 10mM Tris-HCl (pH 8,0), 1mM EDTA (pH 8,0)] u Eppendorf tubu od 1,5 ml;
2. Dodati 100 µl ekstrakta uzorka i staviti u termoblok ili vodeno kupatilo na 95°C 10 minuta;
3. Staviti tubu na led u trajanju od pet minuta;
4. Dodati 80 µl osnovnog štok rastvora Lysozyme (50 mg lizozima po ml u 10 mM Tris HCl, pH 8,0) i inkubirati na 37°C 30 minuta;
5. Dodati 220 µl rastvora Easy DNA® A (Invitrogen), dobro izmešati na vorteksu i inkubirati na 65°C 30 minuta;
6. Dodati 100 µl rastvora Easy DNA® B (Invitrogen) i snažno izmešati na vorteksu do postizanja uniformnog viskoziteta uzorka;
7. Dodati 500 µl hloroforma, izmešati na vorteksu dok se viskozitet ne umanji i smesa postane homogena;
8. Centrifugirati na 15.000 g 20 minuta na 4°C da se podele faze i stvori međufaza;
9. Preneti gornju fazu u novu Eppendorf tubu;
10. Dodati 1 ml 100% etanola (-20°C), kratko promešati na vorteksu i inkubirati na ledu 10 minuta;
11. Centrifugirati na 15.000 g 20 minuta na 4°C i ukloniti etanol od taloga;
12. Dodati 500 µl 80% etanola (-20°C) i promešati okretanjem tube;
13. Centrifugirati na 15.000 g 10 minuta na 4°C sačuvati talog, a ukloniti etanol;
14. Ostaviti talog da se suši na vazduhu ili u vakuumskoj centrifugi (DNK speed vac);
15. Resuspendovati talog u 100 µl sterilne Ultra čiste vode i ostaviti na sobnoj temperaturi najmanje 20 minuta;
16. Čuvati na -20°C do izvođenja PCR-a;
17. Bilo koji beli talog izdvojiti centrifugiranjem i za PCR upotrebiti 5 µl supernatanta koji sadrži DNK;
b) druge metode - za ekstrakciju DNK mogu se primeniti i druge metode (npr. Qiagen DNeasy Plant Kit), ukoliko je dokazana ekvivalentnost u pročišćavanju DNK iz kontrolnih uzoraka koji sadrže 103 do 104 patogenih ćelija po ml.
6.2.1. Pripremiti uzorke za testiranje i kontrolne uzorke za PCR prema odobrenim protokolima (Poglavlje VIII ovog priloga). Pripremiti razređenje ekstrakta DNK iz uzorka 1:10 u Ultra čistoj vodi.
6.2.2. U nekontaminiranom prostoru pripremiti odgovarajući reakcioni miks za PCR prema objavljenim protokolima (Poglavlje VIII ovog priloga). Odobreni PCR protokol je multipleks reakcija koja takođe uključuje unutrašnju PCR kontrolu.
6.2.3. Dodati 5 µl ekstrakta DNK u sterilne epruvete za PCR, za PCR reakciju koja se izvodi u 25 µl.
6.2.4. Uključiti i negativnu kontrolu koja sadrži samo PCR reakcioni miks, a umesto uzorka dodati isti izvor Ultra čiste vode koji je korišćen za pripremu PCR reakcionog miksa.
6.2.5. Staviti epruvete u uređaj za PCR (thermal cycler) i pokrenuti standardizovani PCR program (Poglavlje VIII ovog priloga).
6.3.1. Umnožene PCR produkte razdvojiti elektroforezom u agaroznom gelu. U svaki bunarčić 2,0%-tnog (v/v) agaroznog gela u tris-acetat EDTA puferu (TAE) naneti najmanje 12 µl amplikona DNK iz svakog uzorka, pomešane s 3 µl boje i propustiti uz napon od 5 do 8 B V/cm. Upotrebiti odgovarajući DNK marker, npr. 100 bpladder (Poglavlje VIII ovog priloga).
6.3.2. Obojiti elektroforetske trake DNK u gelu potapanjem gela u etidium bromid (0,5 mg/l) u trajanju od 30 do 45 minuta. Preduzeti odgovarajuće mere opreza pri radu sa ovim mutagenom.
6.3.3. Obojeni gel pregledati na kratkotalasnom UV transiluminatoru (npr. l = 302 nm), i potražiti umnožene fragmente očekivane dužine (Poglavlje VIII ovog priloga) i dokumentovati ih.
6.3.4. Prilikom svakog novog nalaza/slučaja proveriti autentičnost umnoženog PCR produkta izvođenjem analize uz pomoć restrikcionih enzima na uzorku preostale umnožene DNK i to inkubacijom pri optimalnoj temperaturi i u optimalnom vremenu s odgovarajućim enzimom i puferom (Poglavlje VIII ovog priloga). Nastale fragmente razdvojiti elektroforezom u agaroznom gelu kako je prethodno navedeno i posle bojenja etidium bromidom na UV transiluminatoru posmatrati karakterističnu matricu (obrazac) restrikcionih fragmenata i uporediti je sa pozitivnom kontrolom pre i posle razdvajanja.
Tumačenje rezultata PCR testa:
PCR test je negativan ako u testiranom uzorku nije vidljiv PCR produkt očekivane dužine koji je specifičan za C. m. subsp. sepedonicus, ali je vidljiv u svim pozitivnim kontrolnim uzorcima (kod multipleks PCR-a sa prajmerima za unutrašnju kontrolu koji su specifični za biljku domaćina: u testiranom uzorku se mora umnožiti drugi produkt PCR-a očekivane veličine).
PCR test je pozitivan ako je vidljiv PCR produkt koji je specifičan za C. m. subsp. sepedonicus i koji je očekivane dužine i restrikcionog obrasca, pod uslovom da nije umnožen ni u jednom uzorku koji predstavlja negativnu kontrolu. Pouzdana potvrda pozitivnog rezultata predstavlja i uspešno ponavljanje testa s drugim parom PCR prajmera (tačka 9. podtačka 9.3. ovog poglavlja).
Napomena:
Ukoliko se očekivani fragment (pozitivna reakcija) dobije u uzorku pozitivne kontrole koja sadrži C. m. subsp. sepedonicus u vodi, a negativni rezultat dobije u uzorku pozitivne kontrole koja sadrži C. m. subsp. sepedonicus u ekstraktu krompira, pretpostavlja se da je došlo do inhibicije PCR reakcije. U multipleks PCR protokolima koji se izvode upotrebom unutrašnjih PCR kontrola, smatra se da je došlo do inhibicije reakcije ako nije dobijen ni jedan od dva produkta.
Takođe, ako se iz jedne ili više negativnih kontrola dobije očekivani produkt, može se sumnjati da je došlo do kontaminacije.
Napomena:
Preliminarno testiranje ovom metodom treba da omogući ponovljivo otkrivanje prisustva 103 do 104 cfu C. m. subsp. sepedonicus po ml, dodatih ekstraktima uzoraka koji su u ranijem testiranju bili negativni (za pripremu videti Poglavlje IV ovog priloga).
Najveća osetljivost detekcije može se očekivati ako se koriste sveže pripremljeni ekstrakti uzoraka i optimalni uslovi za rast i razvoj patogena. Međutim, ova metoda može uspešno da se primeni i upotrebom ekstrakata koji su čuvani sa glicerolom na temperaturi od -68 do -86°C.
Neke sorte plavog patlidžana predstavljaju odličnu selektivnu podlogu za obogaćenje i rast C. m. subsp. sepedonicus, čak i u odsustvu simptoma, a ujedno su i odlične za utvrđivanje biljaka domaćina. Uslovi rasta treba da su optimalni kako bi se umanjio rizik od dobijanja lažno negativnih rezultata.
Detalji u vezi sa gajenjem biljaka se nalaze u (Poglavlje X ovog priloga).
7.1. Na preostalu količinu resuspendovanog taloga ostavljenog za testiranje iz 3.1.6 ili 3.2.5 primeniti metodu inokulacije zarezivanjem ili metodu inokulacije injekcijom. Koristiti samo biljke plavog patlidžana u stadijumu dva do tri prava lista, do potpune razvijenosti trećeg pravog lista. Po jednom uzorku potrebno je 15 do 25 biljaka patlidžana, kako bi se u potpunosti iskoristio resuspendovani talog i osigurala efikasna inokulacija.
7.2. U cilju smanjenja turgora, biljke patlidžana ne zalivati jedan do dva dana pre inokulacije.
7.3. Inokulacija zarezivanjem.
7.3.1. Držeći biljku među prstima, pipetom naneti kapljicu (oko 5-10 µl) resuspendovanog taloga na stabljiku i to između kotiledona i prvog lista.
7.3.2. Sterilnim skalpelom napraviti dijagonalni rez, dug oko 1 cm i dubok oko 2/3 debljine stabljike, počevši od nanesene kapljice resuspendovanog taloga.
7.3.3. Čvrsto zatvoriti rez sterilnim vazelinom iz šprica.
7.4. Inokulacija injekcijom.
Stabljike plavog patlidžana inokulisati neposredno iznad kotiledona injekcijom s tankom iglom (ne manjom od 23G). Uzorak podeliti na biljke plavog patlidžana, tako da svaka biljka dobije odgovarajuću količinu.
7.5. Pozitivna kontrola: pet biljaka inokulisati suspenzijom od 105 do 106 ćelija po ml vode poznate kulture C. m. subsp. sepedonicus i, kada je moguće, ekstraktom prirodno zaraženog tkiva krtola (tačka 4. ovog poglavlja) istom metodom inokulacije.
7.6. Negativna kontrola: pet biljaka inokulisati istom metodom inokulacije koristeći sterilni pelet pufer (pufer za rastvaranje taloga).
7.7. Biljke gajiti u karantinskim prostorijama do četiri sedmice na 18 do 24°C, uz dovoljnu količinu svetla i visoku vlažnost (70 do 80%) i adekvatno zalivati kako bi se sprečilo nakupljanje vode ili uvenuće zbog nedostatka vode. C. m. subsp. sepedonicus se ne razvija na temperaturama iznad 30°C, a optimalna temperatura je 21°C. U cilju sprečavanja unakrsne kontaminacije, biljke pozitivne i negativne kontrole gajiti na jasno odvojenim stolovima u stakleniku ili policama u komori za rast ili, u slučaju da je prostor ograničen, pobrinuti se da su biljke jasno odvojene između pojedinih postupaka u toku izvođenja procedure. Ako se biljke za različite uzorke moraju gajiti blizu jedna drugoj, razdvojite ih pogodnim platnom. Paziti da ne dođe do unakrsne kontaminacije prilikom prihranjivanja, zalivanja, pregledanja i svakog drugog postupka s biljkama. Od ključne važnosti je da u staklenicima i komorama za gajenje ne bude nikakvih insekata jer oni mogu preneti bakteriju s uzorka na uzorak.
7.8. Pojavu simptoma redovno proveravati posle sedam dana od inokulacije. Prebrojati biljke koje pokazuju simptome. C. m. subsp. sepedonicus izaziva uvenuće listova patlidžana koje može početi kao uvelost ivica ili između nerava listova. Uvenulo tkivo u početku izgleda tamnozeleno ili prošarano, ali kasnije postaje bledo pa nekrotično. Uvela površina između lisnih nerava često izgleda masno, kao da je natopljena vodom. Nekrotično tkivo često ima svetložutu ivicu. Biljke ne uginu uvek; što je period pre nego što se simptomi počnu razvijati duži, veća je mogućnost preživljavanja. Biljke mogu prerasti zarazu. Mlade biljke patlidžana mnogo su osetljivije na prisustvo niskog nivoa populacija C. m. subsp. sepedonicus nego starije biljke; zbog toga se koriste biljke u ili neposredno pre faze tri prava lista.
Uvenuće može biti izazvano i populacijom drugih bakterija ili gljivica koje su prisutne u ekstraktu tkiva krtola. To su: Ralstonia solanacearum, Erwinia carotovora subsp. carotovora i Erwinia carotovora subsp. atroseptica, Erwinia chrysanthemi, Phoma exigua var. foveata, kao i populacije velikog broja saprofitnih bakterija. Naročito Erwinia chrysanthemi može izazvati simptome na listovima i uvenuće koje je vrlo slično simptomima C. m. subsp. sepedonicus. Jedinu razliku predstavlja pojava tamnjenja-crnjenja stabljika u slučaju infekcija bakterijom Erwinia chrysanthemi. Druge vrste uvenuća se razlikuju od onih koje prouzrokuje C. m. subsp. sepedonicus zato što celi listovi ili cele biljke vrlo brzo venu. C. m. subsp. sepedonicus se od Erwinia spp može brzo i lako razdvojiti i izvođenjem bojenja i/ili reakcije po Gram-u.
7.9. Odmah po uočavanju prisustva simptoma na biljkama patlidžana, potrebno je izvršiti re-izolaciju, koristeći delove uvenulog tkiva lišća ili tkiva stabljike. Listove i stabljike biljaka patlidžana površinski dezinfikovati brisanjem sa 70%-tnim etanolom. Tkivo izmacerirati i primeniti IF ili PCR test na soku patlidžana i izolaciju patogena na pogodnu (selektivnu) hranljivu podlogu (tačka 8. ovog poglavlja). Takođe se može primeniti i bojenje/reakcija po Gram-u (Poglavlje XI ovog priloga). Izvršiti identifikaciju čiste kulture C. m. subsp. sepedonicus i proveru patogenosti (tačke 9. i 10. ovog poglavlja).
7.10. U određenim okolnostima, naročito u uslovima nepovoljnim za rast i razvoj biljaka, moguće je da se, čak i posle perioda inkubacije od četiri nedelje C. m. subsp. sepedonicus nalazi latentno u biljkama patlidžana. Ako ni posle četiri nedelje od inokulacije ne dođe do pojave simptoma na biljkama treba izvesti IF/PCR test na zbirnom uzorku sastavljenom od delova stabljike (1 cm od svake biljke za testiranje, uzet iznad mesta inokulacije). Ako je test pozitivan, ponovno izvršiti izolaciju patogena na odgovarajuću (selektivnu) hranljivu podlogu, prema postupku iz tačke 8. ovog priloga. Izvršiti identifikaciju čiste kulture C. m. subsp. sepedonicus i proveru patogenosti (tačke 9. i 10. ovog poglavlja).
Tumačenje rezultata biološkog testa - validni rezultati biološkog testa se dobijaju ako biljke u pozitivnoj kontroli pokazuju tipične simptome, ako se iz tih biljaka može ponovo izdvojiti bakterija i ako na biljkama negativne kontrole ne dođe do pojave simptoma.
Biološki test je negativan ako testirane biljke nisu zaražene C. m. subsp. sepedonicus, a pod uslovom da je utvrđeno prisustvo C. m. subsp. sepedonicus u pozitivnim kontrolama.
Biološki test je pozitivan ako su testirane biljke zaražene C. m. subsp. sepedonicus.
8. Izolacija C. m. subsp. sepedonicus
Napomena:
Dijagnoza se može potvrditi samo ako se C. m. subsp. sepedonicus izoluje, a zatim izvrši i identifikacija dobijenog izolata (tačka 9. ovog poglavlja), i ako se potom potvrdi i patogenost dobijenog izolata (tačka 10. ovog poglavlja). Iako je C. m. subsp. sepedonicus zahtevan organizam, može se izolovati iz tkiva sa karakterističnim simptomima. Prilikom izolacije lako može doći do prerastanja kolonije ovog patogena sa kolonijama brzo rastućih saprofitnih bakterija pa je zato izolacija direktno iz ekstrakta tkiva krtola ili stabljike teška. Direktna izolacija C. m. subsp. sepedonicus moguća je korišćenjem odgovarajuće selektivne hranljive podloge i razređenja resuspendovanog taloga dobijenog iz izdvojenog konusa pupčanog dela krtole ili iz stabljika krompira.
Izolacije je potrebno izvršiti iz svih krtola ili delova stabljike krompira sa simptomima kao i iz testiranih biljaka patlidžana kod kojih nisu primećeni simptomi ili je IF/PCR test iz zbirnog uzorka bio pozitivan (tačka 7. podtačka 7.10.). Po potrebi, treba koristiti i maceriranje stabljika patlidžana, prema propisanoj proceduri.
Pozitivna kontrola: pripremiti decimalna razređenja suspenzije 106 cfu po ml C. m. subsp. sepedonicus (npr. NCPPB 4053 ili PD 406). Pozitivne kontrole pripremiti potpuno odvojeno od uzoraka koji se testiraju, da bi se izbegla mogućnost kontaminiranja uzoraka.
Pre upotrebe za rutinsko testiranje uzoraka, proveriti pogodnost svake serije selektivne hranljive podloge za rast i razvoj patogena. Kontrolni materijal podvrgnuti istim principima testiranja kao i uzorak ili uzorke.
8.1. Gajenje na selektivnoj hranljivoj podlozi
8.1.1. Iz odvojene količine od 100 µl resuspendovanog taloga dobijenog iz krtole krompira ili biljnog soka biljaka patlidžana pripremiti decimalna razređenja u pelet puferu (pufer za rastvaranje taloga iz tačke 3. ovog poglavlja).
8.1.2. Izolacija iz resuspendovanog taloga, bez prethodnog razređivanja obično ne uspeva zbog teškog gajenja C. m. subsp. sepedonicus i velike konkurentske sposobnosti saprofita. S obzirom da je u zaraženom tkivu biljke bakterija obično prisutna u populacijama visokog nivoa, saprofiti se mogu odstraniti razređivanjem, dok patogen ostaje. Stoga se preporučuje nanošenje 100 µl iz svakog uzorka (kod upotrebe Petrijevih šolja prečnika 90 mm, dok za Petrijeve šolje drugih veličina treba prilagoditi količinu), 1/100 do 1/10 000 razređene suspenzije na hranjivu podlogu MTNA ili na NCP-88 (Poglavlje VII ovog priloga), tehnikom razmaza.
Napomena:
Alternativna mogućnost je razmaz početne količine od 100 µl resuspendovanog taloga na prvu podlogu, a zatim pravljenje razmaza istim štapićem na drugoj i trećoj podlozi, pri čemu se na njih nanose ostaci ekstrakta s prethodne podloge. Na ovaj način se dobija efekat sličan efektu korišćenja razređenja.
8.1.3. Zasejanu podlogu inkubirati u mraku na 21 do 23°C.
8.1.4. Prva provera podloga i procena pojave i razvoja kolonija nalik C. m. subsp. sepedonicus, u poređenju sa podlogama pozitivne kontrole, se vrši posle 3 dana, a naredne procene posle 5, 7, i eventualno 10 dana.
8.2. Prečišćavanje sumnjivih kolonija
Napomena:
Kolonije slične C. m. subsp. sepedonicus treba dalje preneti na hranjivu podlogu YGM ako će se koristiti za inokulaciju patlidžana i/ili dalju identifikaciju; to treba učiniti pre nego na podlogama dođe do prerastanja kolonija, odnosno najbolje posle tri do pet dana.
8.2.1. Razmazom naneti kolonije slične C. m. subsp. sepedonicus na jednu od sledećih hranljivih podloga: hranljivi agar s dodatkom dekstroze (koristi se samo za presejavanje izolata), agar sa dodatkom kvasca, peptona i glukoze, agar sa dodatkom ekstrakta kvasca i mineralnih soli. Sastav hranljivih podloga naveden je u Poglavlju VII ovog priloga.
Zasejanu podlogu inkubirati na 21°C do 24°C u trajanju do 10 dana. C. m. subsp. sepedonicus sporo raste, obično stvara kremaste, kupolaste kolonije sa šiljatim vrhom. Fotografije tipičnih kolonija C. m. subsp. sepedonicus se mogu videti na web stranici http://forum.europa.eu.int /Public/irc/sanco/Home/main).
8.2.2. Prečišćavanje izolata se postiže ponovnim razmazima i iscrpljivanjem na odgovarajućim hranljivim podlogama. Nivo porasta se povećava presejavanjem. Tipične kolonije su kremasto-bele ili boje slonovače, ponekad žute, zaokružene, glatke, povišene, konveksno-kupolaste, sluzavo-tečne, s celim ivicama i obično 1 do 3 mm u prečniku. Jednostavno bojenje po Gram-u (Poglavlje XI ovog priloga) može pomoći pri izboru kolonija za dalje testiranje.
8.2.3. Izvršiti identifikaciju izabranih kolonija (tačka 9. ovog poglavlja) i proveriti patogenost izolata (tačka 10. ovog poglavlja).
Identifikacija čiste kulture dobijenih izolata C. m. subsp. sepedonicus vrši se korišćenjem najmanje dva od navedenih testova koji se zasnivaju na različitim biološkim principima. Prema potrebi, uključiti poznate referentne izolate za svaki test.
9.1. Odgajivački i enzimski testovi za identifikaciju
Fenotipska svojstva univerzalno prisutna ili odsutna kod bakterije C. m. subsp. sepedonicus utvrditi prema metodama Lelliott i Stead (1987), Klement i sar. (1990), Schaad i sar. (2001), nepoznati autor (1987) i sl.
Sve hranljive podloge inkubirati na 21°C i pregledati nakon šest dana. Ako ne dođe do rasta kolonija, inkubirati do 20 dana. U sve testove treba uključiti poznatu kontrolu C. m. subsp. sepedonicus. Odgajivačke i fiziološke testove izvoditi korišćenjem kulture sa hranjivog agara. Morfološka upoređenja izvršiti u odnosu na kulture na hranjivom agaru sa dodatkom dekstroze.
Testovi |
Očekivani rezultati |
Test oksidacije/fermentacije (O/F) |
inertan ili slabo oksidativan |
Aktivnost oksidaze |
- |
Rast na 37°C |
- |
Aktivnost ureaze |
- |
Hidroliza eskulina |
+ |
Hidroliza skroba |
- ili slaba |
Tolerantnost na 7% rastvora NaCl |
- |
Stvaranje indola |
- |
Aktivnost katalaze |
+ |
Stvaranje H2S |
- |
Korišćenje citrata |
- |
Rastvaranje želatina |
- |
Stvaranje kiseline iz glicerola |
- |
Stvaranje kiseline iz laktoze |
- ili slaba |
Stvaranje kiseline iz ramnoze |
- |
Stvaranje kiseline iz salicina |
- |
Bojenje po Gramu (Poglavlje XI) |
+ |
a) pripremiti suspenziju od približno 106 ćelija po ml u IF puferu (Poglavlje V ovog priloga);
b) pripremiti dvostruka razređenja rastvora pogodnog antiseruma;
v) primeniti IF postupak (tačka 4. ovog poglavlja);
g) IF test je pozitivan ako je IF titar kulture jednak titru pozitivne kontrole.
a) pripremiti suspenziju od približno 106 ćelija po ml u Ultra čistoj vodi;
b) zagrejati 100 µl suspenzije ćelija bakterije u zatvorenim epruvetama u termobloku ili u vrelom vodenom kupatilu četiri minuta na 100°C. Razlaganje ćelija se, po potrebi, može ubrzati dodavanjem sveže pripremljenog NaOH do konačne koncentracije od 0,05M. Do upotrebe uzorci se mogu čuvati na -16 do -24°C;
v) upotrebiti odgovarajuće PCR procedure za umnožavanje specifičnih fragmenata C. m. subsp. sepedonicus (npr. Pastrik, 2000; videti Poglavlje VIII ovog priloga; Li i de Boer, 1995; Mills i sar., 1997; Pastrik i Raineu, 1999; Schaad i sar., 1999);
g) Identifikacija C. m. subsp. sepedonicus je pozitivna ako su PCR produkti iste veličine i imaju isti polimorfizam dužine restrikcionih fragmenata kao i pozitivni kontrolni izolat.
a) pripremiti suspenziju od približno 106 ćelija po ml Ultra čiste vode;
b) primeniti FISH postupak (tačka 5. ovog poglavlja);
v) FISH test je pozitivan ako su postignute reakcije kulture i pozitivne kontrole jednake.
9.5. Profiliranje masnih kiselina (FAP)
a) Kulturu gajiti na triptikaza-soja-agaru (Oxoid) 72 sata na 21°C (+/- 1°C);
b) primeniti odgovarajući FAP postupak (Janse, 1991; Stead, 1992);
v) FAP test je pozitivan ako je profil testirane kulture identičan profilu pozitivne kontrole. Prisustvo karakterističnih masnih kiselina: 15:1 Anteiso A, 15:0 Iso, 15:0 Anteiso, 16:0 Iso, 16:0 i 17:0 Anteiso, u velikoj meri ukazuje da se radi o C. m. subsp. sepedonicus. Rodovi bakterija kao Curtobacterium, Arthrobacter i Micrococcus takođe imaju neke od ovih kiselina, ali 15:1 Anteiso A je kiselina koja se retko može pronaći u ovim bakterijama, ali se pojavljuje u svim bakterijama roda Clavibacter i to između 1 do 5%. Kod C. m. subsp. sepedonicus vrednost je obično oko 5%.
a) pripremiti suspenziju od približno 106 ćelija po ml Ultra čiste vode;
b) primeniti test u skladu s procedurom (Smith i sar., 2001).
Test provere patogenosti se koristi za konačno potvrđivanje prisustva C. m. subsp. sepedonicus i za procenu virulentnosti kultura identifikovanih kao C. m. subsp. sepedonicus.
10.1. Pripremiti inokulum od približno 106 ćelija po ml iz kultura izolata koji se testira, starosti tri dana i odgovarajućeg izolata pozitivne kontrole C. m. subsp. sepedonicus.
10.2. Inokulisati stabljike 5 do 10 mladih sejanaca plavog patlidžana u fazi 3 prva lista (tačka 7. podtačka 7.3. ili 7.4. ovog poglavlja).
10.3. Inokulisane sejance inkubirati na 18 do 24°C uz dovoljnu količinu svetla i visoku relativnu vlažnost i adekvatno zalivati kako bi se izbeglo nakupljanje vode ili stres od suše (tačka 7. podtačka 7.7. ovog poglavlja). Kod inokulacije čistim kulturama, tipično uvenuće se pojavljuje u roku od dve nedelje, dok se biljke koje ne ispoljavaju simptome (videti tačka 7. podtačka 7.8. ovog poglavlja) posle tog vremena inkubiraju još nedelju dana na temperaturama povoljnim za rast plavog patlidžana, ali ne višim od 25°C (Poglavlje X ovog priloga). Ako simptomi nisu prisutni ni posle tri nedelje, dobijena kultura se ne može potvrditi kao patogeni izolat C. m. subsp. sepedonicus.
10.4. Izolaciju iz biljaka sa simptomima izvršiti odstranjivanjem dela stabljike dužine 2 cm iznad mesta inokulacije koji se potom usitni i rastvori u maloj količini sterilne destilovane vode ili 50 mM fosfatnom puferu (Poglavlje V ovog priloga). Izolacija patogena se potom vrši razmazom dobijenog macerata na MTNA i YPGA podloge (Poglavlje VII ovog priloga), inkubiranjem tri do pet dana na 21 do 23°C i utvrđivanjem da li su formirane tipične kolonije bakterije C. m. subsp. sepedonicus.
LABORATORIJE UKLJUČENE U OPTIMIZACIJU I VALIDACIJU PROTOKOLA
Laboratorija (1) |
Mesto |
Država |
Agentur für Gesundheit und Ernährungssicherheit |
Beč i Linz |
Austrija |
Departement Gewasbescherming |
Merelbeke |
Belgija |
Plantedirektoratet |
Lungby |
Danska |
Central Science Laboratory |
York |
Engleska |
Scottish Agricultural Science Agency |
Edinburgh |
Škotska |
Laboratoire National de la Protection des Végétaux, Unité de Bactériologie |
Angers |
Francuska |
Laboratoire National de la Protection des Végétaux, Station de Quarantaine de la Pomme de Terre |
Le Rheu |
Francuska |
Biologische Bundesanstalt |
Kleinmachnow |
Nemačka |
Pflanzenschutzamt Hannover |
Hannover |
Nemačka |
State Laboratory |
Dublin |
Irska |
Plantenziektenkundige Dienst |
Wageningen |
Holandija |
Norwegian Crop Research Institute, Plant Protection Centre |
Aas |
Norveška |
Direcção-Geral de Protecção das Culturas |
Lisbon |
Portugalija |
Nacionalni institut za biologijo |
Ljubljana |
Slovenija |
Centro de Diagnostico de Aldearrubia |
Salamanca |
Španija |
1 Za kontakt sa naučnicima: videti web stranicu: http://forum.europa.eu.int/Public/irc/sanco/Home/main |
||
PRIPREMA POZITIVNIH I NEGATIVNIH KONTROLA ZA OSNOVNE TESTOVE PROVERE
Napraviti suspenziju kulture virulentnog izolata C. m. subsp. sepedonicus (NCPPB 4053 ili PD 406) gajenog 72 sata na MTNA osnovnoj hranljivoj podlozi u 10 mM fosfatnom puferu koncentracije približno 1-2 x 108 cfu/ml. To je obično slabo mutna suspenzija optičke gustine 0,20 na 600 nm.
Izvaditi konus pupčanog dela iz 200 krtola bele sorte krompira za koje je poznato da nisu zaražene bakterijom C. m. subsp. sepedonicus.
Obraditi konuse uobičajenom metodom i resuspendovati talog u 10 ml.
Pripremiti deset sterilnih mikroepruveta od 1,5 ml sa 900 µl resuspendovanog taloga.
U prvu mikroepruvetu dodati 100 µl suspenzije C. m. subsp. sepedonicus i izmešati na vorteksu.
U sledećih pet mikroepruveta pripremiti decimalna razređenja bakterijske suspenzije.
Ovih šest mikroepruveta sa zaraženim ekstraktom koristiti za pozitivnu, a četiri mikroepruvete sa nezaraženim ekstraktom koristiti za negativnu kontrolu. U skladu s tim, označiti mikroepruvete.
U mikroepruvetama od 1,5 ml pripremiti alikvote od 100 µl tako da se dobije devet kopija svakog kontrolnog uzorka. Do upotrebe čuvati na -16 do -24°C.
Prisustvo i količinu prisutne C. m. subsp. sepedonicus u kontrolnim uzorcima prvo potvrditi IF testom.
Za PCR test, izvršiti ekstrakciju DNK u pozitivnim i negativnim kontrolnim uzorcima za svaku seriju uzoraka za testiranje.
Za IF i FISH testove, izvršiti testiranje pozitivnih i negativnih kontrolnih uzoraka za svaku seriju uzoraka za testiranje. Kod IF, FISH i PCR testova, potrebno je utvrditi prisustvo C. m. subsp. sepedonicus u koncentraciji od najmanje 103 i 104 ćelija/ml kod pozitivnih kontrola i ni u jednoj negativnoj kontroli.
PUFERI ZA TEST PROCEDURE
Sterilisani puferi koji nisu otvarani mogu se čuvati do jedne godine.
1.1. Ekstrakcioni pufer (50 mM fosfatni pufer, pH 7,0)
Ovaj pufer se koristi za ekstrakciju bakterije iz biljnog tkiva homogenizacijom ili trešenjem.
Na2HPO4 (anhidrovani) 4,26 g
KH2PO4 2,72 g
Destilovana voda 1,00 L
Rastvoriti sastojke, proveriti pH i sterilisati u autoklavu na 121°C 15 minuta.
Sledeći sastojci mogu biti korisni:
|
Namena |
Količina (po L) |
Pahuljice Lubrol |
Deflokulant* |
0,5 g |
DC silikon protiv stvaranja pene |
Sredstvo protiv |
1,0 ml |
Tetranatrijum pirofosfat |
Antioksidant |
1,0 g |
Polivinilpirolidon-40000 (PVP-40) |
Vezivanje PCR |
50 g |
* Za upotrebu kod metode ekstrakcije homogenizacijom |
||
1.2. Pelet pufer (Pufer za rastvaranje taloga-10 mM fosfatni pufer, pH 7,2)
Ovaj pufer se koristi za resuspendovanje i razređivanje ekstrakta konusa izvađenih iz pupčanih delova krtola krompira, posle koncentrovanja taloga centrifugiranjem.
Na2HPO x 12H2O |
2,7 g |
NaH2PO4 x 2H2O |
0,4 g |
Destilovana voda 1,00 L
Rastvoriti sastojke, proveriti pH i sterilisati u autoklavu na 121°C 15 minuta.
2.1. IF pufer (10 mM fosfatni pufer s dodatkom soli (PBS), pH 7,2)
Ovaj pufer se koristi za razređivanje antitela.
Na2HPO4 x 12H2O |
2,7 g |
NaH2PO4 x 2H2O |
0,4 g |
NaCl |
8,0 g |
Destilovana voda 1.0 L
Rastvoriti sastojke, proveriti pH i sterilisati u autoklavu na 121°C 15 minuta.
Ovaj pufer se koristi za ispiranje IF pločica.
IF puferu dodati 0,1% Tween 20.
2.3. Fosfatni pufer s glicerolom pH 7,6
Ovaj pufer se koristi kao rastvor za prekrivanje bunarčića u IF testu kako bi se pojačala fluorescencija.
Na2HPO4 x 12H2O |
3,2 g |
NaH2PO4 x 2H2O |
0,15 g |
Glicerol 50 ml
Destilovana voda 100 ml
Komercijalni rastvori npr. Vectashield® (Vector Laboratories) ili Citifluor® (Leica).
ODREĐIVANJE NIVOA KONTAMINACIJE U IF I FISH TESTOVIMA
1. Izbrojati prosečan broj tipičnih fluorescentnih ćelija po vidnom polju (c)
2. Izračunati broj tipičnih fluorescentnih ćelija po bunarčiću mikroskopske pločice (C)
C = c x S/s
gde je
S = površina bunarčića IF pločice sa više bunarčića i
s = površina polja objektiva.
s = pi2/4G2K2
gde je
i = koeficijent polja (varira od 8 do 24 zavisno od tipa okulara)
K = koeficijent tube (cevi) (1 ili 1,25)
G = povećanje objektiva (100x, 40x itd.).
Izračunati broj tipičnih fluorescentnih ćelija po ml resuspendovanog taloga (N)
N = C x 1000/u x F
gde je
u = zapremina resuspendovanog taloga u svakom bunarčiću, i
F = faktor razređenja resuspendovanog taloga.
HRANLJIVE PODLOGE ZA IZOLACIJU I GAJENJE C. M. SUBSP. SEPEDONICUS
Hranljivi agar (Difco) 23,0 g
Destilovana voda 1,0 L
Rastvoriti sastojke i sterilisati u autoklavu na 121°C 15 minuta.
1.2. Hranljivi agar sa dekstrozom (NDA)
Difco bacto hranljivi agar koji sadrži 1% D(+) glukoze (monohidrata).
Sterilisati u autoklavu na 115°C 20 minuta
1.3. Agar sa kvascem, peptonom i glukozom (YPGA)
Ekstrakt kvasca (Difco) 5,0 g
Bacto pepton (Difco) 5,0 g
D(+) glukoza (monohidrat) 10,0 g
Agar Bacto (Difco) 15,0 g
Destilisana voda 1,0 L
Rastvoriti sastojke i sterilisati u autoklavu na 121°C 15 minuta.
1.4. Agar sa ekstraktom kvasca i mineralnim solima (YGM)
Bacto ekstrakt kvasca (Difco) 2,0 g
D(+) glukoza (monohidrat) 2,5 g
K2HPO4 0,25 g
KH2PO4 0,25 g
MgSO4.7H2O 0,1 g
MnSO4.H2O 0,015 g
NaCl 0,05 g
FeSO4.7H2O 0,005 g
Bacto agar (Difco) 18 g
Destilovana voda 1,0 L
Rastvoriti sastojke i sterilisati 0,5 litara hranljive podloge u autoklavu na 121°C 15 minuta.
2. Selektivne hranljive podloge koje su prošle validaciju
Osim ako nije drugačije navedeno, svi sastojci su iz BDH.
Ekstrakt kvasca (Difco) 2,0 g
Manitol 2,5 g
K2HPO4 0,25 g
KH2PO4 0,25 g
NaCl 0,05 g
MgSO4.7H2O 0,1 g
MnSO4.H2O 0,015 g
FeSO4.7H2O 0,005 g
Agar (Oxoid no. 1) 16,0 g
Destilovana voda 1,0 L
Rastvoriti sastojke, podesiti pH na 7,2. Nakon sterilizacije u autoklavu na 121°C u trajanju od 15 minuta i hlađenja na 50°C, dodati antibiotike: trimetoprim 0,06 g, nalidiksilnu kiselinu 0,002 g, amfotericin B 0,01 g kiselina (Sigma) (oba 5 mg/ml), u 96% metanolu, amfotericin B (Sigma) (1 mg/ml) u dimetil sulfoksidu. Štok rastvori se sterilišu filtracijom.
Koncentrovani rastvori antibiotika: trimetoprim (Sigma) i nalidiksilna kiselina (Sigma) (oba 5 mg/ml), u 96%-tnom metanolu, amfotericin B (Sigma) (1 mg/ml) u dimetilsulfoksidu.
Napomena:
Rok trajanja osnovne hranljive podloge je tri meseca. Nakon što se dodaju antibiotici, rok trajanja je mesec dana, i to ukoliko se pripremljena podloga čuva u frižideru.
Hranljivi (Difco) 23 g
Ekstrakt kvasca (Difco) 2 g
D-manitol 5 g
K2HPO4 2 g
KH2PO4 0,5 g
MgSO4.7H2O 0,25 g
Destilovana voda 1,0 L
Rastvorite sastojke, podesite pH na 7,2. Nakon sterilizacije u autoklavu (na 121°C 15 minuta) i hlađenja na 50°C, dodajte sledeće antibiotike: Polimiksin B sulfat (Sigma) 0,003 g, nalidiksilna kiselina (Sigma) 0,008 g, cikloheksimid (Sigma) 0,2 g.
Štok rastvore antibiotika napraviti na sledeći način: rastvoriti nalidiksilnu kiselinu u 0,01 M NaOH cikloheksimid u 50% etanolu, polimiksin B sulfat u destilovanoj vodi. Osnovni rastvori su sterilisani filtriranjem.
Napomena:
Rok trajanja osnovne hranjive podloge je tri meseca. Nakon što se dodaju antibiotici, rok trajanja je mesec dana, i to kada se čuva u frižideru.
POTVRĐENI I ODOBRENI PROTOKOLI I REAGENSI ZA PCR
Napomena:
Preliminarna testiranja treba da omoguće ponovljivu detekciju od najmanje 103 do 104 ćelija C. m. subsp. sepedonicus po ml ekstrakta uzorka.
Tokom preliminarnih testiranja ne sme doći do pojave lažno pozitivnih rezultata kod odabranih bakterijskih izolata.
1. Protokol za multipleks PCR sa unutrašnjom PCR kontrolom (Pastrik, 2000)
1.1. Oligonukleotidni prajmeri
Uzvodni prajmer PSA-1 5´- ctc ctt gtg ggg tgg gaa aa -3´
Nizvodni prajmer PSA-R 5´- tac tga gat gtt tca ctt ccc c -3´
Uzvodni prajmer NS-7-F 5´- gag gca ata aca ggt ctg tga tgc -3´
Nizvodni prajmer NS-8-R 5’- tcc gca ggt tca cct acg ga -3’
Očekivana dužina umnoženog proizvoda iz DNK C. m. subsp. sepedonicus = 502 bp (par prajmera PSA).
Očekivana dužina umnoženog proizvoda iz 18S rRNA unutrašnje kontrole = 377 bp (par prajmera NS).
Reagens |
Količina |
Konačna |
Sterilna Ultra čista voda |
15,725 µl |
|
10x PCR pufer1 (15mM MgCl2) |
2,5 µl |
1x (1,5mM MgCl2) |
BSA (frakcija V) (10%) |
0,25 µl |
0,1% |
Smesa d-NTP (20mM) |
0,125 µl |
0,1 mM |
Prajmer PSA-1 (10 µM) |
0,5 µl |
0,2 µM |
Prajmer PSA-R (10 µM) |
0,5 µl |
0,2 µM |
Prajmer NS-7-F (10 µM)2 |
0,1 µl |
0,04 µM |
Prajmer NS-8-R (10 µM)2 |
0,1 µl |
0,04 µM |
Taq polimeraza (5 U/µl)1 |
0,2 µl |
1,0 U |
Zapremina uzorka |
5,0 µl |
|
Ukupna zapremina |
25,0 µl |
|
(1) validacija metode je izvršena uz korišćenje Taq polimeraze Perkin Elmer (AmpliTaq ili Gold) i Gibco BRL.
(2) optimizacija koncentracije prajmera NS-7F i NS-8-R je izvršena za ekstrakciju iz pupčanog konusa krompira metodom homogenizacije i prečišćavanja DNK prema Pastrik (2000) (Poglavlje II tačka 6. podtačka 6.1. i 6.2). Ukoliko se koristi ekstrakcija trešenjem ili neka druga metoda izolacije DNK, potrebno je izvršiti ponovnu optimizaciju koncentracije reagenasa.
Izvesti sledeći program:
a) 1 ciklus: 3 minuta na 95°C (denaturacija lanca DNK);
b) 10 ciklusa: 1 minut na 95°C (denaturacija lanca DNK);
v) 1 minut na 64°C (vezivanje prajmera);
g) 1 minut na 72°C (hibridizacija);
d) 25 ciklusa: 30 sekundi na 95°C (denaturacija lanca DNK);
đ) 30 sekundi na 62°C (denaturacija lanca DNK);
e) 1 minut na 72°C (produžavanje kopije);
ž) ciklus: 5 minuta na 72°C (konačno produžavanje);
z) držati na 4°C.
Napomena:
Optimalni uslovi korišćenja ovog programa su definisani za korišćenje na PCR MJ Research PTC 200 thermal cycler. Modifikacija trajanja koraka ciklusa je verovatno potrebna u slučaju upotrebe drugih modela thermal cycler-a.
1.4. Analiza produkta umnožavanja restrikcionim enzimom
PCR proizvodi umnoženi iz DNK C. m. subsp. sepedonicus ispoljavaju karakteristične polimorfizme u dužini restrikcionih fragmenata sa enzimom Bgl II posle inkubacije na 37°C 30 minuta. Restrikcioni fragmenti dobijeni iz specifičnog fragmenta C. m. subsp. sepedonicus su veličine 282 bp i 220 bp.
2. Priprema boje za elektroforezu
2.1. Bromfenol plavo (10%-tni koncentrovanii rastvor)
Bromfenol plavo 5 g
Destilovana voda (bidestilovana) 50 ml
Glicerol (86%) 3,5 ml
Bromfenol plavo (5.1) 300 µl
Destilovana voda (bidestilovana) 6,2 ml
3. 10x Tris acetatni i EDTA pufer (TAE), pH 8,0
Tris pufer 48 g
Glacijalna sirćetna kiselina 11,42 ml
EDTA (dinatrijumova so) 3,72 g
Destilovana voda 1,00 L
Razredite 1x pre upotrebe.
(npr. Invitrogen ili zamena)
POTVRĐENI I ODOBRENI REAGENSI ZA FISH TEST
Specifična proba za C. m. subsp. sepedonicus
CMS-CY3-01: 5´- ttg cgg ggc gca cat ctc tgc acg -3´
Nespecifična eubakterijska proba EUB-338-FITC: 5´- gct gcc tcc cgt agg agt -3´
Rastvor za fiksiranje sadrži paraformaldehid koji je toksičan. Nositi rukavice i ne udisati ga. Preporučuje se rad u digestoru.
a) zagrejati 9 ml vode za upotrebu u procedurama molekularne biologije (npr. Ultra čiste vode) na oko 60°C i dodati 0,4 g paraformaldehida. Paraformaldehid se rastvara posle dodavanja pet kapi 1N NaOH i mešanja na magnetnoj mešalici;
b) podesiti pH na 7,0 dodajući 1 ml 0,1M fosfatnog pufera (PB; pH 7,0) i 5 kapi 1N HCl. Vrednost pH proveriti I pomoću indikator traka i ako je potrebno podesite pH pomoću HCl ili NaOH.
U rastvorima sa paraformaldehidom ne potrebljavati ph metar;
v) profiltrirati rastvor kroz membranski filter od 0,22 µm i do dalje upotrebe čuvati na 4°C i zaštititi od prašine.
Napomena:
Alternativni rastvor za fiksiranje: 96%-tni etanol.
NaCl 2,7 M
Tris-HCl 60mM (pH 7,4)
EDTA (filter sterilisani u autoklavima) 15 mM
Razredite do 1x prema potrebi
1x Hybmix
Natrijum dodecil sulfat (SDS) 0,01%
Proba EUB 338 5 ng/µl
Proba CMSCY301 5 ng/µl
Pripremiti količine rastvora za hibridizaciju prema proračunima u Tabeli 1. Predložene količine za pripremanje smese za hibridizaciju (u daljem tekstu: Tabela 1).
Za svaku pločicu (sa 2 različita uzorka u duplikatu) treba 90 µl rastvora za hibridizaciju.
Tabela 1.
|
2 pločice |
8 pločica |
Sterilna ultra čista voda |
50,1 |
200,4 |
3x hybmix |
30,0 |
120,0 |
1% SDS |
0,9 |
3,6 |
Proba EUB 338 (100 ng/µl) |
4,5 |
18,0 |
Proba CMSCY301 (100 ng/µl) |
4,5 |
18,0 |
Ukupna zapremina (µl) |
90,0 |
360,0 |
Napomena:
Sve rastvore koji sadrže oligo-probe osetljive na svetlost čuvati u mraku na -20°C. Tokom upotrebe zaštititi ih od direktne sunčeve svetlosti ili električnog svetla.
5. 0,1M fosfatni pufer, pH 7,0
Na2HPO4 8,52 g
KH2PO4 5,44 g
Destilovana voda
Rastvoriti sastojke, proveriti pH i sterilisati u autoklavu na 121°C 15 minuta.
GAJENJE PLAVOG PATLIDŽANA
Posejati seme plavog patlidžana (Solanum melongena) u pasterizovani kompost za seme. Presaditi sejance sa potpuno razvijenim kotiledonima (10 do 14 dana) u pasterizovan kompost u saksijama.
Plavi patlidžani bi trebalo da se gaji u stakleniku pod sledećim uslovima:
1) dužina dana: 14 sati ili prirodna dužina dana, ako je duža od 14 sati;
2) temperatura: dan: 21 do 24°C, noć: 15°C.
Osetljive sorte plavog patlidžana: "Black Beauty", "Long Tom", "Rima", "Balsas" (web stranica http //forum.europa.eu.int/Public/irc/sanco/Home/main).
POSTUPAK BOJENJA PO GRAM-U (HUCKEROVA MODIFIKACIJA) (DOETSCH, 1981)
Rastvorite 2 g kristal violeta u 20 ml 95%-tnog etanola.
Rastvorite 0,8 g amonijum-oksalata u 80 ml destilovane vode.
Pomešati dva rastvora.
Jod 1 g
Kalijum-jodid 2 g
Destilovana voda 300 ml
Usitniti sastojke koristeći tučak i avan. Dodati sastojke vodi i promešati da se rastvore u zatvorenoj posudi.
v) Rastvor šafranina za kontrast
Osnovni rastvor:
Šafranin O 2,5 g
95%-tni etanol 100 ml
Promešati i čuvati.
Razrediti: 1:10 za dobijanje radnog rastvora.
Postupak bojenja:
1. Pripremiti razmaze, osušiti na vazduhu i fiksirati ih zagrevanjem.
2. Pločicu preliti rastvorom kristal violeta i držati jedan minut.
3. Kratko isprati tekućom vodom.
4. Preliti Lugolovim rastvorom jedan minut.
5. Isprati tekućom vodom i prosušiti filter-papirom.
6. Boju ukloniti 95%-tnim etanolom, koji se dodaje kap po kap ili se razmaz uroni na 30 sekundi i lagano protrese.
7. Isprati tekućom vodom i prosušiti filter-papirom.
8. Preliti rastvorom šafranina 10 sekundi.
9. Isprati tekućom vodom i osušiti filter-papirom.
Gram pozitivne bakterije se boje ljubičasto-plavo; gram negativne bakterije se boje ružičasto-crveno.