PRAVILNIKO MERAMA OTKRIVANJA, SPREČAVANJA ŠIRENJA I SUZBIJANJA ŠTETNOG ORGANIZMA RALSTONIA SOLANACEARUM (SMITH) YABUUCHI ET AL. PROUZROKOVAČA MRKE TRULEŽI KRTOLA KROMPIRA I BAKTERIJSKOG UVENUĆA KROMPIRA I PARADAJZA, NAČINU ODREĐIVANJA GRANICA ZARAŽENOG, UGROŽENOG I PODRUČJA BEZ ŠTETNOG ORGANIZMA, USLOVIMA ZA OKONČANJE NALOŽENIH MERA, KAO I NAČINU OBAVEŠTAVANJA O PREDUZETIM MERAMA I PRESTANAK MERA("Sl. glasnik RS", br. 107/2009) |
Ovim pravilnikom propisuju se mere otkrivanja, sprečavanja širenja i suzbijanja štetnog organizma Ralstonia solanacearum (Smith) Yabuuchi et al., prouzrokovača mrke truleži krtola krompira i bakterijskog uvenuća krompira i paradajza (u daljem tekstu: štetni organizam), način određivanja granica zaraženog, ugroženog i područja bez štetnog organizma, uslovi za okončanje naloženih mera, kao i način obaveštavanja o preduzetim merama i prestanak mera.
II MERE OTKRIVANJA ŠTETNOG ORGANIZMA
Pregledi radi otkrivanja štetnog organizma
Radi otkrivanja pojave štetnog organizma sprovode se pregledi biljaka i krtola krompira (Solanum tuberosum L.) i pregledi biljaka paradajza (Lycopersicon lycopersicum (L.) Karsten ex Farw), osim semena i plodova paradajza (u daljem tekstu: glavne biljke domaćini), kao i pregledi propisanih objekata.
Radi otkrivanja drugih mogućih izvora zaraze koji mogu ugroziti proizvodnju glavnih biljaka domaćina, vrši se procena opasnosti od širenja štetnog organizma (analiza rizika). Ako se analizom rizika utvrdi opasnost od širenja štetnog organizma u proizvodnim područjima glavnih biljaka domaćina sprovode se mere otkrivanja štetnog organizma, i to pregled:
1) na drugim biljkama domaćinima, uključujući samonikle biljke iz familije Solanaceae;
2) površinskih voda koje se koriste za navodnjavanje ili prskanje glavnih biljaka domaćina;
3) tečnog otpada koji nastaje u industrijskoj preradi ili u pogonima za pakovanje glavnih biljaka domaćina i koristi se za navodnjavanje ili prskanje glavnih biljaka domaćina;
4) supstrata koji se koristi za rast biljaka, zemljišta i čvrstih otpadaka koji nastaju u industrijskoj preradi ili u pogonima za pakovanje glavnih biljaka domaćina.
Način vršenja pregleda i laboratorijskih ispitivanja
Pri vizuelnom pregledu biljaka krompira u polju, u odgovarajućem vremenskom periodu u toku vegetacije, vrši se pregled na prisustvo štetnog organizma, uzimaju se uzorci biljaka krompira i dostavljaju ovlašćenoj laboratoriji (u daljem tekstu: laboratorija), radi laboratorijskog ispitivanja.
Pri vizuelnom pregledu krtola krompira iz lotova u skladištima i distributivnim centrima, vrši se pregled krtola semenskog krompira i krompira koji nije namenjen sadnji (u daljem tekstu: merkantilni krompir), kao i vizuelni pregled krtola koje su sečene čiji uzorci se dostavljaju laboratoriji, radi laboratorijskog ispitivanja. Semenski krompir mora da potiče od materijala koji ispunjava uslove u pogledu zdravstvene ispravnosti i za koji je laboratorijskim ispitivanjem utvrđeno da nije zaražen štetnim organizmom.
Pri vizuelnom pregledu paradajza u odgovarajućem vremenskom periodu tokom vegetacije vrši se pregled rasada na prisustvo štetnog organizma koji je namenjen tržišnoj proizvodnji.
Kada se pregledi vrše na drugim biljkama domaćinima, u površinskim vodama, uključujući tečni otpad i u ostalom materijalu, posebno supstratima, zemljištu i čvrstim otpacima industrijskih postrojenja za preradu i pakovanje, uzimaju se uzorci i dostavljaju laboratoriji, radi laboratorijskog ispitivanja.
Laboratorijsko ispitivanje iz st. 1, 2. i 4. ovog člana sprovodi se na način opisan u Prilogu - Šema testiranja za dijagnostiku, detekciju i identifikaciju prouzrokovača mrke truleži krtola krompira i bakterijskog uvenuća krompira i paradajza (u daljem tekstu: Prilog), koji je odštampan uz ovaj pravilnik i čini njegov sastavni deo.
Sumnja na pojavu štetnog organizma
Sumnja na pojavu štetnog organizma postoji ako su vizuelnim pregledom uočeni tipični simptomi bolesti ili je rezultat jednog od brzih testova provere (screening test) pozitivan.
Da bi se potvrdila ili otklonila sumnja na pojavu štetnog organizma, sprovode se dalja laboratorijska ispitivanja, na način opisan u Prilogu.
Pri laboratorijskom ispitivanju, na odgovarajući način čuvaju se uzorkovane krtole i kada je to moguće uzorkovane biljke, preostali ekstrakt i dodatno pripremljen materijal za brze testove provere (screening test), npr. stakalca za imunofluorescenciju i prateća dokumentacija.
Sačuvani uzorak krtole obezbeđuje testiranje sortnosti, kada je to potrebno.
Ako je laboratorijskim ispitivanjem potvrđeno prisustvo štetnog organizma, na odgovarajući način čuva se materijal iz stava 3. ovoga člana, uzorak veštački zaraženih test biljaka paradajza i patlidžana, kao i izolovana kultura štetnog organizma najmanje mesec dana od dana potvrđene zaraze.
Sprovođenje mera u slučaju sumnje na pojavu štetnog organizma
U slučaju sumnje na pojavu štetnog organizma, pored mera iz čl. 2. i 3. ovog pravilnika, sprovode se sledeće mere:
1) zabrana premeštanja biljaka paradajza, kao i biljaka i krtola krompira iz svih useva, lotova ili pošiljaka iz kojih su uzeti uzorci;
2) preduzimanje potrebnih radnji radi otkrivanja izvora zaraze štetnim organizmom;
3) dodatne preventivne mere radi sprečavanja širenja štetnog organizma, u zavisnosti od procenjenog stepena rizika.
Mere iz stava 1. tačka 3) ovog člana primenjuju se naročito u slučaju proizvodnje glavnih biljaka domaćina i premeštanja svih ostalih krtola ili biljaka povezanih sa sumnjivom pojavom, unutar i van objekata, ograničavanje upotrebe potencijalno kontaminiranih mašina i opreme.
Obaveštavanje u slučaju sumnje na pojavu štetnog organizma
U slučaju sumnje na zarazu štetnim organizmom, kada postoji opasnost od prenošenja zaraze sa glavnih biljaka domaćina ili površinskim vodama u drugu državu, Ministarstvo o tome obaveštava službeno telo nadležno za zaštitu bilja te države i međunarodnu organizaciju, u skladu sa međunarodnim konvencijama i sporazumima obavezujućim za Republiku Srbiju.
III NAČIN ODREĐIVANJA GRANICA ZARAŽENOG, UGROŽENOG I PODRUČJA BEZ ŠTETNOG ORGANIZMA, KAO I MERE SPREČAVANJA ŠIRENJA I SUZBIJANJA ŠTETNOG ORGANIZMA
1. Način određivanja granica zaraženog, ugroženog i područja bez štetnog organizma
Kada se na osnovu rezultata laboratorijskih ispitivanja, sprovedenih na način opisan u Prilogu, potvrdi prisustvo štetnog organizma, granice zaraženog, ugroženog ili područja bez štetnog organizma, određuju se tako što se:
1) utvrđuje obim jednog ili više primarnih izvora zaraze;
2) označavaju kao zaražene glavne biljke domaćini, pošiljke ili lotovi iz kojih je uzet uzorak, mašine, oprema, prevozna sredstva, skladišta ili njihovi delovi, i svi drugi objekti i predmeti, uključujući materijal za pakovanje, koji su bili u kontaktu sa glavnim biljkama domaćinima koji su označeni kao zaraženi, mesta proizvodnje, polja, zaštićene prostore namenjene proizvodnji bilja, bilo da je uzorak uzet u toku vegetacije ili nakon vađenja ili berbe glavnih biljaka domaćina;
3) određuje obim moguće zaraze na osnovu podataka o svim kontaktima u proizvodnom procesu sa izvorom zaraze (pre i posle vađenja ili skupljanja biljaka);
4) razgraničava zaraženo, ugroženo i područje bez štetnog organizma, i to na osnovu označene i potvrđene zaraze, obima moguće zaraze, kao i mogućeg širenja štetnog organizma.
Obim primarnih izvora zaraze glavnih biljaka domaćina
Obim primarnih izvora zaraze glavnih biljaka domaćina iz člana 7. tačka 1) ovog pravilnika utvrđuje se u zavisnosti od:
1) mesta proizvodnje, na kojem se:
- proizvodi ili je bio proizveden krompir, koji je klonski srodan sa krompirom na kojem je potvrđena zaraza štetnim organizmom,
- proizvodi ili je bio proizveden paradajz, koji potiče iz istog izvora kao i paradajz na kome je potvrđena zaraza štetnim organizmom,
- proizvode ili su bili proizvedeni krompir ili paradajz, koji su pod nadzorom fitosanitarnog inspektora zbog sumnje na zarazu štetnim organizmom,
- proizvodi ili je bio proizveden krompir koji je klonski srodan s krompirom proizvedenim na mestu proizvodnje gde je potvrđena zaraza štetnim organizmom,
- proizvode krompir ili paradajz, a koja se nalaze u blizini zaraženih mesta proizvodnje uključujući i ona mesta proizvodnje na kojima se koriste ista oprema za proizvodnju i objekti,
- koriste površinske vode za navodnjavanje ili prskanje iz izvora za koji se sumnja na zarazu ili je potvrđena da je zaražen štetnim organizmom,
- koriste površinske vode za navodnjavanje ili prskanje iz istog izvora koji se koristi i na mestima proizvodnje na kojima je potvrđena zaraza ili postoji sumnja na zarazu štetnim organizmom,
- proizvode glavne biljke domaćini, a koja su poplavljena ili su bila poplavljena površinskim vodama u kojima je potvrđena zaraza ili postoji sumnja na zarazu štetnim organizmom;
2) površinskih voda koje se koriste za navodnjavanje, prskanje ili su poplavile polja ili mesta proizvodnje na kojima je potvrđena zaraza štetnim organizmom.
Pri utvrđivanju obima primarnih izvora zaraze glavnih biljaka domaćina sprovodi se laboratorijsko ispitivanje svih partija semenskog krompira koji je klonski srodan sa zaraženim krompirom, na način opisan u Prilogu.
Obim moguće zaraze glavnih biljaka domaćina
Obim moguće zaraze iz člana 7. tačka 3) ovog pravilnika određuje na osnovu podataka o:
1) glavnim biljkama domaćinima gajenih na mestu proizvodnje koje je označeno kao zaraženo;
2) drugim mestima proizvodnje koja su u bilo kakvoj vezi sa proizvodnjom glavnih biljaka domaćina koje su označene kao zaražene, kao i zajednički korišćene opreme i objekata;
3) glavnim biljkama domaćinima proizvedenim na mestima proizvodnje iz tačke 2) ovog stava ili su se nalazile na tim mestima proizvodnje istovremeno sa glavnim biljkama domaćinima koje su označene kao zaražene ili su se nalazile na mestima proizvodnje koja su označena kao zaražena;
4) prostoru i objektima na kojima se nalaze ili dorađuju glavne biljke domaćini koje potiču sa mesta proizvodnje iz tač. 1) do 3) ovog stava;
5) mašinama, prevoznim sredstvima, skladištima ili njihovim delovima i drugim propisanim objektima ili predmetima, uključujući i materijal za pakovanje, koji su mogli da dođu u kontakt sa glavnim biljkama domaćinima koje su označene kao zaražene;
6) glavnim biljkama domaćinima koje su bile uskladištene ili u dodiru sa nekim od propisanih objekata ili predmetima iz tačke 5) ovog stava pre njihovog čišćenja i dezinfekcije;
7) biljkama paradajza koje potiču iz istih izvora kao i paradajz koji je označen kao zaražen, odnosno krtola ili biljaka krompira koje su klonski povezane sa krtolama, odnosno biljkama krompira koje su označene kao zaražene i koji se, i ako su rezultati laboratorijskih ispitivanja negativni, smatraju moguće zaraženim zbog klonske srodnosti sa krompirom označenim kao zaraženim. Kada je potrebno, može da se sprovede i test sortnosti da bi se proverio identitet zaraženih i klonski srodnih krtola ili biljaka krompira;
8) mestima proizvodnje glavnih biljaka domaćina navedenih u tački 7) ovoga stava;
9) mestima proizvodnje glavnih biljaka domaćina na kojima se za navodnjavanje ili prskanje upotrebljava voda koja je označena kao zaražena;
10) glavnim biljkama domaćinima proizvedenim na poljima koja su bila poplavljena površinskom vodom za koju je utvrđeno da je zaražena štetnim organizmom.
Obim mogućeg širenja štetnog organizma
Obim mogućeg širenja štetnog organizma iz člana 7. tačka 4) ovog pravilnika, određuje se na osnovu podataka o:
1) blizini drugih mesta proizvodnje glavnih biljaka domaćina;
2) zajedničkoj proizvodnji i zajedničkoj upotrebi zaliha semenskog krompira;
3) mestu proizvodnje na kojem se upotrebljava površinska voda za navodnjavanje ili prskanje glavnih biljaka domaćina, na kojima postoji ili je postojala mogućnost površinskog doticanja vode sa mesta proizvodnje koja su označena kao zaražena ili mogućnost poplavljivanja vodom sa mesta proizvodnje koja su označena kao zaražena.
Određivanje granica zaraženog, ugroženog i područja bez štetnog organizma u slučaju zaraze drugih biljaka domaćina
Kada se na osnovu rezultata laboratorijskih ispitivanja, sprovedenih na način opisan u Prilogu, potvrdi prisustvo štetnog organizma u usevu drugih biljaka domaćina u područjima gde je ugrožena proizvodnja glavnih biljaka domaćina određuju se granice zaraženog, ugroženog i područja bez štetnog organizma, tako što se:
1) utvrđuje obim primarnih izvora zaraze glavnih biljaka domaćina, u skladu sa članom 8. ovog pravilnika;
2) označavaju kao zaražene biljke domaćini iz kojih je uzet uzorak;
3) određuje obim moguće zaraze i razgraničava zaraženo i ugroženo područje u skladu sa čl. 9. i 10. ovog pravilnika.
Određivanje granica zaraženog, ugroženog i područja bez štetnog organizma u slučaju zaraze površinskih voda
Kada se na osnovu rezultata laboratorijskih ispitivanja, sprovedenih na način opisan u Prilogu, potvrdi prisustvo štetnog organizma u površinskoj vodi (uključujući i tečni otpad koji nastaje u industrijskoj preradi glavnih biljaka domaćina ili u pogonima za njihovo pakovanje) ili u samoniklim biljkama iz familije Solanaceae koje u njoj rastu, a proizvodnja glavnih biljaka domaćina je ugrožena zbog korišćenja te vode za navodnjavanje, prskanje ili zbog poplavljivanja, određuju se granice zaraženog, ugroženog i područja bez štetnog organizma, tako što se:
1) označava kao zaražena površinska voda iz koje je uzet uzorak;
2) određuje obim moguće zaraze i razgraničava posebno regulisano područje na osnovu označene zaraze i moguće širenje štetnog organizma.
Obim mogućeg širenja štetnog organizma u površinskoj vodi iz stava 1. tačka 2) ovog člana određuje se na osnovu podataka o:
1) blizini mesta proizvodnje glavnih biljaka domaćina koja su ugrožena poplavljivanjem ili se graniče sa površinskom vodom koja je označena kao zaražena;
2) svakom zasebnom području navodnjavanja koje je u vezi s površinskom vodom koja je označena kao zaražena;
3) vodenim tokovima povezanim sa površinskom vodom koja je označena kao zaražena, uzimajući u obzir smer i brzinu toka vode označene kao zaražene i prisutnost samoniklih biljaka domaćina iz familije Solanaceae.
2. Mere sprečavanja širenja i suzbijanja štetnog organizma
Mere sprečavanja širenja i suzbijanja štetnog organizma na glavnim biljkama domaćinima koje su označene kao zaražene
Glavne biljke domaćini koje su označene kao zaražene ne smeju se koristiti za sadnju.
Kada su glavne biljke domaćini iz stava 1. ovog člana označene kao zaražene, sprovode se sledeće mere:
1) uništavanje, odnosno spaljivanje, ili
2) odlaganje na službeno odobreno mesto za odlaganje otpada, za koje je utvrđeno da ne postoji opasnost od širenja štetnog organizma, ili
3) upotrebljavanje tih biljaka kao hrane za životinje nakon odgovarajuće toplotne obrade, koja ne ostavlja nikakvu mogućnost preživljavanja štetnog organizma, ili
4) korišćenje tih biljaka za industrijsku preradu, pod uslovom da se direktno dopreme do mesta prerade koje ima opremu za odlaganje otpada, čime je otklonjena opasnost od širenja štetnog organizma i ako je obezbeđeno čišćenje i dezinfekcija prevoznih sredstava koja napuštaju mesto prerade, ili
5) druge mere, pod uslovom da nema opasnosti od širenja štetnog organizma.
Mere sprečavanja širenja i suzbijanja štetnog organizma na glavnim biljkama domaćinima koje se smatraju moguće zaraženim
Glavne biljke domaćini koje se smatraju moguće zaraženim štetnim organizmom, glavne biljke domaćini gajene na mestima proizvodnje koja se smatraju moguće zaraženima, kao i krtole ili biljke krompira koje su klonski povezane sa onima koje su označene kao zaražene bez obzira na rezultate laboratorijskih ispitivanja ne smeju se koristiti za sadnju.
Krtole krompira iz stava 1. ovog člana, mogu se:
1) upotrebiti kao merkantilni krompir namenjen za ishranu, koji se mora pakovati na mestima sa odgovarajućom opremom za odlaganje otpada, i koji je spreman za neposrednu dostavu i upotrebu bez naknadnog prepakivanja. Sa semenskim krompirom dozvoljeno je da se rukuje na tim istim mestima samo ako se radi odvojeno ili nakon čišćenja i dezinfekcije;
2) upotrebiti kao merkantilni krompir namenjen industrijskoj preradi, pod uslovom da se direktno dopreme do mesta prerade koje ima opremu za odlaganje otpada, čime je otklonjena opasnost od širenja štetnog organizma, i ako je obezbeđeno čišćenje i dezinfekcija prevoznih sredstava koja napuštaju mesto prerade;
3) upotrebiti ili odložiti na drugi odobreni način, pod uslovom da nema opasnosti od širenja štetnog organizma.
Ostali delovi glavnih biljaka domaćina, uključujući i ostatke stabljika i lišća, mogu se uništiti ili upotrebiti ili odložiti na drugi odobreni način, pod uslovom da nema opasnosti od širenja štetnog organizma.
Mere postupanja sa otpadom radi sprečavanja širenja i suzbijanja štetnog organizma
Radi sprečavanja širenja štetnog organizma otpadom koji je nastao kao rezultat sprovođenja mera iz čl. 13. i 14. ovog pravilnika i otpada koji nastaje tokom rukovanja, odstranjivanja i prerade zaraženih partija, sprovode se sledeće mere:
1) otpaci krompira i paradajza (uključujući odbačeni krompir, koru i paradajz) i svi drugi čvrsti otpaci koji su u vezi sa krompirom i paradajzom (uključujući zemlju, kamenje i druge ostatke), moraju da se:
- odlažu na službeno odobrenom mestu, na kojem ne postoji opasnost od nekontrolisanog širenja štetnog organizma u okolinu (npr. ispiranjem kroz pore zemlje do poljoprivrednog zemljišta ili doticajem sa vodom koja bi mogla da se upotrebi za navodnjavanje poljoprivrednog zemljišta). Otpaci se prevoze direktno do određenog mesta, u zatvorenom prevoznom sredstvu, tako da ne postoji opasnost od gubitka otpada,
- spaljuju,
- odstrane primenom drugih mera za koje je utvrđeno da ne postoji opasnost od širenja štetnog organizma;
2) tečni otpad nastao u preradi koji sadrži čvrste čestice, pre uklanjanja se filtrira ili obrađuje postupkom sedimentacije radi odstranjivanja čvrstih čestica, koje se nakon toga uklanjaju na način iz tačke 1) ovog stava.
Tečni deo otpada iz stava 1. tačka 2) ovog člana tretira se na sledeći način:
1) pre odstranjivanja zagreva se na temperaturi od najmanje 60° C u trajanju najmanje 30 minuta, ili
2) se odstranjuje na način koji onemogućava da otpaci dođu na bilo koji način u dodir sa poljoprivrednim zemljištem ili vodom koja se može upotrebiti za navodnjavanje poljoprivrednog zemljišta.
Mašine, prevozna sredstva, skladišta i njihovi delovi, drugi objekti i predmeti, uključujući i materijal za pakovanje, koji su označeni kao zaraženi ili se smatraju moguće zaraženim moraju da se očiste i dezinfikuju primenom odgovarajućih postupaka za čišćenje i dezinfekciju kojima se otklanja opasnost od širenja štetnog organizma.
U slučaju kada materijal za pakovanje iz stava 1. ovog člana nije moguće očistiti i dezinfikovati tako da se otkloni opasnost od širenja štetnog organizma nalaže se njegovo uništavanje.
Mere sprečavanja širenja i suzbijanja štetnog organizma na polju
Na polju namenjenom za proizvodnju glavnih biljaka domaćina, koje je označeno kao zaraženo za vreme od najmanje četiri vegetacione godine posle godine u kojoj je utvrđena zaraza nalaže se sprovođenje sledećih mera:
1) uklanjanje samoniklih biljaka krompira i paradajza, kao i drugih samoniklih biljaka domaćina štetnog organizma, uključujući korove iz porodice Solanaceae;
2) zabrana sadnje krtola ili biljaka krompira, kao i setve semena krompira u botaničkom smislu, sadnje biljaka paradajza i setve semena paradajza, sadnje ili setve drugih biljaka domaćina, sadnje ili setve biljnih vrsta iz roda Brassica za koje je utvrđeno da omogućavaju preživljavanje štetnog organizma i sadnje ili setve biljaka za koje je utvrđeno da omogućavaju širenje štetnog organizma.
U prvoj sezoni proizvodnje krompira ili paradajza koja sledi posle perioda iz stava 1. ovog člana, pod uslovom da na polju najmanje dve poslednje vegetacione godine tokom sprovođenja pregleda nisu pronađene samonikle biljke krompira i paradajza, kao i druge biljke domaćini, uključujući korove iz porodice Solanaceae, u slučaju proizvodnje krompira, dopušta se proizvodnja isključivo merkantilnog krompira i sprovodi laboratorijsko ispitivanje krtola prilikom vađenja.
U sezoni proizvodnje krompira ili paradajza koja sledi posle sezone iz stava 2. ovog člana, dozvoliće se, uz odgovarajući plodored, koji mora biti najmanje dvogodišnji za proizvodnju semenskog krompira, proizvodnja semenskog ili merkantilnog krompira, kao i biljaka paradajza, uz sprovođenje pregleda.
U toku pet vegetacionih godina posle godine u kojoj je zaraza utvrđena, sprovode se sledeće mere:
1) uklanjanje samoniklih biljaka krompira i paradajza kao i drugih biljaka domaćina štetnog organizma, uključujući korove iz familije Solanaceae;
2) u prve tri godine, održavanje polja na ugaru ili kao trajni pašnjak sa intenzivnom ispašom ili čestom niskom košnjom ili se seju žitarice ili se koristi za proizvodnju semenskih trava. U sledeće dve uzastopne godine dopuštena je proizvodnja biljaka koje nisu domaćini štetnog organizma i za koje je poznato da ne omogućavaju preživljavanje ili širenje štetnog organizma.
Posle sprovođenja mera iz stava 1. tačka 2) ovog člana, u sledećoj vegetacionoj godini dozvoliće se proizvodnja semenskog ili merkantilnog krompira ili paradajza, uz laboratorijsko ispitivanje izvađenih biljaka i krtola, ako na polju koje je označeno kao zaraženo u toku sprovođenja pregleda nisu pronađene samonikle biljke krompira i paradajza, kao i drugih biljaka domaćina, uključujući korove iz familije Solanaceae, najmanje dve uzastopne vegetacione godine.
Mere sprečavanja širenja i suzbijanja štetnog organizma na poljima unutar mesta proizvodnje koje je označeno kao zaraženo
Na ostalim poljima unutar mesta proizvodnje koje je označeno kao zaraženo u vegetacionoj godini koja sledi posle godine u kojoj je utvrđena zaraza, pod uslovom da je utvrđeno da je otklonjena opasnost od samoniklih biljaka krompira i paradajza, kao i drugih biljaka domaćina štetnog organizma, uključujući korove iz familije Solanaceae, zabranjuje se sadnja krtola i biljaka krompira, setva semena krompira u botaničkom smislu, kao i setva i sadnja drugih biljaka domaćina štetnog organizma.
Ako je pre sadnje utvrđeno da je otklonjena opasnost od samoniklih biljaka domaćina štetnog organizma, može se dozvoliti sadnja sertifikovanog semenskog krompira namenjenog isključivo proizvodnji merkantilnog krompira, odnosno sadnja biljaka paradajza proizvedenih iz semena koje ispunjava uslove u pogledu zdravstvene ispravnosti. Tokom vegetacije mora se sprovoditi nadzor, kao i laboratorijsko ispitivanje, izvađenih biljaka i krtola na prisustvo štetnog organizma na način opisan u Prilogu.
U drugoj i trećoj vegetacionoj godini koja sledi posle godine u kojoj je zaraza utvrđena, posle sprovođenja mera iz st. 1. i 2. ovog člana, dozvoljava se sadnja isključivo sertifikovanog semenskog krompira za semensku ili merkantilnu proizvodnju, odnosno sadnja samo onih biljaka paradajza koje su proizvedene iz semena koje ispunjava uslove u pogledu zdravstvene ispravnosti, ili iz biljaka dobijenih vegetativnim razmnožavanjem biljaka paradajza proizvedenih iz takvog semena i proizvedenih pod stručnim nadzorom na mestima proizvodnje koja nisu označena kao zaražena, za proizvodnju rasada ili plodova.
Pored mera iz st. 1, 2. i 3. ovog člana na ostalim poljima unutar mesta proizvodnje koje je označeno kao zaraženo najmanje tri vegetacione godine sprovodi se uklanjanje samoniklih biljaka glavnog domaćina i drugih biljaka domaćina štetnog organizma i pregled useva tokom proizvodnje, u odgovarajućim vremenskim periodima, svih polja na kojima se gaji krompir kao i laboratorijsko ispitivanje izvađenih biljaka i krtola sa svakog polja.
Mere čišćenja i dezinfekcije na mestima proizvodnje koja su označena kao zaražena
Na mestima proizvodnje koja su označena kao zaražena posle utvrđivanja zaraze štetnim organizmom, proizvođač mora očistiti i dezinfikovati, sve mašine, opremu i skladišne prostore koji su korišćeni za proizvodnju krompira ili paradajza, kako u prvoj godini kada je dozvoljena proizvodnja krompira i paradajza, tako i u svakoj narednoj proizvodnoj godini.
Kada je to potrebno radi sprečavanja širenja štetnog organizma na mestima proizvodnje koja su označena kao zaražena može se zabraniti navodnjavanje i prskanje.
Mere sprečavanja širenja i suzbijanja štetnog organizma u zaštićenom prostoru
U zaštićenom prostoru koje je označeno kao zaraženo, a namenjeno ja za proizvodnju bilja, nije dozvoljena sadnja krtola ili biljaka krompira i setva semena krompira u botaničkom smislu, kao ni setva i sadnja drugih biljaka domaćina štetnog organizma, uključujući i biljke i seme paradajza, sve dok se u tom zaštićenom prostoru, ne sprovedu mere uništavanja štetnog organizma i ne uklone sve biljke domaćini i njihovi delovi, pri čemu se, kao minimalna mera, obvezno sprovodi potpuna zamena supstrata za gajenje, kao i čišćenje i dezinfekcija tog zaštićenog prostora i celokupne opreme.
Posle sprovođenja mera iz stava 1. ovog člana može se odobriti proizvodnja krompira i paradajza, i to:
1) proizvodnja krompira iz sertifikovanog semenskog krompira proizvedenog pod stručnim nadzorom ili mini-krtola ili mikro-biljaka dobijenih iz kulture biljnog tkiva koje potiču iz testiranih izvora;
2) proizvodnja paradajza iz semena koje ispunjava uslove u pogledu zdravstvene ispravnosti ili iz biljaka dobijenih vegetativnim razmnožavanjem biljaka paradajza proizvedenih iz takvog semena pod stručnim nadzorom.
Kada je to potrebno radi sprečavanja širenja štetnog organizma na mestima proizvodnje koja su označena kao zaražena može se zabraniti navodnjavanje i prskanje.
IV USLOVI ZA OKONČANJE NALOŽENIH MERA
Radi praćenja zdravstvenog stanja glavnih biljaka domaćina, biljnih proizvoda i propisanih objekata u posebno regulisanom području i obezbeđivanja uslova za prestanak naloženih mera u toku najmanje tri vegetacione godine koje slede posle one u kojoj je zaraza utvrđena:
1) vrši se nadzor mesta na kojima se proizvode, skladište, nalaze ili dorađuju krtole krompira ili biljke paradajza, uključujući i parcele (površine) sa kojih potiču i na kojima su se koristili isti uređaji;
2) vrši se sadnja unutar zaraženog i ugroženog područja isključivo sertifikovanog semenskog krompira i obavezno ispitivanje posle vađenja semenskog krompira koji je proizveden na moguće zaraženim mestima proizvodnje;
3) na svim proizvodnim površinama unutar zaraženog i ugroženog područja sa proizvedenim semenskim krompirom postupa se odvojeno od merkantilnog krompira ili se vrši čišćenje i dezinfekcija između postupanja sa semenskim i merkantilnim krompirom;
4) vrši se sadnja samo onih biljaka paradajza proizvedenih iz semena koje ispunjava uslove u pogledu zdravstvene ispravnosti ili iz biljaka dobijenih vegetativnim razmnožavanjem biljaka paradajza proizvedenih iz takvog semena i gajenih pod stručnim nadzorom, u svim usevima paradajza unutar zaraženog i ugroženog područja;
5) obavljaju se pregledi iz čl. 2. i 3. ovog pravilnika.
Radi praćenja površinskih voda koje su bile označene kao zaražene u zaraženom i ugroženom području i obezbeđivanja uslova za prestanak naloženih mera u toku najmanje tri vegetacione godine koje slede posle godine u kojoj je zaraza utvrđena:
1) obavljaju se pregledi u odgovarajućem vremenskom periodu i uzimaju uzorci površinske vode, a kada je to potrebno, uzorci biljaka domaćina štetnog organizma iz familije Solanaceae iz te vode, radi laboratorijskog ispitivanja;
2) vrši se nadzor pri sprovođenju navodnjavanja i prskanja glavnih biljaka domaćina.
Ako je na osnovu rezultata laboratorijskog ispitivanja uzoraka utvrđeno da voda koja je bila označena kao zaražena više nije zaražena može se dozvoliti njena upotreba za navodnjavanje i prskanje.
V NAČIN OBAVEŠTAVANJA O PREDUZETIM MERAMA I PRESTANAK MERA
Podaci i informacije o potvrđenoj zarazi, kao i podaci i informacije o prestanku mera, dostavljaju se drugim državama i međunarodnim organizacijama, u skladu sa međunarodnim konvencijama i sporazumima obavezujućim za Republiku Srbiju.
Ministarstvo će dostaviti službenom telu nadležnom za zaštitu bilja države u kojoj postoji opasnost od širenja zaraze sledeće podatke:
1) naziv sorte krompira ili paradajza i partije;
2) namenu (merkantilni ili semenski), i kada je moguće, kategoriju semenskog krompira;
3) naziv i adresu pošiljaoca i primaoca;
4) datum dospeća partije krompira ili paradajza;
5) veličinu isporučene partije krompira ili paradajza;
6) kopiju fitocertifikata.
Ovaj pravilnik stupa na snagu osmog dana od dana objavljivanja u "Službenom glasniku Republike Srbije".
ŠEMA TESTIRANJA ZA DIJAGNOSTIKU, DETEKCIJU I IDENTIFIKACIJU PROUZROKOVAČA MRKE TRULEŽI KRTOLA KROMPIRA I BAKTERIJSKOG UVENUĆA KROMPIRA I PARADAJZA
OBLAST PRIMENE ŠEME TESTIRANJA
Prikazana šema testiranja opisuje različite postupke uključene u:
1) dijagnozu prouzrokovača mrke truleži krompira i bakterijskog uvenuća krompira, paradajza i drugih biljaka domaćina;
2) detekciju Ralstonia solanacearum u uzorcima krtola krompira, biljaka krompira, paradajza i drugih biljaka domaćina, u vodi i u zemljištu;
3) identifikaciju Ralstonia solanacearum (R. solanacearum).
OPŠTA NAČELA
U poglavljima IX-XVI ovog priloga se nalaze standardni protokoli za pojedine metode, potvrđeni i odobreni reagensi i pojedinosti vezane za pripremu materijala za testiranje i referentnog materijala. U Poglavlju IX ovog priloga se nalazi spisak laboratorija uključenih u proces optimizacije i validacije protokola.
S obzirom da protokoli uključuju metode detekcije karantinskog organizma, što podrazumeva i upotrebu živih referentnih kultura R. solanacearum, procedura se mora izvoditi u propisanim karantinskim uslovima sa odgovarajućim objektima za odlaganje, čuvanje i uništavanje otpada u skladu sa uslovima koje propisuje institucija odgovorna za karantinske propise.
Parametri testiranja moraju obezbediti ujednačene i ponovljive nivoe detekcije R. solanacearum prema propisanim pragovima osetljivosti pojedinih metoda.
Obavezna je precizna priprema pozitivnih kontrola.
Testiranje u skladu sa zahtevanim pragom osetljivosti podrazumeva pravilno postavljanje, održavanje i kalibriranje opreme, pažljivo rukovanje i čuvanje reagenasa kao i preduzimanje mera za sprečavanje kontaminacije između uzoraka, npr. razdvajanje pozitivnih kontrola od uzoraka za testiranje. Kako bi se izbegle administrativne ili druge greške, moraju se primenjivati standardi kontrole kvaliteta, posebno pri označavanju uzoraka i vođenju dokumentacije.
Sumnja na prisustvo patogena u uzorku podrazumeva pozitivan rezultat testa provere uzorka, kao što je prikazano u dijagramima toka.
Pozitivan rezultat dobijen u prvom izvršenom testu provere (IF test, PCR/FISH, selektivna izolacija) se mora potvrditi i drugim testom provere koji se bazira na drugom biološkom načelu.
Ako je rezultat prvog testa provere (IF ili PCR/FISH) pozitivan, tada se sumnja na prisustvo R. solanacearum i potrebno je primeniti i drugi test provere. Ako je rezultat i drugog testa pozitivan, tada je sumnja potvrđena i testiranje se nastavlja prema opisanoj šemi. Ako je rezultat drugog testa negativan, tada se smatra da R. solanacearum nije prisutna u uzorku. Pozitivan rezultat IF testa se definiše kao pozitivno očitavanje IF testa potvrđeno i drugim testom provere (PCR/FISH).
Potvrđeno prisustvo patogena podrazumeva izolaciju i identifikaciju čiste kulture R. solanacearum i potvrdu patogenosti.
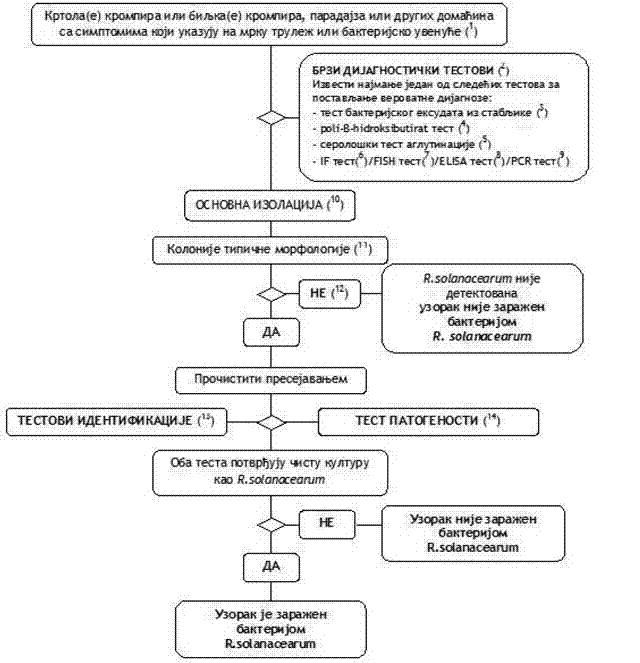
1.1. Šema utvrđivanja prisustva prouzrokovača mrke truleži krtola i bakterijskog uvenuća (Ralstonia solanacearum) u krtolama i biljkama krompira, paradajza ili drugim biljkama domaćinima sa simptomima mrke truleži ili bakterijskog uvenuća (Šema 1)
Postupak testiranja se primenjuje za krtole i biljke krompira, paradajza ili druge biljke domaćine sa tipičnim simptomima ili simptomima koji upućuju na prisustvo prouzrokovača mrke truleži. Postupak uključuje test provere, izolaciju patogena iz zaraženog sprovodnog tkiva na hranjivu podlogu i u slučaju pozitivnog rezultata identifikaciju čiste kulture R. solanacearum.

Šema 1.
(1) Opis simptoma naveden je u Poglavlju IV. ovog priloga.
(2) Brzi dijagnostički testovi olakšavaju postavljanje dijagnoze, ali nisu neophodni. Negativan rezultat ne garantuje uvek odsutnost patogena.
(3) Testiranje prisustva patogena u bakterijskom eksudatu iz sprovodnog tkiva stabljike opisan je u Poglavlju VIII. tačka 1. podtačka 1.1. ovog priloga.
(4) Test za otkrivanje granula poli-β-hidroksibutirata u bakterijskim ćelijama opisan je u Poglavlju VIII. tačka 1. podtačka 1.2. ovog priloga.
(5) Serološki testovi aglutinacije na bakterijskom eksudatu ili ekstraktu iz tkiva sa simptomima opisani su u Poglavlju VIII. tačka 1. podtačka 1.3. ovog priloga.
(6) IF test na suspenziji bakterijskog eksudata u vodi ili na ekstraktu iz tkiva sa simptomima opisan je u Poglavlju VIII. tačka 1. podtačka 1.5. ovog priloga.
(7) FISH test na suspenziji bakterijskog eksudata u vodi ili na ekstraktu iz tkiva sa simptomima opisan je u Poglavlju VIII. tačka 1. podtačka 1.7. ovog priloga.
(8) ELISA test na suspenziji bakterijskog eksudata u vodi ili na ekstraktu iz tkiva sa simptomima opisan je u Poglavlju VIII. tačka 1. podtačka 1.8. ovog priloga.
(9) PCR test na suspenziji bakterijskog eksudata u vodi ili na ekstraktu iz tkiva sa simptomima opisan je u Poglavlju VIII. tačka 1. podtačka 1.6. ovog priloga.
(10) Patogen se obično može lako izolovati iz biljnog materijala sa simptomima metodom razređenja i izolacije na hranljivu podlogu (Poglavlje IV. tačka 1. podtačka 1.3. ovog priloga).
(11) Opis tipične morfologije kolonije naveden je u Poglavlju IV. tačka 1. podtačka 1.3. ovog priloga.
(12) Gajenje bakterijske kulture može biti neuspešno u poodmaklom stadijumu infekcije zbog kompeticije ili preteranog razmnožavanja saprofitnih bakterija. Ako su simptomi bolesti tipični, a test izolacije negativan, test izolacije se mora ponoviti, najbolje na selektivnoj hranljivoj podlozi.
(13) Pouzdana identifikacija čistih kultura izolata bakterije R. solanacearum postiže se izvođenjem testova opisanih u Poglavlju VIII. tačka 2. ovog priloga.
(14) Test patogenosti opisan je u Poglavlju VIII. tačka 3. ovog priloga.
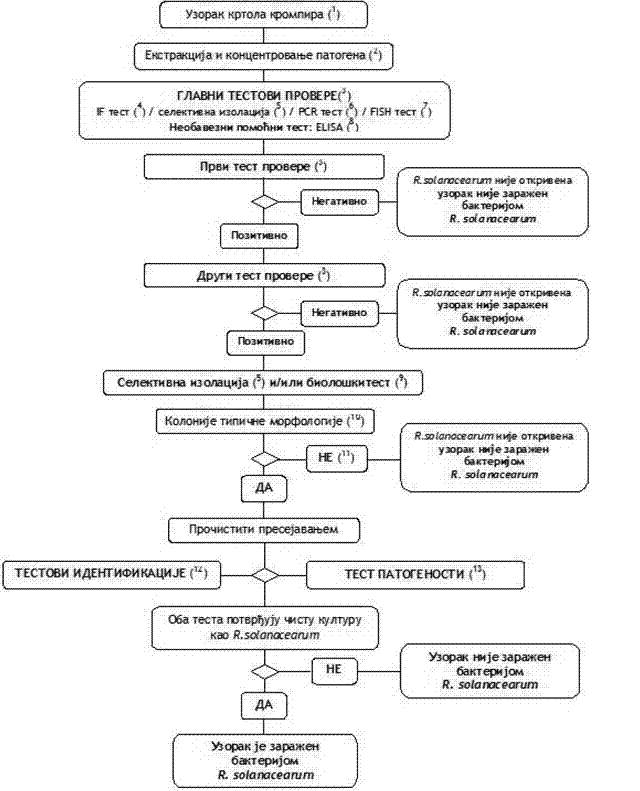
1.2. Šema za utvrđivanje prisustva i identifikaciju R. solanacearum u uzorcima krtola krompira bez vidljivih simptoma (Šema 2)
Načelo:
Postupak testiranja namenjen je za otkrivanje prisustva skrivene zaraze u krtolama krompira.
Pozitivan rezultat najmanje dva testa provere, koji se baziraju na različitim biološkim načelima, dopunjuje se izolacijom patogena, posle čega, u slučaju izolacije tipičnih kolonija, sledi potvrda čiste kulture R. solanacearum.
Pozitivan rezultat samo jednog od testova provere nije dovoljan da bi se uzorak smatrao verovatno zaraženim.
Testovi provere i izolacija moraju omogućiti nivo osetljivosti detekcije 103 do 104 ćelije/ml resuspendovanog taloga, uključenog kao pozitivna kontrola u svakoj seriji testova.
Šema 2.
(1) Standardna veličina uzorka je 200 krtola; ako na raspolaganju nema 200 krtola, postupak se može sprovesti i na manjim uzorcima.
(2) Metode ekstrakcije i koncentrovanja patogena opisane su u Poglavlju V tačka 1. ovog priloga.
(3) Ako su rezultati najmanje dva testa, koji se temelje na različitim biološkim načelima, pozitivni, potrebno je izvršiti izolaciju i potvrditi prisustvo patogena. Izvršiti bar jedan test provere. Kada je rezultat testa negativan, smatra se da je uzorak negativan. U slučaju da je rezultat tog testa pozitivan, potrebno je izvršiti drugi ili više testova provere, koji se temelje na različitim biološkim načelima, kako bi se potvrdio pozitivan rezultat. Ako su rezultati ostalih testova negativni, smatra se da je taj uzorak negativan. Dalje testiranje nije potrebno.
(4) Test imunofluorescencije (IF) je opisan u Poglavlju VIII. tačka 1. podtačka 1.5. ovog priloga.
(5) Selektivna izolacija je opisana u Poglavlju VIII. tačka 1. podtačka 1.4. ovog priloga.
(6) PCR test je opisan u Poglavlju VIII. tačka 1. podtačka 1.6. ovog priloga.
(7) FISH test je opisan u Poglavlju VIII. tačka 1. podtačka 1.7. ovog priloga.
(8) ELISA testovi su opisani u Poglavlju VIII. tačka 1. podtačka 1.8. ovog priloga.
(9) Biološki test je opisan u Poglavlju VIII. tačka 1. podtačka 1.9. ovog priloga.
(10) Tipična morfologija kolonije opisana je u Poglavlju IV. tačka 1. podtačka 1.3. ovog priloga.
(11) Gajenje bakterijske kulture ili biološki test mogu biti neuspešni zbog kompeticije ili inhibicije saprofitnim bakterijama. Ako se u testovima provere dobiju jasno pozitivni rezultati, a rezultati izolacije su negativni, ponoviti testove izolacije iz istog resuspendovanog taloga ili ponoviti uzimanje sprovodnog tkiva na mestu vezivanja stolona kod krtola iz istog uzorka i, ako je potrebno, testirati dodatne uzorke.
(12) Pouzdana identifikacija čistih kultura R. solanacearum postiže se izvođenjem testova opisanih u Poglavlju VIII. tačka 2. ovog priloga.
(13) Test patogenosti opisan je u Poglavlju VIII. tačka 3. ovog priloga.
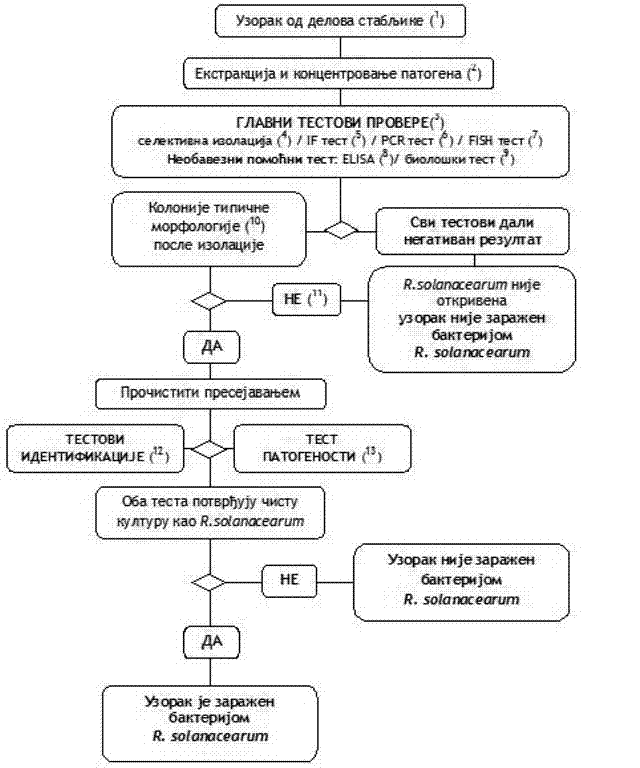
1.3. Šema za utvrđivanje prisustva i identifikaciju R. solanacearum u uzorcima biljaka krompira, paradajza ili drugih biljaka domaćina bez simptoma (Šema 3)
Šema 3.
(1) Za preporučene veličine uzoraka videti Poglavlje V. tačka 2. podtačka 2.1. ovog priloga.
(2) Ekstrakcija patogena i metode koncentrovanja opisane su u Poglavlju V. tačka 2. podtačka 2.1. ovog priloga.
(3) Ako su rezultati najmanje dva testa, koji se temelje na različitim biološkim načelima, pozitivni, potrebno je izvršiti izolaciju i potvrdu prisustva patogena. Izvršiti bar jedan test provere. Kada je rezultat testa negativan, smatra se da je uzorak negativan. U slučaju da je rezultat tog testa pozitivan, potrebno je izvršiti drugi ili više testova provere, koji se temelje na različitim biološkim načelima, kako bi se potvrdio pozitivan rezultat.
Ako su rezultati ostalih testova negativni, smatra se da je taj uzorak negativan. Dalje testiranje nije potrebno.
(4) Selektivna izolacija opisana je Poglavlju VIII. tačka 1. podtačka 1.4. ovog priloga.
(5) IF test opisan je u Poglavlju VIII. tačka 1. podtačka 1.5. ovog priloga.
(6) PCR testovi opisani su u Poglavlju VIII. tačka 1. podtačka 1.6. ovog priloga.
(7) FISH test opisan je u Poglavlju VIII. tačka 1. podtačka 1.7. ovog priloga.
(8) ELISA test opisan je u Poglavlju VIII. tačka 1. podtačka 1.8. ovog priloga.
(9) Biološki test opisan je u Poglavlju VIII. tačka 1. podtačka 1.9. ovog priloga.
(10) Tipična morfologija kolonije opisana je u Poglavlju IV. tačka 1. podtačka 1.3. ovog priloga.
(11) Gajenje bakterijske kulture ili biološki test mogu biti neuspešni zbog kompeticije ili inhibicije saprofitnim bakterijama. Ako se u testovima provere dobiju jasno pozitivni rezultati, a rezultati izolacije su negativni, ponoviti testove izolacije iz istog resuspendovanog taloga ili ponoviti uzimanje sprovedenog tkiva na mestu vezivanja stolona kod krtola iz istog uzorka i, ako je potrebno, testirati dodatne uzorke.
(12) Pouzdana identifikacija čistih kultura R. solanacearum postiže se izvođenjem testova opisanih u Poglavlju VIII. tačka 2. ovog priloga.
(13) Test patogenosti opisan je u Poglavlju VIII. tačka 3. ovog priloga.
DETEKCIJA BAKTERIJE R. SOLANACEARUM U KRTOLAMA I BILJKAMA KROMPIRA, PARADAJZA I DRUGIM BILJKAMA DOMAĆINIMA
1. Detaljne metode za detekciju R. solanacearum u krtolama i biljkama krompira, paradajza ili drugim biljkama domaćinima sa simptomima mrke truleži i bakterijskog uvenuća
1.1. Simptomi (videti web stranicu http://forum.europa.eu.int/Public/irc/sanco/Home/main)
1.1.1. Simptomi na krompiru
Biljka krompira. Početna faza infekcije u polju prepoznaje se po uvenuću lišća pri vrhu biljke na visokim temperaturama tokom dana, ali koje se oporavljaju tokom noći. U ranim fazama uvenuća lišće ostaje zeleno ali kasnije počinje da žuti i razvija se smeđa nekroza. Takođe, dolazi i do pojave epinastije. Ubrzo dolazi do nepovratnog uvenuća izdanka ili cele biljke što rezultira propadanjem i odumiranjem biljke. Poprečni presek sprovodnog tkiva uvenule stabljike obično je smeđe boje, a iz presečenog mesta se lako može iscediti mlečni bakterijski eksudat. Kad se presečeno mesto stabljike stavi uspravno u vodu, iz sprovodnih sudova ističe bakterijski eksudat.
Krtola krompira. Krtole krompira treba prerezati poprečno ili uzdužno u blizini pupka krtola. Početna faza infekcije prepoznaje se po promeni boje sprovodnog prstena od staklasto-žute do svetlosmeđe iz kojeg se spontano, nakon nekoliko minuta, pojavljuje bledi kremasti bakterijski eksudat. Kasnije, sprovodno tkivo postaje izrazito smeđe i nekroza se može proširiti na parenhimsko tkivo. U uznapredovalim fazama infekcije bakterijski eksudat može cureti i iz pupčanog dela i iz okaca i na nju se lepe čestice zemlje. Na pokožici krtole mogu se pojaviti crvenkasto-smeđa ulegnuća zbog propadanja sprovodnog tkiva iznutra. U uznapredovalim fazama bolesti uobičajen je i sekundarni razvoj meke truleži koju prouzrokuju gljive i bakterije.
1.1.2. Simptomi na paradajzu
Biljka paradajza. Prvi vidljivi simptom je uvelost najmlađih listova. U uslovima koji su povoljni za patogena (temperatura zemljišta oko 25°C; zasićenost vlagom) u roku od nekoliko dana dolazi do epinastije i uvenuća samo jedne strane ili cele biljke što dovodi do potpunog propadanja biljke. U manje povoljnim uslovima (temperatura zemljišta manja od 21°C) uvenuće se ređe pojavljuje, ali se na stabljici može razviti veliki broj adventivnog korenja. Moguće je uočiti pruge koje izgledaju kao natopljene vodom i protežu se duž stabljike, od njene baze, a dokaz su nekrotiranja sprovodnog tkiva. Ako se stabljika preseče unakrsno, iz sprovodnog tkiva čija je boja promenjena u smeđu, curi beli ili žućkasti bakterijski eksudat.
1.1.3. Simptomi na drugim biljkama domaćinima
Biljke Solanum dulcamara i S. nigrum. Kod ovih biljaka domaćina se, u prirodnim uslovima retko uočavaju simptomi uvenuća, osim ako temperatura zemljišta prelazi 25°C ili ako je nivo inokuluma izuzetno visok (npr. S. nigrum koji raste blizu obolele biljke krompira ili paradajza). Ako dođe do uvenuća, simptomi su isti kao i kod paradajza. Biljke S. dulcamara rastu sa stabljikama i korenjem u vodi i na njima nije vidljivo uvenuće, ali je na poprečnom preseku osnove stabljike ili delovima stabljike koji su pod vodom vidljiva svetlosmeđa obojenost sprovodnog tkiva. Ukoliko presečenu stabljiku uspravno stavimo u vodu, iz sprovodnog tkiva na mestu preseka može curiti bakterijski eksudat, čak i ako nema simptoma uvenuća.
Brzi testovi provere olakšavaju, ali nisu presudni u postavljanju početne dijagnoze. Primeniti jedan ili više sledećih odobrenih testova:
1.2.1. Test bakterijskog eksudata iz stabljike (Poglavlje VIII. tačka 1. podtačka 1.1. ovog priloga).
1.2.2. Detekcija granula poli-β-hidroksibutirata (PHB):
Karakteristične granule PHB-a u ćelijama R. solanacearum postaju vidljive pri bojenju termički fiksiranim razmazom bakterijskog eksudata iz zaraženog tkiva na mikroskopskoj pločici Nilskom plavom bojom A i Sudanskom crnom bojom B (Poglavlje VIII. tačka 1. podtačka 1.2. ovog priloga).
1.2.3. Serološki testovi aglutinacije (Poglavlju VIII. tačka 1. podtačka 1.3. ovog priloga).
1.2.4. Ostali testovi. U ostale odgovarajuće brze testove provere spadaju IF test, FISH test, ELISA testovi i PCR testovi.
U manjoj količini sterilne destilovane vode ili 50 mM fosfatnog pufera napraviti suspenziju bakterijskog eksudata ili delova tkiva promenjene boje iz sprovodnog prstena krtola krompira ili iz sprovodnih sudova stabljika krompira, paradajza ili drugih biljaka domaćina sa simptomima uvenuća i ostaviti 5 do 10 minuta.
Pripremiti niz decimalnih razređenja suspenzije.
Preneti 50-100 μl suspenzije i razređenja na opštu hranjivu podlogu (NA, YPGA ili SPA; i/ili na Kelmanovu tetrazolium-podlogu i/ili na odobrenu selektivnu podlogu (npr. SMSA; videti Poglavlje X. ovog priloga). Suspenziju i/ili razređenje razmazati po podlozi primenjujući odgovarajuću tehniku nanošenja razređenja na podlogu. Ukoliko je potrebno, nanošenjem razređenja suspenzije kolonija na odvojenim podlogama pripremiti pozitivnu kontrolu R. solanacearum biovar 2.
Inkubirati podloge od dva do šest dana na 28°C.
Na opštoj hranjivoj podlozi virulentni izolati bakterije R. solanacearum stvaraju pljosnate, nepravilne i tečne kolonije biserne kremasto-bele boje, često sa karakterističnim spiralama u sredini. Nevirulentni oblici bakterije R. solanacearum stvaraju male, okrugle, ne-fluidne kolonije, puteraste konzistencije i kremasto-bele boje.
Na Kelmanovoj tetrazolium-podlozi i na SMSA podlozi spirale su krvavo crvene boje. Nevirulentni oblici bakterije R. solanacearum stvaraju male, okrugle, ne-fluidne kolonije, puteraste konzistencije koje su cele i tamno crvene boje.
1.4. Testovi za identifikaciju bakterija R. Solanacearum
Testovi za potvrdu identiteta izolata za koje se smatra da su izolati R. solanacearum navedeni su Poglavlju VIII. tačka 2. ovog priloga.
METODE ZA DETEKCIJU I IDENTIFIKACIJU BAKTERIJE R. SOLANACEARUM U UZORCIMA KRTOLA KROMPIRA BEZ SIMPTOMA
1. Detaljne metode za detekciju i identifikaciju bakterije R. solanacearum u uzorcima krtola krompira bez simptoma
Standardna veličina uzorka je 200 krtola po testu.
Intenzivnije uzorkovanje zahteva izvođenje većeg broja testova na uzorcima te veličine. Veći broj krtola u uzorku dovešće do inhibicije ili će otežati tumačenje rezultata. Međutim, postupak se može primeniti i za uzorke sa manje od 200 krtola, kada je na raspolaganju manje krtola.
Validacija svih metoda za utvrđivanje prisustva patogena, koje su opisane u daljem tekstu, bazira se na testiranju uzoraka od 200 krtola.
Ekstrakt krompira koji je opisan u daljem tekstu može se koristiti i za utvrđivanje prisustva prouzrokovača prstenaste truleži krompira, bakterije Clavibacter michiganensis subsp. sepedonicus.
Procedura koja prethodi pripremi uzorka (opciona):
Inkubirati uzorak na na 25-30°C u periodu do dve nedelje pre izvođenja testova, kako bi se izazvalo umnožavanje populacija bakterija R. solanacearum.
Oprati krtole. Upotrebiti odgovarajuća dezinfekciona sredstva (pri korišćenju PCR testa upotrebiti jedinjenja hlora radi uklanjanja eventualno prisutne DNK patogena) i deterdžente između svakog uzorka. Osušiti krtole na vazduhu. Postupak pranja je posebno koristan (ali ne obavezan) za slučajeve obrade uzoraka sa većom količinom zemlje, pri izvođenju PCR testa ili procedure direktne izolacije.
Čistim i dezinfikovanim skalpelom ili nožem za povrće ukloniti pokožicu sa pupčanog dela krtole tako da se vide sprovodni sudovi. Pažljivo izrezati mali konusni deo sprovodnog tkiva na pupčanom delu zahvatajući što manje okolnog, nesprovodnog tkiva (videti web stranicu: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
Sve krtole sa potencijalno sumnjivim simptomima mrke truleži odvojiti posebno i testirati.
Ako se prilikom vađenja konusa iz pupčanog dela uoče potencijalni simptomi mrke truleži, krtole treba vizuelno pregledati. Svaku presečenu krtolu sa ovakvim simptomima treba ostaviti dva dana na sobnoj temperaturi, a potom čuvati u karantinskim uslovima (na 4 do 10°C) do sprovođenja testiranja. Sve krtole u uzorku (uključujući i one sa sumnjivim simptomima) treba čuvati u skladu s odgovarajućim odredbama Pravilnika.
Izvađene konuse iz pupčanog dela krtole koji sadrže delove sprovodnog tkiva staviti u sterilne posude koje se mogu zapečatiti i/ili hermetički zatvoriti (ako su posude već upotrebljavane, moraju se temeljito očistiti i dezinfikovati upotrebom sredstava na bazi jedinjenja hlora). Uzorke je poželjno odmah obraditi. Ako to nije moguće, čuvati ih u posudi bez dodatka pufera, najduže 72 sata u frižideru ili najduže 24 sata na sobnoj temperaturi. Tokom čuvanja dolazi do sušenja i suberizacije sržnog dela konusa, kao i do rasta i razvoja saprofita, što može ometati utvrđivanje prisustva bakterije prouzrokovača prstenaste truleži.
Izvađene konuse iz pupčanog dela krtole obraditi korišćenjem jednog od sledećih postupaka:
- izvađene konuse prekriti dovoljnom količinom (oko 40 ml) ekstrakcionog pufera i ultracentrifugirati na 50 do 100 obrtaja/min, četiri sata na temperaturi ispod 24°C ili 16 do 24 sata uz hlađenje,
ili
- izvađene konuse homogenizovati sa dovoljnom količinom (oko 40 ml) ekstrakcionog pufera bilo u mešalici (npr. Waring ili Ultra Thurax) bilo drobljenjem u zatvorenoj kesi za maceraciju za jednokratnu upotrebu (npr. kese Stomacher ili Bioreba od čvrstog politena, 150 mm x 250 mm, sterilizovane zračenjem) koristeći gumeni čekić ili odgovarajući aparat za maceriranje (npr. Homex).
Ako se uzorci homogenizuju u blenderu, postoji velika opasnost od njihove unakrsne kontaminacije. Preduzeti mere opreza u cilju sprečavanja nastajanja aerosola ili prosipanja tokom ekstrakcije. Za svaki uzorak upotrebiti sterilizovane nožiće i posude. Tokom procedure PCR-a, sprečiti prenos DNK na kontejnere ili aparaturu za maceriranje. Za PCR test preporučuje se maceriranje uzoraka u kesicama za jednokratnu upotrebu i dalje korišćenje epruveta i tuba za jednokratnu upotrebu.
Odliti supernatant. Ako je previše mutan, razbistriti ga ultracentrifugiranjem na manjem broju obrtaja (najviše 180 g/ 10 minuta na temperaturi od 4 do 10°C) ili vakuumskom filtracijom (40 do 100 μm) tokom koje se filter dodatno ispira ekstrakcionim puferom (oko 10 ml).
Izvršiti koncentrisanje frakcije bakterije centrifugiranjem na 7000 g 15 minuta (ili 10000 g 10 minuta) na temperaturi od 4 do 10°C, posle čega se pažljivo, bez mešanja sa talogom odliva supernatant.
Resuspendovati talog u 1,5 ml pelet pufera (pufera za rastvaranje taloga). Od ove količine koristiti 500 μl za testiranje na prisustvo Ralstonia solanacearum, 500 μl za testiranje na prisustvo C. m. subsp. sepedonicus i 500 μl kao referentni materijal za čuvanje. U poslednji, referentni deo od 500 μl dodati sterilni glicerol u konačnoj koncentraciji od 10 do 25% (v/v), promešati i čuvati na temperaturi od -16 do -24°C (nedeljama) ili na -68 do -86°C (mesecima). Delove odvojene za utvrđivanje prisustva bakterija, tokom testiranja čuvati na temperaturi od 4 do 10°C. Ne preporučuje se višestruko zamrzavanje i odmrzavanje. U slučaju potrebe za transportom uzoraka, isti dostaviti u prenosivom frižideru u roku od 24 do 48 sati.
Važno je da se sve pozitivne kontrole Ralstonia solanacearum i uzorci drže odvojeno da bi se izbegla kontaminacija. Ovo se odnosi i na IF pločice i druge testove.
Videti dijagram i opis testova i optimizovane protokole u odgovarajućim dodacima:
Selektivna izolacija (Poglavlje VIII. tačka 1. podtačka 1.4. ovog priloga).
IF test (Poglavlje VIII. tačka 1. podtačka 1.5. ovog priloga).
PCR testovi (Poglavlje VIII. tačka 1. podtačka 1.6. ovog priloga).
FISH test (Poglavlje VIII. tačka 1. podtačka 1.7. ovog priloga).
ELISA testovi (Poglavlje VIII. tačka 1. podtačka 1.8. ovog priloga).
Biološki test (Poglavlje VIII. tačka 1. podtačka 1.9. ovog priloga).
2. Metode za detekciju i identifikaciju bakterije R. solanacearum u uzorcima biljaka krompira, paradajza ili drugih biljaka domaćina bez simptoma
Za otkrivanje latentnih populacija R. solanacearum preporučuje se testiranje zbirnih uzoraka. Postupak se može pogodno primeniti na zbirne uzorke sa najviše 200 delova stabljike (uzimanje uzoraka tokom sprovođenja nadzora se mora bazirati na statistički reprezentativnom uzorku ispitivane biljne populacije).
Čistim dezinfikovanim nožem ili makazama za rezidbu odrezati 1 do 2 cm donjeg dela svake stabljike, odmah iznad površine zemljišta. Delove stabljike dezinfikovati kratkim potapanjem u 70% etanol i odmah osušiti upijajućim papirom.
Staviti delove stabljike u zatvorenu sterilnu posudu.
Rasad paradajza iz rasadnika: čistim dezinfikovanim nožem odseći deo veličine 1 cm od donjeg dela stabljike, neposredno iznad površine zemlje.
Biljke paradajza iz polja ili staklenika čistim, dezinfikovanim nožem odseći najniži bočni izdanak na svakoj biljci i to neposredno iznad spoja sa stabljikom. Sa svakog bočnog izdanka odseći donji deo veličine 1 cm.
Sa ostalih biljaka domaćina čistim, dezinfikovanim nožem ili baštenskim makazama odseći deo veličine 1 cm sa donjeg dela stabljike, neposredno iznad nivoa zemlje. Ako se uzorkuje S. dulcamara ili druge biljke domaćini koje rastu u vodi, odsecite deo veličine 1-2 cm sa podvodnog dela stabljike ili stolona sa vodenim korenjem.
Pri uzorkovanju na određenoj lokaciji, preporučuje se testiranje statistički reprezentativnog uzorka od najmanje deset biljaka po mestu uzorkovanja za svaku vrstu samoniklog bilja koja je potencijalni domaćin. Detekcija patogena najpouzdanija je krajem proleća i tokom leta i jeseni, iako se prirodne infekcije mogu otkriti tokom cele godine kod višegodišnje biljke Solanum dulcamara koja raste u vodotokovima. Poznati domaćini su samonikle biljke krompira (krtole ostale u zemljištu), Solanum dulcamara, S. nigrum, Datura stramonium i drugi vrste porodice Solanaceae. Ostale biljke domaćini su Pelargonium spp. i Portulaca oleracea. Evropske vrste samoniklog bilja koje u specifičnim uslovima sredine mogu biti potencijalni domaćini populacija R. solanacearum biovar 2 / rasa 3 u korenju i/ili rizosferi su Atriplex hastata, Bidens pilosa, Cerastium glomeratum, Chenopodium album, Eupatorium cannabinum, Galinsoga parviflora, Ranunculus scleratus, Rorippa spp, Rumex spp., Silene alba, S. nutans., Tussilago farfarra i Urtica dioica.
U ovoj se fazi može obaviti vizuelni pregled biljaka (obojenost sprovodnog sistema ili pojava bakterijskog eksudata). Odvojiti sve delove stabljika sa simptomima i testirati ih posebno.
Kratko dezinfikujte delove stabljika 70%-tnim etanolom i odmah osušite upijajućim papirom. Delove stabljika zatim obradite jednim od sledećih postupaka:
- delove stabljike prekriti dovoljnom količinom (približno 40 ml) ekstrakcionog pufera i ultracentrifugirati na 50 do 100 obrtaja/min četiri sata na temperaturi ispod 24°C ili 16 do 24 sata uz hlađenje,
ili
- delove stabljike izmacerirati u čvrstoj kesi za maceraciju (npr. Stomacher ili Bioreba) sa odgovarajućom količinom ekstrakcionog pufera koristeći gumeni čekić ili odgovarajuću opremu za maceriranje (npr. Homex). Ako to nije moguće, delove stabljike čuvati u frižideru najduže 72 sata ili na sobnoj temperaturi najduže 24 sata.
Posle 15 minuta taloženja, odliti supernatant.
Dalje izbistravanje ekstrakta ili koncentrovanje frakcije bakterija obično nije potrebno, ali se može postići filtriranjem i/ili centrifugiranjem kako je opisano u tački 1. ovog poglavlja.
Podeliti čisti ili koncentrovani ekstrakt uzorka na dva jednaka dela. Jednu polovinu čuvati na temperaturi od 4 do 10°C tokom testiranja, a drugu polovinu ostaviti za slučaj upotrebe u dodatnim testiranjima: u ekstrakt se dodaje 10-25% (v/v) sterilnog glicerola i čuva na temperaturi od -16 do -24°C (nedeljama) ili na -68 do -86°C (mesecima).
Videti dijagram i opis testova i optimizovane protokole u odgovarajućim dodacima:
Selektivna izolacija (Poglavlje VIII. tačka 1. podtačka 1.4. ovog priloga).
IF test (Poglavlje VIII. tačka 1. podtačka 1.5. ovog priloga).
PCR testovi (Poglavlje VIII. tačka 1. podtačka 1.6. ovog priloga).
FISH test (Poglavlje VIII. tačka 1. podtačka 1.7. ovog priloga).
ELISA testovi (Poglavlje VIII. tačka 1. podtačka 1.8. ovog priloga).
Biološki test (Poglavlje VIII. tačka 1. podtačka 1.9. ovog priloga).
DETEKCIJA I IDENTIFIKACIJA U VODI
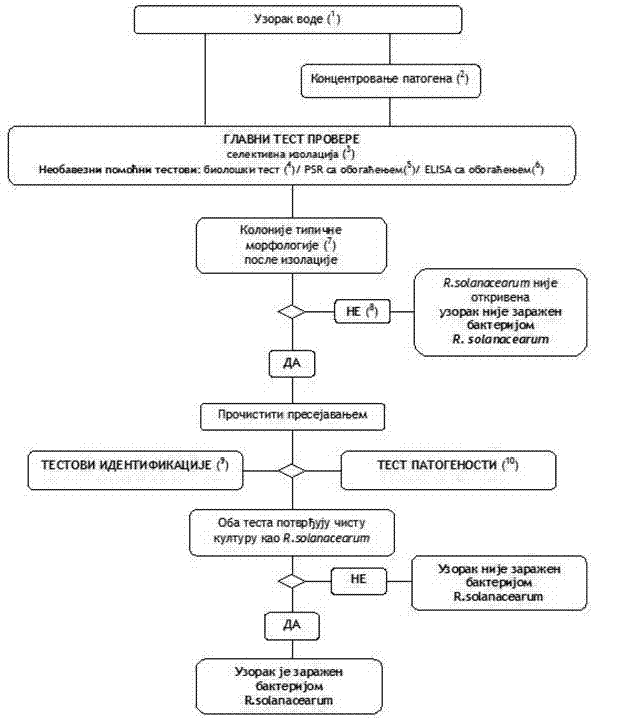
1. Šema za detekciju i identifikaciju bakterije R. solanacearum u vodi
Šema 4.
(1) Za preporučene postupke uzorkovanja videti tačku 2. podtačka 2.1. ovog poglavlja.
(2) Metode koncentrisanja patogena opisane su u tački 2. podtačka 2.1. ovog poglavlja. Ovaj postupak se preporučuje samo ako neće dovesti do inhibicije izolacije, jer se koncentrisanjem povećavaju populacije i patogena i konkurentnih saprofitnih bakterija.
(3) Selektivna izolacija opisana je u Poglavlju VIII. tačka 1. podtačka 1.4. ovog priloga.
(4) Biološko testiranje je opisano u Poglavlju VIII. tačka 1. podtačka 1.9. ovog priloga.
(5) Metode obogaćivanja za PCR test opisane su u Poglavlju VIII. tačka 1. podtačka 1.4. i Poglavlju VIII. tačka 1. Podtačka 1.6. ovog priloga
(6) Metode obogaćivanja za ELISA test opisane su u Poglavlju VIII. tačka 1. podtačka 1.4. i Poglavlju VIII. tačka 1. Podtačka 1.8. ovog priloga.
(7) Tipična morfologija kolonije opisana je u Poglavlju IV. tačka 1. podtačka 1.3. ovog priloga.
(8) Gajenje bakterijske kulture može biti neuspešno zbog kompeticije ili inhibicije saprofitnim bakterijama. Ako se sumnja da će velike populacije saprofitnih bakterija uticati na pouzdanost izolacije, ponoviti izolaciju posle razređivanja uzorka u sterilnoj vodi.
(9) Pouzdana identifikacija čistih kultura R. solanacearum postiže se izvođenjem testova opisanih u Poglavlju VIII. tačka 2. ovog priloga.
(10) Test patogenosti opisan je Poglavlju VIII. tačka 3. ovog priloga.
Identifikaciona šema opisana u ovom poglavlju se može primeniti za detekciju patogena u uzorcima površinske (tekuće vode), kao i u uzorcima industrijskih (otpadnih) voda. Ipak, važno je naglasiti da će očekivana osetljivost detekcije varirati u zavisnosti od supstrata. Na osetljivost testa izolacije utiču populacije konkurentskih saprofitnih bakterija, čija je brojnost najčešće mnogo veća u slučaju industrijskih (otpadnih) voda nego u slučaju površinskih (tekućih) voda. Iako se poštovanjem i realizovanjem pomenute identifikacione šeme očekuje detekcija populacije bakterije koncetracije 103 ć/litru površinske (tekuće) vode, očekuje se da je osetljivost detekcije mnogo niža kod industrijske (otpadne) vode. Iz ovog razloga se preporučuje da se populacija ove bakterije utvrđuje u uzorku otpadne vode tek posle procesa pročišćavanja (npr. sedimentacija ili filtracija), tokom kojeg se redukuje broj bakterija saprofitne populacije. Ovo ograničavanje osetljivosti metoda treba uzeti u obzir kada se procenjuje pouzdanost bilo kog dobijenog negativnog rezultata analize. Iako se ova šema veoma uspešno primenjuje kod utvrđivanja prisustva ove bakterije u tekućim vodama, njena ograničenja treba uzeti u obzir prilikom sličnih nadzora industrijskih (otpadnih) voda.
2. Metode za detekciju i identifikaciju R. Solanacearum u vodi
- detekcija R. solanacearum u tekućim vodama je najpouzdanija tokom kasnog proleća, leta i jeseni, kada je temperatura vode iznad 15°C;
- ponovljeno uzimanje uzoraka na odabranim mestima nekoliko puta tokom navedenog perioda će povećati pouzdanost detekcije umanjivanjem klimatskih varijacija;
- uzeti u obzir uticaj jakih padavina i geografske parametre vodotokova u cilju izbegavanja efekta razređenja koji mogu umanjiti mogućnost detekcije patogena;
- uzorke uzimati u tekućim vodama u blizini biljaka domaćina, ukoliko iste postoje.
Na odabranim mestima uzorkovati vodu zahvatanjem određene količine vode u reciklabilne sterilne epruvete ili boce i to sa dubine ispod 30 cm i u okviru 2 m od obale; industrijsku i otpadnu vodu uzorkovati na mestu ispuštanja; preporučuje se veličina uzorka od 500 ml po mestu uzorkovanja. Ukoliko je potrebno da uzorci budu manji, preporučuje se da isti budu uzeti sa tri različite tačke po odabranom mestu uzorkovanja i da se svaki sastoji od dva poduzorka od najmanje 30 ml. U uslovima intenzivnog nadzora, izabrati najmanje tri mesta uzorkovanja na svaka 3 km vodotoka; u uzorkovanje uključiti i mesta ulivanja drugih vodotokova.
Uzorak transportovati u tamnim i hladnim kontejnerima (4 do 10°C) i testirati u periodu od 24 časa od uzorkovanja.
Ukoliko je potrebno, bakterijska frakcija se može koncentrovati korišćenjem jedne od sledećih metoda:
- centrifugirati 30 do 50 ml poduzoraka na 10000 g u trajanju od 10 minuta (ili 7000 g u trajanju od 15 minuta), najpoželjnije na temperaturi od 4 do 10°C; odliti supernatant i resuspendovati pelet u 1 ml pufera;
- izvršiti membransku filtraciju (minimalna veličina pore 0.45 μm), a potom i ispiranje filtera sa 5 do 10 ml pufera i sakupljanje onoga što se ispere; ovaj metod je pogodan za veće zapremine vode koje sadrže manju koncentraciju saprofita;
Koncentrisanje rastvora se ne preporučuje za uzorke industrijske (otpadne) vode, jer bi povećana populacija saprofitnih bakterija inhibirala razvoj Ralstonia solanacearum.
2.2. Testiranje u laboratoriji se izvodi prema odgovarajućoj identifikacionoj šemi u skladu sa ovim prilogom.
DETEKCIJA I IDENTIFIKACIJA U ZEMLJIŠTU
1. Šema za detekciju i identifikaciju bakterije R. solanacearum u zemljištu
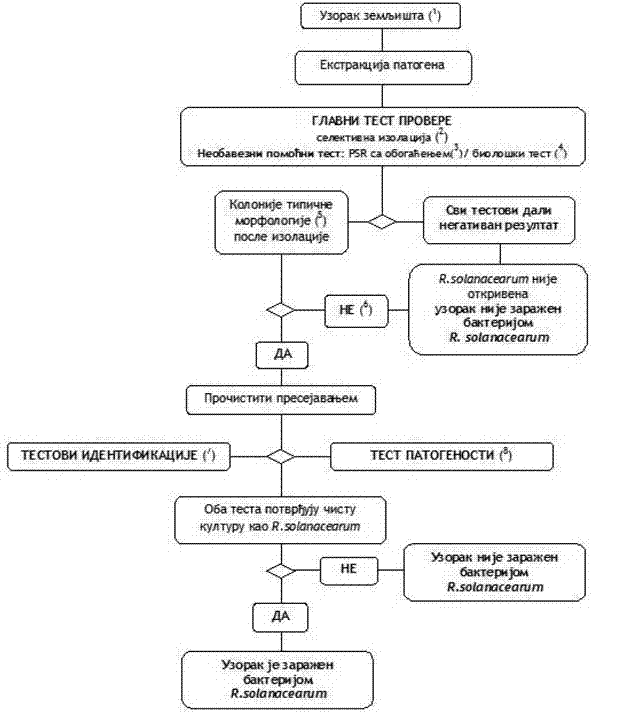
Šema 5.
(1) Za preporučene postupke uzorkovanja videti u Poglavlju VI. tačka 2. podtačka 2.1. ovog priloga.
(2) Selektivna izolacija opisana je u Poglavlju VIII. tačka 1. podtačka 1.4. ovog priloga.
(3) Metode obogaćivanja za PCR test opisane su u Poglavlju VIII. tačka 1. podtač 1.4. i 1.6. ovog priloga.
(4) Biološki test je opisan u Poglavlju VIII. tačka 1. podtačka 1.9. ovog priloga.
(5) Tipična morfologija kolonije opisana je u Poglavlju IV. tačka 1. podtačka 1.3. ovog priloga.
(6) Gajenje bakterije može biti neuspešno zbog kompeticije ili inhibicije saprofitnih bakterija. Ako se sumnja da će velike populacije saprofitnih bakterija uticati na pouzdanost izolacije, ponoviti izolaciju posle dodatnog razređivanja uzorka.
(7) Pouzdana identifikacija čistih kultura R. solanacearum postiže se primenom testova opisanih u Poglavlju VIII. tačka 2. ovog priloga.
(8) Test patogenosti opisan je u Poglavlju VIII. tačka 3. ovog priloga.
2. Metode za detekciju i identifikaciju bakterije R. solanacearum u zemljištu
Načela:
Validovani postupak opisan u ovom delu se može primeniti za detekciju patogena u uzorcima zemljišta, kao i za ispitivanje uzoraka čvrstog industrijskog otpada nastalog pri preradi krompira ili uzoraka kanalizacijskog mulja. Međutim, važno je napomenuti da ove metode nisu dovoljno osetljive da bi garantovale detekciju manjih i/ili neravnomerno raspoređenih populacija bakterije R. solanacearum koje mogu biti prirodno prisutne u uzorcima tih supstrata.
Treba uzeti u obzir ograničenja u osetljivosti ovog postupka testiranja pri ocenjivanju pouzdanosti dobijenih negativnih rezultata kao i pri primeni postupka u istraživanjima čiji je cilj utvrditi prisustvo ili odsustvo patogena u zemljištu ili mulju. Najpouzdaniji način utvrđivanja prisustva patogena u zemljištu na polju je setva/sadnja osetljivih biljaka domaćina i praćenje pojave infekcije, ali se ni korišćenjem ove metode neće otkriti niski nivoi kontaminacije.
Uzorkovanje zemljišta u polju treba obavljati u skladu s osnovnim načelima koja se primjenjuju kod uzorkovanja za ispitivanje nematoda. Sa 60 mesta na svakih 0,3 ha uzeti 0,5 do 1 kg zemljišta po uzorku, s dubine od 10 do 20 cm (ili na mreži od 7 x 7 m). Ako se sumnja na prisustvo patogena, povećati broj mesta uzorkovanja na 120 (na svakih 0,3 ha). Pre testiranja uzorke čuvati na temperaturi od 12 do 15°C. Uzorkovanje čvrstog industrijskog otpada nastalog pri preradi krompira ili uzorkovanje kanalizacijskog mulja izvršiti uzimanjem ukupno 1 kg na mestima koja predstavljaju ukupnu količinu mulja koju treba testirati. Svaki uzorak dobro promešati pre testiranja.
Poduzorke od 10 do 25 g zemljišta ili mulja izmešati u 60 do 150 ml ekstrakcionog pufera na rotacionoj mešalici (250 obrtaja/min), u trajanju od maksimalno 2 sata. Mešanju, po potrebi, može pomoći dodavanje 0,02%-tnog sterilnog Tween-20 i 10 do 20 g sterilnog peska.
Suspenziju održavati na temperaturi od 4°C tokom testiranja.
Testiranje se izvodi prema odgovarajućoj identifikacionoj šemi u skladu sa ovim prilogom.
OPTIMIZOVANI PROTOKOLI ZA DETEKCIJU I IDENTIFIKACIJU R. SOLANACEARUM
1. Dijagnostički testovi i testovi za identifikaciju
1.1. Testiranje bakterijskog eksudata iz stabljike
Prisustvo R. solanacearum u stabljikama uvelih biljaka krompira, paradajza ili drugih biljaka domaćina može se utvrditi sledećim jednostavnim testom: saseći stabljiku neposredno iznad površine zemljišta i taj kraj staviti u epruvetu sa čistom vodom. Posle nekoliko minuta, iz presečenih sprovodnih sudova pratiti pojavu karakterističnog bakterijskog eksudata.
1.2. Detekcija granula poli-β-hidroksibutirata (PHB)
Na mikroskopskoj pločici pripremiti razmaz bakterijskog eksudata iz zaraženog tkiva ili iz 48-časovne kulture sa hranjive podloge YPGA ili SPA (Poglavlje X. ovog priloga).
Za pozitivnu kontrolu pripremiti razmaze biovara 2, bakterije R. solanacearum, a za negativnu kontrolu razmaz bakterijske vrste za koju je poznato da je negativna na PHB, ukoliko se ovaj postupak smatra potrebnim.
Razmaze ostaviti da se osuše na vazduhu i potom ih fiksirati na plamenu.
Obojiti preparat ili Nilskom plavom ili Sudanskom crnom bojom i posmatrati pod mikroskopom sledeće:
1.2.1. Test sa Nilskom plavom bojom:
Preliti svaku pločicu s 1%-tnim vodenim rastvorom Nilsko plave boje A i inkubirati 10 minuta na 55°C.
Ocediti rastvor boje. Isprati kratko pod blagim mlazom vode iz slavine. Višak vode ukloniti upijajućim papirom.
Preliti razmaz 8%-tnim vodenim rastvorom sirćetne kiseline i inkubirati jedan minut na sobnoj temperaturi.
Isprati kratko pod blagim mlazom vode iz slavine. Višak vode ukloniti upijajućim papirom.
Ponovo navlažiti kapljicom vode i pokriti pokrovnim stakalcem.
Pregledati obojeni razmaz epifluorescentnim mikroskopom na 450 nm, imerzijskim objektivom povećanja od 600 do 1000 x (uljna ili vodena imerzija).
Pregledati da li je prisutna svetlo narandžasta fluorescencija granula PHB-a. Takođe, pregledati pločicu i pod normalnim svetlom da bi se potvrdilo prisustvo granula PHB u ćelijama i da je ćelijska morfologija tipična za R. solanacearum.
1.2.2. Test sa bojom Sudansko crno:
Preliti svaku pločicu 0,3%-tnim vodenim rastvorom boje Sudansko crno B u 70%-tnom etanolu i inkubirati 10 minuta na sobnoj temperaturi.
Ocediti rastvor boje, kratko isprati pod mlazom vode iz slavine i višak vode ukloniti upijajućim papirom.
Pločice nakratko umočiti u ksilol i osušiti ih na upijajućem papiru. Ksilol je opasan za zdravlje, preduzeti potrebne sigurnosne mere i raditi u digestoru.
Preliti pločice 0,5%-tnim (w/v) vodenim rastvorom šafranina i ostaviti 10 sekundi na sobnoj temperaturi. Šafranin je opasan za zdravlje, preduzeti potrebne sigurnosne mere i raditi u digestoru.
Isprati pod blagim mlazom vode iz slavine, osušiti na upijajućem papiru i pokriti pokrovnim stakalcem.
Pregledati obojene razmaze pod mikroskopom koji koristi prolazno svjetlo, uljnim imerzijskim objektivom povećanja od 1000 x.
Pregledati da li se uočavaju plavo-crno obojene granule PHB-a u ćelijama R. solanacearum s ćelijskim zidovima obojenim ružičasto.
1.3. Serološki test aglutinacije
Aglutinacija ćelija R. solanacearum u bakterijskom eksudatu ili ekstraktima tkiva sa simptomima, najbolje se uočava korišćenjem potvrđenih i odobrenih antitela obeleženih odgovarajućim obojenim oznakama kao što su crvene ćelije Staphylococcus aureus ili obojene čestice lateksa. Ako se koristi komplet koji je dostupan na tržištu, slediti uputstva proizvođača. U suprotnom primeniti sledeći postupak:
- pomešati kapljice suspenzije obeleženog antitela i bakterijskog eksudata (oko 5 μl svakog) na predmetnim pločicama sa više bunarčića;
- pripremiti pozitivne i negativne kontrole koristeći suspenzije R. solanacearum biovar 2 i heterolognog soja;
- uočiti da li dolazi do aglutinacije u pozitivnim uzorcima posle 15 sekundi laganog mešanja.
1.4. Izolacija R. solanacearum
1.4.1. Izolacija na selektivnoj podlozi
Napomena:
Pre primene ove metode, obaviti prethodne testove kako bi se osigurala ponovljiva detekcija 103 do 104 jedinica koje stvaraju kolonije (CFU) bakterije R. solanacearum po ml, a koje su dodate ekstraktima uzoraka koji su u prethodnim testiranjima dokazani kao negativni.
Koristiti potvrđenu i odobrenu selektivnu hranjivu podlogu kao što je SMSA (prilagođenu prema Elphinstone i sar., 1996; - Poglavlje X. ovog priloga).
Prilikom pregleda zasejane hranljive podloge, obratiti pažnju na razlikovanje R. solanacearum od drugih bakterija čije kolonije mogu rasti na toj hranljivoj podlozi, jer kolonije R. solanacearum mogu biti netipične morfologije ako je intenzivan porast raznih bakterija na podlozi ili ako su prisutne antagonističke bakterije. Ukoliko se posumnja da je došlo do negativnog uticaja kompeticije ili antagonizma, uzorak treba ponovo testirati drugim testom.
Najveća osetljivost detekcije ovom metodom može se očekivati ako se koriste sveže pripremljeni ekstrakti uzoraka. Međutim, ova se metoda može primenjivati i na ekstraktima čuvanim s glicerolom na temperaturi od -68 do -86°C.
Pozitivna kontrola: pripremiti decimalna razređenja suspenzije 106 cfu po ml virulentnog soja biovara 2 R. solanacearum (npr. NCPPB 4156 = PD 2762 = CFBP 3857). Pozitivne kontrole pripremiti potpuno odvojeno od uzoraka koji se testiraju, da bi se izbegla mogućnost kontaminiranja uzoraka.
Pre upotrebe za rutinsko testiranje uzoraka, proveriti pogodnost svake serije selektivne hranjive podloge za rast i razvoj patogena. Kontrolni materijal podvrgnuti istim principima testiranja kao i uzorak ili uzorke.
Primeniti odgovarajuću tehniku nanošenja razređenja kako bi se osigurala dovoljna razređenost populacija saprofitnih bakterija. Naneti 50-100 μl ekstrakta uzorka po podlozi i po svakom razređenju.
Inkubirati podloge na 28°C i očitati ih posle 48 sati, a posle toga svaki dan u periodu od šest dana. Tipične kolonije R. solanacearum na hranjivoj podlozi SMSA su mlečno-bele boje, pljosnate, nepravilnog oblika i vodenaste, a posle tri dana inkubacije sredina im postaje ružičasta do krvavo-crvena s unutrašnjim prugama ili spiralama (videti web stranicu: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
Napomena:
Na ovoj hranjivoj podlozi ponekad rastu i netipične kolonije R. solanacearum koje mogu biti male, okrugle, potpuno crvene boje i nevodenaste ili samo delomično vodenaste, zbog čega ih je teško razlikovati od kolonija saprofitnih bakterija.
Kolonije za koje se smatra da su kolonije R. solanacearum, treba preneti na uobičajenu hranjivu podlogu i prečistiti kako bi se dobile pojedinačne izdvojene kolonije.
Kulture se kratko vreme mogu čuvati u sterilnoj vodi (pH 6 do 8, bez hlora) na sobnoj temperaturi u tami ili duže vreme na temperaturi od -68 do -86°C ili liofilizovane.
Izolate identifikovati (Poglavlje VIII. tačka 2. ovog priloga) i proveriti patogenost (Poglavlje VIII. tačka 3. ovog priloga).
Tumačenje rezultata selektivne izolacije
Selektivna izolacija je negativna ako se posle šest dana ne uočavaju nikakve bakterijske kolonije ili ako se ne pronađu sumnjive kolonije tipične za R. solanacearum, pod uslovom da se ne sumnja na inhibiciju zbog konkurencije ili antagonizma drugih bakterija i da su tipične kolonije R. solanacearum pronađene u pozitivnim kontrolama
Selektivna izolacija je pozitivna ako se izdvoje sumnjive kolonije R. solanacearum.
1.4.2. Postupak obogaćivanja
Za obogaćivanje upotrebiti potvrđenu i odobrenu podlogu što je modifikovana Wilbrink tečna podloga (Poglavlje X. ovog priloga).
Ovaj postupak se može primeniti za selektivno povećanje populacije R. solanacearum u ekstraktima uzoraka, usled čega se povećava i osetljivost detekcije. Na ovaj način se takođe značajno razređuju inhibitori PCR reakcije (1:100). Međutim, treba napomenuti da obogaćivanje R. solanacearum može biti neuspešno zbog kompeticije ili antagonizma saprofitnih organizama koji se često istovremeno obogaćuju. Zbog toga može biti teško izdvojiti R. solanacearum iz kultura obogaćenih u tečnoj podlozi. Pored toga, u slučaju upotrebe ELISA testa, s obzirom da se populacije serološki srodnih saprofita mogu povećati, preporučuje se upotreba specifičnih monoklonalnih antitela umesto poliklonalnih antitela.
Za obogaćivanje za PCR test prenesite 100 μl ekstrakta uzorka u 10 ml tečne podloge za obogaćivanje koji je prethodno podeljen u alikvote u epruvete ili bočice bez DNK. Za obogaćivanje za ELISA test mogu se koristiti veći delovi ekstrakta uzorka u tekućoj podlozi (npr. 100 μl u 1,0 ml tekuće podloge za obogaćivanje.
Inkubirati 72 sata na temperaturi od 27 do 30°C sa ili bez protresanja, s čepom koji nije do kraja zategnut kako bi se omogućilo provetravanje.
Dobro promešati pre korišćenja u ELISA ili PCR testovima.
S obogaćenom tekućom podlogom postupati isto kao i s uzorcima u prethodno opisanim testovima.
Napomena:
Ukoliko se očekuje da će obogaćivanje R. solanacearum biti onemogućeno zbog velikih populacija određenih konkurentnih saprofitnih bakterija, bolji rezultate se mogu dobiti obogaćivanjem ekstrakta uzoraka pre centrifugiranja ili drugih postupaka koncentrisanja.
Načelo
Upotreba IF testa kao glavnog testa provere preporučuje se zbog njegove dokazane ujednačenosti u postizanju zahtevanih pragova osetljivosti metode.
Kada se IF test koristi kao glavni test provere i ako je IF očitavanje pozitivno, dodatno se kao drugi test koristi PCR ili FISH test. Kada se IF test koristi kao drugi test provere i IF očitavanje je pozitivno, dalja testiranja u cilju kompletiranja analiza se izvode prema dijagramu toka.
Napomena:
Koristiti potvrđena i odobrena antitela R. solanacearum (videti web stranicu: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
Preporučuje se određivanje titra za svaku novu seriju antitela. Titar se definiše kao najveće razređenje u kome dolazi do optimalne reakcije pri testiranju suspenzije koja sadrži 105 do 106 ćelija po ml odgovarajućeg soja R. solanacearum uz korišćenje fluorescein-izotiocijanat (FITC) konjugata u skladu s preporukama proizvođača. Svi potvrđeni i odobreni poliklonalni antiserumi imali su IF titar najmanje 1:2000. Tokom testiranja koristiti radna razređenja antitela, koja su blizu ili jednaka titru.
Testiranje treba izvršiti na sveže pripremljenim ekstraktima uzoraka, a po potrebi, testiranje se može uspešno izvršiti i na ekstraktima koji su bili čuvani na temperaturi od -68 do -86°C s dodatkom glicerola. Glicerol ukloniti dodavanjem 1 ml pelet pufera (pufera za rastvaranje taloga) (Poglavlje XII. ovog priloga), ponovnim centrifugiranjem na 7000 g u trajanju od 15 minuta i resuspendovanjem taloga u jednakoj zapremini pelet pufera. Ovaj deo procedure često nije potreban, naročito ako su uzorci fiksirani na mikroskopska IF stakla plamenom.
Na odvojenim mikroskopskim staklima pripremiti pozitivnu kontrolu i to homologni ili neki drugi referentni izolat R. solanacearum, rastvoren u ekstraktu krompira i po izboru u puferu.
Na istoj IF pločici treba, gde god je to moguće, koristiti i pozitivnu kontrolu koju čini prirodno zaraženo tkivo (liofilizovano ili zamrznuto na -16 do -24°C).
Negativnu kontrolu mogu predstavljati i delovi ekstrakta uzoraka koji su u ranijem testiranju pokazali negativan rezultat.
U Poglavlju XI. ovog priloga su navedeni standardizovani pozitivni i negativni kontrolni materijali koji se mogu upotrebljavati u ovom testu.
Koristiti mikroskopske pločice sa više bunarčića, po mogućnosti s 10 otvora prečnika najmanje 6 mm.
Primeniti identičan postupak testiranja na uzorke i na pozitivne i negativne kontrole.
1.5.1. Pripremiti IF pločice za testiranje jednim od sledećih postupaka:
1.5.1.1. Za taloge s relativno malom količinom nataloženog skroba:
U prvi bunarčić pipetom odmeriti standardnu zapreminu razređenja od 1/100 resuspendovanog taloga krompira (15 μl je dovoljno za bunarčiće prečnika 6 mm - povećati zapreminu za veće bunarčiće). Potom u ostale bunarčiće u istom redu pipetom odmeriti sličnu zapreminu nerazređene suspenzije (1/1) taloga. Drugi red se može koristiti kao duplikat prvog ili za drugi uzorak kako je prikazano na Šemi 6.
1.5.1.2. Za ostale suspenzije taloga:
Pripremiti decimalna razređenja (1/10 i 1/100) resuspendovanog taloga u puferu za talog. U jedan red bunarčića pipetom odmeriti standardnu zapreminu resuspendovanog taloga i svakog razređenja (15 μl je dovoljno za bunarčiće prečnika 6 mm - povećati zapreminu za veće). Drugi red se može koristiti kao duplikat prvog ili za drugi uzorak kao što je prikazano na Šemi 7.
1.5.2. Ostaviti da se kapljice osuše na sobnoj temperaturi ili ih zagrevati do temperature od 40 do 45°C. Ćelije bakterija fiksirati na IF pločicu zagrevanjem (15 minuta na 60°C), provlačenjem kroz plamen, 95%-tnim etanolom ili prema posebnim uputstvima proizvođača antitela.
Ukoliko je to neophodno, fiksirane pločice se mogu čuvati zamrznute u desikatoru u kraćem vremenskom intervalu (najviše do tri meseca).

Šema 6. Priprema pločica u skladu sa 1.5.1.1. i 1.5.3.1.
1.5.3. IF postupak:
1.5.3.1. U skladu sa postupkom za pripremu pločica za testiranje kako je opisano u 1.5.1.1.:
Pripremiti dvostruki niz razređenja antitela u IF puferu. Prvi bunarčić mora imati 1/2 titra (T/2), a ostali 1/4 titra (T/4), 1/2 titra (T/2), titar (T) i dvostruki titar (2T).
1.5.3.2. U skladu s postupkom za pripremu pločica za testiranje kako je opisano u 1.5.1.2.
Pripremiti radno razređenje antitela u IF puferu. Radno razređenje utiče na specifičnost.

Šema 7. Priprema pločica u skladu sa 1.5.1.2. i 1.5.3.2.
Poređati pločice na navlaženi upijajući papir. Svaki bunarčić potpuno ispuniti razređenjem antitela. Zapremina antitela mora biti jednaka zapremini nanesenog ekstrakta.
Ukoliko ne postoje posebna uputstva proizvođača antitela, slediti sledeću proceduru:
Inkubirati prekrivene pločice na vlažnom papiru 30 minuta na sobnoj temperaturi (18 do 25°C).
Kapljice sa svake pločice otresti i pločice pažljivo isprati IF puferom. Potopiti pločice u IF pufer-Tween pa u IF pufer, u trajanju od po 5 minuta. Sprečiti stvaranje aerosola ili prenos kapljica jer bi moglo doći do unakrsne kontaminacije uzoraka. Pločice pažljivo osušiti upijajućim papirom.
Poređati pločice na navlaženi upijajući papir. Bunarčiće popuniti razređenim FITC konjugatom koji se koristi za određivanje titra. Zapremina konjugata nanesenog na bunarčić mora biti jednaka zapremini nanesenog antitela.
Inkubirati pokrivene pločice na vlažnom papiru, 30 minuta na sobnoj temperaturi (18 do 25°C).
Otresti kapljice konjugata sa pločica. Isprati i oprati pločice kako je prethodno opisano. Pločice pažljivo osušiti.
Na svaki bunarčić pipetom naneti 5-10 μl 0,1M glicerola s fosfatnim puferom ili komercijalno dostupno sredstvo protiv izbleđivanja i staviti pokrovno staklo.
1.5.4. Očitavanje IF testa:
Pregledati pripremljene pločice pod epifluorescentnim mikroskopom s odgovarajućim filterima za ekscitaciju FITC-a, pod uljnom ili vodenom imerzijom i uvećanjem od 500-1000 x. Pregledati svaki bunarčić uzduž i popreko, pod pravim uglom i duž spoljne ivice. Za uzorke u kojima je vidljiv mali broj ćelija ili ih uopšte nema pregledati najmanje 40 mikroskopskih vidnih polja.
Prvo treba pregledati pločicu s pozitivnom kontrolom. Ćelije moraju biti izrazito fluorescentne i potpuno obojene na utvrđenom titru antitela ili radnog razređenja. U slučaju da kod obojenosti dođe do odstupanja, IF test se mora ponoviti (Poglavlje VIII. tačka 1. podtačka 1.5. ovog priloga).
Utvrditi da li jasno fluorescentne ćelije koje se uočavaju u bunarčićima imaju morfologiju karakterističnu za R. solanacearum (videti web stranicu: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
Intenzitet fluorescencije mora biti jednak ili bolji od onog koji daje pozitivni kontrolni izolat, pri jednakom razređenju antitela. Zanemariti nepotpuno obojene ili slabo fluorescentne ćelije.
Ukoliko se posumnja na kontaminaciju, test se mora ponoviti (npr. ako zbog kontaminacije pufera sve pločice u seriji pokazuju pozitivne ćelije ili ako su pozitivne ćelije pronađene (izvan bunarčića) na površini pločice).
Postoji nekoliko problema u vezi sa specifičnošću testa imunofluorescencije. U koncentrovanom ekstraktu izdvojenih konusa pupčanih delova krtole ili delova stabljike uvek se očekuje i prisustvo populacija fluorescentnih ćelija sa netipičnom morfologijom ili unakrsna reakcija sa saprofitnim bakterijama slične veličine i građe kao R. solanacearum.
Prilikom očitavanja u obzir se uzimaju samo fluorescentne ćelije tipične veličine i morfologije u titru ili radnom razređenju antitela.
Tumačenje očitavanja IF testa:
Ukoliko se utvrdi prisustvo jasno fluorescentnih ćelija karakteristične morfologije, odrediti prosečan broj tipičnih ćelija po mikroskopskom vidnom polju i izračunati broj tipičnih ćelija po ml resuspendovanog taloga (Poglavlje XIII. ovog priloga).
Očitavanje IF testa je pozitivno za uzorke koji imaju najmanje 5 x 103 tipičnih ćelija po ml resuspendovanog taloga. Ovakav uzorak se smatra potencijalno kontaminiranim i potrebno je izvršiti dalje testiranje.
Očitavanje IF testa je negativno za uzorke koji imaju manje od 5 x 103 ćelija po ml resuspendovanog taloga i uzorak se smatra negativnim. Nije potrebno dalje testiranje.
Načela
Kada se upotrebom PCR testa kao prvog testa provere dobije pozitivan rezultat, IF test ili izolacija na podlogu se koriste kao drugi obavezni test provere. Ako se korišćenjem PCR testa kao drugog testa provere dobije pozitivan rezultat, za postavljanje konačne dijagnoze treba obaviti dalje testiranje prema dijagramu toka.
Korišćenje ove metode kao glavnog testa provere preporučuje se samo ukoliko je dostupna specijalizovana ekspertiza.
Napomena:
Preliminarna testiranja primenom ove metode treba da omoguće ponovljivu detekciju najmanje 103 do 104 ćelija R. solanacearum po ml, koje su dodate ekstraktu uzorka prethodno dokazanog kao negativnog.
Za postizanje najvećeg stepena osetljivosti i specifičnosti u svim laboratorijima, potrebno je izvođenje ogleda za standardizaciju (optimizaciju) metode. Koristiti potvrđene i odobrene reagense i protokole za PCR. (Poglavlje XIV. ovog priloga). Poželjno je odabrati metod sa internom kontrolom. Preduzeti odgovarajuće mere opreza kako bi se izbegla kontaminacija uzorka ciljnom DNK. PCR test treba da obavljaju iskusni stručnjaci, u specijalizovanim laboratorijima za molekularnu biologiju.
Negativne kontrole (za ekstrakciju DNK i PCR postupak) treba uvek u postupku obraditi poslednje kako bi se utvrdilo da li je eventualno došlo do bilo kakvog prenošenja DNK.
U PCR test uključiti sledeće negativne kontrole:
- ekstrakt uzorka u kome prethodno tokom testiranja nije dokazano prisustvo R. Solanacearum;
- pufer korišćen za ekstrakciju bakterije i DNK iz uzorka;
- PCR-reakcioni miks.
U PCR test uključiti sledeće pozitivne kontrole:
- alikvote resuspendovanih taloga u koje je dodata bakterija R. solanacearum (za pripremu videti Poglavlje XI. tačka 2. ovog priloga);
- suspenziju od 106 ćelija po ml virulentnog izolata R. solanacearum u vodi (npr. NCPPB 4156=PD 2762=CFBP 3857; videti
- ako je moguće, u PCR testu koristiti i DNK ekstrahovanu iz pozitivnih kontrolnih uzoraka.
Da bi se izbegla moguća kontaminacija, pozitivne kontrole pripremiti prostorno odvojeno od uzoraka za testiranje.
S obzirom da primena PCR protokola zahteva korišćenje ekstrakta uzoraka sa što manje zemlje, pre početka procedure izvođenja testa, uzorke krompira je poželjno dobro oprati.
U poglavlju XI. ovog priloga navedeni su standardiziovani pozitivni i negativni kontrolni materijali koji se mogu koristiti u ovim testovima.
1.6.1. Metode prečišćavanja DNK
Pozitivnu i negativnu kontrolu koristiti kako je prethodno opisano (videti u Poglavlju XI. ovog priloga). Kontrolni materijal pripremiti na isti način kao i uzorke.
Dostupne su različite metode prečišćavanja ciljane DNK iz kompleksnih supstrata uzorka u cilju uklanjanja inhibitora PCR reakcije i drugih enzimskih reakcija i metode koncentrovanja ciljane DNK u ekstraktu uzorka.
Metoda koja sledi je standardizovana za korišćenje sa potvrđenom i odobrenom PCR metodom u Poglavlju XIV. ovog priloga.
1.6.1.1. Metoda prema Pastriku (2000)
Pipetom odmeriti 220 μl lizis pufera [100 mM NaCl, 10 mM Tris-HCl (pH 8,0), 1 mM EDTA (pH 8,0)] u Eppendorf tubu od 1,5 ml.
Dodati 100 μl ekstrakta uzorka i staviti u termoblok ili vodeno kupatilo na 95°C 10 minuta.
Staviti tubu na led u trajanju od pet minuta.
Dodati 80 μl osnovnog štok rastvora Lysozyme (50 mg lizozima po ml u 10 mM Tris HCl, pH 8,0) i inkubirati na 37°C 30 minuta.
Dodati 220 μl rastvora Easy DNA® A (Invitrogen), dobro izmešati na vorteksu i inkubirati na 65°C 30 minuta.
Dodati 100 μl rastvora Easy DNA® B (Invitrogen) i snažno izmešati na vorteksu do postizanja uniformnog viskoziteta uzorka.
Dodati 500 μl hloroforma, izmešati na vorteksu dok se viskozitet ne umanji i smesa postane homogena.
Centrifugirati na 15000 g 20 minuta na 4°C da se podele faze i stvori međufaza.
Preneti gornju fazu u novu Eppendorf tubu.
Dodati 1 ml 100% etanola (-20°C), kratko promešati na vorteksu i inkubirati na ledu 10 minuta.
Centrifugirati na 15000 g 20 minuta na 4°C i ukloniti etanol od taloga.
Dodati 500 μl 80% etanola (-20°C) i promešati okretanjem tube.
Centrifugirati na 15000 g 10 minuta na 4°C sačuvati talog, a ukloniti etanol.
Ostaviti talog da se suši na vazduhu ili u vakuumskoj centrifugi (DNA speed vac).
Resuspendovati talog u 100 μl sterilne Ultra čiste vode i ostaviti na sobnoj temperaturi najmanje 20 minuta.
Čuvati na -20°C do izvođenja PCR-a.
Bilo koji beli talog izdvojiti centrifugiranjem i za PCR upotrebiti 5 μl supernatanta koji sadrži DNK.
1.6.1.2. Druge metode
Za ekstrakciju DNK mogu se primeniti i druge metode (npr. Qiagen DNeasy Plant Kit), ukoliko je dokazana ekvivalentnost u pročišćavanju DNK iz kontrolnih uzoraka koji sadrže 103 do 104 patogenih ćelija po ml.
1.6.2. PCR
Pripremiti uzorke za testiranje i kontrolne uzorke za PCR prema odobrenim protokolima (Poglavlje VIII. tačka 1. podtačka 1.6. ovog priloga). Pripremiti razređenje ekstrakta DNK iz uzorka 1:10 u Ultra čistoj vodi.
U nekontaminiranom prostoru pripremiti odgovarajući reakcioni miks za PCR prema objavljenim protokolima (Poglavlje XIV. ovog priloga). Odobreni PCR protokol je multipleks reakcija koja takođe uključuje unutrašnju PCR kontrolu.
Prema protokolu za PCR, dodati 5 μl ekstrakta DNK na 25 μl reakcionog miksa u sterilne epruvete za PCR.
Uključiti i negativnu kontrolu koja sadrži samo PCR reakcioni miks, a umesto uzorka dodati isti izvor Ultra čiste vode koji je korišćen za pripremu PCR reakcionog miksa.
Staviti epruvete u uređaj za PCR (thermal cycler) i pokrenuti standardizovani PCR program.
1.6.3. Analiza PCR produkata
Umnožene PCR produkte razdvojiti elektroforezom u agaroznom gelu. U svaki bunarčić 2,0%-tnog (v/v) agaroznog gela u tris-acetat EDTA puferu (TAE) (Poglavlje XIV. ovog priloga) naneti najmanje 12 μl amplikona DNK iz svakog uzorka, pomešane s 3 μl boje i propustiti uz napon od 5 do 8 V po cm. Upotrebiti odgovarajući DNK marker, npr. 100 bp ladder.
Obojiti elektroforetske trake DNK u gelu potapanjem gela u etidium bromid (0,5 mg/l) u trajanju od 30 do 60 minuta. Preduzeti odgovarajuće mere opreza pri radu sa ovim mutagenom.
Obojeni gel pregledati na kratkotalasnom UV transiluminatoru (npr. λ = 302 nm), i potražiti umnožene fragmente očekivane dužine i dokumentovati ih.
Prilikom svakog novog nalaza/slučaja proveriti autentičnost umnoženog PCR produkta izvođenjem analize uz pomoć restrikcionih enzima na uzorku preostale umnožene DNK i to inkubacijom pri optimalnoj temperaturi i u optimalnom vremenu s odgovarajućim enzimom i puferom. Nastale fragmente razdvojiti elektroforezom u agaroznom gelu kako je prethodno navedeno i posle bojenja etidium bromidom na UV transiluminatoru posmatrati karakterističnu matricu (obrazac) restrikcionih fragmenata i uporediti je s pozitivnom kontrolom pre i posle razdvajanja.
Tumačenje rezultata PCR testa:
PCR test je negativan ako u testiranom uzorku nije vidljiv PCR produkt očekivane dužine koji je specifičan za R.solanacearum, ali je vidljiv u svim pozitivnim kontrolnim uzorcima (kod multipleks PCR-a s prajmerima za unutrašnju kontrolu koji su specifični za biljku domaćina: u testiranom uzorku se mora umnožiti drugi produkt PCR-a očekivane veličine).
PCR test je pozitivan ako je vidljiv PCR produkt koji je specifičan za R.solanacearum i koji je očekivane dužine i restrikcionog obrasca, pod uslovom da nije umnožen ni u jednom uzorku koja predstavlja negativnu kontrolu. Pouzdana potvrda pozitivnog rezultata predstavlja i i uspešno ponavljanje testa s drugim parom PCR prajmera (Poglavlje XIV. ovog priloga).
Napomena:
Ukoliko se očekivani fragment (pozitivna reakcija) dobije u uzorku pozitivne kontrole koja sadrži R.solanacearum u vodi, a negativni rezultat dobije u uzorku pozitivne kontrole koja sadrži R.solanacearum u ekstraktu krompira, pretpostavlja se da je došlo do inhibicije PCR reakcije. U multipleks PCR protokolima koji se izvode upotrebom unutrašnjih PCR kontrola, smatra se da je došlo do inhibicije reakcije ako nije dobijen ni jedan od dva produkta.
Takođe, ako se iz jedne ili više negativnih kontrola dobije očekivani produkt, može se sumnjati da je došlo do kontaminacije.
Načelo
Kada se FISH test kao prvi test provere i ako se njime dobije pozitivan rezultat, mora se sprovesti IF test ili izolacija kao drugi obavezni test provere. Ako se FISH test koristi kao drugi test provere i ako se njime dobije pozitivan rezultat, za postavljanje konačne dijagnoze treba obaviti dalje testiranje prema dijagramu toka.
Napomena:
Koristiti potvrđene i odobrene oligo-probe specifične za bakteriju R. solanacearum (Poglavlje XV. ovog priloga). Preliminarna testiranja primenom ove metode treba da omoguće ponovljivu detekciju najmanje 103 do 104 ćelija R. solanacearum po ml dodatih ekstraktu uzorka prethodno dokazanog kao negativnog.
Postupak treba izvršiti na sveže pripremljenim ekstraktima uzoraka, ali se uspešno može primeniti i na ekstrakt uzorka koji je bio čuvan sa glicerolom na temperaturi od -16 do -24°C ili od -68 do -86°C.
Za negativnu kontrolu upotrebiti delove ekstrakta uzoraka koji su u ranijem testiranju na R. solanacearum dokazani kao negativni.
Za pozitivnu kontrolu pripremiti suspenzije koje sadrže 105 do 106 ćelija/ml 0,01M fosfatnog pufera (PB) bakterije R. solanacearum biovar 2 (npr. soj NCPPB 4156 = PD 2762 = CFBP 3857; videti Dodatak 3) iz kulture stare 3-5 dana. Pripremiti odvojene pločice za pozitivnu kontrolu sa homologim ili nekim drugim referentnim izolatom bakterije R. solanacearum, rastvorenim u ekstraktu krompira, kao što je navedeno u Poglavlju XI. tačka 2. ovog priloga.
Korišćenje eubakterijske oligo-probe obeležene FITC-om omogućava kontrolu procesa hibridizacije jer će se obojiti sve eubakterije prisutne u uzorku.
U Poglavlju XI tačka 1. ovog priloga navedeni su standardizirani pozitivni i negativni kontrolni materijali koji se mogu upotrebljavati u ovom testu.
Kontrolni materijal testirati primenom iste procedure kao i uzorke.
1.7.1. Fiksiranje ekstrakta krompira
Sledeći protokol se zasniva na proceduri Wullings i sar., (1998):
Pripremiti rastvor za fiksiranje (Poglavlje XV. ovog priloga).
Pipetom odmeriti 100 μl ekstrakta svakog uzorka u Eppendorf epruvetu pa centrifugirati 7 minuta na 7000 g.
Ukloniti supernatant i rastvoriti talog u 200 μl fiksativa pripremljenog najviše 24 sata ranije, promešati i inkubirati jedan sat u frižideru. Alternativni fiksativ je 96% etanol. Pri tome je potrebno rastvoriti talog iz koraka 5.1.2 u 50 μl 0,01 M PB i 50 μl 96% etanola, promešati i inkubirati na 4°C 30 do 60 minuta.
Centrifugirati 7 minuta na 7000 g, ukloniti supernatant i resuspendovati talog u 75 μl 0,01 M PB.
U bunarčiće čistih pločica naneti 16 μl fiksiranih suspenzija kako je prikazano na šema 8. Na svaku pločicu naneti dva različita, nerazređena uzorka i upotrebiti 10 μl za pripremanje razređenja 1:100 (u 0,01 M PB). Preostali fiksirani rastvor uzorka (49 μl) čuvati na -20°C posle dodavanja jednake zapremine 96%-tnog etanola. Ako FISH test treba ponoviti, centrifugiranjem ukloniti etanol i dodati jednaku zapreminu 0,01 PB (uz mešanje).
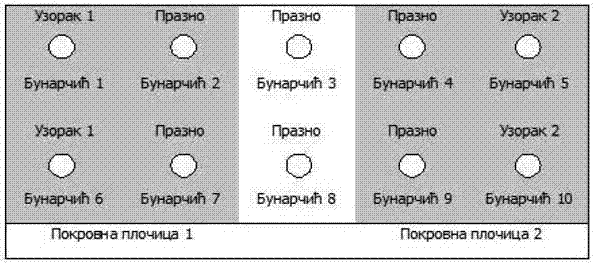
Šema 8. Prikaz pločice za FISH test
Pločice osušiti na vazduhu (ili u sušnici na 37°C) pa ih fiksirati provlačenjem kroz plamen. Na ovom koraku se može prekinuti postupak i nastaviti sledeći dan. Pločice treba čuvati na sobnoj temperaturi u suvom prostoru bez prašine.
1.7.2. Hibridizacija
Dehidrataciju ćelija izvršiti uzastopnim potapanjem pločica u 50%-tni, 80%-tni i 90%-tni etanol, u trajanju od po jednog minuta. Pločice postaviti na držač i osušiti na vazduhu.
Pripremiti vlažnu komoru za inkubaciju tako što se dno hermetički zatvorene kutije prekriva upijajućim ili filter papirom potopljenim u 1 x hybmix (Poglavlje XV. ovog priloga). Kutiju prethodno inkubirati u aparatu za hibridizaciju nukleinskih kiselina na 45°C najmanje 10 minuta.
Nanesite po 10 μl hibridizovanog rastvora u osam bunarčića (bunarčići 1, 2, 4, 5, 6, 7, 9 i 10; videti Šemu 7) svake pločice, a dva srednja bunarčića (3 i 8) ostaviti prazne.
Prva i zadnja 4 bunarčića pokriti pokrovnim stakalcem (24 x 24 mm), pazeći pri tom da u bunarčićima ne ostane vazduh. Staviti pločicu u prethodno zagrejanu vlažnu komoru i hibridizovati 5 sati u aparatu za hibridizaciju na 45°C, u tami.
Pripremiti tri posude sa 1 l Ultra čiste vode, 1 L 1 x hybmix (334 ml 3 x hybmix i 666 ml ultra čiste vode) i 1 L 1/8 x hybmix (42 ml 3 x hybmix i 958 ml ultra čiste vode). Svaku posudu prethodno inkubirati u vodenom kupatilu na 45°C.
Skinuti pokrovna stakalca, a predmetne pločice staviti na držač.
Višak probe ukloniti inkubiranjem u trajanju od 15 minuta na 45°C u posudi s 1 x hybmix.
Preneti držač pločica u rastvor za pranje (1/8 x hybmix) i inkubirati još 15 minuta.
Pločice nakratko uroniti u ultra čistu vodu i staviti na filter papir. Višak vlage ukloniti filter papirom. U svaki bunarčić pipetom naneti 5 do 10 μl zaštitnog rastvora protiv izbleđivanja (npr. Vectashield, Vecta Laboratories, CA, USA ili ekvivalentna) pa celu predmetnu pločicu pokriti velikim pokrovnim staklom (24 x 60 mm).
1.7.3. Očitavanje FISH testa
Pločice pregledati pod epifluorescentnim mikroskopom, korišćenjem uljane imerzije, s uvećanjem 630 ili 1000 x. Sa filterom prikladnim za fluorescein-izotiocijanat (FITC), eubakterijske ćelije (uključujući većinu gram negativnih ćelija) se u uzorku vide kao fluorescentno zelene. Upotrebom filtera za tetrametilrodamin-5- izotiocijanat, ćelije R. solanacearum, obojene sa Cy3, vide se kao fluorescentno crvene. Uporediti morfologiju ćelija uzorka s morfologijom ćelija pozitivnih kontrola. Ćelije moraju biti jasno flourescentne i u potpunosti obojene. Ako dođe do odstupanja u obojenosti, FISH test (Poglavlje VIII. tačka 1. podtačka 1.7. ovog priloga) se mora ponoviti. Pregledati svaki bunarčić uzduž i popreko pod normalnim uglom i duž spoljne ivice. Za uzorke u kojima je vidljiv mali broj ćelija ili ih uopšte nema pregledati najmanje 40 mikroskopskih vidnih polja.
Uočiti da li su vidljive jasno fluorescentne ćelije u bunarčićima morfologije karakteristične za R. solanacearum (videti web stranicu: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
Intenzitet fluorescencije mora biti jednak ili jači nego kod pozitivne kontrole. Ćelije koje nisu u potpunosti obojene ili su slabe fluorescencije se ne uzimaju u obzir.
Ukoliko postoji sumnja da je došlo do kontaminacije, test se mora ponoviti (npr. sve pločice u seriji zbog kontaminacije pufera pokazuju pozitivne ćelije ili su pozitivne ćelije pronađene izvan bunarčića, na površini pločice).
Postoji nekoliko problema u vezi sa specifičnošću FISH testa. U koncentrovanom ekstraktu izdvojenih konusa pupčanih delova krtole ili stabljike uvek se očekuje i prisustvo populacija fluorescentnih ćelija sa netipičnom morfologijom ili unakrsna reakcija sa saprofitnim bakterijama slične veličine i građe kao R. solanacearum, mada znatno ređe nego kod IF testa.
U obzir se uzimaju samo fluorescentne ćelije tipične veličine i morfologije.
Tumačenje rezultata FISH testa
Rezultati FISH testa smatraju se važećim ako se u svim pozitivnim i ni u jednoj negativnoj kontroli primenom FISH filtra uočava prisustvo jasno zelenih fluorescentnih ćelija čija je veličina i morfologija tipična za R. solanacearum i ako se primenom filtera za rodamin uočavaju jasne crvene fluorescentne ćelije. Ako se uoče jasne ćelije karakteristične morfologije, odrediti prosečni broj tipičnih fluorescentnih ćelija po mikroskopskom vidnom polju i izračunati broj tipičnih ćelija po ml resuspendovanog taloga. Potencijalno pozitivnim se smatraju uzorci sa najmanje 5 x 103 tipičnih ćelija po ml resuspendovanog taloga i potrebna su im dalja testiranja. Negativnim se smatraju uzorci s manje od 5 x 103 tipičnih ćelija po ml resuspendovanog taloga.
FISH test je negativan ako se primenom filtera za rodamin ne uoče snažno fluorescentne crvene ćelija čija je veličina i morfologija tipična za R. solanacearum, pod uslovom da se primenom filtera za rodamin uoče tipične izrazito fluorescentne crvene ćelije u preparatima pozitivne kontrole.
Načelo
Zbog relativno niske osetljivosti, ELISA se može primeniti samo kao neobavezni dodatni test pored IF, PCR ili FISH testova. Ako se primjenjuje DAS ELISA, obavezno je prethodno obogaćivanje ekstrakta i upotreba monoklonalnih antitela (videti web stranicu http: //forum.europa.eu.int/Public/irc/sanco/Home/main).
Obogaćivanje uzoraka pre primene ELISA testa može biti korisno jer se na taj način povećava osetljivost testa, ali može biti i neuspješno zbog kompeticije ostalih organizama u uzorku.
Napomena:
Koristiti potvrđeni i odobreni izvor antitela za R. solanacearum (videti web stranicu http://forum.europa.eu.int/Public/ irc/sanco/Home/main).
Preporučljivo je da se titar odredi za svaku novu seriju antitela. Titar se definiše kao najveće razređenje kod kojeg dolazi do optimalne reakcije pri testiranju suspenzije koja sadrži 105 do 106 ćelija/ml homolognog soja bakterije R. solanacearum uz korišćenje odgovarajućih konjugata sekundarnih antitela prema preporukama proizvođača. Tokom testiranja, treba koristiti antitela u radnim razređenjima koja su blizu ili jednaka titru formulacije dostupne na tržištu.
Odrediti titar antitela na suspenziji od 105 do 106 stanica po ml homolognog soja bakterije R. solanacearum.
Za negativnu kontrolu koristiti ekstrakt uzorka koji je u ranijem testiranju na R. solanacearum bio negativan i suspenziju bakterije, s kojom ne dolazi do unakrsne reakcije, u fosfatnom puferu s dodatkom soli (PBS).
Za pozitivnu kontrolu koristiti alikvote ekstrakta uzorka koji je u ranijem testiranju bio negativan, pomešane sa 103 do 104 ćelija/ml bakterije R. solanacearum biovar 2 (npr. soj NCPPB 4156 = PD 2762 = CFBP 3857). Za upoređivanje rezultata na svakoj mikrotitarskoj ploči koristiti standardnu suspenziju od 105 do 106 ćelija/ml bakterije R. solanacearum u PBS-u. Pobrinite se da pozitivne kontrole na mikrotitarskoj ploči budu dobro odvojene od uzoraka koji se testiraju.
U Poglavlju XI. tačka 1. ovog priloga navedeni su standardizovani pozitivni i negativni kontrolni materijali koji se mogu upotrebljavati u ovom testu.
Kontrolni materijal testirati na isti način kao i uzorke.
Izvršena je validacija dva protokola za ELISA test.
1.8.1. Indirektna ELISA
(Robinson Smith i sar., 1995)
Upotrebiti alikvote od 100 do 200 μl ekstrakta uzorka (u nekim slučajevima se, zagrevanjem četiri minuta na 100°C u vodenom kupatilu ili bloku za zagrevanje mogu smanjiti nespecifični rezultati).
Dodati jednaku zapreminu pufera za oblaganje dvostruke jačine i promešati na vorteksu.
Naneti alikvote od 100 μl u najmanje dva bunarčića na mikrotitarske ploče (npr. Nunc-Polysorp ili ekvivalentna) i inkubirati jedan sat na 37°C ili preko noći na 4°C.
Ukloniti ekstrakt iz bunarčića. Isprati bunarčiće tri puta rastvorom PBS-Tween, a poslednji rastvor za ispiranje ostaviti u bunarčićima najmanje pet minuta.
Pripremiti odgovarajuće razređenje antitela za R. solanacearum u puferu za blokiranje. Za potvrđena i odobrena antitela koja su dostupna na tržištu koristiti preporučena razređenja (obično dvostruka koncentracija titra).
Dodati 100 μl u svaki bunarčić i inkubirati jedan sat na 37°C.
Ukloniti rastvor antitela iz bunarčića i isprati bunarčiće, tri puta rastvorom PBS-Tween, a poslednji rastvor za ispiranje ostaviti u bunarčićima najmanje pet minuta.
Pripremiti odgovarajuće razređenje sekundarnih antitela- konjugata alkalne fosfataze u puferu za blokiranje. Dodati 100 μl u svaki bunarčić i inkubirati jedan sat na 37°C.
Ukloniti konjugat antitela iz bunarčića i oprati bunarčiće, kao što je prethodno opisano.
U svaki bunarčić dodati 100 μl rastvora supstrata alkalne fosfataze, inkubirati u tami na sobnoj temperaturi i očitati apsorbciju pri 405 nm u intervalu od 90 minuta.
1.8.2. DASI ELISA
Pripremiti odgovarajuće razređenje poliklonalnih imunoglobulina za bakteriju R. solanacearum u puferu za oblaganje pH 9,6 (Poglavlje XII. ovog priloga). Naneti 200 μl u svaki bunarčić. Inkubirati četiri do pet sati na 37°C ili 16 sati na 4°C.
Bunarčiće isprati tri puta rastvorom PBS-Tween.
U najmanje dva bunarčića naneti 190 μl ekstrakta uzorka.
Na svakoj ploči dodati pozitivnu i negativnu kontrolu, i to svaku u po dva bunarčića. Inkubirati 16 sati na 4°C.
Bunarčiće isprati tri puta rastvorom PBS-Tween.
Pripremiti odgovarajuće razređenje monoklonalnih antitela specifičnih za bakteriju R. solanacearum u PBS-u koji sadrži i 0,5% goveđeg serumskog albumina (BSA) i naneti 190 μl u svaki bunarčić. Inkubirati dva sata na 37°C.
Bunarčiće isprati tri puta rastvorom PBS-Tween.
Pripremiti odgovarajuće razređenje antimišijih imunoglobulina konjugiranih sa alkalnom fosfatazom u PBS-u. Naneti 190 μl u svaki bunarčić. Inkubirati dva sata na 37°C.
Bunarćiće isprati tri puta rastvorom PBS-Tween.
Pripremiti rastvor supstrata alkalne fosfataze koja sadrži 1 mg p-nitrofenil fosfata po ml pufera supstrata. Naneti 200 μl u svaki bunarčić. Inkubirati u tami na sobnoj temperaturi i i očitati apsorbciju pri 405 nm u periodu od 90 minuta.
Tumačenje rezultata ELISA testova
ELISA test je negativan ako je prosečna optička gustina (OD) u bunarčićima s duplikatom uzorka < 2x OD u bunarčiću s negativnom kontrolom ekstrakta uzorka, pod uslovom da su sve vrednosti OD pozitivnih kontrola iznad 1,0 (nakon 90 minuta inkubacije sa supstratom) i da su veće od dvostruke vrednosti OD dobijenih za negativne ekstrakte uzorka.
ELISA test je pozitivan ako je prosečna optička gustina (OD) u bunarčićima s duplikatom uzorka > 2x OD u bunarčiću s negativnom kontrolom ekstrakta uzorka, pod uslovom da su vrednosti OD za sve bunarčiće s negativnom kontrolom < 2x OD u bunarčićima s pozitivnom kontrolom.
Ako se u ELISA testu očitaju negativni rezultati u bunarčićima sa pozitivnom kontrolom, to ukazuje da test nije pravilno izveden ili da je došlo do inhibicije. Ako se u ELISA testu očitaju pozitivni rezultati u bunarčićima s negativnom kontrolom, to ukazuje da je došlo do unakrsne kontaminacije ili do nespecifičnog vezanja antitela.
Napomena:
Preliminarno testiranje ovom metodom treba da omogući ponovljivo otkrivanje prisustva 103 do 104 CFU bakterije R. solanacearum po ml, dodatih ekstraktima uzoraka koji su u ranijem testiranju bili negativni (Poglavlje XI. ovog priloga).
Najveća osetljivost detekcije može se očekivati ako se koriste sveže pripremljeni ekstrakti uzoraka i optimalni uslovi za rast i razvoj patogena. Međutim, ova metoda može uspešno da se primeni i upotrebom ekstrakata koji su čuvani sa glicerolom na temperaturi od -68 do -86°C.
Sledeći protokol se temelji na Janse (1988):
Za svaki uzorak koristiti 10 biljaka osetljive sorte paradajza u fazi trećeg pravog lista. (npr. Moneymaker ili druge sorte za koju je utvrđeno u laboratorijskim uslovima da je jednake osetljivosti). Detalji o gajenju biljaka se nalaze u Poglavlju XVI. ovog priloga Za ovu svrhu se može upotrebiti i plavi patlidžan (npr. sorta Black Beaty ili sorte jednake osetljivosti), ali samo biljke u fazi 2-3 lista do potpunog razvoja trećeg pravog lista. Simptomi na plavom patlidžanu su slabiji i sporije se razvijaju, pa se preporučuje korišćenje mladih biljaka paradajza.
Rasporediti 100 μl ekstrakta uzorka na biljke za testiranje.
Inokulacija injekcijom
Stabljike inokulisati neposredno iznad kotiledona injekcijom s tankom iglom (ne manjom od 23G). Uzorak podeliti na biljke, tako da svaka biljka dobije odgovarajuću količinu.
Inokulacija zarezivanjem
Držeći biljku među prstima, pipetom naneti kapljicu (oko 5-10 μl) resuspendovanog taloga na stabljiku i to između kotiledona i prvog lista. Sterilnim skalpelom napraviti dijagonalni rez, dug oko 1 cm i dubok oko 2/3 debljine stabljike, počevši od nanesene kapljice resuspendovanog taloga. Čvrsto zatvoriti rez sterilnim vazelinom iz šprica.
Pozitivna kontrola: koristeći istu metodu inokulisati 5 biljaka suspenzijom od 105 do 106 ćelija po ml vode poznate kulture R. solanacearum, virulentnog soja biovara 2.
Negativna kontrola: inokulisati 5 biljaka koristeći sterilni pelet pufer (pufer za rastvaranje taloga). Biljke za pozitivne i negativne kontrole odvojiti od ostalih biljaka.
Biljke gajiti u karantinskim prostorijama do četiri sedmice na 25 do 30°C, uz dovoljnu količinu svetla i visoku vlažnost i adekvatno zalivati kako bi se sprečilo nakupljanje vode ili uvenuće zbog nedostatka vode. U cilju sprečavanja unakrsne kontaminacije, biljke pozitivne i negativne kontrole gajiti na jasno odvojenim stolovima u stakleniku ili policama u komori za rast ili, u slučaju da je prostor ograničen, pobrinuti se da su biljke jasno odvojene između pojedinih postupaka u toku izvođenja procedure. Ako se biljke za različite uzorke moraju gajiti blizu jedna drugoj, razdvojite ih pogodnim platnom. Paziti da ne dođe do unakrsne kontaminacije prilikom prihranjivanja, zalivanja, pregledanja i svakog drugog postupka s biljkama. Od ključne važnosti je da u staklenicima i komorama za gajenje ne bude nikakvih insekata jer oni mogu preneti bakteriju s uzorka na uzorak. Pratiti pojavu simptoma uvenuća, epinastije, hloroze i/ili zaostajanje u porastu.
Iz zaraženih biljaka izolovati (Poglavlje IV. tačka 1. podtačka 1.3. ovog priloga) i identifikovati prečišćene kulture R. solanacearum (Poglavlje VIII. tačka 2. ovog priloga).
Ako se posle 3 nedelje ne pojave simptomi, obaviti IF/PCR/izolaciju na uzorku delova stabljika dužine 1 cm sa svake biljke za testiranje. Ako test bude pozitivan, primeniti metod zasejavanja razređenja na hranljivu podlogu.
Identifikovati sve prečišćene kulture R. solanacearum.
Tumačenje rezultata biološkog testa
Validni rezultati biološkog testa se dobijaju ako biljke u pozitivnoj kontroli pokazuju tipične simptome, ako se iz tih biljaka može ponovo izdvojiti bakterija i ako na biljkama negativne kontrole ne dođe do pojave simptoma.
Biološki test je negativan ako testirane biljke nisu zaražene R. solanacearum, a pod uslovom da je utvrđeno prisustvo R. solanacearum u pozitivnim kontrolama.
Biološki test je pozitivan ako su testirane biljke zaražene R. solanacearum.
Identifikacija čiste kulture dobijenih izolata R. solanacearum vrši se korišćenjem najmanje dva od navedenih testova koji se zasnivaju na različitim biološkim principima. Prema potrebi, uključiti poznate referentne izolate za svaki test (Poglavlje XI. ovog priloga).
2.1. Odgajivački i enzimski testovi za identifikaciju
Fenotipska svojstva univerzalno prisutna ili odsutna kod bakterije R. solanacearum utvrditi prema metodama Lelliott i Stead (1987), Klement i sar. (1990), Schaad i sar. (2001).
Testovi |
Očekivani rezultati |
Stvaranje fluorescentnog pigmenta |
- |
Granule poli-β-hidroksibutirata |
+ |
Oksidacijski/Fermentacijski (O/F) test |
O+/F- |
Aktivnost katalaze |
+ |
Test oksidaze po Kovacu |
+ |
Redukcija nitrata |
+ |
Korišćenje citrata |
+ |
Rast na 40°C |
- |
Rast u 1% NaCl |
+ |
Rast u 2% NaCl |
- |
Aktivnost arginin-dihidrolaze |
- |
Razlaganje želatina |
- |
Hidroliza skroba |
- |
Hidroliza eskulina |
- |
Stvaranje levana |
- |
Pripremiti suspenziju od približno 106 ćelija po ml u IF puferu.
Pripremiti dvostruka razređenja rastvora pogodnog antiseruma. (vidi web stranicu: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
Primeniti IF postupak (Poglavlje VIII. tačka 1. podtačka 1.5. ovog priloga).
IF test je pozitivan ako je IF titar kulture jednak titru pozitivne kontrole.
Napomena:
Pri primeni samo 2 testa identifikacije, ne primenjivati drugi serološki test uz ovaj.
Pripremite suspenziju od oko 108 ćelija po ml u 1 x PBS.
Sprovesti odgovarajući postupak ELISA sa monoklonalnim antitelima specifičnim za bakteriju R. solanacearum.
ELISA test je pozitivan ako je ELISA vrednost očitanja kulture jednaka najmanje polovini vrednosti pozitivne kontrole.
Pripremiti suspenziju od približno 106 ćelija po ml u Ultra čistoj vodi.
Zagrejati 100 μl suspenzije ćelija bakterije u zatvorenim epruvetama u termobloku ili u vrelom vodenom kupatilu četiri minuta na 100°C. Do upotrebe uzorci se mogu čuvati na -16 do -24°C.
Upotrebiti odgovarajuće PCR procedure za umnožavanje specifičnih fragmenata R. solanacearum [npr. Seal i sar. (1993), Pastrik & Maiss (2000), Pastrik i sar. (2002), Boudazin i sar. (1999), Opina i sar. (1997), Weller i sar. (1999)].
Identifikacija R. solanacearum je pozitivna ako su PCR produkti iste veličine i imaju isti polimorfizam dužine restrikcionih fragmenata kao i pozitivni kontrolni izolat.
Pripremiti suspenziju od približno 106 ćelija po ml Ultra čiste vode.
Primeniti FISH postupak ((Poglavlje VIII. tačka 1. podtačka 1.7. ovog priloga) sa najmanje dve oligo-probe specifične za R. solanacearum (Poglavlje XV. ovog priloga).
FISH test je pozitivan ako su postignute reakcije kulture i pozitivne kontrole jednake.
2.6. Profiliranje masnih kiselina (FAP)
Kulturu gajiti na triptikaza-soja-agaru (Oxoid) 48 sati na 28°C.
Primeniti odgovarajući FAP postupak (Janse, 1991; Stead, 1992).
FAP test je pozitivan ako je profil testirane kulture identičan profilu pozitivne kontrole. Prisustvo karakterističnih masnih kiselina: 14:0 3OH, 16:0 2OH, 16:1 2OH i 18:1 2OH, i odsustvo 16:0 3OH u velikoj meri ukazuju na Ralstonia sp.
2.7. Metode karakterizacije soja
Kod svakog novog slučaja izolacije R. solanacearum, preporučuje se obavljanje karakterizacija soja, primenom jedne od sledećih metoda.
Prema potrebi, u svaki korišćeni test uključiti poznate referentne sojeve.
2.7.1. Određivanje biovara
R. solanacearum se deli na biovare na temelju sposobnosti korišćenja i/ili oksidacije tri disaharida i tri heksozna alkohola (Hayward, 1964 i Hayward i sar., 1990). Hranljive podloge za određivanje biovara opisane su u Poglavlju X. ovog priloga. Test se može uspešno obaviti inokulisanjem podloge čistim kulturama izolata R. solanacearum i inkubiranjem na 28°C. Ako se podloga rasporedi u 96 sterilnih bunarčića na odgovarajućoj ploči (200 μl po bunarčiću), u roku od 72 sata može se uočiti promena boje od maslinasto zelene do žute, što označava pozitivan rezultat testa.
|
Biovar |
||||
|
1 |
2 |
3 |
4 |
5 |
Korišćenje: |
|
|
|
|
|
Maltoza |
- |
+ |
+ |
- |
+ |
Laktoza |
- |
+ |
+ |
- |
+ |
D (+) celobioza |
- |
+ |
+ |
- |
+ |
Manitol |
- |
- |
+ |
+ |
+ |
Sorbitol |
- |
- |
+ |
+ |
- |
Dulcitol |
- |
- |
+ |
+ |
- |
Biovar 2 se deli na podfenotipove pomoću dodatnih testova.
|
Biovar 2A |
Biovar 2A |
Biovar 2T |
Korišćenje trehaloze |
- |
+ |
+ |
Korišćenje mezo-inozitola |
+ |
- |
+ |
Korišćenje D-riboze |
- |
- |
+ |
Pektolitička aktivnost (1) |
slaba |
slaba |
visoka |
_______________
(1) Videti Lelliot i Stead (1987)
2.7.2. Genomski otisak prsta
Molekularna diferencijacija sojeva u kompleksu R. solanacearum može se postići primenom nekoliko metoda, uključujući sledeće:
Analiza polimorfizma dužine restrikcionih fragmenata (RFLP) (Cook i sar., 1989).
PCR ponavljajućih nizova, korišćenjem prajmera REP, BOX i ERIC (Louws i sar., 1995, Smith i sar., 1995).
Analiza polimorfizma dužine umnoženih fragmenata (AFLP) (Van der Wolf i sar., 1998).
Specifični PCR prajmeri (Pastrik i sar., 2002; videti Poglavlje XIV. ovog priloga) mogu se upotrebiti za diferencijaciju sojeva koji pripadaju grupi 1 (biovari 3, 4 i 5) i grupi 2 (biovari 1, 2A i 2T) bakterije R. solanacearum, kako je prvobitno bilo utvrđeno metodom RFLP (Cook i sar., 1989) i sekvencioniranjem 16S rDNK (Taghavi i sar., 1996).
Test provere patogenosti se koristi za konačno potvrđivanje prisustva R. solanacearum i za procenu virulentnosti kultura identifikovanih kao R. solanacearum.
Pripremiti inokulum od približno 106 ćelija po ml iz kultura izolata koji se testira, starosti 24 do 48 sati i odgovarajućeg izolata pozitivne kontrole R. solanacearum (npr. NCPPB 4156 = PD 2762 = CFBP 3857; Poglavlje XI. ovog priloga).
Inokulisati stabljike 5 do 10 mladih sejanaca osetljivih sorti paradajza ili plavog patlidžana u fazi 3 prva lista (Poglavlje VIII. tačka 1. podtačka 1.9. ovog priloga).
Inokulisane sejance inkubirati do dve nedelje na 25 do 28°C uz visoku relativnu vlažnost i adekvatno zalivati kako bi se izbeglo nakupljanje vode ili stres od suše.
Kod inokulacije čistim kulturama, tipično uvenuće se pojavljuje u roku od 14 dana. Ako posle ovog perioda simptomi nisu prisutni, dobijena kultura se ne može potvrditi kao patogeni izolat R. solanacearum.
Pojavu simptoma uvenuća i/ili epinastije, hloroze i zaostajanja u porastu.
Izolaciju iz biljaka sa simptomima izvršiti odstranjivanjem dela stabljike dužine 2 cm iznad mesta inokulacije koji se zatim usitni i rastvori u maloj količini sterilne destilovane vode ili 50 mM fosfatnom puferu (Poglavlje XII. ovog priloga). Izolacija patogena se potom vrši razmazom dobijenog macerata na odgovarajuću selektivnu podlogu (Poglavlje X. ovog priloga), koja se inkubira 48 do 72 sata na 28°C posle čega se prati rast kolonija tipičnih za bakteriju R. solanacearum.
LABORATORIJE UKLJUČENE U OPTIMIZACIJU I VALIDACIJU PROTOKOLA
Laboratorija (1) |
Mesto |
Država |
Agentur für Gesundheit und Ernährungssicherheit |
Beč i Linz |
Austrija |
Departement Gewasbescherming |
Merelbeke |
Belgija |
Plantedirektoratet |
Lyngby |
Danska |
Central Science Laboratory |
York |
Engleska |
Scottish Agricultural Science Agency |
Edinburgh |
Škotska |
Laboratoire national de la protection des végétaux, unité de bactériologie |
Angers |
Francuska |
Laboratoire national de la protection des végétaux, Station de quarantaine de la pomme de terre |
Le Rheu |
Francuska |
Biologische Bundesanstalt |
Kleinmachnow |
Nemačka |
Pflanzenschutzamt Hannover |
Hannover |
Nemačka |
State Laboratory |
Dublin |
Irska |
Dipartimento di Scienze e Tecnologie Agroambientali |
Bologna |
Italija |
Regione Veneto Unit - Periferica per i Servizi Fitosanitari |
Verona |
Italija |
Nederlandse Algemene Keuringsdienst |
Emmeloord |
Holandija |
Plantenziektenkundige Dienst |
Wageningen |
Holandija |
Direcção-Geral de Protecção das Culturas |
Lisabon |
Portugal |
Centro Diagnostico de Aldearrubia |
Salamanca |
Španija |
Instituto Valenciano de Investigaciones Agrarias |
Valencia |
Španija |
Swedish University of Agricultural Sciences |
Uppsala |
Švedska |
_______________
(1) za kontakt sa naučnicima: videti web stranicu: http://forum.europa.eu.int/Public/irc/sanco/Home/main
HRANLJIVE PODLOGE ZA IZOLACIJU I GAJENJE BAKTERIJE R. SOLANACEARUM
Hranljivi agar (Difco) 23,0 g
Destilovana voda 1,0 L
Rastvoriti sastojke i sterilisati u autoklavu na 121°C 15 minuta.
1.2. Agar sa kvascem, peptonom i glukozom (YPGA)
Ekstrakt kvasca (Difco) 5,0 g
Bacto pepton (Difco) 5,0 g
D(+) glukoza (monohidrat) 10,0 g
Agar Bacto (Difco) 15,0 g
Destilovana voda 1,0 L
Rastvoriti sastojke i sterilisati u autoklavu na 121°C 15 minuta.
1.3. Agar sa saharozom i peptonom (SPA)
Saharoza 20,0 g
Bacto pepton (Difco) 5,0 g
K2HPO4 0,5 g
MgSO4 7H2O 0,25 g
Agar Bacto (Difco) 15,0 g
Destilovana voda 1,0 L
pH 7,2-7,4
Rastvoriti sastojke i sterilisati u autoklavu na 121°C 15 minuta.
1.4. Kelmanova tetrazolium-podloga
Casamino kiseline (Difco) 1,0 g
Bacto pepton (Difco) 10,0 g
Dekstroza 5,0 g
Agar Bacto (Difco) 15,0 g
Destilovana voda 1,0 L
Rastvoriti sastojke i sterilisati u autoklavu na 121°C 15 minuta.
Ohladiti na 50°C i dodati rastvor 2,3,5-trifenil-tetrazolium-hlorida (Sigma), sterilisanog filtriranjem, kako bi se dobila konačna koncentracija od 50 mg/l.
2. Potvrđene i odobrene selektivne hranljive podloge
SMSA podloga (Englebrecht, 1994, izmene prema Elphinstone i sar., 1996)
Osnovna podloga
Casamino kiseline (Difco) 1,0 g
Bacto pepton (Difco) 10,0 g
Glicerol 5,0 ml
Agar bacto (Difco) (vidi napomenu 2) 15,0 g
Destilovana voda 1,0 L
Rastvoriti sastojke i sterilisati u autoklavu na 121°C 15 minuta.
Ohladite na 50°C i dodajte osnovni vodeni rastvor sledećih sastojaka, sterilisan filtriranjem, kako biste dobili predviđene konačne koncentracije:
Kristal violet (Sigma) 5 mg na L
Polimiksin-B-sulfat (Sigma P-1004) 600 000 U (oko 100 mg) na L
Bacitracin (Sigma B-0125) 1 250 U (oko 25 mg) na L
Hloramfenikol (Sigma C-3175) 5 mg na L
Penicilin-G (Sigma P-3032) 825 U (oko 0,5 mg) na L
2,3,5-trifenil-tetrazolium-hlorid (Sigma) 50 mg na L
Napomena:
Drugi reagensi u odnosu na gore navedene mogu uticati na rast bakterije R. solanacearum.
Umesto agara Bacto (Difco) može se koristiti agar Oxoid br. 1. Rast R. solanacearum je u tom slučaju sporiji, ali se može umanjiti i rast konkurentnih saprofita. Za formiranje tipičnih kolonija bakterije R. solanacearum možda će trebati 1 do 2 dana više, a crveno obojenje može biti svetlije i difuznije nego na agaru Bacto.
Povećanjem koncentracije bacitracina na 2500 U/L umanjuje se porast populacije konkurentnih bakterija, bez uticaja na rast bakterije R. solanacearum.
Hranjivu podlogu i osnovni rastvor antibiotika čuvati na 4°C na tamnom mestu i upotrebiti u roku od mesec dana.
Pre upotrebe, sa podloga se uklanja površinska kondenzacija.
Podloge se ne smeju preterano osušiti.
Nakon pripremanja svake nove serije hranljive podloge, treba obaviti kontrolu kvaliteta podloge zasejavanjem suspenzije referentne kulture R. solanacearum (Poglavlje XI. ovog priloga) i praćenjem stvaranja tipičnih kolonija posle dva do pet dana inkubacije na 28°C.
3. Potvrđene i odobrene hranljive podloge za obogaćivanje
SMSA tečna podloga (Elphinstone i sar., 1996)
Pripremiti kao za selektivnu podlogu SMSA, ali izostaviti agar Bacto i 2,3,5-trifenil-tetrazol-hlorid.
Modifikovana Wilbrink tečna podloga (Caruso i sar., 2002)
Saharoza 10 g
Proteoza pepton 5 g
K2HPO4 0,5 g
MgSO4 0,25 g
NaNO3 0,25 g
Destilovana voda 1 L
Sterilizovati u autoklavu na 121°C 15 minuta i ohladiti na 50°C.
Dodati osnovni rastvor antibiotika kao za SMSA tečnu podlogu.
STANDARDIZOVANI KONTROLNI MATERIJALI
1. Standardizovani kontrolni materijali dostupni na tržištu
Preporučuje se korišćenje sledećih bakterijskih izolata kao standardnog referentnog materijala bilo za pozitivne kontrole (Tabela 1) ili tokom optimizacije testova u cilju izbegavanja unakrsnih reakcija (Tabela 2). Svi su sojevi dostupni na tržištu i mogu se nabaviti kod:
1) National Collection of Plant Pathogenic Bacteria (NCPPB), Central Science Laboratory, York, UK;
2) Culture Collection of the Plant Protection Service (PD), Wageningen, Holandija;
3) Collection française de bactéries phytopathogènes (CFBP), INRA - Station de phytobactériologie, Angers, Francuska.
Tabela 1. SMT popis referentnih izolata bakterije R. solanacearum
Oznaka NCPPB |
Br. SMT |
Ostale oznake |
Država porekla |
Biovar |
NCPPB 4153 |
6 |
CFBP 4582, Pr 3020, EURS11 |
Egipat |
2 |
NCPPB 4154 |
10 |
CFBP 4585, 550, EURS21 |
Turska |
2 |
NCPPB 3857 |
12 |
CFBP 4587, Pr 1140, EURS26 |
Engleska |
2 |
NCPPB 1584 |
23 |
CFBP 4598, EURS49 |
Kipar |
2 |
NCPPB 2505 |
24 |
CFBP 4599, EURS50 |
Švedska |
2 |
NCPPB 4155 |
26 |
CFBP 4601, 502, EURS55 |
Belgija |
2 |
NCPPB 4156* |
71* |
PD 2762, CFBP 3857 |
Holandija |
2 |
NCPPB 4157 |
66 |
LNPV 15.59 |
Francuska |
2 |
NCPPB 4158 |
39 |
CFBP 4608, Port 448, EURS80 |
Portugalija |
2 |
NCPPB 4160 |
69 |
IVIA-1632-2 |
Španija |
2 |
NCPPB 4161 |
76 |
B3B |
Nemačka |
2 |
NCPPB 325 |
41 |
CFBP 2047, KEL60-1, R842 |
SAD |
1 |
NCPPB 3967 |
42 |
CFBP 4610, R285, GONg7 |
Kostarika |
1 |
NCPPB 4028 |
43 |
CFBP 4611, R303/571, CIP310, SEQ205 |
Kolumbija |
2 |
NCPPB 3985 |
44 |
CFBP 4612, R578, CIP312 |
Peru |
2T |
NCPPB 3989 |
45 |
CFBP 4613, R568, CIP226 |
Brazil |
2T |
NCPPB 3996 |
46 |
CFBP 3928, R276/355, CIP72, SEQ225 |
Peru |
3 |
NCPPB 3997 |
47 |
CFBP 4614, R280/363, CIP49, HAY0131a |
Australija |
3 |
NCPPB 4029 |
48 |
CFBP 4615, R297/349, CIP121, CMIb2861 |
Šri Lanka |
4 |
NCPPB 4005 |
49 |
CFBP 4616, R470 |
Filipini |
4 |
NCPPB 4011 |
50 |
CFBP 4617, R288, HEmps2 |
Kina |
5 |
* Upotrebljavati kao standardni referentni soj bakterije R. solanacearum biovar 2 (rasa 3)
Napomena:
Autentičnost gore navedenih sojeva može se garantovati samo ako su nabavljeni iz autentične zbirke kultura.
Tabela 2. SMT popis referentnih serološki ili genetski srodnih bakterija za upotrebu pri optimizaciji testova detekcije
Oznaka NCPPB |
Br. SMT |
Ostale oznake |
Identifikacija |
NCPPB 4162 |
51 |
CFBP 1954 |
Bacillus polymyxa(1) |
NCPPB 4163 |
52 |
CFBP 1538 |
Pseudomonas marginalis pv. marginalis(1) |
NCPPB 4164 |
- |
CFBP 2227 |
Burkholderia cepacia(2) |
NCPPB 4165 |
- |
CFBP 2459 |
Ralstonia pickettii (2) |
NCPPB 4166 |
58 |
CFBP 3567 |
Ralstonia pickettii(1) |
|
|
CSL Pr1150 |
|
NCPPB 4167 |
60 |
CFBP 4618 |
Ralstonia sp.(1) |
|
|
D 2778 |
|
NCPPB 1127 |
53 |
CFBP 3575 |
Burkholderia andropogonis(1) |
NCPPB 353 |
54 |
CFBP 3572 |
Burkholderia caryophylli(1) |
NCPPB 945 |
55 |
CFBP 3569 |
Burkholderia cepacia(1) |
NCPPB 3708 |
56 |
CFBP 3574 |
Burkholderia glumae(1) |
NCPPB 3590 |
57 |
CFBP 3573 |
Burkholderia plantarii(1) |
NCPPB 3726 |
59 |
CFBP 3568 |
Banana Blood Disease Bacterium(1) (2) (3) |
NCPPB 4168 |
61 |
CFBP 4619 |
Enterobacter sp.(1) |
|
|
IPO S339 |
|
NCPPB 4169 |
62 |
IPO 1695 |
Enterobacter sp.(1) |
NCPPB 4170 |
63 |
CFBP 4621 |
Ochrobactrum anthropi(1) (2) |
|
|
IPO S306 |
|
NCPPB 4171 |
64 |
CFBP 4622 |
Curtobacterium sp. (1) (2) |
|
|
IPO 1693 |
|
NCPPB 4172 |
65 |
IPO 1696a |
Pseudomonas sp.(1) |
NCPPB 4173 |
- |
PD 2318 |
Aureobacterium sp.(2) |
NCPPB 4174 |
81 |
IVIA 1844.06 |
Flavobacterium sp.(1) (2) |
_______________
(1) Soj koji u serološkim testovima (IF i/ili ELISA) može unakrsno reagovati sa poliklonalnim serumima.
(2) Soj od koga se u nekim laboratorijima može umnožiti PCR produkt dužine slične dužini koja se očekuje pri upotrebi specifičnih prajmera OLI-1 i Y-2 (Poglavlje XIV. ovog priloga)
(3) U većini testova bi mogao dati unakrsnu reakciju, ali je poznato da se javlja samo na bananama u Indoneziji.
Dole navedeni standardni kontrolni materijal može se dobiti iz zbirke kultura NCPPB.
Liofilizovane granule ekstrakta krompira iz 200 zdravih krtola krompira kao negativna kontrola za sve testove.
Liofilizovane granule ekstrakta krompira iz 200 zdravih krtola krompira sa 103 do 104 i 104 do 106 ćelija R. solanacearum biovar 2 (soj NCPPB 4156 = PD 2762 = CFBP 3857) kao pozitivna kontrola za serološke i PCR testove. S obzirom da liofilizacija utiče na vitalnost ćelija, one nisu prikladne kao standardna kontrola za izolaciju ili biološke testove.
Formalinom fiksirane suspenzije bakterije R. solanacearum biovar 2 (soj NCPPB 4156 = PD 2762 = CFBP 3857) sa 106 ćelija/ml kao pozitivna kontrola za serološke testove.
2. Priprema pozitivnih i negativnih kontrola za osnovne testove provere (PCR/IF i FISH)
Napraviti suspenziju kulture virulentnog soja R. solanacearum rasa 3/biovar 2 (npr. soj NCPPB 4156 = PD 2762 = CFBP 3857) gajene 48 sati na SMSA osnovnoj podlozi u 10 mM fosfatnom puferu koncentracije približno 2 x 108 cfu/ml. To je obično slabo mutna suspenzija optičke gustine 0,15 na 600 nm.
Izvaditi konus pupčanog dela iz 200 krtola bele sorte krompira za koje je poznato da nisu zaražene bakterijom R. solanacearum.
Obraditi konuse uobičajenom metodom i resuspendovati talog u 10 ml.
Pripremiti 10 sterilnih mikroepruveta od 1,5 ml sa 900 μl resuspendovanog taloga.
U prvu mikroepruvetu dodati 100 μl suspenzije R. solanacearum. i izmešati na vorteksu. U sledećih pet mikroepruveta pripremiti decimalna razređenja bakterijske suspenzije.
Ovih šest mikroepruveta sa zaraženim ekstraktom koristiti za pozitivnu, a četiri mikroepruvete sa nezaraženim ekstraktom koristiti za negativnu kontrolu. U skladu s tim, označiti mikroepruvete.
U mikroepruvetama od 1,5 ml pripremiti alikvote od 100 μl tako da se dobije devet kopija svakog kontrolnog uzorka. Do upotrebe čuvati na -16 do -24°C.
Prisustvo i količinu prisutne R. solanacearum u kontrolnim uzorcima prvo potvrditi IF testom.
Za PCR test, izvršiti ekstrakciju DNK u pozitivnim i negativnim kontrolnim uzorcima za svaku seriju uzoraka za testiranje.
Za IF i FISH testove, izvršiti testiranje pozitivnih i negativnih kontrolnih uzoraka za svaku seriju uzoraka za testiranje. Kod IF, FISH i PCR testova, potrebno je utvrditi prisustvo R. solanacearum u koncentraciji od najmanje 103 i 104 ćelija/ml kod pozitivnih kontrola i ni u jednoj negativnoj kontroli.
PUFERI ZA TEST PROCEDURE
Sterilisani puferi koji nisu otvarani mogu se čuvati do jedne godine.
1.1. Ekstrakcioni pufer (50 mM fosfatni pufer, pH 7,0)
Ovaj pufer se koristi za ekstrakciju bakterije iz biljnog tkiva homogenizacijom ili trešenjem.
Na2HPO4 (anhidrovani) 4,26 g
KH2PO4 2,72 g
Destilovana voda 1,00 L
Rastvoriti sastojke, proveriti pH i sterilisati u autoklavu na 121°C 15 minuta.
Sledeći sastojci mogu biti korisni:
|
Namena |
Količina (po L) |
Pahuljice Lubrol |
Deflokulant* |
0,5 g |
DC silikon protiv stvaranja pene |
Sredstvo protiv stvaranja pene* |
1,0 ml |
Tetranatrijum pirofosfat |
Antioksidant |
1,0 g |
Polivinilpirolidon-40000 (PVP-40) |
Vezivanje PCR inhibitora |
50 g |
* Za upotrebu kod metode ekstrakcije homogenizacijom
1.2. Pelet pufer (Pufer za rastvaranje taloga-10 mM fosfatni pufer, pH 7,2)
Ovaj pufer se koristi za resuspendovanje i razređivanje ekstrakta konusa izvađenih iz pupčanih delova krtola krompira, posle koncentrovanja taloga centrifugiranjem.
Na2HPO4 x 12H2O |
2,7 g |
NaH2PO4 x 2H2O |
0,4 g |
Destilovana voda |
1,00 L |
Rastvoriti sastojke, proveriti pH i sterilisati u autoklavu na 121°C 15 minuta.
2.1. IF pufer (10 mM fosfatni pufer s dodatkom soli (PBS), pH 7,2)
Ovaj pufer se koristi za razređivanje antitela.
Na2HPO4 x 12H2O |
2,7 g |
NaH2PO4 x 2H2O |
0,4 g |
NaCl |
8,0 g |
Destilovana voda |
1,0 L |
Rastvoriti sastojke, proveriti pH i sterilisati u autoklavu na 121°C 15 minuta.
Ovaj pufer se koristi za ispiranje IF pločica.
IF puferu dodati 0,1% Tween 20.
2.3. Fosfatni pufer s glicerolom pH 7,6
Ovaj pufer se koristi kao rastvor za prekrivanje bunarčića u IF testu kako bi se pojačala fluorescencija.
Na2HPO4 x 12H2O 3,2 g
NaH2PO4 x 2H2O 0,15 g
Glicerol 50 ml
Destilovana voda 100 ml
Komercijalni rastvori npr. Vectashield® (Vector Laboratories) ili Citifluop® (Leica).
3. Puferi za indirektni ELISA test
3.1. Pufer za oblaganje dvostruke jačine, pH 9,6
Na2CO3 |
6,36 g |
NaHCO3 |
11,72 g |
Destilovana voda |
1.0 L |
Rastvoriti sastojke, proveriti pH i sterilisati u autoklavu na 121°C 15 minuta.
Kao antioksidans može se dodati natrijum sulfit (0,2%).
3.2. 10X fosfatni pufer sa dodatkom soli (PBS), pH 7,4
NaCl |
80,0 g |
KH2PO4 |
2,0 g |
Na2HPO4·12H2O |
29,0 g |
KCl |
2,0 g |
Destilovana voda |
1,0 L |
10X PBS |
100 ml |
10% Tween 20 |
5 ml |
Destilovana voda |
895 ml |
3.4. Pufer za blokiranje antitela (mora biti sveže pripremljen)
10X PBS |
10,0 ml |
Polivinilpirolidon-44000 (PVP-44) |
2,0 g |
10% Tween 20 |
0,5 ml |
Mleko u prahu |
0,5 g |
Destilovana voda |
Dopunite do 100 ml |
3.5. Rastvor supstrata alkalne fosfataze, pH 9,8
Dietanolamin |
97 ml |
Destilovana voda |
800 ml |
Pomešati i podesiti pH na 9,8 koncentrovanom HCl. Dopuniti destilovanom vodom do 1 litra.
Dodajte 0,2 g MgCl2.
Rastvorite dve tablete supstrata fosfataze od 5 mg (Sigma) na 15 ml rastvora.
4.1. Pufer za oblaganje, pH 9,6
Na2CO3 |
1,59 g |
NaHCO3 |
2,93 g |
Destilovana voda |
1000 ml |
Rastvoriti sastojke i podesiti pH na 9,6.
4.2. 10X fosfatni pufer sa dodatkom soli (PBS), pH 7,2 do 7,4
NaCl |
80,0 g |
NaH2PO4·2H2O |
4,0 g |
Na2HPO4·12H2O |
27,0 g |
Destilovana voda |
1000 ml |
10X PBS |
50 ml |
10% Tween |
20 5 ml |
Destilovana voda |
950 ml |
Dietanolamin |
100 ml |
Destilovana voda |
900 ml |
Pomešati i podesiti pH na 9,8 koncentrovanom HCl.
ODREĐIVANJE NIVOA KONTAMINACIJE U IF I FISH TESTOVIMA
1. Izbrojati prosečan broj tipičnih fluorescentnih ćelija po vidnom polju (c)
s = πi2/4G2K2
gde je
i = koeficijent polja (varira od 8 do 24 zavisno od tipa okulara)
K = koeficijent tube (cevi) (1 ili 1,25)
G = povećanje objektiva (100x, 40x itd.).
2. Izračunati broj tipičnih fluorescentnih ćelija po bunarčiću mikroskopske pločice (C)
C = c x S/s
gde je
S = površina bunarčića IF pločice sa više bunarčića i
s = površina polja objektiva.
3. Izračunati broj tipičnih fluorescentnih ćelija po ml resuspendovanog taloga (N)
N = C x 1000/y x F
gde je
y = zapremina resuspendovanog taloga u svakom bunarčiću, i
F = faktor razređenja resuspendovanog taloga.
POTVRĐENI I ODOBRENI PROTOKOLI I REAGENSI ZA PCR
Napomena:
Preliminarna testiranja treba da omoguće ponovljivu detekciju od najmanje 103 do 104 ćelija R. solanacearum po ml ekstrakta uzorka.
Tokom preliminarnih testiranja ne sme doći do pojave lažno pozitivnih rezultata kod odabranih bakterijskih izolata.
(Poglavlje XI. ovog priloga)
1. Protokol za multipleks PCR sa unutrašnjom PCR kontrolom (Seal i sar., 1993)
1.1. Oligonukleotidni prajmeri
Uzvodni prajmer OLI-1 5'-GGG GGT AGC TTG CTA CCT GCC-3'
Nizvodni prajmer Y-2 5'-CCC ACT GCT GCC TCC CGT AGG AGT-3'
Očekivana dužina umnoženog proizvoda iz DNK bakterije R. solanacearum = 288 bp (par prajmera PSA).
Reagens |
Količina po reakciji |
Konačna koncentracija |
Sterilna Ultra čista voda |
17,65 μl |
|
10 x PCR pufer1 (15 mM MgCl2) |
2,5 μl |
1 X (1,5 mM MgCl2) |
Smesa d-NTP (20 mM) |
0,25 μl |
0,2 mM |
Prajmer OLI-1 (20 μM) |
1,25 μl |
1 μM |
Prajmer Y-2 (20 μM) |
1,25 μl |
1 μM |
Taq polimeraza (5 U/μl)1 |
0,1 μl |
0,5 U |
Zapremina uzorka |
2,0 μl |
|
Ukupna zapremina |
25,0 μl |
|
_______________
1) validacija metode je izvršena uz korišćenje Taq polimeraze Perkin Elmer (AmpliTaq ili Gold) i Gibco BRL.
Izvesti sledeći program:
1 ciklus: 2 minuta na 96°C (denaturacija lanca DNK)
35 ciklusa: 20 sekundi na 94°C (denaturacija lanca DNK)
20 sekundi na 68°C (vezivanje prajmera)
30 sekundi na 72°C (hibridizacija)
1 ciklus: 10 minuta na 72°C (konačno produžavanje) držati na 4°C
Napomena:
Optimalni uslovi korišćenja ovog programa su definisani za korišćenje na PCR Perkin Elmer 9600 thermal cycler-u. Modifikacija trajanja koraka ciklusa 35 je verovatno potrebna u slučaju upotrebe drugih modela thermal cycler-a.
1.4. Analiza produkta umnožavanja restrikcionim enzimom
PCR proizvodi umnoženi iz DNK R. solanacearum ispoljavaju karakteristične polimorfizme u dužini restrikcionih fragmenata sa enzimom Ava II posle inkubacije na 37°C.
2. Protokol za PCR prema Pastrik i Maiss (2000)
2.1. Oligonukleotidni prajmeri
Uzvodni prajmer Ps-1 5'- agt cga acg gca gcg ggg g -3'
Nizvodni prajmer Ps-2 5'- ggg gat ttc aca tcg gtc ttg ca -3'
Očekivana dužina umnoženog proizvoda iz lanca DNK bakterije R. solanacearum = 553 bp.
Reagens |
Količina po reakciji |
Konačna koncentracija |
Sterilna Ultra čista voda |
16,025 μl |
|
10 x PCR pufer1 (15 mM MgCl2) |
2,5 μl |
1 X (1,5 mM MgCl2) |
BSA (frakcija V) (10%) |
0,25 μl |
0,1% |
Smesa d-NTP (20 mM) |
0,125 μl |
0,1 mM |
Prajmer Ps-1 (10 μM) |
0,5 μl |
0,2 μM |
Prajmer Ps-2 (10 μM) |
0,5 μl |
0,2 μM |
Taq polimeraza (5 U/μl)(1) |
0,1 μl |
0,5 U |
Zapremina uzorka |
5,0 μl |
|
Ukupna zapremina |
25,0 μl |
|
______________
(1) validacija metode je izvršena uz korišćenje Taq polimeraze Perkin Elmer (AmpliTaq ili Gold) i Gibco BRL.
Napomena:
Optimalni uslovi korišćenja ovog programa su definisani za korišćenje na PCR MJ Research PTC 200 thermal cycler-u sa Gibco Taq polimerazom. Pri istim koncentracijama može se koristiti i Perkin Elmer AmpliTaq i pufer.
Izvesti sledeći program:
1 ciklus: |
5 minuta na 95°C (denaturacija lanca DNK) |
35 ciklusa: |
30 sekundi na 95°C (denaturacija lanca DNK) |
30 sekundi na 68°C (vezivanje prajmera) |
|
45 sekundi na 72°C (produžavanje kopije) |
|
1 ciklus: |
5 minuta na 72°C (konačno produžavanje) držati na 4°C |
Napomena:
Optimalni uslovi korišćenja ovog programa su definisani za korišćenje na PCR MJ Research PTC 200 thermal cycler-u. Modifikacija trajanja koraka ciklusa 35 je možda potrebna u slučaju upotrebe drugih modela thermal cycler-a.
2.4. Analiza produkta umnožavanja restrikcionim enzimom
PCR proizvodi umnoženi iz DNK R. solanacearum ispoljavaju karakteristične polimorfizme u dužini restrikcionih fragmenata sa enzimom Taq I posle inkubacije na 65°C 30 minuta. Restrikcioni fragmenti dobijeni iz specifičnog fragmenta R. solanacearum su veličine 457 bp i 96 bp.
3. Protokol za multipleks PCR sa unutrašnjom PCR kontrolom (Pastrik i sar., 2000)
3.1. Oligonukleotidni prajmeri
Uzvodni prajmer RS-1-F 5'-ACT AAC GAA GCA GAG ATG CAT TA-3'
Nizvodni prajmer RS-1-R 5'-CCC AGT CAC GGC AGA GAC T-3'
Uzvodni prajmer NS-5-F 5'-AAC TTA AAG GAA TTG ACG GAA G-3'
Nizvodni prajmer NS-6-R 5'-GCA TCA CAG ACC TGT TAT TGC CTC-3'
Očekivana dužina umnoženog proizvoda iz DNK R. solanacearum = 718 bp (par prajmera RS).
Očekivana dužina umnoženog proizvoda iz 18S rRNK unutrašnje kontrole = 310 bp (par prajmera NS).
Reagens |
Količina po reakciji |
Konačna koncentracija |
Sterilna Ultra čista voda |
12,625 μl |
|
10 x PCR pufer1 (15 mM MgCl2) |
2,5 μl |
1 X (1,5 mM MgCl2) |
BSA (frakcija V) (10%) |
0,25 μl |
0,1% |
Smesa d-NTP (20 mM) |
0,125 μl |
0,1 mM |
Prajmer RS-1-F (10 μM) |
2,0 μl |
0,8 μM |
Prajmer RS-1-R (10 μM) |
2,0 μl |
0,8 μM |
Prajmer NS-5-F (10 μM)(2) |
0,15 μl |
0,06 μM |
Prajmer NS-6-R (10 μM)(2) |
0,15 μl |
0,06 μM |
Taq polimeraza (5 U/μl)(1) |
0,2 μl |
1,0 U |
Zapremina uzorka |
5,0 μl |
|
Ukupna zapremina |
25,0 μl |
|
_______________
(1) Metoda je potvrđena Taq polimerazom Perkin Elmer (AmpliTaq ili Gold) i Gibco BRL.
(2)Koncentracije prajmera NS-5-F i NS-6-R su optimizovane za ekstrakciju konusa pupčanih delova krtola krompira metodom homogenizacije i prečišćavanjem DNK prema Pastrik-u (2000). Ako se ekstrakcija obavlja trešenjem ili ako se primenjuju druge metode izdvajanja DNK, potrebno je ponovo optimizovati koncentracije reagenasa.
Izvesti sledeći program:
1 ciklus: |
5 minuta na 95°C (denaturacija lanca DNK) |
35 ciklusa: |
30 sekundi na 95°C (denaturacija lanca DNK) |
30 sekundi na 58°C (vezivanje prajmera) |
|
45 sekundi na 72°C (hibridizacija) |
|
1 ciklus: |
5 minuta na 72°C (konačno produžavanje) držati na 4°C |
Napomena:
Optimalni uslovi korišćenja ovog programa su definisani za korišćenje na PCR MJ Research PTC 200 thermal cycler-u. Modifikacija trajanja koraka ciklusa 35 je možda potrebna u slučaju upotrebe drugih modela thermal cycler-a.
3.4. Analiza produkta umnožavanja restrikcionim enzimom
PCR proizvodi umnoženi iz DNK R. solanacearum ispoljavaju karakteristične polimorfizme u dužini restrikcionih fragmenata sa enzimom Bsm I ili izoshizomerom (npr. Mva 1269 I) posle inkubacije na 65°C u trajanju od 30 minuta.
4. Protokol za specifičan PCR biovara (Pastrik i sar. 2001)
4.1. Oligonukleotidni prajmeri
Uzvodni prajmer Rs-1-F 5'-ACT AAC GAA GCA GAG ATG CAT TA-3'
Nizvodni prajmer Rs-1-R 5'-CCC AGT CAC GGC AGA GAC T-3'
Nizvodni prajmer Rs-3-R 5'-TTC ACG GCA AGA TCG CTC-3'
Očekivana dužina umnoženog proizvoda iz DNK R. solanacearum:
sa Rs-1-F/Rs-1-R = 718 bp
sa Rs-1-F/Rs-3-R = 716 bp
Specifični PCR za biovar 1/2
Reagens |
Količina po reakciji |
Konačna koncentracija |
Sterilna Ultra čista voda |
12,925 μl |
|
10 x PCR pufer1 (15 mM MgCl2) |
2,5 μl |
1 X (1,5 mM MgCl2) |
BSA (frakcija V) (10%) |
0,25 μl |
0,1% |
Smesa d-NTP (20 mM) |
0,125 μl |
0,1 mM |
Prajmer Rs-1-F (10 μM) |
2 μl |
0,8 μM |
Prajmer Rs-1-R (10 μM) |
2 μl |
0,8 μM |
Taq polimeraza (5 U/μl)(1) |
0,2 μl |
1,0 U |
Zapremina uzorka |
5,0 μl |
|
Ukupna zapremina |
25,0 μl |
|
_______________
(1) Metode su potvrđene Taq polimerazom Perkin Elmer (AmpliTaq) i Gibco BRL
Specifični PCR za biovar 3/4/5
Reagens |
Količina po reakciji |
Konačna koncentracija |
Sterilna Ultra čista voda |
14,925 μl |
|
10 x PCR pufer1 (15 mM MgCl2) |
2,5 μl |
1 X (1,5 mM MgCl2) |
BSA (frakcija V) (10%) |
0,25 μl |
0,1% |
Smesa d-NTP (20 mM) |
0,125 μl |
0,1 mM |
Prajmer Rs-1-F (10 μM) |
1 μl |
0,4 μM |
Prajmer Rs-3-R (10 μM) |
1 μl |
0,4 μM |
Taq polimeraza (5 U/μl)(1) |
0,2 μl |
1,0 U |
Zapremina uzorka |
5,0 μl |
|
Ukupna zapremina |
25,0 μl |
|
_______________
(1) Metode su potvrđene Taq polimerazom Perkin Elmer (AmpliTaq ili Gold) i Gibco BRL.
Izvesti sledeći program za specifične reakcije za biovar 1/2 i biovar 3/4/5:
1 ciklus: |
5 minuta na 95°C (denaturacija lanca DNK) |
35 ciklusa: |
30 sekundi na 95°C (denaturacija lanca DNK) |
30 sekundi na 58°C (vezivanje prajmera) |
|
|
45 sekundi na 72°C (hibridizacija) |
1 ciklus: |
5 minuta na 72°C (konačno produžavanje) držati na 4°C |
Napomena:
Optimalni uslovi korišćenja ovog programa su definisani za korišćenje na PCR MJ Research PTC 200 thermal cycler-u. Modifikacija trajanja koraka ciklusa 35 je možda potrebna u slučaju upotrebe drugih modela thermal cycler-a.
4.4. Analiza produkta umnožavanja restrikcionim enzimom
PCR proizvodi umnoženi iz DNK R. solanacearum sa prajmerima Rs-1-F i Rs-1-R ispoljavaju karakteristične polimorfizme u dužini restrikcionih fragmenata sa enzimom Bsm I ili izoshizomerom (npr. Mva 1269 I) posle inkubacije na 65°C u trajanju od 30 minuta. PCR proizvodi umnoženi iz DNK bakterije R. solanacearum sa prajmerima Rs-1-F i Rs-3-R nemaju mesta restrikcije.
5. Priprema boje za elektroforezu
5.1. Bromfenol plavo (10%-tni koncentrovani rastvor)
Bromfenol plavo 5 g
Destilovana voda (bidestilovana) 50 ml
Glicerol (86%) 3,5 ml
Bromfenol plavo (5.1) 300 μl
Destilovana voda (bidestilovana) 6,2 ml
5.3. 10x Tris acetatni i EDTA pufer (TAE), pH 8,0
Tris pufer 48,g
Glacijalna sirćetna kiselina 11,42 ml
EDTA (dinatrijumova so) 3,72 g
Destilovana voda 1,00 L
Razredite 1x pre upotrebe.
Dostupan je i na tržištu (npr. Invitrogen ili zamena).
POTVRĐENI I ODOBRENI REAGENSI ZA FISH TEST
Specifična proba za R. solanacearum OLI-1-CY3: 5'-ggc agg tag caa gct acc ccc-3'
Nespecifična eubakterijska proba EUB-338-FITC: 5'-gct gcc tcc cgt agg agt -3'
Rastvor za fiksiranje sadrži paraformaldehid koji je toksičan. Nositi rukavice i ne udisati ga. Preporučuje se rad u digestoru.
2.1. Zagrejati 9 ml vode za upotrebu u procedurama molekularne biologije (npr. Ultra čiste vode) na oko 60°C i dodati 0,4 g paraformaldehida. Paraformaldehid se rastvara posle dodavanja 5 kapi 1N NaOH i mešanja na magnetskoj mešalici.
2.2. Podesiti pH na 7,0 dodajući 1 ml 0,1M fosfatnog pufera (PB; pH 7,0) i 5 kapi 1N HCl. Vrednost pH proveriti i pomoću indikator traka i ako je potrebno podesite pH pomoću HCl ili NaOH.
U rastvorima s paraformaldehidom ne upotrebljavati ph-metar.
2.3. Profiltrirati rastvor kroz membranski filter od 0,22 μm i do dalje upotrebe čuvati na 4°C i zaštititi od prašine.
NaCl 2,7 M
Tris-HCl 60 mM (pH 7,4)
EDTA (sterilizovana filtriranjem i u autoklavu) 15 mM
Razredite do 1x prema potrebi
1X Hybmix
Natrijum dodecil sulfat (SDS) 0,01%
Formamid 30%
Proba EUB 338 5 ng/μl
Proba OLI-1 ili OLI-2 5 ng/μl
Pripremiti količine rastvora za hibridizaciju prema proračunima u Tabeli 1. Za svaku pločicu (sa 2 različita uzorka u duplikatu) treba 90 μl rastvora za hibridizaciju. Važno: formamid je veoma toksičan i zato nositi rukavice i preduzeti potrebne mere opreza!
Tabela 1. Predložene količine za pripremanje smese za hibridizaciju
Broj stakalaca |
1 |
4 |
6 |
8 |
10 |
Sterilna Ultra čista voda |
23,1 |
92,4 |
138,6 |
184,8 |
231,0 |
3 x hybmix |
30,0 |
120,0 |
180,0 |
240,0 |
300,0 |
1% SDS |
0,9 |
3,6 |
5,4 |
7,2 |
9,0 |
Formamid |
27,0 |
108,0 |
162,0 |
216,0 |
270,0 |
Proba EUB 338 (100 ng/μl) |
4,5 |
18,0 |
27,0 |
36,0 |
45,0 |
Proba OLI-1 ili OLI-2 (100 ng/μl) |
4,5 |
18,0 |
27,0 |
36,0 |
45,0 |
Ukupna zapremina (μl) |
90,0 |
360,0 |
540,0 |
720,0 |
900,0 |
Napomena:
Sve rastvore koji sadrže oligo-probe osetljive na svetlost čuvati u mraku na -20°C.
Tokom upotrebe zaštitite ih od direktne sunčeve svetlosti ili električnog svetla.
5. 0,1M fosfatni pufer, pH 7,0
Na2HPO4 |
8,52 g |
KH2PO4 |
5,44 g |
Destilovana voda |
1,00 L |
Rastvorite sastojke, proverite pH i sterilišite u autoklavu na 121°C 15 minuta.
USLOVI GAJENJA PLAVOG PATLIDŽANA I PARADAJZA
Posejati seme paradajza (Lycopersicon esculentum) i plavog patlidžana (Solanum melongena) u pasterizovani kompost za seme. Presaditi sejance sa potpuno razvijenim kotiledonima (10 do 14 dana) u pasterizovan kompost u saksijama.
Pre inokulacije, paradajz i plavi patlidžan bi trebalo da se gaji u stakleniku pod sledećim uslovima:
Dužina dana: 14 sati ili prirodna dužina dana, ako je duža od 14 sati;
Temperatura:
dnevna: 21 do 24°C
noćna: 14 do 18°C
Osetljiva sorta paradajza: "Moneymaker"
Osetljiva sorta plavog patlidžana "Black Beauty"
Proizvođač: web stranica: http://forum.europa.eu.int/Public/irc/sanco/Home/main