
SMERNICEDOBRE PROIZVOĐAČKE PRAKSE("Sl. glasnik RS", br. 97/2017) |
UVOD
Farmaceutska industrija u Evropskoj uniji održava visok standard obezbeđenja kvaliteta u razvoju, proizvodnji i kontroli lekova. Postupkom za izdavanje dozvole za stavljanje leka u promet obezbeđena je usaglašenost lekova sa važećim zahtevima u pogledu bezbednosti, kvaliteta i efikasnosti, koju procenjuju nadležne institucije. Postupkom za izdavanje dozvole za proizvodnju obezbeđeno je da su svi lekovi koji imaju dozvolu za stavljanje u promet na evropskom tržištu proizvedeni/uvezeni od strane proizvođača koji poseduju dozvolu za proizvodnju i koji su redovno inspektovani od strane nadležne institucije, primenom principa Upravljanja rizikom kvaliteta. Dozvola za proizvodnju neophodna je svim proizvođačima lekova na teritoriji Evropske unije, bez obzira da li je lek u prometu u ili van Evropske unije.
Dve direktive koje propisuju principe i smernice dobre proizvođačke prakse za lekove (GMP), usvojene su od strane Komisije Evropske unije. Direktiva 2003/94/EC se odnosi na lekove koji se koriste u humanoj medicini, dok se Direktiva 91/412/EEC odnosi na lekove koji se koriste u veterinarskoj medicini. U skladu sa ovim direktivama objavljene su detaljne Smernice Dobre proizvođačke prakse, koje se koriste prilikom procene dokumentacije za izdavanje dozvole za proizvodnju lekova i kao osnova za inspekciju proizvođača lekova.
Principi Dobre proizvođačke prakse i detaljne smernice se odnose na sve operacije za koje je potrebna dozvola prema članu 40. Direktive 2001/83/EC, članu 44. Direktive 2001/82/EC i članu 13. Direktive 2001/20/EC, koje su izmenjene i dopunjene. Smernice Dobre proizvođačke prakse odnose se i na ostale farmaceutske proizvodne procese, kao što su oni koji se obavljaju u bolnicama.
Države članice EU i industrija su se saglasile da se u proizvodnji lekova koji se koriste u veterinarskoj medicini primenjuju isti zahtevi Smernica dobre proizvođačke prakse koji se primenjuju i u proizvodnji lekova koji se koriste u humanoj medicini. Izvesne razlike u smernicama dobre proizvođačke prakse date su u dva posebna aneksa koji se odnose na lekove koji se koriste u veterinarskoj medicini i imunološke veterinarske lekove.
Smernice Dobre proizvođačke prakse sastoje se od tri dela i posebnih aneksa. Prvi deo daje principe dobre proizvođačke prakse za lekove. Drugi deo daje smernice dobre proizvođačke prakse za aktivne supstance koje se upotrebljavaju kao polazne supstance u proizvodnji lekova. Treći deo čine dokumenta koja se odnose na dobru proizvođačku praksu i koji pojašnjavaju regulatorna očekivanja.
Poglavlja iz Osnovnih zahteva Prvog dela se zasnivaju na principima koji su definisani u Direktivama 2003/94/EC i 91/412/EEC. Poglavlje 1 "Upravljanje kvalitetom" daje osnovni koncept upravljanja kvalitetom koji se primenjuje u proizvodnji lekova. U svakom sledećem poglavlju dati su principi koji daju kratak pregled ciljeva upravljanja kvalitetom koji se odnose na to poglavlje i deo teksta koji proizvođaču daje dovoljno detalja kako bi bio upoznat sa značajnim principima za njihovo ostvarivanje.
Na osnovu izmenjenog člana 47. i člana 51. Direktive 2001/83/EC, odnosno Direktive 2001/82/EC, koje su izmenjene i dopunjene, Komisija EU je propisala i objavila detaljnu smernicu i principe dobre proizvođačke prakse za aktivne supstance koje se upotrebljavaju kao polazne supstance u proizvodnji lekova. Drugi deo Smernica dobre proizvođačke prakse je ustanovljen na osnovu ICH smernice, koja je objavljena kao ICH Q7a "Smernica o aktivnim farmaceutskim sastojcima". Drugi deo Smernica Dobre proizvođačke prakse se primenjuje za humane i veterinarske lekove.
Osnovnim zahtevima dobre proizvođačke prakse, predstavljenim u Prvom delu i Drugom delu, dodati su posebni aneksi u kojima su dati detaljni zahtevi u vezi sa specifičnim područjima primene. Za neke proizvodne procese, primenjuju se istovremeno različiti aneksi (npr. aneks o sterilnim proizvodima i aneks o radiofarmaceutskim i/ili biološkim proizvodima).
Rečnik nekih termina koji se koriste u Smernicama Dobre proizvođačke prakse nalazi se posle aneksa a neki od aneksa sadrže svoj rečnik.
Smernice Dobre proizvođačke prakse ne obuhvataju aspekte bezbednosti osoblja zaposlenog u proizvodnji. Bezbednost zaposlenih je od izuzetnog značaja u proizvodnji nekih lekova kao što su visoko reaktivni, biološki i radioaktivni lekovi. Ova pitanja se posebno razmatraju u drugim propisima Evropske zajednice ili u nacionalnim propisima.
Smernice Dobre proizvođačke prakse podrazumevaju da su, od strane nosioca dozvole za proizvodnju, zahtevi iz dozvole za stavljanje leka u promet koji se odnose na bezbednost, kvalitet i efikasnost, sistematski inkorporirani u sve proizvodne, kontrolne i postupke puštanja serije leka u promet.
Proizvodnja lekova se u toku dugog perioda obavlja u skladu sa Smernicama Dobre proizvođačke prakse, tako da ona nije regulisana CEN/ISO standardima. Prilikom pripreme ove smernice uzeti su u obzir CEN/ISO standardi, ali ne i terminologija koja se u njima koristi. Prepoznato je da postoje i druge prihvatljive metode, pored onih koje su opisane u ovim smernicama Dobre proizvođačke prakse, kojima se mogu dostići principi upravljanja kvalitetom. Ovim smernicama se ne sprečava razvoj novih pristupa ili novih tehnologija koje su validirane i koje obezbeđuju zadovoljavajući nivo upravljanja kvalitetom, a koji je najmanje ekvivalentan onom koji se zahteva Smernicom.
Smernice Dobre proizvođačke prakse se redovno ažuriraju kako bi odražavale kontinuirano unapređenje najboljih praksi u oblasti kvaliteta. Izmene su javno dostupne na internet stranici Evropske Komisije.
Važeća je poslednja ažurirana verzija smernica, objavljena na internet stranici Evropske Komisije (EudraLex - Volume 4 Good manufacturing practice (GMP) Guidelines).
http://ec.europa.eu/health/documents/eudralex/vol-4/index_en.htm
OSNOVNI ZAHTEVI ZA PROIZVODNJU LEKOVA
FARMACEUTSKI SISTEM KVALITETA
Nosilac dozvole za proizvodnju lekova (u daljem tekstu: proizvođač lekova) mora da obavlja proizvodnju na način kojim je obezbeđeno da lekovi kvalitetom odgovaraju predviđenoj nameni, zahtevima dozvole za stavljanje leka u promet ili odobrenja za sprovođenje kliničkog ispitivanja i da u pogledu bezbednosti, kvaliteta i efikasnosti ne predstavljaju opasnost po zdravlje pacijenata. Za ispunjenje svih zahteva kvaliteta odgovorno je najviše rukovodstvo kompanije, a u njihovoj realizaciji aktivno učestvuje osoblje iz različitih organizacionih delova i različitog nivoa odgovornosti, kao i svi dobavljači i distributeri koji sarađuju sa proizvođačem lekova. Da bi zahtevi kvaliteta bili ispunjeni, mora da postoji sveobuhvatno isplaniran i implementiran Farmaceutski sistem kvaliteta koji obuhvata Dobru proizvođačku praksu (GMP) i Upravljanje rizikom kvaliteta. Farmaceutski sistem kvaliteta treba da bude u potpunosti dokumentovan, a njegova efektivnost treba redovno da se prati. Svi segmenti Farmaceutskog sistema kvaliteta treba da raspolažu odgovarajućim, kompetentnim osobljem, odgovarajućim i dovoljnim prostorom i opremom. Postoje i dodatne zakonske obaveze za proizvođača lekova i Kvalifikovano lice odgovorno za puštanje serije leka u promet (QP).
Osnovni koncepti Upravljanja kvalitetom, dobre proizvođačke prakse i Upravljanja rizikom kvaliteta međusobno su povezani. Oni su ovde opisani tako da se naglašavaju njihovi međusobni odnosi, kao i njihov fundamentalni značaj u proizvodnji i kontroli kvaliteta lekova.
Farmaceutski sistem kvaliteta1
1.1 Upravljanje kvalitetom je širok koncept koji obuhvata sve značajne elemente koji pojedinačno ili zajedno utiču na kvalitet proizvoda. To je skup svih organizovanih aktivnosti preduzetih u cilju obezbeđenja takvog kvaliteta lekova koji je neophodan za njihovu nameravanu upotrebu, zbog čega podrazumeva primenu dobre proizvođačke prakse.
1.2 Dobra proizvođačka praksa se primenjuje u svim fazama životnog ciklusa leka počevši od proizvodnje leka namenjenog za kliničko ispitivanje, preko transfera tehnologije, komercijalne proizvodnje, do prestanka proizvodnje leka. Međutim, Farmaceutski sistem kvaliteta može da se primenjuje i na fazu farmaceutskog razvoja leka na način opisan u smernici ICH Q10, koja iako je opciona, može da olakša inovacije i stalno unapređenje i učvrsti vezu između aktivnosti farmaceutskog razvoja i proizvodnih aktivnosti. Smernica ICH Q10 može da se koristi kao dodatak sadržaju ovog poglavlja.
1.3 Obim i složenost aktivnosti proizvođača lekova treba da se uzmu u obzir prilikom razmatranja razvoja novog Farmaceutskog sistema kvaliteta ili modifikovanja postojećeg. U dizajn ovog sistema treba ugraditi i odgovarajuće principe upravljanja rizikom, kao i upotrebu odgovarajućih "alata" za upravljanje rizikom. Bez obzira što su neki aspekti Farmaceutskog sistema kvaliteta primenljivi u celoj kompaniji, dok su neki specifični za određeno mesto proizvodnje, efektivnost ovog sistema se po pravilu dokazuje na određenom mestu proizvodnje.
1.4 Farmaceutski sistem kvaliteta koji je odgovarajući za proizvodnju lekova treba da obezbedi:
i) da se realizacija proizvoda postiže dizajnom, planiranjem, implementacijom, održavanjem i kontinuiranim unapređenjem sistema koji omogućava doslednu isporuku proizvoda odgovarajućeg kvaliteta;
ii) da je znanje o procesu i proizvodu implementirano kroz sve faze njegovog životnog ciklusa;
iii) da su faza dizajna i razvoja leka u saglasnosti sa zahtevima dobre proizvođačke prakse (GMP);
iv) da su postupci proizvodnje i kontrole kvaliteta jasno definisani uz odgovarajuću primenu Smernica dobre proizvođačke prakse;
v) da su odgovornosti rukovodstva jasno utvrđene;
vi) da su izvršene pripreme za proizvodnju, nabavku i upotrebu ispravnih polaznih supstanci i materijala za pakovanje, da se vrši odabir i monitoring dobavljača i da se potvrđuje da je svaka isporuka izvršena od odobrenog dobavljača, odnosno proizvođača;
vii) da je obezbeđeno upravljanje poverenim aktivnostima;
viii) da je uspostavljeno i da se održava efektivan monitoring i sistem kontrole performansi procesa i kvaliteta proizvoda;
ix) da se rezultati monitoringa procesa i proizvoda uzimaju u obzir prilikom puštanja serije leka u promet, prilikom istrage odstupanja, kao i prilikom predlaganja preventivnih mera za sprečavanje ponavljanja odstupanja u budućnosti;
x) da su obavljene sve neophodne kontrole kvaliteta međuproizvoda, procesne kontrole i validacije;
xi) da je kontinuirano unapređenje olakšano implementacijom unapređenja kvaliteta odgovarajućim za postojeći nivo znanja o procesima i proizvodu;
xii) da se prospektivno procenjuju planirane izmene i da se vrši njihovo odobravanje pre sprovođenja, kao i da se one prijavljuju nadležnim organima/institucijama kada je to potrebno;
xiii) da se posle svake izmene vrši procena radi potvrđivanja postizanja ciljeva kvaliteta, kao i potvrđivanja da nije došlo do nenamernog štetnog uticaja na kvalitet leka;
xiv) da je primenjen odgovarajući nivo analize osnovnog uzroka prilikom istrage odstupanja, sumnje u defekt kvaliteta proizvoda i u drugim slučajevima, a što se postiže primenom principa Upravljanja rizikom kvaliteta. U slučaju kada ne može da se utvrdi stvarni uzrok, treba da se identifikuje i navede najverovatniji uzrok. Kada postoji sumnja da je ljudska greška mogla da bude, ili jeste, stvarni uzrok odstupanja, to mora da se potvrdi vodeći računa da se ne previde eventualne procesne, proceduralne ili sistemske greške. Odgovarajuće korektivne i/ili preventivne mere (CAPA) treba da se isplaniraju i preduzmu u skladu sa rezultatom istrage. Efektivnost ovih mera se prati i procenjuje u skladu sa principima Upravljanja rizikom kvaliteta;
xv) da se lekovi ne prodaju niti isporučuju pre nego što Kvalifikovano lice (QP) potvrdi da je svaka serija leka proizvedena i kontrolisana u skladu sa zahtevima dozvole za stavljanje u promet i svim drugim zahtevima koji se odnose na proizvodnju, kontrolu kvaliteta i puštanje serije leka u promet;
xvi) da postoje odgovarajući uslovi koji obezbeđuju, koliko god je moguće, da skladištenje, distribucija i rukovanje lekovima ne utiču na promenu njihovog kvaliteta u toku predviđenog roka upotrebe;
xvii) da se primenjuju procedure za interne provere i/ili provere kvaliteta na osnovu kojih se redovno procenjuje efektivnost i primenljivost Farmaceutskog sistema kvaliteta.
1.5 Najviše rukovodstvo ima krajnju odgovornost za obezbeđenje odgovarajućeg Farmaceutskog sistema kvaliteta za koji treba da obezbedi odgovarajuće resurse, kao i unapred određena i saopštena zaduženja i odgovornosti zaposlenih koja su implementirana u celoj kompaniji. Vodeća uloga najvišeg rukovodstva treba da obezbedi podršku i posvećenost svih zaposlenih u okviru kompanije za održavanje Farmaceutskog sistema kvaliteta.
1.6 Potrebno je da rukovodstvo vrši periodično preispitivanje funkcionisanja Farmaceutskog sistema kvaliteta, uz učešće najvišeg rukovodstva, kako bi se identifikovale mogućnosti za kontinuirano unapređenje procesa, proizvoda i samog sistema.
1.7 Farmaceutski sistem kvaliteta treba da bude definisan i dokumentovan. Poslovnik o kvalitetu ili drugi ekvivalentan dokument treba da sadrži detaljan opis sistema upravljanja kvalitetom uključujući i odgovornosti rukovodstva.
___________
1 U članu 6. Direktive
2003/94/EC i 91/412/EEC propisan je zahtev proizvođačima da uspostave i implementiraju
efektivan farmaceutski sistem obezbeđenja kvaliteta. Izraz Farmaceutski sistem
kvaliteta se u ovom poglavlju koristi radi doslednosti sa terminologijom iz
smernice ICH Q10. Za potrebe ovog poglavlja ovi termini se mogu smatrati međusobno
zamenljivim.
Dobra proizvođačka praksa za lekove (GMP)
1.8 Dobra proizvođačka praksa (GMP) je onaj deo Upravljanja kvalitetom koji obezbeđuje da se proizvodi dosledno proizvode i kontrolišu u skladu sa standardima kvaliteta odgovarajućim za njihovu nameravanu upotrebu i zahtevima dozvole za stavljanje leka u promet, odobrenja za sprovođenje kliničkog ispitivanja ili specifikacijom proizvoda. Dobra proizvođačka praksa se odnosi i na proizvodnju i na kontrolu kvaliteta. Osnovni zahtevi dobre proizvođačke prakse su:
i) da su svi proizvodni postupci jasno definisani, sistematski proveravani na osnovu stečenog iskustva, da obezbeđuju doslednu proizvodnju lekova zahtevanog kvaliteta prema specifikaciji;
ii) da su kritične faze proizvodnog procesa i značajne izmene procesa validirane;
iii) da su obezbeđeni svi neophodni uslovi za primenu dobre proizvođačke prakse, uključujući i:
- odgovarajuće kvalifikovano i obučeno osoblje;
- odgovarajuće objekte i prostor;
- odgovarajuću opremu i održavanje;
- ispravne polazne supstance, materijal za pakovanje i etikete;
- odobrene procedure i uputstva u skladu sa Farmaceutskim sistemom kvaliteta;
- odgovarajući način i uslove čuvanja i transporta;
iv) da su uputstva i procedure napisani instruktivnim, jasnim i nedvosmislenim jezikom i prilagođeni postojećim uslovima u konkretnim proizvodnim objektima;
v) da je osoblje obučeno za korektno sprovođenje procedura;
vi) da se u toku proizvodnog procesa vode zapisi, ručno i/ili elektronski, kojima se potvrđuje da su sve faze, definisane procedurama i uputstvima, u potpunosti izvršene i da kvantitet i kvalitet proizvoda odgovaraju očekivanom;
vii) da je svako značajno odstupanje dokumentovano i istraženo kako bi se utvrdio osnovni uzrok i sprovele odgovarajuće korektivne i preventivne mere;
viii) da se na odgovarajući način vodi dokumentacija o proizvodnji, uključujući i distribuciju, na osnovu koje je moguća sledljivost određene serije leka;
ix) da se distribucija obavlja tako da je rizik za kvalitet lekova tokom distribucije sveden na minimum i da se obavlja u skladu sa Smernicama dobre prakse u distribuciji lekova;
x) da je obezbeđen sistem za povlačenje bilo koje serije leka iz prometa;
xi) da su reklamacije na kvalitet leka u prometu i uzroci nastanka defekta kvaliteta istraženi, kao i da su preduzete odgovarajuće korektivne i preventivne mere.
1.9 Kontrola kvaliteta predstavlja deo dobre proizvođačke prakse koji se odnosi na uzorkovanje, specifikacije i ispitivanja, kao i na organizaciju, dokumentaciju i procedure odobravanja koje obezbeđuju sprovođenje svih neophodnih i relevantnih metoda ispitivanja kvaliteta polaznih supstanci i gotovih lekova pre odobravanja njihove upotrebe, odnosno puštanja u promet. Osnovni zahtevi kontrole kvaliteta su sledeći:
(i) da postoji odgovarajuća oprema, obučeno osoblje i odobrene procedure za uzorkovanje, kontrolu kvaliteta polaznih supstanci, materijala za pakovanje, međuproizvoda, poluproizvoda (bulk) i gotovih proizvoda, kao i monitoring ambijentalnih uslova kada je to neophodno u svrhu dobre proizvođačke prakse;
(ii) da uzimanje uzoraka polaznih supstanci, pakovnog materijala, međuproizvoda, poluproizvoda (bulk) i gotovih proizvoda vrši obučeno osoblje, u skladu sa odobrenim metodama;
(iii) da su metode ispitivanja validirane;
(iv) da se vode zapisi, ručno i/ili elektronski, kojima se potvrđuje da su sve zahtevane procedure za uzorkovanje i ispitivanja stvarno obavljene. Svako odstupanje mora biti u potpunosti zapisano i istraženo;
(v) da gotovi proizvodi sadrže aktivne supstance koje kvalitativno i kvantitativno odgovaraju specifikaciji iz dokumentacije dostavljene za dobijanje dozvole za stavljanje leka u promet ili odobrenja za sprovođenje kliničkog ispitivanja, da su zahtevanog stepena čistoće, da su u odgovarajućem pakovanju i ispravno obeleženi;
(vi) da izveštaji o rezultatima ispitivanja i sertifikati analize polaznih supstanci, međuproizvoda, poluproizvoda (bulk) i gotovih proizvoda i zvanično odgovaraju specifikacijama. Procena kvaliteta proizvoda obuhvata pregled i procenu relevantne proizvodne dokumentacije i procenu odstupanja od predviđenih procedura;
(vii) da nijedna serija proizvoda nije puštena u promet pre nego što, u skladu sa zahtevima Aneksa 16, Kvalifikovano lice za puštanje serije u promet (QP) odobri, odnosno potvrdi da je kvalitet proizvoda u potpunosti usaglašen sa zahtevima važećih dozvola;
(viii) da se, u skladu sa zahtevima Aneksa 19, čuva dovoljan broj referentnih uzoraka polaznih supstanci i gotovih proizvoda kako bi, u slučaju potrebe, bilo moguće da se izvrše ponovna ispitivanja kvaliteta proizvoda, kao i da se proizvodi čuvaju u njihovom originalnom pakovanju.
1.10 U cilju potvrđivanja doslednosti postojećeg proizvodnog procesa i usaglašenosti kvaliteta polaznih supstanci i gotovih proizvoda sa specifikacijama, potrebno je da se sprovode redovni ili periodični pregledi kvaliteta svih lekova koji imaju dozvolu za stavljanje u promet, uključujući i one koji su namenjeni isključivo za izvoz. Ovakvi pregledi se obično obavljaju i dokumentuju na godišnjem nivou, uzimajući u obzir prethodne preglede, što podrazumeva praćenje trenda i identifikovanje poboljšanja kvaliteta proizvoda i procesa. Oni treba da obuhvate najmanje:
(i) pregled polaznih supstanci i materijala za pakovanje koji se koriste u proizvodnji, naročito onih koji su nabavljeni od novih proizvođača, odnosno dobavljača, a posebno pregled sledljivosti u lancu snabdevanja aktivnih supstanci;
(ii) pregled kritičnih procesnih kontrola i rezultata ispitivanja gotovog proizvoda;
(iii) pregled svih serija proizvoda koje ne odgovaraju utvrđenoj specifikaciji kao i pregled sprovedenih istraga rezultata van specifikacije;
(iv) pregled svih značajnih odstupanja ili neusaglašenosti, odgovarajućih istraga i efektivnost sprovedenih korektivnih i preventivnih mera;
(v) pregled svih izmena procesa ili analitičkih metoda;
(vi) pregled svih varijacija dozvole za stavljanje leka u promet - podnetih, odobrenih, odnosno odbijenih, uključujući i one u registracionim dosijeima za treće zemlje (samo za izvoz);
(vii) pregled rezultata programa praćenja stabilnosti sa prikazom bilo kakvih nepovoljnih trendova;
(viii) pregled svih povraćaja, reklamacija i povlačenja proizvoda iz prometa zbog neodgovarajućeg kvaliteta, kao i pravovremeno sprovedenih istraga;
(ix) pregled adekvatnosti prethodno sprovedenih korektivnih mera u vezi sa proizvodnim procesom ili opremom;
(x) za nove dozvole za stavljanje leka u promet i varijacije dozvola za stavljanje leka u promet, pregled ispunjavanja obaveza vezanih za kvalitet leka posle puštanja u promet;
(xi) pregled statusa kvalifikacije relevantne opreme i pomoćnih sistema za proizvodnju npr. HVAC, sistemi za vodu, komprimovane gasove i dr.;
(xii) pregled svih ugovora o poverenim aktivnostima, kako je definisano u Poglavlju 7, u cilju potvrđivanja njihove ažuriranosti.
1.11 Proizvođač i nosilac dozvole za stavljanje leka u promet, ako nije u pitanju isto pravno lice, treba da analiziraju rezultate ovih pregleda i da izvrše procenu da li je potrebno da se preduzmu korektivne ili preventivne mere, ili da se izvrši bilo kakva revalidacija, u skladu sa Farmaceutskim sistemom kvaliteta. Treba da postoje procedure za kontinuirano upravljanje i izveštavanje o korektivnim i preventivnim merama, a efektivnost tih mera treba da se proveri tokom internih provera. Pregledi kvaliteta proizvoda mogu da budu grupisani prema vrsti proizvoda ili farmaceutskim oblicima (npr. čvrsti, tečni farmaceutski oblici, sterilni proizvodi itd.).
U slučaju da nosilac dozvole za stavljanje leka u promet nije istovremeno i proizvođač tog leka, između njih treba da postoji zaključen ugovor koji utvrđuje odgovornost svake od ugovornih strana u pripremi pregleda kvaliteta proizvoda.
1.12 Upravljanje rizikom kvaliteta je sistematski proces koji obuhvata procenu, kontrolu, komunikaciju i izveštavanje o rizicima za kvalitet leka. Upravljanje rizikom kvaliteta može da se primenjuje proaktivno i retrospektivno.
1.13 Principi upravljanja rizikom kvaliteta su sledeći:
i) da se procena rizika zasniva na naučnim saznanjima i stečenom iskustvu u vezi sa procesom, kao i da je krajnji cilj povezan sa zaštitom pacijenata;
ii) da je nivo preduzetih aktivnosti, postupanja po proceduri i dokumentovanja procesa upravljanja rizikom kvaliteta srazmeran nivou rizika.
Primeri procesa i primene upravljanja rizikom kvaliteta dati su u Smernici ICH Q9.
OSOBLJE
Ispravna proizvodnja lekova zavisi od osoblja. Za izvođenje svih zadataka za koje je odgovoran, proizvođač lekova mora da obezbedi dovoljno kvalifikovanog osoblja. Individualna odgovornost treba da bude dokumentovana i jasno shvaćena od strane svakog pojedinca. Celokupno osoblje treba da bude upoznato sa principima dobre proizvođačke prakse koji se na njih odnose i podvrgnuto početnoj i kontinuiranoj obuci, uključujući i uputstva o higijeni, u skladu sa njihovim potrebama.
2.1 Proizvođač treba da raspolaže dovoljnim brojem osoblja sa neophodnom kvalifikacijom i iskustvom. Najviše rukovodstvo treba da definiše i obezbedi odgovarajuće resurse (osoblje, finansijske resurse, polazne materijale, prostor i opremu) za implementaciju i održavanje sistema upravljanja kvalitetom i za kontinuirano unapređenje njegove efektivnosti. Odgovornost svakog pojedinca ne sme da bude toliko sveobuhvatna da predstavlja rizik po kvalitet.
2.2 Proizvođač mora da ima organizacionu šemu u kojoj su naznačeni međusobni odnosi u upravljačkoj hijerarhiji lica odgovornog za proizvodnju, lica odgovornog za kontrolu kvaliteta, lica odgovornog za obezbeđenje kvaliteta ili za kvalitet kada je to primenljivo u skladu sa tačkom 2.5, kao i Kvalifikovanog lica odgovornog za puštanje serije leka u promet (QP).
2.3 Osobe na odgovornim pozicijama moraju da imaju definisane odgovornosti navedene u pisanoj formi, u opisu radnog mesta i odgovarajuće ovlašćenje za sprovođenje svojih odgovornosti. Njihove dužnosti mogu biti prenete samo onim imenovanim zamenicima koji imaju odgovarajuću kvalifikaciju. Ne sme da bude praznina ili neobjašnjivih preklapanja u odgovornostima osoblja zaduženog za primenu dobre proizvođačke prakse.
2.4 Najviše rukovodstvo ima krajnju odgovornost da obezbedi postojanje efektivnog sistema upravljanja kvalitetom kako bi se ostvarili ciljevi kvaliteta, kao i da obezbedi da su zaduženja, odgovornosti i ovlašćenja zaposlenih unapred određeni, saopšteni i da se sprovode u celoj kompaniji. Najviše rukovodstvo treba da uspostavi politiku kvaliteta koja opisuje sveobuhvatne namere i pravac kompanije u vezi sa kvalitetom i da kroz učešće u periodičnom preispitivanju, kontinuirano obezbeđuje pogodnost i efektivnost sistema upravljanja kvalitetom i usaglašenost sa dobrom proizvođačkom praksom.
2.5 Najviše rukovodstvo treba da imenuje ključne osobe i to: lice odgovorno za proizvodnju, lice odgovorno za kontrolu kvaliteta, a u slučaju da ni jedna od tih osoba nije odgovorna za zaduženja predviđena važećim propisima za odgovornu osobu za puštanje serije leka u promet koja su navedena u članu 51. Direktive 2001/83/EC2, tada se imenuje i dovoljan broj, a najmanje jedno Kvalifikovano lice odgovorno za puštanje serije leka u promet (QP). Na ključnim pozicijama može da radi samo osoblje sa punim radnim vremenom. Lice odgovorno za proizvodnju i lice odgovorno za kontrolu kvaliteta moraju da budu nezavisni jedan od drugog. U velikim organizacijama zaduženja predviđena tačkama 2.7, 2.8 i 2.9 ovog poglavlja, mogu da se prenesu na druge osobe. Osim toga, u zavisnosti od veličine i organizacione strukture kompanije, potrebno je da se imenuje i lice odgovorno za obezbeđenje kvaliteta ili lice odgovorno za kvalitet. Kada je imenovano i ovo lice, obično su neke od odgovornosti navedenih u tačkama 2.7, 2.8 i 2.9 ovog poglavlja, podeljene između ovog lica i lica odgovornog za proizvodnju, odnosno lica odgovornog za kontrolu kvaliteta, a najviše rukovodstvo treba da obezbedi da su njihove dužnosti, odgovornosti i ovlašćenja definisani.
2.6 Dužnosti Kvalifikovanog lica odgovornog za puštanje serije leka u promet (date u članu 51. Direktive 2001/83/EC) mogu da se rezimiraju na sledeće:
a) za lekove proizvedene u zemlji članici Evropske unije, QP mora da potvrdi da je svaka serija leka proizvedena i ispitana, odnosno kontrolisana u skladu sa važećim zakonom u toj državi članici i u skladu sa zahtevima dozvole za stavljanje u promet;3
b) u slučaju kada se lek uvozi iz treće zemlje (zemlje koja nije članica EU), bez obzira da li je lek proizveden u zemlji članici Evropske unije, QP mora da obezbedi da se u zemlji članici EU izvrši kompletno kvalitativno laboratorijsko ispitivanje svake uvezene serije tog leka, kvantitavno ispitivanje najmanje svih aktivnih supstanci, kao i svako drugo ispitivanje neophodno da se potvrdi da je kvalitet leka u skladu sa zahtevima dozvole za stavljanje u promet. QP mora da potvrdi u sertifikatu ili ekvivalentnom dokumentu, kako su operacije sprovedene i pre puštanja u promet, da svaka proizvedena serija ispunjava zahteve iz člana 51. Direktive 2001/83/EC.
Lica odgovorna za ove dužnosti moraju da zadovolje propisane zahteve u pogledu kvalifikacija koji su dati u članu 49. Direktive 2001/83/EC4 i moraju da budu stalno i u kontinuitetu na raspolaganju nosiocu dozvole za proizvodnju lekova u cilju izvršenja svojih odgovornosti. Odgovornosti QP se mogu preneti samo na drugo(a) Kvalifikovano lice(a).
_______
2 Član 55. Direktive 2001/82/EC
3 Na osnovu člana 51. Direktive
2001/83/EC, serije lekova za koje je izvršena kontrola kvaliteta u nekoj od
zemalja članica EU i koje poseduju izveštaj o izvršenoj kontroli kvaliteta
potpisan od strane QP, ne moraju ponovo da se kontrolišu pre stavljanja u promet
u drugim zemljama članicama Evropske Zajednice
4 Član 51. Direktive 2001/82/EC
Detaljnije o ulozi QP dato je u Aneksu 16.
2.7 Rukovodilac proizvodnje generalno ima sledeće odgovornosti:
i) da u cilju postizanja zahtevanog kvaliteta leka obezbedi proizvodnju i skladištenje proizvoda u skladu sa zahtevima odgovarajuće dokumentacije;
ii) da odobri uputstva koja se odnose na proizvodne postupke i da obezbedi njihovu doslednu primenu;
iii) da obezbedi da je proizvodna dokumentacija analizirana i potpisana od strane ovlašćenog lica;
iv) da obezbedi kvalifikacije i održavanje prostorija i opreme za proizvodnju;
v) da obezbedi da se izvrše odgovarajuće validacije;
vi) da obezbedi da je zahtevana početna i kontinuirana obuka proizvodnog osoblja izvršena i da je prilagođena potrebama.
2.8 Rukovodilac kontrole kvaliteta generalno ima sledeće odgovornosti:
i) da odobri ili odbije polazne supstance, materijal za pakovanje, među, polu (bulk) ili gotove proizvode;
ii) da obezbedi da se izvrše sva predviđena ispitivanja, kao i da se proceni odgovarajuća dokumentacija o izvršenim ispitivanjima;
iii) da odobri specifikacije, uputstva za uzorkovanje, metode ispitivanja i ostale procedure kontrole kvaliteta;
iv) da odobri i prati rad svakog izvođača ispitivanja pod ugovorom (svaku ugovornu laboratoriju za kontrolu kvaliteta);
v) da obezbedi kvalifikacije i održavanje prostorija i opreme za laboratorijsku kontrolu kvaliteta;
vi) da potvrdi da su izvršene odgovarajuće validacije analitičkih metoda;
vii) da potvrdi da je propisana početna i kontinuirana obuka osoblja izvršena i da je prilagođena potrebama.
Druge dužnosti odeljenja kontrole kvaliteta navedene su u Poglavlju 6.
2.9 Rukovodioci proizvodnje, kontrole kvaliteta kao i lice odgovorno za obezbeđenje kvaliteta ili za kvalitet, kada je imenovano, imaju i zajedničke odgovornosti koje se odnose na kvalitet ili ih mogu zajednički vršiti, a koje se prvenstveno odnose na dizajn, efektivnu implementaciju, praćenje i održavanje sistema upravljanja kvalitetom. Te obaveze mogu obuhvatati sledeće:
i) odobravanje pisanih procedura i uputstava, uključujući i njihove izmene;
ii) monitoring i kontrolu ambijentalnih uslova proizvodnje;
iii) higijenu u fabrici;
iv) validaciju procesa;
v) obuke osoblja;
vi) odobravanje i monitoring dobavljača svih polaznih materijala;
vii) odobravanje i monitoring ugovornih proizvođača i davaoca usluga u vezi sa poverenim GMP aktivnostima;
viii) određivanje i monitoring uslova čuvanja polaznih materijala i gotovih proizvoda;
ix) čuvanje zapisa, izveštaja i dokumentacije;
x) praćenje usaglašenosti sa zahtevima dobre proizvođačke prakse;
xi) provere, ispitivanja i uzorkovanja u cilju praćenja svih činioca koji mogu da utiču na kvalitet proizvoda;
xii) učešće u periodičnom preispitivanju performansi procesa, kvaliteta proizvoda i sistema upravljanja kvalitetom, od strane najvišeg rukovodstva, kao i zalaganje za stalno unapređenje;
xiii) obezbeđivanje blagovremenog i efektivnog izveštavanja u slučaju kada se kvalitet dovodi u pitanje, do odgovarajućih nivoa rukovodstva.
2.10 Proizvođač treba da obezbedi obuku celokupnom osoblju koje svoje dužnosti obavlja u proizvodnim, skladišnim i prostorijama laboratorija za kontrolu kvaliteta (uključujući i tehničko osoblje, osoblje zaduženo za održavanje i čišćenje), kao i za sve ostale čiji rad može uticati na kvalitet proizvoda.
2.11 Pored osnovne teorijske i praktične obuke o sistemu upravljanja kvalitetom i Dobroj proizvođačkoj praksi, novozaposleno osoblje treba da završi i obuku vezanu za zaduženja za koja su odgovorni. Takođe, potrebno je da se obezbedi i kontinuirana obuka, a periodično treba da se vrši provera njene praktične usvojenosti. Program obuke treba da bude definisan i odobren ili od rukovodioca proizvodnje ili od rukovodioca kontrole kvaliteta. Treba da se vode zapisi o obuci.
2.12 Osoblju koje radi u proizvodnim prostorima u kojima postoji opasnost od kontaminacije, npr. u čistim prostorima ili prostorima u kojima se radi sa visoko aktivnim, toksičnim, zaraznim ili senzibilizirajućim materijalima, treba da se obezbedi posebna obuka.
2.13 Preporučljivo je da se, ukoliko je to moguće, posetioci ili osoblje koje nije prošlo obuku, ne uvode u prostorije za proizvodnju i kontrolu kvaliteta. U slučaju da to nije moguće, oni prethodno treba da budu informisani o ličnoj higijeni i propisanoj zaštitnoj odeći. Ove osobe treba da budu strogo nadgledane.
2.14 Farmaceutski sistem kvaliteta i sve mere koje mogu da unaprede njegovo razumevanje i sprovođenje, treba da budu potpuno razjašnjeni u toku obuke.
2.15 Detaljan program higijene treba da bude uspostavljen i prilagođen različitim zahtevima unutar fabrike. Programom treba da budu obuhvaćene procedure koje se odnose na zdravlje, pravila higijene i oblačenje osoblja. Ove procedure treba da budu shvaćene i veoma precizno izvršavane od strane osoblja koje svoje radne obaveze izvršava u proizvodnim i prostorijama kontrole kvaliteta. Program higijene treba da bude predstavljen od strane rukovodilaca i detaljno objašnjen tokom obuke.
2.16 Svi zaposleni, pre zapošljavanja, treba da budu podvrgnuti lekarskom pregledu. Proizvođač mora da postavi odgovarajuće zdravstvene zahteve koji mogu bitno uticati na kvalitet proizvoda. Nakon prvog lekarskog pregleda, preglede treba obavljati periodično, u skladu sa potrebama radnog mesta i ličnog zdravlja.
2.17 Treba da se preduzmu praktične mere kojima se garantuje da u procesu proizvodnje lekova nisu angažovane osobe sa nekom infektivnom bolešću ili osobe koje imaju rane na otkrivenim delovima tela.
2.18 Svaka osoba koja ulazi u proizvodni prostor treba da nosi zaštitnu odeću koja odgovara radnim postupcima koje ta osoba obavlja.
2.19 U proizvodnom i skladišnom prostoru treba da se zabrani jelo, piće, žvakanje ili pušenje, odnosno držanje hrane, pića, pribora za pušenje ili ličnih lekova. Svaki nehigijenski postupak u proizvodnom prostoru ili u bilo kom delu u kom može štetno da utiče na proizvod, treba da bude zabranjen.
2.20 Treba da se izbegava direktan kontakt između ruku operatera i neupakovanog proizvoda, kao i svakog dela opreme koji dolazi u kontakt sa proizvodom.
2.21 Zaposleni treba da budu obučeni da koriste uređaje za pranje ruku.
2.22 Posebni zahtevi za proizvodnju specifičnih grupa proizvoda, kao na primer sterilnih proizvoda, dati su u aneksima.
2.23 Konsultanti treba da imaju odgovarajuće obrazovanje, obuku i iskustvo, ili kombinaciju navedenog, da bi bili angažovani za pružanje savetodavnih usluga proizvođaču lekova.
Treba da se vodi zapis u kome se navodi ime, adresa, kvalifikacije i vrsta savetodavne usluge za koju je angažovan svaki od konsultanata.
PROSTORIJE I OPREMA
Prostorije i oprema moraju da budu smešteni, dizajnirani, konstruisani, prilagođeni i održavani u skladu sa zahtevima proizvodnih postupaka. Njihov raspored i konstrukcija moraju da budu prilagođeni potrebi minimiziranja rizika od greške i obezbeđenju efektivnog čišćenja i održavanja u cilju sprečavanja unakrsne kontaminacije, nakupljanja prašine i prljavštine, kao i svakog mogućeg štetnog uticaja na kvalitet proizvoda.
Opšti deo
3.1 Prostorije treba da budu smeštene u takvoj sredini koja je, uzimajući u obzir i mere zaštite proizvodnog procesa, najmanje rizična u pogledu kontaminacije polaznih materijala ili gotovih proizvoda.
3.2 Prostorije treba da budu pravilno održavane, tako da popravke i održavanje ne predstavljaju nikakvu opasnost po kvalitet proizvoda. Prostorije treba da budu čišćene i dezinfikovane prema detaljno propisanim procedurama.
3.3 Osvetljenje, temperatura, vlažnost i ventilacija treba da budu odgovarajući i bez štetnog, direktnog ili indirektnog uticaja, kako na lekove u toku njihove proizvodnje i skladištenja, tako i na ispravno funkcionisanje opreme.
3.4 Prostorije treba da budu projektovane i opremljene na način koji maksimalno sprečava ulazak insekata ili drugih štetočina.
3.5 Treba predvideti sve neophodne mere kojima bi se zabranio ulaz neovlašćenim osobama. U prostorije za proizvodnju, skladištenje i kontrolu kvaliteta ne treba neovlašćeno da ulaze osobe koje u njima ne rade.
Proizvodni prostor
3.6 U cilju sprečavanja unakrsne kontaminacije dizajn prostorija i aktivnosti koje se u njima obavljaju treba da budu odgovarajući za sve proizvode. Mere za sprečavanje unakrsne kontaminacije treba da budu srazmerne mogućim rizicima. Za procenu i kontrolu rizika primenjuju se načela Upravljanja rizikom kvaliteta.
U zavisnosti od nivoa rizika, za neke proizvode treba da se obezbede namenske prostorije i oprema za proizvodnju i/ili pakovanje, u cilju kontrole rizika.
Namenske, odvojene prostorije za proizvodnju treba da se obezbede u slučaju kada sam proizvod predstavlja rizik iz jednog od sledećih razloga:
i) rizik ne može uspešno da se kontroliše poznatim operacionim i/ili tehničkim merama;
ii) na osnovu naučnih podataka iz toksikoloških procena rizik nije moguće kontrolisati (npr. alergijski potencijal visoko senzibilizirajućih supstanci kao što su beta laktami), ili
iii) limiti relevantnih rezidua, izvedeni na osnovu toksikološke procene, ne mogu da se na zadovoljavajući način odrede validiranim analitičkim metodama.
Detaljnije uputstvo dato je u Poglavlju 5 i Aneksima 2, 3, 4, 5 i 6.
3.7 Prostorije treba da su raspoređene na način koji omogućava proizvodnju u prostorima logično povezanim u skladu sa redosledom proizvodnih postupaka i potrebnim stepenom čistoće.
3.8 Prilagođenost prostorija za proizvodnju i skladištenje međuproizvoda treba da omogući logičan raspored opreme i dopremanje polaznih supstanci na način koji minimizira rizik od zamene različitih aktivnih supstanci ili njihovih sastojaka, da bi se izbegla unakrsna kontaminacija i minimizirao rizik od propusta ili pogrešne primene bilo kog postupka u proizvodnji ili procesnoj kontroli.
3.9 Tamo gde su polazne supstance i materijal za pakovanje, međuproizvodi ili poluproizvodi (bulk) izloženi ambijentalnim uslovima, unutrašnje površine (zidovi, pod i plafon) treba da budu glatke, bez oštećenja i otvorenih pukotina, bez sitnih čestica i takve da omogućavaju lako i efektivno čišćenje i, u slučaju potrebe, dezinfekciju.
3.10 Cevi, osvetljenje, ventilacija i druge prateće instalacije treba da budu dizajnirane i smeštene tako da nema udubljenja koja su teška za čišćenje. Ako je moguće, oni treba da budu dostupni za održavanje sa spoljašnje strane proizvodnog prostora.
3.11 Slivnik treba da bude odgovarajućih dimenzija i sa zaštićenim odvodom. Otvorene kanale treba izbegavati gde god je to moguće, ali ako su oni neophodni treba da budu plitki kako bi se olakšalo čišćenje i dezinfekcija.
3.12 Proizvodni prostor treba da bude opremljen efektivnom i odgovarajućom ventilacijom i opremom za kontrolu protoka vazduha (uključujući i kontrolu temperature, a gde je to neophodno, i vlažnosti i filtracije), kako za proizvode kojima se rukuje, tako i za postupke koji se u prostoru sprovode, kao i za spoljašnju sredinu.
3.13 Razmeravanje polaznih supstanci treba da se obavlja u posebnim prostorijama za merenje, prilagođenim ovom proizvodnom postupku.
3.14 U slučajevima kada dolazi do stvaranja prašine (npr. tokom uzorkovanja, razmeravanja, mešanja i drugih proizvodnih postupaka, kao i pakovanja praškastih proizvoda) treba da se preduzmu posebne mere kako bi se izbegla unakrsna kontaminacija i olakšalo čišćenje.
3.15 Prostorije za pakovanje lekova treba da budu dizajnirane i raspoređene tako da se izbegnu zabune ili unakrsna kontaminacija.
3.16 Proizvodni prostor treba da bude dobro osvetljen, posebno tamo gde se obavlja vizuelna kontrola na liniji.
3.17 Procesna kontrola može da se se vrši u proizvodnom prostoru na način koji nije rizičan za proizvodnju.
Prostori za skladištenje
3.18 Prostori za skladištenje treba da budu dovoljnog kapaciteta kako bi se omogućilo propisno skladištenje različitih kategorija materijala i proizvoda: polaznih supstanci, materijala za pakovanje, međuproizvoda, poluproizvoda (bulk) i gotovih proizvoda, proizvoda u karantinu, odobrenih, odbijenih, vraćenih ili proizvoda povučenih iz prometa.
3.19 Prostori za skladištenje treba da budu projektovani ili prilagođeni tako da su obezbeđeni odgovarajući uslovi čuvanja i skladištenja. Treba da budu čisti, suvi, a temperaturu treba održavati u okviru prihvatljivog opsega. Tamo gde se zahtevaju posebni uslovi čuvanja proizvoda (npr. temperatura, vlažnost), oni treba da se obezbede, kontrolišu i prate.
3.20 U prijemnom prostoru i prostoru za otpremanje, polazni materijali i proizvodi treba da se zaštite od vremenskih uslova. Prostori za prijem treba da budu dizajnirani i opremljeni na način koji omogućava čišćenje kontejnera sa polaznim supstancama pre skladištenja, ako je to potrebno.
3.21 Tamo gde je karantin obezbeđen skladištenjem u odvojenom prostoru, taj prostor mora da bude jasno označen, a pristup dozvoljen samo ovlašćenim osobama. Bilo koji drugi sistem koji zamenjuje fizički karantin treba da obezbeđuje istu sigurnost.
3.22 Za uzorkovanje polaznih supstanci treba da se obezbedi odvojen prostor. U slučaju kada se uzorkovanje obavlja u delu prostora za skladištenje, potrebno je da se obavlja na način kojim se izbegava kontaminacija ili unakrsna kontaminacija.
3.23 Za skladištenje polaznih supstanci ili gotovih proizvoda koji su odbijeni, vraćeni ili lekova povučenih iz prometa potrebno je da se obezbede odvojeni prostori.
3.24 Visoko aktivne polazne supstance ili gotovi proizvodi treba da budu skladišteni u bezbednom i obezbeđenom prostoru.
3.25 Štampani materijal za pakovanje smatra se kritičnim i posebna pažnja treba da se obrati na bezbedno i sigurno skladištenje ovih materijala, kako ne bi došlo do zamene.
Prostorije kontrole kvaliteta
3.26 Laboratorije za kontrolu kvaliteta treba da budu odvojene od proizvodnih prostora. Ovo je posebno važno za laboratorije za kontrolu bioloških i mikrobioloških proizvoda i radioizotopa, koje takođe treba da budu međusobno odvojene.
3.27 Laboratorije za kontrolu kvaliteta treba da budu dizajnirane tako da odgovaraju operacijama koje će se u njima obavljati. Treba da se obezbedi dovoljno prostora kako bi se izbegla zamena i unakrsna kontaminacija. One treba da raspolažu odgovarajućim prostorom za čuvanje uzoraka i dokumentacije.
3.28 Radi zaštite osetljivih instrumenata od vibracija, električnih interferencija, vlažnosti itd. za njih treba predvideti odvojene prostorije.
3.29 Neophodno je da se obezbede posebni uslovi u laboratorijama u kojima se radi sa supstancama kao što su biološki ili radioaktivni uzorci.
Pomoćne prostorije
3.30 Pomoćne prostorije i prostorije za odmor treba da budu odvojene od drugih prostorija.
3.31 Garderobe, prostorije za pranje i toaleti treba da budu pristupačni i prilagođeni broju korisnika. Toaleti ne treba da budu u direktnoj komunikaciji sa proizvodnim prostorom ili prostorom za skladištenje.
3.32 Radionice za održavanje treba da budu, ukoliko je moguće, odvojene od proizvodnih prostora. U slučaju da su delovi opreme i alat smešteni u prostorijama za proizvodnju, oni treba da se čuvaju u za to namenjenom prostoru ili ormarima.
3.33 Prostorije za životinje treba da budu izolovane od ostalih prostorija, sa odvojenim ulazom i ventilacijom.
3.34 Oprema za proizvodnju treba da bude projektovana, smeštena i održavana na način koji odgovara njenoj nameni.
3.35 Postupci popravki i održavanja ne smeju da predstavljaju opasnost po kvalitet proizvoda.
3.36 Proizvodna oprema treba da bude dizajnirana na način koji omogućava njeno lako i potpuno čišćenje. Oprema treba da se čisti prema detaljnoj, pisanoj proceduri i čuva isključivo u čistom i suvom stanju.
3.37 Oprema za pranje i čišćenje treba da se odabere i koristi tako da ne predstavlja uzrok kontaminacije.
3.38 Oprema treba da bude instalirana na način koji sprečava svaki rizik od greške ili kontaminacije.
3.39 Oprema za proizvodnju ne sme da predstavlja opasnost po proizvod. Delovi proizvodne opreme koji dolaze u kontakt sa proizvodom ne smeju da budu reaktivni, odnosno apsorptivni u meri koja može da utiče na kvalitet proizvoda i tako predstavlja opasnost po proizvod.
3.40 Za proizvodne i kontrolne postupke treba da se obezbede vage i drugi merni instrumenti odgovarajućeg opsega i preciznosti.
3.41 Instrumenti za različita merenja, vage i instrumenti za beleženje i kontrolu kvaliteta treba da budu kalibrisani i kontrolisani odgovarajućim metodama u definisanim vremenskim intervalima. O izvršenim kalibracijama treba da se vode odgovarajući zapisi.
3.42 Fiksirani cevovodi treba da budu jasno obeleženi sa naznakom sadržaja, i po mogućstvu, smerom protoka.
3.43 Cevi za destilovanu vodu, dejonizovanu vodu ako je primenljivo, kao i za druge vrste vode, treba da se sanitizuju prema pisanoj proceduri koja detaljno utvrđuje akcione limite mikrobiološke kontaminacije i mere koje treba da se preduzmu u slučaju prekoračenja.
3.44 Neispravna oprema treba da bude, ako je moguće, izmeštena iz proizvodnih i prostorija za kontrolu kvaliteta ili bar jasno obeležena kao oštećena i neispravna.
DOKUMENTACIJA
Valjana dokumentacija predstavlja osnovu sistema upravljanja kvalitetom i ključni je faktor za funkcionisanje u skladu sa zahtevima dobre proizvođačke prakse. Razne vrste dokumenata i prenosnih medijuma koji se koriste treba da budu detaljno opisani u Sistemu upravljanja kvalitetom proizvođača lekova. Dokumentacija može da se vodi na različite načine, uključujući papirnu, elektronsku formu ili fotografski. Osnovni cilj podrške sistema dokumentacijom je da se uspostave, kontrolišu, prate i zapisuju sve aktivnosti koje, direktno ili indirektno, mogu da utiču na kvalitet lekova. Sistem upravljanja kvalitetom treba da sadrži dovoljno detaljna uputstva kako bi se jasno razumeli postavljeni zahtevi i obezbedilo neophodno vođenje zapisa o različitim procesima i procena bilo kakvih zapažanja, tako da postupanje u skladu sa zahtevom može da se pokaže.
Postoje dve osnovne vrste dokumenata koji se koriste za upravljanje i evidentiranje usaglašenosti sa Dobrom proizvođačkom praksom: instrukcije (uputstva, zahtevi) i zapisi/izveštaji. U zavisnosti od vrste dokumenta treba da se primenjuje dobra praksa u vođenju dokumentacije.
Potrebno je da se uspostavi odgovarajuća kontrola, kako bi se obezbedila tačnost, celovitost, dostupnost i čitljivost dokumenata. Uputstva treba da budu bez grešaka i dostupna u pisanoj formi. Pojam "pisano" znači napisano ili dokumentovano na medijumu sa koga podaci mogu da se prevedu u čitljivu formu.
Potrebna GMP dokumentacija (po vrsti):
Glavna dokumentacija mesta proizvodnje (Site Master File): dokument koji opisuje aktivnosti proizvođača lekova vezane za Dobru proizvođačku praksu.
Dokumentacija tipa instrukcija (uputstva ili zahtevi):
Specifikacije: detaljno opisuju zahteve kojima treba da odgovaraju proizvod ili polazne supstance i materijali koji se koriste ili dobijaju u toku proizvodnje. One služe kao osnova za procenu kvaliteta.
Proizvodne formule, uputstva za proizvodnju, pakovanje i ispitivanje: detaljno opisuju sve polazne materijale, opremu uključujući i kompjuterizovane sisteme (ako su u primeni) koji će se koristiti, kao i detaljna uputstva za proizvodnju, pakovanje, uzorkovanje i ispitivanje. Potrebno je da se navedu procesne kontrole i procesne analitičke tehnologije (PAT) koje će se koristiti, uključujući i kriterijume prihvatljivosti.
Procedure (poznatije kao Standardne operativne procedure - SOP): daju uputstva za obavljanje pojedinih operacija, odnosno aktivnosti.
Protokoli: daju uputstva za obavljanje određenih posebnih aktivnosti.
Ugovori: ugovori zaključeni između davaoca i primaoca ugovora za poverene aktivnosti.
Dokumentacija tipa zapisa, odnosno izveštaja je sledeća:
Zapisi obezbeđuju dokaze o raznim aktivnostima koje su izvršene u skladu sa uputstvima npr. postupci, događaji, istrage, i u slučaju proizvedenih serija omogućavaju uvid u istorijat svake serije leka uključujući i njenu distribuciju. Zapisi podrazumevaju i izvorne podatke koji služe za generisanje drugih zapisa. Za elektronske zapise korisnici treba da definišu koji podaci će se koristiti kao izvorni. Najmanje svi podaci na osnovu kojih se donose odluke o kvalitetu leka treba da se definišu kao izvorni.
Sertifikati analiza: sadrže pregled rezultata ispitivanja uzorka proizvoda ili polaznih materijala5, kao i procenu usaglašenosti sa navedenom specifikacijom.
Izveštaji: dokumenti o sprovođenju određenih provera, projekata ili istraga, zajedno sa rezultatima, zaključcima i preporukama.
_______
5 Alternativno, izdavanje
sertifikata može, delimično ili u potpunosti, da se bazira na proceni podataka
prikupljenih u toku procesa proizvodnje serije leka (rezimirani izveštaji i
izveštaji o izuzecima) iz podataka procesne analitičke tehnologije (PAT) za
seriju, parametara ili mernih podataka po odobrenoj dokumentaciji dozvole za
stavljanje leka u promet.
Izrada i kontrolisanje dokumentacije
4.1 Sve vrste dokumenata koje se koriste treba da budu definisane i treba ih se pridržavati. Zahtevi treba podjednako da odgovaraju svim vrstama dokumenata. Složeni sistemi treba da se razumeju, dobro dokumentuju, validiraju i treba da se uspostave odgovarajuće kontrole. Mnogi dokumenti (uputstva i/ili zapisi) mogu da se vode na dva načina npr. neki delovi dokumenta u elektronskoj, a ostali u papirnoj formi. Veza sa glavnim dokumentima kao i mere kontrolisanja glavnih dokumenta, odobrene
kopije, rukovanje podacima i zapisima treba da budu navedeni kako za one koji se vode i u elektronskoj i papirnoj formi, tako i za one koji se vode na samo jedan od ova dva načina. Potrebno je da se uspostavi odgovarajuća kontrola za elektronska dokumenta, kao što su obrasci, forme i glavni dokumenti. Treba da se uspostave odgovarajuće kontrole kojima se obezbeđuje celovitost zapisa tokom perioda njihovog čuvanja.
4.2 Dokumenta treba da budu pažljivo dizajnirana, pripremljena, pregledana i dostavljana. Ona treba da budu usaglašena sa važećim specifikacijama proizvoda, kao i odgovarajućim delovima iz dokumentacije podnete nadležnoj instituciji uz zahtev za dobijanje dozvole za proizvodnju i dozvole za stavljanje leka u promet. Reprodukovanje radnih dokumenata sa originala ne sme da dovede do greške.
4.3 Dokumenta koja sadrže uputstva treba da budu odobrena, potpisana i datirana od strane odgovornih i ovlašćenih osoba. Dokumenta treba da imaju nedvosmislen sadržaj i da budu obeležena na jedinstven način. Datum stupanja na snagu treba da bude definisan.
4.4 Dokumenta koja sadrže uputstva treba da budu raspoređena na uredan način i laka za proveru. Stil i jezik kojim su napisana dokumenta treba da odgovara njihovoj nameni. Standardne operativne procedure, radna uputstva i metode treba da budu napisani u obavezujućem imperativnom stilu.
4.5 Dokumenta u okviru sistema upravljanja kvalitetom treba da budu redovno pregledana i ažurirana.
4.6 Dokumenta ne treba da budu pisana rukom, a u slučajevima kada je potrebno unošenje podataka u dokumenta, treba da se predvidi dovoljno prostora za unošenje podataka.
4.7 Ručno unošenje podataka u dokumentima treba da se izvrši na jasan, čitak, neizbrisiv način.
4.8 Zapisi treba da se vode ili popune u vreme kada se radnja obavlja i na takav način da mogu da se prate sve značajne aktivnosti vezane za proizvodnju leka.
4.9 Svaka ispravka podataka unetih u dokument treba da budu potpisana i datirana; ispravka treba da se uradi na takav način da je moguće čitanje prvobitnih podataka. Ako je primenljivo, treba da bude naveden i razlog ispravke.
4.10 Treba jasno da se definiše koji zapis se odnosi na koju proizvodnu aktivnost i gde se nalazi taj zapis. Mora da se uspostavi, a po potrebi i da se validira, kontrola bezbednosti dokumenata, kako bi se obezbedila njihova celovitost tokom perioda čuvanja.
4.11 Treba da se uspostave posebni zahtevi za dokumentaciju o seriji leka koja mora da se čuva najmanje godinu dana nakon isteka roka upotrebe gotovog proizvoda, ili najmanje pet godina od izdavanja odobrenja za puštanje u promet od strane QP, ako je to duži period. U slučaju lekova namenjenih za kliničko ispitivanje, dokumentacija o seriji proizvoda mora da se čuva najmanje pet godina od završetka ili zvaničnog prekida poslednjeg kliničkog ispitivanja u kome se koristila ta serija leka. Zahtevi u pogledu čuvanja dokumentacije mogu da budu navedeni i u drugim propisima koji se odnose na specifične proizvode (npr. lekovi za napredne terapije), a u kojima može da bude određen duži period čuvanja određenih dokumenata.
4.12 Za druge vrste dokumenata period čuvanja zavisi od aktivnosti na koje se dokumenta odnose. Kritična dokumentacija, uključujući i izvorne podatke (npr. podaci koji se odnose na izvršene validacije i stabilnost), a koja čini sastavni deo dokumentacije za izdavanje dozvole za stavljanje leka u promet, treba da se čuva do kraja roka na koji je dozvola izdata. Može se smatrati prihvatljivim da se arhiviraju ona dokumenta (npr. izvorni podaci u vezi sa izvršenim validacijama i izveštaji ispitivanja stabilnosti) koja su u potpunosti zamenjena novim podacima. Opravdanje za ovakvo postupanje treba da bude dokumentovano, a treba da se uzme u obzir i propisano vreme čuvanja za dokumentaciju o seriji proizvoda; npr. u slučaju podataka o validaciji procesa, prateći izvorni podaci treba da se čuvaju najmanje do roka do kada treba da se čuvaju zapisi koji se odnose na sve validacione serije.
U nastavku su dati primeri potrebnih dokumenata. U sistemu upravljanja kvalitetom treba da budu opisani svi dokumenti neophodni za obezbeđenje kvaliteta proizvoda i bezbednosti pacijenata.
Specifikacije
4.13 Treba da postoje odobrene i datirane specifikacije za polazne supstance, materijale za pakovanje i gotove proizvode.
Specifikacije za polazne supstance i materijale za pakovanje
4.14 Specifikacije za polazne supstance i unutrašnje ili štampane materijale za pakovanje, ako je to primenljivo, treba da sadrže reference, odnosno upućivanje na sledeće:
a) Opis koji obuhvata:
- dodeljeno ime i internu referentnu šifru;
- referencu, odnosno upućivanje na monografiju iz farmakopeje, ako postoji;
- odobrene dobavljače i, ako je primenljivo, originalnog proizvođača;
- uzorak štampanog materijala;
b) uputstva za uzorkovanje i ispitivanje;
c) kvalitativne i kvantitativne zahteve sa limitima prihvatljivosti;
d) uslove čuvanja i mere predostrožnosti;
e) maksimalno vreme skladištenja pre ponovnog ispitivanja.
Specifikacije za međuproizvode i poluproizvode (bulk)
4.15 Specifikacije za međuproizvode i poluproizvode (bulk) treba da budu dostupne za kritične faze postupka proizvodnje ili ako su oni kupljeni ili isporučeni. Ove specifikacije treba da budu slične specifikacijama za polazne materijale ili gotove proizvode, ako je primenljivo.
Specifikacije za gotove proizvode
4.16 Specifikacije za gotove proizvode treba da sadrže referencu ili da upućuju na sledeće:
a) zaštićeno ime proizvoda i referentnu šifru gde je primenljivo;
b) formulu;
c) opis farmaceutskog oblika i podatke o pakovanju;
d) uputstvo za uzorkovanje i ispitivanje;
e) kvalitativne i kvantitativne zahteve sa limitima prihvatljivosti;
f) uslove čuvanja i posebne mere predostrožnosti pri rukovanju, kad je to primenljivo;
g) rok upotrebe.
Proizvodna formula i uputstva za proizvodnju
Za svaki proizvod i svaku veličinu serije koja se proizvodi treba da postoje zvanično odobrena proizvodna formula i uputstva za proizvodnju.
4.17 Proizvodna formula treba da sadrži:
a) naziv proizvoda, sa šifrom proizvoda koji se odnosi na njegovu specifikaciju;
b) opis farmaceutskog oblika, jačinu proizvoda i veličinu serije;
c) kvantitativni sastav, odnosno spisak svih polaznih supstanci i materijala sa količinom, određenim nazivom i šifrom jedinstvenom za taj materijal. Potrebno je da se navedu i sve supstance koje mogu da nestanu u toku procesa proizvodnje;
d) proračun očekivanog finalnog prinosa sa prihvatljivim odstupanjima (rasturom) i odgovarajuće prinose međuproizvoda, kada je to primenljivo.
4.18 Uputstva za proizvodnju treba da sadrže:
a) mesto proizvodnje i osnovnu opremu koja se koristi;
b) metode ili referencu, odnosno upućivanje na metode koje će se koristiti za pripremu osetljive opreme (npr. čišćenje, sklapanje, kalibracija, sterilizacija);
c) provere koje treba da se izvrše da bi se obezbedilo da su oprema i radna mesta očišćeni od prethodno proizvedenog proizvoda, dokumenata i materijala koji nisu potrebni za planirani proces, kao i da je oprema čista i pogodna za upotrebu;
d) detaljna uputstva za proizvodnju korak po korak [(npr. provera polaznih supstanci, prethodne pripreme, redosled dodavanja supstanci, kritični procesni parametri (vreme mešanja, temperatura i sl.)];
e) uputstvo za sve procesne kontrole, sa limitima;
f) kad je neophodno, zahteve za skladištenje proizvoda u bulk-u, uključujući neophodne kontejnere, obeležavanje i specijalne uslove čuvanja;
g) sve posebne mere predostrožnosti kojih se treba pridržavati.
4.19 Za svaki proizvod, veličinu i tip pakovanja treba da postoji odobreno uputstvo za pakovanje. Ono treba da sadrži referencu ili da upućuje na sledeće:
a) naziv proizvoda; uključujući i broj serije bulk-a i gotovog proizvoda;
b) opis farmaceutskog oblika i jačinu gde je to primenljivo;
c) veličinu pakovanja predstavljenu brojem, jediničnom masom ili zapreminom proizvoda u finalnom pakovanju;
d) kompletan spisak svih neophodnih materijala za pakovanje, uključujući količine, dimenzije i tipove, sa šifrom ili referencom, odnosno upućivanjem na specifikaciju svakog pojedinačnog materijala za pakovanje;
e) kad je odgovarajuće, uzorak ili kopiju odgovarajućeg štampanog materijala za pakovanje i uzorak na kome je naznačeno gde treba staviti podatke o broju serije i roku upotrebe proizvoda;
f) provere koje treba da se izvrše da bi se obezbedilo da su oprema i radna mesta očišćeni od prethodno proizvedenog proizvoda, dokumenata i materijala koji nisu potrebni za planirani proces, kao i da je oprema čista i pogodna za upotrebu;
g) posebne mere predostrožnosti kojih se treba pridržavati, uključujući pažljivu proveru prostora i opreme pre početka pakovanja radi kontrole postupka čišćenja;
h) opis postupaka pakovanja, uključujući i sve značajne pomoćne operacije i opremu koja će da se koristi;
i) detalje o procesnoj kontroli sa uputstvom za uzorkovanje i dozvoljene granične vrednosti.
Evidencija o proizvodnji serije leka
4.20 Evidencija o proizvodnji serije leka treba da se vodi za svaku proizvedenu seriju. Ona treba da se zasniva na odgovarajućim delovima važeće odobrene proizvodne formule i uputstava za proizvodnju i treba da sadrži sledeće podatke:
a) naziv i broj serije proizvoda;
b) datum i vreme početka proizvodnje, značajnih međufaza i završetka proizvodnje;
c) potpis ili paraf izvršioca svih značajnih koraka u procesu i, gde je odgovarajuće, osobe koja je proverila svaki od tih koraka;
d) broj serije i/ili analitički kontrolni broj, kao i količinu svake polazne supstance koja je izmerena (uključujući broj serije i količinu svake dodate supstance koja je u postupku prerade);
e) sve bitne proizvodne operacije ili događaje i glavnu opremu koja se koristi;
f) podatke o procesnoj kontroli, potpis ili paraf osobe koja je izvršila kontrolu i dobijene rezultate;
g) dobijeni prinos proizvoda u različitim i relevantnim fazama proizvodnje;
h) detaljnu belešku o posebnim problemima nastalim u toku proizvodnje, potpisanim odobrenjem za svako odstupanje od proizvodne formule i uputstava za proizvodnju;
i) odobrenje od strane lica odgovornog za proces proizvodnje.
Napomena: U slučaju kada se validirani proces kontinuirano prati i kontroliše, onda automatski prikupljeni izveštaji mogu da se ograniče na rezimirane izveštaje o usaglašenosti i izveštaje o odstupanjima, odnosno izveštaje o rezultatima van specifikacije (OOS)
Evidencija o pakovanju serije leka
4.21 Evidencija o pakovanju serije leka treba da se vodi za svaku proizvedenu seriju leka ili njen deo. Ona treba da bude zasnovana na odgovarajućim delovima uputstva za pakovanje.
Evidencija o pakovanju serije leka treba da sadrži sledeće podatke:
a) naziv i broj serije proizvoda;
b) datum(e) i vreme(na) izvođenja pojedinih operacija pakovanja;
c) potpis ili paraf operatera koji je izvršio svaki značajan korak u procesu i gde je potrebno, osobe koja je proverila svaki od tih koraka;
d) zapise o proverama identiteta i usaglašenosti sa uputstvom za pakovanje uključujući i rezultate procesne kontrole;
e) detalje o izvršenim operacijama pakovanja, uključujući i podatke o korišćenoj opremi i linijama za pakovanje;
f) uvek kada je to moguće, uzorak štampanog materijala za pakovanje, uključujući i uzorak sa odštampanim serijskim brojem i rokom upotrebe proizvoda i svim dodatno odštampanim podacima;
g) detaljnu belešku o posebnim problemima tokom pakovanja ili neočekivanim događajima, sa potpisanim odobrenjem za svako odstupanje od proizvodne formule i uputstva za proizvodnju;
h) količinu i referentni broj ili identifikaciju za sve štampane materijale za pakovanje i bulk proizvode koji su naručeni, upotrebljeni, uništeni ili vraćeni u skladište i količinu dobijenog proizvoda, u cilju obračuna utrošenih količina u odnosu na specifikovane. U slučaju kada se primenjuju opsežne elektronske kontrole tokom pakovanja, može da se potvrdi da nije neophodno navoditi ove podatke u Evidenciji o pakovanju serije leka;
i) odobrenje od strane lica odgovornog za proces pakovanja.
Prijem
4.22 Treba da postoji pisana procedura i zapis o svakom prijemu svake isporuke polaznih supstanci (uključujući međuproizvode, proizvode u bulk-u i gotove proizvode) i unutrašnjeg, spoljnjeg i štampanog materijala za pakovanje.
4.23 Zapis o prijemu treba da sadrži:
a) naziv isporučenog materijala sa dostavnice i kontejnera;
b) interni naziv i/ili šifru materijala, ako je različit od a);
c) datum prijema;
d) naziv isporučioca i naziv proizvođača;
e) broj serije ili referentni broj određen od strane proizvođača;
f) ukupnu primljenu količinu i broj primljenih kontejnera;
g) dodeljeni kontrolni broj nakon prijema;
h) sve značajne napomene.
4.24 Treba da postoji odgovarajuća pisana procedura za interno obeležavanje, karantin i skladištenje polaznih supstanci, materijala za pakovanje i drugih materijala.
Uzorkovanje
4.25 Treba da postoje pisane procedure za uzorkovanje, koje opisuju metode i opremu koja će se koristiti, količinu uzorka koju treba uzeti i sve mere predostrožnosti kojih se treba pridržavati u cilju izbegavanja kontaminacije materijala ili ugrožavanja kvaliteta.
Ispitivanje
4.26 Treba da postoje pisane procedure za ispitivanje svih polaznih meterijala i proizvoda u različitim fazama proizvodnje, sa opisom metoda i opreme koja će se koristiti. O izvršenim ispitivanjima treba da se vode zapisi.
Ostalo
4.27 Treba da postoje pisane procedure za odobravanje i odbijanje polaznih materijala i proizvoda, a posebno za puštanje u promet serija gotovih proizvoda od strane Kvalifikovanog(ih) lica. Svi zapisi treba da budu dostupni Kvalifikovanom licu (QP). Treba da se uspostavi sistem za ukazivanje na posebna zapažanja i sve izmene kritičnih podataka.
4.28 Treba da se vode zapisi o distribuciji svake serije proizvoda (leka) kako bi, u slučaju potrebe, povlačenje serije bilo olakšano.
4.29 Treba u pisanoj formi da postoje politike, procedure, protokoli, izveštaji i pripadajući zapisi o preduzetim merama ili izvedenim zaključcima, kad je to neophodno, za:
- validaciju i kvalifikaciju procesa, opreme i sistema;
- sklapanje opreme i kalibraciju;
- transfer tehnologije;
- održavanje, čišćenje i sanitizaciju;
- osoblje, uključujući listu deponovanih potpisa, podatke o obuci za rad i obuci o Dobroj proizvođačkoj praksi, presvlačenju, zaštitnoj odeći i higijeni, kao i načinu potvrđivanja efektivnosti obuke;
- monitoring ambijentalnih uslova;
- kontrolu štetočina;
- reklamacije;
- povlačenja lekova iz prometa;
- povraćaj lekova iz prometa;
- kontrolu izmena;
- istrage odstupanja i neusaglašenosti;
- interne provere kvaliteta/provere usaglašenosti sa Dobrom proizvođačkom praksom;
- rezimirane zapise, kada je to primereno (npr. pregled kvaliteta proizvoda);
- proveru (audit) dobavljača.
4.30 Treba da postoje jasna uputstva za upotrebu glavne opreme za proizvodnju i kontrolu kvaliteta.
4.31 Dnevnici treba da se vode za veća ili kritična analitička ispitivanja, proizvodnu opremu, kao i za proizvodne prostore. U dnevnicima se hronološki zapisuje svaka upotreba proizvodnih prostorija, opreme/metoda, podaci o kalibracijama, održavanju, čišćenju ili popravkama, uključujući datume i ime osobe(a) koja je to izvršila.
4.32 Treba da se vodi popis dokumenata Sistema upravljanja kvalitetom.
PROIZVODNJA
Sve proizvodne operacije obavljaju se prema jasno definisanim procedurama; moraju da budu u skladu sa principima dobre proizvođačke prakse, kako bi dobijeni proizvod bio zahtevanog kvaliteta i u skladu sa dozvolom za proizvodnju i dozvolom za stavljanje leka u promet.
5.1 Samo obučeno i kompetentno osoblje može da obavlja proizvodnju i vrši nadzor.
5.2 Svako rukovanje materijalima i proizvodima, kao što su prijem, smeštanje u karantin, uzorkovanje, skladištenje, obeležavanje, izdavanje, izrada, pakovanje i distribucija, treba da se vrši u skladu sa pisanim procedurama ili uputstvima što, po potrebi, treba i dokumentovati.
5.3 Svi ulazni materijali treba da budu provereni kako bi se potvrdilo da pošiljka odgovara narudžbini. Po potrebi primljeni kontejneri treba da se očiste i obeleže na propisan način.
5.4 Sva oštećenja kontejnera i drugi nedostaci, koji mogu štetno da utiču na kvalitet polaznih supstanci, treba da budu istražena, dokumentovana, o čemu se izveštaj dostavlja odeljenju kontrole kvaliteta.
5.5 Svi polazni materijali i gotovi proizvodi, nakon prijema ili završetka proizvodnje, treba da budu fizički ili administrativno smešteni u karantin sve do odobravanja njihove upotrebe ili distribucije.
5.6 Sa kupljenim međuproizvodima i poluproizvodima (bulk) pri prijemu treba postupati kao da su polazni materijali.
5.7 Sve polazne supstance i proizvodi treba da se čuvaju u odgovarajućim uslovima, predviđenim od strane proizvođača, i da se skladište na način koji omogućava razdvajanje serija i rotaciju zaliha.
5.8 Potrebno je da se izvrši provera prinosa i obračun utrošenih količina kako bi se potvrdilo da nema odstupanja od prihvatljivih granica.
5.9 Proizvodnja različitih proizvoda ne treba da se obavlja istovremeno ili uzastopno u istoj prostoriji, izuzev u slučaju kada ne postoji opasnost od mešanja ili unakrsne kontaminacije.
5.10 U svakoj fazi proizvodnje proizvodi i materijali treba da budu zaštićeni od mikrobiološke i drugih vrsta kontaminacije.
5.11 U toku rada sa praškastim polaznim supstancama i proizvodima, treba da se preduzmu posebne mere opreza u cilju sprečavanja nastanka i širenja praha. Ovo se posebno odnosi na rad sa visokoaktivnim ili senzibilizirajućim supstancama.
5.12 U toku proizvodnje, svi materijali, kontejneri sa poluproizvodima (bulk), glavni delovi opreme i, ako je primenljivo, prostorije koje se koriste, treba da budu obeleženi ili na drugi način označeni šifrom i nazivom proizvoda ili materijala koji ulaze u proces proizvodnje, jačinom (kad je neophodno) i brojem serije. Tamo gde je primenljivo, oznaka treba da sadrži i podatak o fazi proizvodnje.
5.13 Oznake za kontejnere, opremu i prostorije treba da budu nedvosmislene, jasne i u formatu koji je proizvođač predvideo. Pored pisanog obeležavanja, dodatna upotreba boja za označavanje različitih statusa (npr. u karantinu, odobreno, odbijeno, čisto) može da bude od velike pomoći.
5.14 Potrebno je da se vrši provera ispravnosti cevovoda (vodova) i drugih delova opreme, koji se koriste za transport proizvoda iz jedne u drugu prostoriju.
5.15 Koliko god je moguće treba da se izbegavaju sva odstupanja od pisanih uputstava ili procedura. Ako do odstupanja ipak dođe, ona treba da budu pismeno odobrena od strane za to odgovorne osobe, uz uključivanje odeljenja kontrole kvaliteta, kad je to odgovarajuće.
5.16 Pristup proizvodnim prostorijama treba da se dozvoli samo ovlašćenim zaposlenim licima.
Prevencija unakrsne kontaminacije u proizvodnji
5.17 Po pravilu, u prostorijama i sa opremom predviđenom za proizvodnju lekova treba izbegavati proizvodnju nemedicinskih proizvoda ali, kada je to opravdano, može da bude dozvoljeno kada mogu da se primene mere za sprečavanje unakrsne kontaminacije lekova, a koje su opisane u Poglavlju 3 ove smernice. Proizvodnja i/ili skladištenje otrova, kao što su pesticidi (osim kada se oni upotrebljavaju za proizvodnju lekova) i herbicidi, ne treba da se obavlja u prostorijama koje se koriste za proizvodnju i skladištenje lekova.
5.18 Treba da se spreči kontaminacija polaznih supstanci i proizvoda drugim supstancama ili proizvodima. Treba da se proceni rizik od slučajne unakrsne kontaminacije do koje može da dođe usled nekontrolisanog oslobađanja prašine, gasova, isparenja, aerosola, genetskog materijala ili organizama iz aktivnih supstanci, drugih polaznih materijala i proizvoda u procesu, ostataka na opremi i sa odeće zaposlenih. Značaj ovog rizika zavisi od tipa kontaminacije i proizvoda koji je kontaminiran. Proizvodi kod kojih unakrsna kontaminacija može da ima najveći značaj su oni koji se primenjuju injekciono i oni koji se daju u toku dužeg vremenskog perioda. Međutim, kontaminacija bilo kog leka predstavlja rizik za bezbednost pacijenta koji zavisi od prirode i obima kontaminacije.
5.19 Unakrsna kontaminacija treba da se spreči odgovarajućim dizajnom prostorija i opreme, kao što je opisano u Poglavlju 3. Kontrola rizika od unakrsne kontaminacije treba da bude podržana posvećivanjem pažnje dizajnu procesa i sprovođenju svih relevantnih tehničkih ili organizacionih mera, uključujući efektivne i ponovljive postupke čišćenja.
5.20 Proces upravljanja rizikom kvaliteta, koji uključuje procenu jačine i toksikološku procenu, treba da se primeni za procenu i kontrolu rizika od unakrsne kontaminacije proizvoda koji su proizvedeni. Potrebno je uzeti u obzir i sledeće faktore: dizajn i namenu pogona/opreme, tokove kretanja osoblja i materijala, mikrobiološku kontrolu, fizičko-hemijske karakteristike aktivnih supstanci, karakteristike procesa, postupak čišćenja i analitičke sposobnosti za određivanje relevantnih limita utvrđenih prilikom procene proizvoda. Rezultat procesa upravljanja rizikom kvaliteta treba da bude osnov za određivanje da li i u kojoj meri prostorije i oprema za proizvodnju treba da budu namenski za određeni proizvod ili grupu proizvoda. Ovo može da se odnosi na delove opreme koji dolaze u kontakt sa proizvodom i koji treba da budu namenski, ili na celokupan proizvodni pogon koji treba da bude namenski. U slučaju kada je to opravdano, prihvatljivo je obavljanje proizvodnih aktivnosti u odvojenim, izolovanim proizvodnim prostorima unutar pogona u kome se proizvodi više proizvoda.
5.21 Rezultat procesa upravljanja rizikom kvaliteta treba da bude osnov za određivanje obima tehničkih i organizacionih mera potrebnih za kontrolu rizika od unakrsne kontaminacije. One obuhvataju, ali nisu ograničene na sledeće:
Tehničke mere:
i) namenski proizvodni pogon (prostor i oprema);
ii) proizvodnja u odvojenim proizvodnim prostorijama sa odvojenom opremom za proizvodnju i posebnim sistemom za grejanje, ventilaciju i hlađenje (HVAC). Takođe, poželjno je da određeni pomoćni sistemi budu izolovani od onih koji se koriste u drugim prostorijama;
iii) dizajn proizvodnog procesa, prostora i opreme kako bi se minimizirala mogućnost unakrsne kontaminacije tokom proizvodnje, održavanja i čišćenja;
iv) upotreba "zatvorenih sistema" za proizvodnju i prenos materijala/proizvoda od jednog do drugog dela opreme;
v) primena sistema fizičkih barijera, uključujući izolatore, kao mere izolacije;
vi) kontrolisano uklanjanje praha u neposrednoj blizini izvora kontaminacije, npr. pomoću lokalizovane ekstrakcije vazduha;
vii) namenska oprema, namenski delovi opreme koji dolaze u kontakt sa proizvodom, ili namenski delovi opreme koji se teško čiste (npr. filteri), kao i namenski alat za održavanje;
viii) primena tehnologije za jednokratnu upotrebu;
ix) upotreba opreme koja je dizajnirana tako da se lako čisti;
x) odgovarajuća primena vazdušnih propusnika i kaskade pritisaka u cilju sprečavanja potencijalne čestične kontaminacije unutar određenog prostora;
xi) minimizacija rizika od kontaminacije prouzrokovane recirkulacijom ili ponovnim ulaskom neprečišćenog ili nedovoljno prečišćenog vazduha;
xii) primena automatizovanih sistema čišćenja na mestu ("in place"), čija je efektivnost validirana;
xiii) odvajanje opreme za pranje i sušenje, kao i prostora za čuvanje čiste opreme u okviru zajedničkih prostorija za pranje opreme.
Organizacione mere:
i) namenski proizvodni pogon ili proizvodnja u odvojenim (izolovanim) proizvodnim prostorima na bazi kampanjske, vremenski razdvojene proizvodnje (namenska u određenom vremenskom periodu), posle kojih sledi postupak čišćenja čija je efektivnost validirana;
ii) držanje zaštitne odeće u prostoru u kome se proizvode proizvodi sa posebnim rizikom od unakrsne kontaminacije;
iii) u slučaju proizvoda koji predstavljaju veći rizik, potvrđivanje čišćenja posle svake proizvodne kampanje treba smatrati kao način detekcije kojim se podržava efektivnost pristupa upravljanja rizikom kvaliteta;
iv) u zavisnosti od rizika kontaminacije, potvrđivanje čistoće površina koje ne dolaze u kontakt sa proizvodom i praćenje čistoće vazduha unutar proizvodnog i okolnih prostora, kako bi se dokazala efektivnost kontrolnih mera protiv čestične kontaminacije putem vazduha ili kontaminacije koja se mehanički prenosi;
v) primena posebnih mera za rukovanje otpadom, vodom koja je kontaminirana prilikom pranja i zaprljanom radnom odećom;
vi) evidentiranje prosipanja, slučajnih nezgoda i odstupanja od procedura;
vii) izbor takvog postupka čišćenja prostora i opreme koji sam po sebi ne predstavlja rizik od kontaminacije;
viii) izrada detaljnih zapisa o procesu čišćenja kojima se dokazuje da je čišćenje obavljeno u skladu sa odobrenom procedurom, kao i upotreba etiketa o statusu čistoće prostora i opreme;
ix) kampanjska upotreba zajedničkih prostorija za pranje opreme;
x) nadzor radnog ponašanja osoblja kako bi se obezbedila efektivnost obuke i poštovanje relevantnih proceduralnih kontrola.
5.22 Mere zaštite od unakrsne kontaminacije i njihova efektivnost treba da se periodično proverava na osnovu utvrđenih procedura.
5.23 Studije validacije treba da pojačaju Dobru proizvođačku praksu i treba da se sprovode prema definisanim procedurama. Rezultate i zaključke ovih studija treba zapisati.
5.24 Prilikom uvođenja svake nove proizvodne formulacije ili proizvodnog postupka, treba da se utvrde mere za proveru njihove pogodnosti za rutinsku proizvodnju. Treba da se dokaže da određeni proces, upotrebom specifikovanih polaznih supstanci i opreme, uvek daje proizvod zahtevanog kvaliteta.
5.25 Bitne izmene u procesu proizvodnje, uključujući sve promene opreme ili polaznih materijala, koje mogu da utiču na kvalitet proizvoda, odnosno na ponovljivost procesa, treba da budu validirane.
5.26 Treba da se vrši periodična, kritička revalidacija procesa, odnosno proizvodnih postupaka, radi potvrđivanja postizanja očekivanih rezultata.
5.27 Izbor, kvalifikacija, odobravanje i praćenje dobavljača, odnosno proizvođača polaznih materijala, kao i nabavka i prijem polaznih materijala treba da budu dokumentovani u okviru Farmaceutskog sistema kvaliteta. Obim nadzora treba da bude proporcionalan riziku koji predstavljaju pojedini polazni materijali, uzimajući u obzir njihovo poreklo, proces njihove proizvodnje, složenost lanca snabdevanja, kao i krajnju upotrebu leka koji će se proizvoditi od tih polaznih materijala. Treba da postoje dokazi o odobravanju svakog dobavljača/materijala. Zaposleni koji su uključeni u ove aktivnosti treba da imaju ažurne informacije o dobavljačima, lancu snabdevanja i pratećim povezanim rizicima. Kad god je to moguće, polazne materijale treba nabavljati direktno od proizvođača polaznog materijala.
5.28 Zahtevi u pogledu kvaliteta polaznih materijala koje je postavio proizvođač, treba da se razmotre i usaglase sa dobavljačima. Odgovarajući aspekti proizvodnje, ispitivanja i kontrole, uključujući i zahteve u pogledu rukovanja, obeležavanja, pakovanja i distribucije, reklamacija, povlačenja iz prometa i odbijanje, treba da budu dokumentovani u zaključenom ugovoru o kvalitetu ili specifikaciji.
5.29 Za odobravanje i održavanje statusa dobavljača aktivnih supstanci i pomoćnih supstanci (ekscipijenasa) neophodno je sledeće:
Aktivne supstance6
Treba da se uspostavi sledljivost u lancu snabdevanja aktivnih supstanci, a prateći rizici, od sirovina za proizvodnju aktivnih supstanci do gotovog proizvoda - leka, treba da se zvanično procenjuju i periodično proveravaju. Treba da se preduzimaju određene mere za smanjenje rizika za kvalitet aktivne supstance.
Zapisi o lancu snabdevanja i sledljivost svake aktivne supstance (uključujući i sirovine za proizvodnju aktivne supstance) treba da budu dostupni i da se čuvaju kod proizvođača ili uvoznika aktivne supstance koji se nalazi na teritoriji EEA.
Treba da se vrši provere (audit) proizvođača i distributera aktivnih supstanci u cilju potvrđivanja usaglašenosti sa zahtevima dobre proizvođačke prakse za aktivne supstance i dobre prakse u distribuciji aktivnih supstanci. Proizvođač lekova utvrđuje usaglašenost sa navedenim dobrim praksama, bilo na osnovu lične provere ili provere koju je u njegovo ime izvršilo drugo lice sa kojim je proizvođač zaključio ugovor. U slučaju veterinarskih lekova provere se obavljaju na osnovu procene rizika.
Trajanje i obim provere (audit) treba da budu odgovarajući kako bi se u potpunosti i precizno utvrdila usaglašenost sa Dobrom proizvođačkom praksom, a naročito u pogledu moguće unakrsne kontaminacije drugim materijalima koji se proizvode na istom mestu proizvodnje. U izveštaju provere (audit) treba da se navede sve što je bilo predmet provere, kompletan nalaz stanja, kao i sve neusaglašenosti koje su utvrđene. Takođe, navode se i sve potrebne korektivne i preventivne mere.
Kontrolne i ponovljene provere (audit) treba da se sprovedu u intervalima definisanim na osnovu upravljanja rizikom kvaliteta, kako bi se osiguralo održavanje standarda i nastavila nabavka aktivne supstance preko odobrenog lanca nabavke.
______
6 U članu 46. b Direktive
2001/83/EC dati su specifični zahtevi za uvoz aktivnih supstanci koje će se
koristiti za proizvodnju humanih lekova
Pomoćne supstance (ekscipijensi)
Pomoćne supstance i njihovi dobavljači treba da se kontrolišu u skladu sa rezultatima formalizovane procene rizika kvaliteta koja odgovara "Smernicama za formalizovanu procenu rizika za određivanje odgovarajuće dobre proizvođačke prakse za pomoćne supstance koje se upotrebljavaju u proizvodnji lekova za humanu upotrebu" Evropske Komisije.
5.30 Kod svakog prijema polaznih materijala treba da se proveri celovitost pakovanja, uključujući i zapečaćenost kontejnera ako je primenljivo, kao i usaglašenost podataka sa narudžbenice, dostavnice i etiketa dobavljača sa podacima koje je proizvođaču lekova dostavio odobreni proizvođač i dobavljač polaznog materijala. Provere koje se vrše prilikom prijema svake isporuke treba da se dokumentuju.
5.31 Ukoliko se isporučeni polazni materijal sastoji od više različitih serija, svaka serija mora pojedinačno da se razmatra u procesu uzorkovanja, ispitivanja i odobravanja za upotrebu.
5.32 Polazni materijali u skladištima treba da budu obeleženi na odgovarajući način (videti tačku 5.13). Etiketa treba da sadrži najmanje sledeće informacije:
i) dodeljeno ime i internu referentnu šifru, gde je to primenljivo;
ii) kontrolni broj dodeljen nakon prijema;
iii) kad je primenljivo, status (npr. u karantinu, na ispitivanju, odobren, odbijen);
iv) kada je primenljivo, datum isteka roka upotrebe ili datum kada je neophodno ponovno ispitivanje kvaliteta.
Ukoliko je u primeni potpuno kompjuterizovan sistem skladištenja, ne moraju sve navedene informacije da budu na etiketi.
5.33 Treba da se uspostavi odgovarajuća procedura ili mere za potvrdu sadržaja svakog kontejnera polaznih supstanci. Kontejneri sa poluproizvodima (bulk) iz kojih su uzorci uzeti treba da budu obeleženi (videti Poglavlje 6).
5.34 Za proizvodnju lekova treba da se upotrebljavaju samo polazni materijali čiju je upotrebu odobrila kontrola kvaliteta i čiji je rok upotrebe ispravan.
5.35 Proizvođači lekova su odgovorni za kontrolu kvaliteta polaznog materijala7 u skladu sa odobrenom dokumentacijom dozvole za stavljanje leka u promet. Proizvođači lekova mogu da koriste kompletne ili delimične rezultate ispitivanja od odobrenog proizvađača polaznog materijala, ali najmanje, u skladu sa Aneksom 8, moraju samostalno da izvrše testove identifikacije sadržaja8 svake primljene serije.
______
7 Sličan pristup treba
primenjivati za pakovni materijal, kako je navedeno u tački 5.45
8 Identifikacija sadržaja
polaznih materijala treba da se vrši u skladu sa metodama i specifikacijama
iz dokumentacije dozvole za stavljanje leka u promet
5.36 Obrazloženje za poveravanje poslova kontrole kvaliteta polaznog materijala treba da bude opravdano i dokumentovano, a sledeći zahtevi treba da budu ispunjeni:
i) Posebna pažnja treba da se obrati na kontrolu distribucije (transport, promet na veliko, skladištenje i isporuka) kako bi se održale karakteristike kvaliteta polaznih materijala i obezbedilo da rezultati ispitivanja i dalje odgovaraju isporučenom polaznom materijalu;
ii) Proizvođač leka treba, lično ili preko trećeg lica, da vrši provere (audit) kod davaoca usluga ispitivanja i to u vremenskim intervalima određenim na osnovu rizika na mestu ugovorne kontrole kvaliteta (uključujući i uzorkovanje) polaznog materijala, u cilju obezbeđivanja usaglašenosti sa Dobrom proizvođačkom praksom, specifikacijama i analitičkim metodama opisanim u dokumentaciji dozvole za stavljanje leka u promet;
iii) Sertifikat analize proizvođača/dobavljača polaznog materijala treba da bude potpisan od strane ovlašćenog lica odgovarajućih kvalifikacija i iskustva. Potpisom se potvrđuje da je svaka serija polaznog materijala kontrolisana prema zahtevima specifikacije, osim ako posebno nije dostavljena ovakva potvrda;
iv) Proizvođač leka treba da ima odgovarajuće iskustvo u poslovanju sa proizvođačem polaznog materijala (uključujući i iskustvo u poslovanju preko dobavljača), što podrazumeva i pregled kvaliteta svih prethodno isporučenih serija polaznog materijala i istorijat usaglašenosti kvaliteta pre redukovanja obima kontrole kvaliteta koju vrši proizvođač lekova.
Svaka značajna promena u proizvodnji i kontroli kvaliteta treba da se razmotri;
v) Proizvođač leka treba takođe (u sopstvenoj ili ugovornoj laboratoriji kontrole kvaliteta) da izvrši kompletnu kontrolu kvaliteta polaznog materijala u odgovarajućim vremenskim intervalima koji su određeni na osnovu analize rizika i da te rezultate uporedi sa rezultatima iz sertifikata analize proizvođača ili dobavljača polaznog materijala kako bi se proverila njihova pouzdanost. U slučaju da se utvrdi bilo kakvo neslaganje rezultata, proizvođač lekova treba da sprovede istragu neusaglašenosti i da preduzme odgovarajuće mere. Prihvatanje sertifikata analize proizvođača ili dobavljača polaznog materijala treba da se prekine do završetka sprovođenja tih mera.
5.37 Polazne supstance mogu da odmere i izdaju samo ovlašćene osobe, na osnovu pisanog uputstva, kako bi se obezbedilo da odgovarajuća polazna supstanca bude tačno odmerena u čist i odgovarajuće obeležen kontejner.
5.38 Masa ili zapremina svake izdate polazne supstance treba da se nezavisno proveri i o tome treba da se napravi zapis.
5.39 Polazni materijali izdati za proizvodnju jedne serije proizvoda, treba da se drže na jednom mestu i obeleže na odgovarajući način.
Proizvodni procesi: međuproizvodi i poluproizvodi (bulk)
5.40 Pre početka svakog procesa proizvodnje treba da se preduzmu mere koje će obezbediti da radna mesta i oprema budu čisti i bez polaznih materijala, proizvoda, ostataka proizvoda ili dokumentacije koja nije potrebna za trenutnu proizvodnju.
5.41 Međuproizvodi i poluproizvodi (bulk) treba da se čuvaju pod odgovarajućim uslovima.
5.42 Kritični procesi treba da budu validirani (videti odeljak "validacija" iz ovog poglavlja).
5.43 Procesna kontrola, odnosno sva neophodna ispitivanja parametara u toku procesa proizvodnje i kontrola ambijentalnih uslova treba da se sprovedu i dokumentuju.
5.44 Svako značajno odstupanje od očekivanog prinosa, treba da bude dokumentovano i ispitano.
5.45 Izboru, kvalifikaciji, odobravanju i održavanju dobavljača unutrašnjeg i štampanog materijala za pakovanje treba da se posveti slična pažnja kao u slučaju polaznih supstanci.
5.46 Posebna pažnja treba da se obrati na štampani materijal za pakovanje. On treba da se čuva pod odgovarajućim, bezbednim uslovima kako bi se sprečio neovlašćen pristup. Sečene etikete i drugi štampani materijal u rasutom stanju treba da se čuva i transportuje u odvojenim zatvorenim kontejnerima kako bi se izbegla zamena. Materijal za pakovanje može da se izda za upotrebu samo od strane ovlašćene osobe, na osnovu odobrene i dokumentovane procedure.
5.47 Svakoj isporuci ili seriji unutrašnjeg ili štampanog materijala za pakovanje treba da se dodeli posebna referentna šifra ili identifikaciona oznaka.
5.48 Zastarelo ili neupotrebljeno unutrašnje pakovanje ili štampani materijal za pakovanje treba da se unište, o čemu treba da se vode zapisi.
5.49 Prilikom pripreme procesa pakovanja, posebna pažnja treba da se posveti smanjenju rizika od unakrsne kontaminacije, zabune ili zamene. Različiti proizvodi ne treba da se pakuju jedan u blizini drugog, osim ako između postoji fizička barijera.
5.50 Pre početka procesa pakovanja treba da se preduzmu mere kako bi se obezbedilo da su radni prostor, linija za pakovanje, mašina za štampanje podataka i ostala oprema čisti i da nema proizvoda, prethodno korišćenih polaznih materijala ili dokumentacije koji nisu potrebni za taj proces pakovanja. Čistoća linije za pakovanje treba da se proveri na osnovu odgovarajuće kontrolne liste.
5.51 Naziv i broj serije proizvoda koji se pakuje, treba da bude naznačen na svakom mestu za pakovanje, odnosno liniji za pakovanje.
5.52 Svi proizvodi i materijali za pakovanje koji se koriste, treba da budu provereni nakon dostavljanja odeljenju za pakovanje u pogledu količine, identiteta i usaglašenosti sa uputstvom za pakovanje proizvoda.
5.53 Kontejneri za punjenje treba da budu čisti pre punjenja. Treba da se posveti pažnja sprečavanju kontaminacije i uklanjanju kontaminanata, kao što su staklo i čestice metala.
5.54 Nakon punjenja i zatvaranja kontejnera, njihovo obeležavanje treba da se izvrši što je pre moguće. Ako to nije moguće, treba da se primene odgovarajuće procedure kako bi se sprečila zabuna ili pogrešno obeležavanje proizvoda.
5.55 Ispravnost podataka za štampu (na primer broj serije, rok upotrebe), koji treba da se štampaju odvojeno ili u toku pakovanja, treba da se proveri i o tome vodi zapis. Posebna pažnja treba da se posveti ručnom štampanju, koje treba da se proverava u odgovarajućim intervalima.
5.56 Posebna pažnja treba da se obrati pri upotrebi sečenih etiketa i u slučajevima kada se dodatno štampanje obavlja van linije. Etikete u rolnama su mnogo podesnije za upotrebu, jer se na taj način izbegava moguća zamena.
5.57 Kontrola ispravnosti elektronskog čitača bar-koda, brojača etiketa i slične opreme, treba redovno da se vrši.
5.58 Štampani i utisnuti podaci na materijalu za pakovanje treba da budu uočljivi i otporni na izbleđivanje i brisanje.
5.59 Kontrola proizvoda u toku procesa pakovanja treba da obuhvati, najmanje kontrolu sledećih parametara:
i) opšti izgled pakovanja;
ii) kompletnost pakovanja;
iii) da li je upotrebljen odgovarajući proizvod i materijal za pakovanje;
iv) da li su ispravni podaci koji su dodatno štampani;
v) da li je ispravan rad linijskih monitora.
Uzorci uzeti sa linije za pakovanje ne treba da se vraćaju na pakovanje.
5.60 Proizvodi koji su bili uključeni u neočekivani događaj mogu ponovo da se vrate na proces pakovanja nakon specijalno obavljenog nadzora, istrage neočekivanog događaja i odobrenja od strane odgovorne osobe. Treba da postoji detaljan zapis o ovakvom događaju.
5.61 Treba da se istraži i na odgovarajući način obrazloži svako značajno ili neočekivano neslaganje količina uočeno tokom poređenja broja proizvedenih jedinica gotovog proizvoda sa brojem jedinica poluproizvoda (bulk) i štampanog materijala za pakovanje.
5.62 Nakon završetka procesa pakovanja, neiskorišćeni materijal za pakovanje već označen brojem serije, treba da bude uništen, a uništavanje dokumentovano. U slučaju povraćaja neiskorišćenog štampanog materijala u skladište, povraćaj treba da se izvrši prema dokumentovanoj proceduri.
5.63 Do puštanja serije leka u promet, gotovi proizvodi treba da se čuvaju u karantinu, pod uslovima utvrđenim od strane proizvođača.
5.64 Procena kvaliteta gotovih proizvoda i odgovarajuće dokumentacije pre odobravanja za puštanje proizvoda u promet data je u Poglavlju 6 (Kontrola kvaliteta).
5.65 Nakon odobravanja za puštanje serije leka u promet, gotov proizvod treba da se čuva u skladištu kao upotrebljiva zaliha, pod uslovima utvrđenim od strane proizvođača.
Odbijeni, prerađeni i vraćeni materijali
5.66 Odbijeni materijali i proizvodi treba da budu vidljivo obeleženi kao takvi i da se čuvaju odvojeno u za to predviđenom prostoru za koji je ograničen pristup. Oni treba ili da se vrate dobavljaču, odnosno proizvođaču ili, kad je to primenljivo, prerade ili unište. Bilo koja preduzeta aktivnost treba da bude odobrena i zabeležena od strane za to odgovorne osobe.
5.67 Vraćanje u proces proizvodnje već odbijenog proizvoda vrši se samo u izuzetnim slučajevima. To je dozvoljeno samo u slučaju ako kvalitet gotovog proizvoda nije ugrožen, ukoliko su zahtevi iz specifikacije ispunjeni i ako se to obavlja u saglasnosti sa definisanom i odobrenom procedurom nakon procene mogućeg rizika. O ponovnom puštanju u proces proizvodnje treba da postoji zapis.
5.68 Regenerisanje celokupne ili dela serije koja po kvalitetu odgovara seriji istog proizvoda u određenoj fazi proizvodnje treba prethodno da bude odobreno. Ovo regenerisanje treba da se izvrši prema definisanoj proceduri, nakon procene mogućih rizika, uključujući i mogući uticaj na predviđeni rok upotrebe. Treba da postoji zapis o regenerisanju serije.
5.69 Potreba za dodatnim ispitivanjima svakog gotovog proizvoda koji je bio u postupku prerade ili proizvoda u koji je ugrađena regenerisana serija, treba da se razmotri od strane odeljenja kontrole kvaliteta.
5.70 Proizvod vraćen iz prometa, a koji je bio van kontrole proizvođača, treba da bude uništen, osim ako je kvalitet tog proizvoda nesumnjivo zadovoljavajući, u kom slučaju može da se razmotri njegovo ponovno stavljanje u promet, ponovo obeležavanje ili regenerisanje u sledeću seriju, samo ako je odeljenje kontrole kvaliteta izvršilo kritičku procenu u skladu sa pisanom procedurom. Prilikom ovakve procene treba da se uzme u obzir priroda proizvoda, posebni uslovi čuvanja, stanje i istorijat proizvoda, kao i vreme koje je proteklo od trenutka kada je pušten u promet. U slučaju kada postoji bilo kakva sumnja u kvalitet proizvoda, on se ne sme ponovo pustiti u promet odnosno ponovo upotrebiti, ali je dozvoljeno obavljanje osnovnih hemijskih postupaka u cilju regenerisanja aktivnih supstanci. Svaka preduzeta aktivnost treba da bude dokumentovana na odgovarajući način.
Nestašica leka zbog problema, odnosno ograničenja u proizvodnji
5.71 Proizvođač leka treba da obavesti nosioca dozvole za stavljanje leka u promet o problemima, odnosno ograničenjima u proizvodnji zbog kojih može da dođe do poremećaja u snabdevanju tim lekom. Ovo obaveštenje treba da bude dostavljeno blagovremeno kako bi nosilac dozvole za stavljanje leka u promet mogao da obavesti nadležne institucije o problemu u snabdevanju tim lekom, u skladu sa zahtevima nacionalne regulative.
KONTROLA KVALITETA
Ovo poglavlje treba da se čita zajedno sa svim relevantnim poglavljima smernice dobre proizvođačke prakse.
Osnovne aktivnosti kontrole kvaliteta su uzorkovanje, specifikacije i ispitivanje, kao i postupci organizacije, dokumentovanja i odobravanja kojima se potvrđuje da su sva neophodna i relevantna ispitivanja obavljena i da polazne supstance i gotovi proizvodi nisu upotrebljeni za proizvodnju, odnosno pušteni u prodaju ili promet, pre nego što je utvrđeno da je njihov kvalitet odgovarajući. Kontrola kvaliteta ne obuhvata samo laboratorijska ispitivanja, već mora da bude uključena u donošenje svih odluka koje se odnose na kvalitet proizvoda. Nezavisnost kontrole kvaliteta od proizvodnje osnovni je preduslov za dobro funkcionisanje kontrole kvaliteta.
6.1 Svaki nosilac dozvole za proizvodnju lekova treba da ima Odeljenje Kontrole kvaliteta. Kontrola kvaliteta treba da bude potpuno nezavisna od svih drugih službi, i pod rukovodstvom osobe sa odgovarajućom kvalifikacijom i iskustvom, koja na raspolaganju ima jednu ili više kontrolnih laboratorija. Za efektivno i pouzdano obavljanje svih ispitivanja kontrole kvaliteta obezbeđuju se svi potrebni resursi.
6.2 Osnovna zaduženja rukovodioca kontrole kvaliteta navedeni su u Poglavlju 2. Odeljenje Kontrole kvaliteta obavlja i druge aktivnosti, kao što su npr. uspostavljanje, validacija i implementacija svih procedura u vezi sa kontrolom kvaliteta, nadgledanje kontrole referentnih i/ili kontrolnih uzoraka gotovih proizvoda i polaznih supstanci kada je to primenljivo, obezbeđivanje ispravnog obeležavanja pakovanja materijala i proizvoda, obezbeđivanje praćenja stabilnosti proizvoda, učešće u istrazi reklamacija koje se odnose na kvalitet proizvoda itd. Sve aktivnosti kontrole kvaliteta treba da se obavljaju u skladu sa pisanim procedurama i, kad je to neophodno, da budu zabeležene u odgovarajućim zapisima.
6.3 Procena kvaliteta gotovog proizvoda treba da obuhvati sve značajne faktore, uključujući uslove proizvodnje, rezultate procesne kontrole, pregled dokumentacije o proizvodnji (uključujući i pakovanje), usaglašenost sa specifikacijom gotovog proizvoda kao i kontrolu finalnog pakovanja gotovog proizvoda.
6.4 Osobe zaposlene u kontroli kvaliteta treba da imaju pristup odeljenjima za proizvodnju radi uzorkovanja i ispitivanja, kad je to neophodno.
Dobra kontrolna laboratorijska praksa
6.5 Prostorije i oprema kontrolnih laboratorija treba da odgovaraju opštim i specifičnim zahtevima za kontrolu kvaliteta koji su dati u Poglavlju 3. Da bi se izbegla slučajna unakrsna kontaminacija, laboratorijska oprema ne treba da se rutinski premešta između prostora visokog rizika. Naročito mikrobiološka laboratorija treba da bude organizovana tako da se rizik od unakrsne kontaminacije minimizira.
6.6 Zaposleni, prostorije i oprema u laboratoriji treba da budu prilagođeni zahtevima koji zavise od prirode i obima proizvodnje. Korišćenje ugovornih laboratorija u skladu sa principima datim u Poglavlju 7, odnosno ugovorna kontrola kvaliteta može da bude prihvatljiva iz određenih razloga, ali to treba da bude navedeno u zapisima o kontroli kvaliteta.
Dokumentacija
6.7 Laboratorijska dokumentacija treba da odgovara zahtevima datim u Poglavlju 4. Značajan deo ove dokumentacije odnosi se na ispitivanje kvaliteta i sledeći dokumenti treba da budu na raspolaganju odeljenju kontrole kvaliteta:
i) specifikacije;
ii) procedure koje opisuju uzorkovanje, ispitivanje, zapise (uključujući analitičke radne liste i/ili laboratorijske sveske), vođenje zapisa i verifikaciju;
iii) procedure i zapisi o kalibraciji/kvalifikaciji instrumenata i održavanju opreme;
iv) procedure za istragu rezultata van specifikacije (OOS) i rezultata van trenda (OOT);
v) izveštaji analitičkog ispitivanja i/ili sertifikati analize;
vi) podaci o monitoringu ambijentalnih uslova (voda, vazduh i ostali pomoćni sistemi), kad se zahtevaju;
vii) zapisi o validaciji analitičkih metoda, kad je primenljivo.
6.8 Sva dokumentacija kontrole kvaliteta koja se odnosi na Evidenciju o proizvodnji serije leka treba da se čuva kako je navedeno u Poglavlju 4 ove smernice.
6.9 Za neke podatke (npr. rezultati analitičkih ispitivanja, obračun prinosa, kontrola ambijentalnih uslova itd.) preporučuje se vođenje zapisa na takav način koji omogućava procenu trenda. Svaki rezultat van trenda ili van specifikacije treba da bude istražen.
6.10 Pored informacija koje su sastavni deo Evidencije o proizvodnji serije leka i drugi izvorni podaci kao što su laboratorijska sveska i/ili zapisi treba da se čuvaju i budu uvek dostupni.
Uzorkovanje
6.11 Uzimanje uzoraka treba da se obavi i o tome vodi zapis u skladu sa odobrenom pisanom procedurom koja opisuje:
i) postupak uzorkovanja;
ii) opremu koja se koristi;
iii) količinu uzorka koju treba uzeti;
iv) uputstvo za svaku neophodnu podelu uzorka;
v) tip i kvalitet kontejnera za uzorke;
vi) način obeležavanja uzorkovanih kontejnera;
vii) svaku posebnu meru predostrožnosti koju treba poštovati, posebno one koje se odnose na uzorkovanje sterilnog ili opasnog materijala;
viii) uslove čuvanja;
ix) uputstvo za čišćenje i održavanje opreme za uzorkovanje.
6.12 Uzorci treba da budu reprezentativni za seriju polazne supstance ili proizvoda od kojih su uzorkovani. Radi praćenja najkritičnijih faza procesa proizvodnje (npr. početak ili kraj procesa) mogu se uzeti i drugi uzorci. Izbor plana uzorkovanja mora da bude obrazložen na odgovarajući način i zasnovan na pristupu upravljanja rizikom.
6.13 Kontejneri za uzorke treba da imaju etiketu sa označenim sadržajem, brojem serije, datumom uzorkovanja, kao i brojem kontejnera iz koga je uzorak uzet. Njima treba da se rukuje na takav način da se minimizira mogućnost rizika od zamene, kao i da se uzorci zaštite od neodgovarajućih uslova tokom čuvanja.
6.14 Detaljna uputstva o kontrolnim i referentnim uzorcima data su u Aneksu 19.
Ispitivanja
6.15 Analitičke metode ispitivanja treba da budu validirane. Laboratorija koja primenjuje analitičku metodu za koju nije sama izvršila inicijalnu, odnosno originalnu validaciju, treba da preispita validnost metode ispitivanja. Sve metode ispitivanja prikazane u dokumentaciji koja se prilaže uz zahtev za dobijanje dozvole za stavljanje leka u promet treba da se kasnije sprovode rutinski, u skladu sa odobrenim metodama.
6.16 Dobijeni rezultati treba da se zabeleže. Rezultati parametara koji predstavljaju karakteristike kvaliteta ili se smatraju kritičnim treba da se proveravaju i da se prati njihov trend kako bi se garantovalo da su dobijeni rezultati dosledni. Sve proračune treba kritički ispitati.
6.17 O izvršenim ispitivanjima treba da se vode zapisi koji sadrže najmanje sledeće podatke:
i) naziv materijala ili proizvoda i gde je primenljivo i farmaceutski oblik;
ii) broj serije i naziv proizvođača i/ili dobavljača;
iii) referencu, odnosno upućivanje na odgovarajuću specifikaciju i metodu ispitivanja;
iv) rezultate ispitivanja, uključujući primedbe i proračune, i reference, odnosno upućivanje na sve sertifikate analize;
v) datum ispitivanja;
vi) potpis ili paraf osobe koja je obavila ispitivanja;
vii) potpis ili paraf osobe koja je verifikovala ispitivanje i proračune;
viii) jasnu odluku o odobravanju ili odbijanju (ili drugu odluku o statusu materijala ili proizvoda) i potpis, sa datumom, imenovane odgovorne osobe;
ix) referencu, odnosno upućivanje na opremu koja je korišćena.
6.18 Sva ispitivanja u procesu proizvodnje (procesna kontrola), uključujući i ona koja se obavljaju od strane zaposlenih u proizvodnji, treba da se izvrše po metodama ispitivanja odobrenim od strane kontrole kvaliteta i rezultati zabeleže.
6.19 Posebna pažnja treba da se obrati na kvalitet laboratorijskih reagenasa, rastvore, laboratorijske staklene posude, referentne standarde i hranljive podloge. Oni treba da se pripreme u skladu sa pisanim procedurama.
6.20 Referentni standardi treba da odgovaraju njihovoj nameni. Treba da budu jasno navedene i dokumentovane njihova kvalifikacija i sertifikacija za tu namenu. Kada postoje farmakopejski referentni standardi zvanično priznatog porekla, oni se prvenstveno upotrebljavaju kao primarni referentni standardi, osim ako drugačije nije u potpunosti opravdano (upotreba sekundarnih standarda je dozvoljena ako je njihova sledljivost do primarnog standarda dokazana i dokumentovana). Ove farmakopejske materijale treba koristiti za namenu koja je navedena u monografiji, ako nije drugačije odobreno od strane nacionalne nadležne institucije.
6.21 Laboratorijski reagensi, rastvori, referentni standardi i podloge treba da budu obeleženi datumom pripreme i datumom početka njihove upotrebe i potpisom osobe koja ih je pripremila. Datum isteka roka upotrebe reagenasa i hranljivih podloga treba da bude naznačen na etiketi, kao i posebni uslovi čuvanja. Za volumetrijske rastvore potrebno je da se naznači i poslednji datum standardizacije i važeći faktor.
6.22 Datum prijema svih materijala koji se koriste u metodama ispitivanja (npr. reagensi, rastvori i referentni standardi) treba da bude naznačen na kontejneru. Treba se pridržavati uputstva za njihovu upotrebu i čuvanje. U nekim slučajevima može da bude potrebno ispitivanje identifikacije i/ili druga ispitivanja polaznih supstanci za pripremu reagenasa nakon prijema ili pre upotrebe.
6.23 Hranljive podloge se pripremaju u skladu sa preporukom proizvođača, osim kada je drugačije naučno dokazano. Svojstva svih hranljivih podloga treba da se provere pre njihove upotrebe.
6.24 Upotrebljene mikrobiološke podloge i sojevi treba da se dekontaminiraju u skladu sa standardnom procedurom i da se sa njima rukuje tako da se spreči unakrsna kontaminacija i zadržavanje ostataka. Treba da se odredi, dokumentuje i naučno opravda rok upotrebe mikrobioloških podloga u upotrebi.
6.25 Životinje koje se koriste za ispitivanja polaznih materijala ili proizvoda, treba da se na odgovarajući način čuvaju u karantinu pre upotrebe. Način čuvanja i kontrole treba da obezbedi njihovu pogodnost za nameravanu upotrebu. Potrebno je da budu adekvatno identifikovani i da se vode odgovarajući zapisi koje prikazuju istorijat njihove upotrebe.
Program kontinuiranog praćenja stabilnosti
6.26 Posle puštanja u promet treba da se prati stabilnost proizvoda po odgovarajućem kontinuiranom programu, koji omogućava otkrivanje bilo kakvog problema u vezi sa stabilnošću proizvoda u pakovanju u kome je pušteno u promet (npr. promena nivoa nečistoća, oslobađanje aktivne supstance itd.).
6.27 Svrha programa kontinuiranog praćenja stabilnosti je praćenje proizvoda u toku roka upotrebe, odnosno da se dokaže da proizvod ostaje ili da se može očekivati da ostaje u okviru granica specifikacije, ako se čuva pod deklarisanim uslovima čuvanja.
6.28 Program kontinuiranog praćenja stabilnosti se uglavnom odnosi na proizvode u njihovom finalnom pakovanju u kome se puštaju u promet, ali može da se primeni i na poluproizvode (bulk). Na primer, ako se poluproizvod (bulk) čuva u toku dužeg vremenskog perioda pre postupka pakovanja i/ili otpremanja sa mesta proizvodnje do mesta pakovanja, potrebno je da se ispita uticaj ambijentalnih uslova čuvanja na stabilnost gotovog proizvoda. Dodatno, potrebno je da se razmotri i uticaj na intermedijere/međuproizvode koji se čuvaju i koriste nakon dužeg vremenskog perioda. Stabilnost rekonstituisanog proizvoda treba da se ispita tokom razvoja proizvoda i nije potrebno kontinuirano praćenje njegove stabilnosti. Međutim, kada je relevantno, može da se prati i stabilnost rekonstituisanog proizvoda.
6.29 Program kontinuiranog praćenja stabilnosti treba da bude opisan u pisanom protokolu, u skladu sa opštim zahtevima Poglavlja 4, a rezultati prikazani u obliku izveštaja. Oprema koja se koristi za kontinuirano praćenje stabilnosti (pre svega komore za praćenje stabilnosti) treba da bude kvalifikovana i održavana u skladu sa opštim zahtevima Poglavlja 3 i Aneksa 15.
6.30 Protokol za kontinuirano praćenje stabilnosti treba da obuhvati vreme do kraja roka upotrebe proizvoda, i treba da sadrži najmanje sledeće podatke:
i) broj serije(a) proizvoda posebno za svaku jačinu i različite veličine serija, ako je primenljivo;
ii) odgovarajuće fizičke, hemijske, mikrobiološke i biološke metode ispitivanja;
iii) kriterijume prihvatljivosti;
iv) reference, odnosno upućivanje na metode ispitivanja;
v) opis sistema zatvaranja kontejnera;
vi) termine ispitivanja (vremenske intervale ispitivanja);
vii) opis uslova čuvanja (treba koristiti uslove predviđene ICH/VICH smernicama za dugoročna ispitivanja stabilnosti, u skladu sa obeležavanjem proizvoda);
viii) ostale parametre specifične za određeni lek.
6.31 Protokol za kontinuirano praćenje stabilnosti može da se razlikuje od inicijalnog protokola za dugoročno ispitivanje stabilnosti koji je predat u sastavu dokumentacije za dobijanje dozvole za stavljanje leka u promet ukoliko je opravdano i dokumentovano u protokolu (npr. učestalost ispitivanja, ili u slučaju usklađivanja sa ICH/VICH preporukama).
6.32 Broj serija i učestalost ispitivanja treba da obezbede dovoljan broj podataka za procenu trenda. Ukoliko ne postoji opravdanje za drugačiji pristup, u program kontinuiranog praćenja stabilnosti treba da se uključi najmanje jedna proizvedena serija leka godišnje, u svakoj pojedinačnoj jačini i svakom tipu primarnog pakovanja (osim ako u određenoj godini lek nije proizveden). Za proizvode kod kojih program kontinuiranog praćenja stabilnosti zahteva ispitivanje na životinjama i ne postoje alternativne validirane metode, učestalost ispitivanja može da se određuje na osnovu analize kojom se procenjuje odnos rizika i koristi (risk-benefit). Ukoliko je to naučno opravdano u protokolu, može da se primeni princip grupisanja (bracketing) i sortiranja (matrixing).
6.33 U određenim situacijama, u program kontinuiranog praćenja stabilnosti treba da se uključe i dodatne serije. Na primer, ispitivanje stabilnosti u toku roka upotrebe treba da se izvrši nakon svake značajne promene ili značajnih odstupanja procesa ili pakovanja. Takođe, za uključivanje u program treba da se uzmu u obzir i svi postupci prerade, dorade ili regenerisanja.
6.34 Rezultati kontinuiranog praćenja stabilnosti treba da budu dostupni ključnom osoblju, a naročito Kvalifikovanom licu za puštanje serije leka u promet. Ukoliko se kontinuirano praćenje stabilnosti vrši van mesta proizvodnje poluproizvoda (bulk) ili gotovog proizvoda, treba da postoji pisani ugovor između ugovornih strana. Nadležnim institucijama treba na mestu proizvodnje da budu dostupni na uvid rezultati kontinuiranog ispitivanja stabilnosti.
6.35 Odstupanje od specifikacije ili pojava neuobičajenog trenda, treba da budu istraženi, a potvrđeno odstupanje rezultata od specifikacije ili pojava negativnog trenda koji utiču na serije leka u prometu, prijavljeni nadležnoj instituciji. Mogući uticaj na kvalitet serija leka u prometu treba da se razmotri u skladu sa Poglavljem 8 ove smernice i u konsultaciji sa nadležnim institucijama.
6.36 Sažetak svih prikupljenih podataka, uključujući i sve u međuvremenu izvedene zaključke o programu praćenja stabilnosti leka, treba da bude u pisanoj formi i ažuriran. Ovaj sažetak treba da bude predmet periodičnog pregleda.
6.37 Pre transfera analitičke metode, laboratorija iz koje se vrši transfer treba da potvrdi da analitička metoda odgovara onoj koja je opisana u dokumentaciji dozvole za stavljanje leka u promet ili relevantnoj tehničkoj dokumentaciji. Treba da se pregleda inicijalna, odnosno originalna validacija analitičke metode u cilju provere usaglašenosti sa zahtevima ICH/VICH smernice. Pre transfera analitičke metode treba da se izvrši i dokumentuje analiza razlika u cilju utvrđivanja potrebe za dodatnom validacijom.
6.38 Transfer analitičkih metoda iz jedne laboratorije (laboratorija koja prenosi) u drugu laboratoriju (laboratorija koja prima), treba da bude opisan u detaljnom protokolu.
6.39 Protokol transfera analitičke metode treba da sadrži najmanje sledeće parametre:
i) identifikovanje ispitivanja koje će se vršiti i relevantne analitičke metode koja se prenosi;
ii) identifikovanje dodatnih zahteva u pogledu obuke;
iii) identifikovanje standarda i uzoraka koji će se ispitivati;
v) identifikovanje svih posebnih uslova transporta i čuvanja materijala koji će se ispitivati;
vi) kriterijumi prihvatljivosti koji su zasnovani na važećoj validaciji metode i koji su u skladu sa zahtevima smernica ICH/VICH.
6.40 Odstupanja od protokola treba da se istraže pre završetka procesa tehničkog transfera. Izveštaj o tehničkom transferu treba da dokumentuje uporedni ishod procesa i da identifikuje oblasti koje zahtevaju neophodne revalidacije analitičke metode, ako je to primenljivo.
6.41 U slučaju transfera određenih analitičkih metoda (npr. NIR - bliska infracrvena spektroskopija), potrebno je upućivanje na posebne zahteve opisane u drugim evropskim smernicama.
POVERENE AKTIVNOSTI
Bilo koja aktivnost koja je obuhvaćena Smernicama dobre proizvođačke prakse, a čije je obavljanje povereno, treba da bude definisana na odgovarajući način, dogovorena i kontrolisana kako bi se izbegli nesporazumi koji mogu da dovedu do nezadovoljavajućeg kvaliteta proizvoda ili rada. Mora da postoji pisani ugovor između davaoca i primaoca ugovora kojim su jasno definisane obaveze svake ugovorne strane. U Sistemu upravljanja kvalitetom davaoca ugovora jasno mora da bude naveden način na koji Kvalifikovano lice pušta svaku seriju proizvoda u promet izvršavajući sve zakonske i ugovorne obaveze pod punom odgovornošću.
Napomena:
Ovo poglavlje govori o odgovornostima proizvođača u odnosu na nadležne institucije zemalja članica EU, a vezano za dobijanje dozvole za proizvodnju i dozvole za stavljanje leka u promet. Ovim se ne želi ni na koji način uticati na odgovornost primaoca i davaoca ugovora prema korisnicima, što je predmet drugih zakona EU i nacionalnih zakona.
7.1 Treba da postoji zaključen pisani ugovor kojim su obuhvaćene poverene aktivnosti, proizvodi ili procesi na koje se poverene aktivnosti odnose, sa svim tehničkim detaljima ugovora.
7.2 Svi dogovori o poverenim aktivnostima, uključujući i sve predložene izmene tehničkih ili drugih detalja ugovora, treba da budu u skladu sa važećim propisima i dozvolom za stavljanje leka u promet, kada je to primenljivo.
7.3 U slučaju kada proizvođač leka nije istovremeno i nosilac dozvole za stavljanje leka u promet, između njih treba da postoji zaključen odgovarajući ugovor koji sadrži principe opisane u ovom poglavlju.
7.4 Farmaceutski sistem kvaliteta davaoca ugovora treba da obuhvati kontrolu i procenu svih poverenih aktivnosti. Davalac ugovora je u krajnjem odgovoran da obezbedi kontrolu poverenih aktivnosti. Ovi procesi treba da obuhvataju principe upravljanja rizikom kvaliteta i posebno da sadrže:
7.5 Pre poveravanja aktivnosti davalac ugovora treba da izvrši procenu zakonitosti poslovanja primaoca ugovora, njegove podobnosti i kompetentnosti za uspešno izvršenje ugovorenih poslova. Davalac ugovor ja odgovoran i da su odredbe ugovora u saglasnosti sa principima ove smernice.
7.6 Davalac ugovora treba primaocu ugovora da obezbedi sve informacije neophodne za izvršavanje ugovorenih poslova u skladu sa važećim propisima i dokumentacijom dostavljenom uz zahtev za dobijanje dozvole za stavljanje leka u promet. Davalac ugovora treba da obezbedi da je primalac potpuno obavešten o svim problemima u vezi sa proizvodom ili postupcima koji mogu štetno da utiču na prostor, opremu, zaposlene, ostale polazne materijale ili druge proizvode.
7.7 Davalac ugovora treba da prati i kontroliše poverene aktivnosti koje obavlja primalac ugovora i da utvrdi potrebu za neophodnim poboljšanjima.
7.8 Davalac ugovora je odgovoran za pregled i procenu zapisa i rezultata u vezi sa poverenim aktivnostima. Takođe, davalac ugovora treba, lično ili na osnovu izjave Kvalifikovanog lica (QP) primaoca ugovora, da obezbedi da se sa svim polaznim materijalima ili proizvodima koje mu je isporučio primalac ugovora postupalo u skladu sa Smernicama dobre proizvođačke prakse i dozvolom za stavljanje leka u promet.
7.9 Primalac ugovora mora da ima odgovarajuće prostorije, opremu, znanje i iskustvo za korektno izvršenje aktivnosti predviđenih ugovorom.
7.10 Primalac ugovora treba da garantuje da svi proizvodi, polazni materijali i podaci koji su mu dostavljeni, odgovaraju njihovoj predviđenoj nameni.
7.11 Primalac ugovora ne treba da prenese trećoj strani ni jedan od poslova koji su mu povereni po ugovoru, bez prethodne procene i saglasnosti davaoca ugovora. Dogovori između primaoca ugovora i bilo koje treće strane treba da obezbede da su podaci i rezultati podugovorenih aktivnosti, uključujući i podatke o proceni podobnosti treće strane, dostupni na isti način kao i između prvobitnih ugovornih strana.
7.12 Primalac ugovora ne treba da vrši neodobrene izmene koje nisu predmet ugovora, a koje mogu štetno da utiču na kvalitet ugovorenih aktivnosti.
7.13 Primalac ugovora treba da zna da su sve ugovorene aktivnosti, uključujući i ugovornu kontrolu kvaliteta, predmet inspekcije nadležnih organa.
7.14 Ugovor, u pisanoj formi, zaključen između davaoca i primaoca treba da precizira njihove pojedinačne odgovornosti, kao i razmenu informacija koje se odnose na poverene aktivnosti. Tehnički aspekti ugovora treba da budu napisani od strane kompetentne osobe sa odgovarajućim znanjem o poverenoj aktivnosti i Smernicama dobre proizvođačke prakse. Svi ugovori o poverenim aktivnostima moraju da budu u skladu sa važećim propisima i dokumentacijom dostavljenom uz zahtev za dobijanje dozvole za stavljanje leka u promet i odobreni od obe strane.
7.15 U ugovoru treba da budu jasno definisane odgovornosti ugovornih strana za svaki korak poverene aktivnosti, npr. upravljanje znanjem, transfer tehnologije, lanac distribucije, podugovaranje, kvalitet i nabavka materijala, kontrola kvaliteta i odobravanje za upotrebu polaznih materijala, proizvodnja i kontrola kvaliteta leka (uključujući i procesne kontrole, uzorkovanje i ispitivanje uzoraka).
7.16 Svi zapisi i dokumentacija u vezi poverenih aktivnosti (npr. dokumentacija o proizvodnji, kontroli kvaliteta i distribuciji leka), kao i referentni uzorci treba da se čuvaju kod davaoca usluga ili da mu budu dostupni. Dokumentacija neophodna za procenu kvaliteta leka u slučaju reklamacija, sumnje u defekt kvaliteta leka ili za potrebe istrage u slučaju sumnje u pojavu falsifikovanog leka, mora da bude dostupna i definisana u relevantnoj proceduri davaoca ugovora.
7.17 Ugovor treba da omogući davaocu ugovora da izvrši proveru ugovorenih aktivnosti koje obavlja primalac ugovora ili zajednički dogovoreni podugovarači.
REKLAMACIJE, DEFEKTI KVALITETA I POVLAČENJE LEKA IZ PROMETA
U cilju zaštite zdravlja ljudi i životinja, treba da se uspostavi sistem i odgovarajuće procedure u skladu sa kojima se vode zapisi, vrše procene, istrage i pregled reklamacija, uključujući i potencijalne defekte kvaliteta, na osnovu kojih se, ako je to potrebno, efektivno i brzo iz prometa povlače lekovi za primenu u humanoj ili veterinarskoj medicini, kao i lekovi namenjeni za kliničko ispitivanje. Prilikom istrage i procene defekata kvaliteta, kao i u procesu donošenja odluke o povlačenju leka iz prometa, određivanja korektivnih i preventivnih mera i drugih mera za smanjenje rizika, treba da se primene principi upravljanja rizikom kvaliteta. Principi upravljanja rizikom kvaliteta dati su u Poglavlju 1.
Nadležne institucije treba da budu blagovremeno obaveštene o utvrđenom defektu kvaliteta leka (greška u proizvodnji leka, neodgovarajući kvalitet leka, otkrivanje falsifikovanog leka, neusaglašenost sa dozvolom za stavljanje leka u promet ili specifikacijom proizvoda, ili neki drugi ozbiljan problem u vezi sa kvalitetom), odnosno leka namenjenog za kliničko ispitivanje, zbog koga može da se povuče lek iz prometa ili može da dođe do poremećaja u snabdevanju lekom. Kada se za lek koji je u prometu utvrdi da nije u skladu sa dozvolom za stavljanje u promet, ne postoji zahtev da se o tome obaveste nadležne institucije ukoliko stepen neusaglašenosti odgovara ograničenjima navedenim u Aneksu 16 u pogledu postupanja kod neplaniranih odstupanja.
U slučaju poverenih aktivnosti, zaključeni ugovor treba da definiše ulogu i odgovornosti proizvođača leka, nosioca dozvole za stavljanje leka u promet i/ili sponzora, kao i svih trećih relevantnih strana, u vezi procene, donošenja odluke, dostavljanja informacija i sprovođenja mera za smanjenje rizika od neusaglašenog proizvoda. smernice u vezi ugovora date su u Poglavlju 7. Ti ugovori treba da obuhvate i način na koji se kontaktiraju odgovorne osobe za postupanje u slučaju defekta kvaliteta i povlačenja leka iz prometa svake od ugovornih strana.
8.1 Za upravljanje istragom u slučaju reklamacija i defekta kvaliteta, kao i donošenje odluke o merama koje je potrebno preduzeti u slučaju potencijalnog rizika, treba da se odredi osoblje sa odgovarajućom obukom i iskustvom. Ove osobe treba da budu nezavisne od službi prodaje i marketinga, osim ako drugačije nije opravdano. Ako ni jedna od ovih osoba nije Kvalifikovano lice odgovorno za puštanje u promet predmetne serije ili serija leka, QP treba zvanično i blagovremeno da bude obavešteno o svim istragama, merama za smanjenje rizika i povlačenju iz prometa.
8.2 Treba da postoji dovoljno osoblja i resursa za odgovarajuće postupanje, procenu, istrage i pregled reklamacija i defekta kvaliteta, kao i za sprovođenje svih mera za smanjenje rizika. Treba da postoji i dovoljno obučenog osoblja i resursa za upravljanje uzajamnom komunikacijom sa nadležnim institucijama.
8.3 Treba uzeti u obzir učešće multidisciplinarnih timova uključujući i odgovarajuće obučeno osoblje službe za upravljanje kvalitetom.
8.4 U slučaju kada se postupanje sa reklamacijama i defektom kvaliteta upravlja na centralnom nivou u okviru organizacije, treba da se dokumentuju uloge i odgovornosti uključenih strana. Međutim, upravljanje na centralnom nivou ne sme da dovede do kašnjenja u istrazi i upravljanju istragom.
Procedure za postupanje i istragu reklamacija i potencijalnih defekata kvaliteta
8.5 Treba da postoji pisana procedura sa opisanim merama koje treba preduzeti u slučaju prijave reklamacije. Svaka reklamacija treba da bude dokumentovana i procenjena kako bi se utvrdilo da li predstavlja potencijalni defekt kvaliteta ili je druge prirode.
8.6 Posebna pažnja treba da se posveti utvrđivanju da li se reklamacija ili sumnja u defekt kvaliteta odnosi na falsifikovanje.
8.7 Reklamacije koje ne ukazuju na potencijalni defekt kvaliteta treba da se dokumentuju na odgovarajući način i proslede timu ili osobi zaduženoj za istragu i postupanje sa reklamacija te vrste (npr. prijave sumnje na neželjena dejstva leka).
8.8 Treba da postoje procedure za olakšavanje postupanja po zahtevu za ispitivanje kvaliteta serije leka, kao podrška za istragu prijavljenog neželjenog dejstva.
8.9 Kada se pokrene istraga defekta kvaliteta, treba da postoji procedura koja obuhvata najmanje sledeće:
i) opis prijavljenog defekta kvaliteta;
ii) određivanje klase defekta kvaliteta. U tom cilju može da se izvrši provera ili kontrola kvaliteta referentnih i/ili rezervnih uzoraka, a u nekim slučajevima treba da se izvrši pregled dokumentacije o proizvodnji serije leka, dokumentacije o kontroli kvaliteta serije leka, kao i zapisa o distribuciji (naročito za proizvode osetljive na temperaturu);
iii) potrebu da se traži uzorak ili povraćaj iz prometa proizvoda na koji se odnosi reklamacija, a kada je uzorak dostupan, potrebu da se izvrši odgovarajuća procena;
iv) procenu rizika koji predstavlja defekt kvaliteta, na osnovu ozbiljnosti i klase defekta kvaliteta;
v) proces donošenja odluke koji će se koristiti u vezi sa potencijalnom potrebom za preduzimanje mera za smanjenje rizika u lancu distribucije, kao što su povlačenje leka ili njegove serije iz prometa ili druge mere;
vi) procenu uticaja povlačenja leka iz prometa na dostupnost leka pacijentima/za životinje na bilo kom zahvaćenom tržištu, kao i potrebu obaveštavanja nadležnih institucija o takvom uticaju;
vii) dostavljanje obaveštenja unutar i van kompanije o defektu kvaliteta i sprovedenoj istrazi;
viii) utvrđivanje potencijalnog osnovnog uzroka defekta kvaliteta;
ix) potrebu da se utvrde i sprovedu odgovarajuće korektivne i preventivne mere (CAPA), kao i za procenu efektivnosti tih mera.
8.10 Sve informacije o mogućem defektu kvaliteta treba da budu dokumentovane, uključujući sve izvorne podatke. Opravdanost i obim svih prijavljenih defekata kvaliteta treba da budu dokumentovani i procenjeni u skladu sa principima upravljanja rizikom kvaliteta, kao podrška za donošenje odluke o obimu istrage i merama koje je potrebno preduzeti.
8.11 Ako se otkrije ili se sumnja u neispravnost jedne serije proizvoda, potrebno je proveriti i druge serija tog leka, a u nekim slučajevima i druge lekove, kako bi se utvrdilo da li su i one neispravne. Posebno treba ispitati one serije leka koje sadrže delove neispravne serije ili neispravne komponente.
8.12 Istraga defekta kvaliteta treba da obuhvati i pregled prethodnih izveštaja o defektu kvaliteta ili druge relevantne informacije koje mogu da ukažu na specifične ili probleme koji se ponavljaju, a koji zahtevaju pažnju i eventualno dalje regulatorne mere.
8.13 Sve odluke donete u toku i posle istrage defekta kvaliteta treba da odgovaraju nivou rizika koji defekt kvaliteta predstavlja, kao i ozbiljnosti svake neusaglašenosti sa zahtevima dozvole za stavljanje leka u promet/specifikacije proizvoda ili Smernicama dobre proizvođačke prakse. Odluke treba da budu donete na vreme, kako bi se sačuvala bezbednost pacijenata/životinja, kao i da su srazmerne nivou rizika.
8.14 Iako u ranim fazama istrage nisu uvek dostupne sveobuhvatne informacije o prirodi i obimu defekta kvaliteta, neophodno je da procesi donošenja odluka obezbede preduzimanje odgovarajućih mera za smanjenje rizika u odgovarajućem trenutku tokom te istrage. Sve odluke i mere preduzete u vezi sa defektom kvaliteta treba da budu dokumentovane.
8.15 Proizvođač lekova treba o defektu kvaliteta blagovremeno da obavesti nosioca dozvole za stavljanje leka u promet/sponzora i sve nadležne institucije u slučaju kada defekt kvaliteta može da prouzrokuje povlačenje leka iz prometa ili poremećaj u snabdevanju.
Analiza osnovnog uzroka i korektivne i preventivne mere
8.16 Tokom istrage defekta kvaliteta potrebno je primeniti odgovarajući nivo analize osnovnog uzroka. U slučajevima kada ne može da se utvrdi pravi uzrok (uzroci) nastanka defekta kvaliteta, pažnja treba da se usmeri na utvrđivanje najverovatnijeg osnovnog uzroka.
8.17 U slučaju kada se sumnja ili je dokazano da je ljudska greška uzrok defekta kvaliteta, to treba da bude obrazloženo vodeći računa da se ne previde procesne, proceduralne ili sistemske greške ili problemi, ako postoje.
8.18 Treba da se definišu i preduzmu odgovarajuće korektivne i preventivne mere (CAPA) u vezi sa defektom kvaliteta. Efektivnost ovih mera treba da se prati i procenjuje.
8.19 Potrebno je da se vrši pregled zapisa o defektu kvaliteta i redovno da se vrši analiza trenda u slučaju svake pojave specifičnih ili problema koji se ponavljaju, a koji zahtevaju pažnju.
Povlačenje proizvoda iz prometa i druge mere za smanjenje rizika
8.20 Treba da se uspostave pisane procedure koje se redovno pregledaju i ažuriraju po potrebi, kako bi se preduzele bilo koje aktivnosti povlačenja leka iz prometa ili sprovele druge mere za smanjenje rizika.
8.21 Posle puštanja serije leka u promet, svaki povraćaj iz prometa zbog defekta kvaliteta treba da se posmatra i u vezi sa njim postupa kao da je u pitanju povlačenje iz prometa (ova odredba se ne primenjuje u slučaju povraćaja ili vraćanja iz prometa uzoraka leka radi istrage defekta kvaliteta).
8.22 Treba da se obezbedi mogućnost trenutnog započinjanja postupka povlačenja leka u bilo koje vreme. U određenim slučajevima postupak povlačenja leka iz prometa treba da se pokrene u cilju zaštite zdravlja ljudi ili životinja, pre utvrđivanja uzroka i klase defekta kvaliteta.
8.23 Zapisi o distribuciji serije/proizvoda treba da budu lako dostupni osobama odgovornim za sprovođenje postupka povlačenja i da sadrže dovoljno informacija o veleprodajama i kupcima kojima se lek direktno isporučuje (adrese, brojevi telefona/faksa u radno vreme i van radnog vremena, isporučene serije i količine), uključujući i podatke o izvezenim proizvodima i dostavljenim uzorcima.
8.24 U slučaju lekova namenjenih za kliničko ispitivanje, treba da budu poznata sva mesta ispitivanja i navedene zemlje i destinacije u kojima se nalaze mesta ispitivanja. Kada se klinički ispituju lekovi za koje je izdata dozvola za stavljanje u promet, proizvođač leka treba, u saradnji sa sponzorom, da obavesti nosioca dozvole za stavljanje leka u promet o svakom defektu kvaliteta koji može da se dovede u vezu sa lekom za koji je izdata dozvola. Kada je potrebno hitno povlačenje leka sponzor treba da sprovede proceduru za hitno otkrivanje identiteta leka (dešifrovanje). Sponzor treba da obezbedi da se tokom ove procedure otkriva identitet maskiranog proizvoda u onoj meri u kojoj je to potrebno.
8.25 Nakon konsultacija sa nadležnim institucijama, treba da se razmotri do kog nivoa u lancu distribucije će se vršiti povlačenje leka, uzimajući u obzir potencijalni rizik za zdravlje ljudi ili životinja i svaki uticaj koji predloženo povlačenje leka može da ima. Nadležne institucije treba obavestiti i u slučajevima kada se predlaže povlačenje iz prometa serije leka kojoj je istekao rok upotrebe (u slučaju lekova sa kratkim rokom upotrebe).
8.26 O nameri povlačenja leka iz prometa treba unapred da budu obaveštene sve nadležne institucije zemalja u kojima je proizvod distribuiran. Za ozbiljne slučajeve (npr. slučajevi koji mogu ozbiljno da utiču na zdravlje pacijenata ili životinja), hitne mere za smanjenje rizika (kao što je povlačenje leka iz prometa) mogu da se preduzmu pre obaveštavanja nadležnih institucija. Kad god je moguće, pre sprovođenja, treba da se pokuša da se kontaktiraju nadležne institucije i sa njima uspostavi dogovor.
8.27 Treba razmotriti da li predložena mera povlačenja leka iz prometa može na različite načine da utiče na razna tržišta, a kada je to slučaj, potrebno je, u dogovoru sa nadležnim institucijama, preduzeti odgovarajuće mere za smanjenje rizika specifične za svako tržište. U zavisnosti od terapijskih indikacija, treba da se razmotri rizik od nestašice određenog leka za koji ne postoji terapijska alternativa, i to pre donošenja takve odluke za smanjenje rizika kao što je povlačenje leka iz prometa. Svaka odluka da se ne preduzme mera za smanjenje rizika u slučaju kada je ona potrebna, treba prethodno da bude dogovorena sa nadležnim institucijama.
8.28 Do donošenja odluke o daljem tretmanu, lekovi povučeni iz prometa treba da se obeleže na odgovarajući način i čuvaju odvojeno u obezbeđenom i za to predviđenom prostoru. Zvaničan raspored svih povučenih serija lekova treba da bude dokumentovan. Obrazloženje za donošenje odluke o eventualnoj doradi/preradi lekova povučenih iz prometa treba da bude dokumentovano i razmotreno sa nadležnim institucijama. U slučaju razmatranja mogućnosti za stavljanje u promet serije leka koja je dorađena/prerađena, treba da se razmotri preostali rok upotrebe te serije leka.
8.29 Postupak povlačenja leka iz prometa treba da se dokumentuje u svim fazama do njegovog završetka, a završni izveštaj, u pisanoj formi, treba da obuhvati i obračun distribuiranih količina i količina leka povučenih iz prometa.
8.30 Efektivnost postupka povlačenje leka iz prometa treba periodično da se proverava u cilju potvrđivanja da je on i dalje odgovarajući i sveobuhvatan. Ova provera treba da obuhvati situacije u toku i van radnog vremena, a treba razmotriti i potrebu da se izvrši simulacija postupka povlačenja iz prometa u cilju provere njegove efektivnosti. Provera efektivnosti postupka povlačenja treba da bude dokumentovana i obrazložena.
8.31 Osim povlačenja iz prometa, mogu da se razmotre i druge mere za smanjenje potencijalnog rizika u slučaju defekta kvaliteta. Takve mere mogu da obuhvataju dostavljanje pisanog upozorenja zdravstvenim radnicima o upotrebi serije leka za koju postoji mogućnost da je neispravna. Ovakve mere za smanjenje rizika treba, za svaki pojedinačan slučaj, da se razmotre sa nadležnim institucijama.
INTERNE PROVERE
Princip
Interne provere treba da se vrše radi praćenja primene i usaglašenosti sa principima dobre proizvođačke prakse, kao i radi predlaganja neophodnih korektivnih mera.
9.1 U cilju potvrđivanja usaglašenosti sa principima obezbeđenja kvaliteta, potrebno je periodično, po unapred definisanom planu, proveravati osoblje, prostorije, opremu, dokumentaciju, proizvodnju, kontrolu kvaliteta, distribuciju lekova, rešavanje reklamacija i povlačenje lekova iz prometa i interne provere.
9.2 Interne provere, nezavisno i detaljno, treba da obavlja kompetentna osoba(e) zaposlena kod proizvođača lekova. Nezavisne provere izvršene od strane spoljnih eksperata mogu takođe da budu korisne.
9.3 O svim internim proverama treba da se vodi zapis. Izveštaj treba da sadrži sva zapažanja uočena tokom provere, kao i predloge korektivnih mera. Takođe, treba da se vode zapisi o naknadno preduzetim merama.
PROIZVODNJA STERILNIH LEKOVA
Proizvodnja sterilnih proizvoda podleže posebnim zahtevima u cilju minimizacije rizika od mikrobiološke kontaminacije, kontaminacije česticama i pirogenim supstancama. Proizvodnja sterilnih proizvoda u mnogome zavisi od veština, obučenosti i ponašanja osoblja. Obezbeđenje kvaliteta je od posebnog značaja, tako da se pri ovoj vrsti proizvodnje moraju strogo poštovati pažljivo uspostavljene i validirane metode izrade i procedure. U pogledu sterilnosti i drugih aspekata kvaliteta, ne sme se oslanjati isključivo na završne postupke proizvodnje i završnu kontrolu kvaliteta gotovog proizvoda.
Napomena:
Aneks ne daje detaljne metode za određivanje mikrobiološke i čestične čistoće vazduha, površina i dr. Ovaj aneks sadrži reference, odnosno upućuje na druga dokumenata kao što su EN/ISO standardi.
1. Proizvodnju sterilnih proizvoda treba obavljati u čistim prostorima ("čistim sobama") sa obezbeđenim ulaskom osoblja i/ili opreme i materijala preko vazdušnih propusnika. Čisti prostori treba da se održavaju prema odgovarajućem standardu čistoće, a dovod vazduha treba da bude preko filtera odgovarajuće efikasnosti.
2. Različite postupke pripreme komponenti, izrade proizvoda i punjenja treba obavljati u odvojenim prostorima u okviru čistog prostora. Proizvodni postupci su podeljeni u dve kategorije: prva - oni u kojima se proizvod steriliše na kraju procesa (završna, odnosno terminalna sterilizacija), i druga - oni koji se, u nekoj ili u svim fazama, sprovode aseptično.
3. Čisti prostori za proizvodnju sterilnih proizvoda su klasifikovani u skladu sa zahtevanim karakteristikama okruženja. Svaki proizvodni postupak zahteva odgovarajući nivo čistoće okruženja u toku rada, kako bi se minimizirao rizik od mikrobiološke i čestične kontaminacije proizvoda ili materijala kojima se rukuje.
Da bi se zadovoljili uslovi "stanja u radu", ovi prostori treba da budu dizajnirani tako da se postigne odgovarajući definisan nivo čistoće vazduha u "stanju mirovanja". "Stanje mirovanja" je ono stanje pri kome su sve instalacije postavljene i u operativnom su stanju, proizvodna oprema je kompletno postavljena, ali osoblje koje treba da radi nije prisutno. "Stanje u radu" je ono stanje pri kome instalacije funkcionišu na definisan način, uz prisustvo i rad prethodno određenog broja osoblja.
"Stanje u radu" i "stanje mirovanja" treba definisati za svaku čistu sobu ili više funkcionalno povezanih čistih soba.
Postoje 4 klase čistih prostora za proizvodnju sterilnih lekova:
Klasa A: ograničena zona u kojoj se vrše visoko rizični postupci, npr. prostor u kojem se vrši postupak punjenja, zatvaranja bočica, prostor u kome se nalaze otvorene ampule i bočice, prostori u kojima se uspostavljaju aseptične veze. Po pravilu se takvi uslovi postižu u radnom prostoru sa laminarnim protokom vazduha. Sistemi laminarnog protoka vazduha treba da obezbede ujednačenu brzinu vazduha od 0,36 m/s - 0,54 m/s (preporučena vrednost) na radnim pozicijama u čistim prostorima sa direktno izloženim materijalom, odnosno proizvodom.
Održavanje laminarnog protoka vazduha treba da bude dokazano i validirano.
Model jednosmernog protoka vazduha koji je manje brzine od preporučenih vrednosti može da se koristi u zatvorenim izolatorima i kabinetima čijem radnom prostoru može da se priđe samo preko sistema rukavica/rukav.
Klasa B: za aseptičnu pripremu i punjenje klasa B je okruženje za zonu klase A.
Klasa C i D: čisti prostori za izvođenje manje rizičnih faza u proizvodnji sterilnih proizvoda.
Klasifikacija čistih soba i uređaja za čist vazduh
4. Čiste sobe i uređaji za čist vazduh se klasifikuju prema standardu EN/ISO 14644-1. Klasifikacija treba jasno da se razlikuje od radnog procesa ambijentalnog monitoringa. Maksimalno dozvoljena koncentracija čestica u vazduhu za svaku klasu je data u sledećoj tabeli:
maksimalan broj dozvoljenih čestica/m³ |
||||
|
"stanje mirovanja" |
"stanje u radu" |
||
klasa |
0,5 µm |
5 µm |
0,5 µm |
5 µm |
A |
3 520 |
20 |
3 520 |
20 |
B |
3 520 |
29 |
352 000 |
2 900 |
C |
352 000 |
2 900 |
3 520 000 |
29 000 |
D |
3 520 000 |
29 000 |
nije definisano |
nije definisano |
5. Prilikom određivanja broja čestica u svrhu klasifikacije, za zonu klase A zapremina uzorka ne sme da bude manja od 1 m3 po mestu uzorkovanja. Za klasu A broj čestica odgovara klasi ISO 4.8 a klasifikacija je određena limitom za čestice veličine ≥ 5,0 µm. Za klasu B (u "stanju mirovanja"), broj čestica odgovara klasi ISO 5 za obe veličine čestica. Za klasu C (u "stanju mirovanja" i u "stanju u radu"), klasifikacija odgovara ISO 7 i ISO 8. Broj čestica u zoni klase D (u "stanju mirovanja") odgovara klasi ISO 8. Za potrebe klasifikacije, standard EN/ISO 14644-1 definiše minimalan broj mesta uzorkovanja, kao i zapreminu uzorka u zavisnosti od maksimalnog broja čestica najveće veličine za svaku klasu i načina procene dobijenih rezultata.
6. Za potrebe klasifikacije, treba da se koristi prenosivi brojač sa kratkim crevom za uzorkovanje, zbog relativno veće brzine taloženja čestica veličine ≥ 5,0 µm kod sistema daljinskog uzorkovanja sa dugačkim crevom. U sistemima sa jednosmernim protokom vazduha treba da se koriste sonde za uzorkovanje namenjene za primenu u izokinetičkim uslovima.
7. Klasifikacija u uslovima "stanja u radu" može da se dokazuje u normalnim radnim uslovima, simuliranim radnim uslovima ili tokom testa simulacije aseptičnog procesa (media fill) kao simulacija najgoreg slučaja. U standardu EN/ISO 14644-1 date su informacije o testiranju kako bi se dokazala kontinuirana usaglašenost za svaku određenu klasu čistoće.
Monitoring čistih soba i uređaja za čist vazduh
8. Čiste sobe i uređaje za čist vazduh treba rutinski pratiti tokom rada, a pozicije se određuju na osnovu zvanične odobrene analize rizika i rezultata dobijenih tokom klasifikacije čistih soba i/ili uređaja za čist vazduh.
9. Za zonu klase A monitoring čestica treba da se vrši tokom celokupnog perioda trajanja kritičnog procesa, uključujući i sklapanje opreme, osim u slučaju kada je dokazano da kontaminant iz procesa može da ošteti brojač čestica ili kada predstavlja opasnost, npr. živi organizmi ili radiološka opasnost. U tom slučaju monitoring tokom rutinskog podešavanja opreme treba da se izvrši pre izlaganja riziku. Monitoring čestica treba da se obavlja i tokom simulacije procesa. Za zonu klase A treba da se obezbedi takva učestalost monitoringa i odgovarajuća zapremina uzorka, da mogu da se obuhvate sve intervencije, prolazni događaji i bilo kakvo pogoršanje sistema, kao i aktiviranje alarma za prekoračenje upozoravajućih limita. Prihvatljivo je da, kada je proces punjenja u toku, nije uvek moguće dokazati niske nivoe čestica veličine ≥ 5,0 µm na mestu punjenja zbog stvaranja čestica ili kapljica iz samog proizvoda.
10. Za zonu klase B preporučuje se sličan sistem monitoringa, mada učestalost uzorkovanja može da bude manja. Značaj monitoringa čestica je određen efektivnošću razdvajanja između zone klase A i klase B. Za zonu klase B treba da se obezbedi takva učestalost monitoringa i odgovarajuća zapremina uzorka, da može da se obuhvati svaka promena nivoa kontaminacije i pogoršanje sistema, kao i aktiviranje alarma za prekoračenje upozoravajućih limita.
11. Sistemi za monitoring čestica u vazduhu mogu da čine nezavisni brojači čestica; mreža sekvencijalno dostupnih mesta uzorkovanja povezanih pomoću razvodnika na jedan brojač čestica; ili kombinacija ova dva sistema. Izabrani sistem mora da bude odgovarajući za veličinu čestica koja se prati. Kada se koriste daljinski sistemi uzorkovanja, dužina creva i prečnik bilo koje krivine u crevu mora da se uzme u obzir u kontekstu gubitaka čestica u crevu. Prilikom izbora sistema za monitoring treba da se uzme u obzir svaki rizik koji potiče od materijala koji se koriste u proizvodnim operacijama, na primer materijali koji sadrže žive organizme ili radiofarmaceutike.
12. Količina uzorka za potrebe monitoringa korišćenjem automatizovanih sistema obično zavisi od brzine uzorkovanja tog sistema. Nije neophodno da zapremina uzetog uzorka bude ista kao zapremina korišćena za zvaničnu klasifikaciju čistih soba i uređaja za čist vazduh.
13. U zonama klase A i B, od izuzetnog značaja je monitoring koncentracije čestica veličine ≥ 5,0 µm, kao važan alat za rano otkrivanje otkaza sistema. Povremeno povećanje broja čestica veličine ≥ 5,0 µm može da bude lažno zbog elektronske buke, svetlosti, slučajnosti itd. Međutim, uzastopni ili redovni rezultati niskih nivoa koncentracije ovih čestica ukazuju na moguću kontaminaciju koju je neophodno istražiti. Ovakvi slučajevi mogu da ukazuju na početak otkazivanja HVAC sistema, opreme za punjenje, ili na lošu praksu tokom sklapanja i podešavanja opreme i rutinskih operacija.
14. Maksimalan broj čestica naveden u tabeli za "stanje mirovanja" treba da se dostigne nakon kratkog perioda izmene vazduha ("ispiranja") koje iznosi 15-20 minuta (preporučena vrednost) posle završetka procesa, bez prisustva operatera.
15. Monitoring u zonama C i D klase u "stanju u radu" treba da se vrši u skladu sa principima upravljanja rizikom kvaliteta. Zahtevi i upozoravajući/akcioni limiti zavise od prirode operacija koje se obavljaju, ali treba da se dostigne preporučeni period "ispiranja".
16. Ostali parametri kao što su temperatura i relativna vlažnost zavise od prirode proizvoda i operacija koje se izvode. Oni ne treba da utiču na definisane standarde čistoće.
17. Primeri operacija koje se vrše u različitim klasama čistoće dati su u tabeli (takođe, videti i tačke 28. i 35).
klasa |
za proizvode koji se sterilišu na kraju procesa (videti tačke 28-30) |
A |
Punjenje proizvoda, uz neuobičajeni rizik |
C |
Priprema rastvora, uz neuobičajeni rizik. Punjenje proizvoda |
D |
Priprema rastvora i komponenata za sledeće punjenje |
klasa |
za aseptične postupke (videti tačke 31-35) |
A |
Aseptična priprema i punjenje |
C |
Priprema rastvora za filtraciju |
D |
Rukovanje komponentama nakon pranja |
18. Kad se obavljaju aseptični procesi, treba da se vrši učestao monitoring uz upotrebu metoda kao što su: taložne ploče, volumetrijsko uzorkovanje vazduha, kao i uzimanje uzoraka sa površina (npr. brisevi i kontaktne ploče). Metode uzorkovanja koje se koriste u "stanju u radu" ne treba da narušavaju zaštitu prostora. Rezultati monitoringa obavezno treba da se razmotre pri pregledu dokumentacije o proizvodnji serije, kako bi se odobrilo njeno puštanje u promet. Monitoring površina i osoblja treba da se sprovede nakon izvršenja kritičnih procesa. Potrebno je sprovoditi dodatni mikrobiološki monitoring i van proizvodnog procesa, npr. posle validacije sistema, čišćenja i sanitizacije.
19. U sledećoj tabeli dati su preporučeni limiti za mikrobiološka ispitivanja čistih prostora u "stanju u radu".
|
preporučeni limiti mikrobiološke kontaminacije (a) |
|||
klasa |
uzorak vazduha |
taložne ploče |
kontaktne ploče |
otisak rukavice, |
A |
< 1 |
< 1 |
< 1 |
< 1 |
B |
10 |
5 |
5 |
5 |
C |
100 |
50 |
25 |
- |
D |
200 |
100 |
50 |
- |
Napomene:
a) date su srednje vrednosti.
b) pojedinačne taložne ploče mogu biti izložene manje od 4 sata.
20. Za monitoring čestica i mikrobiološki monitoring treba da se uspostave odgovarajući upozoravajući i akcioni limiti. Standardnim operativnim procedurama treba da se propišu korektivne mere za slučajeve prekoračenja ovih limita.
21. Korišćenje tehnologije izolatora u cilju minimizacije intervencije ljudi u proizvodnim prostorima, može da dovede do značajnog smanjenja rizika od mikrobiološke kontaminacije iz okruženja proizvoda koji se izrađuju aseptično. Postoji veliki broj različitih tipova izolatora i uređaja za prenos, odnosno transfer, u i iz izolatora. Izolator i njegovo neposredno okruženje treba da budu dizajnirani tako da se u svakoj od ovih zona postiže odgovarajući kvalitet vazduha. Izolatori se prave od različitih materijala, koji su više ili manje podložni pucanju i propuštanju. Uređaji za prenos, odnosno transfer, mogu da budu različiti, od onih sa jednim ili dvostrukim vratima do potpuno zatvorenih sistema u čijem sastavu postoje mehanizmi sterilizacije.
22. Prenos, odnosno transfer materijala iz izolatora i u izolator je jedan od najvećih potencijalnih izvora kontaminacije. Generalno, prostor unutar izolatora je lokalizovana zona za obavljanje visokorizičnih operacija, mada se prihvata da u radnom prostoru kod svih tipova izolatora ne mora da postoji laminarni protok vazduha.
23. Klasa čistoće vazduha koja se zahteva za neposredno okruženje zavisi od dizajna izolatora i njegove primene. Čistoća vazduha u neposrednom okruženju izolatora treba da se kontroliše, a kod aseptičnog procesa ona treba da bude najmanje D klase.
24. Izolatori mogu da se koriste tek nakon sprovedene odgovarajuće validacije. Validacija treba da obuhvati sve kritične faktore izolatorske tehnologije, na primer, kvalitet vazduha unutar i izvan izolatora, sanitizaciju izolatora, proces prenosa i integritet izolatora.
25. Monitoring treba da se obavlja rutinski i treba da obuhvati često ispitivanje propustljivosti izolatora i sistema rukavica u sastavu izolatora.
Tehnologija formiranja/punjenja/zatapanja
26. Uređaji za formiranje/punjenje/zatapanje su namenski napravljene mašine, u kojima se tokom jednog kontinuiranog procesa formira kontejner od termoplastičnog granulata, puni i onda zatapa, pomoću jedne automatske mašine. Oprema za formiranje/punjenje/zatapanje koja se koristi za aseptičan postupak proizvodnje i koja ima efikasan "vazdušni tuš" A klase čistoće, može da se instalira u prostoru najmanje C klase čistoće, pod uslovom da se koristi zaštitna odeća propisana za klasu A/B. U "stanju mirovanja" okruženje treba da zadovoljava limite za žive i nežive čestice, a u toku rada samo limite za žive čestice. Opremu za formiranje/punjenje/zatapanje koja se koristi za izradu proizvoda koji se termilno sterilišu, treba instalirati u okruženju koji je najmanje D klase čistoće.
27. Zbog ove specijalne tehnologije, posebnu pažnju treba obratiti najmanje na sledeće:
- dizajn i kvalifikaciju opreme,
- validaciju i ponovljivost čišćenja "na licu mesta" (CIP) i sterilizacije "na licu mesta" (SIP),
- uslove okruženja čistog prostora u kome je oprema smeštena,
- obuku i oblačenje osoblja,
- sve intervencije na kritičnim delovima opreme, uključujući i aseptično montiranje pre početka punjenja.
Proizvodi koji se sterilišu na kraju procesa
28. Kako bi rizik od mikrobiološke i čestične kontaminacije bio nizak, priprema komponenti i većine proizvoda pogodnih za filtraciju i sterilizaciju, treba da se obavlja u prostoru najmanje klase D. Kada za proizvod postoji visok ili neuobičajen rizik od mikrobiološke kontaminacije (npr. kada proizvod aktivno potpomaže rast mikroorganizama, kada mora dugo da se čuva pre sterilizacije, ili kada proizvod nije moguće proizvoditi u potpunosti u zatvorenim sudovima), priprema treba da se vrši u prostoru klase C.
29. Punjenje proizvoda koji se sterilišu na kraju procesa proizvodnje, treba da se obavlja u okruženju najmanje klase C.
30. Kada je proizvod izložen neuobičajenom riziku od kontaminacije iz okruženja, na primer zato što se punjenje obavlja sporo ili kada kontejneri/bočice za punjenje imaju široko grlo ili kada je potrebno da budu izloženi uticaju okruženja duže od nekoliko sekundi pre zatvaranja, punjenje treba da se vrši u prostoru klase A, u okruženju koje odgovara najmanje klasi C. Priprema i punjenje masti, krema, suspenzija i emulzija po pravilu treba da se obavlja u prostoru klase C pre završne, odnosno terminalne sterilizacije.
31. Posle pranja, komponentama treba da se rukuje u okruženju koje je najmanje klase D. Rukovanje sterilnim polaznim materijalima i komponentama, osim ako kasnije tokom proizvodnje podležu sterilizaciji ili filtraciji kroz filtere koji zadržavaju mikroorganizme, treba da se obavlja u prostoru klase A, sa okruženjem klase B.
32. Priprema rastvora koji se sterilno filtriraju tokom procesa, treba da se vrši u prostoru klase C, a ukoliko se ne vrši sterilna filtracija, priprema materijala i proizvoda treba da se vrši u prostoru klase A, sa okruženjem klase B.
33. Rukovanje i punjenje aseptično pripremljenih proizvoda treba da se vrši u prostoru klase A, sa okruženjem klase B.
34. Pre završetka zatvaranja, prenos delimično zatvorenih kontejnera, kao što je slučaj kod liofilizacije, treba da se obavlja u prostoru klase A, sa okruženjem klase B, ili u potpuno zatvorenim tacnama za prenos u prostoru klase B.
35. Pripremu i punjenje sterilnih masti, krema, suspenzija i emulzija treba vršiti u prostoru klase A, sa okruženjem klase B, kada je proizvod izložen uticaju ambijentalnih uslova, a ne podleže naknadnoj filtraciji.
36. U čistim prostorima treba da bude prisutan samo minimalan broj osoba; što je posebno važno u toku aseptičnog procesa. Inspekcije i kontrole treba obavljati što je moguće dalje izvan čistih prostora.
37. Svo osoblje (uključujući i ono zaduženo za čišćenje i održavanje) koje radi u ovim prostorima treba redovno obučavati o svim važnim aspektima bitnim za ispravnu proizvodnju sterilnih proizvoda. Ova obuka treba da obuhvati i higijenu, kao i osnovne elemente mikrobiologije. Kada spoljno osoblje, koje nije prošlo takvu obuku, treba uvesti u čist prostor (npr. ugovorni izvođači nekih radova ili redovnog održavanja), posebnu pažnju treba posvetiti uputstvima koja im se daju i njihovom nadzoru.
38. Osoblje koje radi sa materijalom od tkiva životinjskog porekla ili kulturama mikroorganizama, različitim od onih koji se koriste u tekućoj proizvodnji, ne treba da ulazi u prostore u kojima se proizvode sterilni proizvodi, osim ako se sprovode rigorozne i jasno definisane procedure ulaska.
39. Visoki standardi lične higijene i čistoće su veoma bitni. Osoblju, uključenom u proizvodnju sterilnih proizvoda, treba dati uputstva da prijave svako stanje koje može da dovede do rasipanja velikog broja ili različitih vrsta kontaminananta; potrebni su periodični zdravstveni pregledi za takva stanja. Odgovorna osoba za sterilnu proizvodnju treba da preduzme odgovarajuće mere u vezi osoblja koje može da predstavlja neprimerenu mikrobiološku opasnost.
40. Ručni satovi, šminka i nakit ne treba da se nose u čistim prostorima.
41. Presvlačenje i pranje treba da se obavlja u skladu sa pisanom procedurom koja je ustanovljena tako da se minimizira kontaminacija odeće koja se nosi u čistom prostoru ili prenošenje kontaminanata u čiste prostore.
42. Odeća i njen kvalitet treba da odgovaraju procesu i klasi čistoće radnog prostora. Istu treba nositi tako da proizvod bude zaštićen od kontaminacije.
43. Opis odeće koja je zahtevana za svaku klasu:
- Klasa D: Kosa i kad je to primenljivo brada treba da su pokriveni. Treba da se nose zaštitna odeća i odgovarajuća obuća ili nazuvci. Treba preduzeti odgovarajuće mere kako bi se izbegla bilo kakva kontaminacija čistog prostora iz spoljašnje sredine.
- Klasa C: Kosa i kad je to primenljivo brada i brkovi treba da budu pokriveni. Treba da se nosi zaštitna odeća iz jednog ili dva dela, koja je skupljena na zglobovima, i sa visokim okovratnikom, kao i odgovarajuća obuća ili nazuvci. Sa zaštitne odeće i obuće praktično ne treba da otpadaju vlakna ili čestice.
- Klasa A/B: Kapuljača treba u potpunosti da pokriva kosu i kad je to primenljivo bradu i brkove; treba je uvući u okovratnik odela; maska za lice treba da se nosi kako bi se sprečilo raspršivanje kapljica. Treba da se nose odgovarajuće sterilisane gumene ili plastične rukavice koje nisu posute puderom, kao i sterilisana ili dezinfikovana obuća. Nogavice pantalona treba da budu uvučene u obuću, a rukavi odeće u rukavice. Zaštitna odeća praktično ne treba da odaje vlakna ili čestice, i treba da zadrži čestice sa tela.
44. U prostorije za presvlačenje koje vode u prostorije klase čistoće B i C ne treba unositi odeću koja se nosi napolju. Za svakog radnika koji ulazi u prostor klase A/B, treba da se obezbedi čisto, sterilno (sterilisano ili na odgovarajući način sanitizovano) zaštitno odelo za svaki ulazak. Rukavice treba redovno da se dezinfikuju tokom rada. Maske i rukavice treba da se menjaju najmanje pri svakom ulasku.
45. Odeća za čiste prostore treba da se pere i njome se postupa na takav način da se ne skupljaju dodatni kontaminanti koji kasnije mogu da se rasipaju u prostor. Ove radnje treba da se vrše u skladu sa pisanim procedurama. Poželjno je da postoje odvojene perionice za zaštitnu odeću za čiste prostore. Neadekvatno postupanje sa odećom oštećuje vlakna i povećava rizik od rasipanja čestica.
46. U čistim prostorima sve izložene površine treba da budu glatke, nepropusne i bez pukotina kako bi se rasipanje ili nakupljanje čestica ili mikroorganizama minimiziralo i kako bi se omogućila ponovljena primena sredstava za čišćenje i dezinfekciju, tamo gde se oni koriste.
47. Da bi se smanjilo nakupljanje prašine i da bi se olakšalo čišćenje, ne treba da postoje udubljenja koja se ne mogu čistiti, a prisustvo izbočina, polica, ormara i pribora treba da bude minimalno. Vrata treba da budu tako dizajnirana tako da se izbegnu udubljenja koja se ne mogu očistiti; iz tog razloga su klizna vrata nepoželjna.
48. Spuštene tavanice treba da budu potpuno zatvorene kako ne bi došlo do kontaminacije iz prostora iznad njih.
49. Cevi, kanali i drugi vodovi treba da budu tako instalirani da se ne stvaraju udubljenja, nezaptiveni otvori i površine koje se teško čiste.
50. Slivnici i odvodi u prostorima klase A/B u kojima se obavlja aseptičan postupak proizvodnje nisu dozvoljeni. U drugim prostorima između mašine ili slivnika i odvoda treba da postoji vazdušni prekid koji razdvaja odvodnu cev i odvod. U čistim sobama niže klase čistoće treba postaviti podne odvode sa poklopcem ili bespovratnim sistemom za vodu kako bi se sprečilo vraćanje tečnosti.
51. Prostorije za presvlačenje treba da su napravljene kao vazdušni propusnici koji se koriste tako da obezbeđuju fizičku razdvojenost različitih faza presvlačenja i tako da se kontaminacija zaštitne odeće mikroorganizmima i česticama minimizira. Treba ih efektivno "ispirati" filtriranim vazduhom. Poslednja faza prostora za presvlačenje treba, u stanju mirovanja, da bude iste klase čistoće kao i prostorija u koju taj prostor vodi. Ponekad je poželjno da postoje odvojene prostorije za presvlačenje pri ulasku i izlasku iz čistih prostora. Uređaji za pranje ruku, uglavnom, treba da postoje samo u prvoj fazi prostorija za presvlačenje u objektu.
52. Ne treba da se istovremeno otvaraju oboje vrata vazdušnog propusnika. Treba postaviti sistem međusobnog blokiranja (interlock system) ili sistem vizuelnog i/ili zvučnog upozorenja, kako bi se sprečilo otvaranje više od jednih vrata u istom trenutku.
53. Dovod filtriranog vazduha treba da održava nadpritisak i protok vazduha u odnosu na okolne prostore niže klase čistoće pod svim radnim uslovima, i treba efektivno da "ispira" prostor. Povezane prostorije različitih klasa čistoće treba da imaju razliku u pritisku od 10-15 paskala (preporučene vrednosti). Posebnu pažnju treba obratiti zaštiti zone najvećeg rizika, odnosno gde su proizvod i čiste komponente koje dolaze u kontakt sa proizvodom izloženi uticaju neposrednog okruženja. Brojne preporuke u vezi sa dovodom vazduha i diferencijalnim pritiskom mogu se modifikovati tamo gde je neophodno da se zadrže pojedini materijali kao što su patogeni, visoko toksični, radioaktivni ili materijali, odnosno proizvodi sa živim virusima ili bakterijama. Za neke operacije može da bude neophodno da se izvrši dekontaminacija prostora i tretman vazduha koji izlazi iz čistog prostora.
54. Treba da se dokaže da model protoka vazduha ne predstavlja rizik od kontaminacije, npr. treba voditi računa da se osigura da se protokom vazduha ne prenose čestice koje nastaju od osoblja, operacija ili mašina, u zonu većeg rizika po proizvod.
55. Treba da se obezbedi sistem upozorenja koji ukazuje na grešku u dovodu vazduha. Indikatori razlike pritisaka treba da budu postavljeni između prostora u kojima su te razlike važne. Ove razlike pritisaka treba redovno da se zapisuju ili dokumentuju na neki drugi način.
56. Transportna traka ne treba da prolazi kroz pregradu između prostora klase A ili B i proizvodnog prostora niže klase čistoće vazduha, osim ako se traka stalno steriliše (npr. u tunelu za sterilizaciju).
57. Koliko god je to moguće, oprema, tehničke instalacije, uređaji i pribor treba da budu tako dizajnirani i instalirani da postupak održavanja i popravke mogu da se vrše izvan čistog prostora. Ukoliko je potrebna sterilizacija, treba je izvršiti nakon kompletnog ponovnog montiranja, kad god je to moguće.
58. Kada se održavanje opreme obavlja unutar čistog prostora, taj prostor treba da bude očišćen, dezinfikovan i/ili sterilisan, kako je odgovarajuće, pre ponovnog započinjanja proizvodnje, ako su zahtevani standardi čistoće i/ili aseptični uslovi tokom aktivnosti održavanja opreme narušeni.
59. Postrojenja za tretman i sistem za distribuciju vode treba da budu tako dizajnirani, napravljeni i održavani da obezbede pouzdan izvor vode odgovarajućeg kvaliteta. Oni ne treba da rade izvan dizajniranog kapaciteta. Voda za injekcije treba da se proizvodi, skladišti i distribuira na način koji sprečava rast mikroorganizama, na primer, uz stalnu cirkulaciju na temperaturi iznad 70° C.
60. Sva oprema kao što su sterilizatori, sistemi za ventilaciju i filtriranje vazduha, filteri za vazduh i gasove, postrojenja za tretman vode, proizvodnju, skladištenje i distribuciju vode, treba da se validiraju i održavaju prema planu; njihova ponovna upotreba treba da bude odobrena.
61. Sanitizacija u čistim prostorima je od posebne važnosti. Čišćenje treba da se obavi u skladu sa pisanim programima. Kada se koriste dezinfekciona sredstva, treba koristiti više od jedne vrste. Monitoring treba sprovoditi redovno kako bi se otkrio razvoj rezistentnih sojeva.
62. Mikrobiološka čistoća dezinfekcionih sredstava i deterdženata treba da se prati; razblažene rastvore treba držati u prethodno očišćenim kontejnerima i treba ih skladištiti samo u okviru definisanog vremenskog perioda, osim ako su sterilisani. Dezinfekciona sredstva i deterdženti koji se koriste u prostorima klase A i B treba pre upotrebe da budu sterilni.
63. Za smanjenje mikrobiološke kontaminacije na nedostupnim mestima može da bude od koristi fumigacija čistih prostora.
64. Mere predostrožnosti treba da se preduzmu kako bi se minimizirala kontaminacija tokom svih procesa, uključujući i faze pre sterilizacije.
65. Materijali i proizvodi mikrobiološkog porekla ne treba da se proizvode ili pune u prostorima koji se koriste za proizvodnju drugih lekova, međutim, vakcine od mrtvih organizama, ili ekstrakti bakterija, posle inaktivacije, mogu da se pune u istim proizvodnim prostorima kao i drugi sterilni lekovi.
66. Validacija aseptičnog procesa treba da uključi test simulacije procesa uz korišćenje hranljive podloge (media fill). Izbor hranljive podloge treba da se zasniva na farmaceutskom obliku proizvoda, kao i selektivnosti, bistrini, koncentraciji i pogodnosti za sterilizaciju same hranljive podloge.
67. Test simulacije procesa treba, u što je moguće većoj meri, da podražava rutinski aseptičan postupak proizvodnje i da obuhvati sve kritične korake koji potom slede u proizvodnji. Takođe, treba da se uzmu u obzir različite intervencije za koje se zna da se događaju tokom redovne proizvodnje, kao i situacije najgoreg slučaja.
68. Test simulacije procesa treba obaviti kao početnu/inicijalnu validaciju na tri uzastopna zadovoljavajuća testa simulacije po smeni i ponavljati ga u definisanim intervalima, kao i nakon svake značajne izmene HVAC sistema, opreme, procesa i broja smena. Uobičajeno, test simulacije treba ponoviti dva puta godišnje po smeni i procesu.
69. Broj kontejnera napunjenih podlogom treba da bude dovoljan da omogući valjanu procenu. Za male serije, broj kontejnera napunjenih podlogom treba da bude najmanje jednak veličini serije proizvoda. Cilj testa treba da bude nula rasta, i treba uzeti u obzir i sledeće:
- kada se puni manje od 5000 kontejnera, ne sme da se pokaže kontaminacija ni u jednom kontejneru;
- kada se puni 5000-10000 kontejnera:
a) jedna (1) kontaminirana jedinica treba da bude predmet istrage, uključujući razmatranje ponavljanja testa simulacije;
b) dve (2) kontaminirane jedinice predstavljaju razlog za revalidaciju uz istragu.
- kada se puni više od 10000 kontejnera:
a) jedna (1) kontaminirana jedinica treba da bude predmet istrage;
b) dve (2) kontaminirane jedinice predstavljaju razlog za revalidaciju uz istragu.
70. Za bilo koju veličinu serije, povremena pojava kontaminacije može da ukazuje na nizak nivo kontaminacije koju treba istražiti. Istraga pojave kontaminacije većih razmera treba da obuhvati i mogući uticaj na obezbeđenje sterilnosti serija koje su proizvedene od poslednjeg uspešno obavljenog testa simulacije (media fill).
71. Treba da se vodi računa da bilo koja validacija ne ugrozi same procese.
72. Potrebno je da se vrši redovan monitoring izvora vode, opreme za tretman vode i prerađene vode, na hemijsku i biološku kontaminaciju, i kad je to odgovarajuće, na endotoksine. Treba da se čuvaju zapisi sa rezultatima monitoringa i merama koje su preduzete.
73. Aktivnosti u čistim prostorima, posebno kada su aseptični postupci u toku, treba svesti na minimum, a kretanje osoblja treba da bude kontrolisano i definisano, kako bi se izbeglo povećano rasipanje čestica i organizama usled prevelike aktivnosti. Ambijentalna temperatura i vlaga ne treba da budu neprijatno visoke, zbog prirode odeće koja se nosi.
74. Mikrobiološka kontaminacija polaznih materijala treba da bude minimalna. Specifikacije treba da obuhvataju i zahteve za mikrobiološki kvalitet kada je potreba za tim utvrđena tokom monitoringa.
75. Prisustvo kontejnera i materijala koji su skloni stvaranju vlakana treba da se svede na minimum u čistim prostorima.
76. Gde je primenljivo, treba da se preduzmu mere da se minimizira čestična kontaminacija krajnjeg proizvoda.
77. Komponentama, kontejnerima i opremom treba, posle završnog čišćenja, da se rukuje tako da ne dođe do njihove ponovne kontaminacije.
78. Vremenski period između pranja i sušenja i sterilizacije komponenti, kontejnera i opreme, kao i između njihove sterilizacije i upotrebe treba svesti na minimum i treba da se postavi vremensko ograničenje odgovarajuće za uslove skladištenja.
79. Vremenski period između početka pripreme rastvora i njegove sterilizacije ili filtracije kroz filter koji zadržava mikroorganizme treba svesti na minimum. Treba da se ustanovi maksimalno dozvoljeno vreme za svaki proizvod, imajući u vidu njegov sastav i propisan način skladištenja.
80. Prethodno biološko opterećenje treba da se prati pre sterilizacije. Treba da postoje radni limiti za mikrobiološku kontaminaciju neposredno pre sterilizacije, koji su vezani za efikasnost metode koja se koristi. Ispitivanje prethodnog biološkog opterećenja treba da se izvrši na svim serijama, kako onih koji su proizvedeni aseptičnim postupkom, tako i završno, odnosno terminalno sterilisanih proizvoda. Kada su postavljeni preterani parametri sterilizacije (overkill) za proizvode koji se sterilišu na kraju procesa, dozvoljeno je praćenje prethodnog biološkog opterećenja u odgovarajućim, definisanim intervalima. U slučaju parametarskog puštanja serija, prethodno biološko opterećenje treba da se ispituje na svakoj seriji i smatra se procesnom kontrolom. Gde je primereno, treba da se prati nivo endotoksina. Sve rastvore, a posebno parenteralne rastvore velike zapremine (infuzioni rastvori), treba propustiti kroz filter koji zadržava mikroorganizme, a koji je, ukoliko je moguće, postavljen neposredno pre punjenja.
81. Komponente, kontejnere, opremu i drugi pribor koji su neophodni u čistom prostoru u kom se obavlja aseptični postupak, treba da budu sterilisani i prebačeni u prostor kroz prolazne sterilizatore koji su potpuno zatvoreni u zidu, ili nekim drugim postupkom kojim se postiže isti cilj sprečavanja kontaminacije. Nezapaljivi gasovi treba da se propuste kroz filtere koji zadržavaju mikroorganizme.
82. Efikasnost svake nove procedure treba da se validira, a validaciju treba potvrditi u planiranim intervalima, koji se određuju na osnovu istorijskih podataka ili kada se izvrše značajne promene u procesu, ili na opremi.
83. Svi sterilizacioni procesi treba da se validiraju. Posebnu pažnju treba obratiti kada usvojena metoda sterilizacije koja se primenjuje nije opisana u važećem izdanju Evropske farmakopeje, ili kada se koristi za proizvod koji nije običan vodeni ili uljani rastvor. Kad god je to moguće, sterilizacija toplotom je metoda izbora. U svakom slučaju, metoda sterilizacije mora biti u saglasnosti sa dozvolom za proizvodnju i dozvolom za stavljanje leka u promet.
84. Pre primene bilo kog postupka sterilizacije treba da se pokaže njegova pogodnost za određeni proizvod i efikasnost u postizanju željenih uslova sterilizacije u svakom delu bilo kog tipa tereta podvrgnutog procesu, i to fizičkim merenjima i biološkim indikatorima, kad je to primenljivo. Validnost postupka sterilizacije treba da se potvrdi u propisanim intervalima, a najmanje jedanput godišnje, kao i kada se izvrše značajne izmene na opremi. Potrebno je da se čuvaju zapisi o ovim rezultatima.
85. Da bi sterilizacija bila efektivna, kompletan materijal mora da se podvrgne zahtevanom tretmanu i procesu, što može da se postigne odgovarajućim dizajnom procesa.
86. Treba da se uspostave validirane pozicione šeme tereta za sve sterilizacione procese.
87. Kao dodatnu metodu monitoringa sterilizacije treba razmotriti upotrebu bioloških indikatora. Oni treba da se čuvaju i koriste u skladu sa uputstvom proizvođača, a njihov kvalitet da se proverava pozitivnom kontrolom. Ako se koriste biološki indikatori, treba da se preduzmu stroge mere opreza da se izbegne prenošenje mikrobiološke kontaminacije sa njih.
88. Treba da postoje jasni načini razlikovanja proizvoda koji su sterilisani od onih koji nisu. Svaka korpa, tacna ili drugi nosač proizvoda ili materijala treba da bude jasno obeležen nazivom materijala, brojem serije i naznakom da li je ili nije sterilisan. Kad je primenjivo, mogu se koristiti indikatori kao što su trake za autoklave, da se označi da li je ili nije serija (ili podserija) prošla proces sterilizacije, ali oni nisu pouzdan pokazatelj da je cela serija/šarža sterilna.
89. Zapisi o sterilizaciji treba da postoje za svaki ciklus sterilizacije. Oni treba da budu odobreni kao sastavni deo procedure za puštanje serije leka u promet.
90. Za svaki ciklus sterilizacije toplotom treba da se obezbedi zapis u formi dijagrama u funkciji vreme/temperatura sa dovoljno velikim opsegom, ili pomoću druge adekvatne opreme odgovarajuće tačnosti i preciznosti. Pozicije temperaturnih sondi koje se koriste za kontrolu i/ili zapisivanje treba odrediti tokom validacije, i kad je primenljivo, treba ih proveriti u odnosu na drugu nezavisnu temperaturnu sondu smeštenu u isti položaj.
91. Takođe, mogu da se koriste i hemijski ili biološki indikatori, ali ne umesto fizičkog merenja.
92. Mora da se omogući dovoljno vremena da ceo teret dostigne zahtevanu temperaturu, pre nego što započne merenje vremena sterilizacije. To vreme se mora odrediti posebno za svaki tip tereta koji se steriliše.
93. Nakon faze visoke temperature ciklusa sterilizacije toplotom, treba da se preduzmu mere za sprečavanje kontaminacije sterilisanog materijala tokom hlađenja. Svaka tečnost ili gas za hlađenje koji dolazi u kontakt sa proizvodom treba da se steriliše, osim ako se dokaže da svaki kontejner koji curi neće biti odobren za dalju upotrebu.
Sterilizacija "vlažnom toplotom"
94. Za praćenje procesa treba meriti i temperaturu i pritisak. Kontrolni instrumenti su po pravilu nezavisni od instrumenata za praćenje i beleženje dijagrama. Kada se koriste automatski sistemi za kontrolu i monitoring u ovu svrhu, oni treba da budu validirani kako bi se obezbedilo da su zadovoljeni zahtevi za kritične procese. Poremećaje u sistemu i ciklusu treba da registruje sam sistem i treba da budu uočeni od strane operatera. Očitavanje nezavisnog indikatora temperature treba da se rutinski proverava u odnosu na grafikon zabeležen tokom perioda sterilizacije. Za sterilizatore koji imaju drenažu na dnu komore, može biti potrebno da se beleži temperatura i u toj poziciji tokom trajanja sterilizacije. Kada kao deo ciklusa postoji vakuum faza na komori treba često sprovoditi ispitivanje na "test curenja".
95. Predmete koje treba sterilisati, osim proizvoda u zatvorenim kontejnerima, treba umotati u materijal koji omogućava uklanjanje vazduha i prodiranje pare, ali i sprečavanje ponovne kontaminacije posle sterilizacije. Svi delovi tereta treba da budu u kontaktu sa agensom za sterilizaciju na zahtevanoj temperaturi i tokom zahtevanog vremenskog perioda.
96. Treba voditi računa da se obezbedi da je para koja se koristi za sterilizaciju odgovarajućeg kvaliteta i da ne sadrži aditive u meri koja bi mogla uzrokovati kontaminaciju proizvoda ili opreme.
97. Postupak koji se koristi treba da obuhvati cirkulaciju vazduha u komori i održavanje pozitivnog pritiska da bi se sprečio ulazak nesterilnog vazduha. Sav ulazni vazduh mora da prolazi kroz HEPA filter. Ako je namera da se uklone i pirogeni ovim postupkom, kao deo validacije treba da se koristi test izazova uz korišćenje endotoksina, odnosno test opterećenja endotoksinima.
98. Sterilizacija zračenjem se uglavnom koristi za sterilizaciju materijala i proizvoda koji su osetljivi na toplotu. Mnogi lekovi i neki materijali za pakovanje su osetljivi na zračenje, tako da je ova metoda dozvoljena samo u slučajevima kada je eksperimentalno potvrđeno da neće imati štetan uticaj na proizvod. Ultravioletno zračenje po pravilu nije prihvatljiva metoda sterilizacije.
99. Tokom postupka sterilizacije treba da se meri doza zračenja. U tu svrhu, treba da se koriste indikator dozimetri nezavisno od doze koja se koristi, a koji prikazuju kvantitativno merenje doze zračenja koju je sam proizvod primio. Dozimetre treba postaviti u teret sterilizatora u dovoljnom broju i dovoljno blizu, kako bi se obezbedilo da je dozimetar uvek u opsegu zračenja. Kada se koriste plastični dozimetri, oni treba da se koriste u okviru vremenskog perioda njihove kalibracije. Apsorbancije dozimetra treba da se očitaju u kratkom roku nakon izlaganja zračenju.
100. Biološki indikatori mogu da se koriste kao dodatna kontrola.
101. Pri validaciji treba da se sagleda uticaj razlika u gustini pakovanja proizvoda pri sterilizaciji.
102. Uputstva za rukovanje materijalima treba da spreče mešanje ozračenih i neozračenih materijala. Diskovi u boji osetljivoj na zračenje treba da se koriste na svakom pakovanju da bi se razlikovala pakovanja koja su podvrgnuta zračenju od onih koja nisu.
103. Ukupna doza zračenja treba da se primeni u okviru unapred određenog vremenskog intervala.
104. Ovu metodu treba koristiti samo kada nijedna druga metoda nije primenjiva. Tokom validacije treba dokazati da nema štetnog uticaja na proizvod i da su uslovi i vreme dozvoljeno za oslobađanje od gasa takvi da snižavaju količinu preostalog gasa i produkata reakcije do definisanih prihvatljivih granica za određenu vrstu proizvoda ili materijala.
105. Direktan kontakt između gasa i ćelija mikroorganizama je od suštinskog značaja; treba da se preduzmu mere opreza kako bi se izbeglo prisustvo organizama koji se mogu naći u materijalu, kao što su kristali ili suvi proteini. Priroda i količina materijala za pakovanje mogu znatno da utiču na proces.
106. Pre izlaganja gasu, materijale treba dovesti na uravnotežene uslove u pogledu vlage i temperature zahtevane za postupak. Vreme koje je za to potrebno treba da se uravnoteži u odnosu na potrebu da se vreme pre sterilizacije svede na minimum.
107. Svaki sterilizacioni ciklus treba da se prati pomoću odgovarajućih bioloških indikatora, uz upotrebu odgovarajućeg broja komada za testiranje raspoređenih po teretu. Dobijeni podaci čine sastavni deo dokumentacije o seriji.
108. Za svaki sterilizacioni ciklus treba da se vode zapisi o ukupnom vremenu koje je potrebno da se sprovede ciklus, o pritisku, temperaturi i vlazi u samoj komori tokom procesa, o koncentraciji gasa, kao i o ukupnoj iskorišćenoj količini gasa. Pritisak i temperatura treba da se beleže tokom celog ciklusa na dijagramu. Ovi zapisi čine sastavni deo Evidencije o proizvodnji serije leka.
109. Nakon sterilizacije, teret treba čuvati na kontrolisan način, u uslovima takve ventilacije koja će omogućiti da se preostali gas i produkti reakcije smanje na definisani nivo. Ovaj postupak treba da bude validiran.
Filtracija medicinskih proizvoda koji ne mogu da se sterilišu u finalnom pakovanju
110. Filtracija se ne smatra dovoljnom kada je sterilizacija u finalnom pakovanju moguća. Prednost se daje sterilizaciji parom. Ukoliko proizvod ne može da se steriliše u finalnom kontejneru, rastvori ili tečnosti mogu da se filtriraju u prethodno sterilisan kontejner kroz sterilni filter nominalne veličine pora od 0,22 mikrona (ili manje), ili kroz filter koji ima najmanje ekvivalentne osobine zadržavanja mikroorganizama. Takvi filteri mogu da uklone većinu bakterija i plesni, ali ne i sve viruse i mikroplazme. Treba da se razmotri mogućnost da se proces filtracije u izvesnoj meri dopuni tretmanom toplotom.
111. Zbog potencijalnih dodatnih rizika metode filtracije u poređenju sa ostalim metodama sterilizacije, preporučuje se dodatna filtracija, kroz drugi sterilisan filter koji zadržava mikroorganizme, neposredno pre punjenja. Završnu sterilnu filtraciju treba obaviti što je moguće bliže mestu na kom se vrši punjenje.
112. Filteri treba da budu takvih karakteristika da otpuštanje vlakana bude minimalno.
113. Integritet sterilisanog filtera treba da se proveri pre upotrebe, i potvrdi neposredno posle upotrebe pomoću odgovarajućih metoda, kao što su "bubble point" (tačka izbijanja mehurića), test difuzije, ili test smanjenja pritiska. Vreme koje je potrebno da se filtrira poznata zapremina bulk rastvora i razlika pritisaka na filteru treba da se odrede u toku validacije, a bilo kakva značajna razlika od toga tokom redovne proizvodnje, treba da se zabeleži i istraži. Rezultati ovih provera treba da budu sastavni deo Evidencije o proizvodnji serije leka. Integritet kritičnih filtera za gasove i vazduh treba da se potvrdi nakon upotrebe. Integritet ostalih filtera treba da se potvrđuje u odgovarajućim intervalima.
114. Isti filter ne treba da se koristi duže od jednog radnog dana, osim ako je takva upotreba validirana.
115. Filter ne treba da utiče na proizvod tako što iz njega uklanja sastojke ili tako što oslobađa supstance u njega.
Finalizacija sterilnih proizvoda
116. Delimično zatvorene bočice sa proizvodom za liofilizaciju treba da budu u uslovima klase A sve vreme dok se čep u potpunosti ne utisne u bočice.
117. Kontejneri treba da se zatvaraju u skladu sa odgovarajućim, validiranim metodama. Kontejneri koji se zatvaraju zatapanjem, npr. staklene ili plastične ampule, treba da se podvrgnu 100%-tnom ispitivanju integriteta. Integritet uzoraka drugih vrsta kontejnera treba kontrolisati u skladu sa odgovarajućom procedurom.
118. Sistem zatvaranja kontejnera kod aseptično napunjenih bočica nije potpuno celovit dok se ne pričvrste i aluminijumske kapice na bočice sa čepom. Iz tog razloga aluminijumske kapice treba da se pričvrste što je pre moguće nakon utiskivanja čepa u bočice.
119. Kako mašina za pričvršćivanje kapica može da stvara značajnu količinu neživih čestica, ona treba da bude postavljena na odvojenom mestu sa obezbeđenim odgovarajućim izvlačenjem vazduha.
120. Montiranje i zatvaranje kapica na bočice može da se obavlja kao aseptični postupak korišćenjem sterilisane kapice ili kao čist proces izvan aseptične zone. U ovom drugom slučaju, do napuštanja zone u kojoj se obavlja aseptičan postupak bočice treba da budu zaštićene u uslovima klase A, odnosno bočice sa čepom treba da se zaštite dovodom vazduha klase čistoće A do pričvršćivanja kapica.
121. Bočice kod kojih čep nedostaje, ili nije dobro postavljen treba da se odbace pre pričvršćivanja kapica. Kada je kod pozicije zatvaranja kapica neophodna intervencija operatera, treba da se obezbedi odgovarajuća tehnologija kako bi se sprečio direktan kontakt sa bočicama i minimizirala mikrobiološka komtaminacija.
122. Barijere koje ograničavaju pristup (RABS) i izolatori mogu da budu korisni za obezbeđivanje zahtevanih uslova i minimizaciju direktnih intervencija operatera tokom zatvaranja bočica kapicama.
123. Kontejneri koji se zatapaju pod vakuumom treba da se ispitaju na održavanje vakuuma nakon odgovarajućeg, prethodno određenog vremenskog perioda.
124. Napunjene kontejnere parenteralnih proizvoda treba individualno proveravati na čestičnu kontaminaciju ili na druge nedostatke. Kada se provera obavlja vizuelno, treba da se sprovodi pod pogodnim i kontrolisanim uslovima osvetljenja i pozadine. Operateri koji obavljaju proveru treba da budu podvrgnuti redovnim pregledima vida, sa naočarima ako ih nose i treba im omogućiti česte pauze tokom provere. Kada se koriste druge metode provere, one treba da budu validirane, a rad opreme treba proveravati u prethodno utvrđenim intervalima. Treba da postoje zapisi sa rezultatima.
125. Test sterilnosti koji se vrši na gotovom proizvodu treba posmatrati samo kao poslednju u nizu kontrolnih mera, pomoću kojih se obezbeđuje sterilnost. Test treba da bude validiran za svaki pojedinačan proizvod.
126. U slučajevima kada je odobreno parametarsko puštanje serije, posebna pažnja treba da se obrati na validaciju i monitoring celokupnog proizvodnog procesa.
127. Uzorci koji su uzeti za test sterilnosti treba da budu reprezentativni za celu seriju, ali posebno treba da obuhvate i uzorke onih delova serije koji se smatraju najrizičnijim u pogledu kontaminacije, npr:
a) za proizvode koji su punjeni aseptično, uzorci treba da obuhvate i kontejnere napunjene na početku i na kraju svake serije i nakon svih značajnih intervencija,
b) ili za proizvode koji su sterilisani toplotom u kontaktnim kontejnerima (unutrašnjem pakovanju), treba da se uzmu u obzir uzorci iz potencijalno najhladnijih delova tereta.
PROIZVODNJA BIOLOŠKIH AKTIVNIH SUPSTANCI I LEKOVA KOJI SE KORISTE U HUMANOJ MEDICINI
Metode koje se koriste u proizvodnji bioloških aktivnih supstanci i lekova predstavljaju kritičan faktor za pripremu odgovarajuće regulatorne kontrole. Biološke aktivne supstance i lekovi najvećim delom mogu da se definišu na osnovu postupaka njihove proizvodnje. Ovaj aneks daje smernice za sve aktivne supstance i lekove koji se definišu kao biološki.
Ovaj aneks je podeljen u dva dela:
a) deo A sadrži dodatne smernice za proizvodnju bioloških aktivnih supstanci i lekova, od kontrole izvora semena i banke ćelija do finalizacije i testiranja;
b) deo B sadrži dodatne smernice za određene tipove bioloških aktivnih supstanci i lekova.
Zajedno sa još nekoliko aneksa, ovaj aneks daje smernice koje dopunjavaju Prvi i Drugi deo smernice dobre proizvođačke prakse. U okviru ovog aneksa postoje dva aspekta:
a) faza proizvodnje - za biološke aktivne supstance do faze neposredno pre njihove sterilizacije primenjuje se Drugi deo smernice, dok su smernice za dalje korake u proizvodnji bioloških lekova date u Prvom delu smernice;
b) vrsta proizvoda - ovaj aneks daje smernice za čitav niz lekova koji su definisani kao biološki.
Ova dva aspekta su prikazana u tabeli 1. Treba napomenuti da je ova tabela samo ilustrativna i da ne prikazuje precizan obim ovog aneksa. Takođe, treba uzeti u obzir da se, u skladu sa odgovarajućom tabelom u Drugom delu smernice, nivo zahteva dobre proizvođačke prakse povećava od ranih ka kasnijim fazama proizvodnje bioloških aktivnih supstanci, ali se uvek treba pridržavati principa dobre proizvođačke prakse. Uključivanje nekih ranih faza proizvodnje u okvire ovog aneksa ne znači da će te faze da budu predmet rutinske inspekcije nadležnih organa.
Antibiotici nisu definisani kao biološki lekovi, međutim, kada se primenjuju biološke faze proizvodnje mogu da se koriste smernice ovog aneksa. smernice za lekove dobijene iz frakcionisane krvi ili plazme humanog porekla date su u Aneksu 14, a za netransgene biljne lekove u Aneksu 7.
U nekim slučajevima se na polazne materijale primenjuju drugi propisi:
a) Za tkiva i ćelije koje se koriste za industrijsku proizvodnju lekova: primenjuje se Direktiva 2004/23/EC za uspostavljanje standarda za kvalitet i bezbednost za doniranje, nabavku, testiranje, proizvodnju, čuvanje, skladištenje i distribuciju humanog tkiva i ćelija, dok se Direktiva 2006/17/EC primenjuje samo na doniranje, nabavku i testiranje humanog tkiva i ćelija. Takva tkiva i ćelije postaju biološki aktivne supstance za nekoliko vrsta bioloških lekova (inženjering), kada se primenjuje Dobra proizvođačka praksa i drugi propisi za lekove;
b) Kada se krv ili komponente krvi koriste kao polazni materijal za proizvodnju lekova za naprednu terapiju, Direktiva 2002/98/EC propisuje standarde kvaliteta i bezbednosti za prikupljanje, testiranje, proizvodnju, skladištenje i distribuciju krvi i komponenata krvi humanog porekla, kao i izmene i dopune Direktive 2001/83/EC i ostale direktive koje propisuju tehničke zahteve za selekciju davalaca i prikupljanje i testiranje krvi i komponenata krvi.
c) Na proizvodnju i kontrolu genetski modifikovanih organizama primenjuju se nacionalni propisi. U skladu sa Direktivom 2009/41/EC uspostavljaju se i održavaju izolacija i odgovarajuće zaštitne mere u objektima u kojima se rukuje genetski modifikovanim mikroorganizmima. Za uspostavljanje i održavanje odgovarajućeg nivoa biološke bezbednosti primenjuju se nacionalni propisi koji ne treba da budu u suprotnosti sa zahtevima dobre proizvođačke prakse.
Tip i poreklo materijala |
Primeri proizvoda |
Primena aneksa na proizvodne korake je osenčena sivo |
|||
1. životinjskog ili biljnog porekla: |
heparini, insulin, enzimi, proteini, ekstrakti alergena, ATMPs, imunoserumi |
sakupljanje biljaka, organa, tkiva ili fluida9 |
sečenje, mešanje i/ili inicijalni proces |
izolovanje i purifikacija |
formulacija, punjenje |
2. virus ili bakterija/ fermentacija/ ćelijska kultura |
virusne ili bakterijske vakcine, enzimi, proteini |
uspostavljanje i održavanje MCB10, WCB, MVS, WSL |
ćelijska kultura i/ili fermentacija |
inaktivacija |
formulacija, punjenje |
3. biotehnologija - fermentacija / ćelijska kultura |
rekombinantni proizvodi, MAb, alergeni, vakcine, genska terapija (virusni i nevirusni vektori, plazmidi) |
uspostavljanje i održavanje MCB10, WCB, MVS, WSL |
ćelijska kultura i/ili fermentacija |
izolovanje, purifikacija, modifikacija |
formulacija, punjenje |
4. životinjskog porekla: |
rekombinantni proteini, lekovi za napredne terapije ATMPs |
glavna ili radna transgena banka |
sakupljanje, sečenje, mešanje i/ili inicijalni proces |
izolovanje, purifikacija i modifikacija |
formulacija, punjenje |
5. biljnog porekla: transgeni |
rekombinantni proteini, vakcine, alergeni |
glavna ili radna transgena banka |
gajenje, berba11 |
inicijalna ekstrakcija, izolovanje, purifikacija i modifikacija |
formulacija, punjenje |
6. humanog porekla |
enzimi dobijeni iz urina, hormoni |
sakupljanje fluida12 |
mešanje i/ili inicijalni proces |
izolovanje i purifikacija |
formulacija, punjenje |
7. humanog i/ili životinjskog porekla |
genska terapija, genetski modifikovane ćelije |
doniranje, nabavka i testiranje polaznog tkiva/ćelija13 |
proizvodnja vektora i ćelijska purifikacija i proizvodnja14 |
ex-vivo genetska modifikacija ćelija, uspostavljanje glavne banke ćelija (MCB), radne banke ćelija (WCB) i ćelijskog stoka |
formulacija, punjenje |
|
terapija somatskim ćelijama |
doniranje, nabavka i testiranje polaznog tkiva/ćelija13 |
uspostavljanje glavne banke ćelija (MCB), radne banke ćelija (WCB) i ćelijskog stocka |
izolovanje ćelija, purifikacija kultura, kombinovanje sa nećelijskim komponentama |
formulacija, kombinovanje punjenje |
|
proizvodi inženjeringa tkiva |
doniranje, nabavka i testiranje polaznog tkiva/ćelija13 |
inicijalni proces, izolovanje i purifikacija, uspostavljanje glavne banke ćelija (MCB), radne banke ćelija (WCB) i primarnog ćelijskog stocka |
izolovanje ćelija, purifikacija kultura, kombinovanje sa nećelijskim komponentama |
formulacija, kombinovanje punjenje |

_______
9 Videti odeljak B1 za
oblast na koju se primenjuju standardi dobre proizvođačke prakse
10 Videti deo "Sistem
izvora semena i sistem banke ćelija" za oblast na koju se primenjuju standardi
dobre proizvođačke prakse
11 HMPC "Smernice
dobre poljoprivredne i prakse u sakupljanju" - EMEA/HMPC/246816/2005 može
da se primenjuje na gajenje, berbu i inicijalne procese na mestu berbe
12 Primenjuju se principi
dobre proizvođačke prakse, videti tekst objašnjenja u "Područje primene"
13 Humana tkiva i ćelije
moraju da budu u skladu sa direktivom 2004/23/EC i implementiranim direktivama
u tim fazama
14 Za virusne vektore,
glavna kontrola je kao za proizvodnju virusa (red 2)
Proizvodnja bioloških aktivnih supstanci i lekova obuhvata određena specifična razmatranja koja su uslovljena prirodom ovih proizvoda i procesima proizvodnje. Način na koji se biološki lekovi proizvode, kontrolišu i primenjuju, zahteva primenu posebnih mera predostrožnosti.
Za razliku od konvencionalnih lekova koji se proizvode upotrebom hemijskih i fizičkih metoda kod kojih je moguć visok nivo doslednosti, proizvodnja bioloških aktivnih supstanci i lekova podrazumeva upotrebu bioloških procesa i materijala, kao što su kultivacija ćelija ili ekstrakcija materijala iz živih organizama. Ove biološke procese može da karakteriše svojevrsna promenljivost, tako da opseg i priroda uzgred nastalih proizvoda (nus proizvoda) variraju. Iz tog razloga su principi Upravljanja rizikom kvaliteta (QRM) od posebnog značaja za ovu vrstu proizvoda i treba da se koriste za uspostavljanje kontrolne strategije u svim fazama proizvodnje, kako bi se smanjili varijabilnost i mogućnost kontaminacije i unakrsne kontaminacije.
Pošto su materijali koji se koriste u procesima kultivacije i uslovi proizvodnje dizajnirani tako da obezbeđuju uslove za rast pojedinih ćelija i mikroorganizama, oni su pogodni i za razvoj mikrobioloških kontaminanata. Osim toga, mnogi proizvodi imaju ograničenu sposobnost da izdrže širok spektar tehnika prečišćavanja naročito onih za inaktivaciju i uklanjanje slučajnih neželjenih (nus) viralnih kontaminanata. Dizajn procesa, opreme, objekata, pomoćnih sistema, uslovi za proizvodnju i dodavanje pufera i reagenasa, uzorkovanje i obuka osoblja su ključni faktori za minimiziranje pojave takve kontaminacije.
Specifikacije proizvoda (iz monografija farmakopeja, dozvole za stavljanje leka u promet, ili odobrenja za kliničko ispitivanje leka), određuju da li i u kojoj fazi supstance i materijali mogu da imaju određeni nivo prethodnog biološkog opterećenja (bioburden), ili moraju da budu sterilni. Takođe, proizvodnja mora da bude u skladu sa drugim specifikacijama postavljenim u uputstvima za izdavanje dozvole za stavljanje leka u promet ili odobrenja za kliničko ispitivanje (npr. broj pasaža između izvora semena ili banke ćelija).
Za biološki materijal koji ne može da se steriliše (npr. membranskom filtracijom), mora da se obezbedi aseptičan postupak proizvodnje kako bi se smanjilo prenošenje kontaminanata. Kada postoje kontaminanti, treba koristiti smernice Komiteta za lekove za humanu upotrebu (CHMP) za validaciju specifičnih metoda proizvodnje, npr. uklanjanje ili inaktivacija virusa. Odgovarajuća kontrola i monitoring ambijentalnih uslova i, kada je izvodljivo čišćenje i sterilizacija "na mestu" (in-situ), zajedno sa upotrebom zatvorenih sistema proizvodnje, mogu značajno da smanje rizik od slučajne kontaminacije i unakrsne kontaminacije.
Kontrola po pravilu obuhvata biološke analitičke metode koje karakteriše veća varijabilnost od fizičko hemijskih ispitivanja. Robustan proces proizvodnje je od ključnog značaja, a procesna kontrola ima značajnu ulogu u proizvodnji bioloških aktivnih supstanci i lekova.
Biološki lekovi koji sadrže humano tkivo ili ćelije, kao što su neki lekovi za naprednu terapiju (ATMPs), moraju da budu u skladu sa Direktivom 2004/23/EC, Direktivom 2006/17/EC. U skladu sa Direktivom 2006/86/EC i 2004/23/EC zahtevi o sledljivosti, prijavljivanju ozbiljnih neželjenih reakcija i događaja i određeni tehnički zahtevi za šifriranje, proizvodnju, čuvanje, skladištenje i distribuciju humanih tkiva i ćelija, sakupljanje i testiranje, moraju da budu u skladu sa odgovarajućim sistemom kvaliteta koji su definisani ovim aneksom. Osim toga, zahtevi Direktive 2006/86/EC i 2004/23/EC u pogledu sledljivosti, prijavljivanja ozbiljnih neželjenih reakcija i događaja i određeni tehnički zahtevi za kodiranje, proizvodnju, čuvanje, skladištenje i distribuciju humanih tkiva i ćelija, primenjuju se od davaoca, preko banaka tkiva kroz propise o lekovima do ustanove gde se lekovi upotrebljavaju.
Biološke aktivne supstance i lekovi moraju da budu u skladu sa poslednjom verzijom "Uputstva za smanjenje rizika od prenošenja transmisivne životinjske spongiformne encefalopatije (TSE) humanim i veterinarskim lekovima".
OPŠTA UPUTSTVA
1. Osoblje koje radi u prostorima u kojima se proizvode i kontroliše kvalitet bioloških lekova (uključujući i zaposlene zadužene za čišćenje, održavanje ili kontrolu kvaliteta) treba da prođe obuku, kao i periodičnu ponovljenu obuku specifičnu za proces proizvodnje, odnosno ispitivanje kvaliteta u skladu sa njihovim zaduženjima i odgovornostima i obuku o posebnim merama zaštite proizvoda, osoblja i životne sredine.
2. Zdravstveno stanje zaposlenih je važno za bezbednost proizvoda. Svo osoblje angažovano u proizvodnji, održavanju, kontroli kvaliteta i brizi o životinjama (uključujući i inspekciju) treba da se vakciniše odgovarajućim specifičnim vakcinama kada je to neophodno i treba da budu podvrgnuti redovnoj zdravstvenoj kontroli.
3. Zaposleni promenjenog zdravstvenog statusa koji bi mogao štetno da utiče na kvalitet proizvoda, treba da se isključe iz rada u proizvodnim prostorima, o čemu se vodi odgovarajući zapis. Proizvodnja BCG vakcine i tuberkulinskih proizvoda treba da se ograniči na osoblje koje se pažljivo kontroliše redovnom proverom imunološkog statusa ili rendgenskim snimanjem pluća. Praćenje zdravstvenog stanja osoblja treba da bude srazmerno riziku, a za angažovanje osoblja u aktivnostima sa opasnim mikroorganizmima, treba da se traži medicinski savet.
4. Kada je potrebno da se minimizira rizik od unakrsne kontaminacije, ograničavanje kretanja svih zaposlenih (uključujući i osoblje zaduženo za kontrolu kvaliteta, održavanje opreme i čišćenje) treba da se kontroliše u skladu sa principima Upravljanja rizikom kvaliteta. Osoblje ne treba da prelazi iz prostora gde postoji izloženost živim mikroorganizmima, genetski modifikovanim organizmima, toksinima ili životinjama u prostore gde se koriste drugi proizvodi, inaktivisani proizvodi ili različiti mikroorganizmi. Ako prelaz nije moguće izbeći, mere kontrole kontaminacije treba da budu zasnovane na principima Upravljanja rizikom kvaliteta.
5. Stepen kontrole ambijentalnih uslova u pogledu čestične i mikrobiološke kontaminacije prostorija za proizvodnju treba da bude primeren aktivnoj supstanci, međuproizvodima i gotovom proizvodu i odgovarajućoj fazi proizvodnog procesa, pri čemu treba da se vodi računa o nivou kontaminacije polaznih materijala i rizika u odnosu na gotov proizvod. Kada je to određeno u procesu Upravljanja rizikom kvaliteta, u program monitoringa ambijentalnih uslova treba da se uključe i metode za detekciju prisustva specifičnih mikroorganizama (organizam domaćina, gljivice, plesni, anaerobi i dr.).
6. Proizvodni i skladišni prostor, procesi i klasifikacija prostora treba da budu dizajnirani tako da se spreči spoljnja kontaminacija. Iako je verovatno da će doći do kontaminacije tokom procesa fermentacije i kultivacije ćelija, prihvatljivije je sprečavanje kontaminacije nego njena detekcija i uklanjanje. U slučaju kada nije obezbeđen zatvoreni sistem proizvodnje, zbog čega je proizvod neposredno izložen ambijentalnim uslovima (npr. prilikom dodavanja komponenti, hranljive podloge, pufera, gasova, rukovanje prilikom proizvodnje lekova za napredne terapije - ATMPs), treba da se primene kontrolne mere, uključujući tehničku kontrolu i monitoring ambijentalnih uslova u skladu sa principima Upravljanja kvalitetom rizika. Principi Upravljanja kvalitetom rizika treba da uzmu u obzir principe i smernice odgovarajućih delova Aneksa 1.15
_______
15 Iako se Aneks 1 odnosi
na proizvodnju sterilnih lekova, u ovom slučaju ne postoji namera da se zahteva
proizvodnja sterilnih proizvoda u fazi kada je nisko prethodno biološko opterećenje
prihvatljivo i odobreno. Na Aneks 1 se upućuje iz razloga što je to jedina
EU smernica dobre proizvođačke prakse u kojoj su date smernice za klasifikaciju
proizvodnih prostora uključujući one niže klase čistoće (klasa D i C).
Smernice Dobre proizvođačke prakse, prilikom planiranja odgovarajućih klasa čistoće u okviru prostora za proizvodnju, kao i odgovarajućih kontrola.
7. Kada se u proizvodnji koriste živi mikroorganizmi koji mogu da opstanu u proizvodnom prostoru, treba da se koriste namenski proizvodni prostori. Takođe, za proizvodnju patogenih mikroorganizama treba da se obezbedi namenski proizvodni prostor sa odgovarajućom biološkom bezbednošću (npr. nivo biološke bezbednosti (biosafety) 3 ili 4).
8. Proizvodnja više proizvoda u istom objektu je prihvatljiva samo ako su za kontrolu i sprečavanje unakrsne kontaminacije preduzete sledeće navedene ili ekvivalentne mere, ili je uzeto u obzir sledeće:
a) Poznavanje osnovnih karakteristika svih ćelija, mikroorganizama i bilo kojih drugih sporednih agenasa (npr. patogenost, detektabilnost, otpornost, podložnost inaktivaciji) u istom objektu;
b) U slučaju kada se proizvodi veći broj manjih serija proizvoda od različitog polaznog materijala (npr. proizvodi na bazi ćelija), prilikom razmatranja prihvatljivosti istovremene proizvodnje u planiranju odgovarajuće kontrolne strategije treba da se uzmu u obzir faktori kao što su zdravstveni status davaoca i rizik od potpunog gubitka proizvoda od ili za specifične pacijente;
c) Sprečavanje prenosa živih mikroorganizama ili spora u druge prostore ili opremu utvrđivanjem svih potencijalnih puteva kontaminacije, upotrebom pribora za jednokratnu upotrebu, kao i primenom zatvorenih sistema proizvodnje;
d) Preduzimanje kontrolnih mera za uklanjanje mikroorganizama i spora pre uzastopne proizvodnje više proizvoda, a koje obuhvataju i sistem za grejanje, ventilaciju i hlađenje vazduha (HVAC). Čišćenje i dekontaminacija mikroorganizama i spora treba da budu validirani;
e) U slučaju mikroorganizama koji imaju sposobnost da opstanu u proizvodnom prostoru, tokom proizvodnje kao i posle čišćenja i dekontaminacije, u okolnim prostorima se primenjuju metode za monitoring ambijentalnih uslova specifične za mikroorganizme koji se proizvode. U prostorima u kojima se rukuje živim i/ili spongiformnim mikroorganizmima treba da se obrati pažnja na rizike u vezi sa upotrebom opreme za monitoring ambijentalnih uslova (npr. brojač čestica u vazduhu);
f) Proizvodi, proizvodna i pomoćna oprema (npr. oprema za kalibraciju i validaciju) i delovi koji se rasklapaju, treba da se unose i iznose iz proizvodnog prostora na takav način da se spreči kontaminacija drugih prostora, proizvoda i različitih faza proizvoda (npr. da se spreči kontaminacija inaktivisanih ili toksoidnih proizvoda neinaktivisanim proizvodima);
g) kampanjska proizvodnja.
9. Prilikom razmatranja potrebe da se u okviru istog objekta obezbede namenske prostorije za završne operacije proizvodnje16, osim navedenog u tački 8. ovog odeljka, treba da se uzmu u obzir i specifične potrebe biološkog leka i karakteristike drugih proizvoda, uključujući i lekova koji nisu biološki. Druge kontrolne mere u završnim operacijama uključuju potrebu dodavanja specifičnih aktivnosti, kontrolu brzine mešanja, kontrolu vremena trajanja i temperature, kontrolu izlaganja svetlosti i kontaminantima i postupak čišćenja u slučaju prolivanja.
_______
16 Formulacija, punjenje i pakovanje
10. Mere i procedure neophodne za izolaciju (npr. za okolinu i bezbednost operatera) ne treba da budu u suprotnosti sa merama za zaštitu kvaliteta proizvoda.
11. Uređaji za filtraciju vazduha treba da budu specifični za određenu zonu i da budu dizajnirani, konstruisani i održavani tako da se minimizira rizik od unakrsne kontaminacije između različitih proizvodnih zona. Treba da se, u skladu sa principima Upravljanja rizikom kvaliteta, razmotri upotreba sistema za filtraciju vazduha bez recirkulacije.
12. Za proizvodnju sterilnih proizvoda treba da se koriste prostorije/prostori u nadpritisku, dok je u cilju izolacije neophodno obezbediti negativan pritisak u posebnim zonama u kojima postoji izloženost patogenima. Kad se prostori pod negativnim pritiskom ili sigurnosni kabineti koriste za aseptičan postupak proizvodnje proizvoda koji su rizični (npr. patogeni), oni treba da budu okruženi zonama odgovarajuće klase čistoće koje su u nadpritisku. Ove kaskade pritisaka treba da budu jasno definisane i da se kontinuirano prate sa odgovarajućim podešavanjem alarma.
13. Oprema koja se koristi u toku rukovanja živim mikroorganizmima i ćelijama, uključujući i opremu za uzorkovanje, treba da bude dizajnirana tako da se spreči kontaminacija tokom upotrebe.
14. Primarna izolacija treba da bude dizajnirana i periodično testirana tako da se spreči izlazak bioloških agenasa u neposredno okruženje.
15. Kad god je moguće moraju da se koriste sistemi za "čišćenje i sterilizaciju na mestu" ("clean in place" i "sterilisation in place"). Ventili na sudovima za fermentaciju treba da budu takvi da mogu da se potpuno sterilišu vodenom parom.
16. Filteri za vazduh treba da budu hidrofobni i validirani za propisani rok upotrebe, i da se ispitivanje integriteta ovih filtera vrši u odgovarajućim vremenskim intervalima određenim u skladu sa principima Upravljanja rizikom kvaliteta.
17. Sistemi za odvod moraju da budu tako dizajnirani da otpadni materijali mogu efektivno da se neutrališu ili dekontaminiraju u cilju minimizacije rizika. Da bi se minimizirao rizik od kontaminacije spoljašnje sredine otpadnim materijalom biohazardne prirode, sistemi za odvod moraju da odgovaraju zahtevima nacionalnih propisa.
18. Zbog varijabilnosti bioloških proizvoda ili procesa proizvodnje, relevantni/kritični materijali (kao što su hranljive podloge i puferi) treba da se odmeravaju tokom proizvodnog procesa. U tim slučajevima, male zalihe ovih materijala mogu da se čuvaju u proizvodnom prostoru tokom vremenskog perioda određenog na osnovu definisanih kriterijuma kao što su trajanje proizvodnje jedne serije ili kampanje.
19. Za proizvodnju mnogih bioloških proizvoda upotrebljava se širok spektar životinjskih vrsta. U odnosu na poreklo one mogu da se podele u dve velike grupe:
a) žive životinje, stada, jata: na primer za polio vakcinu (majmuni), za imunoserume protiv zmijskog otrova i tetanusa (konji, ovce i koze), za alergene (mačke), za vakcinu protiv besnila (kunići, miševi i hrčci), za transgene proizvode (koze, goveda);
b) tkiva i ćelije dobijeni od mrtvih životinja i iz klanica: na primer ksenogene ćelije iz životinjskog tkiva i ćelija, hraniteljske ćelije koje podržavaju rast nekih lekova za napredne terapije (ATMPs), klanice kao izvor enzima, antikoagulanasa i hormona (ovce i svinje).
Životinje se koriste i pri ispitivanju kvaliteta, kako za generička ispitivanja kao što je npr. ispitivanje pirogenosti, tako i za specifična ispitivanja aktivnosti, npr. vakcina protiv velikog kašlja (miševi), ispitivanje prisustva pirogena (kunići), BCG vakcina (zamorci).
20. Osim usaglašenosti sa propisima za TSE i drugi slučajni neželjeni agensi koji izazivaju zabrinutost (zoonoze, bolesti izvornih životinja) treba da se prate i evidentiraju u skladu sa utvrđenim zdravstvenim programom. Ovi programi se uspostavljaju na osnovu saveta specijalista. Slučajevi pojave bolesti kod izvornih/donorskih životinja treba da se istraže u smislu podobnosti i pogodnosti nastavka korišćenja tih životinja (za proizvodnju, kao izvor polaznog materijala, za kontrolu kvaliteta i ispitivanje bezbednosti) i te odluke moraju da budu dokumentovane. Treba da se uspostavi procedura sledljivosti (look-back) za informacije potrebne za proces donošenje odluke o kontinuiranoj prikladnosti biološke aktivne supstance ili leka koji su proizvedeni od polaznih materijala životinjskog porekla. Ovaj proces donošenja odluke može da obuhvata i retestiranje referentnih uzoraka iz prethodno sakupljenog materijala od iste donatorske životinje kako bi se utvrdila poslednja negativna donacija. Podatak o vremenu prekida upotrebe terapijskih agenasa za lečenje donorskih životinja mora da se dokumentuje i koristi za donošenje odluke o isključenju ovih životinja iz programa na određeni vremenski period.
21. Posebno treba da se vodi računa da se spreči, kao i da se prati pojava infekcija donorskih životinja. Mere treba da obuhvate nabavku, objekte, gazdinstva, procedure biološke sigurnosti, režime testiranja, kontrolu prostirke za životinje i hrane. Ovo je od posebnog značaja za životinje bez specifičnih patogena (SPF) kada moraju da budu ispunjeni zahtevi monografija farmakopeja. Za ostale kategorije životinja treba da se definiše praćenje zdravstvenog stanja i prostora za smeštaj životinja (npr. zdrava stada ili krda).
22. Za proizvode koji se proizvode od transgenih životinja, treba da se održava sledljivost u stvaranju transgenih životinja od izvornih životinja.
23. Treba uzeti u obzir Direktivu 86/609/EC o harmonizaciji zakona, propisa administrativnih odredbi država članica EU u pogledu zaštite životinja koje se koriste u eksperimentalne i naučne svrhe, kao i uslova koje treba da ispune prostorije za čuvanje, negu i karantin životinja. Prostor za smeštaj životinja koje se koriste za proizvodnju i kontrolu bioloških aktivnih supstanci i lekova treba da bude odvojen od prostora za proizvodnju i kontrolu.
24. Za različite životinjske vrste ključni kriterijumi treba da se definišu, prate i beleže. U ključne kriterijume spadaju starosna dob, težina i zdravstveni status životinja.
25. Sistem obeležavanja treba da se uspostavi za životinje, biološke agense i testove u cilju sprečavanja rizika od zabune, kao i u cilju kontrole svih utvrđenih opasnosti.
26. Za polazne materijale može da bude potrebna i dodatna dokumentacija o izvoru, poreklu, lancima snabdevanja, odnosno distribucije, postupcima proizvodnje, metodama ispitivanja koje se primenjuju, kako bi se obezbedio odgovarajući nivo kontrole kvaliteta uključujući i mikrobiološku kontrolu.
27. Za neke vrste proizvoda potrebno je definisati materijale koji čine seriju, naročito somatskih ćelija u slučaju proizvodnje lekova za naprednu terapiju (ATMPs). U slučajevima autologno dobijenih proizvoda i proizvoda dobijenih od odgovarajućeg davaoca, proizvedeni proizvod se smatra serijom.
28. Kada se koriste ćelije ili tkiva ljudskih davaoca, neophodna je potpuna sledljivost od polaznih materijala, uključujući sve supstance koje dolaze u kontakt sa ćelijama ili tkivima, do potvrde prijema proizvoda na mestu upotrebe, uz poštovanje privatnosti pojedinaca i zaštite njihovih medicinskih podataka. Zapisi o sledljivosti17 moraju da se čuvaju 30 godina nakon isteka roka upotrebe leka. Posebna pažnja treba da se posveti održavanju sledljivosti lekova za posebne namene kao što su ćelije odgovarajućeg davaoca. Direktiva 2002/98/EC i Direktiva 2005/61/EC koja dopunjava Direktivu 2002/98/EC u pogledu zahteva sledljivosti i prijavljivanja ozbiljnih neželjenih reakcija i događaja, primenjuju se na komponente krvi kada se one koriste kao polazni materijal za proizvodnju lekova. Za lekove za napredne terapije (ATMPs), zahtevi u pogledu sledljivosti ljudskih ćelija, uključujući hematopoetske ćelije, moraju da budu u skladu sa principima Direktive 2004/23/EC i Direktive 2006/86/EC. Aranžmani potrebni za postizanje sledljivosti i period čuvanja treba da budu predmet ugovora između ugovornih strana.
______
17 za više informacija
o sledljivosti lekova za napredne terapije namenjene za kliničko ispitivanje,
videti ENTR/F/2/SF/dn D(2009) 35810, Detaljna smernica o dobroj kliničkoj praksi
specifičnoj za lekove za napredne terapije,
29. S obzirom na veliku varijabilnost bioloških aktivnih supstanci i lekova, koraci koji se preduzimaju za povećanje robusnosti procesa u cilju smanjenja varijabilnosti i povećanje ponovljivosti u različitim fazama životnog ciklusa leka, kao što je dizajn procesa, treba da se preispitaju u pregledu kvaliteta proizvoda.
30. Pošto su uslovi kultivacije, hranljive podloge i reagensi dizajnirani tako da povećavaju rast ćelija ili mikroorganizama, obično u akseničnom stanju, naročita pažnja treba da se posveti kontrolnoj strategiji kako bi se obezbedili snažni koraci za sprečavanje ili smanjenje pojave neželjenog biološkog opterećenja (bioburden), kao i nastalih metabolita i endotoksina. U slučaju lekova za naprednu terapiju na bazi ćelija, koji se obično proizvode u malim serijama, rizik od unakrsne kontaminacije između ćelijskih preparata različitih davaoca čiji se zdravstveni status razlikuje, treba da se kontroliše u skladu sa definisanom procedurom i zahtevima.
Polazni materijali
31. Izvor, poreklo i pogodnost bioloških i drugih polaznih materijala (npr. krioprotektanti, hraniteljske ćelije, reagensi, mikrobiološke podloge, puferi, serumi, enzimi, citokini, faktori rasta), treba da budu jasno definisani. U slučaju kada neophodna testiranja traju dugo, može da se odobri upotreba polaznih materijala pre nego što se dobiju rezultati tih testiranja, pod uslovom da je rizik od korišćenja materijala potencijalno neodgovarajućeg kvaliteta i potencijalni uticaj na druge serije procenjen u skladu sa Upravljanjem rizikom kvaliteta. U takvim slučajevima, uslov za puštanje u promet gotovog proizvoda jesu zadovoljavajući rezultati tih testiranja. Identifikacija svih polaznih materijala treba da bude u skladu sa zahtevima koji odgovaraju određenoj fazi proizvodnje. Detaljnije smernice za biološke lekove date su u Prvom delu i Aneksu 8, a za biološke aktivne supstance u Drugom delu smernice.
32. Mora da se proceni rizik od kontaminacije polaznih materijala u lancu snabdevanja, a posebno u odnosu na TSE. Mora da se obrati pažnja na materijale koji dolaze u direktan kontakt sa proizvodnom opremom i proizvodom (kao što su hranljive podloge koje se koriste u media fill testu i lubrikansi).
33. S obzirom da su rizici od kontaminacije i posledice na proizvod isti bez obzira na fazu proizvodnje, uspostavljanje kontrolne strategije u cilju zaštite proizvoda i pripreme rastvora, pufera i drugih dodataka, treba da se zasniva na principima i smernicama sadržanim u odgovarajućim delovima Aneksa 1. U slučajevima kada završna, odnosno terminalna sterilizacija nije moguća i kada je ograničena mogućnost uklanjanja mikrobioloških nus proizvoda, naročito za proizvode na bazi ćelija, od izuzetnog značaja je kontrola kvaliteta polaznih materijala i aseptičnog postupka proizvodnje. Kada je nosilac dozvole za stavljanje leka u promet ili nosilac odobrenja za kliničko ispitivanje odredio dozvoljenu vrstu i stepen prethodnog biološkog opterećenja (bioburden) kod aktivne supstance, kontrolna strategija treba da bude usmerena na način održavanja postignutog stepena prethodnog biološkog opterećenja (bioburden) u okviru definisanih limita.
34. Kada se zahteva sterilizacija polaznih materijala, ona treba da se izvrši toplotom kad god je to moguće. Kada je neophodno, i druge odgovarajuće metode sterilizacije mogu da se koriste za inaktivaciju bioloških materijala (npr. metoda zračenjem i filtracijom).
35. Za smanjenje prethodnog biološkog opterećenja (bioburden), kod nabavke živih tkiva i ćelija mogu da budu neophodne druge mere, kao što je upotreba antibiotika u ranim fazama proizvodnje. Upotreba antibiotika treba da se izbegne, ali kada je dokazano da je njihova upotreba neophodna, oni treba da se uklone u fazi procesa proizvodnje koju je odredio nosilac dozvole za stavljanje leka u promet ili nosilac odobrenja za kliničko ispitivanje.
36. Za humana tkiva i ćelije koji se koriste kao polazni materijal za proizvodnju bioloških lekova, neophodno je da se obezbedi sledeće:
a) Njihova nabavka, doniranje i testiranje u EU je uređeno Direktivom 2004/23/EC. Mesta njihove nabavke u EU moraju da imaju odgovarajuće dozvole nacionalnih nadležnih organa, što mora da se potvrdi u skladu sa procedurom odobravanja/kvalifikacije dobavljača polaznih materijala;
b) Kada se ta humana tkiva i ćelije uvoze iz trećih zemalja oni moraju da zadovoljavaju standarde kvaliteta i bezbednosti koji su ekvivalentni standardima EU datim u Direktivi 2004/23/EC. Zahtevi u pogledu sledljivosti i prijavljivanja ozbiljnih neželjenih reakcija i događaja dati su Direktivi 2006/86/EC;
c) Kada je potrebno, obrada ćelija i tkiva koji se koriste kao polazni materijali za proizvodnju bioloških lekova, vrši se u banci tkiva npr. izvođenje ranih ćelijskih linija ili banke pre uspostavljanja glavne (master) banke ćelija. Za ove proizvodne korake, koji su definisani direktivom 2004/23/EC, odgovorno je imenovano Odgovorno lice u banci ćelija, odnosno tkiva;
d) Pre isporuke proizvođaču lekova, Odgovorno lice u banci odobrava tkiva i ćelije, nakon čega se primenjuju uobičajene kontrole kvaliteta polaznog materijala za proizvodnju lekova. Rezultati testiranja svih ćelija i tkiva izvršenih u banci ćelija/tkiva, moraju da budu dostupni proizvođaču lekova. Ovi podaci su neophodni za donošenje odluka o izolaciji i skladištenju. U slučaju kada proizvodnja leka mora da započne pre nego što su u banci ćelija/tkiva dostupni rezultati testiranja, ćelije i tkiva mogu da se isporuče proizvođaču pod uslovom da su obezbeđene mere za sprečavanje unakrsne kontaminacije;
e) Način transporta/prevoza ćelija i tkiva do mesta proizvodnje lekova mora da bude definisan ugovorom između ugovornih strana. Proizvođač lekova treba da raspolaže dokazima da su propisani uslovi održavani tokom skladištenja i transporta;
f) Treba da se obezbedi nastavak ispunjavanja zahteva u pogledu sledljivosti koji su uspostavljeni u banci ćelija/tkiva, uključujući i podatke o materijalima koji dolaze u kontakt sa ćelijama i tkivima;
g) Treba da postoji ugovor zaključen između ugovornih strana (npr. proizvođača, banke tkiva, sponzora, nosioca dozvole za stavljanje leka u promet) kojim su definisane odgovornosti svake strane, uključujući i Odgovornog lica u banci ćelija/tkiva i Kvalifikovanog lica odgovornog za puštanje serije leka u promet.
37. Za polazne materijale za gensku terapiju18, važi sledeće:
a) Za proizvode koji se sastoje od virusnih vektora, polazni materijali su komponente za dobijanje virusnih vektora, kao što su glavni izvor virusa ili plazmidi za prenos ćelija za pakovanje i glavna banka ćelijskih linija za pakovanje;
b) Za proizvode koji se sastoje od plazmida, nevirusnih vektora ili genetski modifikovanih mikroorganizama, osim virusa i virusnih vektora, polazni materijali su komponente koje se koriste za proizvodnju ćelija (plazmid, bakterijska ćelija domaćina i glavna banka ćelija rekombinantnih ćelija mikroorganizama);
c) Za genetski modifikovane ćelije polazni materijali su komponente koje se koriste za dobijanje genetski modifikovanih ćelija, odnosno polazni materijali za proizvodnju vektora i humanih i životinjskih ćelijskih preparata;
d) Principi dobre proizvođačke prakse se primenjuju od banke sistema koji se koristi za proizvodnju vektora ili plazmida za transfer gena.
38. Kada se za proizvodnju koriste humane ili životinjske ćelije, treba da se uspostave odgovarajuće mere kontrole porekla, testiranja, skladištenja i transporta, uključujući i kontrolu usaglašenosti sa Direktivom 2004/23.
________
18 Detalje videti u tački
3.2 Dela IV Aneksa I Direktive 2001/83/EC.
Sistem izvora semena (seed lot) i sistem banke ćelija
39. Da bi se sprečila neželjena odstupanja osobina koja mogu da proizađu iz ponovljenih subkultura ili višestrukih generacija, proizvodnja bioloških supstanci i lekova dobijenih iz mikrobioloških kultura, ćelijskih kultura ili razmnožavanjem u embrionima i životinjama, treba da se zasniva na sistemu glavnih/matičnih i radnih izvora semena, odnosno sistemu banke ćelija. Ovi sistemi ne mogu da se primenjuju na sve tipove lekova za napredne terapije.
40. Broj generacija (dupliranja, pasaža) između primarnog izvora semena ili banke ćelija, biološke aktivne supstance i gotovog proizvoda treba da bude u skladu sa specifikacijama, odnosno dokumentacijom dostavljenom za dobijanje dozvole za stavljanje leka u promet.
41. U okviru upravljanja životnim ciklusom leka, uspostavljanje izvora semena i banke ćelija, uključujući i njihove glavne i radne generacije, treba da se vrši pod uslovima koji su dokazano odgovarajući. Pripremanje izvora semena i banke ćelija treba da se vrši u odgovarajuće kontrolisanoj sredini, kako bi se oni zaštitili, kao i osoblje koje rukuje sa njima. U postupku pripremanja izvora semena i banke ćelija, ne treba istovremeno da se rukuje nekim drugim živim ili infektivnim materijalom (npr. virusima, ćelijskim linijama ili ćelijskim vrstama) u istom prostoru, niti od strane istog osoblja. U fazama pre uspostavljanja izvora semena i banke ćelija, kada su primenljivi samo principi dobre proizvođačke prakse, treba da bude dostupna dokumentacija kojom se obezbeđuje sledljivost, između ostalog i komponenti koje su korišćene tokom razvoja, a koje imaju potencijalni uticaj na bezbednost proizvoda (npr. reagensi biološkog porekla), i to podataka o poreklu i genetskom razvoju ako je primenljivo. Za vakcine se primenjuju zahtevi monografije Evropske farmakopeje 2005; 153 "Vakcine za humanu upotrebu".
42. U fazama posle uspostavljanja glavnih i radnih banki ćelija i izvora semena, treba da se obezbede procedure karantina i odobravanja za upotrebu. Ovo podrazumeva adekvatnu karakterizaciju i ispitivanje na prisustvo kontaminanata. Njihova pogodnost za upotrebu treba da bude dokazana na osnovu doslednosti osobina i kvaliteta uzastopnih serija leka. Podaci o stabilnosti i obnavljanju izvora semena i banki ćelija treba da budu dokumentovani, a zapisi da se vode na način koji omogućava prećenje trenda.
43. Izvori semena i banke ćelija treba da se čuvaju i koriste na takav način da se minimizira rizik od kontaminacije (npr. čuvanje u zatvorenim kontejnerima u gasnoj fazi tečnog azota) ili zamene. Kod čuvanja različitih izvora semena i/ili ćelija u istom prostoru ili opremi, primenjuju se kontrolne mere u cilju sprečavanja zamene, kao i sprečavanja kontaminacije koja potiče od infektivnosti materijala.
44. Lekovi na bazi ćelija se proizvode od ćelija dobijenih kroz ograničen broj pasaža u odnosu na ćelijski stock. Za razliku od sistema glavne i radne banke ćelija, broj proizvodnih postupaka od ćelijskog stock-a je ograničen brojem alikvota dobijenih posle ekspanzije i ne pokriva ceo životni ciklus proizvoda. Protokol validacije treba da obuhvati promene ćelijskog stock-a.
45. Kontejneri za čuvanje treba da budu hermetički zatvoreni, jasno obeleženi i na odgovarajućoj temperaturi. Mora da se vodi zapis o popisu ćelijskog stock-a. Temperatura skladištenja treba kontinuirano da se evidentira i stalno da se proverava tečni azot, kada se on koristi. Svako odstupanje od postavljenih limita, kao i preduzete korektivne i preventivne mere treba da se zabeleže.
46. Poželjno je da se ćelijski stock-ovi razdvajaju i da se čuvaju na različitim mestima, kako bi se smanjio rizik od potpunog gubitka. Kontrole na tim mestima treba da obezbede ispunjenje zahteva navedenih u prethodnim tačkama ovog dela aneksa.
47. Rukovanje ćelijskim stock-ovima treba da se vrši u skladu sa istim procedurama, i da se obezbede isti parametri uslova čuvanja. Svi kontejneri sa glavnim ili radnim bankama ćelija i izvorima semena treba da se skladište i da se njima rukuje na identičan način. Kad se jednom iznesu iz skladišta, odnosno van sistema upravljanja ćelijskim stock-om, kontejneri više ne treba da se vraćaju u skladište.
Principi proizvodnje
48. Periodično treba da se razmotre efekti upravljanja izmenama (kontrola izmena), uključujući kumulativne efekte izmena (npr. procesa) na kvalitet, bezbednost i efikasnost leka.
49. Kritični operacioni (procesni) parametri, ili drugi ulazni parametri koji utiču na kvalitet proizvoda, treba da se identifikuju, validiraju i dokumentuju, kao i da se dokaže da mogu da se održavaju u okviru definisanih zahteva.
50. Kontrolna strategija prilikom unošenja komponenti i polaznih materijala u proizvodni prostor treba da se zasniva na principima upravljanja rizikom kvaliteta. Za aseptične procese, unošenje komponenti i polaznih materijala koji su termo stabilni u čist ili čist/izolovan prostor, treba da se vrši kroz prolazne autoklave ili sterilizatore sa dvoje vrata. Komponente i materijali koji nisu otporni na toplotu se unose kroz vazdušni propusnik sa inter-lock sistemom blokiranja vrata, u kome se vrši sanitizacija njihovih površina u skladu sa definisanom procedurom dokazane efektivnosti. Prihvatljivo je da se sterilizacija komponenti i polaznih materijala izvrši na drugom mestu, pod uslovom da su nakon sterilizacije zaštićeni sa onoliko slojeva omotača koliko je prelazaka u čist prostor, kao i da se unose kroz vazdušni propusnik uz primenu odgovarajućih mera sanitizacije površina.
51. Treba da se dokaže da su karakteristike promocije rasta u hranljivim podlogama odgovarajuće za njihovu namenu. Kad god je moguće hranljive podloge treba da se sterilišu "na mestu" (in sity). Za rutinsko uvođenje gasova, odnosno dodavanje podloga, kiselina, baza ili antipenećih sredstava u fermentore, kad god je to moguće treba da se koriste tzv. "in-line" sterilizacioni filteri koji su povezani sa fermentorom.
52. Dodavanje materijala ili kultura u fermentore i druge sudove, kao i uzimanje uzoraka, treba da se vrši pod pažljivo kontrolisanim uslovima, kako bi se sprečila kontaminacija. Kada se dodaju materijali u fermentore ili kada se vrši uzorkovanje treba da se vodi računa da su sudovi ispravno povezani.
53. Dokumentacija o proizvodnji serije treba da sadrži podatak o tome da li je potreban kontinuirani monitoring nekih proizvodnih procesa (npr. fermentacija). Kada se koristi kontinuirana kultura posebna pažnja treba da se obrati na one zahteve ispitivanja kvaliteta koji proističu iz ove vrste proizvodnje.
54. Centrifugiranje i mešanje proizvoda može da dovede do stvaranja aerosola, zbog čega je neophodno izolovati ove proizvodne operacije, radi sprečavanja unakrsne kontaminacije.
55. Slučajno prosipanje, naročito živih organizama mora brzo i bezbedno da se sanira. Za svaki mikroorganizam, ili grupu srodnih mikroorganizama treba da se obezbede kvalifikovane mere dekontaminacije. U slučaju različitih sojeva jedne bakterijske vrste ili kod vrlo sličnih virusa, proces dekontaminacije može da se validira na reprezentativnom soju, osim ako postoji razlog zbog koga se veruje da se oni značajno razlikuju u pogledu otpornosti na sredstvo koje se koristi za dekontaminaciju.
56. Materijal iz proizvodnje ili kontrole kao i dokumenta u papirnoj formi, koji su očigledno kontaminirani putem prolivanja ili aerosola koji sadrže potencijalno opasan mikroorganizam, moraju da se dezinfikuju na odgovarajući način, ili da se podaci sačuvaju na drugi način.
57. U slučajevima kad se procesi inaktivacije ili uklanjanja virusa izvode u toku proizvodnje, treba da se preduzmu posebne mere predostrožnosti kojima se sprečava rizik ponovne kontaminacije tretiranih proizvoda proizvodima koji nisu prethodno tretirani.
58. Kada se inaktivacija mikroorganizama vrši dodavanjem reagenasa (npr. mikroorganizmi u toku proizvodnje vakcina), postupak treba da obezbedi potpunu inaktivaciju živog mikroorganizma. Osim intenzivnog mešanja kulture i sredstva za inaktivaciju, treba da se obrati pažnja na kontaktne površine proizvoda koje su izložene živoj kulturi, i kada je potrebno da se proizvod prenese u drugi sud.
59. Za hromatografiju može da se koristi veoma raznovrsna oprema. Planiranje kontrolne strategije za matrice, kućišta i prateću opremu treba da se vrši u skladu sa principima upravljanja rizikom kvaliteta, u slučaju kada se oni koriste u kampanjskoj proizvodnji i kada se nalaze u okruženju više proizvoda. Treba da se izbegava ponovno korišćenje iste matrice u različitim fazama proizvodnje. Treba da se definišu kriterijumi prihvatljivosti, procesni uslovi, metode regeneracije, rok upotrebe, metode dezinfekcije ili sterilizacije kolona.
60. Kada se koristi ozračen materijal ili oprema, detaljna uputstva su data u Aneksu 12 smernice.
61. U slučaju kada gotovi proizvodi ili međuproizvodi predstavljaju poseban rizik, treba da postoji sistem koji obezbeđuje integritet i zatvaranje kontejnera nakon punjenja, kao i procedure za postupanje u slučaju curenja ili izlivanja. U toku punjenja i pakovanja proizvoda treba da se održavaju uslovi u okviru postavljenih limita, npr. vreme i/ili temperatura.
62. Bočicama koje sadrže žive biološke agense mora da se rukuje na takav način da se spreči kontaminacija drugih proizvoda ili kontaminacija radne ili životne sredine ovim agensima. U okviru upravljanja ovim rizicima treba da se uzme u obzir sposobnost ovih agenasa da opstanu kao i njihova biološka klasifikacija.
63. Treba da se vodi računa prilikom pripreme, štampanja, čuvanja i lepljenja etiketa, kao i o svim specifičnim informacijama o proizvodu za određene pacijente, ili napomeni na unutrašnjem ili spoljnjem pakovanju da je sadržaj proizveden genetskim inženjeringom. U slučaju kada se lekovi za naprednu terapiju (ATMPs) koriste za autolognu primenu, na spoljnjem pakovanju, ili na unutrašnjem pakovanju kada ne postoji spoljnje pakovanje, treba da se navede jedinstvena identifikacija pacijenta i napomena "samo za autolognu primenu".
64. Treba da se proveri kompatibilnost etiketa sa ultra niskim temperaturama skladištenja, ako se one koriste.
65. Kada su nakon nabavke dostupne informacije o zdravstvenom stanju davalaca (humanog ili životinjskog) koje mogu da utiču na kvalitet proizvoda, takve informacije treba da se uzmu u obzir radi procedure povlačenja proizvoda.
Kontrola kvaliteta
66. Procesna kontrola ima veći značaj za obezbeđenje konzistentnosti kvaliteta bioloških aktivnih supstanci i bioloških lekova, nego što je to slučaj kod konvencionalnih lekova. Procesna kontrola treba da se vrši u odgovarajućim fazama proizvodnje radi kontrole onih uslova koji su važni za kvalitet gotovog proizvoda.
67. Kada međuproizvodi mogu da se skladište tokom dužeg vremenskog perioda (više dana, nedelja ili duže), prilikom razmatranja njihove upotrebe za proizvodnju serija gotovog proizvoda treba da se uzme u obzir maksimalno vreme stajanja pre nastavka proizvodnje, koje je određeno u programu ispitivanja stabilnosti.
68. Određene vrste ćelija (npr. autologne ćelije koje se upotrebljavaju za proizvodnju lekova za naprednu terapiju) mogu da budu dostupne u ograničenim količinama, i kada je to odobreno u postupku izdavanja dozvole za stavljanje leka u promet, uspostavlja se i dokumentuje modifikovano testiranje i strategija uzimanja i čuvanja referentnih uzoraka.
69. U slučaju lekova za napredne terapije (ATMPs) na bazi ćelija, test sterilnosti treba da se sprovede na kulturi ćelija ili banci ćelija koja ne sadrži antibiotike, kako bi se obezbedio dokaz odsustva bakterijske i gljivične kontaminacije, kao i da bi se omogućila detekcija organizama sa specifičnim potrebama, kada je to potrebno.
70. Za biološke lekove sa kratkim rokom upotrebe, a što prema svrsi ovog aneksa iznosi 14 dana ili kraće, kao i kada je potrebno da se serija leka odobri za upotrebu pre završetka svih testova kontrole kvaliteta (npr. test sterilnosti), mora da se uspostavi odgovarajuća kontrolna strategija. Ova strategija mora da se zasniva na dobrom poznavanju performansi proizvoda i procesa i mora da se uzme u obzir kontrola i karakteristike polaznih materijala i sirovina. Posebno je značajno da pisana procedura za puštanje serije leka u promet bude precizna i detaljna, kao i da definiše odgovornosti zaposlenih koji vrše procenu podataka o proizvodnji i kontroli kvaliteta. Mora da se obezbedi stalna procena efektivnosti sistema obezbeđenja kvaliteta, uključujući i vođenje zapisa na takav način koji omogućava procenu trenda. U slučaju kada rezultati testova za gotov proizvod ne mogu da budu dostupni zbog kratkog roka upotrebe leka, treba da se razmotre alternativne metode za dobijanje ekvivalentnih podataka radi inicijalnog odobravanja serije leka (npr. metode brze mikrobiološke kontrole). Procedura puštanja serije leka u promet može da se odvija u dve ili više faze:
a) procena dokumentacije o proizvodnji serije, rezultata monitoringa ambijentalnih uslova (kada je primenljivo) koja uključuje uslove proizvodnje, sva odstupanja od normalnih procedura, kao i pregled dostupnih analitičkih podataka, koju vrši lice određeno za obavljanje tih poslova u postupku pripreme za donošenje inicijalne odluke od strane Kvalifikovanog lica za puštanje serije leka u promet;
b) procena konačnih analitičkih rezultata i drugih podataka dostupnih za donošenje konačne odluke od strane Kvalifikovanog lica za puštanje serije leka u promet.
Treba da se uspostavi procedura kojom su definisane mere koje treba da se preduzmu (uključujući vezu sa kliničkim osobljem), u slučaju dobijanja rezultata van specifikacije. Takvi događaji treba da se u potpunosti istraže, kao i da se preduzmu i dokumentuju odgovarajuće korektivne i preventivne mere u cilju sprečavanja njihovog ponavljanja.
SPECIFIČNA UPUTSTVA ZA ODREĐENE TIPOVE PROIZVODA
B1: Proizvodi životinjskog porekla19
Ova uputstva se odnose na životinjske materijale u koje spadaju i materijali iz klanica. Kako lanci snabdevanja mogu da budu obimni i složeni, kontrola treba da se bazira na principima upravljanja rizikom kvaliteta, kao i zahtevima monografija Evropske farmakopeje uključujući i potrebu za specifičnim testovima u određenim fazama. Treba da se obezbedi dokumentacija koja pruža podatke o sledljivosti u lancu snabdevanja20 i jasnim odgovornostima svih učesnika u tom lancu i koja treba da sadrži dovoljno detaljan i ažuran dijagram procesa.
1. Za bolesti životinja koje mogu da utiču na zdravlje ljudi treba da se uspostavi program monitoringa. Prilikom procene faktora rizika i planiranja mera za njihovo smanjenje treba da se uzmu u obzir izveštaji iz proverenih izvora o nacionalnoj rasprostranjenosti bolesti (npr. Svetska organizacija za zdravlje životinja, OIE, itd). Pored navedenog treba da se uzmu u obzir i informacije o zdravlju životinja i programima monitoringa i kontrole na nacionalnom i lokalnom nivou odakle potiču životinje (npr. farme ili klanice), kao i preduzete kontrolne mere tokom transporta do klanice.
2. U slučaju kada su životinjska tkiva poreklom iz klanica, treba da se potvrdi da one rade po standardima koji su jednaki evropskim. Treba da se uzmu u obzir i izveštaji organizacija kao što je Evropska uprava za veterinu (FVO) koja utvrđuje usaglašenost regulative trećih zemalja koje izvoze u zemlje EU sa evropskom regulativom u pogledu zahteva za kvalitet i bezbednost hrane, kao i zaštitu zdravlja životinja i bilja.
3. Mere kontrole polaznog materijala i sirovina na mestu njihovog porekla (npr. u klanicama) treba da sadrže odgovarajuće elemente Sistema upravljanja kvalitetom kako bi se obezbedio zadovoljavajući nivo obučenosti operatera, sledljivosti materijala, kontrole i konzistetnosti. Ove mere ne moraju da budu iz evropske smernice dobre proizvođačke prakse, već iz drugih ekvivalentnih izvora koji obezbeđuju ekvivalentan nivo kontrole.
4. Treba da se implementiraju takve mere kontrole polaznog materijala i sirovina da se spreče intervencije koje mogu da utiču na kvalitet materijala, ili koje bar obezbeđuju zapise o takvim aktivnostima tokom proizvodnje i u lancu snabdevanja. Ovi zapisi treba da obuhvate kretanje materijala od mesta početnog prikupljanja, preko mesta delimičnog i finalnog prečišćavanja, mesta skladištenja, konsolidatora i posrednika. Detalji o ovim kretanjima treba da se evidentiraju u okviru sistema sledljivosti, a bilo kakvo odstupanje treba da se dokumentuje, istraži i da se preduzmu odgovarajuće mere.
5. Treba da se vrše redovne provere (audit) dobavljača polaznog materijala ili sirovina kako bi se potvrdila usaglašenost kontrole materijala u različitim fazama proizvodnje. Sve zapažanja moraju da budu istražena u skladu sa njihovim značajem, o čemu se vodi potpuna dokumentacija. Takođe, treba da se uspostave sistemi koji obezbeđuju sprovođenje efektivnih korektivnih i preventivnih mera.
6. Za dobijanje ćelija, tkiva i organa namenjenih za proizvodnju lekova na bazi ksenogenih ćelija treba da se koriste samo životinje koje su uzgajane u izolovanim uslovima (izolovanom objektu) posebno za tu svrhu i u uslovima u kojima ne postoji mogućnost da se uzimaju ćelije, tkiva i organi od divljih životinja ili iz klanica. Takođe, ne treba da se koriste ni tkiva izvorne životinje. Zdravstveno stanje životinja treba da se prati i dokumentuje.
7. Za lekove na bazi ksenogenih ćelija primenjuju se odgovarajuće smernice u pogledu nabavke i testiranja životinjskih ćelija, kao što je uputstvo Evropske agencije za lekove koje se odnosi na lekove na bazi ksenogenih ćelija.
_______
19 Videti zahteve iz monografije 0333
Evropske farmakopeje
20 videti Poglavlje 5, Prvi deo Smernice
Dobre proizvođačke prakse
Materijali mogu da se proizvode ekstrakcijom iz prirodnih izvora ili tehnologijom rekombinantne DNK.
1. Izvorni materijal treba da se opiše sa dovoljno detalja kako bi se obezbedila doslednost njihove nabavke, npr. uobičajeno i naučno ime, poreklo, priroda, limiti kontaminanata, način prikupljanja. Izvorni materijali životinjskog porekla treba da budu poreklom od zdravih životinja. Odgovarajuća kontrola biološke sigurnosti treba da se uspostavi na mestu kolonija (npr. grinja, životinja) koje se koriste za ekstrakciju alergena. Alergeni treba da se čuvaju pod određenim uslovima da bi se smanjilo njihovo propadanje.
2. Proizvodni koraci koji uključuju pred-tretman, ekstrakciju, filtraciju, dijalizu, koncentraciju ili liofilizaciju, treba da se detaljno opišu i validiraju.
3. Procesi modifikacije u proizvodnji modifikovanih ekstrakata alergena (npr. alergoidi, konjugati) treba da se opišu. Međuproizvodi u procesu proizvodnje treba da se identifikuju i opišu.
4. Smeše ekstrakata alergena treba da se pripremaju od pojedinačnih ekstrakata iz istog izvornog materijala. Svaki pojedinačan ekstrakt treba da se tretira kao jedna aktivna supstanca.
1. Posebna pažnja treba da se obrati na kontrolu antigena biološkog porekla, kako bi se obezbedio kvalitet, doslednost i odsustvo slučajnih neželjenih agenasa. Priprema materijala koji se koristi za imunizaciju izvorne životinje (npr. antigena, nosača haptena, adjuvanasa, stabilizatora), kao i čuvanje tog materijala do imunizacije, treba da se vrši u skladu sa pisanom procedurom.
2. Imunizacija, test krvarenja i šema krvarenja radi berbe treba da budu u skladu sa podacima iz dozvole za stavljanje leka u promet ili odobrenja za kliničko ispitivanje.
3. Proizvodni uslovi za pripremu subfragmenata antitela (npr. Fab ili F(ab)2) ili bilo koju dalju modifikaciju moraju da budu u skladu sa validiranim i odobrenim parametrima. U slučaju kada se enzimi sastoje od nekoliko komponenti treba da se obezbedi njihova konzistentnost.
1. U slučaju kada se koriste jaja, treba da se potvrdi zdravstveno stanje jata od kojih se dobijaju jaja (da li je potvrđeno odsustvo patogena ili zdrava jata).
2. Mora da se validira integritet kontejnera u kojima se čuvaju međuproizvodi i vreme čuvanja međuproizvoda do sledeće faze proizvodnje.
3. Kontejneri sa inaktivisanim proizvodima ne treba da se otvaraju ili uzorkuju u prostorima koji sadrže žive biološke agense.
4. Redosled i način dodavanja aktivnih sastojaka, adjuvanasa i ekscipijenasa prilikom proizvodnje međuproizvoda ili gotovih proizvoda mora da bude u skladu sa specifikacijama.
5. U slučaju kada se za proizvodnju ili testiranje koriste mikroorganizmi koji zahtevaju viši nivo biološke bezbednosti (npr. sojevi pandemijske vakcine), moraju da se obezbede odgovarajuće mere izolacije. Za ovakve mere treba da se obezbedi saglasnost/odobrenje nacionalnih institucija i odobrenja treba da budu dostupna kao dokaz.
1. Uslovi procesa tokom rasta ćelija, ekspresije proteina i prečišćavanja moraju da se održavaju u okviru validiranih parametara kako bi se obezbedio konzistentan proizvod sa opsegom nečistoća definisanim u okviru sposobnosti procesa da ih smanji na prihvatljiv nivo. U zavisnosti od tipa ćelija koje se koriste za proizvodnju može da bude neophodno povećanje mera koje treba da se preduzmu kako bi se obezbedilo odsustvo virusa. Za proizvodnju koja podrazumeva višestruku berbu period kontinuirane kultivacije treba da bude u okviru definisanih limita.
2. Proces prečišćavanja radi uklanjanja proteina ćelije domaćina, nukleinskih kiselina, ugljenih hidrata, virusa i drugih nečistoća treba da se vrši u okviru definisanih validiranih granica.
B6: Proizvodi monoklonskih antitela
1. Monoklonska antitela mogu da se proizvode od hibridoma miševa, hibridoma ljudi ili tehnologijom rekombinantne DNK. Treba da se uspostave kontrolne mere koje su odgovarajuće za različite izvore ćelija (uključujući hraniteljske ćelije, ako se koriste) i materijale koji se koriste za uspostavljanje hibridoma/ćelijskih linija, kako bi se obezbedio kvalitet i bezbednost proizvoda. Treba da se potvrdi da su bezbednost i kvalitet proizvoda u okviru odobrenih limita. Posebna pažnja treba da se obrati na oslobađanje od virusa. Treba napomenuti da su podaci koji potiču od proizvoda dobijenih istom proizvodnom tehnologijom prihvatljivi za dokazivanje podobnosti.
2. Treba da se potvrdi da su kriterijumi koje treba pratiti na kraju proizvodnog ciklusa i za rani prestanak proizvodnog ciklusa, u okviru odobrenih granica.
3. Uslovi za proizvodnju subfragmenata antitela (npr. Fab, F(ab)2, scFv) i svako dalje modifikovanje (npr. radio obeležavanje, konjugacija, hemijsko povezivanje) mora da bude u skladu sa validiranim parametrima.
B7: Proizvodi transgenih životinja
Doslednost polaznih materijala transgenog porekla obično predstavlja veći problem nego u slučaju ne-transgenih materijala biotehnološkog porekla. Shodno tome, povećani su zahtevi da se pokaže potpuna konzistentnost proizvoda od serije do serije.
1. Čitav niz vrsta može da se koristi za proizvodnju bioloških lekova, a one se mogu naći u telesnim tečnostima (npr. mleku) koje se prikupljaju i prečišćavaju. Životinje treba da budu obeležene na jasan i jedinstven način i treba da se obezbedi sistem za čuvanje (backup) podataka u slučaju gubitka primarnog markera.
2. Prostor za smeštaj i negu životinja treba da bude tako uređen da se minimizira izloženost životinja patogenima ili zoogenim agensima. Treba da se uspostave mere za zaštitu spoljašnje sredine. Treba da se uspostavi program zdravstvene kontrole i da se dokumentuju svi rezultati, kao i da se ispita svaki incident i njegov uticaj kako na dalju upotrebu životinje tako i na prethodne serije proizvoda. Neophodno je da se obezbedi da lekovi koji se koriste za lečenje životinja ne kontaminiraju proizvod.
3. Rodoslov od roditeljske do životinje koja se upotrebljava u proizvodnji mora da se dokumentuje. Pošto se transgene ćelije izvode iz jedne roditeljske životinje, materijali iz različitih transgenih linija ne treba da se mešaju.
4. Uslovi pod kojima se proizvodi prikupljaju treba da budu u skladu sa uslovima definisanim u dokumentaciji dozvole za stavljanje leka u promet ili odobrenja za kliničko ispitivanje. Raspored berbe i uslovi pod kojima se životinje uklanjaju iz proizvodnje treba da se odrede prema odobrenoj proceduri i da se odrede limiti prihvatljivosti.
B8: Proizvodi transgenih biljaka
Doslednost polaznih materijala transgenog porekla obično predstavlja veći problem nego u slučaju ne-transgenih materijala biotehnološkog porekla. Shodno tome, povećani su zahtevi da se pokaže potpuna konzistentnost proizvoda od serije do serije.
1. Osim mera navedenih u u delu A, mogu da budu neophodne i dodatne mere za sprečavanje kontaminacije glavnih ili radnih transgenih banaka stranim biljnim materijalom ili relevantnim pomoćnim agensima. Treba da se prati stabilnost gena u okviru određenog broja generacija.
2. Biljke treba da budu obeležene na jasan i jedinstven način i da se u okviru kulture u definisanim intervalima potvrde ključne karakteristike biljke, uključujući i zdravstveno stanje, kako bi se obezbedila doslednost prinosa u okviru jedne kulture.
3. Kad god je moguće, treba da se definišu mere bezbednosti za zaštitu kulture, kao što je smanjenje izloženosti mikrobiološkoj kontaminaciji ili unakrsnoj kontaminaciji nesrodnim biljkama. Treba da se uspostave mere za sprečavanje kontaminacije materijala pesticidima ili đubrivom. Treba da se uspostavi program kontrole i da se dokumentuju svi rezultati, kao i da se ispita svaki incident i njegov uticaj na dalju upotrebu kulture za proizvodnju.
4. Treba da se odrede uslovi pod kojima se uklanjaju biljke iz proizvodnje. Treba da se uspostave kriterijumi prihvatljivosti za materijale (npr. proteini domaćina) koji mogu da utiču na proces prečišćavanja. Treba da se potvrdi da su rezultati u okviru limita prihvatljivosti.
5. Treba da se vode zapisi o spoljašnjim uslovima (temperatura, kiša) koji mogu da utiču na karakteristike kvaliteta i prinos rekombinantnog proteina od sađenja, preko gajenja do berbe i privremenog skladištenja materijala. Prilikom uspostavljanja ovih kriterijuma treba da se uzmu u obzir principi određeni u dokumentima Komiteta za biljne lekove kao što su smernice dobre poljoprivredne i prakse u sakupljanju polaznog materijala biljnog porekla.
B9: Proizvodi za gensku terapiju
Postoji nekoliko tipova lekova za gensku terapiju (lekovi za gensku terapiju koji sadrže sekvence rekombinantnih nukleinskih kiselina ili genetski modifikovanih organizama ili virusa, lekovi za gensku terapiju koji sadrže genetski modifikovane ćelije) i svi su obuhvaćeni ovim odeljkom smernice. Za lekove za gensku terapiju na bazi ćelija, primenljive su smernice date u odeljku B10 Dela B.
1. Potencijalni rizik od kontaminacije slučajnim neželjenim agensima potiče od ćelija koje se koriste za proizvodnju proizvoda za gensku terapiju, a koje se dobijaju ili od ljudi (autologna ili alogenska), ili od životinja (ksenogenska). Naročito mora da se obrati pažnja na segregaciju autolognog materijala koji je dobijen od zaraženog donora. Obim kontrolnih mera i ispitivanja za takve polazne materijale, krioprotektante, hranljive podloge, ćelije i vektore treba da se zasniva na principima upravljanja rizikom kvaliteta, kao i da bude u skladu sa dozvolom za stavljanje leka u promet ili odobrenjem za kliničko ispitivanje. Takođe, obrazovane ćelijske linije koje se koriste za proizvodnju virusnih vektora i njihovu kontrolu, kao i mere za testiranje treba da se zasnivaju na principima upravljanja rizikom kvaliteta.
2. Faktori kao što su priroda genetskog materijala, vrsta vektora (virusni ili nevirusni) i tip ćelija imaju uticaj na sadržaj potencijalnih nečistoća, pomoćne agense i unakrsnu kontaminaciju, i treba da se uzmu u obzir u okviru strategije minimizacije rizika. Ova strategija treba da se koristi kao osnov za dizajn procesa, prostora i opreme za proizvodnju i skladištenje, procedura čišćenja i dekontaminacije, pakovanje, obeležavanje i distribuciju.
3. Proizvodnja i ispitivanje lekova za gensku terapiju predstavljaju specifična pitanja u pogledu bezbednosti i kvaliteta gotovog proizvoda, kao i sigurnosti za primaoce i osoblje. Treba da se primeni pristup zasnovan na riziku za operatera, životnu sredinu i bezbednost pacijenata, kao i sprovođenje kontrole na osnovu klase biološkog rizika/biohazarda. Treba da se primene nacionalne ili međunarodne zakonske sigurnosne mere.
4. Tok kretanja osoblja (uključujući i osoblje kontrole kvaliteta i tehničko osoblje) i materijala, uključujući i onih za skladištenje i kontrolu kvaliteta (npr. polaznih materijala, uzoraka procesne kontrole, gotovih proizvoda i uzoraka za monitoring ambijentalnih uslova), treba da se kontroliše u skladu sa principima upravljanja rizikom kvaliteta i kad god je moguće da se primenjuje tok kretanja u jednom smeru. Ovaj princip treba da se uzme u obzir u slučaju toka kretanja između prostora koji sadrže različite genetski modifikovane organizme i prostora koji sadrže organizme koji nisu genetski modifikovani.
5. Prilikom dizajna prostora i opreme treba da se uzme u obzir potreba za posebnim metodama čišćenja i dekontaminacije koje su neophodne za mikroorganizme kojima se rukuje. Kada je moguće program monitoringa ambijentalnih uslova treba da uključi metode za detekciju prisustva specifičnih organizama koji se obrađuju.
6. Kada se koristi replikacija ograničenih vektora treba da se primene mere za sprečavanje uvođenja divljih virusa, što može da dovede do formiranja replikacije kompetentnih rekombinantnih vektora.
7. Treba da se ustanovi plan za hitno postupanje u situacijama slučajnog oslobađanja živih organizama. Ovim planom treba da budu obuhvaćene metode i procedure izolacije, zaštita operatera, čišćenje, dekontaminacija i sigurno vraćanje u upotrebu. Takođe, treba da se izvrši i procena uticaja na okolne i druge proizvode u toj zoni.
8. Prostori za proizvodnju virusnih vektora treba da budu odvojeni od drugih primenom specifičnih mera. Efektivnost mera odvajanja treba da bude dokazana. Kad god je moguće treba da se koriste zatvoreni sistemi, prilikom uzorkovanja, dodavanja i prenosa uzoraka kako bi se sprečilo oslobađanje virusnog materijala.
9. Nije prihvatljivo da se u istom prostoru vrši istovremena proizvodnja različitih virusnih vektora za gensku terapiju. Istovremena proizvodnja nevirusnih vektora u istom prostoru treba da se kontroliše u skladu sa principima upravljanja rizikom kvaliteta. Treba da se dokaže efektivnost promene procedura između proizvodnih kampanja.
10. Treba da postoji dovoljno detaljan opis proizvodnje vektora i genetski modifikovanih ćelija kako bi se obezbedila sledljivost proizvoda od polaznih materijala (plazmidi, geni od interesa i regulatorne sekvence, banke ćelija i zalihe virusnih i nevirusnih vektora) do gotovog proizvoda.
11. Isporuka proizvoda koji sadrže ili se sastoje od genetski modifikovanih organizama treba da se prilagodi zahtevima odgovarajuće regulative.
12. Za ex vivo transfer gena do ćelije primaoca treba da se uzme u obzir sledeće:
Treba da se obavlja u objektima namenjenim za te aktivnosti u kojima su obezbeđene odgovarajuće mere izolacije;
a) Neophodno je preduzimanje mera za smanjenje potencijalne unakrsne kontaminacije i zamene ćelija različitih pacijenata, a koje pored mera navedenih u odeljku 10 Dela A, uključuju i validirane procedure čišćenja. Kod istovremene upotrebe različitih virusnih vektora primenjuju se kontrolne mere zasnovane na principima upravljanja rizikom kvaliteta. Neki virusni vektori (npr. Retro-virusi ili Lenti-virusi) ne treba da se koriste za proizvodnju genetski modifikovanih ćelija osim ako je dokazano da ne sadrže kontaminirajuće vektore koji su sposobni za replikaciju;
b) Sledljivost mora da se održava. Serija treba da bude jasno definisana od izvora ćelije do pakovanja gotovog proizvoda;
c) Za proizvode koji koriste nebiološka sredstva za prenos gena treba da se dokumentuju i ispitaju njihove fizičko-hemijske osobine.
B10: Proizvodi za somatsku i ksenogensku ćelijsku terapiju i proizvodi dobijeni inžinjeringom tkiva
U tački 2.2, IV Dela Aneksa I direktive 2001/83/EC data je definicija lekova za terapiju somatskim ćelijama (SCT), a definicija lekova dobijenih inženjeringom tkiva je data u članu 2 (1) (b) Uredbe (EC) 1394/2007 Evropskog parlamenta i Saveta, od 13. novembra 2007, o lekovima za naprednu terapiju kojim su dopunjene Direktiva 2001/83/EC i Uredba (EC) 726/2004. Za proizvode na bazi genetski modifikovanih organizama koji nisu klasifikovani kao proizvodi za gensku terapiju (GT), primenljivi su neki elementi iz odeljka B9 ove smernice.
1. kada su dostupni odobreni izvori (lekovi za koje je izdata dozvola ili medicinska sredstva sa CE znakom), dodatne supstance (kao što su proizvodi ćelija, bio-molekuli, biomaterijali, nosači (scaffold) i matriksi treba da se koriste za proizvodnju ovih proizvoda.
2. Kada su kao deo proizvoda ugrađena medicinska sredstva, uključujući i ona izrađena za određenog pacijenta:
a) treba da postoji pisani ugovor između proizvođača leka i proizvođača medicinskog sredstva, koji sadrži dovoljno informacija o medicinskom sredstvu, kako bi se izbegla promena njegovih svojstava tokom proizvodnje lekova za napredne terapije (ATMPs). Treba da budu dostupne informacije o zahtevima kontrole izmene koje su predložene za medicinsko sredstvo;
b) Ugovor treba da sadrži zahtev za razmenu informacija o neusaglašenostima u proizvodnji medicinskog sredstva.
3. Kako se somatske ćelije dobijaju od ljudi (autologne ili alogene) ili životinja (ksenogenske), postoji potencijalni rizik od kontaminacije slučajnim neželjenim agensima. Posebna pažnja mora da se obrati na segregaciju autolognih materijala dobijenih od inficiranih donora. Potrebno je obezbediti opsežne kontrolne mere i testiranja koje su uspostavljene za ovaj izvor materijala.
4. U slučaju kada sterilizaciju gotovog proizvoda nije moguće izvršiti korišćenjem standardnih metoda kao što je sterilna filtracija, proizvodnja treba da se obavlja u aseptičnim uslovima.
5. Treba da se obrati pažnja na posebne zahteve za sve faze kriokonzerviranja, npr. brzina promene temperature tokom zamrzavanja ili odmrzavanja. Vrsta komore za skladištenje/čuvanje, postupak postavljanja i vraćanja, treba da budu takvi da se minimizira rizik od unakrsne kontaminacije, da se održi kvalitet proizvoda i da se olakša njihovo precizno pronalaženje. Treba da se uspostave dokumentovane procedure za bezbedno rukovanje i čuvanje proizvoda sa pozitivnim serološkim markerima.
6. Test sterilnosti treba da se izvodi na ćelijskim kulturama ili bankama ćelija koje su bez antibiotika kako bi se obezbedio dokaz odsustva bakterijske ili gljivične kontaminacije i razmotrilo otkrivanje posebnih organizama na koje treba obratiti pažnju.
7. Kada je to relevantno, treba da se uspostavi program praćenja stabilnosti, i obezbedi dovoljna količina referentnih i rezervnih uzoraka potrebnih za dalje ispitivanje.
U tekstu Aneksa 2 upotrebljeni su izrazi koji zahtevaju dalja objašnjenja. Za definicije koje već postoje u propisima ili drugim izvorima izvršena su upućivanja na njih. U tom smislu, primenjuju se značenja reči smernice dobre proizvođačke prakse, osim ukoliko nije drugačije naznačeno.
A uvans: Hemijska ili biološka supstanca koja pojačava imuni odgovor na antigen.
Aktivna supstanca: Videti član 1.(3a) Direktive 2001/83/EC.
Alergoid: Alergeni koji su hemijski modifikovani tako da umanjuju aktivnost IgE.
Antigeni: Supstance (npr. toksini, strani proteini, bakterije, ćelije tkiva) sposobne da izazovu specifičan imuni odgovor.
Antitelo: Proteini koje proizvode B limfociti i koji su vezani za specifične antigene. Antitela mogu da se podele na dva glavna tipa na osnovu ključnih razlika u načinu proizvodnje.
Banka ćelija: skup odgovarajućih kontejnera, čiji je sadržaj jednakog sastava, koji se čuvaju pod definisanim uslovima. Svaki kontejner je alikvot jednog ćelijskog pula.
Bez specifičnih patogena (SPF): Životinjski materijali (npr. pilići, embrioni ili ćelijske kulture) koji se koriste za proizvodnju ili kontrolu kvaliteta bioloških lekova koji se dobijaju iz grupa (npr. jata, stada) životinja bez specifičnih patogena. Takva jata ili stada su definisani kao životinje koje dele zajedničko okruženje i imaju svoje negovatelje koji nemaju kontakte sa grupama koje nisu SPF.
Biološki lek: Videti 3. stav tačke 3.2.1.1.b. Dela I Aneksa 1. Direktive 2001/83/EC.
Vektor: prenosnik genetskih podataka od jedne ćelije ili organizma na drugi, npr. plazmidi, lipozomi, virusi.
Virusni vektor: vektor koji se dobija iz virusa i koji je modifikovan molekularnom biološkom metodom na način da zadrži neke, ali ne sve, roditeljske virusne gene; Ukoliko se uklone geni odgovorni za virusnu replikaciju vektor je nesposoban za replikaciju.
Višenamenski pogon: Pogon za proizvodnju, bilo u istovremenom ili kampanjskom režimu, različitih bioloških medicinskih supstanci ili lekova u kojoj oprema može ili ne mora biti namenjena specifičnoj supstanci ili proizvodu.
Gen: sekvenca DNK koja kodira jedan ili više proteina.
Genetski modifikovani organizam (GMO). Videti član 2(2) Direktive 2001/18/EC.
Genski transfer: Proces prenosa gena u ćelije, uključujući sistem ekspresije koji je sadržan u sistemu isporuke poznat kao vektor. Vektor može da bude virusnog ili nevirusnog porekla. Posle genskog transfera, genetski modifikovane ćelije se nazivaju "transdukovane ćelije".
Glavna banka ćelija (MCB): alikvot jednog ćelijskog pula koji se obično priprema od odabranog klona ćelija pod određenim uslovima, podeljen na više kontejnera i koji se čuva pod definisanim uslovima. MCB se koristi za dobijanje svih radnih banki ćelija.
Glavna transgena banka - kao napred navedeno, ali za transgene biljke ili životinje.
Glavni izvor semena virusa - MVS - kao napred navedeno, ali u vezi sa virusima.
Ekscipijens: Videti član 1(3b) Direktive 2001/83/EC.
Ex-vivo: Kada se procedure sprovode na tkivima ili ćelijama izvan živog organizma i vraćaju u živi organizam.
Zatvoreni sistem. Kada supstanca ili proizvod nije izložen uticaju neposredne okoline za vreme proizvodnje.
Zoonoze: Bolesti životinja koje se mogu preneti na ljude.
In-vivo. Postupci koji se sprovode u živim organizmima.
Kampanjska proizvodnja: Proizvodnja niza serija istog proizvoda uzastopno u okviru određenog vremenskog perioda uz strogo pridržavanje propisanih mera kontrole pre prelaska na drugi proizvod. Proizvodi se ne proizvode u isto vreme, ali mogu da se proizvode na istoj opremi.
Međuproizvod: Videti značenje u rečniku smernice dobre proizvođačke prakse, Drugi deo.
Monoklonska antitela (Mab) - populacija homogenih antitela koja se dobija iz jednog klona limfocita ili rekombinantnom tehnologijom i koja se vezuje za pojedinačni epitop.
Monosepsa (aksenic): pojedinačni organizam iz kulture koji nije kontaminiran drugim organizmima.
Namerno oslobađanje: Videti član 2(3) Direktive 2001/18/EC kojom se ukida Direktive Saveta 90/220/EEC od 12. marta 2001. godine, o namernom oslobađanju u okolinu genetski modifikovanih organizama.
Nivo biološke bezbednosti (biosafety level - BSL): ispunjenje određenih uslova koji se zahtevaju za bezbedno rukovanje mikroorganizmima različitih hazardnih nivoa od BSL1 (najniži stepen rizika za izazivanje oboljenja kod ljudi) do BSL4 (najviši stepen rizika za izazivanje ozbiljnih oboljenja kod ljudi, sa mogućim i verovatnim širenjem i bez dostupne efektivne profilakse i lečenja).
Nosač (scaffold): nosač, posrednik za isporuku ili matriks, koji može da obezbedi strukturu ili omogući migraciju, vezivanje ili transport ćelija i/ili bioaktivnih molekula.
Ograničena upotreba: Videti član 2(c) Direktive 2009/41/EC za sve genetski modifikovane organizme.
Odgovorna osoba (RP) Osoba imenovana u skladu sa članom 17. Direktive 2004/23/EC-
Plazmid: deo DNK, obično prisutan u bakterijskoj ćeliji kao cirkularni deo, odvojen od ćelijskog hromozoma; on može da bude izmenjen molekularnim biološkim metodama, prečišćen od bakterijske ćelije i upotrebljen za prenos DNK u drugu ćeliju.
Polazni materijal: Videti stav 4. tačke 3.2.1.1.b. Dela I Aneksa 1 Direktive 2001/83/EC.
Poliklonska antitela - dobijaju se iz jednog broja limfocitnih klonova koji su ljudskog ili životinjskog porekla kao odgovor na epitope većine "stranih" molekula.
Polazni materijal: Videti odeljak 1. i 2. tačke 3.2.1.1. Dela 1 Aneksa 1 Direktive 2001/83/EC.
Procedura sledljivosti (look-back): dokumentovana procedura kojom se istražuje negativan uticaj upotrebe materijala humanog ili životinjskog porekla u proizvodnji biološkog leka, koji nije ispunio zahteve za odobrenje zbog prisustva kontaminirajućih agenasa ili kada uzroci zabrinutosti postaju očigledni na izvornoj životinji ili čoveku.
Prostor: Posebne prostorije u okviru objekta u kome se obavlja proizvodnja jednog ili više proizvoda, a koje imaju zajednički uređaj za filtraciju vazduha.
Prethodno biološko opterećenje (bioburden): Stepen i vrsta neželjenih mikroorganizama prisutnih u polaznim materijalima, podlozi, biološkim supstancama, međuproizvodima ili proizvodima. Bioburden se smatra kontaminacijom kada stepen i/ili vrsta prekoračuju specifikacije.
Radna banka ćelija (WCB) - homogeni skup mikroorganizama ili ćelija, koji je ujednačeno podeljen u više kontejnera dobijen iz glavne banke ćelija i koji se čuva tako da se obezbedi stabilnost i za upotrebu u proizvodnji. Radni izvor virusa (working virus seed - WVS) - kao napred navedeno, ali u vezi sa virusima, radna transgenska banka - kao napred navedeno, ali za transgene biljke ili životinje.
Somatske ćelije: ćelije, izuzev reproduktivnih ćelija, od kojih se sastoji telo čoveka ili životinje. Ove ćelije mogu biti autologne (od pacijenta), alogene (od drugog ljudskog organizma) ili ksenogene (od životinja) somatske žive ćelije koje su obrađene ili izmenjene ex vivo, da bi se primenile na ljudima u cilju terapijskog, dijagnostičkog ili preventivnog delovanja
Transgeni: organizam koji sadrži strani gen u svom normalnom genetskom sastavu za ekspresiju biološkog farmaceutskog materijala.
Ćelijski stock (cell stock): primarne ćelije proširene na određen broj ćelija kako bi bile alikvot i upotrebljene kao polazni materijal za proizvodnju ograničenog broja serija leka na bazi ćelija.
Hraniteljske ćelije: Ćelije koje se koriste u ko-kulturama za održavanje pluripotentnih matičnih ćelija. Za ljudske embrionalne matične ćelijske kulture, tipični hraniteljski slojevi uključuju mišije embrionske fibroblaste (MEFs) ili humane embrionske fibroblaste koji se prethodno tretiraju da bi se sprečila njihova deoba.
Hapten: Molekul niske molekulske mase koji sam po sebi nije antigenski, sve dok se ne konjuguje sa molekulom "nosačem".
Hibridom: beskonačno živeća ćelijska linija koja stvara željena (monoklonska) antitela i koja se tipično dobijaju fuzijom B limfocita sa tumorskim ćelijama.
PROIZVODNJA RADIOFARMACEUTSKIH LEKOVA
Proizvodnja radiofarmaceutika treba da se obavlja u skladu sa principima datim u Prvom i Drugom delu Smernica Dobre proizvođačke prakse. Ovaj aneks se posebno odnosi na neke principe koji su specifični za radiofarmaceutike.
Napomena i. ovaj aneks se ne odnosi na pripremu radiofarmaceutika koja se, u bolnicama ili apotekama, vrši upotrebom generatora ili kitova za koje je izdata dozvola za stavljanje u promet ili odobrenje nacionalnog nadležnog organa, osim ako to nije zahtev nacionalnih propisa.
Napomena ii. prema propisima za zaštitu od jonizujućih zračenja potrebno je obezbediti da svako medicinsko izlaganje jonizujućem zračenju bude pod kliničkom odgovornošću lekara - specijaliste nuklearne medicine. Medicinsko izlaganje u dijagnostičkoj i terapijskoj nuklearnoj medicini obavlja se uz obavezno učešće stručnjaka iz oblasti fizike primenjene u medicini.
Napomena iii. ovaj aneks se odnosi i na radiofarmaceutike namenjene za kliničko ispitivanje.
Napomena iv. transport radiofarmaceutika je regulisan važećim propisima za zaštitu od jonizujućeg zračenja.
Napomena v. osim metoda koje su opisane u ovom aneksu, poznato je da postoje i druge prihvatljive metode pomoću kojih je moguće dostizanje principa obezbeđenja kvaliteta. Te druge metode treba da budu validirane i da omogućavaju dostizanje nivoa obezbeđenja kvaliteta koji je bar ekvivalentan nivou koji je propisan ovim aneksom.
1. Proizvodnja i rukovanje radiofarmaceuticima je potencijalno opasno. Nivo rizika naročito zavisi od aktivnosti izvora jonizujućeg zračenja, vrste i energije emitovanog zračenja i vremena poluraspada radioizotopa. Posebna pažnja mora da se obrati na sprečavanje unakrsne kontaminacije, zadržavanje radionuklidnih kontaminanata i odlaganje otpada.
2. Neki radiofarmaceutici se, zbog kratkog vremena poluraspada njihovih radionuklida, stavljaju u promet i pre završetka nekih od propisanih ispitivanja kontrole kvaliteta. U tom slučaju je veoma važno da celokupna procedura puštanja radiofarmaceutika u promet bude precizno i veoma detaljno opisana, uključujući i odgovornosti osoblja koje je uključeno u ovu proceduru Pri tome je veoma važna i kontinuirana procena efektivnosti sistema obezbeđenja kvaliteta.
3. Ovaj aneks se primenjuje na industrijsku proizvodnju radiofarmaceutika, kao i na proizvodnju i kontrolu kvaliteta u nuklearnim centrima/institutima i PET centrima, i to sledećih proizvoda:
- radiofarmaceutskih lekova,
- radiofarmaceutskih lekova za pozitronsku emisionu tomografiju (PET),
- radioaktivnih prekursora za proizvodnju radiofarmaceutika,
- radionuklidnih generatora.
vrsta proizvodnje |
bez GMP21 zahteva |
I i II deo GMP i odgovarajući aneksi |
|||
radiofarmaceutski lekovi PET- radiofarmaceutski lekovi radioaktivni prekursori |
proizvodnja u reaktoru/ciklotronu |
hemijska sinteza |
prečišćavanje |
izrada, formulacija deljenje/raspodela |
aseptičan postupak ili završna, odnosno terminalna sterilizacija |
radionuklidni generatori |
proizvodnja u reaktoru/ciklotronu |
proizvodnja |
|||
_______
21 Meta i prenosni sistem
od ciklotrona do mesta sinteze radiofarmaceutika može se smatrati kao prvi
korak proizvodnje aktivne supstance
4. Proizvođač radiofarmaceutika treba da opiše i potvrdi koje faze proizvodnje aktivne supstance i radiofarmaceutskog leka su usaglašene sa kojim zahtevima Smernice Dobre proizvođačke prakse (Prvog i Drugog dela).
5. Priprema radiofarmaceutika podrazumeva usaglašenost sa propisima za zaštitu od zračenja.
6. Radiofarmaceutici koji se primenjuju parenteralno treba da odgovaraju zahtevima sterilnosti za parenteralne lekove i, kada je to relevantno, uslovima aseptičnog postupka proizvodnje sterilnih lekova, kako je opisano u Aneksu 1 Smernice Dobre proizvođačke prakse.
7. Specifikacije i procedure kontrole kvaliteta koje se primenjuju za radiofarmaceutike date su u Evropskoj farmakopeji ili u dozvoli za stavljanje leka u promet.
Klinička ispitivanja
8. Proizvodnja radiofarmaceutika namenjenih za klinička ispitivanja treba da bude u skladu sa Aneksom 13 Smernice Dobre proizvođačke prakse.
9. Obezbeđenje kvaliteta je posebno značajno u slučaju proizvodnje radiofarmaceutika zbog njihovih specifičnih karakteristika, malih količina i činjenice da ih u nekim slučajevima treba primeniti i pre završetka nekih ispitivanja Kontrole kvaliteta.
10. Kao i drugi lekovi, radiofarmaceutici moraju da se zaštite od kontaminacije i unakrsne kontaminacije. Međutim, moraju da se sprovode propisane mere zaštite od jonizujućih zračenja radi zaštite života i zdravlja profesionalno izloženih lica kao i zaštite životne sredine od štetnog dejstva jonizujućih zračenja. Iz navedenog se može zaključiti da je uloga efektivnog sistema obezbeđenja kvaliteta od presudnog značaja.
11. Važno je da se podaci dobijeni tokom monitoringa proizvodnih prostorija i procesa obavezno zapisuju i procenjuju u okviru procedure puštanja serije leka u promet.
12. Principi kvalifikacije i validacije treba da se primenjuju na proizvodnju radiofarmaceutika, a pristup procene rizika koji se koristi za određivanje obima kvalifikacije/validacije, treba da obuhvati i Dobru proizvođačku praksu i zaštitu od jonizujućeg zračenja.
13. Za obavljanje svih operacija proizvodnje odgovorno je osoblje koje je dodatno kompetentno i za zaštitu od jonizujućeg zračenja. Osoblje uključeno u procese proizvodnje, kontrole kvaliteta i puštanja serije radiofarmaceutika u promet treba da ima i odgovarajuću obuku za aspekte sistema upravljanja kvalitetom koji su specifični za radiofarmaceutike. QP treba da ima sveukupnu odgovornost za puštanje serije radiofarmaceutika u promet.
14. Svi zaposleni (uključujući i zaposlene zadužene za čišćenje i održavanje) u prostorima u kojima se proizvode radioaktivni proizvodi treba da prođu dodatnu obuku specifičnu za ovu vrstu proizvoda.
15. U slučaju kada se proizvodne prostorije koriste i za obavljanje istraživačke delatnosti, osoblje koje obavlja istraživačku delatnost mora da bude obučeno u pogledu zahteva dobre proizvođačke prakse, a Obezbeđenje kvaliteta mora da pregleda i odobri istraživačke aktivnosti kako bi obezbedilo da one ne predstavljaju nikakav rizik za proizvodnju radiofarmaceutika.
Opšte
16. Radioaktivni proizvodi treba da se proizvode u prostoru koji je kontrolisan (u pogledu ambijentalnih uslova i radioaktivnosti). Svi proizvodni koraci treba da se obavljaju u izolovanom pogonu namenjenom za proizvodnju radiofarmaceutika.
17. Treba da se definišu i implementiraju mere za sprečavanje unakrsne kontaminacije od strane osoblja, materijala, radionuklida i dr. Kad god je to moguće treba da se koriste zatvoreni sistemi ili izolovana oprema. Kada se koristi otvorena oprema ili kada se oprema otvara, treba da se preduzmu mere opreza radi minimizacije rizika od kontaminacije. U cilju dokazivanja da klasa čistoće prostora odgovara vrsti radiofarmaceutika koji se proizvodi, treba da se izvrši procena rizika.
18. Pristup proizvodnim prostorijama treba da se ograniči na ovlašćeno osoblje i da se obezbedi ulazak kroz prostorije za presvlačenje.
19. Za radna mesta i njihovo okruženje treba da se obezbedi monitoring radioaktivnosti, monitoring čestica i mikrobiološke čistoće, kako je to utvrđeno tokom kvalifikacije performansi (PQ).
20. Program preventivnog održavanja, kalibracije i kvalifikacije treba da se sprovodi tako da su celokupan proizvodni prostor i oprema koji se koriste za proizvodnju radiofarmaceutika, odgovarajući i kvalifikovani. Ove aktivnosti treba da obavlja kvalifikovano osoblje i da vodi zapise i dnevnike rada opreme.
21. Potrebno je da se preduzimaju mere za sprečavanje radioaktivne kontaminacije u okviru pogona. Treba da se uspostave adekvatne kontrole za detekciju i najmanje radioaktivne kontaminacije, bilo direktno pomoću detektora radijacije, ili indirektno tehnikom briseva.
22. Delovi proizvodne opreme koji dolaze u kontakt sa proizvodom ne treba da budu reaktivni, aditivni ili absorptivni do granice koja može da utiče na kvalitet proizvoda.
23. Treba da se izbegava recirkulacija vazduha koji se odvodi iz prostora u kojima se rukuje sa radioaktivnim proizvodima, osim ako je to opravdano. Odvodi za vazduh treba da budu projektovani tako da se izbegne moguća kontaminacija prostora radioaktivnim česticama i gasovima, kao i da se preduzmu odgovarajuće mere za zaštitu kontrolisanog prostora od čestične i mikrobiološke kontaminacije.
24. U cilju zadržavanja radioaktivnih čestica, može biti neophodno da vazdušni pritisak u prostorijama u kojima su radiofarmaceutski proizvodi smešteni bude niži nego u prostorima u okruženju. Međutim, važan zahtev je i da se proizvodi zaštitite od kontaminacije iz okruženja. Ovo može da se postigne, na primer, upotrebom tehnologije propusnika, koji služe kao vazdušne barijere.
Sterilna proizvodnja
25. Sterilni radiofarmaceutici se proizvode ili aseptičnim postupkom ili postupkom završne, odnosno terminalne sterilizacije. U zavisnosti od vrste sterilne proizvodnje, u proizvodnim prostorima treba da se održava odgovarajuća klasa čistoće vazduha. Proizvodni prostori za sterilne radiofarmaceutike, u kojima se lekovi ili pakovni materijal mogu naći izloženi uticaju okruženja, treba da odgovaraju klasifikaciji prostora, propisanoj u Aneksu 1 Smernice (Proizvodnja sterilnih medicinskih proizvoda).
26. Potrebno je izvršiti procenu rizika da bi se odredila razlika pritisaka, model protoka vazduha i čistoća vazduha koji su odgovarajući za proizvodnju radiofarmaceutika.
27. Kada se koriste zatvoreni i automatizovani sistemi (hemijska sinteza, prečišćavanje, "on-line" sterilna filtracija), odgovarajući je prostor klase C ("vruća ćelija"). Vruće ćelije treba da zadovoljavaju visok stepen čistoće vazduha, sa filtracijom vazduha koji se ubacuje u zatvorene vruće ćelije. Aseptični postupci proizvodnje moraju da se obavljaju u prostoru klase A.
28. Pre početka procesa proizvodnje, sklapanje sterilisanih delova opreme i pribora (povezivanje creva, sterilisanih filtera i sterilnih zatvorenih i zapečaćenih bočica u zatvoren sistem) mora da se obavlja pod aseptičnim uslovima
29. Sva dokumentacija u vezi sa proizvodnjom radiofarmaceutika treba da bude pripremljena, pregledana, odobrena i izdata u skladu sa pisanim procedurama.
30. Treba da se uspostave i dokumentuju specifikacije za polazne supstance, materijale za pakovanje, štampani pakovni materijal, kritične međuproizvode i gotove proizvode. Takođe, treba da postoje i specifikacije za sve druge kritične materijale koji se koriste u procesu proizvodnje, kao što su pomoćni pribor za proizvodnju, zaptivci, sterilni kompleti za filtraciju, koji mogu da imaju kritičan uticaj na kvalitet.
31. Treba da se uspostave kriterijumi prihvatljivosti za gotove proizvode, uključujući kriterijume u specifikaciji za puštanje serije u promet i kriterijume u specifikaciji u toku roka upotrebe (npr: radionuklidna čistoća, radiohemijska čistoća, radioaktivna koncentracija, hemijska čistoća i specifična aktivnost).
32. Zapisi o upotrebi, čišćenju, sanitizaciji, sterilizaciji i održavanju glavne opreme, treba, kada je to od značaja, da sadrže podatke o nazivu radiofarmaceutika i broju serije, kao i datum i vreme obavljanja aktivnosti i potpise izvršilaca koji su uključeni u ove aktivnosti.
33. Zapisi treba da se čuvaju najmanje tri godine, osim ako se drugačije nije propisano.
34. Proizvodnja različitih radioaktivnih proizvoda ne treba da se obavlja istovremeno ili uzastopno u istom prostoru (npr. vruće ćelije, laminarne komore) kako bi se minimizirao rizik od radioaktivne unakrsne kontaminacije ili zamene.
35. Posebna pažnja treba da se obrati na validacije, uključujući i validaciju kompjuterizovanih sistema koja treba da se sprovodi prema zahtevima Aneksa 11 Smernice Dobre proizvođačke prakse. Za nove proizvodne procese treba da se uradi prospektivna validacija.
36. Kritični parametri po pravilu treba da se utvrde pre ili tokom validacije, kao i da se definiše opseg tih parametara neophodan za ponovljivost operacija.
37. Test integriteta membranskih filtera treba da se vrši kod aseptičnog postupka punjenja proizvoda, vodeći računa o potrebnoj zaštiti od jonizujućeg zračenja i održavanju sterilnosti filtera.
38. Zbog zaštite od izlaganja jonizujućem zračenju, prihvatljivo je da se veći deo kontaktne ambalaže obeležava pre početka proizvodnog procesa. Sterilne prazne zatvorene bočice mogu delimično da se obeleže pre procesa punjenja tako da ovaj postupak ne ugrožava sterilnost, niti otežava vizuelnu kontrolu napunjenih bočica.
39. Neki radiofarmaceutici mogu da budu isporučeni i upotrebljeni na bazi procene dokumentacije pre završetka nekih od hemijskih i mikrobioloških ispitivanja kvaliteta.
Puštanje u promet serije radiofarmaceutika može da se izvrši u dve ili više faza, pre ili posle završetka kompletnih ispitivanja:
a) Odgovorna osoba, na osnovu procene dokumentacije o proizvodnji serije radiofarmaceutika kojom su obuhvaćeni uslovi proizvodnje i ispitivanja koja su do tada završena, dozvoljava distribuciju radiofarmaceutika u statusu karantina do nuklearno-medicinskih centara;
b) Kvalifikovano lice (QP), pre izdavanja sertifikata za puštanje serije leka u promet, procenjuje konačne rezultate ispitivanja, pod uslovom da su sva odstupanja dokumentovana, opravdana i propisno odobrena. U slučaju kada rezultati nekih ispitivanja nisu dostupni pre primene proizvoda, Kvalifikovano lice (QP) može uslovno da pusti u promet seriju radiofarmaceutika, a kada se kompletiraju rezultati svih ispitivanja, izdaje konačno zvanično pisano odobrenje/sertifikat za puštanje serije leka.
40. Većina radiofarmaceutika se upotrebljava u kratkom vremenskom periodu. Zbog kratkog vremena poluraspada, rok upotrebe mora da se jasno naznači.
41. Radiofarmaceutici koji sadrže radionuklide sa dugim vremenom poluraspada, treba da se ispitaju kako bi se dokazalo da zadovoljavaju sve kriterijume prihvatljivosti pre puštanja serije u promet od strane Kvalifikovanog lica (QP).
42. Pre započinjanja nekih ispitivanja uzorci mogu da se čuvaju kako bi se omogućio dovoljan broj radioaktivnih raspada. Sva ispitivanja, uključujući i test sterilnosti treba da se izvrše što pre.
43. Treba da postoji pisana standardna operativna procedura (SOP) kojom se propisuju svi podaci o proizvodnji i ispitivanju kvaliteta, koji treba da se razmotre pre nego što se serija leka isporuči.
44. Proizvodi koji ne ispunjavaju zahteve kvaliteta treba da se odbiju. Ako se materijal ponovo koristi (reprocesira), to treba da se radi u skladu sa prethodno odobrenom procedurom, a gotov proizvod treba da ispuni kriterijume prihvatljivosti pre puštanja u promet. Proizvodi vraćeni iz prometa ne smeju da se ponovo koriste i moraju da se odlažu kao radioaktivan otpad.
45. Takođe, treba da postoji procedura koja propisuje mere koje treba da preduzme Kvalifikovano lice za puštanje serije leka u promet (QP) u slučaju dobijanja nezadovoljavajućih rezultata ispitivanja (rezultata van specifikacije - OOS) nakon isporuke leka a pre isteka roka njegove upotrebe. U ovakvim slučajevima treba da se sprovede istraga i da se preduzmu odgovarajuće korektivne i preventivne kako bi se sprečilo ponavljanje ovakvih slučajeva u budućnosti. Ovaj postupak mora da se dokumentuje.
46. Ako je potrebno, informacije se dostavljaju odgovornom zdravstvenom radniku. Da bi se to olakšalo, neophodno je da se implementira sistem sledljivosti za radiofarmaceutike.
47. Treba da se uspostavi sistem za proveru kvaliteta polaznog materijala. Odobravanje dobavljača treba da obuhvati procenu koja obezbeđuje odgovarajuće dokaze da materijal dosledno ispunjava zahteve specifikacije. Polazni i pakovni materijali, kao i kritični materijali koji se koriste u procesu proizvodnje treba da se nabavljaju od odobrenih dobavljača.
48. Ako nije drugačije opravdano na osnovu upravljanja rizikom, treba da se čuva dovoljna količina uzoraka svake serije radiofarmaceutika, i to najmanje šest meseci nakon isteka roka upotrebe leka.
49. Uzorci polaznih materijala, osim rastvarača, gasova i vode koji se koriste u proizvodnji, treba da se čuvaju najmanje dve godine nakon puštanja serije radiofarmaceutika u promet. Taj period može da bude kraći za one materijale koji nisu stabilni, a što se navodi u odgovarajućim specifikacijama.
50. Za polazne supstance i radiofarmaceutike koji se proizvode pojedinačno ili u malim količinama ili kada njihovo čuvanje može da prouzrokuje posebne teškoće, proizvođač može u dogovoru sa nadležnim organom da utvrdi drugačije uslove uzorkovanja i čuvanja.
51. Za radiofarmaceutike je prihvatljiva distribucija gotovih proizvoda pod kontrolisanim uslovima i pre nego što su dostupni svi rezultati ispitivanja kvaliteta, ako se obezbedi da njihova primena u bolnicama ne započne pre nego što se dobiju odgovarajući rezultati svih ispitivanja i procenu tih rezultata izvrši za to odgovorna osoba.
10. Rečnik
Vruće ćelije: zatvoreno, zaštićeno radno mesto (boks) za proizvodnju i rukovanje radioaktivnim materijalom. Vruće ćelije ne moraju da budu dizajnirane kao izolatori.
Kvalifikovano lice za puštanje serije leka u promet: QP kako je to definisano u Direktivi 2001/83/EC i 2001/82/EC. Odgovornosti QP opisane su u Aneksu 16 Smernice dobre proizvođačke prakse.
Priprema: rukovanje i radioobeležavanje kitova radionuklidima eluiranim iz generatora ili radioaktvnim prekursorima u bolnici. Kitovi, radionuklidi i prekursori treba da poseduju dozvolu za stavljanje u promet ili odobrenje nacionalnih nadležnih organa.
Proizvodnja: proces proizvodnje od aktivne supstance i polaznih materijala, kontrola kvaliteta, puštanje serije leka u promet i isporuka radiofarmaceutika.
PROIZVODNJA VETERINARSKIH LEKOVA KOJI NE SPADAJU U IMUNOLOŠKE VETERINARSKE LEKOVE
Napomena:
Ovaj aneks se odnosi na sve veterinarske lekove koji ne spadaju u imunološke veterinarske lekove, koji su obuhvaćeni Aneksom 5 (domen Direktive 2001/82/EC).
Proizvodnja predsmeša (premiksa) za mediciniranu hranu za životinje
U ovom aneksu koriste se sledeći izrazi:
Medicinirana hrana za životinje je bilo koja mešavina veterinarskog leka i hrane, namenjena za stavljanje u promet, a koristi se, bez dalje dorade, za ishranu životinja zbog svojih terapijskih ili preventivnih svojstava ili drugih lekovitih svojstava kao medicinski proizvod na osnovu člana 1(2) Direktive 2001/82EC.
Predsmeša (premiks) je bilo koji veterinarski lek pripremljen unapred za proizvodnju medicinirane hrane za životinje.
1. Proizvodnja predsmeša za mediciniranu hranu za životinje (premiksa) zahteva upotrebu velikih količina polaznih supstanci biljnog porekla koje privlače insekte i glodare. Objekti moraju da budu projektovani, opremljeni i funkcionalno osposobljeni tako da svode na minimum rizik od zagađenja (videti 3.4 iz osnovnih zahteva Smernice Dobre proizvođačke prakse) i da se redovno kontrolišu na prisustvo glodara i insekata.
2. Zbog velike količine prašine koja se stvara u toku proizvodnje predsmeša za mediciniranu hranu za životinje (premiksa), posebnu pažnju neophodno je posvetiti potrebi da se izbegne unakrsna kontaminacija i da se olakša čišćenje (videti 3.14 iz osnovnih zahteva Smernice Dobre proizvođačke prakse), npr. instalacijom zatvorenih sistema transporta i otprašivanjem kad god je to moguće. Instaliranje ovih sistema ne isključuje obavezu redovnog čišćenja proizvodnih prostora.
3. Delovi proizvodnog procesa koji mogu imati značajan neželjeni uticaj na stabilnost aktivnih supstanci (npr. upotreba pare u proizvodnji peleta) moraju da se izvode na ujednačen način od serije do serije.
4. Proizvodnja predsmeša za mediciniranu hranu za životinje (premiksa) sprovodi se u za to namenskim prostorijama koje, ako je to moguće, ne predstavljaju deo glavnog proizvodnog prostora fabrike. Alternativno rešenje je da se takvi proizvodni prostori odvoje tampon zonom kako bi se smanjio rizik kontaminacije drugih proizvodnih prostora.
Proizvodnja ektoantiparazitskih lekova
5. Suprotno tački 3.6. osnovnih zahteva Smernice Dobre proizvođačke prakse, ektoantiparazitici za spoljnu upotrebu na životinjama, a koji spadaju u veterinarske lekove i predmet su izdavanja dozvole za stavljanje u promet, mogu se proizvoditi i puniti kampanjski u posebnim prostorijama za pesticide. Druge kategorije veterinarskih lekova, ne smeju se proizvoditi u ovim prostorima.
6. Potrebno je primeniti odgovarajuće i validirane metode čišćenja kako bi se sprečila unakrsna kontaminacija. Neophodno je preduzeti mere za primenu bezbednog skladištenja veterinarskih lekova u skladu sa Smernicom Dobre proizvođačke prakse.
Proizvodnja veterinarskih lekova koji sadrže peniciline
7. Upotreba penicilina u veterinarskoj medicini ne podrazumeva isti rizik od pojave hipersenzitivnosti kod životinja kao kod ljudi. Iako su zabeleženi slučajevi preosetljivosti kod konja i pasa, postoje supstance koje su toksične za pojedine životinjske vrste, kao što je npr. slučaj sa jonofornim antibioticima kod konja. Iako je poželjno da se ovi lekovi proizvode u namenskim, odvojenim prostorima (videti 3.6. iz osnovnih zahteva Smernice Dobra proizvođačka praksa), proizvođači se mogu osloboditi ove obaveze samo ako se radi o prostorima namenjenim isključivo za proizvodnju veterinarskih lekova. Potrebno je u skladu sa Smernicom dobre proizvođačke prakse preduzeti sve neophodne mere kako bi se izbegla unakrsna kontaminacija i bilo kakav rizik za bezbednost operatera. Proizvodi koji sadrže penicilin moraju da se proizvode kampanjski, što mora da bude praćeno odgovarajućim validiranim postupcima dekontaminacije i čišćenja.
(videti 1.4 viii i 6.14 iz osnovnih zahteva Smernice Dobre proizvođačke prakse)
8. Zbog velikog volumena pakovanja nekih veterinarskih lekova, posebno kada su u pitanju predsmeše za mediciniranu hranu za životinje (premiksi), proizvođačima nije izvodljivo da čuvaju kontrolne uzorke svake serije leka u finalnom pakovanju. Proizvođači moraju obezbediti da se dovoljan broj reprezentativnih uzoraka svake serije leka čuva i skladišti u skladu sa Smernicom dobre proizvođačke prakse.
9. U svim slučajevima, kontejner koji se koristi za čuvanje i skladištenje mora da bude napravljen od istog materijala kao unutrašnje pakovanje u kome se veterinarski lek pušta u promet.
Sterilni lekovi za upotrebu u veterinarskoj medicini
10. Kada su nadležni organi saglasni, veterinarski lekovi sa završnom, odnosno terminalnom sterilizacijom mogu se proizvoditi u čistom prostoru sa nižim stepenom čistoće vazduha od stepena propisanog u Aneksu 1, koji govori o sterilnim proizvodima, ali ne manjim od stepena čistoće klase D.
PROIZVODNJA IMUNOLOŠKIH LEKOVA ZA UPOTREBU U VETERINARSKOJ MEDICINI
Proizvodnja veterinarskih imunoloških lekova ima posebne karakteristike i one se moraju uzeti u obzir pri proceni i primeni sistema obezbeđenja kvaliteta.
Zbog velikog broja životinjskih vrsta i patogenih agenasa, veliki je broj lekova koji se proizvode, a obim proizvodnje je često mali. Iz ovih razloga, često se proizvodnja obavlja u kampanjama. Zbog prirode ove proizvodnje (faze kultivacije, nedostatak završne, odnosno terminalne sterilizacije, itd.), proizvodi se moraju posebno dobro zaštititi od kontaminacije i unakrsne kontaminacije. Proizvodni prostor se mora posebno zaštititi, kada proizvodnja uključuje upotrebu patogenih i/ili visokoinfektivnih agenasa. Operateri moraju biti posebno dobro zaštićeni, kada proizvodnja uključuje upotrebu bioloških agenasa posebno patogenih za čoveka.
Navedeni činioci, veliki broj različitih imunoloških proizvoda i relativna neefektivnost metoda ispitivanja kvaliteta gotovog proizvoda, ukazuju na to da je sistem obezbeđenja kvaliteta od najveće važnosti. Od velikog značaja je da se primene osnovni zahtevi smernice dobre proizvođačke prakse, kao i uputstva iz ovog aneksa. Posebno je važno da se vrši rigorozna procena svih podataka dobijenih praćenjem neophodnih parametara na osnovu primene različitih aspekata smernice dobre proizvođačke prakse (oprema, proizvodni i drugi prostori, kvalitet proizvoda itd.) i da se vode zapisi o svim odlukama i sprovedenim aktivnostima na osnovu procene tih podataka.
1. Zaposleni (uključujući i zadužene za čišćenje i održavanje) u prostorijama za proizvodnju imunoloških lekova moraju da prođu obuku iz higijene i mikrobiologije. Pored ove opšte obuke, treba da prođu i dodatnu specifičnu obuku, u zavisnosti od vrste proizvoda na čijoj proizvodnji rade.
2. Odgovorna osoba za proizvodnju i Kvalifikovano lice za puštanje serije u promet treba da budu lica sa završenim fakultetima: veterinarske medicine, farmacije, biologije, hemije, medicine, sa dodatnom obukom iz oblasti bakteriologije, biometrije, imunologije, parazitologije, farmakologije, virusologije, kao i sa odgovarajućim znanjem o merama zaštite sredine.
3. Zaposleni moraju biti zaštićeni od moguće infekcije biološkim agensima u proizvodnji. Kada su u pitanju biološki agensi za koje je poznato da izazivaju bolesti kod ljudi, potrebno je preduzeti odgovarajuće posebne mere opreza, da bi se sprečila infekcija osoblja koje radi sa agensom ili sa eksperimentalnim životinjama. Kada je to potrebno, osoblje treba da se podvrgne vakcinaciji i medicinskim pregledima.
4. Potrebno je preduzeti odgovarajuće mere da se spreči iznošenje bioloških agenasa izvan proizvodnog prostora (pogona). U zavisnosti od vrste biološkog agensa, takve mere mogu podrazumevati potpunu promenu odeće i obavezno tuširanje pre napuštanja proizvodnog prostora.
5. Rizik od kontaminacije ili unakrsne kontaminacije do koje može doći putem osoblja je posebno važan za imunološke proizvode.
Prevencija kontaminacije nastale od osoblja treba da se postigne uvođenjem operativnih postupaka i mera kojima se obezbeđuje upotreba zaštitne odeće u toku različitih postupaka proizvodnog procesa.
Prevencija unakrsne kontaminacije, nastale od osoblja uključenog u proizvodnju mora da se postigne sprovođenjem operativnih postupaka i odgovarajućih mera, kojima se obezbeđuje da oni ne prelaze iz jednog proizvodnog prostora u drugi, ukoliko nisu preduzeli odgovarajuće mere kojima se eliminiše rizik od kontaminacije. U toku radnog dana osoblje ne treba da prelazi iz prostora iz kojih je moguća kontaminacija živim mikroorganizmima ili u kojima se drže životinje, u prostore u kojima se rukuje sa drugim proizvodima ili mikroorganizmima. Ako je takav prelazak neizbežan, potrebno je da se osoblje uključeno u takvu proizvodnju pridržava jasno definisanih operativnih postupaka dekontaminacije, uključujući promenu odeće i obuće, a kad je potrebno i tuširanje.
Osoblje koje ulazi u zatvorenu prostoriju, u kojoj se mikroorganizmi nisu nalazili u otvorenim sistemima u prethodnih dvanaest časova, radi provere kulture u zatvorenim kontejnerima sa dekontaminiranom površinom, ne smatra se rizičnim u pogledu kontaminacije, ukoliko se ne radi o visokoinfektivnim mikroorganizmima.
6. Prostorije moraju da su projektovane tako da se izbegne rizik za proizvod i za sredinu.
Ovo se može postići upotrebom izolovanih prostora, čistih prostora (tzv. čistih soba), čistih/izolovanih ili kontrolisanih prostora.
7. Živi biološki agensi moraju se čuvati u izolovanim prostorima. Nivo izolovanosti sistema zavisi od patogenosti mikroorganizma, kao i od toga da li je klasifikovan u grupu visokoinfektivnih mikroorganizama. Moraju se primeniti i drugi referentni propisi (direktive 90/219/EEC i 90/220/EEC).
8. Sa inaktiviranim biološkim agensima mora da se rukuje u čistim sobama. Čisti prostori moraju da se koriste i kada se rukuje sa nezaraženim ćelijama izolovanim iz višećelijskih organizama.
9. Otvoreni proizvodni postupci u kojima se koriste proizvodi ili komponente koji se kasnije ne sterilišu, moraju se izvoditi u radnim prostorima sa laminarnim protokom vazduha (stepena čistoće vazduha klase A) u okruženju sredine čistoće vazduha klase B.
10. Ostale aktivnosti, prilikom kojih se rukuje sa živim biološkim agensima (ispitivanje kvaliteta proizvoda, istraživački i dijagnostički postupci), moraju biti propisno izolovane i izdvojene, ako se proizvodni postupci sprovode u istom objektu. Nivo izolacije bi u tom slučaju zavisio od patogenosti biološkog agensa, kao i od toga da li taj agens pripada grupi visokoinfektivnih mikroorganizama. Prilikom sprovođenja dijagnostičkih aktivnosti uvek postoji opasnost od unošenja patogenih organizama. Iz tog razloga, nivo izolacije mora da bude prikladan stepenu rizika. Izolacija se može zahtevati i kada se ispitivanje kvaliteta i druge aktivnosti izvode u objektima koji su u neposrednoj blizini proizvodnog prostora (pogona).
11. U prostorijama za izolaciju mora da postoji mogućnost jednostavnog postupka dezinfekcije, i one moraju imati sledeće karakteristike:
a) ne smeju imati direktan odvod u spoljašnju sredinu;
b) ventilaciju vazduhom pod negativnim pritiskom. Odvod vazduha mora da bude preko HEPA filtera i ne sme biti ponovo pušten u cirkulaciju, osim u istom prostoru i samo pod uslovom da se i dalje koristi HEPA filtracija (ovaj uslov se može svakako ispuniti propuštanjem takvog vazduha preko HEPA filtera za određeni prostor). Međutim, recirkulacija vazduha između dva prostora je dozvoljena isključivo ako se vazduh propušta kroz dva izduvna HEPA filtera, od kojih se prvi stalno nadzire u smislu njegove ispravnosti. Ako se integritet tog filtera naruši, neophodno je primeniti odgovarajuće mere za bezbednu zamenu;
c) vazduh iz proizvodnih prostora, koji se koristi u postupcima sa visokoinfektivnim mikroorganizmima, mora se ispuštati kroz dva kompleta HEPA filtera u nizu i ne sme se ponovo puštati u cirkulaciju;
d) mora postojati sistem za sakupljanje i dezinfekciju otpadnih tečnosti, uključujući i kontaminirane produkte kondenzacije iz sterilizatora, bioreaktora itd. Čvrst otpad, u koji spada otpad životinjskog porekla, mora biti ispravno dezinfikovan, sterilisan ili spaljen. Kontaminirani filteri moraju se ukloniti na bezbedan način;
e) svlačionice moraju biti opremljene tuševima i uređajima za pranje ruku. Vazdušni nadpritisak mora biti takav da je onemogućen protok vazduha između proizvodnog prostora i spoljašnje sredine ili da ne postoji opasnost kontaminacije odeće koja se nosi izvan radnog prostora;
f) mora postojati sistem za prenos opreme, koji je projektovan tako da ne postoji mogućnost protoka kontaminiranog vazduha između radnog prostora i spoljašnje sredine ili opasnost od kontaminacije opreme unutar samog propusnika. Dimenzije propusnika treba da su takve da onemogućavaju kontaminaciju materijala koji se kroz njega prenose. Na ulazu propusnika treba da postoji uređaj za merenje vremena kojim se utvrđuje dovoljno vreme potrebno za efikasnu dekontaminaciju;
g) u mnogim slučajevima potreban je autoklav sa dvostrukim pregradnim vratima radi bezbednog uklanjanja otpadnih materijala i delova opreme koja mora da se steriliše.
12. Propusnici za opremu i svlačionice treba da su opremljeni mehanizmom međusobnog blokiranja ili nekim drugim odgovarajućim sistemom, pomoću kojih se sprečava otvaranje više od jednih vrata istovremeno. U svlačionicama, vazduh mora da bude prečišćen po istom standardu kao u radnom prostoru, kako bi u njima cirkulacija vazduha bila identična uslovima u radnom prostoru. Propusnici za opremu moraju da se ventiliraju na isti način, ali je dozvoljena i mogućnost da budu bez ventilacije ili da je samo obezbeđen dovod vazduha.
13. Proizvodni postupci, kao što su održavanje ćelija, priprema podloga, virusna kultura, koji izazivaju kontaminaciju, moraju da se izvode u posebnim odvojenim prostorima. Kada se u proizvodnji koriste životinje i životinjski produkti, potrebno je preduzeti odgovarajuće mere predostrožnosti.
14. Proizvodni prostori u kojima se vrše postupci sa biološkim agensima posebno otpornim na dezinfekciju (npr. bakterije koje formiraju spore), moraju biti odvojeni za tu posebnu namenu, sve dok god biološki agens ne bude inaktiviran.
15. Unutar jednog prostora može se vršiti postupak samo sa jednim biološkim agensom, osim kada se radi o operacijama mešanja i punjenja.
16. Proizvodni prostori moraju biti projektovani tako da omogućavaju dezinfekciju između kampanja pomoću propisanih metoda.
17. Proizvodnja bioloških agenasa može se obavljati u kontrolisanim prostorima, u potpuno zatvorenom sistemu koji je sterilisan toplotom, kao i da su svi spojevi pojedinačnih delova opreme koji čine taj zatvoren sistem, sterilisani nakon povezivanja i pre rasklapanja. Prihvatljivo je da se povezivanje pojedinačnih delova opreme vrši pod nekoliko laminara, pod uslovom da su korišćene propisane aseptične tehnike i da ne postoji opasnost od propuštanja. Parametri sterilizacije korišćeni pre rasklapanja zatvorenog sistema opreme, moraju biti validirani u odnosu na organizme koji se koriste u proizvodnji. Različiti proizvodi mogu biti postavljeni u različite bioreaktore unutar istog prostora, ako nema opasnosti od nehotične unakrsne kontaminacije. Mikroorganizmi koji podležu posebnim uslovima za izolaciju, moraju biti smešteni u posebnim prostorima namenjenim za takve proizvode.
18. Odeljenja za životinje u kojima su smeštene životinje namenjene za proizvodnju moraju da budu odvojena od drugih odeljenja, a neophodno je da se u njima primenjuje odgovarajuća izolacija i posebne mere predostrožnosti.
19. Pristup proizvodnim prostorima mora da bude dozvoljen samo ovlašćenom osoblju. Mora da bude istaknuto jasno i pregledno pisano uputstvo.
20. Dokumentacija koja se odnosi na prostorije mora uvek da bude dostupna i predstavljena u Glavnoj dokumentaciji mesta proizvodnje (SMF). Mesto proizvodnje, odnosno prostorni kapaciteti objekta moraju biti detaljno opisani (planovi, skice i pisana objašnjenja), tako da namena i uslovi upotrebe svih prostora objekta mogu tačno da se identifikuju, kao i biološki agensi sa kojima se rukuje u određenom prostoru. Tok kretanja ljudi pri različitim proizvodnim postupcima, mora biti jasno naznačen.
Životinjske vrste smeštene u odeljenjima za životinje ili bilo gde drugde na određenom mestu proizvodnje, moraju biti identifikovane.
Moraju se naznačiti sve proizvodne aktivnosti koje se sprovode u neposrednom okruženju objekta (mesta proizvodnje).
U planovima čistih prostora (čiste sobe) mora biti opisan ventilacioni sistem sa naznačenim ulazima i izlazima, detalji o filterima i njihove specifikacije, brojem izmena vazduha po času i gradijentima pritiska. Naznačeni gradijenti pritiska se proveravaju indikatorom nadpritiska.
21. Oprema koja se koristi mora da bude osmišljena i projektovana tako da odgovara posebnim uslovima proizvodnje za svaki proizvod. Pre nego što se pusti u rutinski rad, oprema mora da bude kvalifikovana i validirana, a zatim se mora redovno održavati i proveravati.
22. Kada je potrebno, oprema mora da obezbedi zadovoljavajuću primarnu izolaciju bioloških agenasa. Oprema mora da bude osmišljena i konstruisana tako da omogući laku i efikasnu dekontaminaciju i sterilizaciju.
23. Zatvoreni sistem koja se koristi za primarnu izolaciju bioloških agensa, mora da bude osmišljen i konstruisan tako da spreči svako propuštanje ili stvaranje kapljica i aerosola. Dovodi i odvodi za gasove moraju da budu zaštićeni, kako bi se postiglo odgovarajuće zadržavanje, na primer, upotrebom filtera za sterilizaciju, koji su osetljivi na vodu. Dodavanje ili uklanjanje materijala treba da se odvija pomoću zatvorenog sistema koji se može podvrgnuti sterilizaciji ili u odgovarajućem laminarnom protoku vazduha.
24. Oprema mora da bude pravilno sterilisana pre upotrebe, najbolje metodom sterilizacije parom pod pritiskom. Ostali načini su prihvatljivi, ako se metoda sterilizacije parom ne može primeniti zbog vrste opreme. Ne treba prevideti ni pojedinačne delove opreme, kao što su laboratorijske centrifuge ili vodena kupatila. Oprema koja se koristi za prečišćavanje, razdvajanje ili koncentrovanje, mora da se steriliše ili dezinfikuje između upotrebe za različite proizvodnje. Treba da se prati uticaj metode sterilizacije na efektivnost i ispravnost opreme, kako bi se odredio,"životni vek" opreme.
Svi sterilizacioni procesi moraju biti validirani.
25. Oprema mora da bude projektovana tako da se spreči bilo kakvo mešanje različitih mikroorganizama ili proizvoda. Cevi, ventili i filteri moraju da budu identifikovani prema njihovoj funkciji i nameni. Za inficirane i neinficirane kontejnere, kao i za različite mikroorganizme ili ćelije, moraju da se koriste odvojeni inkubatori. Inkubatori koji sadrže više od jednog mikroorganizma ili tipa ćelije, mogu se prihvatiti samo u slučaju kada su preduzeti odgovarajući koraci da se kontejneri zapečate, dekontaminiraju po površini ili odvoje jedni od drugih. Posude u kojima se čuvaju kulture moraju da budu pojedinačno obeležene. Čišćenju i dezinfekciji delova opreme mora da se posveti posebna pažnju.
Oprema za čuvanje bioloških agensa i proizvoda treba da bude osmišljena i korišćena tako da spreči svako međusobno mešanje. Svi uskladišteni proizvodi i uzorci moraju da budu jasno i nedvosmisleno obeleženi u nepropusnim kontejnerima. Banke ćelija i zalihe sojeva mikroorganizama, moraju se čuvati u specijalnoj opremi namenjenoj za tu svrhu.
26. Neophodna oprema, kao na primer, oprema ili instrumenti koji zahtevaju kontrolisani opseg temperature, moraju biti snabdeveni alarmnim uređajem i uređajem za beleženje podataka. Da bi se izbegli kvarovi, potrebno je primenjivati sistem preventivnog održavanja i analizu zabeleženih podataka.
27. Punjenje liofilizatora mora se obavljati u čistom ili posebno kontrolisanom prostoru. Pražnjenje liofilizatora može kontaminirati neposrednu okolinu. Zato je neophodno da se čista prostorija i liofilizator dekontaminiraju pre unošenja naredne serije u proizvodni prostor, ako ta serija ne sadrži iste mikroorganizme. Neophodno je da se prolazni liofilizatori sterilišu posle svakog ciklusa, ukoliko se ne otvaraju u čistom prostoru. Sterilizacija liofilizatora mora se vršiti u skladu sa tačkom 24. ovog aneksa. U slučaju kampanjske proizvodnje, liofilizatori moraju da se sterilišu najmanje posle svake kampanje.
Životinje i odeljenja za životinje
28. Opšta uputstva o uslovima za odeljenja za životinje, negu životinja i karantin postavljena su u Direktivi 86/609/EEC.
29. Odeljenja za životinje moraju biti odvojena od ostalih proizvodnih prostorija i odgovarajuće projektovana.
30. Zdravstveno stanje životinja koje se koriste u proizvodnji mora da se definiše, nadgleda i redovno beleži. Sa određenim životinjskim vrstama mora se postupati prema uputstvima određenim u posebnim propisima (npr. SPF).
31. Životinje namenjene za proizvodnju, biološki agensi i ispitivanja koja se sprovode na životinjama, moraju da budu predmet jednog sistema identifikacije, kojim bi se sprečila svaka greška i obezbedila kontrola rizika od svih potencijalnih opasnosti.
Dezinfekcija - uklanjanje otpada
32. Dezinfekcija i/ili uklanjanje otpada i otpadnih voda su od posebnog značaja za proizvodnju imunoloških proizvoda. Zato je potrebno posvetiti posebnu pažnju proizvodnim postupcima i opremi, kojima se sprečava kontaminacija okoline, odnosno neophodno je sprovesti njihovu kvalifikaciju i validaciju.
33. Zbog velikog broja različitih imunoloških proizvoda, velikog broja različitih faza u proizvodnim postupcima pri proizvodnji imunoloških veterinarskih lekova i prirode bioloških procesa, posebna pažnja se mora posvetiti stalnom nadzoru proizvodnje i procesnoj kontroli. Neophodno je pridržavati se validiranih operativnih postupaka. Posebno se mora voditi računa o polaznim supstancama, pakovnom materijalu, dobavljačima i upotrebi sistema zasejane serije.
34. Pogodnost za upotrebu polaznih supstanci mora da bude jasno definisana u pisanim specifikacijama. Specifikacijom moraju biti obuhvaćene pojedinosti o dobavljaču i načinu proizvodnje, geografskom poreklu i životinjskim vrstama od kojih su polazne supstance proizvedene. Specifikacijom moraju biti obuhvaćene i metode ispitivanja kvaliteta, koje će se primeniti na polazne supstance. Od posebnog značaja su mikrobiološka ispitivanja.
35. Rezultati ispitivanja polaznih supstanci moraju pokazati usaglašenost sa uslovima iz specifikacije. Ponekad je neophodno započeti proizvodnju sa polaznim supstancama i pre nego što su rezultati ispitivanja kvaliteta gotovi, kada proces ispitivanja zahteva duži vremenski period. U takvim slučajevima, puštanje gotovog proizvoda u promet uslovljeno je prethodno dobijenim zadovoljavajućim rezultatima ispitivanja kvaliteta polaznih supstanci.
36. Prilikom procene usaglašenosti polaznih supstanci sa specifikacijom, odnosno porekla i neophodnog obima ispitivanja kvaliteta polaznih supstanci, neophodno je dobro se upoznati sa sistemom Obezbeđenja kvaliteta dobavljača.
37. Najpoželjniji metod sterilizacije polaznih supstanci je sterilizacija toplotom, ako je izvodljiva. Ako je neophodno, mogu se upotrebiti i druge validirane metode sterilizacije, kao što je sterilizacija zračenjem.
Podloge
38. Podloge za željeni razvoj kultura, moraju da budu na pravi način validirane.
39. Podloge moraju da budu sterilisane. Najpoželjnija je metoda sterilizacije toplotom. Gasovi, podloge, kiseline, baze, agensi protiv stvaranja pene i druge supstance koje se unose u sterilne bioreaktore, moraju biti prethodno sterilisani.
Sistem izvora semena i sistem banke ćelija
40. Proizvodnja imunoloških veterinarskih lekova koji se dobijaju iz mikrobioloških kultura, ćelijskih kultura i kultura tkiva, mora biti zasnovana na sistemu glavnih i radnih izvora semena ili banaka ćelija.
41. Broj generacija (udvostručenja i sl.) između izvora semena ili banke ćelija i gotovog proizvoda mora da je u saglasnosti sa uslovima iz dozvole za stavljanje u promet.
42. Neophodno je da izvori semena i banke ćelija budu obeleženi i odgovarajuće testirani. Za svaki nov izvor semena potrebno je ustanoviti kriterijume prihvatljivosti. Izvori semena i banke ćelija moraju biti pripremljeni, čuvani i korišćeni na takav način da se u najvećoj mogućoj meri umanji rizik od kontaminacije. Tokom pripremanja izvora semena i banke ćelija, niko ne sme istovremeno da rukuje sa drugim živim ili infektivnim materijalima (npr. virusima) u istom proizvodnom prostoru.
43. Osnivanje izvora semena i banke ćelija mora se sprovoditi u odgovarajuće kontrolisanoj sredini kako bi se izvora semena i banke ćelija zaštitile, kao i osoblje koje rukuje njima, a takođe i spoljašnja sredina.
44. Poreklo i oblik zasejanog materijala, kao i uslovi njegovog skladištenja, moraju u potpunosti biti identifikovani i potvrđeni. Dokaz o stabilnosti i regeneraciji semena i ćelija mora biti evidentiran u dokumentaciji. Kontejneri u kojima se čuvaju zasejane kulture moraju biti hermetički zatvoreni, jasno obeleženi i uskladišteni na odgovarajućoj temperaturi. Uslovi skladištenja se moraju stalno proveravati. Neophodno je da se vodi zapis o svakom kontejneru u odgovarajućoj dokumentaciji.
45. Samo ovlašćenom osoblju je dozvoljeno da rukuje sa polaznim materijalom i to pod nadzorom odgovorne osobe. Različiti izvori semena ili banke ćelija moraju da se čuvaju na takav način da se izbegne greška ili unakrsna kontaminacija. Neophodno je da se izvori semena i banke ćelija razdvoje i da se delovi serija čuvaju na različitim mestima, kako bi se umanjio rizik od potpunog gubitka soja ili banke ćelija.
46. Tokom proizvodnog procesa potrebno je izbeći stvaranje aerosolnih kapljica i pene ili ih svesti na najmanju moguću meru. Postupci centrifugiranja i mešanja koji mogu izazvati formiranje kapljica, treba da se izvode u odgovarajućim zatvorenim prostorima ili čistim sobama da bi se sprečio prenos živih mikroorganizama.
47. Prenos polaznog materijala, naročito živih mikroorganizama, mora se obaviti brzo i bezbedno. Za svaki mikroorganizam moraju biti ustanovljene validirane metode dekontaminacije. Kada su u postupku uključeni različiti sojevi jedne iste vrste bakterija ili veoma slični virusi, postupak mora da se podvrgne validaciji za samo jednu od bakterija ili virusa, ukoliko ne postoje drugi valjani razlozi da se tako ne postupi.
48. Postupci prilikom kojih se vrši prenos polaznih materijala, kao što su sterilne podloge, kulture ili proizvodi, mora da se sprovode u zatvorenim prethodno sterilisanim sistemima, kad god je to moguće. Kada je to neizvodljivo, postupci prenosa moraju se odvijati pri laminarnom protoku vazduha.
49. Dodavanje podloga i kultura u bioreaktore i druge posude, mora da se izvodi u strogo kontrolisanim uslovima kako bi se onemogućila kontaminacija. Mora se voditi računa da sudovi budu ispravno povezani tokom dodavanja kultura.
50. Ako je neophodno, na primer da se dva ili više fermentora nalazi u istom prostoru, tada mesto uzimanja uzoraka i mesto za dodavanje drugih materijala, kao i mesta povezivanja (posle povezivanja, pre potoka materijala i ponovo pre razdvajanja) moraju biti sterilisani parom. U drugim okolnostima je prihvatljiva hemijska dezinfekcija konekcija pod laminarom.
51. Oprema, staklene posude, kontejneri i drugi slični materijali moraju se dezinfikovati pre prenosa iz prostorija u druge prostore na način koji je validiran (videti tačku 47). Zapisi koji se vode u toku proizvodnje mogu da predstavljaju poseban problem. Samo apsolutni minimum dokumentacije, koji se zahteva prema standardima smernice dobre proizvođačke prakse, može se uneti ili izneti iz radne prostorije. Ako je izvesno da su papirni dokumenti kontaminirani aerosolima ili je po njima prisutna neka infektivna supstanca koja sadrži visokoinfektivne mikroorganizme, onda je neophodno da se takva dokumentacija adekvatno dezinfikuje ili se podaci prenesu u drugi prostor kao fotokopija ili putem faksa.
52. Tečne ili čvrste otpade, kao što je otpad od zasejanih sojeva, posude za kulture, neželjene kulture i biološke agense, najbolje je sterilisati ili dezinfikovati pre iznošenja iz zatvorenih prostora. U nekim slučajevima mogu poslužiti i alternativne metode uklanjanja otpada, na primer, zapečaćeni kontejneri ili sistem posebnih cevovoda.
53. Materijali, uključujući i dokumentaciju, koji se unose u proizvodni prostor, moraju se pažljivo kontrolisati, jer je dozvoljeno unositi samo obrasce i materijale koji se odnose na proizvodnju. Treba da se ustanovi sistem kojim se omogućava da se pisani materijal, koji se iznosi iz proizvodnog prostora, zamenjuje novim i tako se spreči njegovo nagomilavanje.
54. Materijali stabilni na povišenoj temperaturi, koji se unose u čistu sobu ili čisti/ograničeni prostor, moraju da prođu kroz autoklav ili sterilizator sa dvoja vrata. Pisani materijali koji nisu stabilni na povišenoj temperaturi, treba da se dezinfikuju prolaskom kroz vazdušni propusnik na čijim vratima je instaliran sistem međusobnog blokiranja. U svim drugim slučajevima, sterilizacija pisanih dokumenata je prihvatljiva, pod uslovom da su propušteni kroz vazdušni propusnik uz odgovarajuće mere predostrožnosti.
55. Tokom inkubacije moraju se preduzeti mere predostrožnosti kako bi se izbegla kontaminacija ili greške. Za inkubatore mora da postoji procedura čišćenja i dezinfekcije. Kontejneri u inkubatorima moraju da budu jasno obeleženi.
56. Unutar proizvodnog prostora, u bilo koje vreme, može se vršiti postupak sa samo jednim živim biološkim agensom, osim za postupke mešanja i naknadnog punjenja (ili kada se koristi potpuno zatvoreni sistem). Proizvodni prostori moraju biti efikasno dezinfikovani između postupaka sa različitim biološkim agensima.
57. Proizvode treba inaktivirati dodavanjem nekog inaktivatora, a zatim sledi proces pobuđivanja. Mešavinu tada treba prebaciti u drugu sterilnu posudu, ako kontejner nije takvih dimenzija i oblika da se sve unutrašnje površine prevuku gotovom mešavinom kulture i inaktivatora.
58. Posude koje sadrže inaktivirani proizvod ne smeju se otvarati ili uzorkovati u prostorima sa živim biološkim agensima. Svaka naknadna prerada inaktiviranih proizvoda mora se odvijati u čistim prostorima klase A-B ili u zatvorenoj opremi posebno namenjenoj za inaktivirane proizvode.
59. Posebna pažnja mora da se obrati na validaciju metoda sterilizacije, dezinfekcije, uklanjanje virusa i inaktivacije.
60. Punjenje treba da se sprovodi odmah nakon proizvodnje. Kontejneri za poluproizvod, pre punjenja treba da su zapečaćeni, odgovarajuće obeleženi i uskladišteni u tačno navedenim temperaturnim uslovima.
61. Mora da postoji sistem kojim se obezbeđuje ispravnost i zatvaranje kontejnera posle punjenja.
62. Postupak zatvaranja staklenih kontejnera (stavljanja poklopaca na bočice) u kojima se nalaze živi biološki agensi, mora da se izvede tako da onemogući kontaminaciju drugih proizvoda, drugih prostorija i prostora ili spoljašnje sredine.
63. Zbog različitih razloga može doći do vremenskog odlaganja između postupka punjenja kontejnera sa gotovim proizvodima i postupka pakovanja i obeležavanja. Zato je neophodno da se ustanovi odgovarajući operativni postupak za skladištenje kontejnera pre postupka obeležavanja, kako bi se sprečila greška i obezbedili zadovoljavajući uslovi skladištenja. Naročita pažnja mora da se posveti skladištenju proizvoda koji su osetljivi na toplotu i svetlost. Veoma je važno da se utvrdi adekvatna temperatura skladištenja za svaki proizvod.
64. U svim fazama proizvodnje, stvarni prinos proizvoda treba da bude usaglašen sa teorijskim prinosom. Svako značajnije odstupanje moralo bi da se istraži.
65. Procesna kontrola ima veoma važnu ulogu u obezbeđenju postojanosti kvaliteta bioloških lekova. Ona ispitivanja kvaliteta koja su vrlo bitna za kvalitet (npr. uklanjanje virusa), ali ih je nemoguće sprovesti na gotovom proizvodu, moraju da se izvedu u toku odgovarajućeg postupka proizvodnje.
66. Moraju se čuvati kontrolni uzorci međuproizvoda u dovoljnim količinama i pod odgovarajućim uslovima skladištenja, kako bi se omogućilo ponavljanje ispitivanja i potvrda kvaliteta serije.
67. Mora da postoji stalna provera podataka iz dokumentacije o seriji tokom proizvodnje, kao na primer, proveravanje fizičkih parametara tokom fermentacije.
68. Održavanje stalne kulture je uobičajena praksa i zato se mora obratiti posebna pažnja na zahteve metoda ispitivanja kvaliteta, adekvatne tom načinu proizvodnje.
PROIZVODNJA MEDICINSKIH GASOVA
Gasovi koji odgovaraju definiciji leka iz Direktive 2001/83/EC ili Direktive 2001/82/EC (u daljem tekstu: medicinski gasovi), podležu zahtevima ovih direktiva, uključujući i zahteve za proizvodnju. U tom smislu, ovaj aneks se odnosi na proizvodnju aktivnih supstanci gasova i medicinskih gasova.
Razlika između proizvodnje aktivne supstance i proizvodnje leka treba jasno da se definiše u dokumentaciji dozvole za stavljanje leka u promet. Po pravilu se koraci proizvodnje i prečišćavanja gasa smatraju proizvodnjom aktivnih supstanci. Gasovi ulaze u polje farmaceutike od prvog skladištenja gasa namenjenog za farmaceutsku upotrebu.
Proizvodnja aktivnih supstanci gasova treba da bude usaglašena sa osnovnim zahtevima smernice dobre proizvođačke prakse (Drugi deo), odgovarajućim delovima ovog aneksa, kao i sa drugim relevantnim aneksima Smernica dobre proizvođačke prakse.
Proizvodnja medicinskih gasova treba da bude usaglašena sa osnovnim zahtevima smernice dobre proizvođačke prakse (Prvi deo), odgovarajućim delovima ovog aneksa, kao i sa drugim relevantnim aneksima Smernica dobre proizvođačke prakse.
U izuzetnim slučajevima, kod kontinuiranih procesa kod kojih nema međufaznog skladištenja gasa između proizvodnje aktivne supstance i medicinskog gasa, celokupan proces (od polaznih materijala za proizvodnju aktivne supstance do gotovog proizvoda - medicinskog gasa) pripada oblasti proizvodnje lekova. Ovo treba da bude jasno navedeno u dokumentaciji dozvole za stavljanje leka u promet.
Ovaj aneks ne obuhvata proizvodnju i rukovanje medicinskim gasovima u bolnicama, osim ako se to ne smatra industrijskom pripremom ili proizvodnjom. Međutim, odgovarajući delovi ovog aneksa mogu biti osnov za takve aktivnosti.
Proizvodnja aktivne supstance za proizvodnju medicinskih gasova
Aktivne supstance za proizvodnju medicinskih gasova mogu da se dobiju hemijskom sintezom ili iz prirodnih izvora kroz nekoliko faza prečišćavanja ako je to potrebno (kao na primer u postrojenju za separaciju vazduha).
1. Procesi koji odgovaraju ovim načinima dobijanja aktivnih supstanci medicinskih gasova treba da budu usklađeni sa osnovnim zahtevima Smernice Dobre proizvođačke prakse (Drugi deo). Međutim:
(a) zahtevi u pogledu polaznih materijala, odnosno sirovina za aktivne supstance (Odeljak 7 Drugi deo Smernice) ne primenjuju se na proizvodnju aktivne supstance medicinskog gasa koja se dobija separacijom vazduha (međutim, proizvođač treba da osigura da je kvalitet polaznog vazduha pogodan za proces separacije i da nikakve promene u kvalitetu polaznog vazduha ne utiču na kvalitet aktivne supstance medicinskog gasa);
(b) zahtevi u pogledu kontinuiranog praćenja stabilnosti (Odeljak 11.5 Drugi deo smernice), koje se koristi za određivanje uslova čuvanja i roka upotrebe/datuma retestiranja (Odeljak 11.6 Drugi deo Smernice), ne primenjuju se kada su inicijalne studije stabilnosti zamenjene bibliografskim podacima (videti u smernici Note for Guidance CPMP/QWP/1719/00); i
(c) zahtevi u pogledu referentnih/rezervnih uzoraka (odeljak 11.7 Drugi deo smernice), ne primenjuju se na aktivne supstance medicinskih gasova, osim ako nije drugačije određeno.
2. Proizvodnja aktivnih supstanci medicinskih gasova kroz kontinuirani proces (npr. separacijom vazduha) treba da se kontinuirano prati u pogledu njihovog kvaliteta. Rezultati ovog monitoringa treba da se čuvaju tako da je omogućena procena trenda.
3. Osim navedenog:
(a) transport i isporuke aktivnih supstanci medicinskih gasova u bulk-u treba da budu usklađeni sa istim zahtevima kao za medicinske gasove (tačke 19. do 21. ovog aneksa);
(b) punjenje aktivnih supstanci medicinskih gasova u boce ili mobilne kriogene sudove treba da bude usklađeno sa istim zahtevima kao za medicinske gasove (tačke 22. do 37. ovog aneksa) i Odeljak 9. Drugi deo Smernice Dobre proizvođačke prakse.
Proizvodnja medicinskih gasova
Proizvodnja medicinskih gasova se uglavnom vrši u zatvorenim sistemima. Iz tog razloga je kontaminacija proizvoda minimalna. Međutim, do rizika od kontaminacije (ili unakrsne kontaminacije drugim gasovima), može da dođe naročito zbog ponavljanja upotrebe boca.
4. Zahtevi koji se odnose na boce treba da se primenjuju i na baterije boca (osim čuvanja i transporta pod krovom).
5. Svom osoblju koje učestvuje u proizvodnji i distribuciji medicinskih gasova treba da bude obezbeđena odgovarajuća obuka u oblasti dobre proizvođačke prakse za medicinske gasove. Zaposleni treba da budu svesni kritičnih mesta i potencijalnih opasnosti za pacijente od lekova u obliku medicinskog gasa. Programi obuke treba da obuhvate i vozače cisterni.
6. Zaposleni kod primaoca ugovora za poverene poslove koji mogu da utiču na kvalitet medicinskog gasa (kao što je na primer osoblje zaduženo za održavanje boca ili ventila), treba da budu odgovarajuće obučeni.
Prostorije
7. Boce i mobilni kriogeni kontejneri treba da se proveravaju, pripremaju, pune i čuvaju u prostorima odvojenim od nemedicinskih gasova i između tih prostora ne treba da bude razmene boca/mobilnih kriogenih kontejnera. Međutim, može se prihvatiti da se provera, priprema, punjenje i čuvanje drugih gasova vrši u istim prostorima, pod uslovom da njihov kvalitet odgovara specifikacijama za medicinske gasove, kao i da se procesi proizvodnje obavljaju u skladu sa zahtevima Smernica dobre proizvođačke prakse.
8. U prostorijama treba da bude dovoljno prostora za različite postupke koji se preduzimaju u proizvodnji, ispitivanju i skladištenju, kako bi se izbegao bilo kakav rizik od zamene. Prostorije treba da budu tako dizajnirane da obezbeđuju:
a) odvojene i obeležene prostore za različite gasove;
b) jasno obeležavanje i odvajanje boca i mobilnih kriogenih kontejnera u različitim fazama proizvodnje (npr. "čeka proveru", "čeka punjenje", "napunjeno", "karantin", "odobreno za promet", "odbijeno", "pripremljeno za isporuku").
Način na koji se postižu ovi različiti nivoi razdvojenosti zavisi od vrste, obima i složenosti postupaka. Prihvatljivi su obeležavanje podne zone, odeljci, rampe, pregrade i oznake ili drugi odgovarajući načini.
9. Prazne boce/kriogeni kontejneri za kućnu upotrebu nakon sortiranja i održavanja, kao i napunjene boce/kriogeni kontejneri za kućnu upotrebu treba da se čuvaju pokriveni, zaštićeni od nepovoljnih vremenskih uslova. Napunjene boce/mobilni kriogeni sudovi treba da se čuvaju na takav način koji obezbeđuje njihovu isporuku u čistom stanju, odnosno u stanju koje odgovara okruženju u kome će se koristiti.
10. Treba da se obezbede uslovi čuvanja u skladu sa zahtevima iz dozvole za stavljanje leka u promet (npr. za mešavine gasova kod kojih dolazi do fazne separacije pri zamrzavanju).
Oprema
11. Oprema treba da bude dizajnirana tako da je omogućeno da se određeni gas puni u odgovarajući kontejner. Između cevi koje sprovode različite gasove ne treba da postoji nikakva međusobna veza. Ako su međusobne veze neophodne (oprema za punjenje mešavina gasova), kvalifikacija treba da obezbedi da ne postoji rizik od unakrsne kontaminacije između različitih gasova. Osim toga, razvodnici (manifold) treba da budu opremljeni specifičnim priključcima za punjenje. Ovi priključci treba da odgovaraju nacionalnim ili međunarodnim standardima. Upotreba priključaka koji odgovaraju različitim standardima na istom mestu punjenja treba da bude pod strogom kontrolom, kao i upotreba adaptera koji su u nekim slučajevima potrebni za povezivanje (bypass) specifičnih priključaka sistema za punjenje.
12. Rezervoari za skladištenje i cisterne za isporuku treba da budu namenski za svaku vrstu i propisan kvalitet toga gasa. Međutim, medicinski gasovi se mogu čuvati ili transportovati u istim kontejnerima, drugim kontejnerima koji su korišćeni za međufazno skladištenje ili cisternama, koji su korišćeni za isti nemedicinski gas, pod uslovom da je njegov kvalitet najmanje jednak kvalitetu medicinskog gasa i da se održavaju standardi dobre proizvođačke prakse. U takvim slučajevima treba da se sprovede i dokumentuje upravljanje rizikom kvaliteta.
13. Zajednički sistem razvodnika za snabdevanje za medicinski i nemedicinski gas je prihvatljiv samo ako postoji validirana metoda za sprečavanje povratnog toka iz cevovoda nemedicinskog gasa u cevovod medicinskog gasa.
14. Razvodnici za punjenje treba da budu namenski za svaki pojedinačan medicinski gas ili određenu mešavinu gasova. U izuzetnim slučajevima, punjenje gasova koji se koriste za druge medicinske svrhe na razvodniku za medicinske gasove može da bude prihvatljivo ako je opravdano i ako se izvodi pod kontrolom. U ovim slučajevima kvalitet nemedicinskog gasa treba da bude najmanje jednak zahtevanom kvalitetu medicinskog gasa i da se održavaju standardi dobre proizvođačke prakse. U takvim slučajevima punjenje treba da se sprovodi po kampanjskom principu.
15. Postupci popravke i održavanje opreme (uključujući čišćenje i ispiranje) ne smeju negativno da utiču na kvalitet medicinskog gasa. Naročito treba da postoje procedure koje propisuju mere koje treba da se preduzmu nakon postupaka popravki i održavanja uključujući narušavanje integriteta sistema. Posebno treba dokazati da je, nakon popravke i održavanja, oprema bez bilo kakve kontaminacije koja može negativno da utiče na kvalitet gotovog proizvoda pre nego što se gas odobri za upotrebu. O navedenom treba da se vode zapisi.
16. Treba da postoji procedura koja opisuje mere koje treba preduzeti kada se cisterna za isporuku vrati u punionicu medicinskog gasa (nakon transporta nemedicinskog gasa pod uslovima navedenim u tački 12. ili nakon postupka održavanja). Ove mere treba da uključe i analitička ispitivanja.
17. Podaci u zapisima za svaku seriju boca/mobilnih kriogenih sudova moraju da obezbede sledljivost svake napunjene boce kroz sve značajne aspekte odgovarajućih postupaka punjenja. Dokumentacija treba da sadrži sledeće podatke:
(a) naziv proizvoda;
(b) broj serije;
(c) datum i vreme punjenja;
(d) potpis ili paraf operatera koji su izvršili svaku značajnu aktivnost (npr. raščišćavanje linije, prijem, provere pre punjenja, punjenje itd);
(e) referencu, odnosno upućivanje na broj serije gasa u bulk-u koji se koristi za punjenje, kako je navedeno u tački 22, uključujući njegov status;
(f) podatke o korišćenoj opremi (npr. razvodnik za punjenje);
(g) broj boca/mobilnih kriogenih kontejnera pre punjenja, uključujući i pojedinačne reference za identifikaciju i vodene kapacitete;
(h) podatke o postupcima pripreme izvršenim pre punjenja (videti tačku 20);
(i) ključne parametre potrebne za obezbeđenje pravilnog punjenja pod standardnim uslovima;
(j) rezultate odgovarajućih provera kojima se utvrđuje da su boce/mobilni kriogeni kontejneri napunjeni;
(k) uzorak etikete sa brojem serije;
(l) specifikaciju gotovog proizvoda i rezultate ispitivanja kontrole kvaliteta (uključujući reference za kalibracioni status opreme za ispitivanje);
(m) broj odbačenih boca/mobilnih kriogenih kontejnera, sa pojedinačnim referencama za identifikaciju i razlozima njihovog odbacivanja;
(n) detalje o problemima ili neuobičajenim događajima i potpis odgovorne osobe za odobravanje odstupanja od uputstva za punjenje;
(o) odluku o puštanju u promet od strane QP, sa datumom i potpisom.
18. Treba da se vode zapisi o svakoj seriji gasa koja je namenjena za isporuku u bolničke rezervoare. Ovi zapisi treba, u zavisnosti od potreba, da sadrže sledeće (podaci koji se zapisuju mogu da variraju u zavisnosti od nacionalnih propisa):
(a) naziv proizvoda;
(b) broj serije;
(c) identifikaciona oznaka za rezervoar (cisternu) u kome je serija za koju je izdat sertifikat;
(d) datum i vreme punjenja;
(e) potpis ili paraf operatera koji je izvršio punjenje rezervoara (cisterne);
(f) referencu, odnosno upućivanje na oznaku cisterne (rezervoara), odnosno na izvorni gas, kako je primenljivo;
(g) relevantne podatke o punjenju;
(h) specifikaciju gotovog proizvoda i rezultate ispitivanja kontrole kvaliteta (uključujući reference za kalibracioni status opreme za ispitivanje);
(i) detalje o problemima ili neuobičajenim događajima i potpis odgovorne osobe za odobravanje odstupanja od uputstva za punjenje; i
(j) odluku o puštanju u promet od strane QP, sa datumom i potpisom.
Prenos i isporuka kriogenog i tečnog gasa
19. Prenos kriogenih ili tečnih gasova od primarnog skladišta, uključujući kontrole pre prenosa, treba da se obavljaju u skladu sa validiranim procedurama koje su uspostavljene kako bi se izbegla mogućnost kontaminacije. Linije za prenos gasova treba da budu opremljene nepovratnim ventilima ili drugim odgovarajućim sredstvom. Fleksibilni priključci, spojnice i konektori treba da se isperu odgovarajućim gasom pre upotrebe.
20. Cevi za prenos koje se koriste za punjenje rezervoara i cisterni treba da budu opremljene konekcijama specifičnim za proizvod. Korišćenje adaptera koji omogućavaju povezivanje rezervoara i cisterni, a koji nisu namenjeni za isti gas, treba da se kontroliše na odgovarajući način.
21. Isporuke gasa mogu se dodavati u rezervoare za skladištenje koji sadrže isti definisan kvalitet gasa, pod uslovom da se uzorak isporučenog gasa ispita kako bi se osiguralo da je kvalitet isporučenog gasa prihvatljiv. Ovaj uzorak se može uzeti iz isporučenog gasa pre dodavanja isporuke; ili iz rezervoara za prijem nakon dodavanja.
Napomena: specifične zahteve za punjenje rezervoara koji zadržavaju kupci u svojim prostorijama videti u tački 42.
Punjenje i obeležavanje boca i mobilnih kriogenih kontejnera
22. Pre punjenja boca i mobilnih kriogenih kontejnera, treba da bude određena serija (serije) gasa (gasova), kontrolisana u skladu sa specifikacijama i odobrena za punjenje.
23. U slučaju kontinuiranog procesa (naveden u odeljku "Princip") treba da postoje odgovarajuće procesne kontrole kako bi se osiguralo da je gas u skladu sa specifikacijama.
24. Boce, mobilni kriogeni kontejneri i ventili treba da budu u skladu sa odgovarajućim tehničkim specifikacijama i svim relevantnim zahtevima iz dozvole za stavljanje leka u promet. Oni treba da se koriste samo za pojedinačan medicinski gas ili datu mešavinu medicinskih gasova. Svaka boca treba da bude obeležena i kodirana bojom u skladu sa odgovarajućim standardom. Kako bi se obezbedila odgovarajuća zaštita od kontaminacije, boce treba da imaju sigurnosne ventile sa nepovratnim mehanizmom za održavanje minimalnog pritiska.
25. Boce, mobilni kriogeni kontejneri i ventili treba da se provere pre prve upotrebe u proizvodnji i treba da se održavaju na odgovarajući način. Kada se upotrebljavaju medicinska sredstva sa CE znakom, održavanje treba da se vrši u skladu sa uputstvom proizvođača.
26. Postupci provere i održavanja ne smeju negativno da utiču na kvalitet i bezbednost medicinskog gasa. Voda koja se koristi za ispitivanje hidrostatičkog pritiska na bocama treba da bude najmanje kvaliteta vode za piće.
27. Kao deo postupka provere i održavanja boce treba da se podvrgnu unutrašnjoj vizuelnoj proveri pre ugradnje ventila, kako bi se osiguralo da nisu kontaminirane vodom ili drugim kontaminantima. Ova provera treba da se izvrši:
- kada su potpuno nove i prvi put se stavljaju u upotrebu za medicinske gasove;
- u vezi sa bilo kojim testiranjem na hidrostatički pritisak ili ekvivalentnom metodom, kada su ventili uklonjeni;
- uvek kada se ventili menjaju.
Nakon ugrađivanja ventil treba da se drži na poziciji "zatvoreno" kako bi se sprečio ulazak bilo kakvih kontaminanata u boce. Ako postoji sumnja u unutrašnje stanje boca, ventil treba da se ukloni i boca interno proveri kako bi se osiguralo da nije kontaminirana.
28. Za postupke održavanja i popravke boca, mobilnih kriogenih kontejnera i ventila odgovoran je proizvođač medicinskog gasa. Ako se ovi poslovi poveravaju, primaoci ugovora treba da budu odobreni i sa njima treba da budu zaključeni tehnički ugovori. Treba da se vrši provera (audit) primaoca ugovora kako bi se obezbedilo da se održavaju odgovarajući standardi.
29. Treba da postoji sistem koji obezbeđuje praćenje boca, mobilnih kriogenih kontejnera i ventila.
30. Provere pre punjenja treba da obuhvate:
(a) u slučaju boca, provera, koja se vrši u skladu sa definisanom procedurom, kojom se potvrđuje pozitivan rezidualni pritisak u svakoj boci;
- kod boca sa ugrađenim ventilom za zadržavanje minimalnog pritiska, kada signal ne ukazuje da je pozitivan rezidualan pritisak, treba proveriti funkcionisanje ventila i ako se pokaže da on ne funkcioniše ispravno, boca treba da se pošalje na popravku,
- kod boca bez ugrađenog ventila za zadržavanje minimalnog pritiska, kada nema pozitivnog rezidualnog pritiska, boce treba ostaviti sa strane radi dodatnih mera kako bi se utvrdilo da li su kontaminirane vodom ili drugim kontaminantima; dodatne mere mogu da obuhvate unutrašnju vizuelnu proveru posle koje se vrši čišćenje validiranom metodom;
(b) proveru da li su sve etikete od prethodnih serija uklonjene;
(c) proveru da li su sve oštećene etikete uklonjene i zamenjene;
(d) vizuelnu, spoljnu proveru svake boce, mobilnog kriogenog suda i ventila na mehanička oštećenja, oštećenja od električnog luka, metalne opiljke i druga oštećenja i kontaminacije uljem ili masnoćom; ako je potrebno treba izvršiti čišćenje;
(e) proveru ventilnog spoja svake boce ili kriogenog suda radi potvrđivanja da se radi o odgovarajućem tipu za namenjeni medicinski gas;
(f) proveru datuma sledećeg ispitivanja ventila (u slučaju ventila koje treba periodično ispitivati);
(g) proveru da li je za boce i mobilne kriogene sudove urađeno bilo koje ispitivanje zahtevano nacionalnim ili međunarodnim standardima (npr. hidrostatičkim pritiskom ili slično ispitivanje), kao i da su rezultati još uvek validni;
(h) proveru da je svaka boca obojena kodirana bojom koja je navedena u dozvoli za stavljanje u promet (bojenje kodiranom bojom u skladu sa odgovarajućim nacionalnim/međunarodnim standardom).
31. Za punjenje medicinskih gasova treba da bude definisana serija.
32. Boce koje su vraćene na ponovno punjenje treba da se pripreme veoma pažljivo kako bi se rizik od kontaminacije minimizirao, u skladu sa procedurama definisanim u dozvoli za stavljanje leka u promet. Ove procedure koje treba da obuhvate pražnjenje i/ili ispiranje treba da budu validirane.
Napomena: Za komprimovane gasove maksimalni teoretski nivo nečistoće iznosi 500 ppm v/v za pritisak punjenja od 200 bara na 15 °C (i ekvivalentne vrednosti za druge vrednosti pritiska punjenja).
33. Mobilni kriogeni sudovi koji su vraćeni na ponovno punjenje treba da se pripreme veoma pažljivo kako bi se rizik od kontaminacije minimizirao, u skladu sa procedurama definisanim u dozvoli za stavljanje leka u promet. Naročito treba kontejneri za transport bez rezidualnog pritiska da se pripreme validiranim metodama.
34. Potrebno je sprovesti odgovarajuće provere kako bi se potvrdilo da su boce/mobilni kriogeni kontejneri ispravno napunjeni.
35. Svaka napunjena boca pre stavljanja zaštitne folije treba da se ispita na curenje koristeći odgovarajuću metodu (videti tačku 36). Ova metoda ispitivanja ne sme da dovede do kontaminacije izlaznog ventila, i ako je to primenljivo, ispitivanje treba da se izvrši nakon svakog uzorkovanja za potrebe kontrole kvaliteta.
36. Nakon punjenja ventili na bocama treba da se zaštite od kontaminacije. Boce i mobilni kriogeni sudovi treba da budu plombirani zaštitnim žigovima koji su uočljivi.
37. Svaka boca i mobilni kriogeni sud treba da budu obeleženi. Broj serije i rok upotrebe mogu da budu navedeni na posebnoj etiketi.
38. U slučaju medicinskih gasova proizvedenih mešanjem dva ili više različitih gasova (u liniji pre punjenja ili direktno u bocama); proces mešanja treba da bude validiran kako bi se osiguralo da su gasovi ispravno izmešani u svakoj boci i da je mešavina homogena.
39. Svaka serija medicinskog gasa (boce, mobilni kriogeni kontejneri, bolnički rezervoari) treba da bude ispitana u skladu sa specifikacijom iz dozvole za stavljanje leka u promet i da poseduje odgovarajući sertifikat.
40. Ukoliko u dozvoli za stavljanje leka u promet nisu postavljeni drugačiji zahtevi, u slučaju boca plan uzorkovanja i kontrola kvaliteta koja treba da se izvrši, treba da budu u skladu sa sledećim zahtevima:
(a) U slučaju medicinskog gasa koji se puni putem višecilindričnog razvodnika, treba da se ispita identifikacija gasa iz najmanje jedne boce svakog punjenja razvodnika, kao i sadržaj gasa pri svakom menjanju boca na razvodniku;
(b) U slučaju medicinskog gasa koji se puni u bocu jedan po jedan, treba da se ispita identifikacija i sadržaj gasa iz najmanje jedne boce svakog neprekidnog ciklusa punjenja. Primer neprekidnog ciklusa punjenja je jedna proizvodna smena sa istim osobljem, opremom i jednom serijom gasa koji se puni;
(c) U slučaju medicinskog gasa koji se proizvodi mešanjem dva ili više gasova u boci iz istog razvodnika, treba da se ispita identifikacija i sadržaj svakog komponentnog gasa iz najmanje jedne boce iz svakog ciklusa punjenja iz cevovoda. Za pomoćne supstance, ako ih ima, ispitivanje identifikacije treba da se izvrši iz jedne boce po ciklusu punjenja razvodnika (ili po neprekidnom ciklusu punjenja u slučaju kada se boce pune jedna po jedna). U slučaju kada je automatizovani sistem punjenja validiran, može da se ispita manji broj boca;
(d) Kada su gasovi na liniji mešani pre punjenja, za ispitivanje treba da se primeni isti princip kao u slučaju pojedinačnih gasova, vrši se kontinuirana kontrola kvaliteta mešavine koja se puni.
U slučaju gasova koji se mešaju pre punjenja primenjuje se isti princip kao kod medicinskih gasova koji se proizvode mešanjem gasova u bocama kada nema kontinuiranog ispitivanja mešavine koja se puni.
Treba da se vrši ispitivanje sadržaja vode, osim ako drugačije nije opravdano.
Mogu da budu opravdane drugačije procedure uzorkovanja i ispitivanja kojima se postiže bar ekvivalentan nivo obezbeđenja kvaliteta.
41. Ukoliko u dozvoli za stavljanje leka u promet nisu postavljeni drugačiji zahtevi, završna kontrola kvaliteta sadržaja mobilnih kriogenih sudova podrazumeva ispitivanje identifikacije i sadržaja svakog suda. Kontrola kvaliteta po serijama može da se vrši samo ako je dokazano da su održavane kritične karakteristike gasa preostalog u svakom sudu pre punjenja.
42. Kriogeni sudovi, zadržani od strane korisnika (bolnički rezervoari ili kriogeni kontejneri za kućnu upotrebu), u koje se ponovo pune medicinski gasovi na licu mesta iz namenskih cisterni, ne moraju se nakon punjenja uzorkovati, pod uslovom da se uz isporuku dostavlja sertifikat analize uzorka uzetog iz te cisterne. Međutim, treba da se dokaže da se sadržaj sudova održava u skladu sa specifikacijom tokom uzastopnih ponovljenih punjenja.
43. Osim ako nije drugačije navedeno, čuvanje referentnih i rezervnih uzoraka nije potrebno.
44. Zahtevi u pogledu kontinuiranog praćenja stabilnosti ne primenjuju se kada su inicijalne studije stabilnosti zamenjene bibliografskim podacima (videti u smernici Note for Guidance CPMP/QWP/1719/00).
Transport napunjenih boca i kriogenih kontejnera za kućnu upotrebu
45. Napunjene boce i kriogeni kontejneri za kućnu upotrebu treba da budu zaštićeni tokom transporta, tako da se isporučuju u čistom stanju, odnosno u stanju koje odgovara okruženju u kome će se koristiti.
Aktivna supstanca gas
Bilo koji gas koji služi kao aktivna supstanca medicinskog gasa.
Baterija boca
Više boca koje su zajedno pričvršćene ramom i povezane razvodnikom, a koja se transportuje i koristi kao jedna jedinica.
Boca
Kontejner koji je po pravilu cilindričnog oblika, pogodan za komprimovani, tečni ili rastvoren gas, opremljen uređajem za regulisanje spontanog ispuštanja gasa pri atmosferskom pritisku i sobnoj temperaturi.
Ventil
Uređaj za otvaranje ili zatvaranje kontejnera.
Ventil za održavanje minimalnog pritiska
Ventil na boci, koji održava pozitivan pritisak iznad atmosferskog pritiska u boci sa gasom posle upotrebe, kako bi se sprečila kontaminacija unutrašnjosti boce.
Gas
Supstanca koja je u gasovitom stanju pri pritisku od 1,013 bara i temperaturi od +15 °C ili koja ima pritisak pare koji prelazi 3 bara na temperaturi od +50 °C.
Delimično tečni gas
Gas koji, napunjen pod pritiskom, je delimično u tečnom stanju (ili čvrstom) na temperaturi iznad -50 °C.
Ispiranje
Uklanjanje rezidualnog/zaostalog gasa iz boce/sistema, prvo povećanjem pritiska a zatim ispuštanjem gasa koji se koristi za ispiranje do pritiska od 1,013 bara.
Ispuštanje
Uklanjanje rezidualnog/zaostalog gasa iz boce/sistema do pritiska od 1,013 bara otvaranjem boce/sistema u atmosferu.
Komprimovani gas
Gas punjen pod pritiskom i koji je u gasovitom stanju na temperaturi iznad -50 °C.
Kontejner
Kontejner je kriogeni sud (rezervoar, cisterna ili druga vrsta mobilnog kriogenog suda), boca, baterija boca ili bilo koje drugo pakovanje koje je u direktnom kontaktu sa gasom.
Kriogeni gas
Gas koji prelazi u tečno stanje na pritisku od 1,013 bara i temperaturi ispod -150 °C.
Kriogeni sud za kućnu upotrebu
Mobilni kriogeni sud za čuvanje tečnog kiseonika i davanje kiseonika u gasovitom stanju u kući pacijenta.
Maksimalna teorijska rezidualna nečistoća
Gasovita nečistoća koja potiče od mogućeg povratnog gasa koji se zadržao posle pripreme boca za punjenje. Izračunavanje maksimalne teorijske nečistoće je značajno samo za komprimovane gasove i pod pretpostavkom da se ovi gasovi ponašaju kao idealni gasovi.
Medicinski gas
Bilo koji gas ili mešavina gasova klasifikovan kao lek (u skladu sa definicijom leka iz Direktive 2001/83/EC ili Direktive 2001/82/EC).
Mobilni kriogeni sud/kontejner
Mobilan termički izolovan sud/kontejner konstruisan za održavanje sadržaja u tečnom stanju. Izraz se u ovom aneksu ne odnosi na cisterne.
Nepovratni ventil
Ventil koji dozvoljava protok samo u jednom pravcu
Pražnjenje
Uklanjanje rezidualnog gasa iz kontejnera/sistema do pritiska manjeg od 1,013 bara, upotrebom vakuumskog sistema.
Razvodnik (manifold)
Oprema ili aparat projektovan tako da omogućava istovremeno pražnjenje ili punjenje jednog ili više kontejnera gasa.
Rezervoar
Fiksiran termički izolovan sud/kontejner konstruisan za skladištenje delimično tečnog ili kriogenog gasa. Naziva se i "stacionarni kriogeni sud".
Separacija vazduha
Separacija atmosferskog vazduha na sastavne gasove frakcionom destilacijom na kriogenim temperaturama.
Test hidrostatičkim pritiskom
Test koji se sprovodi na osnovu nacionalnih ili međunarodnih standarda kako bi se potvrdilo da boca ili rezervoar mogu izdržati visoke pritiske.
Cisterna
Kontejner fiksiran na transportno sredstvo za prenos delimično tečnog ili kriogenog gasa.
PROIZVODNJA BILJNIH LEKOVA
Zbog njihovog često složenog i promenljivog sastava, kontrola prolaznih materijala, njihovo skladištenje i proces proizvodnje zauzimaju posebno značajno mesto u proizvodnji lekova biljnog porekla.
Polazni materijal u proizvodnji biljnih lekova22 može da bude biljna droga23 ili biljni preparat22 nastao obradom biljne droge. Biljna droga treba da bude odgovarajućeg kvaliteta i prateće podatke o kvalitetu je potrebno dostaviti proizvođaču biljnog preparata/biljnog leka. Obezbeđivanje konzistentnog kvaliteta biljne droge može da zahteva detaljnije informacije o njenoj poljoprivrednoj proizvodnji. Izbor semena, uslovi gajenja i berbe predstavljaju važne aspekte kvaliteta biljne droge i mogu da utiču na konzistentnost gotovog proizvoda. Preporuke za odgovarajući sistem obezbeđenja kvaliteta za dobru poljoprivrednu i praksu sakupljanja su date u smernici HPMC "Smernice dobre poljoprivredne i prakse u sakupljanju polaznog materijala biljnog porekla".
Ovaj aneks se primenjuje i na sve polazne materijale biljnog porekla: biljke, biljne droge i biljne preparate.
Tabela koja ilustruje primenu Dobrih praksi u proizvodnji biljnih lekova24
aktivnost |
Dobra |
II deo GMP |
I deo GMP |
gajenje, sakupljanje i berba biljaka, algi, gljivica i lišajeva i sakupljanje eksudata |
|
|
|
sečenje i sušenje biljaka, algi, gljivica, lišajeva i eksudata ** |
|
|
|
izdvajanje iz biljaka i destilacija*** |
|
|
|
mlevenje, obrada eksudata, ekstrakcija iz biljaka, frakcionisanje, prečišćavanje, koncentrovanje ili fermentacija biljnih droga |
|
|
|
dalja obrada u farmaceutski oblik, uključujući postupak pakovanja leka |
|
|
|
________
22 Osim ako nije drugačije
navedeno, u ovom aneksu termin "biljni lek/preparat" obuhvata i "tradicionalni
biljni lek/preparat"
23 Termini biljna droga
i biljni preparat, kao što je definisano u Direktivi 2004/24/EC, ekvivalentni
su terminima biljni lek i biljni preparat iz Evropske farmakopeje.
24 Ovo je detaljna tabela
koja se odnosi na biljne preparate iz Drugog dela smernice dobre proizvođačke
prakse
25 Kao što je objavila
EMA (Evropska agencija za lekove)
* GMP klasifikacija biljnog materijala zavisi od upotrebe koju je odredio nosilac
dozvole za stavljanje leka u promet. Materijal može da se klasifikuje kao aktivna
supstanca, međuproizvod ili gotov proizvod. Odgovornost je proizvođača leka
da se obezbedi primena odgovarajuće GMP klasifikacije.
** proizvođači treba da obezbede da se ovi koraci izvršavaju u skladu sa dozvolom
za stavljanje leka u promet/registracijom, Za početne korake koji se odvijaju
na mestu berbe, kako je navedeno u dozvoli za stavljanje leka u promet/registraciji,
primenjuju se standardi dobre poljoprivredne i prakse sakupljanja biljnih materijala
biljnog porekla (GACP), dobra proizvođačka praksa se primenjuje za dalje korke
rezanja i sušenja.
*** U pogledu izdvajanja iz biljaka i destilacije, ako je za ove aktivnosti
neophodno da bude sastavni deo berbe da bi se održao kvalitet proizvoda u okviru
odobrene specifikacije, prihvatljivo je da se one obavljaju na mestu berbe
pod uslovom da je gajenje u skladu sa standardima dobre poljoprivredne i prakse
sakupljanja materijala biljnog porekla (GACP). Ove okolnosti treba posmatrati
kao izuzetke koji su opravdani u dokumentaciji dozvole za stavljanje leka u
promet/registraciji. Za aktivnosti koje se obavljaju na mestu berbe treba da
se obezbedi odgovarajuća dokumentacija, kontrola i validacija u skladu sa principima
dobre proizvođačke prakse. Nadležni organi mogu izvršiti inspekcije ovih aktivnosti
u cilju utvrđivanja usaglašenosti sa Dobrom proizvođačkom praksom.
Skladišni prostori
1. Biljne droge treba da se skladište u odvojenim prostorima. Skladišni prostor treba da bude tako opremljen da pruža zaštitu od ulaska insekata i drugih životinja, naročito glodara. Treba da se preduzmu efektivne mere, kako bi se sprečilo razmnožavanje spomenutih životinja ili mikroorganizama unetih u skladište sa biljnim drogama i biljnim sirovinama i da bi se onemogućila fermentacija ili razvoj plesni, kao i unakrsna kontaminacija. Treba koristiti različite zatvorene prostore za karntin primljenih biljnih droga i za odobrene biljne droge.
2. Skladišni prostor treba da bude dobro provetren, a kontejneri treba da budu raspoređeni tako da vazduh nesmetano cirkuliše.
3. Posebna pažnja treba da se obrati na čistoću i dobro održavanje prostora za skladištenje, naročito tamo gde se stvara prašina.
4. Skladištenje biljnih droga i biljnih preparata može zahtevati specifične uslove u pogledu vlage, temperature ili zaštite od svetla. Propisani uslovi treba da se obezbede, održavaju i kontrolišu.
Proizvodni prostor
5. Kad se stvara prašina tokom uzorkovanja, merenja, mešanja ili sl. u toku prerade biljnih droga i postupka proizvodnje biljnog leka, da bi se olakšalo čišćenje i izbegla unakrsna kontaminacija, treba da se preduzmu posebne mere, kao što su uklanjanje prašine, korišćenje namenskih prostorija itd.
6. Oprema, materijal za filtriranje i dr. koji se koriste u procesima proizvodnje moraju da budu kompatibilni sa rastvaračima za ekstrakciju, kako bi se sprečilo bilo kakvo otpuštanje ili neželjena apsorpcija supstanci koje mogu da utiču na proizvod.
Specifikacije za polazne materijale
7. Proizvođači biljnih lekova moraju da obezbede upotrebu samo onih biljnih polaznih materijala koji su proizvedeni u skladu sa Dobrom proizvođačkom praksom i dozvolom za stavljanje leka u promet. Treba da bude dostupna sveobuhvatna dokumentacija o proverama (audit) proizvođača biljnih polaznih materijala koje je izvršio proizvođač leka ili su u njegovo ime izvršene. Sledljivost provera aktivnih supstanci su ključni za kvalitet polaznih materijala. Proizvođač treba da obezbedi da su dobavljači biljnih droga/preparata usaglašeni sa Dobrom poljoprivrednom i praksom sakupljanja materijala biljnog porekla (GACP).
8. Da bi se ispunili zahtevi za specifikacije koji su opisani u Osnovnim zahtevima Smernice Dobre proizvođačke prakse (Poglavlje 4), dokumentacija za biljne droge/preparate treba da obuhvati:
- binominalni naučni naziv biljke (botanički naziv) rod, vrsta, podvrsta/sorta, sa imenom izvora klasifikacije - Linnaeus i sl.); po potrebi treba obezbediti i druge značajne podatke kao što su sorta i hemotip;
- pojedinosti o poreklu biljke (zemlja ili region u kom je biljka prikupljena, a kad je moguće, treba navesti način gajenja, vreme berbe, postupke prikupljanja, eventualno upotrebljene pesticide pri gajenju, moguću radioaktivnu kontaminaciju i sl.);
- podatak da li se koristi cela biljka ili samo jedan njen deo;
- kad se nabavlja propisno osušena droga, opis metode sušenja;
- opis biljne droge i odgovarajuća makroskopska i mikroskopska ispitivanja;
- odgovarajuće metode identifikacije koje uključuju, kada je moguće, ispitivanje i identifikaciju poznatih aktivnih supstanci ili karakterističnih sastojaka. Specifični originalni testovi su potrebni kada je biljna droga podložna zloupotrebi/falsifikovanju. Referentan originalan uzorak treba da bude sačuvan i dostupan za potrebe identifikacije;
- sadržaj vlage za biljne droge u skladu sa Evropskom farmakopejom;
- postupak određivanja sadržaja aktivne supstance koja je nosilac terapijskog dejstva ili karakterističnog sastojka; metode pogodne za određivanje moguće kontaminacije pesticidima i granice prihvatljivosti, u skladu sa metodama Evropske farmakopeje, ili ako nema farmakopejskih, drugim odgovarajućim validiranim metodama, osim ako drugačije nije opravdano;
- metode ispitivanja moguće kontaminacije gljivicama, odnosno mikroorganizmima (ispitivanja mikrobiološke čistoće), uključujući aflatoksine, druge mikotoksine, prisutne parazite, kao i dozvoljene limite;
- metode ispitivanja na prisustvo teških metala i druge potencijalne kontaminante ili falsifikate droga;
- metode ispitivanja na prisustvo stranih materija;
- bilo koji drugi dodatni test u skladu sa opštim monografijama o biljnim drogama ili specifičnim monografijama biljnih droga Evropske farmakopeje, ako je odgovarajuće.
Svaki postupak upotrebljen za smanjenje gljivične, odnosno mikrobiološke kontaminacije ili nekih drugih zaraza, treba da bude dokumentovan. Dokumentacija treba da sadrži sve pojedinosti o postupku, metodama ispitivanja i limitima za rezidue.
Uputstva za proizvodnju
9. Uputstvo za proizvodnju treba da sadrži opis različitih proizvodnih postupaka koji se sprovode na biljnoj drogi, kao što su čišćenje, sušenje, usitnjavanje ili prosejavanje, podatke o vremenu trajanja i temperaturi sušenja, kao i o metodama za određivanje veličine delova biljke ili čestica.
10. Naročito treba da postoje pisana uputstva i zapisi koji potvrđuju da je svaki kontejner biljne droge pažljivo proveren u cilju otkrivanja bilo kakve zloupotrebe/zamene ili prisustva stranih materija kao što su čestice metala, stakla, delovi životinja ili njihovih izlučevina, kamena, peska itd, ili znakova truljenja ili raspadanja.
11. Uputstvima za proizvodnju treba da se opišu bezbedonosna prosejavanja ili druge metode uklanjanja stranih materijala i odgovarajuće procedure čišćenja/selekcije biljnog materijala pre skladištenja odobrene biljne droge ili pre početka proizvodnje.
12. U proizvodnji biljnih preparata uputstva treba da sadrže i detalje o ekscipijensima i rastvaraču, o trajanju i temperaturi ekstrakcije, kao i podatke i metode eventualno primenjenog postupka uparavanja i koncentrovanja.
Uzorkovanje
13. Zbog velike heterogenosti lekovitih biljaka/biljnih supstanci njihovo uzorkovanje treba vrlo pažljivo da izvodi samo stručno osoblje. Svaku seriju treba da prati dokumentacija.
14. Neophodan je referentni uzorak biljne droge, posebno u slučajevima kada biljna droga nije opisana u Evropskoj farmakopeji ili drugoj farmakopeji zemlje članice. Ako se koriste praškovi, potrebni su uzorci nemlevene biljne droge.
15. Osoblje koje sprovodi ispitivanja i kontrolu kvaliteta treba da poseduje stručna znanja i iskustvo u oblasti biljnih droga, biljnih preparata i/ili biljnih lekova, kako bi bilo u stanju da sprovodi identifikaciju, prepozna falsifikate, kao i da utvrdi prisustvo gljivica i drugih štetočina, ili neujednačenost u samoj isporuci biljaka, i sl.
16. Identifikacija i kvalitet biljnih droga, preparata i biljnih lekova treba da se odredi prema odgovarajućem važećem Evropskom uputstvu o kvalitetu i specifikacijama biljnih lekova i tradicionalnih biljnih lekova i kada je odgovarajuće, prema specifičnim monografijama Evropske farmakopeje.
UZORKOVANJE POLAZNIH SUPSTANCI I MATERIJALA ZA PAKOVANJE
Uzorkovanje predstavlja veoma važnu operaciju, tokom koje se uzima samo jedan mali deo čitave serije. Validni zaključci o seriji ne mogu biti zasnovani na ispitivanjima koja su sprovedena na nereprezentativnim uzorcima. Zato je ispravno uzorkovanje značajan deo sistema obezbeđenja kvaliteta.
Napomena:
O uzorkovanju je napisano u osnovnim zahtevima smernice dobre proizvođačke prakse, Poglavlje 6, tačke 6.11 do 6.14. Ovaj aneks predstavlja dodatno uputstvo o uzorkovanju polaznih supstanci i materijala za pakovanje.
1. Osoblje koje vrši uzorkovanje treba da prođe redovnu početnu i kontinuiranu obuku iz oblasti relevantnih za ispravno uzorkovanje. Obuka uključuje:
- planove uzorkovanja;
- pisane procedure uzorkovanja;
- metode i opremu za uzorkovanje;
- rizike od unakrsne kontaminacije;
- mere predostrožnosti koje moraju da se preduzmu u odnosu na nestabilne, i/ili sterilne supstance;
- značaj vizuelnog pregleda materijala, kontejnera i etiketa;
- značaj beleženja svih neočekivanih ili neuobičajenih događaja.
2. Identitet cele serije polazne supstance može se utvrditi uzorkovanjem pojedinačnih uzoraka iz svih kontejnera i ako se na svakom uzorku sprovede ispitivanje identifikacije, prema metodi predviđenoj specifikacijom. U slučaju da je ustanovljen validirani postupak uzorkovanja, koji obezbeđuje da ni jedan kontejner u kome se čuvaju polazne supstance ne može biti pogrešno označen, dozvoljeno je da se uzorkuje samo deo od svih kontejnera.
3. Validacija obuhvata sledeće aspekte:
- vrstu i status proizvođača i dobavljača, kao i njihovo poznavanje zahteva dobre proizvođačke prakse za proizvodnju lekova;
- sistem obezbeđenja kvaliteta proizvođača polaznih supstanci;
- uslove u kojima se proizvode polazne supstance i u kojima se ispituje njihov kvalitet;
- prirodu polaznih supstanci i lekova za čiju proizvodnju će se te supstance upotrebiti.
Kad je sistem takav da na zadovoljavajući način obuhvata gore navedene aspekte, može se prihvatiti validirani postupak kojim se dozvoljava izuzimanje uzorkovanja u cilju identifikacije iz svakog od dostavljenih kontejnera polaznih supstanci i to u sledećim slučajevima:
- kad se polazne supstance dostavljaju od proizvođača ili sa mesta proizvodnje na kome se proizvodi samo jedan proizvod;
- kad se polazne supstance dostavljaju direktno od proizvođača u originalnom zapečaćenom kontejneru, u slučajevima kada postoji istorija pouzdanosti proizvođača i ako se vrši redovna provera sistema obezbeđenja kvaliteta od strane naručioca supstanci (proizvođača leka) ili zvanične ovlašćene institucije.
Nije verovatno da postupak može biti zadovoljavajuće validiran ako:
- polazne supstance isporučuju dobavljači - posrednici (brokeri i sl.); kad mesto gde se proizvode polazne supstance nije poznato ili nije izvršena provera mesta proizvodnje;
- su polazne supstance namenjene za izradu parenteralnih proizvoda.
4. Kvalitet serije polaznih supstanci može se proceniti uzimanjem i ispitivanjem kvaliteta reprezentativnog uzorka. Uzorci koji se uzimaju za identifikaciju mogu se koristiti i u ovu svrhu. Broj uzoraka uzetih za pripremu reprezentativnog uzorka mora da bude statistički određen i definisan u planu uzorkovanja. Mora da se odredi i broj pojedinačnih uzoraka koji se mešaju da bi se formirao sjedinjeni reprezentativni uzorak, pri čemu mora da se vodi računa o prirodi supstanci, poznavanju dobavljača i homogenosti sjedinjenog uzorka.
5. Plan uzorkovanja pakovnog materijala mora da obuhvati najmanje sledeće elemente: isporučenu količinu, zahtevani kvalitet, prirodu materijala (unutrašnje pakovanje, odnosno spoljno - štampano pakovanje), postupke proizvodnje odgovarajućeg materijala za pakovanje i raspoložive podatke o sistemu obezbeđenja kvaliteta proizvođača pakovnog materijala na osnovu izvršenih zvaničnih provera.
Broj uzetih uzoraka mora da bude određen statistički i definisan u planu uzorkovanja.
PROIZVODNJA TEČNIH FARMACEUTSKIH OBLIKA, KREMA I MASTI
Tokom proizvodnje, tečni farmaceutski oblici, kreme i masti mogu biti podložni mikrobiološkoj i drugim vrstama kontaminacije. Zbog toga moraju da se primene posebne mere predostrožnosti kako bi se sprečila pojava kontaminacije.
1. Preporučuje se upotreba zatvorenih sistema za proizvodnju i prenos kako bi se proizvodi zaštitili od kontaminacije. Proizvodni prostori u kojima su proizvodi ili otvoreni čisti kontejneri izloženi uticaju okoline, treba da se efektivno snabdevaju filtriranim vazduhom.
2. Rezervoari, kontejneri, cevovodi i pumpe treba da budu dizajnirani i instalirati tako da je moguć lako čišćenje i sanitizacija. Od posebnog značaja je da je oprema tako dizajnirana, da ima što manje nepristupačnih, "slepih" mesta i delova na kojima mogu da se nagomilavaju ostaci proizvoda, koji mogu da podstiču razmnožavanje mikroorganizama.
3. Kad god je moguće treba da se izbegava upotreba staklenih aparatura. Nerđajući čelik visokog kvaliteta predstavlja materijal izbora za delove opreme koji dolaze u dodir sa proizvodom.
4. Treba da se utvrde standardi hemijskog i mikrobiološkog kvaliteta vode koja se koristi u proizvodnji i da se redovno kontroliše njen kvalitet. Posebna briga mora da se vodi o održavanju sistema za vodu, kako bi se izbegla opasnost od razmnožavanja mikroorganizama. Posle svake hemijske sanitizacije sistema za vodu, mora da se sprovede validiran postupak ispiranja radi efektivnog uklanjanja sredstava za čišćenje i sanitaciju.
5. Kvalitet materijala u bulk-u mora da se proveri pre nego što se izvrši prenos u rezervoare za skladištenje poluproizvoda.
6. Prilikom prenosa materijala propuštanjem kroz cevi, mora da se obezbedi njihovo isporučivanje na tačno odredište.
7. Materijali koji ispuštaju vlakna ili druge kontaminante (kartoni, drvene palete i sl.) ne smeju da se unose u prostore u kojima su proizvodi ili čisti kontejneri nezaštićeni.
8. Tokom punjenja treba da se vodi računa da se održava homogenost mikstura i suspenzija. Postupak mešanja i punjenja mora da se validira. Posebno se mora voditi računa o održavanju homogenosti na početku procesa punjenja, posle prekida punjenja i na kraju procesa punjenja.
9. Kad se gotov proizvod ne pakuje odmah u odgovarajuće pakovanje, moraju da se odrede maksimalan rok i uslovi čuvanja.
PROIZVODNJA PREPARATA ZA INHALACIJU U OBLIKU AEROSOLA POD PRITISKOM SA DOZIMETROM
Proizvodnja preparata za inhalaciju u obliku aerosola pod pritiskom i sa dozimetrom zahteva posebnu pažnju upravo zbog prirode oblika ovog proizvoda. Proizvodnja mora da se obavlja pod uslovima koji minimiziraju kontaminaciju česticama i mikroorganizmima. Od posebne važnosti je da se obezbedi odgovarajući kvalitet komponenti ventila i homogenost materijala u slučaju suspenzija.
1. Trenutno postoje dve uobičajene metode za proizvodnju i punjenje:
a) Sistem punjenja u dva koraka (punjenje pod pritiskom). Aktivna supstanca se dodaje u punilac sa visokom tačkom ključanja, doza se puni u bocu, postavlja se ventil, a punilac sa nižom tačkom ključanja se ubrizgava kroz cev ventila kako bi se napravio finalni gotov proizvod. Suspenzija aktivne supstance u puniocu se održava na hladnom, kako bi se smanjio gubitak isparavanjem;
b) Postupak punjenja u jednom koraku (hladno punjenje). Aktivna supstanca se dodaje u mešavinu punilaca i drži se ili pod visokim pritiskom ili na niskoj temperaturi, ili pod oba uslova. Suspenzija se onda puni direktno u bocu u jednom potezu.
2. Ako je moguće, proizvodnju i punjenje treba obavljati u zatvorenom sistemu.
3. Prostor u kome se nalaze proizvodi ili čiste komponente mora da se snabdeva vazduhom preko filtera, koji mora da odgovara zahtevima najmanje klase D čistoće i u prostor mora da se ulazi kroz vazdušne propusnike.
Proizvodnja i kontrola kvaliteta
4. Ventili za aerosole sa dozimetrom su složeniji tehnički delovi od većine delova koji se koriste u farmaceutskoj proizvodnji. O tome mora da se vodi računa kod specifikacija, uzorkovanja i ispitivanja. Provera sistema obezbeđenja kvaliteta proizvođača ventila je od posebne važnosti.
5. Svi fluidi (npr. tečni ili gasni punioci) moraju da se filtriraju kako bi se otklonile čestice veće od 0,2 mikrona. Ako je moguće, poželjno je i dodatno filtriranje neposredno pre punjenja.
6. Čišćenje boca i ventila treba da se sprovodi po validiranoj proceduri, koja je u skladu sa namenom proizvoda, kako bi se obezbedilo odsustvo nepoželjnih mikrobioloških kontaminanata ili pomoćnih sredstava za izradu boca i ventila (npr. sredstva za podmazivanje). Nakon čišćenja, ventile treba čuvati u čistim, zatvorenim kontejnerima i treba da se preduzmu posebne mere opreza kako ne bi došlo do kontaminacije tokom daljeg rukovanja, npr. uzorkovanja. Boce treba da se stavljaju na liniju za punjenje u čistom stanju ili da se čiste na liniji neposredno pre punjenja.
7. Treba preduzeti mere opreza u momentu punjenja da bi se obezbedila homogenost suspenzije tokom celog procesa punjenja.
8. Kada se koristi proces punjenja u dva koraka, neophodno je obezbediti da težina bude tačna u oba koraka, kako bi se dobio ispravan sastav. U tu svrhu često je poželjna 100%-na provera težine u svakoj fazi.
9. Kontrola nakon punjenja treba da osigura da nema nepoželjnog curenja. Ispitivanje - "test na curenje", treba da se sprovede tako da se izbegne kontaminacija mikroorganizmima i rezidualna vlaga.
KOMPJUTERIZOVANI SISTEMI
Ovaj aneks se odnosi na sve oblike kompjuterizovanih sistema koji se koriste kao deo aktivnosti koje su regulisane Smernicama dobre proizvođačke prakse.
Kompjuterizovani sistem je skup softverskih i hardverskih komponenata koje zajedno obezbeđuju određenu funkcionalnost sistema.
Aplikacija treba da bude validirana; IT infrastruktura treba da bude kvalifikovana.
Ukoliko kompjuterizovani sistem zamenjuje manuelne operacije, njegova upotreba ne treba da dovede do smanjenja kvaliteta proizvoda, kontrole procesa ili obezbeđenja kvaliteta. Ovi sistemi ne treba da povećavaju ukupan rizik procesa.
1. Upravljanje rizikom
Upravljanje rizikom treba da se primenjuje tokom celog životnog ciklusa kompjuterizovanog sistema uzimajući u obzir bezbednost pacijenta, integritet podataka i kvalitet proizvoda. Kao deo sistema upravljanja rizikom, odluke o obimu validacije i kontrola integriteta podataka treba da se zasnivaju na opravdanoj i dokumentovanoj proceni rizika kompjuterizovanog sistema.
2. Osoblje
Treba da postoji bliska saradnja između relevantnog osoblja kao što su Vlasnik procesa, Vlasnik sistema, Kvalifikovana lica i osoblje zaduženo za kompjuterizovane sisteme (IT osoblje). Svo osoblje treba da ima odgovarajuće kvalifikacije, nivo pristupa i definisane odgovornosti za obavljanje svojih zadataka.
3. Dobavljači i davaoci usluga
3.1 Kada se koriste treće strane (npr. dobavljači, davaoci usluga) da npr. obezbede, instaliraju, konfigurišu, integrišu, validiraju, održavaju (npr. preko udaljenog pristupa), modifikuju ili čuvaju kompjuterizovane sisteme ili povezane usluge ili za obradu podataka, mora da postoji zaključen ugovor između proizvođača i bilo koje treće strane, kojim su jasno definisane odgovornosti treće strane. Analogno, treba da se razmotre odeljenja koja će se baviti informacionim tehnologijama (IT odeljenja).
3.2 Kompetentnost i pouzdanost dobavljača su ključni faktori pri izboru davaoca roba ili usluga. Potreba za njihovom proverom (audit), treba da bude zasnovana na proceni rizika.
3.3 Dokumentacija dostavljena sa standardnim komercijalnim softverskim (off-the-shelf) proizvodima treba da bude pregledana od strane ovlašćenih korisnika koji proveravaju da li su ispunjeni korisnički zahtevi.
3.4 Informacije o sistemu kvaliteta i proveri (audit) trećih strana koje razvijaju ili isporučuju softver i implementirani sistemi treba da budu dostupni inspektorima na njihov zahtev.
4. Validacija
4.1 Dokumentacija o validaciji i izveštaji treba da obuhvate relevantne korake životnog ciklusa. Proizvođači treba da budu sposobni da opravdaju standarde, protokole, kriterijume prihvatljivosti, procedure i zapise zasnovane na njihovoj proceni rizika.
4.2 Dokumentacija o validaciji treba da obuhvati zapise o kontroli izmena (ako je primenjivo) i zapise o svim odstupanjima koja su zabeležena tokom procesa validacije.
4.3 Ažurirana lista sa podacima o svim relevantnim sistemima i njihovoj GMP funkcionalnosti (inventar) treba da bude dostupna.
Za kritične sisteme treba da bude dostupan ažuriran opis sistema koji detaljno opisuje fizičku i logičku strukturu, protok podataka i interfejse sa drugim sistemima ili procesima, bilo koji hardverski ili softverski preduslov i mere bezbednosti.
4.4 Specifikacije zahteva korisnika treba da opišu potrebnu funkciju kompjuterizovanog sistema i da se zasnivaju na dokumentovanoj proceni rizika i GMP uticaju. Korisnički zahtevi treba da budu sledljivi tokom celog životnog ciklusa.
4.5 Ovlašćeni korisnik treba da preduzme sve razumne korake, da obezbedi da sistem bude razvijen u skladu sa odgovarajućim sistemom upravljanja kvalitetom. Treba da se izvrši procena dobavljača na odgovarajući način.
4.6 Za validaciju posebno dizajniranih (bespoke) ili prilagođenih (customized) kompjuterizovanih sistema treba da postoji ustanovljen proces koji omogućava formalnu procenu i izveštavanje o merama vezanim za kvalitet i performanse svih faza životnog ciklusa sistema.
4.7 Dokaz o odgovarajućim metodama i postupcima testiranja treba da postoji. Naročito treba da se razmotre limiti parametara sistema (procesa), limiti podataka i postupanje u slučaju greške. Za automatizovane alate za testiranje i uslove testiranja treba da postoji dokumentovana procena njihove adekvatnosti.
4.8 Ako se podaci prenose u drugi format podataka ili sistem, validacija treba da uključi provere da nisu promenjene vrednosti i/ili značenje podataka tokom ovog procesa prenosa.
5. Podaci
Kompjuterizovani sistemi koji elektronski razmenjuju podatke sa drugim sistemima treba da imaju ugrađene odgovarajuće provere za pravilan i bezbedan unos i obradu podataka, da bi minimizirali rizike.
6. Provera tačnosti
Za kritične podatke koji se unose ručno, treba dodatno da se proveri tačnost podataka. Ovu proveru može da izvrši drugi operater ili se ona može obaviti validiranim elektronskim sredstvima.
Kritičnost i potencijalne posledice pogrešnih ili neispravno unetih podataka u sistem treba da budu obuhvaćeni upravljanjem rizikom.
7. Čuvanje podataka
7.1 Podaci treba da budu obezbeđeni od oštećenja, kako fizičkim tako i elektronskim sredstvima. Treba da se proveri dostupnost, čitljivost i tačnost sačuvanih podataka. Pristup podacima treba da bude obezbeđen tokom perioda čuvanja.
7.2 Treba da se obezbede redovne rezervne kopije (back-up) svih relevantnih podataka. Integritet i tačnost rezervnih kopija i mogućnost za vraćanje (restore) podataka treba da se provere tokom validacije, kao i da se periodično provere.
8. Štampani izveštaji
8.1 Treba da se omogući dobijanje čitkih štampanih kopija elektronski sačuvanih podataka.
8.2 Za zapise koji podržavaju puštanje serije leka u promet, treba da postoji mogućnost da se generišu štampani izveštaji koji ukazuju na to da li je neki od podataka promenjen u odnosu na prvobitni unos.
9. "Audit trails"
Na osnovu procene rizika treba da se razmotri da sistem generiše zapise o svim GMP relevantnim promenama i brisanju (sistemski generisan "audit trail"). Razlog za promenu ili brisanje GMP relevantnih podataka treba da bude dokumentovan.
"Audit trails" treba da budu raspoloživi i da mogu da se konvertuju u razumljiv oblik i da se redovno pregledaju.
10. Izmene i upravljanje konfiguracijom
Bilo kakve izmene u kompjuterizovanom sistemu, uključujući konfiguracije sistema, mogu da se vrše samo na kontrolisan način u skladu sa definisanom procedurom.
11. Periodična procena
Kompjuterizovani sistemi treba periodično da se procenjuju, kako bi se potvrdio njihov validacioni status, kao i usaglašenost sa Dobrom proizvođačkom praksom. Kada je primenljivo, ovakve procene treba da uključe trenutni obim funkcionalnosti, zapise o odstupanjima, incidente, probleme, istoriju ažuriranja (upgrade), performanse, pouzdanost, bezbednost i izveštaje o validacionom statusu.
12. Bezbednost
12.1 Fizičke i/ili logičke kontrole treba da budu u funkciji kako bi se pristup kompjuterizovanom sistemu ograničio na ovlašćena lica. Odgovarajuće metode sprečavanja neovlašćenog ulaska u sistem mogu da uključe upotrebu hardverskih "ključeva", pristupnih kartica, ličnih šifri sa lozinkama, biometrijskih podataka, ograničen pristup računarskoj opremi i prostoru za čuvanje podataka.
12.2 Stepen bezbednosnih kontrola zavisi od kritičnosti kompjuterizovanog sistema.
12.3. Kreiranje, promena i ukidanje ovlašćenja za pristup, treba da budu zabeleženi.
12.4. Sistemi za upravljanje podacima i dokumentima treba da budu dizajnirani tako da beleže identitet operatora koji unose, menjaju, potvrđuju ili brišu podatke uključujući datum i vreme.
13. Upravljanje incidentima
Svi incidentni slučajevi, a ne samo otkazivanja sistema i greške u podacima, treba da budu prijavljene i procenjene. Osnovni uzrok kritičnog incidenta treba da bude identifikovan i da bude osnova za korektivne i preventivne aktivnosti.
14. Elektronski potpis
Elektronski zapisi mogu biti potpisani elektronski. Od elektronskog potpisa se očekuje da:
a. Ima isti značaj kao i svojeručni potpisi unutar kompanije,
b. Bude trajno povezan sa odgovarajućim zapisom,
c. Uključuje vreme i datum kada su primenjeni.
15. Puštanje serije leka u promet
Kada se kompjuterizovani sistem koristi za izdavanje sertifikata i puštanje serije leka u promet, sistem treba da dozvoli samo Kvalifikovanim licima da odobre puštanje serije leka u promet i jasno da identifikuje i evidentira osobu koja izdaje sertifikat i pušta seriju leka u promet. Ovaj postupak treba da se izvrši upotrebom elektronskog potpisa.
16. Kontinuitet poslovanja
Za dostupnost kompjuterizovanih sistema koji podržavaju kritične procese, treba da se primenjuju mere kako bi se obezbedio kontinuitet podrške za te procese u slučaju pada sistema (npr. manuelni ili alternativni sistem). Vreme potrebno za aktiviranje alternativnih sistema treba da bude zasnovano na proceni rizika u odnosu na određeni sistem i poslovni proces koji podržava. Ovi alternativni sistemi treba da se adekvatno dokumentuju i testiraju.
17. Arhiviranje
Podaci se mogu arhivirati. Za arhivirane podatke treba da se proveri dostupnost, čitljivost i integritet. U slučaju kada su izvršene značajne promene u sistemu (npr. računarska oprema ili programi), treba da se osigura i testira sposobnost preuzimanja arhiviranih podataka.
Aplikacija: Softver instaliran na definisanoj platformi/hardveru koji pruža specifičnu funkcionalnost.
Vlasnik procesa: lice odgovorno za poslovni proces.
Vlasnik sistema: Osoba odgovorna za dostupnost i održavanje kompjuterizovanog sistema i za bezbednost podataka koji se nalaze u tom sistemu.
Životni ciklus: Sve faze u životu sistema od početnih zahteva do povlačenja uključujući dizajn, specifikaciju, programiranje, testiranje, instalaciju, rad i održavanje.
IT infrastruktura: Hardver i softver, kao što su softver za umrežavanje i rad sistema, što omogućava da aplikacija funkcioniše.
Posebno dizajniran (bespoke)/prilagođen customized) kompjuterizovani sistem: kompjuterizovani sistem koji je individualno dizajniran da odgovara određenom poslovnom procesu.
Standardni komercijalni softver: Komercijalno dostupan softver, čija je pogodnost za upotrebu demonstrirana širokim spektrom korisnika.
Treća strana: Strane kojim ne upravlja direktno nosilac dozvole za proizvodnju i/ili uvoz.
UPOTREBA JONIZUJUĆEG ZRAČENJA U PROIZVODNJI LEKOVA
Napomena:
Nosilac ili podnosilac zahteva za dobijanje dozvole za stavljanje leka u promet koja kao deo proizvodnje uključuje zračenje, treba da se pozove na smernicu "Jonizujuće zračenje u proizvodnji lekova" datu od strane Komiteta za zaštićene lekove (CPMP - EMEA).
Jonizujuće zračenje se može koristiti tokom proizvodnog procesa u različite svrhe, uključujući smanjenje biološke kontaminacije i sterilizaciju polaznih materijala, komponenti pakovanja ili proizvoda, kao i tretman proizvoda od krvi.
Postoje dva tipa procesa ozračivanja: gama ozračivanje iz radioaktivnog izvora i ozračivanje elektronima visoke energije (beta zračenje) primenom akceleratora.
Gama ozračivanje: mogu se primeniti dva različita načina:
i) Stacionarni način: proizvod je smešten na fiksnim mestima oko izvora zračenja i ne može se stavljati i uklanjati dok je izložen dejstvu izvora zračenja.
ii) Kontinualni način: automatskim sistemom proizvodi se prenose u ćeliju za ozračivanje, određenom putanjom i odgovarajućom brzinom prolaze pored izvora zračenja i izlaze iz ćelije. Ozračivanje elektronima: proizvod se kreće pored kontinualnog ili impulsnog snopa elektrona visoke energije (beta zračenje), pomerajući se napred-nazad po putanji.
1. Postupak ozračivanja može izvoditi proizvođač lekova ili operater na postrojenju za zračenje na osnovu ugovora ("ugovorni proizvođač"), pri čemu oba moraju posedovati odgovarajuću dozvolu za proizvodnju.
2. Proizvođač lekova odgovoran je za kvalitet proizvoda uključujući i postizanje cilja ozračivanja. Ugovorni operater na postrojenju za zračenje odgovoran je da obezbedi da kontejner za ozračivanje (krajnji kontejner u kome se proizvodi ozračuju) bude izložen dozi zračenja koju zahteva proizvođač.
3. Zahtevana doza, uključujući potvrđene granice, treba da bude navedena u dozvoli za stavljanje leka u promet.
4. Dozimetrija se definiše kao merenje apsorbovane doze pomoću dozimetara. Razumevanje i pravilno korišćenje tehnike su od suštinskog značaja za validaciju, puštanje u pogon i kontrolu procesa.
5. Kalibracija svih rutinskih dozimetara treba da bude sledljiva do nacionalnih ili međunarodnih standarda. Rok važnosti kalibracije mora da bude naveden, potvrđen i ispoštovan.
6. Isti instrument treba da se koristi za postavljanje kalibracione krive rutinskih dozimetara, kao i za merenje promena njihove apsorbancije posle ozračivanja. Ako se koriste različiti instrumenti, treba da se utvrdi apsolutna apsorbancija svakog instrumenta.
7. Zavisno od vrste korišćenog dozimetra, treba da se vodi računa o mogućim uzrocima nepreciznosti, uključujući promenu sadržaja vlage, promenu temperature, vreme proteklo između ozračivanja i merenja, kao i jačinu doze.
8. Talasna dužina instrumenta koji se koristi za merenje promena apsorbancije dozimetara i instrument koji se koristi za merenje njihove debljine, treba da budu redovno kalibrisani u intervalima utvrđenim na osnovu njihove stabilnosti, namene i korišćenja.
9. Validacija je postupak kojim se dokazuje da će se u procesu postići očekivani rezultati, tj. postići željena apsorbovana doza proizvoda. Zahtevi u pogledu validacije procesa su opširnije izneti u preporukama "Korišćenje jonizujućeg zračenja u proizvodnji lekova".
10. Validacija treba da uključi izradu mape doza, kako bi se ustanovila distribucija apsorbovane doze u kontejneru za ozračivanje, kad je napunjen proizvodom po definisanoj šemi.
11. Specifikacija za proces ozračivanja treba da sadrži:
a) detalje o pakovanju proizvoda;
b) šemu punjenja proizvoda unutar kontejnera za ozračivanje. Posebno treba da se obrati pažnja kada se u kontejner za ozračivanje stavljaju različiti proizvodi, da ne dođe do smanjenog doziranja zračenja u proizvodima veće gustine ili da proizvod veće gustine ne zakloni druge proizvode. Svako punjenje kontejnera za ozračivanje različitim proizvodima mora biti specificirano i validirano;
c) šemu postavljanja kontejnera za ozračivanje oko izvora (stacionarni način) ili duž putanje kroz ćeliju (kontinualni način);
d) maksimalne i minimalne granice apsorbovane doze u leku (i odgovarajuću rutinsku dozimetriju);
e) maksimalne i minimalne granice apsorbovane doze u kontejneru za ozračivanje i odgovarajuću rutinsku dozimetriju za praćenje te apsorbovane doze;
f) ostale parametre procesa, uključujući jačinu doze, maksimalno vreme izlaganja, broj izlaganja i sl.
Kad se ozračivanje vrši kao poverena aktivnost (po ugovoru), u ugovoru treba najmanje da budu tačke (d) i (e) specifikacije za proces ozračivanja.
Opšte odredbe
12. Kvalifikacija postrojenja je rad na dobijanju i dokumentovanju dokaza da će postrojenje za ozračivanje dosledno raditi u okvirima prethodno određenih granica kad se postupa po specifikaciji procesa. U smislu ovog aneksa, prethodno određene granice su maksimalne i minimalne doze koje treba da apsorbuje kontejner za ozračivanje. Isključuje se mogućnost da se pojave variranja u radu postrojenja koja bi dovela do toga da kontejner primi dozu izvan tih granica, bez znanja operatera.
13. Kvalifikacija uključuje sledeće elemente:
a) projekat/dizajn;
b) izradu mape doza;
c) dokumentaciju;
d) zahtev za ponovnu kvalifikaciju.
Gama radijaciona jedinica
Projekat/dizajn
14. Apsorbovana doza koju je primio određeni deo kontejnera za ozračivanje u bilo kojoj poziciji u radijacionoj jedinici, zavisi prvenstveno od sledećih činilaca:
a) aktivnosti i geometrije izvora;
b) razdaljine od izvora do kontejnera;
c) trajanja ozračivanja, kontrolisanog pomoću tajmera ili brzine prenošenja;
d) sastava i gustine materijala, uključujući ostale proizvode, između izvora i određenog dela kontejnera.
15. Ukupna apsorbovana doza dodatno će zavisiti od putanje kontejnera kroz radijacionu jedinicu sa kontinualnim načinom ozračivanja ili od mesta postavljanja u radijacionoj jedinici sa stacionarnim načinom ozračivanja, kao i od broja ciklusa izlaganja.
16. Za radijacionu jedinicu sa kontinualnim načinom ozračivanja sa fiksnom putanjom ili za radijacionu jedinicu sa stacionarnim načinom ozračivanja, sa fiksnim mestom postavljanja i pri datoj jačini izvora i vrstom proizvoda, ključni parametar postrojenja koji treba da kontroliše operater je brzina prenošenja ili podešavanje tajmera.
Izrada mape doza
17. Za proceduru izrade mape doza, radijaciona jedinica treba da bude napunjena kontejnerima za ozračivanje koji su ispunjeni modelima proizvoda ili reprezentativnim proizvodima ravnomerne gustine. Dozimetri treba da budu postavljeni u najmanje tri napunjena kontejnera za ozračivanje koji prolaze kroz radijacionu jedinicu, okruženi sličnim kontejnerima ili modelima proizvoda. Ako proizvod nije uniformno zapakovan, dozimetri treba da se postave u veliki broj kontejnera.
18. Postavljanje dozimetara zavisiće od veličine kontejnera za ozračivanje. Na primer, za kontejnere do veličine od 1x1x0,5 m pogodna je trodimenzionalna rešetka stranice od 20 cm, duž kontejnera, uključujući spoljašnje površine. Ako su očekivane vrednosti maksimalnih i minimalnih doza poznate iz prethodnih karakterizacija osobina radijacione jedinice, neki dozimetri se mogu premestiti iz zona prosečnih doza i postaviti u zone ekstremnih doza, tako da obrazuju rešetku stranice od 10 cm.
19. Rezultati ovog postupka daće minimalne i maksimalne apsorbovane doze u proizvodu i na površini kontejnera za dati set parametara postrojenja, gustinu proizvoda i šeme punjenja.
20. Za izradu mape doza idealno je koristiti referentne dozimetre zbog njihove veće preciznosti. Mogu se koristiti rutinski dozimetri, ali se savetuje da se pored njih postave referentni dozimetri na očekivanim mestima minimalne i maksimalne doze, kao i na mestu rutinskog praćenja pri svakom ponovnom ozračivanju kontejnera. Posmatrane vrednosti doza imaće zajedničku slučajnu nepouzdanost, koja se može proceniti iz variranja ponovljenih merenja.
21. Minimalna doza, izmerena rutinskim dozimetrima, koja obezbeđuje da svi kontejneri za ozračivanje prime minimalnu zahtevanu dozu, uzima u obzir i slučajnu varijabilnost rutinskih dozimetara koji se koriste.
22. Parametri radijacione jedinice treba da se održavaju konstantnim, prate i beleže tokom izrade mape doza. Zapisi, zajedno sa rezultatima dozimetrije i svim drugim prikupljenim zapisima treba da budu sačuvani.
Radijaciona jedinica za ozračivanje snopom elektrona
Projekt/dizajn
23. Apsorbovana doza koju je primio određeni deo ozračenog leka zavisi prvenstveno od sledećih činilaca:
a) karakteristika snopa: energije elektrona, srednje vrednosti struje snopa, širine i uniformnosti snopa;
b) brzine konvejera;
c) sastava i gustine proizvoda;
d) sastava, gustine i debljine materijala između izlaznog prozora i određenog dela proizvoda;
e) razdaljine između izlaznog prozora i kontejnera.
24. Ključni parametri koje kontroliše operater su karakteristike snopa i brzina konvejera.
Izrada mape doza
25. Za proceduru izrade mape doza dozimetri treba da se postave između slojeva homogenih listova apsorbera koji čine model leka, ili između slojeva reprezentativnog leka ravnomerne gustine tako da bude moguće da se obavi najmanje deset merenja unutar maksimalnog dometa elektrona. Mora se voditi računa i o tačkama: 18 do 21.
26. Parametri radijacione jedinice treba da se održavaju konstantnim, prate i beleže tokom izrade mape doza. Zapisi, zajedno sa rezultatima dozimetrije i svim drugim prikupljenim zapisima, treba da budu sačuvani.
Rekvalifikacija
27. Kvalifikacija treba da bude ponovljena ako postoji promena u procesu ili radijacionoj jedinici koja bi mogla da utiče na distribuciju doze u kontejneru za ozračivanje (tj. promena izvora). Obim ponovne kvalifikacije zavisi od stepena promene u radijacionoj jedinici ili rasporedu punjenja kontejnera. Ako postoji sumnja, vrši se ponovno puštanje u rad.
28. Prostorije treba da budu projektovane i korišćene tako da se razdvoje ozračeni od neozračenih kontejnera, kako bi se izbegla njihova unakrsna kontaminacija. Kad se rukuje sa materijalima u zatvorenim kontejnerima za ozračivanje, nije neophodno da se razdvajaju farmaceutski od drugih materijala, pod uslovom da nema rizika da dođe do kontaminacije farmaceutskih materijala drugim materijalima.
Mora se isključiti svaka mogućnost kontaminacije proizvoda radionuklidima iz izvora.
29. Kontejneri za ozračivanje treba da budu postavljeni prema specifikovanoj šemi punjenja uspostavljenoj tokom validacije.
30. Tokom procesa, doze zračenja u kontejnerima za ozračivanje treba da se prate primenom validiranih postupaka dozimetrije. Odnos između ove doze i doze apsorbovane u proizvodu unutar kontejnera mora da bude ustanovljen tokom validacije procesa i kvalifikacije postrojenja.
31. Indikatori zračenja treba da se koriste kao pomoć za razlikovanje ozračenih od neozračenih kontejnera. Oni ne treba da se koriste kao jedino sredstvo za razlikovanje ili kao znak zadovoljavajućeg toka procesa.
32. Postupak sa mešovitim sadržajem kontejnera unutar ćelije za ozračivanje treba da se izvede samo kada je, posle proba tokom kvalifikacije ili na osnovu drugih dokaza, poznato da se doza zračenja koju su primili pojedinačni kontejneri nalazi u okviru specifikovanih granica.
33. Kada je planirano davanje zahtevane doze zračenja tokom više od jednog izlaganja ili prolaska kroz postrojenje, to treba da bude uz saglasnost nosioca dozvole za stavljanje leka u promet i da se vrši u prethodno određenom vremenskom periodu. O neplaniranim prekidima tokom ozračivanja, ako oni produžavaju proces ozračivanja preko prethodno ugovorenog perioda, treba da bude obavešten nosilac dozvole za stavljanje leka u promet.
34. Neozračeni proizvodi moraju biti razdvojeni od ozračenih proizvoda. Metode kojima se ovo postiže uključuju korišćenje indikatora zračenja (videti 31) i odgovarajuću konstrukciju prostorija (videti 28).
Gama radijaciona jedinica
35. Za kontinualni način, dozimetri treba da budu postavljeni tako da su najmanje dva dozimetra izložena zračenju sve vreme.
36. Za stacionarni način, najmanje dva dozimetra treba da budu izložena u položajima koji odgovaraju položajima sa minimumom doze.
37. Za kontinualni način treba da postoji nedvosmisleni znak tačnog položaja izvora i blokada između položaja izvora i kretanja prenosnog sistema. Brzina prenosnog sistema treba stalno da se prati i zapisuje.
38. Za stacionarni način, kretanje i vreme izlaganja svake serije treba da se prate i zapisuju.
39. Za datu željenu dozu, podešavanje tajmera ili brzine prenosnog sistema zahtevaju korekciju zbog opadanja ili dopune izvora. Rok važnosti podešavanja ili brzine treba da bude zapisan i ispoštovan.
Radiaciona jedinica za ozračivanje snopom elektrona
40. Dozimetar treba da se postavi na svaki kontejner.
41. Srednja vrednost struje snopa, energija elektrona, širina skeniranja i brzina prenosnog sistema treba stalno da se zapisuju. Ove promenljive, osim brzine prenosnog sistema, treba da se kontrolišu u definisanim granicama ustanovljenim prilikom puštanja u rad, zbog njihove sklonosti trenutnoj promeni.
42. Broj primljenih, ozračenih i otpremljenih kontejnera treba da bude usklađen međusobno i sa pripadajućom dokumentacijom. Svaka neusaglašenost treba da se prijavi i reši.
43. Operater na postrojenju za ozračivanje treba pismeno da potvrdi opseg doza koje je primio svaki ozračeni kontejner u seriji ili isporuci.
44. Zapisi o postupku i kontroli za svaku ozračenu seriju treba da budu pregledani, potpisani od imenovane odgovorne osobe i sačuvani. O načinu i mestu čuvanja treba da se dogovore operater postrojenja i nosilac dozvole za stavljanje u promet.
45. Dokumentacija, zajedno sa dokumentacijom o validaciji i kvalifikaciji postrojenja treba da se čuva godinu dana po isteku roka upotrebe leka ili najmanje pet godina od puštanja u promet poslednjeg proizvoda koji je obrađen u postrojenju, ili bilo koji duži rok.
46. Mikrobiološki monitoring je obaveza proizvođača leka. On treba da obuhvati praćenje uslova sredine u kojoj je lek proizveden i praćenje leka pre ozračivanja, kao što je naznačeno u dozvoli za stavljanje u promet.
PROIZVODNJA LEKOVA NAMENJENIH ZA KLINIČKO ISPITIVANJE
Proizvodnja lekova namenjenih za kliničko ispitivanje treba da se obavlja u skladu sa principima i detaljnim uputstvima smernice dobre proizvođačke prakse za lekove. Druge smernice i uputstva izdata od Evropske Komisije treba uzeti u obzir tamo gde su ona primenljiva i odgovarajuća u odnosu na fazu razvoja leka. Procedure treba da odgovaraju fazi razvoja leka i takve da se mogu menjati kako se znanje o procesu povećava.
U kliničkim ispitivanjima može da postoji dodatni rizik za učesnike u ispitivanju u odnosu na pacijente koji upotrebljavaju lekove koji imaju dozvolu za stavljanje u promet. Primena smernice dobre proizvođačke prakse u proizvodnji lekova u fazi ispitivanja ima za cilj da obezbedi da se učesnici u ispitivanju ne izlažu riziku i da na rezultate kliničkih ispitivanja ne utiču neodgovarajuća bezbednost, kvalitet ili efikasnost leka nastali usled nepropisne proizvodnje. Namera je takođe, da se obezbedi doslednost serija istog leka koje se upotrebljavaju u istom ili različitim kliničkim ispitivanjima i da se promene nastale tokom razvoja leka adekvatno dokumentuju i opravdaju.
Povećana složenost postupaka proizvodnje lekova u fazi ispitivanja, u poređenju sa registrovanim lekovima, usled nedostatka rutinskih postupaka, raznovrsnosti u dizajnu kliničkih ispitivanja, dizajnu materijala za pakovanje, česte potrebe za randomizacijom i prikrivanjem identiteta proizvoda i povećanog rizika od unakrsne kontaminacije i mešanja proizvoda. Takođe, može postojati nedovoljno znanja o jačini i toksičnosti leka, nedostatak potpune validacije procesa ili se mogu ispitivati registrovani lekovi koji su prepakovani ili modifikovani na neki način. Ovakvim izazovima može da odgovori osoblje sa temeljnim poznavanjem i obukom o primeni dobre proizvođačke prakse u proizvodnji lekova namenjenih za kliničko ispitivanje. Neophodna je saradnja sa sponzorima kliničkih ispitivanja koji preuzimaju krajnju odgovornost za sve aspekte kliničkog ispitivanja uključujući i kvalitet lekova namenjenih za kliničko ispitivanje. Povećana složenost proizvodnih postupaka zahteva izuzetno delotvoran sistem kvaliteta.
Ovaj aneks sadrži i uputstva o naručivanju, dostavljanju i povraćaju lekova koji se klinički ispituju, koja su međusobno povezana i u skladu sa Smernicom dobre prakse u kliničkom ispitivanju.
Lekovi koji nisu namenjeni za kliničko ispitivanje*
Učesnicima u ispitivanju mogu da se dostave i proizvodi koji nisu namenjeni za kliničko ispitivanje, placebo ili komparativni proizvodi. Ovi proizvodi se koriste kao pomoćni ili lekovi za preventivnu, u dijagnostičke ili terapijske svrhe i/ili treba da obezbede pružanje adekvatne medicinske nege ispitaniku. Oni takođe, u skladu sa protokolom, mogu da se koriste kako bi izazvali fiziološki odgovor. Ovi proizvodi se ne smatraju lekovima namenjenim za kliničko ispitivanje i može ih dostaviti sponzor ili istraživač. Sponzor treba da obezbedi da su oni u skladu sa odobrenjem za sprovođenje kliničkog ispitivanja, da su odgovarajućeg kvaliteta u svrhe ispitivanja uzimajući u obzir poreklo materijala, bez obzira da li su ili nisu registrovani, ili su prepakovani. Za ovakve odluke neophodno je uključivanje Kvalifikovanog lica.
Dozvola za stavljanje leka u promet i rekonstituisanje
Celokupan proces ili delovi procesa proizvodnje lekova namenjenih za kliničko ispitivanje, kao i razni procesi deljenja, pakovanja i obeležavanja su predmet odobrenja u skladu sa članom 13(1) Direktive 2001/20/EC i članom 9(1) Direktive 2005/28/EC. Međutim, ovo odobrenje se ne zahteva za rekonstituisanje pod uslovima propisanim u članu 9(2) Direktive 2005/28/EC. U svrhu ove odredbe rekonstituisanje se može smatrati kao jednostavan proces:
- rastvaranja ili dispergovanja leka namenjenog za kliničko ispitivanje radi primene leka na ispitaniku,
- ili, razblaživanje ili mešanje leka namenjenog za kliničko ispitivanje sa nekom drugom supstancom koja se koristi kao pomoćno sredstvo za njegovo davanje.
Rekonstituisanje nije mešanje nekoliko sastojaka, uključujući aktivnu supstancu, radi proizvodnje leka namenjenog za kliničko ispitivanje.
Lek namenjen za kliničko ispitivanje mora da postoji pre procesa definisanog kao rekonstituisanje.
Rekonstituisanje treba da se izvrši neposredno pre davanja leka.
Ovaj proces treba da bude definisan u zahtevu za odobravanje kliničkog ispitivanja/dosijeu leka namenjenog za kliničko ispitivanje i protokolu kliničkog ispitivanja, ili sličnom dokumentu koji je dostupan na mestu kliničkog ispitivanja.
________
* Ostale informacije date
su u Uputstvu Evropske komisije o lekovima namenjenim za kliničko ispitivanje
(IMPs), kao i drugim lekovima koji se koriste tokom kliničkog ispitivanja.
Ispitivani proizvod
Farmaceutski oblik aktivne supstance ili placebo koji se ispituje ili sa kojim se ispitivana supstanca poredi u kliničkom ispitivanju, uključujući registrovan lek kada se on koristi ili finalno oblikuje (formulacija ili pakovanje) na drugačiji način od onoga koji je odobren u dozvoli za stavljanje u promet, kada se ispituje za novu neodobrenu indikaciju ili kada se ispitivanje sprovodi radi dobijanja više informacija o odobrenoj upotrebi leka.
Isporuka
Priprema lekova namenjenih za klinička ispitivanja za transport i otpremanje u skladu sa nalogom.
Istraživač u kliničkom ispitivanju
Istraživač je osoba odgovorna za sprovođenje kliničkog ispitivanja na mestu kliničkog ispitivanja. Ako kliničko ispitivanje sprovodi istraživački tim, jedan istraživač je odgovoran za rukovođenje timom istraživača i može se nazvati glavni istraživač.
Kliničko ispitivanje
Bilo koje sistematsko ispitivanje lekova na ljudima, s ciljem da se otkriju ili potvrde klinički, farmakološki i/ili drugi farmakodinamski efekti lekova koji se ispituju ili da se identifikuju neželjene reakcije na te lekove, i/ili da se ispitaju resorpcija, distribucija, metabolizam i izlučivanje lekova koji se ispituju, kako bi se ustanovila bezbednost ili efikasnost tih lekova.
Komparativni lek
Lek koji se ispituje ili lek za koji je izdata dozvola za stavljanje u promet (aktivna kontrola), ili placebo koji se koristi kao referentni lek u kliničkom ispitivanju.
Nalog
Nalog je zahtev za proizvodnju, pakovanje, odnosno isporuku određene količine pakovanja leka koji se ispituje.
Prikrivanje identiteta leka
Postupak kojim se obezbeđuje da jedna ili više strana uključenih u kliničko ispitivanje nema uvid u pripadnost ispitanika terapijskim grupama. Jednostruko slep pristup znači da ispitanik nema uvid u pripadnost terapijskim grupama, a dvostruko slepi pristup znači da uvid u pripadnost terapijskim grupama nemaju ispitanik/ispitanici, istraživač/istraživači, monitor/monitori, a u nekim slučajevima i osoba koja vrši obradu podataka u vezi sa kliničkim ispitivanjem. U odnosu na lekove namenjene kliničkom ispitivanju, slepo kliničko ispitivanje predstavlja namerno prikrivanje identiteta tih lekova, u skladu sa uputstvima sponzora. Otkrivanje označava postupak kojim se otkriva identitet "maskiranih" proizvoda.
Proizvođač / uvoznik leka namenjenog za kliničko ispitivanje
Nosilac dozvole za proizvodnju/uvoz iz člana 13(1) Direktive 2001/20/EC.
Proizvodni dosije leka
Referentna dokumentacija koja sadrži reference, odnosno upućivanje na dokumentaciju koja sadrži sve informacije neophodne za sastavljanje detaljnih pisanih uputstva za proizvodnju, pakovanje, metode kontrole kvaliteta, kriterijume za puštanje serija u promet i isporuku lekova namenjenih za kliničko ispitivanje.
Randomizacija
Postupak svrstavanja ispitanika u terapijsku ili kontrolnu grupu, korišćenjem elementa slučajnog izbora pri redosledu uključivanja, sa ciljem izbegavanja pristrasnosti istraživača.
Sponzor
Sponzor je pojedinac, preduzeće, organizacija ili institucija, koja snosi odgovornost za započinjanje, sprovođenje, i/ili finansiranje kliničkog ispitivanja.
Šifra randomizacije
Spisak na kome su naznačene terapije dodeljene svakom od lica koja se podvrgavaju kliničkom ispitivanju.
1. Sistem kvaliteta, osmišljen, uveden i odobren od strane proizvođača ili uvoznika, treba da bude opisan pisanim procedurama dostupnim sponzoru, uzimajući u obzir principe dobre proizvođačke prakse i druge smernice primenljive na lekove u fazi ispitivanja.
2. Specifikacije proizvoda i uputstva za proizvodnju mogu se menjati tokom faze razvoja leka, ali treba da se obezbedi puna kontrola i sledljivost tih izmena.
3. Svo osoblje uključeno u proizvodnju lekova namenjenih za kliničko ispitivanje treba da bude adekvatno obučeno u skladu sa zahtevima koji su specifični za ovu vrstu lekova.
Čak i u slučajevima kada je mali broj zaposlenih lica, odgovorno lice za proizvodnju i kontrolu kvaliteta treba da budu nezavisni, za svaku seriju leka namenjenog za kliničko ispitivanje.
4. Kvalifikovano lice za puštanje serije leka namenjenog za kliničko ispitivanje odgovorno je, pre svega, da obezbedi postojanje sistema koji ispunjavaju zahteve dobre proizvođačke prakse i treba da poseduje široko znanje iz oblasti farmaceutskog razvoja i procesa kliničkog ispitivanja. smernice za sertifikovanje/puštanje serije leka namenjenog za kliničko ispitivanje od strane Kvalifikovanog lica je dato u tačkama 38-41.
5. Toksičnost, jačina i senzibilizirajuća svojstva lekova u fazi ispitivanja nisu u potpunosti poznati, što povećava potrebu za smanjenjem na najmanju moguću meru svih rizika od unakrsne kontaminacije. Oprema i prostorije treba da budu tako projektovane, a metode ispitivanja i dozvoljene granične vrednosti nakon čišćenja treba da budu u skladu sa prirodom ovih rizika. Kada je to neophodno, kampanjska proizvodnja može biti prihvatljiva. Prilikom odabira sredstva za čišćenje treba da se vodi računa o rastvorljivosti lekovite supstance i ekscipijenasa.
Specifikacije i uputstva
6. Specifikacije (polaznih materijala, primarnog pakovnog materijala, međuproizvoda, poluproizvoda i gotovih proizvoda), proizvodne formule, uputstva za proizvodnju i uputstva za pakovanje treba da budu što je moguće razumljivije i u skladu sa fazom razvoja proizvoda. One tokom razvoja proizvoda treba periodično ponovo da se procenjuju i po potrebi ažuriraju. Svaka nova verzija treba da obuhvati najnovije podatke, korišćenu tehnologiju i zakonske i farmakopejske zahteve, uz pozivanje na prethodnu verziju, u odnosu na prethodna izdanja dokumentacije. Bilo kakva izmena treba da bude sprovedena prema pisanoj proceduri i sa naznakom uticaja sprovedenih promena na kvalitet proizvoda npr. na stabilnost i bioekvivalenciju.
7. Razlozi za izmene treba da budu zapisani, a uticaj tih izmena na kvalitet proizvoda i klinička ispitivanja koja su u toku treba da se ispita i dokumentuje.*
_______
* Uputstvo za izmene koje
zahtevaju odobravanje suštinske izmene IMP dosijea od strane nadležnih institucija,
data su u Smernici (CHMP - Komiteta za lekove za humanu upotrebu) o zahtevima
za dokumentaciju o hemijskom i farmaceutskom kvalitetu leka namenjenog za kliničko
ispitivanje.
Nalog
8. Nalog za proizvodnju i/ili pakovanje određenog broja jedinica leka za kliničko ispitivanje i/ili njihovu isporuku izdaje sponzor ispitivanja lično, ili se u njegovo ime izdaje, proizvođaču leka namenjenog za kliničko ispitivanje. Nalog treba da bude u pisanoj formi (iako može da se pošalje elektronskim putem) i dovoljno precizan kako bi se izbegla bilo kakva dvosmislenost. Nalog treba da bude zvanično odobren i da upućuje na proizvodni dosije leka i u odgovarajućem slučaju na određeni protokol kliničkog ispitivanja.
Proizvodni dosije leka
9. Proizvodni dosije leka (videti rečnik) treba neprestano da se ažurira u skladu sa razvojem proizvoda, uz obezbeđivanje sledljivosti u odnosu na prethodne verzije. Dosije treba da obuhvati reference ili da upućuje na sledeća dokumenta:
- Specifikacije i metode ispitivanja polaznih i materijala za pakovanje međuproizvoda, proizvoda u bulk-u i gotovih proizvoda,
- Proizvodne postupke,
- Procesnu kontrolu i metode,
- Primerak odobrene etikete,
- Relevantne protokole kliničkog ispitivanja i šifre randomizacije,
- Relevantne ugovore o poslovno tehničkoj saradnji sa davaocima ugovora,
- Podatke o stabilnosti,
- Uslove čuvanja i transporta.
Spisak pobrojanih dokumenata nije konačan i nepromenljiv. Sadržina spiska može da se menja u zavisnosti od vrste proizvoda i faze razvoja proizvoda. Ove informacije treba da predstavljaju osnovu za procenu i sertifikovanje/puštanje određene serije proizvoda od strane Kvalifikovanog lica i stoga treba da mu budu dostupne. U slučaju kada se različite faze proizvodnje obavljaju na različitim mestima proizvodnje pod odgovornošću različitih Kvalifikovanih lica, prihvatljivo je voditi odvojene dosijee sa informacijama od značaja za aktivnosti na pojedinačnim mestima proizvodnje.
Proizvodna formula i uputstva za proizvodnju
10. Za svaki proizvodni postupak ili isporuku treba da postoji jasno i odgovarajuće pisano uputstvo i zapisi. U slučaju kada proizvodni postupak nije ponovljiv, tada nije potrebno izraditi Glavnu formulu i uputstvo za proizvodnju. Zapisi su naročito važni za pripremu konačne verzije dokumenata koji će se koristiti u rutinskoj proizvodnji nakon dobijanja dozvole za stavljanje leka u promet.
11. Informacije iz proizvodnog dosijea leka treba da se koriste za izradu detaljnih pisanih uputstava za proizvodnju, pakovanje, kontrolu kvaliteta, uslove čuvanja i transporta.
Uputstvo za pakovanje
12. Lekovi namenjeni za kliničko ispitivanje se obično pakuju pojedinačno za svakog ispitanika uključenog u kliničko ispitivanje. Broj jedinica leka koje treba zapakovati treba da bude određen pre početka pakovanja, uzimajući u obzir i broj jedinica leka potrebnih za ispitivanje kvaliteta, kao i broj kontrolnih uzoraka leka koji će se čuvati. Da bi se obezbedila tačna količina svakog leka koji je potreban, na kraju svake faze proizvodnje treba da se vrši obračun dobijenih i teorijskih prinosa.
Evidencije o proizvodnji i pakovanju serije leka
13. Zapisi o svakoj operaciji tokom proizvodnje i pakovanja serije leka treba da se vode detaljno kako bi mogao precizno da se sledi redosled postupaka. Evidencije treba da sadrže sve važne napomene koje opravdavaju korišćene postupke i svaku izvršenu izmenu, treba da doprinesu povećanju nivoa znanja o proizvodu i da omoguće poboljšanje proizvodnih postupaka.
14. Evidencije o proizvodnji i pakovanju serije leka treba da se čuvaju najmanje tokom perioda propisanog u Direktivi 2003/94/EC.
Materijal za pakovanje
15. Specifikacije i ispitivanje kvaliteta treba da obuhvate mere zaštite od nenamernog otkrivanja identiteta proizvoda zbog različitog izgleda materijala za pakovanje kod različitih serija.
Proizvodni postupak
16. Tokom faze razvoja leka treba da se odrede kritični parametri, a procesna kontrola treba da se sprovodi prvenstveno u cilju kontrole procesa. Privremeni procesni parametri i parametri procesne kontrole mogu se odrediti na osnovu prethodnih iskustava, uključujući i iskustva iz ranih faza razvoja leka. Ključno osoblje treba da obrati posebnu pažnju pri izradi neophodnih uputstava o proizvodnim postupcima, kao i njihovog stalnog prilagođavanja u skladu sa novim iskustvima stečenim u toku proizvodnje. Određivanje i kontrola parametara treba da se bazira na znanju koje je dostupno u tom trenutku.
17. U toku faze razvoja leka, proizvodni postupci ne treba da budu validirani u obimu koji je neophodan za rutinsku proizvodnju, ali je neophodna validacija/kvalifikacija prostorija i opreme. Kod sterilnih proizvoda, validacija procesa sterilizacije treba da bude izvršena po istim standardima kao za registrovane lekove. Isto tako, kada se to zahteva, uz poštovanje naučnih principa i tehnika koje su definisane u smernicama odgovarajućim za ovu oblast, treba da se dokaže inaktivacija/uklanjanje virusa i drugih nečistoća biološkog porekla, da bi se osigurala bezbednost biotehnološki dobijenih proizvoda.
18. Validacija aseptičnih postupaka predstavlja poseban problem kada se proizvodi mala serija; u takvim slučajevima broj aseptično napunjenih jedinica može istovremeno da bude i maksimalan broj proizvedenih jedinica proizvoda. Ako je to izvodljivo u praksi, u toku simulacije procesa, treba napuniti veći broj jedinica hranljivom podlogom kako bi se obezbedila veća pouzdanost dobijenih rezultata. Punjenje i zatvaranje kontejnera se često obavlja ručno ili poluautomatski što u velikoj meri predstavlja opasnost po sterilnost, tako da je neophodno posvetiti veću pažnju obuci operatera i validirati aseptične postupke pojedinačnih operatera.
Principi primenjivi na komparativni lek
19. Ukoliko se za potrebe kliničkog ispitivanja menja lek za koji je izdata dozvola za stavljanje u promet, treba da budu dostupni podaci (npr. stabilnost, komparativna rastvorljivost, bioraspoloživost) koji potvrđuju da ove promene ne menjaju značajno prvobitne karakteristike kvaliteta proizvoda.
20. Rok upotrebe komparativnog leka, naznačen na njegovom originalnom pakovanju, je odgovarajući samo za lek u tom pakovanju i ne mora biti primenljiv za lek kada je on prepakovan u drugo unutrašnje pakovanje koje ne pruža jednaku zaštitu ili nije kompatibilno sa proizvodom. Rok upotrebe komparativnog leka, uzimajući u obzir prirodu proizvoda, karakteristike unutrašnjeg pakovanja i uslove čuvanja proizvoda, treba da odredi sponzor ili to treba da bude određeno u njegovo ime. Rok upotrebe mora da bude potvrđen i ne može da bude duži od roka naznačenog na originalnom pakovanju. Rok upotrebe treba da bude kompatibilan sa trajanjem kliničkog ispitivanja.
Postupci prikrivanja, odnosno maskiranja identiteta leka
21. Potrebno je uspostaviti sistem koji omogućava otkrivanje identiteta "maskiranih" proizvoda kada je to potrebno, uključujući i broj serije proizvoda pre prikrivanja identiteta leka. Takođe, u hitnom slučaju treba da se omogući brza identifikacija proizvoda.
Šifra randomizacije
22. Procedure treba da opisuju nastanak, zaštitu, distribuciju, rukovanje i čuvanje svake šifre randomizacije koja se koristi pri pakovanju leka koji se ispituje, kao i mehanizme za otkrivanje šifara. Treba da se vode odgovarajući zapisi.
Postupak pakovanja
23. Tokom pakovanja lekova koji se ispituju nekada je neophodno istovremeno rukovati različitim proizvodima na istoj liniji za pakovanje. Rizik od zamene proizvoda mora da se svede na minimum, korišćenjem odgovarajućih procedura i/ili specijalne opreme uz odgovarajuću obuku osoblja.
24. Postupak pakovanja i obeležavanja lekova koji se ispituju je mnogo složeniji i podložniji greškama (koje je teže otkriti) nego kod registrovanih lekova, a naročito u slučaju kada se koriste "maskirani" proizvodi sličnog izgleda. Neophodno je pojačati mere opreza u cilju sprečavanja pogrešnog obeležavanja i to obračunom broja etiketa, proverom raščišćenosti linije za pakovanje i procesnom kontrolom koju obavlja adekvatno obučeno osoblje.
25. Pakovanje mora da obezbedi da lek koji se ispituje ostane u nepromenjenom stanju u toku transporta i skladištenja na drugim prelaznim lokacijama. Svaki pokušaj otvaranja ili oštećenja spoljašnjeg pakovanja treba da bude uočen i evidentiran.
Obeležavanje
26. U tabeli 1. rezimirane su odredbe čl. 26-30. ovog aneksa. Obeležavanje treba da bude u skladu sa zahtevima Direktive 2003/94/EC koja je dopunjena odredbama za lekove namenjene za kliničko ispitivanje. Etikete treba da sadrže sledeće informacije, osim ako njihovo izostavljanje može da se opravda npr. korišćenjem centralizovanog elektronskog sistema randomizacije:
a) ime, adresu i broj telefona sponzora, ugovorne istraživačke organizacije za kliničko ispitivanje ili istraživača (kontakt za informacije o leku, kliničkom ispitivanju i hitnom otkrivanju šifre randomizacije);
b) farmaceutski oblik leka, način primene, pojedinačne doze, a u slučaju otvorenog ispitivanja naziv/identifikaciju leka i dozu/jačinu;
c) broj/šifru serije koja identifikuje proizvod i postupak pakovanja;
d) referentnu šifru protokola ispitivanja koja omogućava identifikaciju ispitivanja, mesta kliničkog ispitivanja leka, istraživača i sponzora, ako ti podaci nisu prikazani na drugom mestu;
e) identifikacioni broj ispitanika/terapije i u odgovarajućem slučaju broj posete lekara;
f) ime istraživača (ako nije navedeno pod (a) ili (d));
g) uputstvo za upotrebu (moguće je upućivanje na uputstvo ili drugi odgovarajući dokument koji opisuje način upotrebe, namenjen ispitaniku ili licu koje ispitaniku daje lek);
h) oznaku "samo za upotrebu u kliničkom ispitivanju" ili sličnu frazu;
i) uslove čuvanja leka;
j) rok upotrebe (upotreba do određenog datuma, datum isteka roka upotrebe ili, u odgovarajućem slučaju datuma retestiranja) nedvosmisleno označen u formi mesec/godina;
k) napomenu "čuvati van domašaja dece", osim za lekove koji se ispituju u bolničkim uslovima.
27. Adresa i broj telefona glavne kontakt-osobe za informacije o proizvodu, kliničkom ispitivanju ili za svrhe hitnog otkrivanja šifre randomizacije ne moraju da budu naznačeni na etiketi kada su ispitaniku dati ovi podaci u pisanoj formi i kada mu je naloženo da ove informacije uvek ima kod sebe.
28. Podaci treba da budu napisani na službenom jeziku zemlje u kojoj se ispitivanje sprovodi. Podaci navedeni u tački 26. u odgovarajućem slučaju da se nalaze na unutrašnjem i spoljnjem pakovanju (osim u slučajevima opisanim u tačkama 29. i 30.). Propisan sadržaj etikete na unutrašnjem i spoljnjem pakovanju rezimiran je u tabeli 1. Informacije mogu da budu napisane i na drugim jezicima.
29. Kada se ispitaniku, ili licu koje daje lek, lek dostavlja u unutrašnjem pakovanju zajedno sa spoljnjim pakovanjem na kojem se nalaze informacije iz tačke 26, na unutrašnjem pakovanju (ili sredstvu za doziranje koje je sastavni deo unutrašnjeg pakovanja) treba da budu navedeni sledeći podaci:
a) ime sponzora, ugovorne istraživačke organizacije za sprovođenje ispitivanja ili istraživača;
b) farmaceutski oblik leka, način primene (može da se izostavi za čvrste farmaceutske oblike za oralnu upotrebu), pojedinačnu dozu i u slučaju otvorenog ispitivanja naziv/identifikaciju leka i dozu/jačinu;
c) broj/šifru serije leka radi identifikovanja proizvoda i postupka pakovanja;
d) referentnu šifru protokola ispitivanja koja omogućava identifikovanje ispitivanja, mesta gde se sprovodi ispitivanje, istraživača i sponzora, ako ti podaci nisu prikazani na drugom mestu;
e) identifikacioni broj ispitanika/terapije i u odgovarajućem slučaju broj posete lekara.
30. Ako je unutrašnje pakovanje u obliku blistera ili malih pojedinačnih jedinica pakovanja kao što su ampule, na kojima se podaci iz tačke 26. ne mogu prikazati, tada na spoljnjem pakovanju treba da se obezbedi etiketa sa navedenim podacima. Unutrašnje pakovanje treba da sadrži bar sledeće informacije:
a) ime sponzora, ugovorne istraživačke organizacije angažovane za sprovođenje ispitivanja ili istraživača;
b) način primene (može da se izostavi za čvrste farmaceutske oblike za oralnu upotrebu) i u slučaju otvorenog ispitivanja naziv/identifikaciju leka i dozu/jačinu;
c) broj/šifru serije leka radi identifikovanja proizvoda i postupka pakovanja;
d) referentnu šifru protokola ispitivanja koja omogućava identifikovanje ispitivanja, mesta gde se sprovodi ispitivanje, istraživača i sponzora, ako ti podaci nisu prikazani na drugom mestu;
e) identifikacioni broj ispitanika/terapije i u odgovarajućem slučaju broj posete lekara.
31. U cilju pojašnjenja pomenutih informacija mogu da se koriste simboli i piktogrami. Dodatne informacije, upozorenja i/ili uputstva za rukovanje takođe se mogu prikazati.
32. Za klinička ispitivanja sa karakteristikama određenim u članu 14. Direktive 2001/20/EC, treba da se dodaju sledeći podaci na originalan kontejner, ali se time originalna etiketa ne sme učiniti nejasnom:
i) ime sponzora, ugovorne istraživačke organizacije angažovane za sprovođenje ispitivanja ili istraživača;
ii) referentnu šifru protokola ispitivanja koja omogućava identifikovanje mesta ispitivanja, istraživača i ispitanika.
33. Ako je neophodno da se promeni rok upotrebe leka za kliničko ispitivanje, on treba da se obeleži dodatnom etiketom. Ova dodatna etiketa treba da sadrži novi rok upotrebe i ponovljeni broj serije. Ona može da bude stavljena preko starog roka upotrebe, ali zbog kontrole kvaliteta, ne sme da pokriva originalni broj serije. Ovaj postupak dodatnog obeležavanja može da se izvodi na odobrenom mestu proizvodnje. Međutim, kada je to opravdano, ovaj postupak može da se izvrši na mestu kliničkog ispitivanja leka pod nadzorom farmaceuta iz tima koji sprovodi kliničko ispitivanje ili drugog medicinskog stručnjaka u skladu sa nacionalnim propisima. U slučajevima kada ovo nije moguće, postupak dodatnog obeležavanja može da izvrši monitor kliničkog ispitivanja koji je odgovarajuće za to obučen. Postupak treba da se izvrši u skladu sa principima dobre proizvođačke prakse, specifičnim i standardnim operativnim procedurama, kao i u skladu sa ugovorom ako je to primenljivo i postupak treba da proveri drugo lice. Ovo dodatno obeležavanje treba da bude dokumentovano kako u dokumentaciji o sprovođenju kliničkog ispitivanja tako i u dokumentaciji o proizvodnji serije leka namenjenog za kliničko ispitivanje.
34. S obzirom da proizvodni procesi nisu standardizovani i u potpunosti validirani, kontrola kvaliteta gotovog proizvoda je od posebnog značaja za obezbeđivanje usaglašenosti svake pojedinačne serije sa specifikacijom.
35. Kontrola kvaliteta treba da se obavlja u skladu sa Proizvodnim dosijeom leka i u skladu sa informacijama objavljenim u članu 9(2) Direktive 2001/20/EC. Treba da se izvrši i evidentira potvrđivanje efektivnosti prikrivanja, odnosno maskiranja identiteta proizvoda.
36. Uzorci se čuvaju iz dva razloga: prvi - da bi se obezbedio uzorak za potrebe kontrole kvaliteta i drugi da bi se obezbedio rezervni uzorak gotovog proizvoda. Zbog navedenih razloga uzorci mogu da budu:
Referentni uzorci: uzorak serije polaznog materijala, materijala za pakovanje, proizvoda u primarnom pakovanju ili gotovog proizvoda koji se čuva radi kontrole kvaliteta ukoliko za tim bude potrebe. U slučaju kada njihova stabilnost to dozvoljava, treba da se čuvaju i referentni uzorci iz kritičnih faza proizvodnje (npr. oni koje je potrebno laboratorijski ispitati i odobriti za dalju upotrebu), ili uzorci međuproizvoda koji su isporučeni na mesto van kontrole proizvođača.
Kontrolni uzorci: uzorak upakovanog gotovog proizvoda za svaku seriju pakovanja leka/fazu ispitivanja. Ovi uzorci se čuvaju za potrebe identifikacije. Na primer, izgleda, pakovanja, obeležavanja, uputstva, broja serije leka, roka upotrebe, ako se pojavi potreba za tim tokom roka upotrebe date serije.
U većini slučajeva referentni i kontrolni uzorci su identični, odnosno čuvaju se kao potpuno upakovane jedinice pakovanja leka. U tim slučajevima referentni i kontrolni uzorci se mogu smatrati međusobno zamenljivim. Referentni i kontrolni uzorci svake serije leka koji se ispituje, uključujući i "maskirane" proizvode, treba da se čuvaju najmanje dve godine nakon završetka ili zvaničnog prekida poslednjeg kliničkog ispitivanja u kome je korišćena ta serija, u zavisnosti od toga šta je od ovog duže.
Potrebno je razmotriti mogućnost čuvanja kontrolnih uzoraka sve dok se pripremi završni izveštaj o kliničkom ispitivanju, kako bi se omogućilo potvrđivanje identiteta proizvoda u slučaju istrage nekonzistentnosti rezultata kliničkog ispitivanja, kao deo istrage u vezi sa tim.
37. Mesto čuvanja referentnih i kontrolnih uzoraka treba da bude definisano ugovorom zaključenim između sponzora i proizvođača, kao i da bude omogućen pristup nadležnim institucijama, u bilo koje vreme.
Referentni uzorci gotovog proizvoda treba da se čuvaju u zemlji u okviru EEA ili u trećoj zemlji za koju je Evropska zajednica uspostavila odgovarajuće sporazume sa zemljom izvoznicom, kako bi se obezbedilo da proizvođač leka namenjenog za kliničko ispitivanje primenjuje standarde dobre proizvođačke prakse koji su najmanje ekvivalentni standardima važećim u EU. U izuzetnim slučajevima referentni uzorci gotovog proizvoda mogu da se čuvaju kod proizvođača u nekoj drugoj zemlji, u kom slučaju to treba da se opravda i dokumentuje u ugovoru zaključenom između sponzora, uvoznika iz zemlje u okviru EEA i proizvođača iz treće zemlje.
Količina referentnog uzorka treba da bude dovoljna da, bar u dva navrata, omogući celokupno laboratorijsko ispitivanje te serije, u skladu sa dosijeom leka namenjenog za kliničko ispitivanje (IMP) priloženim u postupku izdavanja odobrenja za kliničko ispitivanje.
U slučaju kontrolnih uzoraka, prihvatljivo je čuvanje informacija o finalnom pakovanju kao pisani ili elektronski zapis, ako takav zapis pruža dovoljno informacija i ako sistem ispunjava zahteve Aneksa 11.
38. Puštanje serije leka namenjenog za kliničko ispitivanje (videti tačku 43.) ne sme da bude izvršeno pre nego što Kvalifikovano lice potvrdi da su ispunjeni uslovi iz člana 13.3 Direktive 2001/20/EC (videti član 39). Kvalifikovano lice treba da uzme u obzir elemente navedene u tački 40. ovog aneksa.
39. Dužnosti Kvalifikovanog lica u vezi sa lekovima namenjenim za kliničko ispitivanje su uslovljene različitim okolnostima koje mogu da nastanu, a pomenute su u daljem tekstu. U tabeli 2. rezimirani su elementi koji se mogu smatrati najčešćim okolnostima:
a) i) Ako je lek proizveden u okviru EU, a nema dozvolu za stavljanje u promet na teritoriji EU, dužnosti Kvalifikovanog lica su utvrđene članom 13.3 (a) Direktive 2001/20/EC;
b) ii) Ako je lek poreklom iz prometa u okviru EU u skladu sa članom 80(b) Direktive 2001/83/EC i ima dozvolu za stavljanje u promet EU, bez obzira na mesto proizvodnje, dužnosti su iste kao gore navedene, međutim, obim sertifikovanja može da bude ograničen samo na garantovanje da su proizvodi u skladu sa zahtevom za odobrenje za sprovođenje kliničkog ispitivanja i svim kasnijim postupcima prikrivanja, odnosno maskiranja identiteta leka, kao i pakovanja i obeležavanja specifičnim za određeno kliničko ispitivanje. Obim Proizvodnog dosijea leka biće ograničen na sličan način (videti 9);
c) Ako je lek uvezen direktno iz treće zemlje, dužnosti Kvalifikovanog lica su utvrđene članom 13.3(b) Direktive 2001/20/EC. Kada je lek koji je namenjen za kliničko ispitivanje uvezen iz treće zemlje, a predmet je sporazuma između EZ i te zemlje, npr. Sporazum o uzajamnom priznavanju, primenjuju se ekvivalentni standardi dobre proizvođačke prakse pod uslovom da se takav sporazum odnosi na lek koji je u pitanju. Kada ne postoji Sporazum o uzajamnom priznavanju, Kvalifikovano lice treba da utvrdi da se primenjuju ekvivalentni standardi dobre proizvođačke prakse na osnovu poznavanja sistema kvaliteta proizvođača leka. Ovo poznavanje se po pravilu stiče kroz proveru (audit) sistema kvaliteta proizvođača. U svakom slučaju, Kvalifikovano lice može da izda potvrdu na osnovu dokumentacije koju je dostavio proizvođač iz treće zemlje (videti 40);
d) Za uvezene komparativne lekove, gde se ne može dobiti adekvatno uverenje radi potvrđivanja da je svaka serija proizvedena u skladu sa ekvivalentnim standardima dobre proizvođačke prakse, dužnost Kvalifikovanog lica je definisana u članu 13.3(c) Direktive 2001/20/EC.
40. Procena svake serije leka radi sertifikovanja pre puštanja može da obuhvata:
- dokumentaciju o proizvodnji serije, uključujući izveštaje o kontroli, zapise o procesnoj kontroli i izjavu o puštanju serije koja potvrđuje usklađenost sa proizvodnim dosijeom leka, nalog, protokol i šifru randomizacije. Ova dokumentacija treba da bude overena od strane ovlašćenih lica i treba da obuhvati sva odstupanja ili planirane izmene, kao i sve kasnije dodatne provere ili ispitivanja o kojima se, u skladu sa sistemom kvaliteta, vode zapisi;
- uslove proizvodnje;
- validacioni status postrojenja, procesa i metoda;
- kontrolu kvaliteta gotovog proizvoda;
- rezultate svake analize ili ispitivanja obavljenog nakon uvoza;
- kada je to primenljivo;
- izveštaje o stabilnosti;
- poreklo i potvrdu uslova skladištenja i transporta;
- izveštaje provere (audit) sistema kvaliteta proizvođača;
- dokumenta kojima se potvrđuje da proizvođač ima dozvolu za proizvodnju lekova za kliničko ispitivanje ili komparativnih lekova namenjenih izvozu, izdata od strane nadležnih organa zemlje izvoza;
- u odgovarajućem slučaju, zakonom propisane uslove za izdavanje dozvole za stavljanje leka u promet, primenljive standarde dobre proizvođačke prakse i sve zvanične potvrde o usklađenosti sa dobrom proizvođačkom praksom;
- sve druge faktore koje Kvalifikovano lice treba da zna, a od značaja su za kvalitet serije leka.
Važnost pomenutih elemenata zavisi od zemlje porekla proizvoda, proizvođača i statusa leka (ima ili nema dozvolu za stavljanje u promet u EU ili trećoj zemlji) kao i od faze razvoja proizvoda. Sponzor treba da obezbedi da su elementi koje je Kvalifikovano lice uzelo u obzir prilikom sertifikovanja/puštanja serije leka usklađeni sa informacijama shodno članu 9(2) Direktive 2001/20/EC. Videti takođe tačku 44.
41. Kada se lekovi namenjeni za kliničko ispitivanje proizvode i pakuju na različitim mestima, pod nadzorom različitih Kvalifikovanih lica, treba da se poštuju preporuke navedene u Aneksu 16. Smernice dobre proizvođačke prakse, ako su primenljive.
42. Kada se pakovanje ili obeležavanje, ako je to dozvoljeno nacionalnim propisima, izvodi na mestu kliničkog ispitivanja pod nadzorom farmaceuta iz tima za kliničko ispitivanje ili drugog medicinskog stručnjaka kome je to dozvoljeno u skladu ovim propisima, nije neophodno da Kvalifikovano lice potvrdi pomenute postupke. Sponzor je odgovoran za obezbeđivanje adekvatnog dokumentovanja sprovedenog postupka i izvođenja u skladu sa načelima Smernice dobre proizvođačke prakse i u vezi sa tim treba da potraži savet Kvalifikovanog lica.
43. Lekovi namenjeni za kliničko ispitivanje treba da budu pod kontrolom sponzora sve do završetka dvostepene procedure: sertifikovanja serije leka od strane Kvalifikovanog lica i odobrenja za upotrebu u kliničkom ispitivanju od strane sponzora nakon ispunjenja uslova iz člana 9. (početak kliničkog ispitivanja) Direktive 2001/20/EC. Obe faze dvostepene procedure treba da se evidentiraju* i zapisi čuvaju u odgovarajućem dosijeu o kliničkom ispitivanju, koje vodi sponzor ili se vodi u njegovo ime. Sponzor treba da obezbedi da su detalji koji su navedeni u zahtevu za odobrenje kliničkog ispitivanja i razmotreni od strane Kvalifikovanog lica, u skladu sa onim koji su konačno prihvaćeni od nadležnih institucija. Treba da se uspostave odgovarajući aranžmani za ispunjavanje ovog zahteva. Praktično, ovo se najbolje može postići kroz proceduru kontrole izmena Proizvodnog dosijea leka namenjenog za kliničko ispitivanje i definisanjem u ugovoru između Kvalifikovanog lica i sponzora.
44. Isporuka lekova namenjenih za kliničko ispitivanje treba da se izvrši u skladu sa uputstvima u nalogu za isporuku koje daje sponzor, ili onaj koga je sponzor odredio da to uradi u njegovo ime.
45. Način dekodiranja treba da bude dostupan ovlašćenim osobama, pre nego što se lekovi namenjeni za kliničko ispitivanje dostave na mesto kliničkog ispitivanja.
46. Treba da se vodi detaljna lista isporuka koje je izvršio proizvođač ili uvoznik. Liste isporuka naročito treba da sadrže navedene adrese svih primaoca isporuka.
47. Prenos lekova koji se ispituju sa jednog na drugo mesto ispitivanja treba da se obavlja samo u izuzetnim slučajevima. Takvi prenosi treba da budu predviđeni standardnom operativnom procedurom. Istorijat u vezi proizvoda kada je on van kontrole proizvođača, kroz npr. izveštaje o monitoringu ispitivanja i zapisi o uslovima skladištenja na mestu ispitivanja, treba da se razmotre u okviru procene podobnosti prenosa leka i tom prilikom treba da se traži savet Kvalifikovanog lica. Kada je potrebno izvršiti dodatno obeležavanje, proizvod treba da se vrati proizvođaču tog leka, ili drugom ovlašćenom proizvođaču, kao i Kvalifikovanom licu na ponovno sertifikovanje/puštanje. Neophodno je čuvati zapise o tim postupcima i obezbediti njihovu potpunu sledljivost.
_______
* usaglašena forma odluke
o sertifikovanju/puštanju serije leka za kliničko ispitivanje radi olakšavanja
prometa između zemalja članica dat je u prilogu 3.
48. Zaključke o sprovedenim istragama u vezi sa reklamacijama na kvalitet leka treba da razmotri proizvođač ili uvoznik sa sponzorom (ako nisu ista lica). Kvalifikovano lice i lica odgovorna za sprovođenje kliničkog ispitivanja treba da razmotre ove zaključke kako bi se procenio potencijalni uticaj na dalji tok ispitivanja, razvoja leka i uticaj na ispitanike.
Povlačenje
49. Procedure povlačenja leka koji se klinički ispituje, kao i dokumentovanje ovih povlačenja treba da utvrdi sponzor u saradnji sa proizvođačem ili uvoznikom (ako nisu u pitanju ista lica). Istraživač i monitor kliničkog ispitivanja treba da znaju svoje odgovornosti u okviru procedure povlačenja.
50. Sponzor treba da obezbedi da dobavljač komparativnog leka ili drugog leka koji će se koristiti u kliničkom ispitivanju poseduje sistem putem koga može da obavesti sponzora o potrebi povlačenja bilo kog od lekova koje je dostavio.
Povraćaj
51. Povraćaj lekova koji se klinički ispituju može da se izvrši pod uslovima koje je definisao sponzor, a koji su precizirani u odobrenim standardnim operativnim procedurama.
52. Vraćeni lekovi namenjeni za kliničko ispitivanje treba da budu jasno obeleženi kao takvi i da se čuvaju u odgovarajućem, namenskom prostoru pod kontrolom. Treba da se vode i čuvaju zapisi o povraćaju lekova.
53. Sponzor je odgovoran za uništavanje neupotrebljenih i/ili vraćenih lekova namenjenih za kliničko ispitivanje. Ovi lekovi se ne mogu uništavati bez pisanog odobrenja sponzora.
54. Sponzor treba da vodi zapise o obračunu količina isporučenih, iskorišćenih i vraćenih lekova, ili to treba uraditi u njegovo ime, za svako mesto ispitivanja i svaku fazu ispitivanja. Uništavanje neiskorišćenih lekova za kliničko ispitivanje treba da se obavi za svako mesto kliničkog ispitivanja i svaku fazu kliničkog ispitivanja, tek nakon što se sve neusaglašenosti količina istraže, obrazlože na odgovarajući način i nakon što je obračun količina upotrebljenog leka odobren. O uništavanju treba da se vode zapisi tako da svi postupci uništavanja budu opravdani u pogledu količina. Ove zapise treba da čuva sponzor.
55. Sponzoru treba da se dostavi potvrda sa datumom izvršenog uništavanja lekova za kliničko ispitivanje ili potvrda o prijemu lekova na uništavanje. Ovi dokumenti treba da omoguće sledljivost serije leka koji se ispituje i/ili brojeve ispitanika kao i stvarne količine leka koje su uništene.
Tabela 1. Obeležavanje pakovanja lekova za kliničko ispitivanje (tačke 26. do 30.)
(a) ime, adresa i broj telefona
sponzora, ugovorne istraživačke organizacije ili istraživača (glavni
kontakt za informacije o proizvodu, kliničkom ispitivanju i za hitno
otkrivanje); |
OPŠTI SLUČAJ podaci a26 do k UNUTRAŠNJE PAKOVANJE a28 b29 c d e UNUTRAŠNJE PAKOVANJE a27 b29,30 13 c d e |
Tabela 2: Puštanje serije proizvoda
ELEMENTI KOJI SE UZIMAJU U OBZIR31 |
PROIZVOD DOSTUPAN NA TRŽIŠTU EU |
PROIZVOD UVEZEN IZ TREĆE ZEMLJE |
|||
|
Proizvod je proizveden u EU, a nema dozvolu za stavljanje u promet |
Proizvod ima dozvolu za stavljanje u promet i dostupan je na tržištu EU |
Proizvod bez dozvole za stavljanje u promet u EU |
Proizvod ima dozvolu za stavljanje u promet u EU |
Komparativni lek, za koji dokumentacija koja potvrđuje da je svaka serija proizvedena u skladu sa uslovima koji su bar ekvivalentni uslovima datim u Direktivi 2003/94/EC, ne može da se dobije |
PRE POSTUPKA KLINIČKOG ISPITIVANJA |
|
||||
a) uslovi transporta i skladištenja |
DA |
||||
b) svi relevantni faktori32 koji pokazuju da je svaka serija proizvedena i puštena u skladu sa: Direktivom 2003/94/EC, ili standardima dobre proizvođačke prakse koji su bar ekvivalentni standardima utvrđenim u Direktivi 2003/94/EC |
DA - |
|
DA33 |
|
|
c) Dokumentacija koja pokazuje da je svaka serija puštena u okviru EU u skladu sa zahtevima EU GMP (videti Direktivu 2001/83/EC, član 51.), ili dokumentacija koja pokazuje da je proizvod dostupan na tržištu EU i da je nabavljen u skladu sa članom 80(b) Direktive 2001/83/EC |
|
DA |
|
||
d) Dokumentacija koja pokazuje da su ispunjeni propisani zakonski uslovi za dobijanje dozvole za stavljanje u promet u zemlji proizvođača i dokumentacija koja pokazuje da je proizvod dostupan na tržištu u toj zemlji |
|
DA |
|||
e) Rezultati svih analiza, testova i provera izvršenih da bi se procenio kvalitet uvezenih serija u skladu sa: dozvolom za stavljanje u promet (videti Direktivu 2001/83/EC, član 51 b), ili |
|
- |
DA |
- |
|
Proizvodnim dosijeom leka, nalogom, postupkom podnošenja regulatornim organima na osnovu člana 9.2. |
|
DA |
- |
DA |
|
Kada ove analize i testovi nisu izvršeni u EU, onda to mora da se opravda, a Kvalifikovano lice mora da potvrdi da su one izvršene u skladu sa standardima GMP koji su bar ekvivalentni standardima utvrđenim u Direktivi 2003/94/EC. |
|
DA |
DA |
DA |
|
NAKON POSTUPKA KLINIČKOG ISPITIVANJA |
|||||
f) Pored procene pre postupka kliničkog ispitivanja, svi dalji bitni faktori32 koji pokazuju da je svaka serija proizvedena u svrhu slepog kliničkog ispitivanja, pakovanja specifičnog za kliničko ispitivanje, obeležavanja i testiranja su u skladu sa: |
DA |
|
|||
Direktivom 2003/94/EC, ili standardima dobre proizvođačke prakse koji su bar ekvivalentni standardima utvrđenim u Direktivi 2003/94/EC |
- |
DA33 |
|||
_______
26 Adresa i broj telefona
glavnog kontakta za informacije o proizvodu, kliničkom ispitivanju i za hitno
otkrivanje ne moraju da se naznače na etiketi kada je ispitaniku data kartica
koja sadrži ove podatke, a dato mu je uputstvo da ove podatke čuva kod sebe
sve vreme (tačka 27)
27 U slučaju kada spoljnje
pakovanje sadrži podatke navedene u tački 26.
28 Adresa i broj telefona
glavnog kontakta za informacije o proizvodu, kliničkom ispitivanju i za hitno
otkrivanje ne moraju da se naznače na etiketi
29 Način upotrebe može
da se izostavi za čvrste farmaceutske oblike za oralnu upotrebu
30 Farmaceutski oblik
i pojedinačna doza/jačina mogu da se izostave
31 U svim slučajevima
kada informacija, u skladu sa članom 9. (Direktive 2001/20/EC treba da bude
u skladu sa faktorima koje razmatra Kvalifikovano lice koje sertifikuje seriju
pre puštanja
32 Ovi faktori su rezimirani
u tački 40.
33 Kada se Sporazum o
uzajamnom priznavanju ili sličnim ugovorom kojim su obuhvaćeni ovi proizvodi,
priznaje da se primenjuju ekvivalentni standardi dobre proizvođačke prakse
[MEMORANDUM PROIZVOĐAČA]
SADRŽAJ SERTIFIKATA SERIJE
u skladu sa članom 13.3 Direktive 2001/20/EC
(1) Naziv (nazivi) leka(ova)/šifra(e) leka(ova), kako je navedeno u zahtevu za odobrenje kliničkog ispitivanja, gde je to primenljivo.
(2) EudraCT No (Eudra broj kliničkog ispitivanja) i broj protokola sponzora, kada je primenljivo.
(3) Jačina
Identitet (ime) i količina po jediničnoj dozi za sve aktivne supstance za sve lekove za kliničko ispitivanje IMP (uključujući placebo). Način na koji se navodi ova informacija ne sme da otkrije šifru ispitivanja.
(4) Dozni oblik (farmaceutski oblik)
(5) Veličina pakovanja (sadržaj primarnog pakovanja) i vrsta (npr. bočice, boce, blisteri).
(6) Broj serije
(7) Rok trajanja/datum retesta/upotrebe
(8) Ime i adresa proizvođača gde se nalazi Kvalifikovano lice koje izdaje ovaj sertifikat.
(9) Broj dozvole za proizvodnju za mesto navedeno u tački 8.
(10) Komentari/napomene
(11) Dodatne informacije koje QP smatra relevantnim.
(12) Izjava o sertifikovanju.
(13) "Ovim potvrđujem da ova serija odgovara zahtevima člana 13.3 Direktive 2001/20/EC"
(14) Ime QP koji potpisuje sertifikat
(15) Potpis
(16) Datum potpisivanja
Obrazloženje
Lekovi namenjeni za kliničko ispitivanje ne smeju da se koriste za kliničko ispitivanje u zemlji Evropske ekonomske zone pre okončanja dvostepene procedure u skladu sa tačkom 43. ovog aneksa. Prvi korak je sertifikovanje svake serije od strane Kvalifikovanog lica proizvođača ili uvoznika da je usklađena sa zahtevima člana 13.3(a),(b) ili (c) Direktive 2001/20/EC, što je dokumentovano u skladu sa članom 13.4 ove direktive. U skladu sa Direktivom 2001/20/EC serija leka namenjenog za kliničko ispitivanje neće biti podvrgnuta daljim kontrolama u skladu sa članom 13.3(a), (b) ili (c) ove direktive prilikom prometa između zemalja članica ako ima sertifikat za seriju potpisan od strane Kvalifikovanog lica (QP). U cilju olakšavanja slobodnog prometa lekova namenjenih za kliničko ispitivanje između zemalja članica, sadržaj ovih sertifikata treba da bude u skladu sa usaglašenom formom koja je data u prilogu 3. Ova forma može da se koristi za sertifikovanje serija namenjenih za upotrebu u zemlji proizvođača ili uvoznika koja je članica EU.
PROIZVODNJA LEKOVA DOBIJENIH IZ KRVI ILI KRVNE PLAZME HUMANOG POREKLA
Rečnik
Glavna dokumentacija o plazmi (PMF)
Glavna dokumentacija o plazmi (PMF), u skladu sa navedenim u Direktivi 2001/83/EC (Aneks I, deo III, br. 1.1.a) je zasebna dokumentacija, odvojena od dokumentacije za dozvolu za stavljanje leka u promet. Ona sadrži sve bitne, detaljne podatke o karakteristikama kompletne plazme humanog porekla korišćene kao polazni materijal i/ili sirovina za proizvodnju podfrakcija ili međufrakcija, sastojaka pomoćnih i aktivnih supstanci, koji su sastavni deo lekova ili medicinskih sredstava dobijenih iz krvi.
Komponenta krvi
Komponenta krvi, u skladu sa navedenim u Direktivi 2002/98/EC (Član 3b), je terapijska komponenta krvi (eritrociti, leukociti, trombociti i plazma) koja može da se pripremi različitim metodama.
Krv
Krv, u skladu sa navedenim u Direktivi 2002/98/EC (Član 3a), je puna krv prikupljena od davaoca i obrađena ili za transfuziju ili dalju proizvodnju.
Kvalifikovano lice (QP)
Kvalifikovano lice je lice u skladu sa navedenim u Direktivi 2001/83/EC (Član 48).
Lekovi dobijeni iz krvi ili plazme humanog porekla
Lekovi dobijeni iz krvi ili plazme humanog porekla, u skladu sa navedenim u Direktivi 2001/83/EC (član 1 broj 10), su lekovi na bazi komponenata krvi koji se proizvode industrijskim postupkom u državnim ili privatnim ustanovama.
Obrada
U skladu sa terminologijom Direktive 2005/62/EC, "obrada znači bilo koji korak u pripremi komponente krvi koji se sprovodi između prikupljana krvi i izdavanja komponente krvi", npr. razdvajanje i zamrzavanje komponenata krvi. Za potrebe ovog aneksa, obrada se dodatno odnosi i na postupke koji se sprovode u ustanovi ovlašćenoj za prikupljanje krvi, a koji su specifični za plazmu za frakcionisanje.
Odgovorno lice (RP)
Odgovorno lice je lice u skladu sa navedenim u Direktivi2002/98/EC (Član 9).
Plazma za frakcionisanje
Plazma za frakcionisanje, u monografiji Evropske farmakopeje navedena kao "Plazma humanog porekla za frakcionisanje" (0853), je tečni deo krvi humanog porekla koji ostaje nakon razdvajanja od ćelija krvi koja je prikupljena u epruvetu sa antikoagulansom ili koja je tokom afereze izdvojena kontinuiranom filtracijom ili centrifugiranjem krvi sa antikoagulansom; namenjena za proizvodnju lekova iz plazme, pre svega albumina, faktora koagulacije i imunoglobulina humanog porekla.
Proizvodi iz krvi
Proizvod iz krvi, u skladu sa navedenim u Direktivi 2002/98/EC (Član 3c), je terapijski proizvod dobijen iz iz krvi ili plazme humanog porekla.
Smernice dobre prakse
Smernice dobre prakse daju tumačenje standarda i specifikacija Evropske Zajednice koji su postavljeni u Aneksu Direktive 2005/62/EC i koji se odnose na sistem kvaliteta u ustanovama ovlašćenim za prikupljanje krvi.
Ugovor o programu frakcionisanja sa trećim zemljama
Ugovorno frakcionisanje na mestu za frakcionisanja/kod proizvođača u zemljama EU/EEA, kada se kao polazni materijal koristi materijal iz trećih zemalja, a dobijeni proizvodi nisu namenjeni za promet u zemljama EU/EEA.
Ustanova ovlašćena za prikupljanje krvi (blood establishment)
U skladu sa navedenim u Direktivi 2002/98/EC (Član 3e), bilo koja organizacija ili telo odgovorno za prikupljanje i testiranje krvi i komponenata krvi humanog porekla, bez obzira na njihovu namenu, kao i za obradu, skladištenje i distribuciju kada se koriste za transfuziju. Iako ova definicija ne obuhvata bolničke banke krvi, podrazumeva se da obuhvata centre u kojima se izvodi afereza.
Frakcionisanje, ustanova/mesto za frakcionisanje
Frakcionisanje je proces proizvodnje u ustanovi/mestu za frakcionisanje tokom koga se komponente plazme razdvajaju/prečišćavaju različitim fizičkim i hemijskim metodama kao što su precipitacija, hromatografija.
1.1 Odredbe ovog aneksa se primenjuju na lekove dobijene iz krvi ili plazme humanog porekla, frakcionisane ili uvezene u zemlje EU/EEA. Aneks se primenjuje i na polazni materijal (npr. plazma humanog porekla) za proizvodnju ovih lekova. U skladu sa uslovima postavljenim u Direktivi 2003/63/EC, zahtevi se primenjuju i na stabilne derivate krvi ili plazme humanog porekla (npr. albumin) koji su ugrađeni u medicinska sredstva.
1.2 Ovaj aneks definiše specifične zahteve dobre proizvođačke prakse (GMP) za obradu, skladištenje i transport plazme humanog porekla koja se koristi za frakcionisanje i proizvodnju lekova iz krvi ili plazme humanog porekla.
1.3 Ovaj aneks sadrži specifične odredbe koje se odnose na polazni materijal koji je uvezen iz trećih zemalja i na programe ugovornog frakcionisanja za potrebe treće zemlje.
1.4 Ovaj aneks se ne primenjuje na komponente krvi koje se koriste za transfuziju.
2.1 Lekovi dobijeni iz krvi ili plazme humanog porekla (i njihove aktivne supstance koje se koriste kao polazni materijal) moraju da budu u skladu sa principima i smernicama dobre proizvođačke prakse (utvrđenim u Direktivi 2003/94/EC i EU Smernicama o Dobroj proizvođačkoj praksi koje je objavila Evropska Komisija), kao i dozvolom za stavljanje leka u promet. Oni se smatraju biološkim lekovima, a polazni materijal sadrži biološke supstance kao što su ćelije ili tečnosti (uključujući krv ili plazmu) humanog porekla (Direktiva 2001/83/EC Aneks I deo 1, br. 3.2.1.1.b). Određene specifične osobine proizilaze iz biološke prirode izvornog materijala. Npr. agensi koji prenose bolesti, posebno virusi, mogu da kontaminiraju izvorni materijal. Stoga, kvalitet i bezbednost ovih proizvoda zavise od kontrole izvornog materijala i njegovog porekla, kao i od narednih proizvodnih postupaka uključujući testiranje markera infekcije, otklanjanje i inaktivaciju virusa.
2.2 Aktivne supstance koje se koriste kao polazni materijal za proizvodnju lekova moraju da budu u skladu sa principima i smernicama dobre proizvođačke prakse (videti tačku 2.1). Za prikupljanje i testiranje polaznog materijala dobijenog iz krvi i plazme humanog porekla, primenjuju se zahtevi definisani u Direktivi 2002/98/EC. Prikupljanje i testiranje moraju da se sprovedu u skladu sa odgovarajućim sistemom kvaliteta za koji su standardi i specifikacije definisani u Aneksu Direktive 2005/62/EC i protumačeni u smernicama dobre prakse iz člana 2(2) Direktive 2005/62/EC. Osim toga, zahtevi Direktive 2005/61/EC se odnose na sledljivost i na prijavljivanje ozbiljnih neželjenih reakcija i događaja od davaoca do primaoca. Dodatno treba da se razmotre i monografije Evropske farmakopeje (Direktiva 2001/83/EC, Aneks 1, deo III br. 1.1.b).
2.3 Polazni materijal za proizvodnju lekova dobijenih iz krvi ili plazme humanog porekla, koji je uvezen iz trećih zemalja i namenjen za upotrebu ili distribuciju u zemljama EU/EEA, mora da zadovoljava standarde jednake standardima Zajednice i specifikacijama sistema kvaliteta koji se odnosi na ustanove ovlašćene za prikupljanje krvi kako je navedeno u Direktivi Komisije 2005/62/EC (Uvodna izjava 6; član 2(3)); zahteve u pogledu sledljivosti i prijavljivanja ozbiljnih neželjenih reakcija i događaja kako je navedeno u Direktivi Komisije 2005/61/EC (Uvodna izjava 5; član 7); tehničke zahteve za krv i komponente krvi kako je navedeno u Direktivi Komisije 2004/33/EC (Uvodna izjava 4; član 2.3 Aneksa V).
2.4 U slučaju programa ugovornog frakcionisanja sa trećim zemljama, polazni materijal uvezen iz trećih zemalja mora da ispunjava zahteve kvaliteta i bezbednosti kako je utvrđeno u Direktivi 2002/98/EC i Aneksu B Direktive 2004/33/EC. Aktivnosti sprovedene u zemljama EU/EEA moraju u potpunosti da budu u skladu sa smernicama dobre proizvođačke prakse. Potrebno je razmotriti standarde i specifikacije Zajednice koji se odnose na sistem kvaliteta u ustanovama koje prikupljaju krv i koji su navedeni u Direktivi Komisije 2005/62/EC; zahteve u pogledu sledljivosti i prijavljivanja ozbiljnih neželjenih reakcija i događaja koji su navedeni u Direktivi Komisije 2005/61/EC; smernice i preporuke SZO navedene u dodatku ovog aneksa.
2.5 Za sve korake koji slede nakon prikupljanja i testiranja (npr. obrada, uključujući razdvajanje, zamrzavanje, skladištenje i transport do proizvođača) primenjuju se zahtevi Direktive 2001/83/EC i, prema tome, moraju da se sprovode u skladu sa principima i smernicama dobre proizvođačke prakse. Po pravilu, ove aktivnost se sprovode pod odgovornošću Kvalifikovanog lica (QP) nosioca dozvole za proizvodnju lekova. Kada se specifični proizvodni postupci u vezi sa frakcionisanjem plazme obavljaju u ustanovama ovlašćenim za prikupljanje krvi, specifično imenovanje Kvalifikovanog lica (QP) međutim, ne može da bude proporcionalno s obzirom na prisustvo i odgovornost Odgovornog lica (RP). Da bi se rešila ova konkretna situacija i kako bi se na odgovarajući način obezbedila zakonska odgovornost Kvalifikovanog lica, između mesta za frakcionisanje/proizvođača i ustanove ovlašćene za prikupljanje krvi treba da bude zaključen ugovor u skladu sa Poglavljem 7 Smernica dobre proizvođačke prakse, kojim su definisane odgovarajuće odgovornosti i detaljni zahtevi kako bi se obezbedila usaglašenost. Odgovorno lice (RP) u ustanovi ovlašćenoj za prikupljanje krvi i Kvalifikovano lice (QP) mesta za frakcionisanje/proizvođača (vidi 3.5) treba da budu uključeni u sačinjavanje ovog ugovora. Kvalifikovano lice (QP) treba da obezbedi vršenje provera (audit) kako bi se potvrdilo da ustanova ovlašćena za prikupljanje krvi postupa u skladu sa ugovorom.
2.6 Specifični zahtevi za dokumentaciju i druge postupke koji se odnose na polazni materijal za lekove dobijene iz plazme su definisani u Glavnoj dokumentaciji o plazmi (PMF).
3.1 Upravljanje kvalitetom treba da pokriva sve faze od selekcije dobrovoljnih davalaca do isporuke gotovog proizvoda. Za sve faze prikupljanja i testiranja krvi i plazme humanog porekla koja se koristi za proizvodnju lekova upućuje se na Direktivu 2005/61/EC o sledljivosti, uključujući i isporuku plazme u ustanovu/mesto za frakcionisanje, kao i na Direktivu 2005/62/EC.
3.2 Krv ili plazmu koji se koriste kao izvorni/polazni materijal za proizvodnju lekova moraju da prikupljaju ustanove ovlašćene za prikupljanje krvi i moraju da se testiraju u laboratorijama koje primenjuju sistem kvaliteta u skladu sa Direktivom 2005/62/EC, koje imaju dozvolu izdatu od strane nadležnih organa i koje podležu redovnom inspekcijskom nadzoru kako je navedeno u Direktivi 2002/98/EC. U skladu sa navedenim u Direktivi 2001/83/EC, proizvođač treba da obavesti nadležno telo EU o programu ugovornog farkcionisanja sa trećim zemljama.
3.3 Ako se plazma uvozi iz trećih zemalja, onda treba da se nabavlja od odobrenih dobavljača (npr. ustanove ovlašćene za prikupljanje krvi, uključujući eksterna skladišta). Oni treba da budu navedeni u specifikaciji polaznog materijala koja je ustanovljena na mestu za frakcionisanje/kod proizvođača, da budu prihvaćeni od strane nadležnih organa zemalja EU/EEA (npr. na osnovu sprovedenih inspekcija), kao i od strane Kvalifikovanog lica (QP) mesta za frakcionisanje u zemljama EU/EEA. Izdavanje sertifikata i odobravanje plazme (plazme za frakcionisanje) kao polaznog materijala, objašnjeni su u odeljku 6.8.
3.4 Kvalifikacija dobavljača, uključujući provere (audit), sprovodi se od strane mesta za frakcionisanje/proizvođača prema pisanim procedurama. Rekvalifikacija treba da se sprovodi u redovnim intervalima uzimajući u obzir pristup zasnovan na riziku.
3.5 Između mesta za frakcionisanje/proizvođača gotovog proizvoda i ustanove koja je ovlašćena za prikupljanje krvi, treba da bude zaključen pisani ugovor koji sadrži najmanje sledeće ključne elemente:
- definiciju dužnosti i odgovornosti,
- zahteve koji se odnose na sistem kvaliteta i dokumentaciju,
- kriterijume za odabir dobrovoljnih davalaca i testiranje,
- zahteve za separaciju krvi na komponente krvi/plazmu,
- zamrzavanje plazme,
- čuvanje i transport plazme,
- sledljivost i prikupljanje informacija (uključujući neželjene događaje).
Rezultati testova svih jedinica plazme iz ustanove koja je ovlašćena za prikupljanje krvi treba da budu dostupni mestu za frakcionisanje/proizvođaču leka. Takođe, bilo koji korak frakcionisanja koji je poveren treba da bude definisan u pisanom ugovoru.
3.6 Za planiranje, procenu i dokumentovanje svih izmena koje mogu da utiču na kvalitet i bezbednost proizvoda ili na sledljivost, treba da se uspostavi zvaničan sistem kontrole izmena. Potencijalni uticaj predloženih izmena treba da se procenjuje. Potrebno je da se odredi dodatno testiranje i validacija, a posebno inaktivacija i uklanjanje virusa.
3.7 Potrebno je da postoji adekvatna strategija o bezbednosti sa ciljem da se minimizira rizik od infektivnih agenasa i novijih infektivnih agenasa. Strategija treba da sadrži procenu rizika koja:
- definiše vreme zadržavanja u karantinu (interno vreme karantina) pre obrade plazme npr. za uklanjanja sledljivih (look back) jedinica34,
- uzima u obzir sve aspekte redukcije virusa i/ili testiranja na infektivne agense ili surogate,
- uzima u obzir mogućnost redukcije virusa, veličinu pula i druge važne aspekte procesa proizvodnje.
_______
34 Jedinice plazme, koje
su donirali davaoci donacija tokom određenog vremena (kako je definisano na
nacionalnoj/EU osnovi) pre nego što je pronađeno da je donacija od visoko rizičnog
davaoca donacije, trebalo bi isključiti iz obrade, npr. zbog pozitivnog rezultata
testa
4. Sledljivost i mere koje se preduzimaju nakon prikupljanja
4.1 Mora da se uspostavi sistem koji obezbeđuje sledljivost svake donacije, od davalaca donacije preko ustanove koja je ovlašćena za prikupljanje krvi do serije gotovog proizvoda i obrnuto.
4.2 Treba da se definišu odgovornosti za sledljivost proizvoda (ne sme da bude praznina):
- od davalaca donacije u ustanovi koja je ovlašćena za prikupljanje krvi do ustanove/mesta za frakcionisanje (ovo je odgovornost Odgovornog lica - RP u ustanovi koja prikuplja krv),
- od ustanove/mesta za frakcionisanje do proizvođača leka i bilo kog drugog objekta, proizvođača leka ili medicinskog sredstva (ovo je odgovornost Kvalifikovanog lica - QP).
4.3 Podaci potrebni za potpunu sledljivost moraju da se čuvaju najmanje 30 godina prema članu 4. Direktive 2005/61/EC i članu 14. Direktive 2002/98/EC.
4.4 Ugovori (pomenuti u tački 3.5) između ustanova koje su ovlašćene za prikupljanje krvi (uključujući i laboratorije koje vrše testiranje) i ustanove/mesta za frakcionisanje/proizvođača treba da osiguraju da sledljivost i mere koje se preduzimaju nakon prikupljanja, pokrivaju čitav lanac od prikupljanja plazme do svih proizvođača koji su odgovorni za puštanje u promet gotovog proizvoda.
4.5 Ustanove ovlašćene za prikupljanje krvi treba da obaveste ustanovu/mesto za frakcionisanje/proizvođača o svakom događaju koji može da utiče na kvalitet i bezbednost proizvoda, uključujući događaje navedene u Aneksu II delu A i Aneksu III delu A Direktive 2005/61/EC, kao i o drugim važnim informacijama dobijenim nakon prihvatanja davalaca donacije i odobravanja plazme, npr. sledljivih (look back) informacija35 (informacije nakon prikupljanja). Ako se ustanova/mesto za frakcionisanje nalazi u trećoj zemlji, informacija treba da se prosledi proizvođaču koji je odgovoran za puštanje u zemlje EU/EEA bilo kog proizvoda koji je proizveden iz plazme na koju se ove informacije odnose. U oba slučaja, ukoliko je važno za kvalitet ili bezbednost gotovog proizvoda, ova informacija treba da se prosledi nadležnom organu odgovornom za ustanovu/mesto za frakcionisanje /proizvođača.
4.6 Procedura za obaveštavanje opisana u tački 4.5 se, takođe, primenjuje kada nadležna inspekcija naloži povlačenje bilo koje važeće dozvole /odobrenja izdatog ustanovi ovlašćenoj za prikupljanje krvi.
4.7 Upravljanje prikupljenim informacijama treba da se opiše u okviru standardnih operativnih procedura uzimajući u obzir obaveze i procedure za informisanje nadležnih organa. Mere koje se preduzimaju nakon prikupljanja informacija treba da budu dostupne kako je definisano u važećoj verziji "Napomena za smernice za lekove dobijene iz plazme" (Note for Guidance on Plasma Derived Medicinal Products) koju je usvojio Komitet za lekove za humanu upotrebu (CHMP) i objavila Evropske Agencije za lekove (EMA).
_______
35 Informacije koje se
pojavljuju ako se za donaciju, koja je prethodno bila negativna za virusne
markere, naknadno utvrdi da je pozitivna za bilo koji virusni marker ili bilo
koji faktor rizika koji ukazuje na virusnu infekciju
5.1 Kako bi se minimizirala mikrobiološka kontaminacija ili unošenje stranog materijala u pul plazme, otapanje ili puliranje jedinica plazme treba da se sprovodi u prostoru koji odgovara zahtevima najmanje klase D čistoće kako je definisano u Aneksu 1 Smernica dobre proizvođačke prakse. Neophodno je da se nosi odgovarajuća odeća uključujući maske za lice i rukavice. Ostali postupci tokom procesa proizvodnje treba da budu u skladu sa zahtevima Aneksa 1 Smernica dobre proizvođačke prakse.
5.2 U skladu sa Aneksom 1 Smernica dobre proizvođačke prakse, monitoring ambijentalnih uslova treba da se vrši redovno, posebno tokom "otvaranja" kontejnera sa plazmom i tokom uzastopnih procesa otapanja i puliranja. Granice prihvatljivosti treba da se odrede.
5.3 U proizvodnji lekova dobijenih iz plazme, treba da se sprovedu postupci inaktivacije i uklanjanja virusa i da se preduzmu koraci u cilju sprečavanja unakrsne kontaminacije tretiranog sa netretiranim proizvodom. Nakon inaktivacije virusa, za proizvodnju treba da se koriste odgovarajuće namenske i odvojene prostorije i oprema.
5.4 Da bi se izbeglo izlaganje rutinske proizvodnje riziku od kontaminacije virusima koji se koriste tokom validacionih studija, validacija metoda za redukciju virusa ne sme da se sprovodi u proizvodnim pogonima. Validacija treba da se sprovodi prema važećoj verziji "Smernice za studije validacije virusa: dizajn, prilog i interpretacija studija o validaciji inaktivacije i uklanjanja virusa" (Note for Guidance on Virus Validation Studies: The Design, Contribution and Interpretation of Studies validating the Inactivation and Removal of Viruses), koju je usvojio Komitet za lekove za humanu upotrebu (CHMP) i objavila Evropske Agencije za lekove (EMA).
Polazni materijal
6.1 Polazni materijal treba da ispunjava zahteve relevantnih monografija Evropske farmakopeje i uslove utvrđene u dokumentaciji dozvole za stavljanje leka u promet, kao i u Glavnoj dokumentaciji o plazmi. Ovi zahtevi treba da se definišu u pisanim ugovorima (videti tačku 3.5) zaključenim između ustanove koja je ovlašćena za prikupljanje krvi i ustanove/mesta za frakcionisanje/ proizvođača i da se kontrolišu u okviru sistema kvaliteta.
6.2 Polazni materijal za program za frakcionisanje koji je ugovoren sa trećim zemljama treba da ispunjava zahteve navedene u tački 2.4.
6.3 U zavisnosti od načina prikupljanja (prikupljanje pune krvi ili automatizovana afereza), mogu da se primenjuju različiti procesni koraci. Svi procesni koraci (npr. centrifugiranje i/ili odvajanje, uzorkovanje, obeležavanje, zamrzavanje) treba da se definišu u pisanim procedurama.
6.4 Moraju da se izbegnu bilo kakve zamene jedinica i uzoraka plazme, posebno tokom obeležavanja, kao i bilo kakva kontaminacija, npr. prilikom oštećenja epruvete/zatvaranja kontejnera.
6.5 Zamrzavanje je kritičan korak za očuvanje (recovery) proteina plazme koji su nestabilni, npr. faktori koagulacije. Stoga, zamrzavanje treba da se izvrši primenom validirane metode što pre nakon prikupljanja (pogledati monografiju Evropske farmakopeje broj 0853 "Ljudska plazma za frakcionisanje" i kada je značajno monografiju broj 1646 "Ljudska plazma pulirana i tretirana postupkom inaktivacije virusa").
6.6 Skladištenje i transport krvi ili plazme u bilo kojoj fazi distributivnog lanca do ustanove/mesta za frakcionisanje treba da se definiše i evidentira. Ustanova/mesto za frakcionisanje treba da bude obaveštena o bilo kakvom odstupanju od definisane temperature. Treba da se koriste kvalifikovana oprema i validirane procedure.
Izdavanje sertifikata/odobravanje za upotrebu plazme kao polaznog materijala za frakcionisanje
6.7 Plazma za frakcionisanje se odobrava za upotrebu, npr. iz statusa karantina, isključivo primenom sistema i procedura koji obezbeđuju kvalitet neophodan za proizvodnju gotovog proizvoda. Plazma može da se distribuira do ustanove/mesta za frakcionisanje plazme/proizvođača isključivo nakon odobrenja od strane Odgovornog lica - RP (ili, u slučaju prikupljanja krvi/plazme u trećim zemljama, od strane lica sa ekvivalentnim odgovornostima i kvalifikacijama), kojim se potvrđuje da plazma za frakcionisanje odgovara zahtevima i specifikacijama koje su definisane u potpisanim ugovorima, kao i da su preduzeti svi koraci u skladu sa Dobrom praksom i Smernicama dobre proizvođačke prakse.
6.8 Nakon prijema u ustanovu/mesto za frakcionisanje, Kvalifikovano lice (QP) je odgovorno za odobravanje jedinica plazme za frakcionisanje. Kvalifikovo lice (QP) treba da potvrdi da plazma ispunjava sve zahteve relevantnih monografija i uslove postavljene u dokumentaciji dozvole za stavljanje leka u promet, kao i u Glavnoj dokumentaciji o plazmi i da, u slučaju da se plazma koristi za programe frakcionisanja koji su ugovoreni sa trećim zemljama, odgovara zahtevima navedenim u tački 2.4
Obrada plazme za frakcionisanje
6.9 Koraci tokom procesa frakcionisanja razlikuju se u zavisnosti od proizvoda i proizvođača i obično uključuju nekoliko procedura za frakcionisanje/prečišćavanje od kojih neke mogu da doprinesu inaktivaciji i/ili uklanjanju potencijalne kontaminacije.
6.10 Zahtevi za procese puliranja, uzorkovanja pula, frakcionisanja/prečišćavanja i inaktivaciju/uklanjanje virusa treba da budu definisani i u potpunosti ispunjeni.
6.11 Metode koje se koriste za proces inaktivacije virusa treba da se primenjuju uz strogo pridržavanje validiranih procedura i u skladu sa metodama koje su korišćene u studijama validacije virusa. Treba detaljno da se istraže greške u procedurama inaktivacije virusa. Kako svako odstupanje može da dovede u pitanje bezbednost finalnog proizvoda, pridržavanje validiranih procesa proizvodnje je posebno važno u procedurama za redukciju virusa. Treba da postoje procedure koje razmatraju ovaj rizik.
6.12 Bilo kakva prerada i dorada može da se vrši samo nakon primene upravljanja rizikom kvaliteta i primene procesnih koraka koji su definisani u odgovarajućoj dozvoli za stavljanje leka u promet.
6.13 Treba da postoji sistem za jasno odvajanje/razlikovanje proizvoda ili međuproizvoda koji su bili podvrgnuti procesu redukcije virusa od onih koji nisu.
6.14. U zavisnosti od ishoda celokupnog procesa upravljanja rizikom (uzimajući u obzir moguće razlike u epidemiologiji), proizvodnja u kampanjama koja podrazumeva jasno razdvajanje i primenu definisanih validiranih procedura čišćenja, može da se prihvati kada se plazma/intermedijeri različitog porekla obrađuju na istom mestu. Zahtev za takvim merama treba da bude zasnovan na preporukama Smernica o epidemiološkim podacima o infekcijama koje se prenose putem krvi (transmisivnim/prenosivim infekcijama). Kroz proces upravljanja rizikom treba da se razmotri da li je neophodno da se koristi namenska oprema u slučaju programa frakcionisanja koji su ugovoreni sa trećim zemljama.
6.15 Rok upotrebe međuproizvoda koji su namenjeni skladištenju, treba da se odredi na osnovu podataka o stabilnosti.
6.16 Skladištenje i transport međuproizvoda i gotovog leka u bilo kojoj fazi lanca distribucije treba da se odrede i evidentiraju. Treba da se koristi kvalifikovana oprema i validirane procedure.
7.1 Zahtevi koji se odnose na testiranje na prisustvo virusa ili drugih infektivnih agenasa treba da se posmatraju u svetlu saznanja o novonastalim infektivnim agensima i dostupnosti odgovarajućih, validiranih test metoda.
7.2 Prvi homogeni plazma pul (npr. nakon izdvajanja krioprecipitata iz pula plazme) treba da se testira validiranim test metodama odgovarajuće osetljivosti i specifičnosti, u skladu sa relevantnim monografijama Evropske farmakopeje (npr. broj 0853).
8. Odobravanje međuproizvoda i gotovog proizvoda
8.1 U promet smeju da se puste samo serije dobijene iz pula plazme koji je testiran i koji je negativan na markere virusa/antitela, za koje je utvrđeno da su usaglašene sa odobrenom specifikacijom (npr. Glavna dokumentacija o plazmi) i relevantnim monografijama Evropske farmakopeje, uključujući bilo koji specifičan virus (cut-off limits).
8.2 Odobravanje međuproizvoda namenjenih za dalju internu (in-house) obradu ili isporuku na različita mesta, kao i puštanje u promet gotovog proizvoda treba da odobri Kvalifikovano lice (QP) u skladu sa odobrenom dozvolom za stavljanje leka u promet.
8.3 Puštanje u promet međuproizvoda i gotovih proizvoda koji su predmet programa ugovaranja frakcionisanja sa trećim zemljama treba da odobri Kvalifikovano lice (QP) na osnovu standarda dogovorenih sa davaocem ugovora i u skladu sa EU Smernicama dobre proizvođačke prakse. S obzirom da ovi proizvodi nisu namenjeni za evropsko tržište, usklađenost sa relevantnim monografijama Evropske farmakopeje nije primenljiva.
9. Čuvanje uzoraka pula plazme
Jedan pul plazme može da se koristiti za proizvodnju više od jedne serije i/ili proizvoda. Uzorci iz svakog pula plazme i njihova dokumentacija treba da se čuvaju najmanje godinu dana nakon isteka roka upotrebe gotovog proizvoda sa najdužim rokom trajanja.
Treba da postoje pisane procedure za bezbedno i dokumentovano skladištenje i odlaganje otpada, predmeta za jednokratnu upotrebu i odbačenih predmeta (npr. kontaminiranih jedinica plazme, jedinica plazme od inficiranih davalaca, krvi, plazme, međuproizvoda ili gotovih proizvoda isteklog roka).
Dodatak
A) Države članice treba da implemetiraju sledeće Direktive i smernice:
1. za prikupljanje i testiranje krvi i komponenta krvi:
Direktiva/Smernice |
Naslov |
Područje primene |
Direktiva 2002/98/EC Evropskog |
Utvrđivanje standarda kvaliteta i bezbednosti za prikupljanje, testiranje, obradu, skladištenje i distribuciju krvi i komponenata krvi humanog porekla, izmenjena i dopunjena Direktiva 2001/83/EC. |
član 2. definiše standarde kvaliteta i bezbednosti za prikupljanje i testiranje krvi ili plazme humanog porekla, bez obzira na njihovu namenu, kao i za njihovu obradu, skladištenje i distribuciju kada su namenjeni za transfuziju |
Direktiva Komisije 2004/33/EC |
Implementacija Direktive 2002/98/EC Evropskog Parlamenta i Saveta, u pogledu određenih tehničkih zahteva za krv i komponente krvi |
Definiše zahteve o informisanju potencijalnih davalaca krvi i o informacijama koje se zahtevaju od davalaca krvi (deo A i B, Aneks II), podobnost davalaca krvi (Aneks III), uslove za skladištenje, transport i distribuciju krvi i komponenata krvi (Aneks IV), kao i zahteve u pogledu kvaliteta i bezbednosti krvi i komponenata krvi (Aneks V). |
Direktiva Komisije 2005/61/EC |
Implementacija Direktive 2002/98 Evropskog Parlamenta i Saveta u pogledu zahteva sledljivosti i prijavljivanja ozbiljnih neželjenih reakcija i događaja. |
Definiše zahteve sledljivosti za ustanove koje su ovlašćene za prikupljanje krvi, za davaoce krvi, krv i komponente krvi, kao i finalno odredište svake jedinice, bez obzira na njihovu namenu. Takođe, definiše i zahteve za prijavljivanje ozbiljnih neželjenih reakcija i događaja. |
Direktiva Komisije 2005/62/EC |
Implementacija Direktive 2002/98/EC Evropskog Parlamenta i Saveta u vezi sa standardima i specifikacijama Zajednice koji se odnose na sistem kvaliteta ustanova ovlašćenih za prikupljanje krvi |
Definiše implementaciju standarda sistema kvaliteta i specifikacija, kako je navedeno u članu 47 Direktive 2001/83/EC. |
2. za prikupljanje i dostavljanje podataka/informacija o plazmi za frakcionisanje:
Direktiva/Smernice |
Naslov |
Područje primene |
Direktiva 2001/83/EC Evropskog Parlamenta i Saveta |
O kodeksu Zajednice (Community Code) o lekovima za humanu upotrebu |
član 2. Lekovi za humanu upotrebu namenjeni za stavljanje u promet u državama članicama, koji su proizvedeni industrijski ili postupkom koji uključuje industrijski proces i koji obuhvataju lekove dobijene iz krvi ili plazme humanog porekla |
Direktiva Komisije 2003/63/EC |
izmenjena i dopunjena Direktiva 2001/83/EC Evropskog Parlamenta i Saveta o kodeksu Zajednice o lekovima za humanu upotrebu; Izmenjen i dopunjen Aneks o dokumentaciji za lek |
|
Direk Direktiva Komisije 2003/94/EC |
Utvrđivanje principa i smernica dobre proizvođačke prakse u proizvodnji lekova za humanu upotrebu i lekova koji su namenjeni za kliničko ispitivanje |
član 1. Principi i smernice dobre proizvođačke prakse u proizvodnji lekova za humanu upotrebu i lekova koji su namenjeni za kliničko ispitivanje |
EU smernice dobre proizvođačke prakse |
Tumačenje principa i smernica dobre proizvođačke prakse |
|
EMEA/CHMP/BWP/3794/03 Rev.1, 15. Nov. 2006 |
Smernica o zahtevima za naučne podatke za Glavnu dokumentaciju o plazmi Revizija 1 |
|
EMEA/CHMP/BWP/548524/2008 EMEA |
Smernica o epidemiološkim podacima o infektivnim bolestima koje se prenose putem krvi |
|
B) Ostali značajni dokumenti:
Direktiva/Smernice |
Naslov |
Područje primene |
Preporuka br. R (95) 15 (Savet Evrope) |
Vodič za pripremu, upotrebu i obezbeđenje kvaliteta komponenata krvi |
|
WHO Preporuke za proizvodnju, kontrolu i regulativu plazme humanog porekla za frakcionisanje. Aneks 4 u: WHO Stručni odbor za biološku standardizaciju 56. izveštaj. Ženeva, Svetska zdravstvena organizacija 2007) (WHO Tehnički izveštaj Series, Br. 941) |
WHO Preporuke za proizvodnju, kontrolu i regulativu plazme humanog porekla za frakcionisanje |
Vodič za proizvodnju, kontrolu i regulativu plazme humanog porekla za frakcionisanje |
WHO smernice dobre proizvođačke prakse za ustanove koje prikupljaju krv |
|
|
KVALIFIKACIJA I VALIDACIJA
Princip
Ovaj aneks opisuje principe kvalifikacije i validacije koji se primenjuju na pogone, opremu, pomoćne sisteme i procese u proizvodnji lekova, a može da se koristi i kao dodatno uputstvo za aktivne supstance bez uvođenja dodatnih zahteva u odnosu na Drugi deo smernice dobre proizvođačke prakse. Zahtev dobre proizvođačke prakse je da proizvođači kontrolišu kritične aspekte određenih operacija kroz kvalifikaciju i validaciju tokom životnog ciklusa proizvoda i procesa. Svaka planirana izmena u vezi sa pogonima, opremom, pomoćnim sistemima i procesima, koja može da utiče na kvalitet proizvoda, treba da se zvanično dokumentuje i da se proceni njen uticaj na validacioni status i kontrolnu strategiju. Kompjuterizovani sistemi koji se koriste u proizvodnji treba da se validiraju u skladu sa Aneksom 11. Takođe, treba uzeti u obzir relevantne koncepte i smernice ICH Q8, Q9, Q10 i Q11.
Opšte
Pristup upravljanja rizikom kvaliteta treba da se primeni na ceo životni ciklus leka. Kao deo sistema upravljanja rizikom kvaliteta, odluke o obimu i sadržaju kvalifikacija i validacija treba da se zasnivaju na opravdanoj i dokumentovanoj proceni rizika u vezi sa pogonima, opremom, pomoćnim sistemima i procesima. Pristup retrospektivne validacije se više ne smatra prihvatljivim. Podaci koji podržavaju kvalifikacione i/ili validacione studije, a koji su dobijeni iz izvora van sopstvenog programa proizvođača mogu da se koriste pod uslovom da je ovaj pristup dokumentovano opravdan i da postoji adekvatno obezbeđenje da su postojale kontrole tokom prikupljanja tih podataka.
1. Organizacija i planiranje kvalifikacije i validacije
1.1 Sve kvalifikacione i validacione aktivnosti treba da se planiraju i da se uzmu u obzir životni ciklus pogona, opreme, pomoćnih sistema, procesa i proizvoda.
1.2 Aktivnosti kvalifikacije i validacije može da obavlja samo odgovarajuće obučeno osoblje koje postupa u skladu sa odobrenim procedurama.
1.3 Izveštavanje od strane osoblja koje se bavi aktivnostima kvalifikacije i validacije treba da bude definisano u Farmaceutskom sistemu kvaliteta iako ovo nije obavezna funkcija upravljanja kvalitetom ili obezbeđenja kvaliteta. Međutim, treba da postoji odgovarajući nadzor kvaliteta u toku celog životnog ciklusa validacije.
1.4 Ključni elementi programa kvalifikacije i validacije na određenom mestu proizvodnje treba da budu jasno definisani i dokumentovani u glavnom planu validacije (VMP) ili u ekvivalentnom dokumentu.
1.5 Glavni plan validacije (VMP) ili ekvivalentan dokument treba da definiše sistem kvalifikacije/validacije i da sadrži reference ili da upućuje na najmanje sledeće:
i. politiku kvalifikacije i validacije;
ii. organizacionu strukturu, uključujući zaduženja i odgovornosti za kvalifikacione i validacione aktivnosti;
iii. sažet pregled prostora, opreme, sistema i procesa na mestu proizvodnje i njihov kvalifikacioni i validacioni status;
iv. kontrolu izmena i upravljanje neusaglašenostima u vezi sa kvalifikacijom i validacijom;
v. uputstvo za određivanje kriterijuma prihvatljivosti;
vi. upućivanje, odnosno vezu sa postojećim dokumentima;
vii. strategiju kvalifikacije i validacije, uključujući i rekvalifikacije kada je to primenljivo.
1.6 Za velike i složene projekte planiranje ima dodatni značaj, a posebni planovi validacije mogu da doprinesu jasnoći.
1.7 Za kvalifikacione i validacione aktivnosti treba da se primeni pristup upravljanja rizikom kvaliteta. Sa povećanjem znanja i razumevanja za bilo koju promenu tokom faze razvoja ili komercijalne proizvodnje, po potrebi treba ponovo da se izvrši procena rizika. Način na koji se procena rizika koristi kao podrška kvalifikacionim i validacionim aktivnostima treba da bude jasno dokumentovan.
1.8 Da bi se obezbedio integritet dobijenih podataka, odgovarajuće provere treba da budu deo kvalifikacionih i validacionih aktivnosti.
2. Dokumentacija, uključujući Glavni plan validacije (VMP)
2.1 Dobra dokumentaciona praksa je važna podrška upravljanju znanjem tokom celog životnog ciklusa proizvoda.
2.2 Svi dokumenti generisani tokom kvalifikacije i validacije treba da budu odobreni i potpisani od strane za to ovlašćenih osoba kako je to definisano u Farmaceutskom sistemu kvaliteta.
2.3 Međusobna veza između dokumenata u složenim validacionim projektima treba jasno da se definiše.
2.4 Treba da se pripreme validacioni protokoli u kojima su definisani kritični sistemi, karakteristike i parametri i sa njima povezani kriterijumi prihvatljivosti.
2.5 Kvalifikaciona dokumentacija može da se kombinuje međusobno, gde je to primenljivo, npr. instalaciona kvalifikacija (IQ) i operaciona kvalifikacija (OQ).
2.6 Kada validacione protokole i drugu dokumentaciju obezbeđuje treća strana koja je davalac usluga validacije, odgovarajuće osoblje na mestu proizvodnje treba, pre odobravanja, da potvrdi njihovu podobnost i usaglašenost sa internim procedurama. Protokoli dobavljača mogu, pre upotrebe, da se dopune dodatnom dokumentacijom/testovima.
2.7 Sve značajne izmene odobrenog protokola tokom izvršenja, npr. kriterijumi prihvatljivosti, operacioni parametri i sl., treba da se dokumentuju kao odstupanja i da se zvanično naučno opravdaju.
2.8 Rezultati koji ne ispunjavaju prethodno definisane kriterijume prihvatljivosti treba da se zabeleže kao odstupanja i u potpunosti da se istraže u skladu sa procedurom proizvođača. Bilo kakvi efekti na validaciju treba da se objasne u izveštaju.
2.9 Izveštaj treba da sadrži pregled i zaključke validacije, kao i sažetak dobijenih rezultata u odnosu na kriterijume prihvatljivosti. Sve naknadne promene kriterijuma prihvatljivosti treba da budu naučno opravdane, a kao krajnji rezultat validacije treba da se da zaključak sa preporukama.
2.10 Nadležne odgovorne osobe treba da daju zvanično odobrenje za sledeću fazu procesa kvalifikacije i validacije, bilo kroz odobravanje izveštaja validacije ili kao poseban sažet dokument. Uslovna saglasnost za prelazak u sledeću fazu kvalifikacije može da se da kada određeni kriterijumi prihvatljivosti ili odstupanja nisu u potpunosti rešeni i kada postoji dokumentovana procena da nema značajnog uticaja na sledeću aktivnost.
3. Faze kvalifikacija opreme, pogona, pomoćnih sistema i sistema
3.1 Kvalifikacione aktivnosti treba da obuhvate sve faze, počev od početnog razvoja specifikacije zahteva korisnika pa sve do prestanka upotrebe opreme, pogona, pomoćnih sistema i sistema. Glavne faze i neki predloženi kriterijumi (iako to zavisi od individualnih okolnosti projekta i mogu da se razlikuju), koji mogu da budu uključeni u svaku fazu su sledeći:
Specifikacija zahteva korisnika (URS)
3.2 Specifikacija opreme, pogona/prostora, pomoćnih sistema ili sistema mora da bude definisana u URS i/ili funkcionalnoj specifikaciji. U ovoj fazi treba da budu implementirani suštinski elementi kvaliteta, a svi rizici dobre proizvođačke prakse svedeni na prihvatljiv nivo. URS treba da bude referentna tačka tokom čitavog životnog ciklusa validacije.
Kvalifikacija dizajna (DQ)
3.3 Sledeća faza u kvalifikaciji opreme, pogona/prostora, pomoćnih sistema ili sistema je DQ u kojoj treba da se dokaže i dokumentuje usaglašenost dizajna sa zahtevima dobre proizvođačke prakse. Tokom kvalifikacije dizajna treba da se potvrde zahtevi iz URS.
Testiranje prihvatljivosti u fabrici dobavljača (FAT)/Testiranje prihvatljivosti na mestu proizvodnje (SAT)
3.4 Oprema, naročito ako sadrži nove ili složene tehnologije, može pre isporuke da bude procenjena kod dobavljača opreme, ako je to primenljivo.
3.5 Pre instalacije može kod dobavljača opreme da bude potvrđeno da oprema odgovara URS/funkcionalnoj specifikaciji, ako je primenljivo.
3.6 Kada je to odgovarajuće i zvanično obrazloženo pregled dokumentacije i neki testovi mogu da se izvrše u toku FAT ili u drugim fazama, bez potrebe da se ponavljaju na mestu proizvodnje u toku IQ/OQ, ako može da se dokaže da transport i instaliranje nisu imali uticaja na funkcionalnost.
3.7 FAT može da bude dopunjen izvršenjem SAT nakon prijema opreme na mestu proizvodnje.
Instalaciona kvalifikacija (IQ)
3.8 Instalaciona kvalifikacija (IQ) treba da se sprovede na opremi, pogonima/prostorima, pomoćnim sistemima ili sistemima.
3.9 IQ treba da uključi najmanje sledeće:
i) proveru ispravnosti instaliranja komponenti, instrumenata, opreme, cevovoda i radova na njima u odnosu na tehničke šeme i specifikacije;
ii) proveru ispravnosti instaliranja u odnosu na prethodno definisane kriterijume;
iii) prikupljanje i proveru dobavljačevih uputstava za rad, rukovanje opremom i zahteva za održavanjem;
iv) kalibraciju instrumenata;
v) verifikaciju konstrukcionih materijala.
Operaciona kvalifikacija (OQ)
3.10 Operaciona kvalifikacija (OQ) po pravilu sledi nakon instalacione kvalifikacije, ali u zavisnosti od složenosti opreme može da se izvede kao kombinovana instalaciona/operaciona kvalifikacija (IOQ).
3.11 OQ treba da obuhvati najmanje sledeće:
i) testove koji su razvijeni na osnovu poznavanja procesa, sistema i opreme, kako bi se obezbedilo da sistem funkcioniše kako je projektovan;
ii) testove koji potvrđuju gornje i donje operativne limite, i/ili uslove "najgoreg slučaja".
3.12 Uspešno završena operaciona kvalifikacija treba da omogući finalizaciju standardnih operativnih procedura rada i čišćenja, obuku operatera i definisanje zahteva preventivnog održavanja.
Kvalifikacija performansi (PQ)
3.13 PQ po pravilu sledi nakon uspešno obavljene IQ i OQ. Međutim, u nekim slučajevima može da bude prikladnije da se ona izvrši zajedno sa OQ ili validacijom procesa.
3.14 PQ treba da obuhvati najmanje sledeće:
i) testove, uz upotrebu polaznih materijala za proizvodnju, odobrenih zamena ili placeba, koji se provereno ekvivaletno ponašaju pri normalnim uslovima rada, za "najgori slučaj" veličine serije. Učestalost uzorkovanja kojom se potvrđuje procesna kontrola treba da bude opravdana;
ii) testove koji obuhvataju radni opseg određenog procesa, osim kada su iz faze razvoja dostupni dokumentovani dokazi koji potvrđuju radni opseg.
4.1 Oprema, pogoni/prostori, pomoćni sistemi i sistemi treba da se procenjuju u odgovarajućim vremenskim intervalima kako bi se potvrdilo da su i dalje u stanju pod kontrolom.
4.2 Kada je potrebno da se rekvalifikacija izvrši u određenom vremenskom intervalu, taj period treba da se opravda i da se definišu kriterijumi za procenu. Osim toga, treba da se proceni mogućnost uticaja manjih izmena tokom vremena.
Opšte
5.1 Zahtevi i principi navedeni u ovom delu su primenjivi za proizvodnju svih farmaceutskih oblika. Oni obuhvataju inicijalnu validaciju novih procesa, naknadnu validaciju izmenjenih procesa, transfer procesa i kontinuiranu verifikaciju procesa. U ovom aneksu se podrazumeva da je uspostavljen robustan proces razvoja proizvoda koji omogućava uspešnu validaciju procesa.
5.2 Ovaj odeljak 5. (Validacija procesa) treba da se koristi zajedno sa EMA (Evropska agencija za lekove) Smernicom za validaciju procesa.
5.2.1 EMA Smernica za validaciju procesa ima za cilj da pruži uputstvo o informacijama i podacima koji se dostavljaju nadležnoj agenciji u postupku izdavanja dozvole za stavljanje leka u promet. Međutim, zahtevi Smernice dobre proizvođačke prakse se nastavljaju tokom celog životnog ciklusa procesa.
5.2.2 Ovaj pristup treba da se primeni kako bi se napravila veza između procesa razvoja i proizvoda. Na taj način će se obezbediti da je validacija komercijalnog procesa proizvodnje i održavanje procesa u stanju pod kontrolom u toku rutinske komercijalne proizvodnje.
5.3 Procesi proizvodnje mogu da se razvijaju kroz tradicionalni pristup ili kroz pristup stalne verifikacije. Međutim, bez obzira koji pristup se koristi, mora da se dokaže da su procesi robusni i da obezbeđuju dosledan kvalitet proizvoda pre njihovog puštanja u promet. Za procese proizvodnje za koje se koristi tradicionalan pristup, kad god je to moguće treba da se uradi prospektivna validacija pre puštanja proizvoda u promet. Retrospektivna validacija više nije prihvatljiv pristup.
5.4 Validacija procesa proizvodnje novih proizvoda treba da obuhvati sve jačine leka čiji se promet planira i sva mesta proizvodnje. Grupisanje (bracketing) može da se opravda za nove proizvode na osnovu opsežnog poznavanja procesa iz faze razvoja i u sprezi sa odgovarajućim kontinuiranim procesom verifikacije.
5.5 Za validaciju procesa proizvodnje koji se transferišu sa jednog na drugo mesto proizvodnje ili u okviru istog mesta proizvodnje, broj validacionih serija može da se smanji upotrebom pristupa grupisanja (bracketing). Međutim, treba da budu na raspolaganju postojeća saznanja o proizvodu uključujući i sadržaj prethodne validacije. Za različite jačine, veličine serije i veličine/vrste pakovanja može da se koristi pristup grupisanja (bracketing) ako se to zvanično opravda.
5.6 U slučaju transfera postojećih proizvoda na drugo mesto, proces proizvodnje i kontrola kvaliteta moraju da budu u skladu sa dozvolom za stavljanje u promet i da ispunjavaju važeće zahteve za dozvolu za stavljanje te vrste lekova u promet. Ako je to potrebno, treba da se podnese zahtev za varijaciju dozvole za lek.
5.7 Validacijom procesa treba da se utvrdi da li procesom dosledno mogu da se dostižu karakteristike kvaliteta i parametri procesa, koji se smatraju važnim za obezbeđivanje validiranog statusa i prihvatljivog kvaliteta proizvoda. Treba jasno da se dokumentuje osnov za određivanje koji parametri procesa i karakteristike kvaliteta su kritični a koji nisu, uzimajući u obzir rezultate bilo koje aktivnosti procene rizika.
5.8 Po pravilu, serije proizvoda korišćene za validaciju procesa treba da budu iste veličine kao i planirane komercijalne serije leka, a upotreba bilo koje druge veličine serije treba da bude zvanično opravdana ili specificirana u drugim tačkama Smernice dobre proizvođačke prakse.
5.9 Oprema, pogoni/proizvodni prostori, pomoćni sistemi i sistemi koji se koriste prilikom validacije procesa treba da budu kvalifikovani. Metode testiranja treba da budu validirane za nameravanu upotrebu.
5.10 Kao osnov za aktivnosti validacije, bez obzira na pristup koji se koristi, na mestu proizvodnje treba da budu dostupna saznanja o procesima za sve proizvode iz faze razvoja ili drugih izvora, osim ako drugačije nije zvanično opravdano.
5.11 U proces proizvodnje validacionih serija može da bude uključeno osoblje iz proizvodnje, razvoja ili drugih mesta sa kojih se vrši transfer. Za proizvodnju validacionih serija može da bude angažovano samo osoblje obučeno u skladu sa Dobrom proizvođačkom praksom uz upotrebu odobrene dokumentacije. Očekivano je da je proizvodno osoblje uključeno u proizvodnju validacionih serija kako bi se olakšalo razumevanje proizvoda.
5.12 Dobavljači kritičnih polaznih i pakovnih materijala treba da budu kvalifikovani pre proizvodnje validacionih serija, u suprotnom je potrebno da se dokumentuje opravdanje za to, zasnovano na principima upravljanja rizikom kvaliteta.
5.13 Za potvrđivanje kontrolne strategije posebno je važno da je dostupno suštinsko poznavanje procesa za opravdan dizajn prostora (space design) (ako se koristi) i razvoj bilo kog matematičkog modela (ako se koristi).
5.14 Ako se validacione serije puštaju u promet, to treba unapred da bude definisano. Uslovi pod kojima se one proizvode treba u potpunosti da budu usaglašeni sa zahtevima dobre proizvođačke prakse, sa kriterijumima prihvatljivosti validacije, sa bilo kojim kriterijumom stalne verifikacije procesa (ako se koristi), kao i sa dozvolom za stavljanje u promet ili odobrenjem za kliničko ispitivanje.
5.15 Za validaciju procesa proizvodnje lekova namenjenih za kliničko ispitivanje videti Aneks 13 Smernice.
Tekuća validacija
5.16 U izuzetnim okolnostima, kada je značajan odnos koristi i rizika u interesu pacijenata, može da bude prihvatljivo da se ne završi program validacije pre početka rutinske proizvodnje leka i da se u promet pusti serija iz tekuće validacije procesa. Međutim, odluka o tekućoj validaciji mora da se opravda i dokumentuje u VMP, kao i da je jasno odobrena od strane za to ovlašćenog osoblja.
5.17 Kada je usvojen pristup tekuće validacije, treba da postoji dovoljno podataka za donošenje zaključka da je svaka proizvedena serija uniformna i da ispunjava definisane kriterijume prihvatljivosti. Rezultati i zaključak treba da budu zvanično dokumentovani i dostupni Kvalifikovanom licu pre puštanja serije leka u promet.
Tradicionalna validacija procesa
5.18 U slučaju tradicionalnog pristupa, određeni broj serija gotovog proizvoda se proizvodi pod rutinskim uslovima da bi se potvrdila ponovljivost.
5.19 Broj proizvedenih serija i broj uzetih uzoraka treba da se odredi na osnovu principa upravljanja rizikom kvaliteta, da se omogući normalan raspon varijacija, da se odrede trendovi i da se obezbedi dovoljno podataka za procenu. Svaki proizvođač mora da odredi i zvanično opravda broj serija potrebnih za dokazivanje visokog stepena sigurnosti da je proces sposoban za doslednu proizvodnju leka odgovarajućeg kvaliteta.
5.20 Ne zanemarujući navedeno u tački 5.19, za validaciju procesa se po pravilu smatra prihvatljivim da su potrebne najmanje tri uzastopne serije proizvedene pod rutinskim uslovima. Alternativan broj serija može da bude opravdan u zavisnosti od toga da li se primenjuju standardne metode proizvodnje i da li se slični proizvodi ili procesi primenjuju na tom mestu proizvodnje. Može da postoji potreba da se inicijalna validacija na tri serije dodatno dopuni podacima dobijenim od naknadno proizvedenih serija iz kontinuirane verifikacije procesa.
5.21 Treba da se pripremi protokol validacije procesa koji definiše kritične parametre procesa (CPP), kritične karakteristike kvaliteta (CQA) i sa njima povezane kriterijume prihvatljivosti koji treba da budu zasnovani na podacima iz faze razvoja ili dokumentovanom saznanju o procesu.
5.22 Protokol validacije procesa treba da sadrži najmanje sledeće:
i) sažet opis procesa sa upućivanjem na odgovarajuću Glavnu dokumentaciju o proizvodnji serije;
ii) zaduženja i odgovornosti;
iii) sažetak kritičnih karakteristika kvaliteta (CQA) koje treba ispitati;
iv) sažetak kritičnih parametara procesa (CPP) i kriterijuma prihvatljivosti za iste;
v) sažetak ostalih (nekritičnih) karakteristika i parametara koji treba da se ispitaju ili prate tokom validacionih aktivnosti, kao i razloge za njihovo uključivanje;
vi) spisak opreme/proizvodnih prostora koji će se koristiti (uključujući opremu za merenje/monitoring/vođenje zapisa) zajedno sa njenim kalibracionim statusom;
vii) spisak analitičkih metoda i metodu validacije, ako je primenljivo;
viii) predložene procesne kontrole sa kriterijumima prihvatljivosti kao i razloge za izbor svake od njih;
ix) dodatna testiranja koja treba da se izvrše, sa kriterijumima prihvatljivosti;
x) plan uzorkovanja sa objašnjenjem za izbor;
xi) način vođenja zapisa i procene rezultata;
xii) postupak puštanja serija u promet, ako je primenljivo.
Stalna verifikacija procesa
5.23 Za proizvode čiji je razvoj baziran na pristupu ugrađivanja kvaliteta kroz dizajn (QbD), kod koga je tokom faze razvoja naučno ustanovljeno da uspostavljena kontrolna strategija obezbeđuje visok stepen sigurnosti kvaliteta proizvoda, stalna verifikacija procesa može da se koristi kao alternativa tradiconalnoj validaciji procesa.
5.24 Treba da se definiše metoda kojom se proces verifikuje. Za potvrđivanje realizacije proizvoda treba da postoji naučno zasnovana kontrolna strategija za zahtevane karakteristike primljenog materijala, kritične karakteristike kvaliteta i kritične parametre procesa. Treba da se uspostavi i redovna procena kontrolne strategije. Kao alati mogu da se koriste procesna analitička tehnologija (PAT) i različiti statistički procesi kontrole. Svaki proizvođač mora da odredi i opravda broj serija potreban za dokazivanje visokog stepena sigurnosti da je proces sposoban za doslednu proizvodnju leka odgovarajućeg kvaliteta.
5.25 Opšti principi navedeni u tačkama 5.1 do 5.14 se i dalje primenjuju.
Kombinovani pristup
5.26 Kombinacija tradicionalnog pristupa i stalne verifikacije procesa može da se koristi u slučaju značajnog poznavanja proizvoda i procesa i razumevanja koje je stečeno kroz proizvodno iskustvo i istorijske podatke o serijama.
5.27 Ovaj pristup može da se koristi i za sve validacione aktivnosti posle izmena ili tokom kontinuirane verifikacije procesa čak i kad je proces inicijalno validiran korišćenjem tradicionalnog pristupa.
Kontinuirana verifikacija procesa tokom životnog ciklusa
5.28 Navedeno u tačkama 5.28 do 5.32 je primenljivo na sva tri pomenuta pristupa validaciji procesa - tradicionalni, stalni i kombinovani.
5.29 Proizvođači treba da prate kvalitet proizvoda kako bi se obezbedilo da se održava stanje pod kontrolom tokom čitavog životnog ciklusa proizvoda uz odgovarajuću procenu trenda relevantnih procesa.
5.30 Obim i učestalost kontinuirane verifikacije procesa treba periodično da se preispita. U bilo kojoj tački životnog ciklusa proizvoda može da bude prikladno da se modifikuju zahtevi uzimajući u obzir trenutni nivo razumevanja procesa i performansi procesa.
5.31 Kontinuirana verifikacija procesa treba da se obavlja u skladu sa odobrenim protokolom ili ekvivalentnim dokumentom, a odgovarajući izveštaj treba da se pripremi kako bi se dokumentovali dobijeni rezultati. Kada je to odgovarajuće, treba da se koriste statistički alati kako bi se podržali zaključci o varijabilnosti i sposobnosti datog procesa i obezbedilo stanje koje je pod kontrolom.
5.32 Kontinuirana verifikacija procesa treba da se vrši tokom celokupnog životnog ciklusa proizvoda kao podrška validacionom statusu proizvoda dokumentovanom u pregledu kvaliteta proizvoda. Takođe, treba da se uzmu u obzir pojedinačne izmene tokom vremena i da se proceni potreba za bilo kakvim dodatnim merama, npr. dodatno uzorkovanje.
6.1 Gotovi lekovi, lekovi namenjeni za kliničko ispitivanje, proizvodi u balk-u i uzorci treba da se od mesta proizvodnje transportuju u skladu sa uslovima definisanim u dozvoli za stavljanje u promet, odobrenom obeležavanju, specifikaciji proizvoda ili kako je to odredio proizvođač.
6.2 Verifikacija transporta može da predstavlja izazov zbog različitih faktora, ali transportne rute treba da budu jasno definisane. Tokom verifikacije transporta treba da se razmotre sezonske i druge varijacije.
6.3 Treba da se izvrši procena rizika kako bi se uzeo u obzir uticaj promenljivih faktora na proces transporta za koji nije obezbeđena kontinuirana kontrola i monitoring, npr. kašnjenja tokom transporta, kvar/otkaz uređaja za monitoring, dopunjavanje tečnog azota, osetljivost proizvoda i drugi relevantni faktori.
6.4 Zbog promenljivih uslova koji se očekuju tokom transporta, treba da se obavlja kontinuiran monitoring i vode zapisi o svim kritičnim ambijentalnim uslovima kojima proizvod može da bude izložen, osim ako drugačije nije opravdano.
7.1 Variranje procesnih parametara opreme, naročito tokom primarnog pakovanja, može da ima značajan uticaj na integritet i ispravno funkcionisanje pakovanja, npr. blister pakovanja, kesice i sterilne komponente, zbog čega oprema za primarno i sekundarno pakovanje gotovih proizvoda i proizvoda u bulk-u treba da bude kvalifikovana.
7.2 Kvalifikacija opreme za primarno pakovanje treba da se izvrši u uslovima minimalnog i maksimalnog radnog opsega za kritične procesne parametre kao što su temperatura, brzina mašine i pritisak zaptivanja ili bilo koji drugi parametar.
8. Kvalifikacija pomoćnih sistema
8.1 Nakon instaliranja pomoćnih sistema, kvalitet pare, vode, vazduha, drugih gasova i sl. treba da se potvrdi kroz faze kvalifikacije navedene u odeljku 3. ovog aneksa.
8.2 Period i obim kvalifikacije treba da odražava sva sezonska variranja, ako je primenljivo, kao i namenu pomoćnih sistema.
8.3 Potrebno je da se izvrši procena rizika u slučaju gde je moguć neposredan kontakt sa proizvodom, npr. sistemi za grejanje, ventilaciju i klimatizaciju (HVAC), ili indirektan kontakt kao u slučaju izmenjivača toplote, u cilju smanjenja rizika od kvara/otkaza.
9. Validacija analitičkih metoda
9.1 Sve analitičke metode ispitivanja koje se koriste u postupku kvalifikacije, validacije ili validacije čišćenja treba da budu validirane sa odgovarajućim limitima detekcije i kvantifikacije gde je to potrebno, kao što je definisano u Poglavlju 6, Prvi deo Smernice dobre proizvođačke prakse.
9.2 U slučaju kada se vrše mikrobiloška ispitivanja proizvoda, metode treba da budu validirane kako bi se potvrdilo da proizvod nema uticaj na rast mikroorganizama.
9.3 U slučaju kada se vrše mikrobiološka ispitivanja površina u čistim prostorima, treba da se izvrši validacija metode da bi se potvrdilo da sredstva za sanitizaciju nemaju uticaj na rast mikroorganizama.
10.1 Validacija čišćenja treba da se sprovodi kako bi se potvrdila efektivnost postupka čišćenja opreme koja dolazi u neposredan kontakt sa proizvodom. Kada je to naučno opravdano može da se koriste placebo. U slučaju kada je izvršeno grupisanje (bracketing) sličnih vrsta opreme, treba da se opravda izbor specifične opreme za validaciju čišćenja.
10.2 Vizuelna provera čistoće je važan deo kriterijuma prihvatljivosti validacije čišćenja. Po pravilu nije prihvatljivo da se koristi samo ovaj kriterijum. Ponovljeno čišćenje i ispitivanje dok se ne dobiju prihvatljivi rezultati za rezidue ne smatra se prihvatljivim pristupom.
10.3 Za završetak programa validacije čišćenja potrebno je vreme, a validacija sa verifikacijom posle svake proizvedene serije može da bude zahtevano za neke proizvode npr. za lekove namenjene za kliničko ispitivanje. Verifikacija treba da obezbedi dovoljno podataka za donošenje zaključka da je oprema čista i pogodna za dalju upotrebu.
10.4 Prilikom validacije treba da se uzme u obzir stepen automatizacije u postupku čišćenja. U slučaju kada se primenjuje automatizovan postupak čišćenja, treba da bude validiran definisan normalni radni opseg pomoćnih sistema i opreme.
10.5 Treba da se procene svi postupci čišćenja radi utvrđivanja promenljivih faktora koji utiču na efektivnost i performanse čišćenja, npr. operateri, nivo detalja u proceduri kao što je vreme ispiranja itd. Kada su određeni varijabilni faktori, u postupku validacije čišćenja treba koristiti pristup najgoreg slučaja.
10.6 Određivanje limita za prenos ostataka proizvoda treba da se bazira na toksikološkoj proceni.* Prilikom procene rizika treba da se dokumentuje opravdanje za odabrane limite, koje obuhvata i sve reference koje to podržavaju. Treba da se odrede limiti za uklanjanje svih sredstava za čišćenje koja se koriste. Kod kriterijuma prihvatljivosti treba da se razmotre potencijalni kumulativni efekti sa različitih delova opreme u okviru jedne linije.
10.6.1 Poznato je da se terapijski makromolekuli i peptidi razgrađuju i denaturišu kada su izloženi ekstremnim vrednostima pH i/ili toploti i da mogu da postanu farmakološki neaktivni. U ovim slučajevima toksikološka procena može da bude neprimenljiva.
10.6.2 Ako nije moguće odrediti rezidue specifičnih proizvoda, mogu da se odaberu drugi reprezentativni parametri, npr. ukupni organski ugljenik (TOC) i provodljivost.
10.7 Prilikom izrade protokola validacije čišćenja treba da se razmotri rizik od mikrobiološke i endotoksinske kontaminacije.
10.8 Radi određivanja vremena čuvanja (hold time) čiste i prljave opreme u postupku čišćenja, treba da se uzme u obzir uticaj vremena između završetka procesa proizvodnje i čišćenja, kao i vremena između čišćenja i upotrebe opreme.
10.9 Kao osnov za izvođenje validacije čišćenja u slučaju kampanjske proizvodnje treba da se uzme u obzir uticaj na lakoću čišćenja na kraju kampanje i maksimalno dužinu kampanje (vreme i/ili broj serija).
10.10 U slučaju kada se za validaciju čišćenja koristi pristup najkritičnijeg proizvoda potrebno je naučno obrazloženje za izbor proizvoda koji je najkritičniji, kao i uticaj uvođenja novih proizvoda na tom mestu proizvodnje. Kriterijumi za određivanje najgoreg slučaja mogu da obuhvate rastvorljivost, lakoću čišćenja, toksičnost i jačinu.
10.11 U protokolu validacije čišćenja treba da se definišu ili da se upućuje na mesta uzorkovanja, da se obrazloži izbor mesta uzorkovanja i da se definišu kriterijumi prihvatljivosti.
10.12 Uzorkovanje treba da se izvrši uzimanjem brisa i/ili ispiranjem ili na neki drugi način u zavisnosti od opreme za proizvodnju. Pribor i metoda/način uzorkovanja ne treba da utiču na rezultat. Treba da se dokaže da je moguće da se količina ostatka izdvoji (recovery) svim primenjenim metodama uzorkovanja sa svih površina opreme koje dolaze u kontakt sa proizvodom.
10.13 U cilju dokazivanja da je način čišćenja validiran, treba da se izvrši dovoljan broj postupaka čišćenja koji je određen na osnovu procene rizika, kao i da se ispune kriterijumi prihvatljivosti.
10.14 U slučaju kada postupak čišćenja nije efektivan ili nije prikladan za neku opremu, za svaki proizvod treba da se koristi namenska oprema ili druge odgovarajuće mere navedene u Poglavlju 3 i 5, Prvi deo smernice dobre proizvođačke prakse.
10.15 Kada se oprema čisti ručno, posebno je važno dokazati efektivnost ručnog postupka pri opravdanoj učestalosti.
________
* Videti Smernicu Evropske
agencije za lekove (EMA) za postavljanje zdravstveno bezbednih limita prilikom
identifikacije rizika u proizvodnji različitih lekova u istom pogonu.
11.1 Kontrola izmena je važan deo upravljanja znanjem koji treba da se sprovodi u okviru Farmaceutskog sistema kvaliteta.
11.2 Pisanim standardnim operativnim procedurama (SOP) treba da se opišu sve mere koje treba preduzeti u slučaju zahteva za planiranim izmenama polaznih materijala, sastojaka proizvoda, procesa, opreme, pogona/prostorija za proizvodnju, farmaceutskog oblika i jačine leka, proizvodnih ili analitičkih metoda, veličine serije, prostora dizajna (design space) ili bilo koje druge izmene tokom životnog ciklusa, a koja može da utiče na kvalitet proizvoda ili ponovljivost procesa.
11.3 Kada se koristi pristup prostora dizajna (design space), treba da se proceni uticaj izmena na prostor dizajna (design space) koji je naveden u dokumentaciji dozvole za stavljanje u promet i razmotri potreba za regulatornim merama.
11.4 Upravljanje rizikom kvaliteta treba da se koristi za procenu planiranih izmena i određivanje mogućeg uticaja na kvalitet proizvoda, Farmaceutski sistem kvaliteta, dokumentaciju, validaciju, regulatorni status, kalibraciju, održavanje ili druge sisteme, kako bi se izbegle nenamerne posledice i planirale neophodne aktivnosti validacije procesa, verifikacije ili rekvalifikacije.
11.5 Izmene treba da budu zvanično odobrene od strane za to odgovornih osoba ili relevantnog osoblja u skladu sa Farmaceutskim sistemom kvaliteta.
11.6 Kako bi se potvrdilo da je uticaj izmene procenjen pre konačnog odobrenja, treba da se pregledaju podaci koji to podržavaju kao što su npr. kopije dokumenata.
11.7 Nakon implementacije izmene i kada je to primenljivo, treba izvršiti procenu efektivnosti izmena kako bi se potvrdilo da su one uspešno sprovedene.
Ovde su date definicije termina upotrebljenih u ovom aneksu koji se odnose na kvalifikaciju i validaciju, a koje nisu date u rečniku termina Smernica dobre proizvođačke prakse.
Validacija procesa. Dokumentovano dokazivanje da taj proces proizvodnje, kada funkcioniše u okviru utvrđenih parametara, može efektivno i reproduktivno da proizvede lek, koji odgovara prethodno utvrđenim specifikacijama i karakteristikama kvaliteta.
Validacija čišćenja. Validacija čišćenja je dokumentovano dokazivanje da se odobrenim postupkom čišćenja obezbeđuje da se reproduktivno uklanja prethodni proizvod ili sredstva koja se koriste za čišćenje opreme ispod naučno određenog maksimalno dozvoljenog nivoa prenosa.
Verifikacija čišćenja. Prikupljanje dokaza dobijenih hemijskom analizom posle svake proizvedene serije/kampanje kako bi se dokazalo da je količina ostataka (rezidua) prethodnog proizvoda ili sredstava za čišćenje smanjena ispod naučno određenog maksimalno dozvoljenog nivoa prenosa.
Grupisanje (bracketing). Naučni pristup validaciji zasnovan na riziku, po kome se tokom validacije ispituju samo one serije koje su proizvedene pri ekstremnim, unapred određenim i opravdanim faktorima dizajna kao što su npr. jačina, veličina serije i/ili pakovanja, koje se testiraju tokom validacije procesa. Dizajn podrazumeva da je validacija bilo kog intermedijernog nivoa obuhvaćena validacijom ekstremnih slučajeva. Kada je validacijom obuhvaćen ceo opseg jačina proizvoda, grupisanje (bracketing) može da se primeni ako su jačine identične ili su vrlo bliskih vrednosti u sastavu proizvoda, npr. za tablete dobijene različitom jačinom kompresije ili sličnom osnovnom granulacijom, ili kapsule dobijene punjenjem istog osnovnog sastava pomoću različitih alata u kapsule istih veličina. Grupisanje (bracketing) može da se primeni na različite veličine kontejnera/kontaktne ambalaže ili različito punjenje u isti sistem kontejnera sa zatvarčem.
Životni ciklus. Sve faze "života" proizvoda, opreme ili pogona od početka razvoja ili upotrebe do prestanka upotrebe.
Instalaciona kvalifikacija (IQ). Dokumentovano potvrđivanje da pogoni, sistemi i oprema, na način na koji su instalirani ili modifikovani, odgovaraju odobrenom dizajnu i specifikacijama proizvođača.
Kvalifikacija dizajna (DQ). Dokumentovana potvrda da je predloženi dizajn pogona, sistema i opreme pogodan za namenjenu svrhu.
Kvalifikacija performansi (PQ). Dokumentovano potvrđivanje da sistemi i oprema, mogu efektivno i reproduktivno da funkcionišu na osnovu odobrenog proizvodnog postupka i specifikacije gotovog proizvoda.
Kvalitet kroz dizajn (Quality by design). Sistemski pristup koji počinje od prethodno definisanih ciljeva i naglašava razumevanje proizvoda, procesa i kontrole procesa na naučnoj osnovi i upravljanju rizikom kvaliteta.
Kontrola izmena. Zvaničan sistem u kome kvalifikovani predstavnici odgovarajućih celina razmatraju predložene ili sprovedene izmene koje mogu da utiču na status validacije proizvodnog prostora, sistema, opreme ili procesa. Namera je da se utvrdi potreba da se sprovedu aktivnosti kojim se obezbeđuje i dokumentuje da se sistem održava u validiranom statusu.
Kontinuirana verifikacija procesa. Dokumentovano dokazivanje da je proces u stanju pod kontrolom tokom komercijalne proizvodnje.
Kontrolna strategija. Niz kontrola, planiran na osnovu trenutnog znanja o proizvodu i procesu, koji obezbeđuje performanse procesa i kvalitet proizvoda. Kontrole obuhvataju parametre i karakteristike aktivnih supstanci, materijala i komponenti za proizvodnju lekova, operativnih uslova u vezi sa pogonom i opremom, procesne kontrole, specifikacije gotovog proizvoda i odgovarajućih metoda i učestalost monitoringa i kontrole (ICH Q10).
Kritični parametri procesa (CPP). Parametri procesa čija promenljivost ima uticaj na kritične karakteristike kvaliteta zbog čega treba da se prate i kontrolišu kako bi se obezbedilo da proces proizvodi željeni kvalitet (ICH Q8).
Kritične karakteristike kvaliteta (CQA). Fizička, hemijska, biološka ili mikrobiološka svojstva ili karakteristike koje treba da budu u okviru odobrenih limita, opsega ili raspodela kako bi se obezbedio željeni kvalitet proizvoda (ICH Q8).
Najgori slučaj. Stanje ili set uslova koji obuhvataju gornje i donje procesne granične slučajeve i okolnosti, u okviru standardnih operativnih procedura, a koje daju najveću mogućnost da proizvod ili proces zakaže u odnosu na idealne uslove. Takvi uslovi ne moraju obavezno da dovedu do neusaglašenosti proizvoda ili proizvodnog procesa.
Operaciona kvalifikacija (OQ). Dokumentovano dokazivanje da pogoni, sistemi i oprema, na način na koji su instalirani ili modifikovani, funkcionišu kako je predviđeno u okviru očekivanog radnog opsega.
Placebo. Materijal koji je po fizičkim svojstvima, a kada je to realno, i po hemijskim karakteristikama (npr. viskoznosti, veličina čestica, pH itd.) sličan proizvodu podvrgnutom validaciji.
Prospektivna validacija. Validacija sprovedena pre rutinske proizvodnje proizvoda namenjenih za puštanje u promet, tj. prodaju.
Prostor dizajna (design space). Multidimenzionalna kombinacija i međusobna povezanost ulaznih varijabli, npr. karakteristika materijala i parametara procesa za koje je dokazano da obezbeđuju kvalitet. Funkcionisanje u okviru prostora dizajna se ne smatra izmenom. Funkcionisanje izvan prostora dizajna smatra se izmenom za koju je po pravilu potrebno pokretanje postupka regulatornog odobrenje izmene. Prostor dizajna predlaže podnosilac zahteva za izdavanje dozvole za lek i kao takav podleže regulatornoj proceni i odobravanju (ICH Q8).
Realizacija proizvoda. Dobijanje proizvoda čije karakteristike kvaliteta zadovoljavaju potrebe pacijenata, zdravstvenih radnika i nadležnih regulatornih organa i internih zahteva kupaca (ICH Q10).
Specifikacija zehteva korisnika (URS). Set zahteva vlasnika, korisnika ili inženjerskih zahteva koji su neophodni i dovoljni za kreiranje izvodljivog dizajna koji odgovara namenjenoj upotrebi sistema.
Stalna verifikacija procesa. Alternativan pristup validaciji kod koga se obavlja kontinuirani monitoring i procena performansi procesa proizvodnje (ICH Q8).
Stanje pod kontrolom. Stanje u kome niz kontrola dosledno obezbeđuje prihvatljive performanse procesa i kvalitet proizvoda.
Tekuća validacija. Validacija koja se sprovodi u posebnim okolnostima opravdanim na osnovu značajne koristi za pacijenta, kada se protokol validacije sprovodi istovremeno sa puštanjem u promet validacionih serija.
Tradicionalan pristup. Pristup razvoja proizvoda u kome su definisani parametri i radni opseg procesnih parametara, tako da se obezbeđuje ponovljivost.
Upravljanje znanjem. Sistematski pristup za sticanje, analiziranje, čuvanje i prenošenje informacija (ICH Q10).
Upravljanje rizikom kvaliteta. Sistematski proces procene, kontrole, komunikacije i izveštavanja o rizicima za kvalitet tokom životnog ciklusa (ICH Q9).
SERTIFIKOVANJE I PUŠTANJE SERIJE LEKA U PROMET OD STRANE KVALIFIKOVANOG LICA
Područje primene
Ovaj aneks daje smernice za sertifikovanje od strane kvalifikovanog lica za puštanje serije leka u promet (u daljem tekstu: Kvalifikovano lice (QP) i postupak puštanja u promet na teritoriji EU serije leka za humanu ili veterinarsku upotrebu, kako lekova za koje je u EU izdata dozvola za stavljanje u promet (MA), tako i lekova koji se proizvode za izvoz. Principi ovih smernica se takođe primenjuju i na lekove za humanu upotrebu koji su namenjeni za kliničko ispitivanje, uz uvažavanje svih razlika u zakonskoj regulativi i detaljnih uputstava datih u smernicama koje je objavila Evropska komisija.
Odgovarajući zahtevi sadržani su u članu 51 Direktive 2001/83/EC, sa izmenama i dopunama, i članu 55 Direktive 2001/82/EC. Uzimaju se u obzir zahtevi navedeni u članu 51 (2) Direktive 2001/83/EC, sa izmenama i dopunama, i član 55 (2) Direktive 2001/82/EC, npr. Sporazumi o međusobnom priznavanju (MRA).
Ovaj aneks nije namenjen nadležnim institucijama (agencijama) za kontrolu kvaliteta lekova koje se izdaju posebna odobrenja (Official Control Authority Batch Release) za određene krvne i imunološke lekove u skladu sa čl. 109, 110, 113 i 114 Direktive 2001/83/EC, sa izmenama i dopunama, i čl. 81. i 82. Direktive 2001/82/ ES. Međutim, ovaj aneks se odnosi na sertifikovanje i puštanje tih serija u promet od strane Kvalifikovanog lica (QP).
Osnovni zahtevi za puštanje serije leka u promet definisani su u dozvoli za stavljanje leka u promet. Ni jedna odredba ovog aneksa ne smatra se važnijom i ne može biti iznad propisanih uslova iz dozvole za lek.
Opšti principi
Krajnja odgovornost za delovanje, kvalitet, bezbednost i efikasnost leka u toku životnog ciklusa leka je na nosiocu dozvole za stavljanje leka u promet.
Međutim, Kvalifikovano lice (QP) je odgovorno da obezbedi da je svaka pojedinačna serija proizvedena i ispitana u skladu sa zakonima važećim u državi članici u kojoj se vrši sertifikovanje, u skladu sa zahtevima iz dozvole za stavljanje leka u promet (MA) i Smernicama dobre proizvođačke prakse (GMP).
Proces puštanja serije leka u promet podrazumeva:
Proveru da li se proizvodnja i ispitivanje/testiranje serije leka obavljaju u skladu sa definisanim procedurama odobravanja.
Sertifikovanje serije gotovog leka od strane Kvalifikovanog lica (QP), kojim se potvrđuje da je serija leka proizvedena i ispitana u skladu sa Smernicama dobre proizvođačke prakse i zahtevima iz dozvole za stavljanje leka u promet. Ovim se potvrđuje kvalitet serije leka.
Za prenos serije gotovog leka na raspoložive prodajne zalihe i/ili izvoz mora da se uzme u obzir sertifikovanje od strane Kvalifikovanog lica (QP). Ukoliko se prenos serije leka vrši na neko drugo mesto koje nije mesto gde se vrši sertifikovanje serije, sve aktivnosti u vezi sa tim moraju da budu dokumentovane u ugovoru zaključenom između tih mesta.
Cilj kontrolisanog puštanja serije leka u promet je da obezbedi sledeće:
Da je serija proizvedena i proverena u skladu sa zahtevima dozvole za stavljanje leka u promet.
Da je serija proizvedena i proverena u skladu sa Smernicama dobre proizvođačke prakse.
Da su uzeti u obzir svi drugi relevantni zakonski uslovi.
Da je u slučaju kada je, u skladu sa Poglavljem 8, Prvi deo smernice dobre proizvođačke prakse, potrebno istražiti defekt kvaliteta ili povlačenje serije leka iz prometa, obezbeđeno da se može lako identifikovati svako Kvalifikovano lice (QP) koje je bilo uključeno u sertifikovanje ili potvrđivanje36, kao i da bilo koji relevantni zapisi budu lako prepoznati.
_______
36 U slučaju kada se odgovornosti
QP za seriju prenose na druga mesta proizvodnje, informacije koje se zahtevane
i navode se u potvrdi navedene su u Dodatku I ovog aneksa.
Svaka serija gotovog proizvoda mora da bude sertifikovana37 od strane Kvalifikovanog lica (QP) pre puštanja u promet u EU, ili pre izvoza. Sertifikovanje može da vrši samo Kvalifikovano lice (QP) proizvođača i/ili uvoznika koje je navedeno u dozvoli za stavljanje leka u promet.
_______
37 Sadržaj sertifikata
serije leka naveden je u Dodatku II ovog aneksa.
Svako Kvalifikovano lice (QP) koje je uključeno u sertifikovanje serije leka mora u potpunosti da bude upoznato sa aktivnostima za koje je odgovorno. Svako Kvalifikovano lice (QP) mora da bude u stanju da dokaže svoju kontinuiranu obučenost u odnosu na vrstu proizvoda, proizvodne procese, tehnički napredak i izmene Smernica dobre proizvođačke prakse.
U različite faze proizvodnje, uvoza, ispitivanja i skladištenja serije leka pre postupka sertifikovanja može da bude uključeno nekoliko mesta. Bez obzira na broj mesta koja su uključena, Kvalifikovano lice (QP) koje sertifikuje seriju gotovog proizvoda mora da obezbedi da su sprovedeni svi neophodni postupci u okviru usvojenog Farmaceutskog sistema kvaliteta koji obezbeđuju usaglašenost serije sa zahtevima iz dozvole za stavljanje leka u promet, Smernicama dobre proizvođačke prakse i svim drugim zakonskim obavezama u državi članici u kojoj se vrši sertifikovanje.
Za svaku fazu proizvodnje koja se obavlja na mestima proizvodnje u EU, svako mesto proizvodnje mora da ima najmanje jedno Kvalifikovano lice (QP).
1.4.1. Kada se na jednom mestu proizvodnje obavlja samo deo postupka proizvodnje u vezi sa serijom leka, Kvalifikovano lice (QP) tog mesta proizvodnje mora da potvrdi da su te operacije obavljene u skladu sa Smernicama dobre proizvođačke prakse i uslovima definisanim ugovorima koji detaljno opisuju operacije za koje je to mesto proizvodnje odgovorno. Ukoliko je Kvalifikovano lice (QP) odgovorno da obezbedi potvrđivanje usaglašenosti proizvodnih operacija sa važećom dozvolom za stavljanje leka u promet, onda to Kvalifikovano lice (QP) treba da ima pristup svim neophodnim podacima iz dozvole za stavljanje leka u promet.
1.4.2 Kvalifikovano lice (QP) koje vrši sertifikovanje serije gotovog leka može da preuzme potpunu odgovornost za sve faze proizvodnje serije ili da odgovornost podeli sa drugim Kvalifikovanim licima (QP) koja potvrđuju usaglašenost određenih faza proizvodnje i kontrole kvaliteta serije. To mogu da budu druga Kvalifikovana lica (QP) kod istog nosioca dozvole za proizvodnju/uvoz (MIA), ili Kvalifikovana lica (QP) različitih nosioca dozvole za proizvodnju/uvoz.
1.4.3 Bilo koja podela odgovornosti između Kvalifikovanih lica (QP) koja se odnosi na usaglašenost serije mora da bude definisana u dokumentu koji su zvanično dogovorile sve strane. Ovim dokumentom treba da se precizira odgovornost za procenu uticaja bilo kakvog odstupanja od usaglašenosti sa Smernicama dobre proizvođačke prakse i dozvolom za stavljanje leka u promet.
1.5. Za lekove koji se proizvode van Evropske unije, fizički uvoz i sertifikovanje je završna faza proizvodnje koja prethodi prenosu serije leka na raspoložive prodajne zalihe.
1.5.1. Proces sertifikovanja opisan u odeljku 1. ovog aneksa, primenjuje se na sve lekove namenjene puštanju u promet u Evropskoj uniji, ili izvozu, bez obzira na složenost lanca snabdevanja i globalnu lokaciju uključenih mesta proizvodnje.
1.5.2 U skladu sa principima opisanim u tački 1.4 ovog aneksa, Kvalifikovano lice (QP) koje sertifikuje seriju leka može da uzme u obzir potvrđivanje, kao i da podeli odgovornost sa drugim Kvalifikovanim licima (QP) koja su uključena u bilo koju proizvodnu operaciju ili uvoz, a koji se odvijaju na drugim mestima u Evropskoj uniji ili kod drugih nosioca dozvole za proizvodnju definisanih u dozvoli za stavljanje leka u promet.
1.5.3 Pre sertifikovanja serije, Kvalifikovano lice (QP) treba da uzme u obzir uslove skladištenja i transporta serije i uzorka, ako se oni otpremaju odvojeno.
1.5.4 Kvalifikovano lice (QP) koje sertifikuje seriju gotovog leka odgovorno je da obezbedi da je svaka serija leka proizvedena u skladu sa Smernicama dobre proizvođačke prakse i u skladu sa dozvolom za stavljanje leka u promet. Osim u slučaju kada postoji sporazum o međusobnom priznavanju (MRA) ili sličan sporazum između EU i zemlje izvoza, Kvalifikovano lice (QP) je takođe odgovorno i da obezbedi da je serija gotovog leka u državi članici podvrgnuta kompletnoj kvalitativnoj analizi, kvantitativnoj analizi najmanje svih aktivnih supstanci, kao i drugim neophodnim ispitivanjima i proverama kojima se obezbeđuje kvalitet leka u skladu sa zahtevima iz dozvole za stavljanje leka u promet.
1.5.5 Uzorkovanje uvezenog leka treba u potpunosti da bude reprezentativno za seriju. Uzorci se mogu uzeti nakon ulaska na teritoriju EU, ili se mogu uzeti na mestu proizvodnje u trećoj zemlji u skladu sa tehnički opravdanim pristupom koji je dokumentovan u okviru sistema kvaliteta kompanije. Odgovornosti u vezi uzorkovanja treba da budu definisane u pisanom ugovoru zaključenom između ovih mesta proizvodnje. Bilo koji uzorak koji je uzet izvan EU treba da se isporuči pod istim uslovima transporta kao i serija koju predstavlja.
1.5.6 Kada se uzorkovanje vrši na mestu proizvodnje u trećoj zemlji, tehničko pravdanje za to treba da obuhvati proces Upravljanja rizikom kvaliteta, u cilju identifikacije i upravljanja rizicima povezanim sa ovim pristupom.
To treba u potpunosti da bude dokumentovano i da uključi najmanje sledeće elemente:
i. Proveru (audit) proizvodnih aktivnosti uključujući sve aktivnosti koje se tiču uzorkovanja na lokacijama u trećim zemljama, kao i procenu postupaka u transportu serije i uzoraka kako bi se osiguralo da su uzorci reprezentativni za uvezenu seriju;
ii. Sveobuhvatnu naučnu studiju, uključujući podatke koji podržavaju donošenje svakog zaključka da su uzorci uzeti u trećoj zemlji reprezentativni za seriju nakon uvoza. Ova studija treba da uključi najmanje sledeće:
Opis procesa uzorkovanja u trećoj zemlji.
Opis uslova transporta uzorka i uvezene serije. Bilo kakve razlike treba da se opravdaju.
Uporedne/komparativne analize uzoraka uzetih u trećoj zemlji i uzoraka uzetih nakon uvoza.
Razmatranje vremenskog intervala između uzorkovanja i uvoza serije i generisanje podataka kojim se podržavaju odgovarajuće definisani limiti;
iii. Obezbeđivanje periodične analize uzoraka uzetih metodom slučajnog izbora nakon uvoza, kako bi se potvrdila kontinuirana pouzdanost uzoraka uzetih u trećim zemljama;
iv. Pregled bilo kog neočekivanog rezultata ili potvrđenih rezultata van specifikacije. Ovi rezultati mogu da imaju uticaj na poverenje u uzorkovanje obavljeno na mestu proizvodnje u trećoj zemlji i o tome mora da bude obaveštena inspekcija koja je nadležna za nadzor mesta proizvodnje gde se vrši sertifikovanje. Takav slučaj treba da se posmatra kao potencijalni defekt kvaliteta i treba da se istraži u skladu sa Poglavljem 8, Prvi deo Smernica dobre proizvođačke prakse.
1.5.7 Različite serije uvezenog leka mogu da potiču od iste serije proizvoda u bulk-u. Sertifikovanje različitih serija gotovog leka od strane Kvalifikovanih lica (QP) može da se zasniva na testu kontrole kvaliteta prve serije uvezenog gotovog leka, pod uslovom da je opravdanje za to dokumentovano na osnovu principa Upravljanja rizikom kvaliteta. U vezi pouzdanosti bilo kojih uzoraka uzetih u trećim zemljama, treba da se uzmu u obzir odredbe tačke 1.5.6. Treba da budu dostupni dokazi o integritetu i identitetu uvezene serije leka, koji su obezbeđeni kroz dokumentovanu proveru najmanje sledećeg:
- da su pre pakovanja ispunjeni relevantni zahtevi za skladištenje proizvoda u bulk-u;
- da je serija leka skladištena i transportovana pod propisanim uslovima;
- da je održavana bezbednost pošiljke i da postoje dokazi da nije bilo nepropisnog rukovanja tokom skladištenja ili transporta;
- da je uspostavljena ispravna identifikacija proizvoda;
- da su uzorci za ispitivanje reprezentativni za sve serije gotovog proizvoda dobijene iz iste serije proizvoda u bulk-u.
1.6 Pre sertifikovanja serije leka za puštanje u promet ili za izvoz, Kvalifikovano lice (QP) mora lično da obezbedi da su ispunjene sledeće operativne odgovornosti:
i. Sertifikovanje je izvršeno pod uslovima iz dozvole za proizvodnju/uvoz (MIA);
ii. Sve dodatne obaveze i zahtevi nacionalne zakonske regulative su ispunjeni;
iii. Sertifikovanje se evidentira u registru ili ekvivalentnom dokumentu.
1.7 Osim toga, Kvalifikovano lice (QP) je odgovorno da uslovi iz tačaka 1.7.1 do 1.7.21 budu obezbeđeni. Ovi zadaci mogu da budu povereni odgovarajućem obučenom osoblju ili trećoj strani. Prepoznato je da Kvalifikovano lice (QP) treba da se oslanja na Farmaceutski sistem kvaliteta, kao i da treba da ima stalnu sigurnost da je ispravno utemeljen osnov za poveravanje ovih zadataka.
1.7.1 Sve aktivnosti povezane sa proizvodnjom i kontrolom kvaliteta/testiranjem leka su sprovedene u skladu sa principima i Smernicama dobre proizvođačke prakse.
1.7.2 Celokupan lanac snabdevanja aktivne supstance i gotovog proizvoda sve do faze sertifikovanja je dokumentovan i dostupan Kvalifikovanom licu (QP). Ovo treba da obuhvati sva mesta proizvodnje polaznih materijala i pakovnog materijala za gotove proizvode i bilo koji drugi materijal koji se, na osnovu procene rizika proizvodnog procesa, smatra kritičnim. Poželjno je da dokument bude u formi sveobuhvatnog dijagrama, gde su uključena sva mesta, uključujući i podizvođače kritičnih postupaka kao što su sterilizacija komponenti i opreme za aseptičnu izradu.
1.7.3 Sve provere (audit) mesta koja su uključena u proizvodnju i ispitivanje/testiranje gotovog proizvoda, kao i mesta na kojima se proizvodi aktivna supstanca, su izvršene i izveštaji o izvršenim proverama su dostupni Kvalifikovanom licu (QP) prilikom sertifikovanja serije.
1.7.4 Sva mesta proizvodnje, kontrole kvaliteta/testiranja i sertifikovanja su u skladu sa uslovima iz dozvole za stavljanje leka u promet na teritoriji za koju je lek namenjen.
1.7.5 Sve aktivnosti proizvodnje i kontrole kvaliteta/testiranja su u skladu sa dozvolom za stavljanje leka u promet.
1.7.6 Poreklo i specifikacije polaznih materijala i materijala za pakovanje koji se koriste u proizvodnji serije leka su u skladu sa dozvolom za stavljanje leka u promet. Treba da postoji Sistem upravljanja kvalitetom kod dobavljača koji obezbeđuje isporuku samo materijala zahtevanog kvaliteta.
1.7.7 Za proizvodnju lekova na koje se odnosi Direktiva 2001/83/EC, sa izmenama i dopunama, ili Direktiva 2001/82/EC, treba da se koriste aktivne supstance koje su proizvedene u skladu sa Smernicama dobre proizvođačke prakse, i kada je primenljivo, distribuirane u skladu sa Smernicama dobre distributivne prakse za aktivne supstance.
1.7.8 Uvoz aktivnih supstanci koje se koriste u proizvodnji lekova za humanu upotrebu treba da bude u skladu sa zahtevima člana 46 (b) Direktive 2001/83/EC, sa izmenama i dopunama.
1.7.9 Za lekove na koje se odnosi Direktiva 2001/83/EC, sa izmenama i dopunama, ekscipijensi treba da budu proizvedeni u skladu sa članom 46 (f) te Direktive.
1.7.10 Kada je relevantno, TSE (transmisivna spongiformna encefalopatija) status svih materijala koji se koriste u proizvodnji treba da bude u skladu sa uslovima iz dozvole za stavljanje leka u promet.
1.7.11 Svi zapisi su kompletirani i odobreni od strane odgovarajućeg osoblja. Sve zahtevane procesne kontrole i provere su izvršene.
1.7.12 Svi procesi proizvodnje i kontrole kvaliteta/testiranja se održavaju u validiranom statusu. Osoblje je obučeno i kvalifikovano u skladu sa zahtevima.
1.7.13 Testovi kontrole kvaliteta gotovog proizvoda su usaglašeni sa specifikacijom gotovog proizvoda iz dozvole za stavljanje leka u promet, ili kada je odobren, Programom testiranja u realnom vremenu za puštanje serije u promet.
1.7.14 Ispunjene su sve regulatorne obaveze posle stavljanja leka u promet, koje se odnose na proizvodnju ili kontrolu kvaliteta/testiranje leka. Sertifikovanje je podržano podacima iz kontinuiranog praćenja stabilnosti.
1.7.15 Izvršena je procena uticaja bilo koje izmene u proizvodnji ili kontroli kvaliteta/testiranju i izvršene su sve dodatne provere i testovi.
1.7.16 Sve istrage koje se odnose na seriju koja se sertifikuje (uključujući i istrage rezultata van specifikacije i rezultate van trenda) su sprovedene u meri koja je dovoljna da podrži sertifikovanje.
1.7.17 Sve tekuće reklamacije, istrage ili povlačenja ne negiraju uslove za odobravanje predmetne serije.
1.7.18 Zaključeni su potrebni tehnički sporazumi.
1.7.19 Program interne kontrole je aktivan i važeći.
1.7.20 Uspostavljeni su odgovarajući sporazumi koji se odnose na distribuciju i isporuke.
1.7.21 U slučaju kada je lek za humanu upotrebu namenjen za stavljanje u promet na tržište EU, pakovanje leka je obeleženo bezbednosnim oznakama iz člana 54(o) Direktive 2001/83/EC, sa izmenama i dopunama, gde je to odgovarajuće.
1.8 Za određene vrste lekova primenjuju se posebna uputstva, kao što su Aneks 2: Proizvodnja bioloških aktivnih supstanci i lekova za humanu upotrebu, i Aneks 3: Proizvodnja radiofarmaceutskih lekova, smernice dobre proizvođačke prakse.
1.9 U slučaju paralelnog uvoza i paralelne distribucije, bilo kakva operacija prepakivanja izvršena na seriji koja je već puštena u promet mora da bude odobrena od strane nadležnog organa zemlje čijem tržištu je lek namenjen.
1.9.1 Pre sertifikovanja serije koja je prepakovana, Kvalifikovano lice (QP) treba da potvrdi usaglašenost sa nacionalnim zahtevima za paralelan uvoz i zahtevima EU za paralelnu distribuciju.
1.9.2 Kvalifikovano lice (QP) nosioca dozvole za proizvodnju/uvoz (MIA) koje je imenovano kao odgovorno u dozvoli za stavljanje u promet prepakovanog leka, treba da potvrdi da je prepakivanje izvršeno u skladu sa odgovarajućim dozvolama koje se odnose na prepakovan proizvod i Dobru proizvođačku praksu.
Vođenje zapisa o sertifikovanju serije leka.
1.10.1 Kvalifikovano lice (QP) odgovorno za sertifikovanje vodi zapise o puštanju serije leka u promet u registru ili ekvivalentnom dokumentu obezbeđenom za tu svrhu. Zapis treba da pokaže da svaka proizvedena serija zadovoljava zahteva navedene u članu 51 Direktive 2001/83/EC, sa izmenama i dopunama, ili članu 55 Direktive 2001/82/EC. Zapis mora da se vodi dok se operacije vrše i mora da bude na raspolaganju predstavnicima nadležnog organa u periodu koji je određen odredbama konkretne države članice, a najmanje pet godina.
1.10.2 Izveštaj kontrole kvaliteta naveden u članu 51 Direktive 2001/83/EC, sa izmenama i dopunama, ili članu 55 Direktive 2001/82/EC, ili drugi dokaz za puštanje serije leka u promet, zasnovan na ekvivalentnom sistemu, treba da bude dostupan za seriju kako bi ona bila izuzeta od obaveze dodatnih kontrola prilikom ulaska u drugu državu članicu.
2. Oslanjanje na procene dobre proizvođačke prakse izvršene od treće strane, npr. provere (AUDIT)
U nekim slučajevima, Kvalifikovano lice (QP) treba da se osloni na proveru (audit) pravilnog funkcionisanja Farmaceutskog sistema kvaliteta na mestima uključenim u proizvodnju leka, sprovedenu od treće strane.
2.1 Oslanjanje na procenu treće strane, npr. proveru (audit), treba da bude u skladu sa Poglavljem 7 Smernica dobre proizvođačke prakse, u cilju adekvatnog definisanja, prihvatanja i kontrole bilo koje aktivnosti koja se poverava trećoj strani.
2.2. Posebna pažnja treba da se obrati na odobravanje izveštaja o izvršenoj proveri:
i. Izveštaj o izvršenoj proveri treba da odgovara opštim zahtevima dobre proizvođačke prakse, kao što su na primer Sistem upravljanja kvalitetom, sve relevantne procedure proizvodnje i kontrole kvaliteta koji se odnose na isporučeni proizvod, npr. proizvodnja aktivne supstance, testiranja kontrole kvaliteta, primarno pakovanje itd. Sve oblasti koje su predmet provere treba da budu precizno opisane u pripremljenom detaljnom izveštaju o izvršenoj proveri;
ii. Treba da se utvrdi da li se proizvodnja i kontrola kvaliteta aktivne supstance i gotovog proizvoda obavljaju u skladu sa Smernicama dobre proizvođačke prakse, ili u slučaju proizvodnje u trećim zemljama, dobre proizvođačke prakse koja je najmanje ekvivalentna Smernici navedenoj u članu 46 Direktive 2001/83/EC, sa izmenama i dopunama, ili člana 50 Direktive 2001/82/EC;
iii. U slučaju poverenih, odnosno ugovornih aktivnosti, treba da se proveri usaglašenost sa dozvolom za stavljanje leka u promet;
iv. Kvalifikovano lice (QP) treba da obezbedi da je izvršena pisana konačna ocena i odobrenje izveštaja o izvršenoj proveri treće strane. Kvalifikovano lice (QP) treba da ima pristup dokumentaciji koja olakšava pregled rezultata provere na osnovu koje nastavlja da se oslanja na aktivnosti koje vrši treća strana;
v. Aktivnosti sa kritičnim uticajem na kvalitet proizvoda poverene trećoj strani treba da budu definisane u skladu sa principima Upravljanja rizikom kvaliteta. U skladu sa navedenim, Kvalifikovano lice (QP) treba da bude svesno ishoda provere sa kritičnim uticajem na kvalitet proizvoda pre sertifikovanja relevantnih serija;
vi. Ponovljene provere treba da se izvrše u skladu sa principima Upravljanja rizikom kvaliteta.
3. Upravljanje neočekivanim odstupanjima
Ukoliko su ispunjeni zahtevi odobrenih specifikacija za aktivne supstance, pomoćne supstance, materijale za pakovanje i lekove, Kvalifikovano lice (QP) može da razmotri potvrđivanje ili sertifikovanje serije kod koje je došlo do neočekivanog odstupanja u proizvodnom procesu i/ili analitičkoj metodi ispitivanja od dokumentacije sadržane u dozvoli za stavljanje leka u promet i/ili odstupanja od dobre proizvođačke prakse. Odstupanje treba detaljno da se istraži i da se koriguje osnovni uzrok. Za nastavak proizvodnje leka može da bude potrebno podnošenje zahteva za odobrenje varijacije dozvole za stavljanje leka u promet.
3.1 Uticaj odstupanja treba da se proceni u skladu sa procesom Upravljanja rizikom kvaliteta primenom odgovarajućeg pristupa. Proces Upravljanja rizikom kvaliteta treba da obuhvati sledeće:
i. Procenu potencijalnog uticaja odstupanja na kvalitet, bezbednost ili efikasnost serije i zaključak da je uticaj zanemarljiv;
ii. Razmatranje potrebe da se serija kod koje je utvrđeno odstupanje uključi u program kontinuiranog praćenja stabilnosti;
iii. U slučaju bioloških lekova, treba da se uzme u obzir da bilo kakvo odstupanje od odobrenog procesa može da ima neočekivan uticaj na bezbednost i efikasnost leka.
Uzimajući u obzir da odgovornosti mogu biti podeljene između više Kvalifikovanih lica (QP) uključenih u proizvodnju i kontrolu serije leka, Kvalifikovano lice (QP) koje sertifikuje seriju leka treba da razmotri sva odstupanja koja imaju potencijalni uticaj na usaglašenost sa principima dobre proizvođačke prakse i /ili usklađenost sa dozvolom za stavljanje leka u promet.
4. Puštanje serije leka u promet
4.1 Serije leka mogu da se puste u promet samo posle sertifikovanja od strane Kvalifikovanog lica (QP), na prethodno naveden način. Dok se ne sertifikuje, serija leka može da se zadrži na mestu proizvodnje ili da se u statusu karantina otpremi do drugog mesta koje za tu svrhu poseduje dozvolu relevantnog nadležnog organa.
4.2 Treba da se uspostave zaštitne mere koje onemogućavaju da se nesertifikovane serije prenesu na raspoložive prodajne zalihe, a koje po svojoj prirodi mogu da budu fizičke, npr. fizičko odvajanje i obeležavanje, ili elektronske prirode, npr. korišćenjem validiranih kompjuterizovanih sistema. Prilikom prenosa nesertifikovanih serija sa jednog mesta na drugo, zaštitne mere za sprečavanje njihovog prevremenog puštanja u promet treba da ostanu na snazi.
4.3. Tehničkim sporazumom treba da se definišu koraci neophodni za obaveštavanje o sertifikovanju serije od strane Kvalifikovanog lica (QP) do mesta na kome se serija prenosi na raspoložive prodajne zalihe. Takvo obaveštenje od strane Kvalifikovanog lica (QP) treba da bude zvanično i nedvosmisleno i u skladu sa zahtevima iz Poglavlja 4, Prvi deo smernice dobre proizvođačke prakse.
Određene reči i fraze u ovom aneksu se koriste sa određenim značenjima definisanim u nastavku. Takođe, treba koristiti i rečnik u Prvom delu smernice.
Kvalifikovano lice (QP). Lice definisano u članu 48 Direktive 2001/83/EC, sa izmenama i dopunama, kao i članu 52 Direktive 2001/82/EC.
Potvrda
Potpisana izjava Kvalifikovanog lica (QP) kojom se potvrđuje da je proces ili test izvršen u skladu sa Smernicama dobre proizvođačke prakse i važećom dozvolom za stavljanje leka u promet ili odobrenjem za kliničko ispitivanje, proizvodnim dosijeom leka i/ili tehničkim sporazumom, ako je to primenjivo, u skladu sa pisanim ugovorom sa Kvalifikovanim licem (QP) odgovornim za sertifikovanje serije gotovog leka pre puštanja u promet. Kvalifikovano lice (QP) koje izdaje potvrdu preuzima odgovornost za aktivnosti koje su obuhvaćene potvrdom.
Sertifikovanje serije gotovog proizvoda.
Sertifikovanje u registru ili ekvivalentnom dokumentu od strane Kvalifikovanog lica (QP), kako je definisano u članu 51 Direktive 2001/83/EC, sa izmenama i dopunama i članu 55 Direktive 2001/82/EC, i predstavlja odobravanje kvaliteta serije pre puštanja serije leka u promet.
Serija gotovog proizvoda. Sa upućivanjem na kontrolu ili testiranje gotovog proizvoda, serija gotovog leka opisana je u Aneksu I, deo I, tačka 3.2.2.5, Direktive 2001/83/EC i Aneksu I, deo 2, poglavlje E, Direktive 2001/82/EC. U kontekstu ovog aneksa izraz posebno označava seriju proizvoda u svom finalnom pakovanju za puštanje u promet.
Uvoznik. Nosilac dozvole propisane u članu 40 (3) Direktive 2001/83/EC, sa izmenama i dopunama, kao i članom 44 (3) Direktive 2001/82/EC, za uvoz lekova iz trećih zemalja.
Dodatak I
Sadržaj potvrde o delu procesa proizvodnje leka
[Pismo lica odgovornog za proizvodnju proizvođača koji je izvršio proizvodnu aktivnost]
1. Ime proizvoda i opis faze proizvodnje (npr. Paracetamol 500 mg tablete, primarno pakovanje u blister pakovanju).
2. Broj serije.
3. Naziv i adresa mesta na kome se obavlja deo procesa a proizvodnje.
4. Pozivanje na Tehnički ugovor o kvalitetu (u skladu sa Poglavljem 7 Smernica).
5. Izjava o potvrđivanju.
Ovim potvrđujem da su faze proizvodnje navedene u Tehničkom ugovoru o kvalitetu izvršene u potpunosti u skladu sa zahtevima dobre proizvođačke prakse važećoj u Evropskoj uniji i uslovima navedenim u ugovoru o obezbeđivanju usklađenosti sa zahtevima iz dozvole za stavljanje leka u promet, koje je obezbedio [Davalac ugovora/proizvođač koji sertifikuje i pušta seriju u promet].
6. Ime Kvalifikovanog lica (QP) koje potvrđuje deo postupka proizvodnje.
7. Potpis Kvalifikovanog lica (QP) koje potvrđuje deo proizvodnje.
8. Datum potpisivanja.
Dodatak II
Sadržaj sertifikata o puštanju serije leka
[Pismo lica odgovornog za sertifikovanje i puštanje serije leka u promet proizvođača]
1. Ime leka, jačina, farmaceutski oblik i veličina pakovanja leka
2. Broj serije leka
3. Ime države gde se nalazi serija leka
4.. Izjava o sertifikovanju.
Ovim sertifikatom potvrđujem da su sve faze proizvodnje navedene serije leka izvršene u potpunosti u skladu sa zahtevima dobre proizvođačke prakse važećoj u Evropskoj uniji i (kada je u okviru EU) i sa zahtevima iz dozvole za stavljanje leka u promet u navedenoj državi.
5. Ime Kvalifikovanog lica (QP) koje sertifikuje seriju leka.
6. Potpis Kvalifikovanog lica (QP) koje sertifikuje seriju leka.
7. Datum potpisivanja.
PARAMETARSKO PUŠTANJE SERIJE LEKA U PROMET
1.1. Definicija termina "Parametarsko puštanje" koja se koristi u ovom aneksu zasniva se na definiciji koju predlaže Evropska organizacija za kvalitet: "Sistem puštanja leka u promet koji obezbeđuje da je proizvod propisanog kvaliteta na osnovu podataka prikupljenih u toku proizvodnog procesa i na osnovu usaglašenosti sa zahtevima smernice dobre proizvođačke prakse (GMP) koji se odnose na parametarsko puštanje."
1.2. Parametarsko puštanje leka treba da bude u skladu sa osnovnim zahtevima Smernice dobre proizvođačke prakse, odgovarajućim aneksima i uputstvima ovog aneksa.
2.1. Postoji saglasnost o tome da sveobuhvatna procesna ispitivanja i kontrole u toku procesa mogu u većoj meri da obezbede usaglašenost gotovog proizvoda sa specifikacijom nego što to može samo ispitivanje gotovog proizvoda.
2.2. Parametarsko puštanje može da se odobri za neke specifične parametre, kao alternativa rutinskom ispitivanju gotovih proizvoda. Odobrenje za parametarsko puštanje treba zajedno da daju, odbiju ili povuku osobe odgovorne za procenu kvaliteta proizvoda i GMP inspektori.
3. Parametarsko puštanje sterilnih proizvoda
3.1. U ovom aneksu se razmatra samo onaj deo parametarskog puštanja serije, koji se odnosi na rutinsko puštanje gotovih proizvoda, bez prethodno sprovedenog ispitivanja sterilnosti. Nesprovođenje ispitivanja sterilnosti dozvoljeno je samo ukoliko se dokaže da su ostvareni unapred zadati, validirani uslovi, koji u potpunosti obezbeđuju sterilnost proizvoda.
3.2. Ispitivanje sterilnosti, zbog statističkih ograničenja metode, daje mogućnost da se otkriju samo značajni propusti u postupku sterilizacije.
3.3. Parametarsko puštanje serije leka može biti odobreno ako Evidencije o proizvodnji serije leka pokazuju ispravnost proizvodnje date serije i pružaju dovoljno dokaza da je proizvodni proces dizajniran i validiran tako da je sterilnost proizvoda obezbeđena.
3.4. Trenutno se parametarsko puštanje serije može dozvoliti samo za proizvode koji se podvrgavaju završnoj, odnosno terminalnoj sterilizaciji u finalnom pakovanju.
3.5. Za parametarsko puštanje mogu se uzeti u obzir metode sterilizacije koje se prema zahtevima Evropske farmakopeje vrše vodenom parom, suvom toplotom i jonizujućim zračenjem.
3.6. Nije uobičajeno da se razmatra prikladnost potpuno novog proizvoda za parametarsko puštanje serije, jer su zadovoljavajući rezultati ispitivanja sterilnosti tokom određenog vremenskog perioda, deo kriterijuma prihvatljivosti za donošenje odluke o parametarskom puštanju serije. U slučaju kada je "novi" proizvod samo manja varijacija, sa stanovišta obezbeđenja sterilnosti, postojeći podaci o ispitivanju sterilnosti drugih proizvoda mogu se smatrati relevantnim.
3.7. Neophodno je uraditi analizu rizika sistema obezbeđenja sterilnosti, koja daje procenu mogućnosti puštanja nesterilnih proizvoda.
3.8. Proizvođač treba da ima istorijat dobre usaglašenosti sa zahtevima Smernice dobre proizvođačke prakse.
3.9. Prilikom procene usaglašenosti sa Smernicama dobre proizvođačke prakse, treba da se uzmu u obzir prethodno zabeleženi slučajevi nesterilnosti određenog proizvoda, kao i rezultati ispitivanja sterilnosti tog proizvoda i proizvoda koji prolaze kroz isti ili sličan sistem za obezbeđenje sterilnosti.
3.10. Na mestu proizvodnje i sterilizacije treba da radi iskusno, kvalifikovano osoblje za obezbeđenje sterilnosti kao i mikrobiolog.
3.11. Dizajn i originalna validacija određenog proizvoda treba da garantuju očuvanje integriteta pod svim relevantnim uslovima.
3.12. U sistemu kontrole izmena treba da se postavi zahtev da zaposleni čija je odgovornost obezbeđenje sterilnosti, izvrše pregled izmena.
3.13. Treba da postoji sistem za ispitivanje mikrobiološke kontaminacije proizvoda pre sterilizacije.
3.14. Treba da se isključi svaka mogućnost mešanja sterilisanih i nesterilisanih proizvoda. Fizičke barijere ili validirani elektronski sistemi mogu da spreče takvu mogućnost.
3.15. Potrebno je kroz najmanje dva nezavisna sistema da se proveri da li zapisi o sterilizaciji odgovaraju specifikaciji. Ovaj sistem provere mogu da čine dva operatera ili validirani kompjuterizovani sistem i jedna osoba, koja vrši proveru.
3.16. Pre parametarskog odobravanja svake serije proizvoda, potrebno je potvrditi sledeće:
- da je obavljeno planirano održavanje i rutinske provere sterilizatora koji se upotrebljava;
- da su odgovorne osobe za obezbeđenje sterilnosti i mikrobiolog, odobrili sve popravke i modifikacije;
- da su svi instrumenti kalibrisani;
- da je sterilizator validiran za odgovarajući raspored punjenja i proizvod koji je u njemu bio podvrgnut postupku sterilizacije.
3.17. Nakon što se dobije dozvola/odobrenje za parametarsko puštanje, odluka o puštanju ili odbijanju serije treba da se zasniva na usaglašenosti sa odobrenim specifikacijama. Neusaglašenost sa specifikacijom treba da se uzme u obzir za parametarsko puštanje, bez obzira na kasnije zadovoljavajuće rezultate ispitivanja sterilnosti.
Napomena:
Ovaj aneks treba primeniti zajedno sa CPMP/QWP/3015/99 koji je evropska Komisija za lekove (CPMP) usvojila februara 2001.
Parametarsko puštanje
Sistem puštanja serije leka koji daje garanciju da je proizvod propisanog kvaliteta na osnovu podataka prikupljenih u toku proizvodnog procesa i na osnovu usaglašenosti sa specifičnim zahtevima Smernice dobre proizvođačke prakse koji se odnose na parametarsko puštanje.
Sistem za obezbeđenje sterilnosti
Sve aktivnosti i aranžmani preduzeti da bi se obezbedila sterilnost proizvoda. Za proizvode koji se sterilišu na kraju procesa po pravilu obuhvata sledeće:
(a) Dizajn/razvoj proizvoda;
(b) Poznavanje i, ako je primenljivo, kontrolu mikrobiološke čistoće polaznih materijala i procesnih pomoćnih sredstava (npr. gasovi i lubrikansi);
(c) Kontrolu kontaminacije tokom procesa proizvodnje kako bi se sprečila mikrobiološka kontaminacija proizvoda. Ovo se po pravilu postiže čišćenjem i sanitizacijom površina koje dolaze u kontakt sa proizvodom, sprečavanjem kontaminacije putem vazduha radom u čistim sobama, uspostavljanjem vremenskih rokova za procesne kontrole i, ako je primenljivo, faze filtracije;
(d) Sprečavanje mešanja tokova kretanja sterilnih i nesterilnih proizvoda;
(e) Održavanje integriteta proizvoda;
(f) Proces sterilizacije;
(g) Sistem kvaliteta koji obuhvata sistem za obezbeđenje sterilnosti, npr. kontrolu izmena, obuke, pisane procedure, kontrole pre puštanja, planirano preventivno održavanje, analizu stanja kvarova, sprečavanje greške operatera, validaciju, kalibraciju itd.
REFERENTNI I KONTROLNI UZORCI
1.1. Ovaj aneks daje smernice za uzimanje i čuvanje referentnih uzoraka polaznih materijala, materijala za pakovanje i gotovih proizvoda, kao i kontrolnih uzoraka gotovih proizvoda.
1.2. Specifični zahtevi za lekove namenjene za kliničko ispitivanje dati su u Aneksu 13.
1.3. Ovaj aneks takođe sadrži i smernice za uzimanje kontrolnih uzoraka paralelno uvezenih/distribuiranih lekova.
2.1 Uzorci se čuvaju iz dva razloga: prvo da bi se obezbedio uzorak za analitičko ispitivanje, i kao drugo, da bi se obezbedio primerak gotovog proizvoda. Uzorci se stoga svrstavaju u dve kategorije:
Referentni uzorak: uzorak serije polaznog materijala, materijala za pakovanje ili gotovog proizvoda koji se čuva radi analize za vreme roka upotrebe date serije, ukoliko za tim bude potrebe. U slučaju kada to njihova stabilnost dozvoljava, treba da se čuvaju i referentni uzorci iz kritičnih međufaza proizvodnje (npr. onih koje je potrebno analitički testirati i odobriti za dalju upotrebu) ili uzorci međuproizvoda koji su isporučeni na mesto van kontrole proizvođača.
Kontrolni uzorak: uzorak potpuno upakovanog proizvoda iz serije gotovih proizvoda. Ovakav uzorak se čuva radi identifikacije, npr. izgleda, pakovanja, obeležavanja, sažetka karakteristika leka, uputstva za pacijenta, broja serije, datuma isteka roka upotrebe, ako se pojavi potreba za tim tokom roka upotrebe date serije. U izuzetnim slučajevima nije potrebno čuvati duple uzorke npr. kada se pakuju male serije proizvoda za različita tržišta ili kada je u pitanju veoma skup proizvod.
Za gotove proizvode, u većini slučajeva referentni i kontrolni uzorci su identični, tj. čuvaju se kao potpuno upakovane jedinice proizvoda. U tim slučajevima, referentni i kontrolni uzorci se mogu smatrati međusobno zamenljivim.
2.2 Neophodno je da se kod proizvođača, uvoznika ili na prijavljenom mestu puštanja serije leka u promet, kako je definisano u Poglavljima 7 i 8, čuvaju referentni i/ili kontrolni uzorci svake proizvedene serije gotovog proizvoda, kao i da proizvođač čuva referentni uzorak serije polaznog materijala (uzeti u obzir određene izuzetke - videti stav 3.2 u nastavku) i/ili međuproizvoda. Svako mesto proizvodnje gde se vrši pakovanje treba da čuva referentne uzorke svake serije materijala za pakovanje, unutrašnjeg i štampanog. Prihvatljivo je čuvanje uzoraka materijala za pakovanje kao sastavnog dela referentnog i/ili kontrolnog uzorka gotovog proizvoda.
3.1 Referentni i kontrolni uzorci svake serije gotovog proizvoda treba da se čuvaju najmanje godinu dana nakon isteka roka upotrebe. Referentni uzorak treba da se čuva u svom originalnom unutrašnjem pakovanju ili u pakovanju napravljenom od istog materijala kao i unutrašnje pakovanje u kome se gotov proizvod stavlja u promet (za veterinarske lekove koji ne spadaju u imunološke proizvode, videti Aneks 4, tač. 8. i 9).
3.2 Osim ako zakon države članice, koja je ujedno i zemlja proizvodnje, ne propisuje duži period, uzorci polaznih materijala (osim rastvarača, gasova ili vode koja se koristi u procesu proizvodnje), treba da se čuvaju najmanje dve godine nakon puštanja leka u promet. Taj period može biti skraćen ukoliko je period stabilnosti materijala kraći, kako je navedeno u relevantnoj specifikaciji. Materijal za pakovanje treba da se čuva do isteka roka upotrebe gotovog proizvoda.
4. Veličina referentnih i kontrolnih uzoraka
4.1 Veličina referentnog uzorka treba da bude dovoljna da omogući, bar u dva navrata, celokupno analitičko ispitivanje te serije u skladu sa registracionom dokumentacijom koja je procenjena i odobrena od strane nadležnog organa.
4.2 Nacionalni propisi, tamo gde su u primeni, koji se odnose na veličinu referentnih uzoraka i ako je neophodno, kontrolnih uzoraka, treba da se poštuju.
4.3 Referentni uzorci treba da budu reprezentativni za seriju polaznog materijala, međuproizvoda ili gotovog proizvoda iz koje su uzeti. Mogu se uzimati i drugi uzorci koji služe za praćenje najkritičnijih delova procesa (npr. početka ili kraja procesa). Kada se serija pakuje u dva ili više odvojenih procesa pakovanja, treba da se uzme najmanje po jedan kontrolni uzorak iz svakog procesa pakovanja. Bilo koji predloženi izuzetak od napred navedenog treba da se obrazloži i sa njim treba da se složi relevantan nadležni organ.
4.4 Treba da se obezbedi da svi neophodni analitički materijali i oprema budu na raspolaganju ili da se mogu lako nabaviti, kako bi se mogli izvršiti svi testovi dati u specifikaciji, do godinu dana nakon isteka roka upotrebe poslednje proizvedene serije.
5.1 Čuvanje referentnih uzoraka gotovih proizvoda i aktivnih supstanci treba da bude u skladu sa važećom verzijom Smernice za određivanje uslova čuvanja medicinskih proizvoda i aktivnih supstanci.
5.2 Uslovi čuvanja treba da budu u skladu sa dozvolom za stavljanje leka u promet (npr. čuvanje u hladnim komorama kada je to potrebno).
6.1 Kada nosilac dozvole za stavljanje leka u promet nije isto pravno lice kao za prijavljeno mesto puštanja serije leka u promet u okviru EEZ, odgovornost za uzimanje i čuvanje referentnih/kontrolnih uzoraka treba da se definiše u pisanom ugovoru koji potpisuju obe ugovorne strane u skladu sa Poglavljem 7 Smernice dobre proizvođačke prakse. Ovo se primenjuje i u slučaju kada se neki od postupaka proizvodnje ili puštanje serije leka u promet izvode na mestu različitom od onog koje ima potpunu odgovornost za seriju leka na EEZ tržištu, a pisanim ugovorom između ugovornih strana treba da budu definisane pojedinačne odgovornosti za uzimanje i čuvanje referentnih/kontrolnih uzoraka.
6.2 Kvalifikovano lice koje pušta seriju leka u promet treba da obezbedi da svi relevantni referentni i kontrolni uzorci budu dostupni u razumnom vremenskom roku. U slučaju kada je to potrebno, treba da postoje pisani ugovori o ovakvim dogovorima.
6.3 Kada se proizvodnja gotovog proizvoda obavlja na više proizvodnih mesta, dostupnost pisanih ugovora je ključni element za kontrolu uzimanja i čuvanja referentnih i kontrolnih uzoraka.
7. Referentni uzorci - opšte odredbe
7.1 Referentni uzorci služe za analizu i stoga treba da budu dostupni laboratoriji koja koristi validirane metode. Za uzorke polaznih materijala koji se koriste za proizvodnju lekova u EEZ, to je mesto proizvodnje gotovog proizvoda. Za uzorke gotovih proizvoda koji su proizvedeni u okviru EEZ, to je mesto proizvodnje gotovog proizvoda.
7.2 Za gotove proizvode proizvedene u zemlji izvan EEZ:
7.2.1 tamo gde važi Sporazum o uzajamnom priznavanju (MRA), referentni uzorci mogu se uzeti i čuvati na mestu proizvodnje gotovog proizvoda. Ovo treba da bude definisano u pisanom ugovoru (kao što je pomenuto u prethodnoj tački 6) između uvoznika/mesta puštanja serije leka u promet i proizvođača koji se nalazi izvan EEZ.
7.2.2 tamo gde ne važi Sporazum o uzajamnom priznavanju (MRA), referentni uzorci gotovog proizvoda mogu se uzeti i čuvati od strane proizvođača koji ima dozvolu za proizvodnju, a koji se nalazi u okviru EEZ. Ovi uzorci treba da se uzimaju u skladu sa pisanim ugovorom (ili ugovorima) zaključenim između svih ugovornih strana. Ove uzorke je najbolje čuvati na mestu gde su obavljena testiranja za uvoz.
7.2.3 Referentni uzorci polaznih i materijala za pakovanje treba da se čuvaju na mestu proizvodnje gde su korišćeni za proizvodnju medicinskog proizvoda.
8. Kontrolni uzorci - opšte odredbe
8.1 Kontrolni uzorci treba da budu reprezentativni za celu seriju gotovih proizvoda koji se distribuiraju u okviru EEZ i namenjeni su za ispitivanje u cilju potvrđivanja netehničkih osobina koje treba da budu u saglasnosti sa Dozvolom za stavljanje u promet ili zakonskom regulativom EU. Zbog toga kontrolni uzorci treba da se čuvaju u okviru EEZ. Najbolje je da se čuvaju na mestu gde se nalazi Kvalifikovano lice koje pušta seriju leka u promet.
8.2 U skladu sa prethodnom tačkom 8.1, kada je na snazi Sporazum o uzajamnom priznavanju i kada se referentni uzorci čuvaju kod proizvođača u zemlji izvan EEZ (navedeno u tački 7.2.2.), odvojeni kontrolni uzorci treba da se čuvaju unutar EEZ.
8.3 Kontrolni uzorci treba da se čuvaju u objektima proizvođača koji ima dozvolu za proizvodnju, kako bi se nadležnim organima omogućio lakši pristup.
8.4 Kada je više od jednog mesta proizvodnje unutar EEZ uključeno u proizvodnju/pakovanje/kontrolu/puštanje serije u promet, u zavisnosti od proizvoda, odgovornost za uzimanje i čuvanje kontrolnih uzoraka treba da bude definisana pisanim ugovorom zaključenim između ugovornih strana.
9. Referentni i kontrolni uzorci za paralelno uvezene/distribuirane proizvode
9.1 Kada se spoljašnje pakovanje proizvoda ne otvara, treba da se čuva samo materijal za pakovanje koji je korišćen, jer ne postoji, ili je nizak rizik od mešanja proizvoda.
9.2 Kada se spoljašnje pakovanje otvara, na primer, da bi se promenila kartonska kutija ili uputstvo za pacijenta, onda treba da se čuva po jedan kontrolni uzorak za svaki postupak pakovanja, jer postoji rizik od zamene proizvoda u toku prepakivanja. Važno je da se omogući brzo otkrivanje odgovornosti u slučaju zamene proizvoda (originalni proizvođač ili prepakivač u slučaju paralelnog uvoza proizvoda) i određivanje obima povlačenja iz prometa u slučaju da je to potrebno.
10. Referentni i kontrolni uzorci u slučaju prestanka rada proizvođača
10.1 Kada proizvođač prestane sa radom i kada se Dozvola za proizvodnju ukine, opozove ili prestane da važi, verovatno će biti u prometu mnoge serije lekova koje je proizveo taj proizvođač, a kojima rok upotrebe nije istekao. Da bi te serije proizvoda mogle ostati u prometu, proizvođač treba da napravi precizne ugovore o prenosu referentnih i kontrolnih uzoraka (i odgovarajuće GMP dokumentacije) na ovlašćeno mesto čuvanja. Proizvođač treba da dokaže nadležnom organu da su ugovori o čuvanju uzoraka zadovoljavajući i da će uzorci biti dostupni, ako bude potrebe za tim, za eventualno ispitivanje.
10.2 Ako proizvođač nije u mogućnosti da zaključi neophodne ugovore može se delegirati drugi proizvođač. Nosilac dozvole za stavljanje leka u promet nadležan je da odredi drugog proizvođača i da pruži sve neophodne informacije nadležnim organima. Pored toga, nosilac dozvole za stavljanje leka u promet, u vezi sa predloženim ugovorima za čuvanje referentnih i kontrolnih uzoraka, treba da konsultuje nadležni organ svake od zemalja članica u kojoj je puštena u promet bilo koja serija kojoj nije istekao rok upotrebe.
10.3 Ovi uslovi se takođe odnose na slučaj prestanka rada proizvođača koji se nalazi izvan EEZ. U tom slučaju, uvoznik je odgovoran da obezbedi zaključivanje ovakvih ugovora i konsultovanje nadležnih organa.
Rečnik
Definicije date u ovom rečniku odnose se na izraze date u Smernicama dobre proizvođačke prakse. U drugom kontekstu one mogu imati drugačije značenje.
Banka ćelija
Sistem banke ćelija je sistem kojim se proizvode uzastopne serije proizvoda pomoću ćelijskih kultura dobijenih od iste matične, glavne banke ćelije. Za pripremu radne banke ćelija koristi se veliki broj kontejnera iz glavne banke ćelija. Validacija sistema banke ćelija vrši se za svaki nivo pasaža ili broja udvostručavanja populacije iznad onog postignutog u toku rutinske proizvodnje.
Matična banka ćelija: Kultura (potpuno karakterizovanih) ćelija podeljena u kontejnere jedinstvenim postupkom, prerađenih (procesuiranih) zajedno na način koji obezbeđuje njihovu uniformnost i koja se čuva na način koji obezbeđuje stabilnost. Matična banka ćelija se obično čuva na temperaturi od -70 °C ili nižoj temperaturi.
Radna banka ćelija: Kultura ćelija, dobijena iz matične banke ćelija, koja je namenjena za upotrebu u pripremi proizvodnje ćelijske kulture. Radna banka ćelija se obično čuva na temperaturi od -70 °C ili nižoj temperaturi.
Biološki agensi
Biološki agensi su mikroorganizmi, koji mogu biti patogeni ili ne, uključujući i mikroorganizme dobijene genetskim inženjeringom, zatim kulture ćelija i endoparaziti.
Biljna droga
Biljna droga je sveža ili osušena lekovita biljka ili određeni delovi sveže ili osušene lekovite biljke.
Biljni lek
Lek koji, kao aktivne supstance, sadrži isključivo biljni materijal i/ili preparate biljnih droga.
Bioreaktor
Zatvoren sistem, npr. fermentor, u koji se biološki agensi uvode zajedno sa drugim supstancama u cilju njihovog umnožavanja ili proizvodnje supstanci reakcijom sa drugim jedinjenjima. Bioreaktori su obično opremljeni uređajima za podešavanje uslova, kontrolu, povezivanje, dodavanje i ispuštanje supstanci.
Broj serije
Karakteristična kombinacija brojeva i/ili slova koja specifično identifikuje seriju.
Boca (cilindar)
Kontejner dizajniran za čuvanje gasa pod visokim pritiskom.
Validacija
Validacija je dokumentovano dokazivanje u skladu sa Smernicama dobre proizvođačke prakse, da svaka procedura, proces, oprema, materijal, aktivnost ili sistem dosledno dovodi do očekivanog rezultata.
Vazdušni propusnik
Zatvoreni prostor sa dvoja ili više vrata koji je postavljen između dve ili više prostorija, npr. različite klase čistoće, u cilju kontrole protoka vazduha između tih prostorija prilikom ulaska u njih. Vazdušni propusnik je dizajniran i koristi za prolaz ljudi ili materijala.
Gotov proizvod
Proizvod koji je prošao sve faze procesa proizvodnje, uključujući i pakovanje u njegovo spoljno pakovanje.
Egzotičan (visokoinfektivan) mikroorganizam
Biološki agens za koji, ili u određenoj zemlji ili geografskom području ne postoji bolest koju on izaziva, ili ta bolest podleže profilaktičkim merama ili programu iskorenjivanja/eradikacije.
Inficiran
Kontaminiran stranim biološkim agensima i zbog čega je potencijalno u stanju da dalje širi infekciju.
Izolacija
Izolacija je postupak zadržavanja bioloških agenasa ili drugih materijala u definisanom/ograničenom prostoru.
Primarna izolacija je sistem izolacije kojim se sprečava izlazak bioloških agenasa u neposredno radno okruženje. Podrazumeva upotrebu zatvorenih kontejnera ili sigurnosnih bioloških kabineta, zajedno sa primenom odgovarajućih bezbednosnih operativnih postupaka.
Sekundarna izolacija je sistem izolacije kojim se sprečava izlazak bioloških agenasa u spoljnu sredinu ili druge radne prostore. Podrazumeva upotrebu soba/prostorija sa specijalno projektovanim regulisanjem protoka vazduha, postojanje vazdušnih propusnika i/ili sterilizatora za izlaz materijala i primenu odgovarajućih bezbednosnih operativnih procedura. U mnogim slučajevima ona se može koristiti za povećanje efektivnosti primarne izolacije.
Izolovan/ograničen prostor (čista soba)
Prostor koji je konstruisan i funkcioniše tako (sa odgovarajućim sistemom za vazduh i filtraciju) kojim se sprečava kontaminacija spoljašnje sredine biološkim agensima iz tog prostora.
Izvor semena (seed lot)
Sistem izvora semena (seed lot): Sistem prema kome se uzastopne serije nekog proizvoda dobijaju od istog matičnog/glavnog izvora semena sa datim brojem pasaža. Za rutinsku proizvodnju radni izvor semena priprema se od matičnog/glavnog izvora semena. Gotov proizvod se dobija iz radnog izvora semena i on u odnosu na matični/glavni izvor semena nema više pasaža nego što ima vakcina za koju je u kliničkim ispitivanjima dokazana zadovoljavajuća bezbednost i efikasnost. O poreklu i sledljivosti (istorijat) matičnog/glavnog izvora semena i radnog izvora semena moraju da se vode zapisi
Glavni/matični izvor semena: Kultura mikroorganizama koja se u jednoj operaciji distribuira iz zbirne količine u kontejnere na način kojim se obezbeđuje ujednačenost, sprečava kontaminacija i obezbeđuje odgovarajuća stabilnost. Glavni/matični izvor semena, u tečnom obliku, se obično čuva na temperaturi od minus 70 °C ili nižoj. Liofiliziran glavni/matični izvor semena: se čuva na temperaturi za koju je dokazano da obezbeđuje stabilnost.
Radni izvor semena: Kultura mikroorganizama dobijena od matičnog/glavnog izvora semena namenjena za upotrebu u proizvodnji. Radni izvor semena se distribuira u kontejnere i čuva na isti način kao i matični/glavni izvor semena.
Kalibracija
Skup operacija kojima se, pod određenim uslovima, utvrđuje odnos između vrednosti koje pokazuje merni instrument ili merni sistem, ili vrednosti predstavljenih merenjem materijala i odgovarajućih poznatih vrednosti referentnih standarda.
Karantin
Status polaznih supstanci ili materijala za pakovanje, međuproizvoda ili poluproizvoda, odnosno gotovih proizvoda, koji su fizički ili na neki drugi efektivan način odvojeni, u periodu do donošenja odluke o njihovom odobravanju ili neodobravanju za dalju upotrebu, odnosno za puštanje serije gotovog leka u promet.
Kvalifikacija
Dokumentovan postupak kojim se dokazuje da sva oprema i sistemi funkcionišu ispravno i dosledno daju očekivane rezultate. Termin validacija se nekad upotrebljava i u širem značenju, obuhvatajući pojam kvalifikacije.
Kompjuterizovani sistem
Sistem koji obuhvata unos podataka, elektronsku obradu podataka i izlazne podatke koji se koriste za pripremu izveštaja ili automatsko upravljanje procesima.
Kontrolisan prostor
Prostor koji je konstruisan i funkcioniše tako da postoji kontrola unosa potencijalnih kontaminanata (dovod vazduha čiji kvalitet približno odgovara D klasi čistoće može biti odgovarajući) i posledice slučajnog oslobađanja živih organizama. Stepen primenjene kontrole mora da bude primeren prirodi organizama koji se koriste u procesu. U ovom prostoru, u najmanjem, mora da se održava negativan pritisak u odnosu na neposredno okruženje i mora biti obezbeđeno efektivno uklanjanje manjih količina kontaminanata iz vazduha.
Kriogeni kontejner/sud
Kontejner dizajniran za čuvanje tečnog gasa na izuzetno niskim temperaturama.
Lek
Svaka supstanca ili kombinacija supstanci namenjena za lečenje ili sprečavanje bolesti kod ljudi ili životinja.
Lekom se smatra svaka supstanca ili kombinacija supstanci koja može da se daje ljudima ili životinjama za postavljanje dijagnoze, ili za vraćanje, poboljšanje ili modifikovanje fizioloških funkcija kod ljudi ili životinja.
Lekovita biljka
Cela biljka ili njen deo koji se koristi u medicinske svrhe.
Materijal za pakovanje
Bilo koji materijal koji se koristi za pakovanje leka, izuzev zbirnog pakovanja koje se koristi prilikom transporta ili otpremanja. Materijal za pakovanje može biti za unutrašnje (primarni) ili spoljnje (sekundarno), u zavisnosti od toga da li je u direktnom kontaktu sa proizvodom ili nije.
Međuproizvod
Delimično procesuiran materijal koji mora da bude podvrgnut narednim proizvodnim koracima pre nego što postane poluproizvod (proizvod u bulk-u).
Pakovanje
Sve operacije, uključujući punjenje i obeležavanje, kojima mora da se podvrgne poluproizvod (proizvod u bulk-u) kako bi se dobio gotov proizvod.
Napomena: Sterilno punjenje se, po pravilu, ne smatra delom postupka pakovanja, jer se puni primarni kontejner, a ne finalno pakovanje.
Polazna supstanca
Svaka supstanca koja se koristi u proizvodnji lekova, izuzev materijala za pakovanje.
Poluproizvod (proizvod u bulk-u)
Proizvod dobijen nakon završetka svih postupaka proizvodnje osim pakovanja u spoljno pakovanje.
Povraćaj
Postupak vraćanja leka proizvođaču ili distributeru koji može, ali ne mora, da bude defekt kvaliteta.
Proces proizvodnje
Sve operacije koji se primenjuju u proizvodnji gotovog proizvoda, od prijema polaznih materijala, preko obrade/procesiranja i pakovanja, do dobijanja gotovog proizvoda.
Procesna kontrola
Provere koje se vrše u toku procesa proizvodnje radi praćenja i, po potrebi, podešavanja procesa, kako bi se obezbedilo da proizvod odgovara svojoj specifikaciji. Kontrola ambijentalnih uslova ili opreme takođe se može smatrati delom procesne kontrole.
Proizvodnja
Sve aktivnosti koje obuhvataju nabavku polaznih supstanci, pakovnog materijala i proizvoda, proces proizvodnje, procesnu kontrolu, kontrolu kvaliteta, odobravanje supstanci i materijala za proizvodnju, odnosno puštanje u promet serije gotovog proizvoda, skladištenje, distribuciju lekova i odgovarajuće kontrole u vezi sa navedenim aktivnostima.
Proizvođač
Proizvođač lekova je nosilac dozvole za proizvodnju lekova članu 40. Direktive 2001/83/EC.
Procedure
Opis svih operacija koje treba izvršiti, mere predostrožnosti koje treba preduzeti i mere koje se primenjuju a koje su, direktno ili indirektno, vezane za proizvodnju lekova.
Radiofarmaceutski lekovi
Radiofarmaceutski lekovi ili tzv. "radiofarmaceutici" su svi lekovi koji u trenutku kada su pripremljeni za upotrebu u medicinske svrhe sadrže jedan ili više radionuklida (radioaktivnih izotopa), član 1(6) Direktive 2001/83/EC.
Razvodnik (manifold)
Oprema ili aparat projektovan tako da omogućuje istovremeno punjenje jednog ili više kontejnera za gas iz istog izvora.
Regeneracija (recovery)
Uvođenje cele ili dela prethodno proizvedene serije zahtevanog kvaliteta u drugu seriju u određenoj fazi postupka proizvodnje.
Reprocesiranje/prerada
Prerada cele serije ili dela serije leka nezadovoljavajućeg kvaliteta iz određene faze proizvodnje, tako da se nakon jedne ili više dodatnih operacija može postići zahtevani kvalitet.
Serija
Određena količina polaznih supstanci, materijala za pakovanje ili proizvoda dobijenih u jednom procesu ili seriji procesa tako da se može očekivati da je homogena.
Napomena:
Radi završetka određene faze u procesu proizvodnje, može da bude neophodno da se serija podeli na nekoliko podserija, koje će kasnije biti sjedinjene u finalnu homogenu seriju. U slučaju kontinuirane proizvodnje, serija mora da odgovara tačno definisanom delu procesa proizvodnje, koji se karakteriše očekivanom homogenošću.
U definiciji kontrole kvaliteta gotovog proizvoda datoj u Aneksu 1. Direktive 2001/83/EC, koja je dopunjena Direktivom 2003/63/EC, navedeno je: "za potrebe kontrole kvaliteta gotovog proizvoda, serija leka podrazumeva ukupnu količinu gotovog proizvoda (finalnog farmaceutskog oblika) proizvedenog od iste početne količine polaznih supstanci i koje potiču od jedne serije proizvodnih operacija ili jednog postupka sterilizacije ili, u slučaju kontinuirane proizvodnje, ukupna količina gotovog proizvoda proizvedena u određenom vremenskom periodu".
Sistem
Termin "sistem" koristi se u smislu modela međusobno povezanih aktivnosti i tehnika u cilju formiranja organizovane celine.
Standardna operativna procedura (SOP)
Detaljan opis svih aktivnosti koje treba izvršiti, mere predostrožnosti koje treba poštovati, a koje se direktno ili indirektno odnose na proizvodnju lekova.
Sterilnost
Sterilnost podrazumeva odsustvo živih mikroorganizama. Uslovi za test sterilnosti dati su u Evropskoj farmakopeji.
Tečni gas
Gas koji prilikom punjenja, pri normalnoj temperaturi i pritisku, ostaje u tečnom stanju u boci.
Ćelijska kultura
Proizvod in-vitro gajenih ćelija izolovanih iz višećelijskog organizma.
Unakrsna kontaminacija
Kontaminacija materijala ili proizvoda drugim materijalom ili proizvodom.
Usaglašavanje/obračun prinosa
Poređenje, uzimajući u obzir normalna/uobičajena odstupanja između teoretskih i stvarno dobijenih proizvoda ili upotrebljenih količina polaznih supstanci i materijala.
Čist prostor
Prostor sa definisanom ambijentalnom kontrolom čestične i mikrobiološke kontaminacije, koji je konstruisan i koristi se na način kojim je smanjeno unošenje, stvaranje i zadržavanje kontaminanata u prostoru.
Napomena:
Različite klase čistoće definisane su u Aneksu 1 Smernica dobre proizvođačke prakse
Čist/izolovan prostor (čista soba)
Prostor koji je konstruisan i funkcioniše tako da omogućava istovremeno ispunjavanje uslova čistog prostora i izolovanog prostora, odnosno čiste prostorije (čista soba).
OSNOVNI ZAHTEVI ZA PROIZVODNJU AKTIVNIH SUPSTANCI KOJE SE UPOTREBLJAVAJU U PROIZVODNJI LEKOVA
Ove smernice su objavljene u novembru 2000. godine kao Aneks 18 Smernica dobre proizvođačke prakse u cilju usaglašavanja EU regulative sa ICH Q7A, a koristili su ih proizvođači i GMP inspektorati na dobrovoljnoj osnovi. Član 46 (f) Direktive 2001/83/EC i član 50 (f) Direktive 2001/82/EC, izmenjeni i dopunjeni Direktivom 2004/27/EC, odnosno 2004/28/EC, postavljaju nove obaveze nosiocima dozvole za proizvodnju da koriste samo aktivne supstance koje su proizvedene u skladu sa Dobrom proizvođačkom praksom za polazne supstance. U ovim direktivama se dalje navodi da principi dobre proizvođačke prakse za polazne supstance treba da budu usvojeni kao detaljne smernice. Zemlje članice su se saglasile da tekst ranijeg Aneksa 18 treba da čini osnovu detaljnih smernica koje predstavljaju Drugi deo Smernica dobre proizvođačke prakse.
1.1 Cilj
Ove smernice treba da obezbede instrukcije u pogledu dobre proizvođačke prakse (GMP) za proizvodnju aktivnih supstanci u okviru odgovarajućeg sistema upravljanja kvalitetom. Namera je takođe da se pomogne u obezbeđivanju da aktivne supstance dostignu zahteve u pogledu kvaliteta i čistoće koje prema navodima ili tvrdnjama one poseduju.
U ovim smernicama "proizvodnja" podrazumeva sve operacije prijema materijala, proizvodnje, pakovanja, prepakivanja, obeležavanja, ponovnog obeležavanja, kontrole kvaliteta, puštanja u promet, skladištenja i distribucije aktivnih supstanci i odgovarajućih kontrola. Termin "treba" označava preporuke za koje se očekuje da budu primenjene, izuzev ako se pokaže da su neprimenljive, modifikovane odgovarajućim aneksima Smernica dobre proizvođačke prakse ili zamenjene alternativom za koju je dokazano da može da obezbedi bar podjednak nivo obezbeđenja kvaliteta.
Smernice dobre proizvođačke prakse kao celina ne obuhvataju aspekte bezbednosti osoblja zaposlenog u proizvodnji, niti aspekte zaštite životne sredine. Ove kontrole predstavljaju pripadajuću obavezu proizvođača i regulisane su drugim zakonskim propisima.
Namera ovih smernica nije da definišu zahteve za registraciju ili da modifikuju zahteve farmakopeje i one ne utiču na mogućnost odgovornih nadležnih organa/institucija da uspostave specifične zahteve za registraciju aktivnih supstanci u kontekstu dozvola za promet/proizvodnju. Sve obaveze u registracionim dokumentima moraju da se ispune.
1.2 Područje primene
Ove smernice se odnose na proizvodnju aktivnih supstanci koje se upotrebljavaju u proizvodnji lekova kako za humanu, tako i veterinarsku upotrebu. One se odnose na proizvodnju sterilnih aktivnih supstanci samo do faze neposredno pre nego što aktivni sastojak postane sterilan. Sterilizacija i aseptični postupak izrade sterilnih aktivnih supstanci nisu obuhvaćeni ovim smernicama, već treba da se sprovode u skladu sa principima i smernicama dobre proizvođačke prakse na način kako je navedeno u Direktivi 2003/94/EC i detaljno dato u Smernicama dobre proizvođačke prakse, uključujući Aneks 1.
U slučaju ektoparazitika za veterinarsku upotrebu, osim ovih smernica, mogu da se koriste drugi standardi koji garantuju da je materijal odgovarajućeg kvaliteta.
Ove smernice se ne odnose na celu krv i plazmu, jer Direktiva 2002/98/EC i tehnički zahtevi koji podržavaju tu direktivu daju detaljne zahteve za prikupljanje i testiranje krvi; međutim, odnose se na aktivne supstance koji su proizvedene iz krvi ili plazme kao sirovina.
I na kraju, ove smernice se ne odnose na proizvode u bulk-u. One se odnose na sve ostale aktivne polazne materijale koji su predmet bilo kakvih odstupanja opisanih u aneksima Smernica dobre proizvođačke prakse, naročito u Aneksima od 2 do 7, u kojima mogu da se pronađu dodatne smernice za određene vrste aktivnih supstanci.
Odeljak 17 sadrži smernice za učesnike u lancu snabdevanja koji distribuiraju ili skladište aktivne supstance ili međuproizvode. Navedene smernice su, u skladu sa članom 47. Direktive 2001/83/EC, proširene u smernicama o principima dobre prakse u distribuciji aktivnih supstanci za humane lekove.
Odeljak 19 sadrži smernice koje se odnose samo na proizvodnju aktivnih supstanci koje se koriste u proizvodnji lekova namenjenih za klinička ispitivanja, mada treba imati u vidu da njegovu primenu, u ovom slučaju, mada se preporučuje, zakonski propisi Zajednice ne zahtevaju.
"Polazni materijal za aktivnu supstancu" je sirovina, međuproizvod ili aktivna supstanca koja se koristi u proizvodnji aktivne supstance i koja je ugrađena kao značajan strukturni deo u strukturu aktivne supstance. Polazni materijal za aktivnu supstancu može da bude komercijalni proizvod, materijal nabavljen od jednog ili više ugovornih dobavljača ili proizveden od strane samog proizvođača aktivne supstance. Polazni materijali za aktivnu supstancu obično imaju utvrđena hemijska svojstva i strukturu.
Proizvođač treba da odredi i dokumentuje argumente za tačku/fazu u kojoj započinje proizvodnja aktivne supstance. Kod procesa sinteze, ovo je poznato kao tačka/faza u kojoj se "polazni materijali za aktivnu supstancu" uvode u proces. Kod drugih procesa (npr. fermentacija, ekstrakcija, prečišćavanje, itd), ovi argumenti treba da se odrede za svaki slučaj ponaosob. U tabeli 1. date se instrukcije za određivanje tačke/faze u kojoj se polazni materijal za aktivnu supstancu obično uvodi u proces. Od ove tačke/faze pa nadalje, odgovarajuća Dobra proizvođačka praksa, onako kako je definisana u ovim smernicama, treba da se primenjuje na proizvodne faze za ove međuproizvode i/ili aktivne supstance. Validacija kritičnih faza procesa za koje je utvrđeno da utiču na kvalitet aktivne supstance mora da bude obuhvaćena. Međutim, treba imati u vidu da to što je proizvođač odlučio da validira neku fazu procesa ne znači obavezno da je taj deo procesa i kritičan. smernice iz ovog dokumenta po pravilu treba da se primenjuju na faze obeležene sivom bojom u tabeli 1. To ne znači da sve prikazane faze treba i da su sprovedene do kraja. Zahtevi dobre proizvođačke prakse u proizvodnji aktivnih supstanci treba da rastu kako se proces razvija od ranih faza do završnih faza, prečišćavanja i pakovanja. Fizička obrada aktivnih supstanci, kao što je, na primer, granulacija, oblaganje ili fizička manipulacija dimenzijama čestica (npr. mlevenje, mikronizacija), treba da se sprovodi bar u skladu sa standardima ovih smernica. Ove smernice se ne odnose na faze koje prethode prvom uvođenju utvrđene "polazne materije za aktivnu supstancu".
U ovim smernicama, često se koristi termin aktivni farmaceutski sastojak (API) i on treba da se smatra za ekvivalent termina "aktivna supstanca". Rečnik termina u Odeljku 20 Drugog dela smernice treba da se primenjuje samo u kontekstu Drugog dela. Neki od ovih istih termina su već definisani u Prvom delu Smernica dobre proizvođačke prakse i oni se primenjuju samo u kontekstu Prvog dela.
Tabela 1: Primena ovih smernica na proizvodnju aktivnih farmaceutskih supstanci (API)
Vrsta proizvodnje |
Primena ovih smernica na faze (obeležene sivom bojom) koje se koriste u ovoj vrsti proizvodnje |
||||
Hemijska proizvodnja |
Proizvodnja polazne materije za API |
Uvođenje polazne materije za API u proces |
Proizvodnja međuproizvoda (jednog ili više) |
Izolovanje i prečišćavanje |
Fizička obrada i pakovanje |
API dobijena iz izvora životinjskog porekla |
Prikupljanje organa, tečnosti ili tkiva |
Sečenje, mešanje i/ili početna obrada |
Uvođenje polazne materije za API u proces |
Izolovanje i prečišćavanje |
Fizička obrada i pakovanje |
API ekstrahovana iz izvora biljnog porekla |
Prikupljanje biljaka |
Sečenje i početna(e) ekstrakcija(e) |
Uvođenje polazne materije za API u proces |
Izolovanje i prečišćavanje |
Fizička obrada i pakovanje |
Biljni ekstrakti koji se koriste kao API |
Prikupljanje biljaka |
Sečenje i početna ekstrakcija |
|
Dalja ekstrakcija |
Fizička obrada i pakovanje |
API koja se sastoji od biljaka koje su izmrvljene ili pretvorene u prah |
Prikupljanje biljaka i/ili gajenje i berba |
Sečenje/mrvljenje |
|
|
Fizička obrada i pakovanje |
Biotehnologija: fermentacija/kultivacija ćelija |
Uspostavljanje glavne banke ćelija i radne banke ćelija |
Održavanje radne banke ćelija |
Kultivacija ćelija i/ili fermentacija |
Izolovanje i prečišćavanje |
Fizička obrada i pakovanje |
"Klasična" fermentacija radi proizvodnje API |
Uspostavljanje banke ćelija |
Održavanje banke ćelija |
Uvođenje ćelija u fermentaciju |
Izolovanje i prečišćavanje |
Fizička obrada i pakovanje |

2.1 Principi
2.10 Za kvalitet su odgovorna sva lica uključena u proizvodnju.
2.11 Svaki proizvođač treba da uspostavi, dokumentuje i primeni efektivan sistem upravljanja kvalitetom, koji podrazumeva aktivno učešće rukovodstva i odgovarajućeg proizvodnog osoblja.
2.12 Sistem upravljanja kvalitetom treba da obuhvata organizacionu strukturu, procedure, procese i resurse, kao i aktivnosti neophodne kako bi se garantovala pouzdanost da će aktivni farmaceutski sastojak (API) biti u skladu sa postavljenom specifikacijom u pogledu kvaliteta i čistoće. Sve aktivnosti u vezi sa kvalitetom treba da budu definisane i dokumentovane.
2.13 Treba da postoji služba(e) za kvalitet koja je nezavisna od proizvodnje i koja ispunjava zaduženja kako u pogledu obezbeđenja kvaliteta (QA), tako i kontrole kvaliteta (QC). Ovo može da se postigne u formi posebnih službi za QA i QC, ili kao jedno lice ili grupa, u zavisnosti od veličine i strukture organizacije.
2.14 Treba imenovati lica odgovorna za puštanje u promet međuproizvoda i aktivnih farmaceutskih sastojaka (API).
2.15 Sve aktivnosti u vezi sa kvalitetom treba da se evidentiraju u vreme sprovođenja.
2.16 Svako odstupanje od uspostavljenih procedura treba da se dokumentuje i obrazloži. Kritična odstupanja treba da se istraže, a istraživanje i njegove zaključke treba dokumentovati.
2.17 Nijedan materijal ne treba da se odobri za upotrebu pre nego što se na zadovoljavajući način završi procena od strane službe(i) za kvalitet, osim u slučaju kada postoje odgovarajući sistemi koji omogućavaju takvu upotrebu (npr. puštanje u promet pod uslovima karantina kao što je opisano u Odeljku 10.20 ili upotreba sirovina ili međuproizvoda u očekivanju završetka procene).
2.18 Treba da postoje procedure za blagovremeno obaveštavanje rukovodstva o regulatornim inspekcijama, ozbiljnim neusaglašenostima u pogledu dobre proizvođačke prakse, defektima proizvoda i o merama preduzetim u vezi sa tim (npr. reklamacije u pogledu kvaliteta, povlačenja, regulatorne mere, itd.).
2.19 U cilju postizanja kvaliteta mora da postoji sveobuhvatno dizajniran i pravilno implementiran sistem kvaliteta koji obuhvata zahteve dobre proizvođačke prakse, Kontrolu kvaliteta i Upravljanje rizikom kvaliteta.
2.2 Upravljanje rizikom kvaliteta
2.20 Upravljanje rizikom kvaliteta je sistematski proces koji obuhvata procenu, kontrolu, obaveštavanja i pregled rizika za kvalitet aktivne supstance, koji može da se primenjuje kako proaktivno, tako i retrospektivno
2.21 Sistem upravljanja rizikom kvaliteta treba da obezbedi sledeće:
- da se procena rizika zasniva na naučnim saznanjima i stečenom iskustvu u vezi sa procesom, kao i da je krajnji cilj povezan sa zaštitom pacijenata kroz komunikaciju sa korisnikom aktivne supstance;
- da je nivo preduzetih aktivnosti, postupanja po proceduri i dokumentovanja procesa upravljanja rizikom kvaliteta srazmeran nivou rizika.
Primeri procesa i primene upravljanja rizikom kvaliteta dati su u Smernici ICH Q9.
2.3 Odgovornosti Službe(i) za kvalitet
2.31 Služba(e) za kvalitet treba da budu uključene u sva pitanja u vezi kvaliteta.
2.32 Služba(e) za kvalitet treba da izvrše reviziju i da odobre sva odgovarajuća dokumenta u vezi sa kvalitetom.
2.33 Osnovne odgovornosti nezavisne(ih) službe(i) za kvalitet ne smeju da se prenose. Ove odgovornosti treba da budu opisane u pismenoj formi i treba da sadrže najmanje sledeće:
1. Puštanje u promet ili odbijanje svih aktivnih farmaceutskih sastojaka (API). Odobravanje ili odbijanje za upotrebu međuproizvoda izvan kontrole proizvođača API;
2. Uspostavljanje sistema za odobravanje ili odbijanje sirovina, međuproizvoda, materijala za pakovanje i obeležavanje;
3. Pregled kompletne dokumentacije o proizvodnji serije i zapisa laboratorijske kontrole kritičnih procesnih koraka pre puštanja aktivnog farmaceutskog sastojka (API) u promet;
4. Da obezbede da su kritična odstupanja istražena i rešena;
5. Odobravanje svih specifikacija i glavnih uputstava za proizvodnju;
6. Odobravanje svih procedura koje imaju uticaj na kvalitet međuproizvoda ili aktivnih farmaceutskih sastojaka (API);
7. Da obezbede sprovođenje internih provera;
8. Odobravanje ugovornih proizvođača međuproizvoda i aktivnih farmaceutskih sastojaka;
9. Odobravanje izmena koje mogu potencijalno da utiču na kvalitet međuproizvoda ili aktivnih farmaceutskih sastojaka (API);
10. Pregled i odobravanje validacionih protokola i izveštaja;
11. Da obezbede da su reklamacije u vezi kvaliteta istražene i rešene;
12. Da obezbede korišćenje efektivnih sistema za održavanje i kalibraciju kritične opreme;
13. Da obezbede da je materijal testiran na odgovarajući način i da postoji izveštaj sa rezultatima;
14. Da obezbede postojanje podataka o stabilnosti na osnovu kojih se određuju datum ponovnog testiranja ili rok upotrebe i uslova skladištenja aktivnih farmaceutskih sastojaka (API) i/ili međuproizvoda kada je primenljivo; i
15. Vršenje pregleda kvaliteta proizvoda (kako je definisano u Odeljku 2.5).
2.4 Odgovornost za proizvodne aktivnosti
Odgovornost za proizvodne aktivnosti treba da bude definisana u pismenoj formi i treba da sadrži najmanje sledeće:
1. Pripremanje, pregled, odobravanje i distribucija uputstava za proizvodnju međuproizvoda ili aktivnih farmaceutskih sastojaka (API) u skladu sa pisanim procedurama;
2. Proizvodnja aktivnih farmaceutskih sastojaka (API) i, kada je primenljivo, međuproizvoda u skladu sa prethodno odobrenim uputstvima;
3. Pregled kompletne dokumentacije o proizvodnji serije i obezbeđivanje da je ista kompletirana i potpisana;
4. Obezbeđivanje da sva odstupanja u proizvodnji budu prijavljena i procenjena, a da su kritična odstupanja istražena i da su zaključci evidentirani;
5. Obezbeđivanje da su proizvodna postrojenja čista i, kada je to primenljivo, dezinfikovana;
6. Obezbeđivanje da se vrše neophodne kalibracije i čuvanje zapisa o tome;
7. Obezbeđivanje da se prostorije i oprema održavaju i čuvanje zapisa o tome;
8. Obezbeđivanje revizije i odobrenja validacionih protokola i izveštaja;
9. Procena predloženih izmena u pogledu proizvoda, procesa ili opreme; i
10. Obezbeđivanje da su nova i, kada je primenljivo, modifikovana postrojenja i oprema kvalifikovani.
2.5 Interne provere
2.50 U cilju provere usaglašenosti sa principima dobre proizvođačke prakse za aktivne farmaceutske sastojke (API), treba vršiti redovne interne provere prema utvrđenom planu.
2.51 Nalazi interne provere i korektivne mere treba da se dokumentuju i dostave odgovornom rukovodstvu firme. Predložene korektivne mere treba da se obave blagovremeno i na efektivan način.
2.6 Pregled kvaliteta proizvoda
2.60 Redovne preglede kvaliteta aktivnih farmaceutskih sastojaka (API) treba sprovoditi sa ciljem provere konzistentnosti procesa. Ovi preglede, po pravilu, treba da se sprovode i dokumentuju na godišnjem nivou, a oni treba da sadrže najmanje sledeće:
- pregled kritičnih procesnih kontrola i kritičnih rezultata testiranja aktivnih farmaceutskih sastojaka (API);
- pregled svih serija koje nisu usaglašene sa postavljenim specifikacijama;
- pregled svih kritičnih odstupanja ili neusaglašenosti i istraga u vezi sa njima;
- pregled svih izmena procesa ili analitičkih metoda;
- pregled rezultata programa praćenja stabilnosti;
- pregled svih povraćaja, reklamacija i povlačenja zbog neodgovarajućeg kvaliteta; i
- pregled adekvatnosti korektivnih mera.
2.61 Rezultati ovih pregleda treba da se procene u cilju donošenja odluke da li treba da se preduzmu korektivne mere ili da se izvrši revalidacija. Razloge za navedenu korektivnu meru treba dokumentovati. Predložene korektivne mere treba obaviti blagovremeno i na efektivan način.
3.1 Kvalifikacije osoblja
3.10 Treba da postoji odgovarajući broj zaposlenih koji su, zahvaljujući odgovarajućem obrazovanju, obuci i/ili iskustvu, kvalifikovani za vršenje i nadzor proizvodnje međuproizvoda i aktivnih farmaceutskih sastojaka (API).
3.11 Odgovornosti svih zaposlenih u proizvodnji međuproizvoda i aktivnih farmaceutskih sastojaka (API) treba da budu specificirane u pismenoj formi.
3.12 Kvalifikovano osoblje treba redovno da sprovodi obuku i ona treba minimalno da pokriva operacije koje zaposleni izvodi, kao i Dobru proizvođačku praksu koja se ona odnosi na zaduženja zaposlenog. O obuci treba voditi evidencije. Obuku treba periodično procenjivati.
3.2 Lična higijena
3.20 Osoblje treba da upražnjava dobre navike u pogledu higijene i zdravlja.
3.21 Zaposleni treba da nose čistu odeću odgovarajuću za proizvodnu delatnost u kojoj učestvuju, a odeću treba da menjaju kad god je to odgovarajuće. Dodatne zaštitne delove odeće, kao što su, na primer, štitnici za glavu, lice, šake i ruke treba nositi kada je to potrebno, da bi se međuproizvodi i aktivni farmaceutski sastojci (API) zaštitili od kontaminacije.
3.22 Osoblje treba da izbegava direktan kontakt sa međuproizvodima ili aktivnim farmaceutskim supstancama (API).
3.23 Pušenje, konzumiranje hrane, pića, žvakanje i držanje hrane treba da se ograniče na određene, za to utvrđene, zone odvojene od proizvodnih zona.
3.24 Osoblje koje boluje od neke zarazne bolesti ili ima otvorene lezije na izloženoj površini tela ne treba da učestvuje u aktivnostima koje bi za posledicu mogle da imaju ugrožavanje kvaliteta aktivnih farmaceutskih supstanci (API). Bilo koje lice za koje se bilo kada dokaže (medicinskim pregledom ili na osnovu nadzora) da ima očiglednu bolest ili da ima otvorene lezije, treba da se isključi iz aktivnosti kod kojih bi takvo zdravstveno stanje moglo štetno da utiče na kvalitet aktivnih farmaceutskih sastojaka (API), dok se stanje ne popravi ili dok kvalifikovano medicinsko osoblje ne utvrdi da uključenje tog lica neće ugroziti bezbednost ili kvalitet aktivnih farmaceutskih sastojaka (API).
3.3 Konsultanti
3.30 Konsultanti koji daju savete u pogledu proizvodnje i kontrole međuproizvoda ili aktivnih farmaceutskih sastojaka (API) treba da imaju dovoljno obrazovanja, obuke i iskustva, ili bilo koju kombinaciju navedenog, da bi mogli da daju savete u pogledu pitanja za koje su angažovani.
3.31 Treba da se vode zapisi u kojima se navode ime, adresa, kvalifikacije i vrsta usluga koje pružaju ovi konsultanti.
4.1 Dizajn i konstrukcija
4.10 Zgrade i postrojenja/pogoni koji se koriste za proizvodnju međuproizvoda i aktivnih farmaceutskih sastojaka (API) treba da budu locirani, dizajnirani i konstruisani tako da olakšavaju čišćenje, održavanje i operacije, na način koji odgovara vrsti i fazi proizvodnje. Postrojenja/pogoni treba, takođe, da budu projektovani tako da se minimizira potencijalna kontaminacija. U slučaju kada su utvrđene mikrobiološke specifikacije za međuproizvod ili aktivni farmaceutski sastojak (API), postrojenja/pogoni treba, takođe, da budu projektovani tako da, koliko je to moguće, ograniče izloženost nepoželjnim mikrobiološkim kontaminantima.
4.11 Zgrade i postrojenja/pogoni treba da imaju odgovarajući prostor za pravilan raspored opreme i materijala kako bi se sprečile zamene i kontaminacija.
4.12 Kada oprema sama po sebi (npr. zatvoreni ili izolovani sistemi) pruža odgovarajuću zaštitu materijala, takva oprema može da bude napolju.
4.13 Tok kretanja materijala i osoblja kroz zgradu ili postrojenja/pogone treba da se uspostavi tako da sprečava zamene ili kontaminaciju.
4.14 Treba da postoje definisane zone ili drugi sistemi kontrole za sledeće aktivnosti:
- Prijem, identifikaciju, uzorkovanje i karantin ulaznih materijala, u očekivanju odluke o odobravanju ili odbijanju;
- Karantin pre odobravanja ili odbijanja međuproizvoda i aktivnih farmaceutskih sastojaka (API);
- Uzorkovanje međuproizvoda i aktivnih farmaceutskih sastojaka (API);
- Čuvanje odbijenih materijala pre daljeg uklanjanja (npr. povraćaj, reprocesiranje ili uništavanje);
- Skladištenje odobrenog materijala;
- Proizvodne operacije;
- Operacije pakovanja i obeležavanja; i
- Laboratorijske operacije.
4.15 Za osoblje treba obezbediti odgovarajuće čiste sanitarne prostorije i toalete. Po potrebi, ove sanitarne prostorije treba da budu snabdevene toplom i hladnom vodom, sapunom ili deterdžentom, aparatom za sušenje ruku ili ubrusima za jednokratnu upotrebu. Sanitarne prostorije i toaleti treba da budu odvojeni od proizvodnih zona, ali lako dostupni iz njih. Takođe, treba obezbediti odgovarajuće prostorije za tuširanje i/ili presvlačenje, tamo gde je to potrebno.
4.16 Laboratorijske zone/operacije, po pravilu, treba da budu odvojene od proizvodnih. Neke laboratorijske zone, a posebno one koje se koriste za kontrolu tokom procesa, mogu da se nalaze u proizvodnim zonama, pod uslovom da operacije proizvodnog procesa ne utiču štetno na preciznost laboratorijskih merenja, kao i da laboratorija i njene operacije ne utiču štetno na proizvodni proces ili na međuproizvode ili aktivne farmaceutske sastojke (API).
4.2 Pomoćni sistemi
4.20 Svi pomoćni sistemi koji mogu da utiču na kvalitet proizvoda (npr. sistemi za paru, gasove, komprimovani vazduh, i sistem zagrejanje, ventilaciju i klimatizaciju vazduha) treba da su kvalifikovani i da se na odgovarajući način prate, kao i da se preduzimaju odgovarajuće mere u slučaju prekoračenja limita. Crteži ovih sistema treba da budu na raspolaganju.
4.21 Tamo gde za to postoji potreba, neophodno je obezbediti odgovarajuće sisteme za ventilaciju, filtraciju i odvod vazduha. Ovi sistemi treba da budu dizajnirani i konstruisani tako da se minimizira rizik od kontaminacije i unakrsne kontaminacije i da su opremljeni uređajima za kontrolu vazdušnog pritiska, mikroorganizama (kada je to potrebno), prašine, vlažnosti i temperature, u skladu sa fazom proizvodnje. Posebnu pažnju treba posvetiti zonama u kojima su aktivni farmaceutski sastojci (API) neposredno izloženi okruženju.
4.22 Ako vazduh recirkuliše u proizvodnim zonama, potrebno je preduzeti odgovarajuće mere radi kontrole rizika od kontaminacije i unakrsne kontaminacije.
4.23 Fiksirani cevovodi treba da se identifikuju na odgovarajući način. Ovo može da se postigne obeležavanjem sa naznakom sadržaja pojedinačnih linija, putem dokumentacije, kompjuterskim sistemima za kontrolu ili na drugi način. Cevovodi treba da budu postavljeni tako da se izbegnu rizici od kontaminacije međuproizvoda ili aktivnih farmaceutskih sastojaka (API).
4.24 Odvodi treba da budu odgovarajućih dimenzija i treba, kada je to potrebno, da imaju vazdušnu kočnicu ili pogodan uređaj koji sprečava vraćanje sadržaja u sifon.
4.3 Voda
4.30 Potrebno je da se dokaže da je voda koja se koristi u proizvodnji aktivnih farmaceutskih supstanci (API) pogodna za tu namenu.
4.31 Ukoliko nije drugačije opravdano, voda koja se koristi u proizvodnji treba da zadovoljava bar zahteve iz smernica Svetske zdravstvene organizacije (WHO) za kvalitet vode za piće.
4.32 Ako kvalitet vode za piće nije dovoljan za obezbeđivanje kvaliteta aktivnog farmaceutskog sastojka (API) i ako su postavljeni strožiji zahtevi u pogledu hemijskog i/ili mikrobiološkog kvaliteta vode, treba da se utvrde odgovarajuće specifikacije za fizičke/hemijske osobine, ukupan broj mikroorganizama, nepoželjnih organizama i/ili endotoksina.
4.33 Kada radi postizanja definisanog kvaliteta proizvođač vrši tretman/prečišćavanje vode koja se koristi u procesu, proces tretmana/prečišćavanja vode treba da se validira i kontroliše uz uspostavljanje akcionih limita.
4.34 U slučaju kada proizvođač nesterilnog aktivnog farmaceutskog sastojka (API) navodi ili tvrdi da je on pogodan za dalju upotrebu u proizvodnji sterilnog leka (medicinskog proizvoda), voda koja se koristi u fazama finalnog izolovanja i prečišćavanja mora da se prati i kontroliše u pogledu ukupnog broja mikroorganizama, nepoželjnih organizama i endotoksina.
4.4 Zatvorene zone
4.40 Namenske proizvodne zone koje mogu da obuhvataju postrojenja/pogone, sisteme za vazduh i/ili procesnu opremu, treba da se koriste u proizvodnji visoko senzibilizirajućih materijala, kao što su, na primer, penicilini i cefalosporini.
4.41 Namenske proizvodne zone treba obezbediti i kada se u proizvodnji upotrebljava materijal infektivne prirode ili visoke farmakološke aktivnosti ili toksičnosti (npr. neki steroidi ili citotoksični antikancerozni agensi), izuzev ako se uspostave i održavaju procedure validirane inaktivacije i/ili čišćenja.
4.42 Odgovarajuće mere treba da se uspostave i primenjuju radi prevencije unakrsne kontaminacije od osoblja, materijala, itd. pri prelasku iz jedne namenske zone u drugu.
4.43 Bilo koja proizvodna aktivnost (uključujući merenje, mlevenje, ili pakovanje) koja se odnosi na visoko toksične nefarmaceutske materijale, kao što su, na primer, herbicidi i pesticidi, ne sme da se sprovodi u pogonima i/ili opremi koje se koriste za proizvodnju aktivnih farmaceutskih supstanci (API). Rukovanje i skladištenje ovih visoko toksičnih nefarmaceutskih materijala treba da bude odvojeno od aktivnih farmaceutskih sastojaka (API).
4.5 Osvetljenje
4.50 U svim zonama treba da se obezbedi adekvatno osvetljenje, kako bi se olakšalo čišćenje, održavanje i odgovarajuće operacije.
4.6 Otpadne vode i otpad
4.60 Otpadne vode, odbačeni materijal i drugi otpad (npr. čvrsti, tečni ili gasoviti nus proizvodi iz proizvodnje) unutar ili iz zgrada i neposredne okoline treba da se odlažu na bezbedan, blagovremen i higijenski ispravan način. Neophodno je jasno identifikovati kontejnere i/ili cevi za otpadni materijal.
4.7 Higijenske mere i održavanje
4.70 Zgrade koje se koriste za proizvodnju međuproizvoda i aktivnih farmaceutskih supstanci (API), treba propisno održavati i popravljati i držati u čistom stanju.
4.71 Treba uspostaviti pisane procedure u kojima su dodeljena zaduženja za održavanje higijene i opisani planovi čišćenja, metode, oprema i materijali koji se koriste u čišćenju zgrada i postrojenja/pogona.
4.72 Kada je to neophodno, treba da se uspostave i pisane procedure za upotrebu pogodnih rodenticida, insekticida, fungicida, fumigacionih sredstava, kao i sredstava za čišćenje i održavanje higijene, kako bi se sprečila kontaminacija opreme, sirovina, materijala za pakovanje/obeležavanje, međuproizvoda i aktivnih farmaceutskih sastojaka (API).
5.1 Dizajn i konstrukcija
5.10 Oprema koja se koristi za proizvodnju međuproizvoda i aktivnih farmaceutskih sastojaka (API) treba da bude odgovarajućeg dizajna i adekvatnih dimenzija i da bude postavljena na način odgovarajući za nameravanu upotrebu, čišćenje, sanitizaciju (gde je to potrebno) i održavanje.
5.11 Oprema treba da bude konstruisana tako da površine koje dolaze u dodir sa sirovinama, međuproizvodima, ili aktivnim farmaceutskim sastojcima (API) ne utiču nepovoljno na kvalitet međuproizvoda i aktivnih farmaceutskih sastojaka (API) u odnosu na zvanične ili druge uspostavljene specifikacije.
5.12 Opremu za proizvodnju treba koristiti samo u okviru kvalifikovanog radnog opsega.
5.13 Veću opremu (npr. reaktori, kontejneri za skladištenje) i trajno instalirane procesne linije koji se koriste pri proizvodnji međuproizvoda ili aktivnog farmaceutskog sastojka (API), treba na odgovarajući način identifikovati.
5.14 Supstance koje utiču na funkcionisanje opreme, kao što su sredstva za podmazivanje, fluidi za zagrevanje ili hlađenje, ne treba da dolaze u dodir sa međuproizvodima ili aktivnim farmaceutskim sastojcima (API) na način koji bi mogao izmeniti njihov kvalitet u odnosu na zvanične ili druge uspostavljene specifikacije. Bilo kakva odstupanja od ovoga treba da se procene kako bi se garantovalo da nema nikakvih štetnih efekata u vezi sa pogodnošću materijala u odnosu na njegovu namenu. Kada god je moguće, treba koristiti lubrikansi i ulja prehrambenog kvaliteta.
5.15 Kada god je potrebno, treba koristiti zatvorenu ili izolovanu opremu. Kada se koristi otvorena oprema ili kada se oprema otvara, treba preduzeti odgovarajuće mere predostrožnosti kako bi se minimizirao rizik od kontaminacije.
5.16 Potrebno je da postoji komplet crteža opreme i kritičnih instalacija (npr. instrumenata i pomoćnih sistema), koji odgovaraju trenutnom stanju.
5.2 Održavanje i čišćenje opreme
5.20 Za preventivno održavanje opreme treba uspostaviti planove i procedure (uključujući i dodelu zaduženja).
5.21 Treba uspostaviti pisane procedure za čišćenje opreme i njeno kasnije puštanje u upotrebu u proizvodnji međuproizvoda i aktivnih farmaceutskih supstanci (API). Procedure čišćenja treba da sadrže dovoljno detalja kako bi se operaterima omogućilo čišćenje celokupne opreme na ponovljiv i efektivan način. Ove procedure treba da sadrže:
- Određivanje odgovornosti za čišćenje opreme;
- Planove čišćenja, uključujući i, gde je to primenljivo, planove sanitizacije;
- Kompletan opis metoda i materijala, uključujući i razblaženje/koncentraciju sredstava za čišćenje koja se koriste za čišćenje opreme;
- Uputstvo za rasklapanje i ponovno sklapanje svakog pojedinačnog dela opreme kako bi se obezbedilo odgovarajuće čišćenje, kada je to primenljivo;
- Uputstvo za uklanjanje ili brisanje oznaka prethodne serije;
- Uputstvo za zaštitu čiste opreme od kontaminacije pre upotrebe;
- Kontrola čistoće opreme neposredno pre upotrebe, ako je izvodljivo; i
- Uspostavljanje maksimalnog vremena koje može da protekne od završetka procesa proizvodnje i čišćenja opreme, kada je to primenljivo.
5.22 Oprema i uređaji treba da se čiste, čuvaju, i kada je to potrebno, podvrgnu sanitizaciji ili sterilizaciji kako bi se sprečila kontaminacija ili prenos materijala koji bi mogao da izmeni kvalitet međuproizvoda ili aktivnog farmaceutskog sastojka iznad propisanih ili drugih uspostavljenih specifikacija.
5.23 Kada je oprema namenjena za kontinuiranu proizvodnju ili kampanjsku proizvodnju uzastopnih serija istog međuproizvoda ili aktivnog farmaceutskog sastojka (API), opremu treba čistiti u odgovarajućim intervalima kako bi se sprečilo nagomilavanje i prenos kontaminanata (npr. degradacioni proizvodi ili nepoželjni nivoi mikroorganizama).
5.24 Nenamenska oprema treba da se čisti između procesa proizvodnje različitih proizvoda kako bi se sprečila unakrsna kontaminacija.
5.25 Potrebno je da se definišu i opravdaju kriterijumi prihvatljivosti za ostatke (rezidue), kao i izbor procedura čišćenja i sredstava za čišćenje.
5.26 Oprema treba da se na odgovarajući način obeleži u pogledu sadržaja i statusa čistoće.
5.3 Kalibracija
5.30 Opremu za kontrolu, merenje težine, merenje dimenzija, monitoring i testiranje, a koja je kritična za obezbeđivanje kvaliteta međuproizvoda ili aktivnih farmaceutskih sastojaka (API) treba kalibrisati u skladu sa pisanim procedurama i prema uspostavljenom planu.
5.31 Kalibraciju opreme treba vršiti prema standardima koji su u skladu sa sertifikovanim standardima, ako takvi postoje.
5.32 Treba da se čuvaju i prate zapisi o kalibracijama.
5.33 Trenutni kalibracioni status kritične opreme treba da bude poznat i da može da se proveri.
5.34 Instrumente koji ne zadovoljavaju kriterijume u pogledu kalibracije ne treba koristiti.
5.35 Potrebno je da se istraže odstupanja od odobrenih standarda za kalibraciju kod kritičnih instrumenata, kako bi se utvrdilo da li su ona mogla da imaju uticaj na kvalitet međuproizvoda (jednog ili više) ili aktivnog(ih) farmaceutskog(ih) sastojka(aka) (API) proizvedenih upotrebom te opreme od poslednje uspešne kalibracije.
5.4 Kompjuterizovani sistemi
5.40 Potrebno je da se validiraju kompjuterizovani sistemi koji imaju uticaj na Dobru proizvođačku praksu. Obim i opseg validacije zavise od različitosti, kompleksnosti i kritičnosti kompjuterizovane aplikacije.
5.41 Odgovarajućom instalacionom kvalifikacijom i operacionom kvalifikacijom treba da se dokaže pogodnost kompjuterskog hardvera i softvera za izvršenje planiranih aktivnosti.
5.42 Za komercijalno dostupan softver koji je kvalifikovan ne zahteva se isti nivo testiranja. Ako postojeći sistem nije validiran u trenutku instaliranja, može da se sprovede retrospektivna validacija ako je dostupna odgovarajuća dokumentacija.
5.43 Za kompjuterizovane sisteme treba obezbediti dovoljno kontrolnih mehanizama kako bi se sprečio nedozvoljen pristup ili izmena podataka. Potrebno je da se uspostave kontrole kojim se sprečava gubljenje podataka (npr. sistem se ugasio, a podaci nisu zapamćeni). Treba da postoji evidencija/zapis bilo kakve izvršene izmene podataka, prethodnog unosa, ko je izvršio izmenu i kada je izvršena izmena.
5.44 Potrebno je da se uspostave pisane procedure za funkcionisanje i održavanje kompjuterizovanih sistema.
5.45 Kada se kritični podaci unose ručno, treba da se uspostavi dodatna kontrola tačnosti unosa. Ovu dodatnu kontrolu može da obavlja drugi operater ili sam sistem.
5.46 Potrebno je da se evidentiraju i istraže incidenti u vezi sa kompjuterizovanim sistemima, a koji mogu da utiču na kvalitet međuproizvoda ili aktivnih farmaceutskih sastojaka (API), ili koji mogu da utiču na pouzdanost zapisa ili rezultata testiranja.
5.47 Izmene kompjuterizovanog sistema treba da se vrše u skladu sa procedurom za izmenu i potrebno ih je formalno odobriti, dokumentovati i testirati. Treba da se vode zapisi o svim izmenama, uključujući i modifikacije i pojačavanja hardvera, softvera i bilo koje druge kritične komponente ovih sistema. Ovi zapisi treba da dokažu da se sistem održava u validiranom statusu.
5.48 Za slučajeve kada zbog pada, otkaza ili kvara sistema može da dođe do trajnog gubitka zapisa, potrebno je obezbediti rezervne kopije. Način zaštite podataka treba da se uspostavi za sve kompjuterizovane sisteme.
5.49 Podaci mogu da se evidentiraju i na drugi način osim kompjuterizovanim sistemom.
6.1 Dokumentacioni sistem i specifikacije
6.10 Sva dokumenta koja se odnose na proizvodnju međuproizvoda ili aktivnih farmaceutskih supstanci (API) treba da se pripremaju, pregledaju, odobravaju i distribuiraju u skladu sa pisanim procedurama. Takva dokumenta mogu da budu u papirnom ili u elektronskom obliku.
6.11 Izdavanje, revizija, zamena i povlačenje svih dokumenata treba da se kontroliše održavanjem istorijata revizija.
6.12 Treba da se uspostavi procedura za čuvanje svih odgovarajućih dokumenata (npr. izveštaji o istorijatu razvoja, izveštaji o povećanju nivoa proizvodnje od veličine razvojnih do veličine komercijalnih serija, izveštaji o tehničkom transferu, izveštaji o validaciji procesa, zapisi o obuci, o proizvodnji, o kontroli i o distribuciji). Za ova dokumenta treba da se navede period čuvanja.
6.13 Sve zapise o proizvodnji, kontroli i distribuciji treba čuvati najmanje godinu dana posle isteka roka trajanja serije. Kod aktivnih farmaceutskih sastojaka (API) kod kojih je određen datum ponovnog testiranja (retest), zapise treba čuvati najmanje tri godine od kada je serija u potpunosti distribuirana.
6.14 Kada se vrše unosi podataka u zapise, oni treba, odmah nakon izvršenja aktivnosti, da se unose na neizbrisiv način, na mestima predviđenim za unose tih podataka i treba da sadrže potpis ili paraf osobe koja ih unosi. Ispravke unosa treba da nose datum i potpis, a prvobitni unos podataka treba da ostane i dalje čitljiv.
6.15 U toku definisanog perioda čuvanja, originali ili kopije zapisa treba da budu odmah raspoloživi na mestu proizvodnje gde su izvršene aktivnosti na koje se zapisi odnose. Prihvatljivo je kada zapisi mogu odmah da se dostave, odnosno povuku sa druge lokacije elektronskim putem ili na drugi način.
6.16 Specifikacije, uputstva, procedure i zapisi mogu da se čuvaju ili u obliku originala ili kao verodostojne kopije, kao što su, na primer, fotokopije, mikrofilm, mikrofiche ili druge verne kopije originalnih zapisa. Kada se koriste redukcione tehnike, kao što su, na primer, pravljenje mikrofilmova ili elektronskih zapisa, treba imati spremnu odgovarajuću opremu za povraćaj i sredstva za izradu kopije štampane na papiru.
6.17 Treba uspostaviti i dokumentovati specifikacije za sirovine, za međuproizvode kada je potrebno, aktivne farmaceutske sastojke (API) i materijale za pakovanje i obeležavanje. Osim toga, specifikacije su potrebne i za neke druge materijale kao što su pomoćna sredstva u proizvodnji, zaptivci ili drugi materijali koji se koriste u toku proizvodnje međuproizvoda ili aktivnih farmaceutskih supstanci (API), a koji mogu da imaju kritičan uticaj na kvalitet. Za parametre procesne kontrole treba da se uspostave i dokumentuju kriterijumi prihvatljivosti.
6.18 Ako se na dokumentima koriste elektronski potpisi, oni treba da budu autorizovani i zaštićeni.
6.2 Zapisi o čišćenju i upotrebi opreme
6.20 Zapisi o upotrebi važnije opreme, čišćenju, sanitizaciji i/ili sterilizaciji i održavanju treba da sadrže datum, vreme (ako je odgovarajuće), naziv proizvoda i broj svake serije proizvedene na toj opremi, kao i identifikacione podatke o operateru koji je izvršio čišćenje i održavanje.
6.21 Ako je oprema namenska za proizvodnju jednog međuproizvoda ili aktivnog farmaceutskog sastojka (API), nisu neophodni pojedinačni zapisi o opremi ako sledljivost serija međuproizvoda ili aktivnog farmaceutskog sastojka (API) može da se prati. U slučaju namenske opreme, zapisi o čišćenju, održavanju i upotrebi opreme mogu da predstavljaju deo evidencije o proizvodnji serije ili da se vode zasebno.
6.3 Zapisi o sirovinama/polaznim supstancama, međuproizvodima, materijalima za obeležavanje i pakovanje aktivnih farmaceutskih sastojaka (API)
6.30 Zapisi koji se vode treba da sadrže sledeće podatke:
- Ime proizvođača, identitet i količinu svake pošiljke svake serije sirovina, međuproizvoda ili materijala za pakovanje i obeležavanje aktivnih farmaceutskih sastojaka (API); ime dobavljača; kontrolni broj(evi) dobavljača, ako je(su) poznat(i) ili neki drugi identifikacioni broj; broj na prijemnom dokumentu pošiljke; i datum prijema pošiljke;
- Rezultati bilo kakvih izvršenih testova ili ispitivanja i zaključci izvedeni na osnovu njih;
- Zapisi o praćenju upotrebe materijala;
- Dokumentacija o ispitivanju i pregledu usklađenosti materijala za pakovanje i obeležavanje aktivnih farmaceutskih sastojaka (API) sa uspostavljenim specifikacijama; i
- Konačna odluka u pogledu odbijenih sirovina, međuproizvoda ili materijala za pakovanje i obeležavanje aktivnih farmaceutskih sastojaka (API).
6.31 Primerak odobrenih etiketa treba sačuvati radi poređenja sa izdatim.
6.4 Glavna uputstva za proizvodnju (Glavne evidencije o proizvodnji i kontroli)
6.40 Kako bi se obezbedila uniformnost od serije do serije, potrebno je da glavna uputstva za proizvodnju svakog međuproizvoda i aktivnog farmaceutskog sastojka (API) pripremi, datira i potpiše jedna osoba, a da ih nezavisno proveri, datira i potpiše osoba iz službe(i) za kvalitet.
6.41 Glavna uputstva za proizvodnju treba da sadrže sledeće podatke:
- Naziv međuproizvoda ili aktivnog farmaceutskog sastojka (API) koji se proizvodi i referentna šifra identifikacionog dokumenta, ako je isto primenljivo;
- Kompletan spisak sirovina i međuproizvoda označenih nazivima ili šiframa koji su dovoljno specifični da na osnovu njih može da se identifikuje bilo koja posebna karakteristika u pogledu kvaliteta;
- Precizno iskazane količine ili proporcionalan odnos svake sirovine ili međuproizvoda koja će se upotrebiti, uključujući i mernu jedinicu. Kada količina nije definisana, treba priložiti obračun za svaku veličinu serije ili nivo proizvodnje. Kada su navedene, treba obrazložiti i varijacije u pogledu količina;
- Mesto gde će se vršiti proces proizvodnje i glavna proizvodna oprema koja će se koristiti;
Detaljna uputstva za proizvodnju, uključujući sledeće:
- redosled koga se treba pridržavati,
- raspon vrednosti procesnih parametara koji će se koristiti,
- uputstvo za uzorkovanje i procesne kontrole sa kriterijumima prihvatljivosti, gde je to primenljivo,
- vremenski rokovi za završetak pojedinačnih procesnih koraka i/ili celog procesa, gde je to primenljivo, i
- očekivani opseg prinosa u odgovarajućim fazama procesa ili vremenskim periodima;
- Kada je primenljivo, treba se pridržavati posebnih napomena i mera predostrožnosti ili upućivanja na iste; i
- Uputstva za uslove skladištenja međuproizvoda ili aktivnog farmaceutskoj sastojka (API) kako bi se osigurala njihova pogodnost za upotrebu, uključujući i materijale za pakovanje i obeležavanje, kao i posebne uslove skladištenja sa vremenskim rokovima, gde je to primenljivo.
6.5 Evidencije o proizvodnji serije (Evidencije o proizvodnji i kontroli serije)
6.50 Evidencije o proizvodnji serije treba pripremiti za svaki međuproizvod i aktivni farmaceutski sastojak (API), a one treba da sadrže potpune informacije u vezi sa proizvodnjom i kontrolom svake serije. Evidenciju o proizvodnji serije treba proveriti pre njenog izdavanja kako bi se osiguralo da je to važeća i ispravna verzija, koja je precizna reprodukcija odgovarajućeg glavnog uputstva za proizvodnju. Ako se Evidencija o proizvodnji serije izvodi iz nekog zasebnog dela glavnog dokumenta, onda taj dokument treba da sadrži upućivanje na važeće glavno uputstvo za proizvodnju koje je upotrebljeno.
6.51 Ove evidencije treba da budu obeležene jedinstvenim brojem serije ili identifikacionim brojem, i datirane i potpisane pri izdavanju. U slučaju kontinuirane proizvodnje, šifra proizvoda zajedno sa datumom i vremenom može da posluži kao jedinstveni identifikacioni parametar do dodeljivanja konačnog broja.
6.52 Dokumentacija o završetku svake značajne faze u Evidencijama o proizvodnji serije (evidencije o proizvodnji i kontroli serije) treba da sadrži sledeće:
- Datume i, kada je to primenljivo, vremena;
- Identitet upotrebljene glavne opreme (npr. reaktori, oprema za sušenje, mlinovi, itd.);
- Jedinstvenu identifikaciju svake serije, uključujući količine, mere i brojeve serije sirovina, međuproizvoda ili bilo kakvih reprocesiranih materijala korišćenih za proizvodnju;
- Dobijene rezultate evidentirane za ključne procesne parametre;
- Bilo kakvo izvršeno uzorkovanje;
- Potpise osoba koje obavljaju i direktno nadgledaju ili proveravaju svaki kritičan korak u operaciji;
- Rezultate procesnih i laboratorijskih testova;
- Dobijeni prinos u odgovarajućim fazama proizvodnje ili vremenskim periodima;
- Opis materijala za pakovanje i obeležavanje za međuproizvod ili aktivni farmaceutski sastojak (API);
- Reprezentativni primerak etikete aktivnog farmaceutskog sastojka (API) ili međuproizvoda, ako se isti stavljaju u promet;
- Bilo kakvo primećeno odstupanje, njegova procena, sprovedena istraga (ukoliko je primenljivo) ili upućivanje na tu istragu ako se zasebno čuva; i
- Rezultate testova za puštanje u promet.
6.53 Treba uspostaviti i pridržavati se pisanih procedura za istragu kritičnih odstupanja ili rezultata van specifikacije za seriju međuproizvoda ili aktivnog farmaceutskog sastojka (API). Istraga treba da se proširi i na druge serije koje mogu da budu u vezi sa navedenim neusaglašenostima ili odstupanjem.
6.6 Evidencije o laboratorijskoj kontroli
6.60 Evidencije o laboratorijskoj kontroli treba da sadrže kompletne podatke dobijene iz svih testova sprovedenih radi provere ispunjavanja uspostavljenih specifikacija i standarda, uključujući i sledeća ispitivanja i testove:
- Opis uzoraka dobijenih za testiranje, uključujući naziv ili poreklo materijala, broj serije ili drugu šifru za razlikovanje, datum uzimanja uzorka, i kada je to primenljivo, količinu i datum kada je uzorak primljen na testiranje;
- Navod ili upućivanje na svaku korišćenu metodu testiranja;
- Podatak o težini ili količini uzorka korišćenog za svaki test, kako je i opisano u metodi; podaci o ili upućivanje na pripremu i testiranje referentnih standarda, reagenasa i standardnih rastvora;
- Kompletna evidencija svih izvornih podataka dobijenih pri svakom testu, pored grafikona, dijagrama i laboratorijskih spektrometrijskih rezultata, pravilno identifikovanim tako da prikazuju specifični materijal i seriju koji su testirani;
- Zapisi o svim obračunima izvršenim u vezi sa testom, uključujući, na primer, merne jedinice, faktore preračunavanja i faktore ekvivalencije;
- Izjava o rezultatima testa u odnosu na uspostavljene kriterijume prihvatljivosti;
- Potpis osobe koja je izvršila svaki test i datum(i) vršenja testova; i
- Datum i potpis druge osobe koja je proverila originalne zapise u pogledu preciznosti, kompletnosti i usklađenosti sa uspostavljenim standardima.
6.61 Detaljni zapisi treba da se vode i o sledećem:
- Bilo kakvim modifikacijama uspostavljene analitičke metode;
- Periodičnoj kalibraciji laboratorijskih instrumenata, aparata, mernih instrumenata i instrumenata za evidentiranje;
- Svim testovima stabilnosti sprovedenim kod aktivnih farmaceutskih sastojaka (API); i
- Istragama u vezi rezultata van specifikacija (OOS).
6.7 Pregled Evidencije o proizvodnji serije
6.70 Za pregled i odobravanje Evidencija o proizvodnji i laboratorijskoj kontroli serije, uključujući pakovanje i obeležavanje, treba uspostaviti i pridržavati se pisanih procedura, kako bi se utvrdila usklađenost međuproizvoda ili aktivnog farmaceutskog sastojka (API) sa uspostavljenim specifikacijama, pre nego što se serija pusti u promet ili distribuira.
6.71 Služba(e) za kvalitet treba da izvrši(e) pregled i odobri(e) Evidencije o proizvodnji i laboratorijskoj kontroli serije za kritične procesne korake, pre puštanja u promet ili distribucije serije aktivnog farmaceutskog sastojka (API). Pregled zapisa o proizvodnji i laboratorijskoj kontroli za procesne korake koji nisu kritični može da izvrši kvalifikovano proizvodno osoblje ili osoblje drugih službi na osnovu procedura odobrenih od strane službe(i) za kvalitet.
6.72 Sve izveštaje o odstupanjima, istragama i rezultatima van specifikacije treba pregledati u okviru pregleda Evidencije o proizvodnji serije pre nego što se ona pusti u promet.
6.73 Služba(e) za kvalitet može(gu) službi za proizvodnju da prenese(u) zaduženje i ovlašćenje za odobravanje za upotrebu međuproizvoda, osim za one međuproizvode koji se isporučuju na mesto van kontrole proizvođača.
7.1 Opšte kontrole
7.10 Treba da postoje pisane procedure koje opisuju prijem, identifikaciju, karantin, skladištenje, rukovanje, uzorkovanje, testiranje i odobravanje ili odbijanje materijala.
7.11 Proizvođači međuproizvoda i/ili aktivnih farmaceutskih sastojaka (API) treba da imaju sistem za procenu dobavljača kritičnih materijala.
7.12 Materijale treba nabavljati u skladu sa odobrenim specifikacijama, od jednog ili više dobavljača odobrenih od strane službe(i) za kvalitet.
7.13 Ako dobavljač kritičnog materijala nije i proizvođač tog materijala, onda proizvođač međuproizvoda i/ili aktivnog farmaceutskog sastojka (API) treba da zna ime i adresu tog proizvođača.
7.14 U slučaju promene izvora nabavke kritičnih sirovina/polaznih materijala treba postupati u skladu sa Odeljkom 13, Kontrola izmena.
7.2 Prijem i karantin
7.20 Prilikom prijema a pre prihvatanja, svaki kontejner ili grupa kontejnera sa materijalom mora da se pregleda vizuelno u pogledu ispravnosti obeležavanja (uključujući vezu između naziva koji koristi dobavljač i internog naziva, ako se oni razlikuju), oštećenja kontejnera, narušenog pečaćenja i evidentnog otvaranja ili kontaminacije. Materijale treba držati u karantinu dok se ne izvrši uzorkovanje, ispitivanje ili testiranje, prema potrebi, i dok se ne odobre za upotrebu.
7.21 Pre mešanja pristiglih materijala sa postojećim zalihama (npr. rastvarači ili zalihe u silosima/rezervoarima), potrebno je da se oni identifikuju kao ispravni, testirani, kada je to primenljivo, i odobreni za upotrebu. Treba da postoje procedure za sprečavanje da se pristigli materijali pogrešno dodaju postojećim zalihama.
7.22 Ako se isporuke materijala u bulk-u vrše u nenamenskim cisternama, potrebno je da se obezbedi da ne dođe do unakrsne kontaminacije iz cisterne. Ovo se može proveriti na jedan ili više od sledećih načina:
- potvrda o čišćenju,
- testiranje na tragove nečistoća,
- provera (audit) dobavljača.
7.23 Veliki kontejneri za skladištenje i njima pripadajući razvodnici (manifold) i linije za punjenje i pražnjenje treba budu na odgovarajući način identifikovani/obeleženi.
7.24 Svakom kontejneru ili grupi kontejnera (serije) materijala treba da se dodeli i da se identifikuje jedinstvenom šifrom, brojem serije ili prijemnim brojem. Ovaj broj treba da se koristi pri evidentiranju rasporeda svake serije. Treba da postoji sistem za identifikaciju statusa svake serije.
7.3 Uzorkovanje i testiranje pristiglih materijala za proizvodnju
7.30 Treba sprovesti najmanje jedan test za proveru identiteta svake serije materijala, sa izuzetkom materijala navedenog u tački 7.32. Sertifikat analize dobavljača može da se upotrebi umesto vršenja drugih testova, pod uslovom da proizvođač ima uspostavljen sistem za ocenu i proveru dobavljača.
7.31 Odobravanje dobavljača treba da sadrži procenu koja pruža adekvatan dokaz (npr. ranija istorija kvaliteta) da proizvođač može redovno da dobija materijal koji je u skladu sa specifikacijama. Treba sprovesti kompletnu analizu na najmanje tri serije materijala pre nego što proizvođač interno redukuje obim testiranja. Međutim, kao minimum, u odgovarajućim intervalima treba da se izvrši kompletna analiza i da se uporedi sa sertifikatima analize dobavljača. Pouzdanost sertifikata analize treba proveravati u redovnim intervalima.
7.32 Pomoćna sredstva za proizvodnju, opasne ili visoko toksične sirovine, druge specijalne materijale ili materijale koji se prenose u druge proizvodne pogone u okviru iste kompanije, nije potrebno testirati ako je pribavljen proizvođačev Sertifikat analize koji dokazuje da su ove sirovine usklađene sa uspostavljenim specifikacijama. Vizuelni pregled kontejnera, obeležavanja i evidentiranje brojeva serija treba da bude od pomoći pri utvrđivanju identiteta ovih materijala. Nedostatak testiranja ovih materijala na licu mesta treba opravdati i dokumentovati.
7.33 Uzorci treba da budu reprezentativni za seriju materijala iz koje su uzeti. U metodama uzorkovanja treba da se navede broj kontejnera koji će se uzorkovati, deo kontejnera iz koga će se uzorkovati i količinu materijala koja će se uzeti iz svakog kontejnera. Broj kontejnera koji će se uzorkovati i veličinu uzorka treba odrediti na osnovu plana uzorkovanja za koji su uzeti u obzir kritičnost materijala, varijabilnost materijala, ranija istorija kvaliteta dobavljača i količina potrebna za analizu.
7.34 Uzorkovanje treba da se vrši na utvrđenim lokacijama i u skladu sa procedurama uspostavljenim tako da se spreči kontaminacija materijala koji se uzima za uzorkovanje, kao i kontaminacija drugih materijala.
7.35 Kontejnere iz kojih se uzimaju uzorci treba otvarati pažljivo i potom ih treba ponovo zatvoriti. Potrebno ih je obeležiti sa naznakom da je iz njih uzet uzorak.
7.4 Skladištenje
7.40 Materijalima treba rukovati i skladištiti ih na način kojim se sprečava razgrađivanje, kontaminacija i unakrsna kontaminacija.
7.41 Materijal koji se skladišti u buradima, vrećama ili kutijama od vlakana ne treba da se drži na podu, i kada je primenljivo, treba da se smesti tako da se omogući čišćenje i provera.
7.42 Materijali treba da se skladište pod uslovima i u vremenskom periodu koji neće štetno uticati na njihov kvalitet i po pravilu treba da se vodi računa o tome da se prvo koriste najstarije zalihe.
7.43 Određeni materijali u odgovarajućim kontejnerima mogu da se drže na otvorenom, pod uslovom da identifikacione oznake ostanu čitljive i da se kontejneri na odgovarajući način očiste pre otvaranja i upotrebe.
7.44 Odbijene materijale treba kao takve obeležiti i držati ih pod uslovima karantina, tako da se spreči njihova neovlašćena upotreba za proizvodnju.
7.5 Ponovna procena/preispitivanje
7.50 Materijale treba ponovo procenjivati, kada je to primenljivo, kako bi se utvrdila njihova pogodnost za upotrebu (npr. posle produženog skladištenja ili izlaganja toploti ili vlazi).
8 Proizvodnja i procesna kontrola
8.1 Proizvodne operacije
8.10 Sirovine za proizvodnju međuproizvoda i aktivnih farmaceutskih sastojaka (API) treba razmeravati ili meriti pod odgovarajućim uslovima koji ne utiču na njihovu pogodnost za upotrebu. Uređaji za merenje težine i ostala merenja treba da poseduju preciznost koja odgovara njihovoj nameni.
8.11 Ako je materijal podeljen na manje količine radi kasnijeg korišćenja u proizvodnim operacijama, kontejner u kome se materijal drži treba da bude odgovarajući i obeležen na takav način da budu dostupne sledeće informacije:
- Naziv materijala i/ili šifra artikla;
- Prijemni ili kontrolni broj;
- Težina ili mere materijala u novom kontejneru, i
- Datum ponovne procene ili ponovnog testiranja ako je primenljivo.
8.12 Kritične operacije merenja težine, drugih merenja ili razmeravanja na manje količine treba obavljati pod nadzorom ili ih treba podvrgnuti ekvivalentnoj kontroli. Pre upotrebe, proizvodno osoblje treba da proveri da li su to materijali koji su navedeni u Evidenciji o proizvodnji serije za konkretan međuproizvod ili aktivni farmaceutski sastojak (API).
8.13 Druge kritične aktivnosti treba obavljati pod nadzorom ili ih treba podvrgnuti ekvivalentnoj kontroli.
8.14 Dobijeni prinosi treba da se uporede sa očekivanim prinosima za određene korake proizvodnog procesa. Očekivane prinose sa odgovarajućim opsegom treba utvrditi na osnovu podataka prethodno dobijenih na laboratorijskom, nivou pilot/probne proizvodnje ili na osnovu proizvodnih podataka. Treba istražiti odstupanja od prinosa utvrđenih za kritične korake procesa, kako bi se utvrdio njihov uticaj ili potencijalni uticaj na konačan kvalitet serija koje su u pitanju.
8.15 Sva odstupanja treba dokumentovati i objasniti. Svako kritično odstupanje treba istražiti.
8.16 Procesni status većih jedinica opreme treba da se navede ili na pojedinačnim jedinicama opreme ili putem odgovarajuće dokumentacije, kompjuterizovanih kontrolnih sistema ili na neki drugi način.
8.17 Materijali za reprocesiranje ili preradu treba da se kontrolišu na odgovarajući način kako bi se sprečila njihova neovlašćena upotreba.
8.2 Vremenski rokovi
8.20 Ako su u glavnim uputstvima za proizvodnju navedeni vremenski rokovi (videti tačku 6.41), tih se vremenskih rokova treba pridržavati kako bi se obezbedio kvalitet međuproizvoda i aktivnih farmaceutskih sastojaka (API). Odstupanja treba dokumentovati i proceniti. Vremenski rokovi mogu biti neodgovarajući kada proces traje do postizanja neke ciljne vrednosti (npr. podešavanje pH, hidrogenacija, sušenje do prethodno specificiranog nivoa) jer je završavanje reakcija ili procesnih koraka uslovljeno uzorkovanjem i testiranjem tokom procesa.
8.21 Međuproizvodi koji se čuvaju do nastavka proizvodnje treba da se skladište u odgovarajućim uslovima kako bi se obezbedila njihova pogodnost za upotrebu.
8.3 Uzorkovanje i kontrole tokom procesa (procesna kontrola)
8.30 Potrebno je uspostaviti pisane procedure za praćenje toka i kontrolu izvršenja onih procesnih koraka koji uzrokuju variranje karakteristika kvaliteta međuproizvoda i aktivnih farmaceutskih sastojaka (API). Procesne kontrole i njihove kriterijume prihvatljivosti treba definisati na osnovu podataka dobijenih tokom faze razvoja ili na osnovu istorijskih podataka.
8.31 Kriterijumi prihvatljivosti i vrsta i obim testiranja mogu da zavise od prirode međuproizvoda ili aktivnog farmaceutskog sastojka koji se proizvode, od reakcije ili procesnog koraka koji se sprovodi, kao i od stepena do koga proces utiče na varijabilnost u kvalitetu proizvoda. Manje stroge procesne kontrole mogu da budu prikladne za rane procesne korake, dok su strožije kontrole prikladnije za kasnije procesne korake (npr. faze izolovanja i prečišćavanja).
8.32 Kritične procesne kontrole (i kritičan monitoring procesa), uključujući kontrolne tačke i metode, treba da budu navedene u pismenoj formi i odobrene od službe(i) za kvalitet.
8.33 Procesne kontrole može da obavlja kvalifikovano osoblje u proizvodnom pogonu i da se procesni parametri podese bez prethodnog odobrenja službe(i) za kvalitet, ako se podešavanja vrše u okviru prethodno utvrđenih limita odobrenih od strane službe(i) za kvalitet. Svi testovi i rezultati treba da se u potpunosti dokumentuju kao deo Evidencije o proizvodnji serije.
8.34 U pisanim procedurama treba da se opišu metode uzorkovanja materijala u toku procesa, međuproizvoda i aktivnih farmaceutskih sastojaka (API). Planovi i procedure uzorkovanja treba da se zasnivaju na naučno validnim praksama uzorkovanja.
8.35 Uzorkovanje tokom procesa treba da se sprovodi primenom procedura koje su uspostavljene tako da se spreči kontaminacija uzorkovanog materijala i drugih međuproizvoda ili aktivnih farmaceutskih sastojaka (API). Potrebno je uspostaviti procedure kojima se garantuje integritet uzoraka posle prikupljanja.
8.36 Istrage u vezi rezultata van specifikacija (OOS) po pravilu nisu potrebne za testove procesne kontrole koji se vrše u svrhu praćenja i/ili prilagođavanja procesa.
8.4 Mešanje serija međuproizvoda ili aktivnih farmaceutskih sastojaka (API)
8.40 Za potrebe ovog dokumenta, mešanje se definiše kao proces kombinovanja materijala u okviru iste specifikacije, a u cilju proizvodnje homogenog međuproizvoda ili aktivnog farmaceutskog sastojka (API). Mešanje delova pojedinačnih serija tokom procesa (npr. sakupljanje nekoliko punjenja centrifuge iz jedne kristalizacione serije) ili kombinovanje delova iz nekoliko serija radi dalje obrade smatra se delom proizvodnog procesa i ne smatra se mešanjem.
8.41 Serije koje odstupaju od specifikacija ne treba mešati sa drugim serijama u cilju postizanja zahteva specifikacija. Svaka serija koja je u sastavu mešavine treba da je pre mešanja proizvedena primenom uspostavljenog procesa, treba da je pojedinačno testirana i da je utvrđeno da odgovara odgovarajućoj specifikaciji.
8.42 Prihvatljive operacije mešanja obuhvataju, ali nisu ograničene na sledeće:
- Mešanje malih serija kako bi se povećala veličina serije;
- Mešanje ostataka (npr. relativno malih količina izolovanog materijala) iz serija istog međuproizvoda ili aktivnog farmaceutskog sastojka (API) u cilju formiranja jedne serije.
8.43 Procesi mešanja treba adekvatno da se kontrolišu i dokumentuju, a serija dobijena mešanjem treba da se testira u pogledu usklađenosti sa uspostavljenim specifikacijama, kada je to primenljivo.
8.44 Evidencija o procesu mešanja treba da omogući sledljivost do pojedinačnih serija koje sačinjavaju mešavinu.
8.45 Kada su kritične fizičke osobine aktivnog farmaceutskog sastojka (API) (npr. aktivni farmaceutski sastojci namenjeni za proizvodnju čvrstih farmaceutskih oblika ili suspenzija), operacije mešanja treba da se validiraju da bi se dokazala homogenost kombinovane serije. Validacija treba da obuhvati testiranje kritičnih osobina (npr. distribucija veličine čestica, zapreminska težina i nasipna gustina) na koje proces mešanja može da utiče.
8.46 Ako mešanje može štetno da deluje na stabilnost, potrebno je izvršiti testiranje stabilnosti finalnih mešanih serija.
8.47 Određivanje roka trajanja ili datuma ponovnog testiranja mešane serije treba da se zasniva na datumu proizvodnje najstarijih ostataka ili serije u mešavini.
8.5 Kontrola kontaminacije
8.50 Rezidualni materijali mogu da se prenose u sledeće serije istog međuproizvoda ili aktivnog farmaceutskog sastojka (API), ukoliko postoji adekvatna kontrola. Primeri uključuju prijanjanje ostataka za zidove mikronizatora, rezidualni sloj vlažnih kristala zaostao u dobošu centrifuge nakon pražnjenja, kao i nepotpuno pražnjenje fluida ili kristala iz procesnih sudova pri prenosu materijala u sledeću fazu procesa. Takva prenošenja ostataka ne smeju da dovedu do prenosa proizvoda degradacije ili mikrobiloške kontaminacije koji mogu neželjeno da izmene uspostavljeni profil nečistoća aktivnog farmaceutskog sastojka (API).
8.51 Proizvodne operacije treba da se sprovode na takav način da se sprečava kontaminacija međuproizvoda ili aktivnih farmaceutskih sastojaka (API) drugim materijalima.
8.52 Kada se aktivnim farmaceutskim sastojcima (API) rukuje posle prečišćavanja, treba preduzeti mere predostrožnosti da se izbegne kontaminacija.
9 Pakovanje i obeležavanje aktivnih farmaceutskih sastojaka (API) i međuproizvoda
9.1 Opšte napomene
9.10 Treba da postoje pisane procedure u kojima se opisuju prijem, identifikacija, karantin, uzorkovanje, ispitivanje i/ili testiranje i odobravanje za upotrebu, kao i rukovanje materijalima za pakovanje i obeležavanje.
9.11 Materijali za pakovanje i obeležavanje treba da budu u skladu sa uspostavljenim specifikacijama. Oni koji nisu u skladu sa specifikacijama treba da se odbace kako bi se sprečila njihova upotreba u operacijama za koje nisu pogodni.
9.12 Potrebno je da se vode zapisi o svakoj pošiljci materijala za obeležavanje i pakovanje sa podacima o prijemu, ispitivanju ili testiranju, kao i o tome da li je materijal prihvaćen ili odbijen.
9.2 Materijali za pakovanje
9.20 Kontejneri treba da obezbede adekvatnu zaštitu od razgrađivanja ili kontaminacije međuproizvoda ili aktivnog farmaceutskog sastojka (API) do kojih može da dođe tokom transporta i preporučenog skladištenja.
9.21 Kontejneri treba da budu čisti i, kada je to indikovano zbog prirode međuproizvoda ili aktivnog farmaceutskog sastojka (API), sanitizirani kako bi se obezbedila njihova podobnost za namenjenu upotrebu. Ovi kontejneri ne treba da budu reaktivni, aditivni ili absorptivni kako ne bi izmenili kvalitet međuproizvoda ili aktivnog farmaceutskog sastojka (API) van utvrđenih granica.
9.22 Ako se ponovo koriste, kontejneri treba da se čiste u skladu sa dokumentovanim procedurama, a sva prethodna obeležja treba ukloniti ili izbrisati.
9.3 Izdavanje i kontrola etiketa
9.30 Pristup zonama za skladištenje materijala za obeležavanje treba da bude ograničen samo na ovlašćeno osoblje.
9.31 Potrebno je da se primenjuju procedure za usaglašavanje/obračun količina izdatih, upotrebljenih i vraćenih etiketa i za procenu utvrđenog neslaganja broja obeleženih kontejnera i broja izdatih etiketa. Takva neslaganja treba da se istraže, a istrage treba da odobri(e) služba(e) za kvalitet.
9.32 Svi viškovi etiketa sa obeleženim brojevima serija ili na kojima su odštampani drugi podaci u vezi sa serijom, treba da se unište. Vraćene etikete treba da se drže i čuvaju na takav način koji sprečava mešanje i omogućava pravilnu identifikaciju.
9.33 Oštećene i zastarele etikete treba uništiti.
9.34 Opremu za štampanje koja se koristi za štampanje podataka u operacijama pakovanja treba kontrolisati kako bi se osiguralo da sve ono što je odštampano bude u skladu sa podacima navedenim u Evidenciji o proizvodnji serije.
9.35 Odštampane etikete izdate za seriju treba pažljivo ispitati u pogledu pravilnog identiteta i usklađenosti sa specifikacijama u glavnom uputstvu za proizvodnju. Rezultate ovog ispitivanja treba dokumentovati.
9.36 Primerak odštampane etikete kao reprezentativan primerak upotrebljenih etiketa treba priložiti u Evidenciji o proizvodnji serije.
9.4 Operacije pakovanja i obeležavanja
9.40 Treba da postoje dokumentovane procedure uspostavljene tako da obezbeđuju korišćenje pravog materijala za pakovanje i etiketa.
9.41 Operacije obeležavanja treba da budu takve da se spreče zamene, odnosno mešanje. Potrebno je da postoji fizička ili prostorna razdvojenost operacija u kojima učestvuju različiti međuproizvodi ili aktivni farmaceutski sastojci (API).
9.42 Na etiketama koja se koriste za kontejnere međuproizvoda ili aktivnih farmaceutskih sastojaka (API) treba da se navedu naziv ili identifikaciona šifra, broj serije proizvoda i uslovi skladištenja, kada su te informacije kritične za obezbeđenje kvaliteta međuproizvoda ili aktivnog farmaceutskog sastojka (API).
9.43 Ukoliko međuproizvod ili aktivni farmaceutski sastojak (API) treba da se prenose na mesto koje je van kontrole proizvođačevog sistema za upravljanje materijalima, na etiketi treba da se navedu ime i adresa proizvođača, količina sadržaja, posebni uslovi transporta, kao i bilo koji posebni zakonski zahtevi. U slučaju međuproizvoda ili aktivnih farmaceutskih sastojaka (API) koji imaju rok trajanja, na etiketi i u Sertifikatu analize treba da se navede rok trajanja. U slučaju međuproizvoda ili aktivnih farmaceutskih sastojaka (API) koji imaju određen rok za ponovno testiranje, na etiketi i/ili u Sertifikatu analize treba da se navede datum ponovnog testiranja.
9.44 Prostorije/pogone u kojima se vrši pakovanje i obeležavanje treba kontrolisati neposredno pre upotrebe kako bi se osiguralo da su uklonjeni svi materijali koji nisu potrebni za sledeću operaciju pakovanja. Ova provera treba da se dokumentuje u Evidencijama o proizvodnji serije, u dnevniku rada ili drugom dokumentacionom sistemu.
9.45 Upakovani i obeleženi međuproizvodi ili aktivni farmaceutski sastojci (API) treba da se pregledaju kako bi se osiguralo da kontejneri i pakovanja u seriji imaju ispravne etikete. Ovaj pregled treba da predstavlja deo operacije pakovanja. Zapisi sa rezultatima ovih provera treba da budu sastavni deo Evidencija o proizvodnji ili kontroli serije.
9.46 Kontejneri međuproizvoda ili aktivnih farmaceutskih sastojaka (API) koji se transportuju van kontrole proizvođača treba da se zapečate na takav način da, u slučaju da je pečat polomljen ili nedostaje, primalac isporuke bude upozoren na mogućnost eventualne izmene sadržaja.
10 Skladištenje i distribucija
10.1 Procedure skladištenja
10.10 Potrebno je da se obezbede prostorije za skladištenje svih materijala pod odgovarajućim uslovima (npr. kontrolisana temperatura i vlažnost, kada je to neophodno). Treba da se vode zapisi o ovim uslovima ako su oni kritični za održavanje karakteristika materijala.
10.11 Ukoliko ne postoji alternativni sistem za prevenciju nenamerne ili neovlašćene upotrebe materijala u statusu karantina, odbijenih, vraćenih ili materijala povučenih iz prometa, treba da se obezbede posebne skladišne zone za privremeno skladištenje tih materijala dok se ne donese odluka o njihovoj upotrebi.
10.2 Procedure distribucije
10.20 Aktivni farmaceutski sastojci (API) i međuproizvodi mogu da se distribuiraju trećoj strani samo ako je dato odobrenje za puštanje u promet od strane službe(i) za kvalitet. Aktivni farmaceutski sastojci (API) i međuproizvodi mogu pod statusom karantinom da se transferišu/prenesu u drugu službu pod kontrolom kompanije ako to odobri(e) služba(e) za kvalitet i pod uslovom da postoje odgovarajuće kontrole i dokumentacija.
10.21 Aktivni farmaceutski sastojci (API) i međuproizvodi treba da se transportuju na takav način koji nema neželjen uticaj na njihov kvalitet.
10.22 Posebni uslovi transporta ili skladištenja aktivnog farmaceutskog sastojka (API) ili međuproizvoda treba da se navedu na etiketi.
10.23 Proizvođač treba da obezbedi da primalac ugovora (podugovarač) za transport aktivnog farmaceutskog sastojka (API) ili međuproizvoda poznaje i pridržava se odgovarajućih uslova transporta i skladištenja.
10.24 Treba da postoji sistem pomoću koga može odmah da se odredi distribucija svake serije međuproizvoda i/ili aktivnog farmaceutskog sastojka (API) kako bi se omogućilo njeno povlačenje.
11.1 Opšte kontrole
11.10 Nezavisna(e) služba(e) za kvalitet treba da raspolaže adekvatnim laboratorijama.
11.11 Treba da postoje dokumentovane procedure u kojima se opisuje uzorkovanje, testiranje, odobravanje ili odbijanje materijala, kao i evidentiranje i čuvanje laboratorijskih podataka. Laboratorijske zapise treba voditi u skladu sa Odeljkom 6.6.
11.12 Sve specifikacije, planovi uzorkovanja i procedure testiranja treba da budu naučno validne i odgovarajuće, tako da obezbede da sirovine, međuproizvodi i aktivni farmaceutski sastojci (API), kao i etikete i materijali za pakovanje, budu u skladu sa uspostavljenim standardima kvaliteta i/ili čistoće. Specifikacije i procedure testiranja treba da budu u skladu sa onima navedenim u registracionoj/zvanično dostavljenoj dokumentaciji. Mogu da postoje i dodatne specifikacije pored onih navedenih u registracionoj/zvanično dostavljenoj dokumentaciji. Specifikacije, planove uzorkovanja i procedure testiranja, uključujući njihove izmene, treba da predloži odgovarajuća organizaciona jedinica, a njihovu reviziju i odobravanje vrši(e) služba(e) za kvalitet.
11.13 Treba uspostaviti odgovarajuće specifikacije za aktivne farmaceutske sastojke (API) u skladu sa prihvaćenim standardima i dosledno u skladu sa proizvodnim procesom. Specifikacije treba da sadrže kontrolu nečistoća (npr. organskih nečistoća, neorganskih nečistoća i rezidualnih rastvarača). Ako aktivni farmaceutski sastojak (API) ima specifikaciju za mikrobiološku čistoću, treba uspostaviti i pridržavati se odgovarajućih akcionih limita u pogledu ukupnog broja mikroorganizama i nepoželjnih organizama. Ako aktivni farmaceutski sastojak (API) ima specifikaciju za endotoksine, treba uspostaviti i pridržavati se odgovarajućih akcionih limita.
11.14 Laboratorijske kontrole treba pratiti i dokumentovati u vreme izvođenja. Bilo kakva odstupanja od gore navedenih procedura treba da se dokumentuju i obrazlože.
11.15 Bilo koji rezultat koji je van specifikacije (OOS) treba da se istraži i dokumentuje u skladu sa procedurom. Ova procedura treba da zahteva analizu podataka, procenu da li postoji neki značajan problem, dodelu zaduženja za korektivne mere i zaključke. Bilo kakvo ponovno uzorkovanje i/ili ponovno testiranje posle rezultata van specifikacije (OOS) treba da se izvrši u skladu sa dokumentovanom procedurom.
11.16 Reagensi i standardni rastvori treba da se pripremaju i obeležavaju u skladu sa pisanim procedurama. Datumi koji označavaju "koristiti do" treba da se navedu, kao odgovarajući, kod analitičkih reagenasa ili standardnih rastvora.
11.17 Primarni referentni standardi treba da se nabave, kao odgovarajući, za proizvodnju aktivnih farmaceutskih sastojaka (API). Izvor svakog primarnog referentnog standarda treba da se dokumentuje. Treba da se vode zapisi o skladištenju i upotrebi svakog primarnog referentnog standarda u skladu sa preporukama dobavljača/proizvođača. Primarni referentni standardi nabavljeni iz zvanično priznatog izvora se obično upotrebljavaju bez testiranja ako su uskladišteni pod uslovima u skladu sa preporukama dobavljača/proizvođača.
11.18 Kada primarni referentni standard ne može da se dobije iz zvanično priznatog izvora, treba da se uspostavi "interni primarni standard". Odgovarajuće testiranje treba da se izvrši kako bi se u potpunosti odredili identitet i čistoća primarnog referentnog standarda. Treba da se vodi odgovarajuća dokumentacija o ovom testiranju.
11.19 Sekundarni referentni standardi treba da se na odgovarajući način pripreme, identifikuju, testiraju, odobre i čuvaju. Podobnost svake serije sekundarnog referentnog standarda treba da se odredi pre prve upotrebe i to poređenjem sa primarnim referentnim standardom. Svaku seriju sekundarnog referentnog standarda treba periodično rekvalifikovati u skladu sa pisanim protokolom.
11.2 Testiranje međuproizvoda i aktivnih farmaceutskih sastojaka (API)
11.20 Za svaku seriju međuproizvoda i aktivnog farmaceutskog sastojka (API), treba da se sprovedu odgovarajući laboratorijski testovi kako bi se odredila usklađenost sa specifikacijama.
11.21 Za svaki aktivni farmaceutski sastojak (API) po pravilu treba da se uspostavi profil nečistoća koji opisuje identifikovane i neidentifikovane nečistoće prisutne u tipičnoj seriji proizvedenoj specifičnim kontrolisanim proizvodnim procesom. Profil nečistoća treba da sadrži podatak o identitetu ili neku kvalitativnu analitičku odrednicu (npr. vreme retencije), raspon vrednosti svake zapažene nečistoće i klasifikaciju svake identifikovane nečistoće (npr. neorganska, organska, rastvarač). Profil nečistoća obično zavisi od proizvodnog procesa i porekla aktivnog farmaceutskog sastojka (API). Profili nečistoća obično nisu potrebni za aktivne farmaceutske sastojke (API) iz tkiva biljnog ili životinjskog porekla. Biotehnološka razmatranja obuhvaćena su ICH Smernicom Q6B.
11.22 U odgovarajućim intervalima profil nečistoća treba da se poredi sa profilom nečistoća navedenim u dokumentaciji priloženoj regulatornom organu ili sa ranijim podacima, kako bi se otkrile promene aktivnog farmaceutskog sastojka (API) koje su rezultat promena u pogledu sirovina, parametara funkcionisanja opreme ili proizvodnog procesa.
11.23 Ogovarajući mikrobiološki testovi treba da se sprovode na svakoj seriji međuproizvoda i aktivnog farmaceutskog sastojka (API) kod kojih je specificiran mikrobiološki kvalitet.
11.3 Validacija analitičkih procedura - vidi Odeljak 12.
11.4 Sertifikati analiza
11.40 Autentični, odnosno originalni sertifikati analiza treba da se izdaju na zahtev, za svaku seriju međuproizvoda ili aktivnog farmaceutskog sastojka (API).
11.41 U Sertifikatu analize treba da se navedu podaci o nazivu međuproizvoda ili aktivnog farmaceutskog sastojka (API) uključujući i, gde je to odgovarajuće, njegovu klasu kvaliteta, broj serije i datum puštanja u promet. Za međuproizvode ili aktivne farmaceutske sastojke (API) sa rokom trajanja, rok trajanja treba da se navede na etiketi i u Sertifikatu analize. Za međuproizvode ili aktivne farmaceutske sastojke (API) koji imaju određen datum ponovnog testiranja, datum ponovnog testiranja treba da se navede na etiketi i/ili u Sertifikatu analize.
11.42 U Sertifikatu treba da se navedu svi izvršeni testovi u skladu sa farmakopejskim ili zahtevima kupca, uključujući i granice prihvatljivosti i dobijene numeričke rezultate (ako su rezultati testova numerički).
11.43 Sertifikati treba da budu datirani i potpisani od strane ovlašćenog osoblja iz službe(i) za kvalitet i treba da sadrže ime, adresu i telefonski broj originalnog proizvođača. Ako je analize izveo prepakivač ili prerađivač, u Sertifikatu analize treba da se navede ime, adresa i telefonski broj prepakivača/prerađivača, kao i upućivanje na originalnog proizvođača.
11.44 Ako prepakivači/prerađivači, zastupnici ili posrednici izdaju nove Sertifikate ili su Sertifikati izdati u njihovo ime, u ovim Sertifikatima treba da stoji ime, adresa i telefonski broj laboratorije koja je izvršila analizu. Oni takođe treba da sadrže podatak o imenu i adresi originalnog proizvođača i originalni Sertifikat o seriji, čija se kopija prilaže.
11.5 Praćenje stabilnosti aktivnih farmaceutskih sastojaka (API)
11.50 Dokumentovan program kontinuiranog praćenja stabilnosti treba da se uspostavi radi praćenja karakteristika stabilnosti aktivnih farmaceutskih sastojaka (API), a rezultate treba koristiti za potvrđivanje odgovarajućih uslova skladištenja i datuma ponovnog testiranja ili roka trajanja.
11.51 Procedure koje se koriste pri testiranju stabilnosti treba da budu validirane i indikativne za stabilnost.
11.52 Uzorci za ispitivanje stabilnosti treba da se čuvaju u kontejnerima koji simuliraju komercijalne kontejnere. Na primer, ako se aktivni farmaceutski sastojak (API) u promet stavlja u vrećama u buradima od vlakana, uzorci za ispitivanje stabilnosti mogu da se pakuju u vreće od istog materijala i u manje buriće napravljene od materijala sličnog ili istog sastava kao burad u koju se pakuje komercijalni proizvod (API).
11.53 Po pravilu se prve tri serije komercijalne proizvodnje uključuju u program praćenja stabilnosti kako bi se potvrdio datum ponovnog testiranja ili roka trajanja proizvoda. Međutim, ako podaci iz prethodnih istraživanja pokazuju da se očekuje da će aktivni farmaceutski sastojak (API) ostati stabilan tokom najmanje dve godine, može se koristiti manje od tri serije.
11.54 Nadalje, najmanje jedna serija godišnje proizvedenog aktivnog farmaceutskog sastojka (API) (osim u slučaju da te godine nije proizvedena ni jedna serija), treba da se doda programu praćenja stabilnosti i da se testira najmanje jedanput godišnje kako bi se potvrdila stabilnost.
11.55 U slučaju aktivnih farmaceutskih sastojaka (API) sa kratkim rokom trajanja, testiranje treba da se obavlja češće. Na primer, kod biotehnoloških/bioloških i drugih aktivnih farmaceutskih sastojaka (API) koji imaju rok trajanja od godinu dana ili manje, uzorci za stabilnost treba da se uzimaju i testiraju jedanput mesečno tokom prva tri meseca, a nakon toga u tromesečnim intervalima. U slučaju kada postoje podaci koji potvrđuju da stabilnost aktivnih farmaceutskih sastojaka (API) nije ugrožena, može se razmotriti izostavljanje određenih intervala za testiranje (npr. 9-mesečno testiranje).
11.56 Kada je odgovarajuće, uslovi čuvanja uzoraka za ispitivanje stabilnosti treba da budu u skladu sa ICH smernicama o stabilnosti.
11.6 Rok trajanja i datum ponovnog testiranja (retestiranja)
11.60 Kada neki međuproizvod treba da se prenese na mesto van kontrole proizvođačevog sistema upravljanja materijalima, a utvrđen je rok trajanja ili datum ponovnog testiranja, treba da budu raspoložive dodatne informacije o stabilnosti (npr. objavljeni podaci, rezultati testova).
11.61 Rok trajanja ili datum ponovnog testiranja aktivnog farmaceutskog sastojka (API) treba da se zasniva na proceni podataka dobijenih iz studija stabilnosti. Uobičajena je praksa da se koristi datum ponovnog testiranja, a ne datum isteka roka trajanja.
11.62 Preliminarni datumi isteka roka trajanja ili ponovnog testiranja aktivnog farmaceutskog sastojka (API) mogu da se zasnivaju na probnim (pilot scale) serijama ako (1) je kod probnih serija upotrebljen metod proizvodnje i procedura koja simulira krajnji proces koji će se koristiti kod komercijalne proizvodnje i (2) ako kvalitet aktivnog farmaceutskog sastojka (API) reprezentuje materijal koji će se proizvoditi za komercijalnom nivou.
11.63 Za ponovljeno testiranje potrebno je uzeti reprezentativni uzorak.
11.7 Rezervni/zadržani uzorci
11.70 Pakovanje i čuvanje rezervnih uzoraka vrši se radi potencijalne buduće procene kvaliteta serija aktivnih farmaceutskih sastojaka (API), a ne radi testiranja stabilnosti.
11.71 Na odgovarajući način obeleženi rezervni uzorci svake serije aktivnog farmaceutskog sastojka (API) treba da se čuvaju godinu dana posle isteka roka trajanja serije koji je označio proizvođač ili tri godine posle distribucije serije, a uzima se duži od navedena dva roka. U slučaju aktivnih farmaceutskih sastojaka (API) sa određenim datumom ponovnog testiranja, rezervni uzorci slično treba da se čuvaju tri godine posle potpune distribucije serije od strane proizvođača.
11.72 Rezervni uzorak treba da se čuva u istom materijalu za pakovanje u kome se skladišti i aktivni farmaceutski sastojak (API) ili koji je ekvivalentan ili koji daje veću zaštitu od pakovanja za tržište. Potrebno je sačuvati dovoljne količine uzorka za sprovođenje bar dve kompletne farmakopejske analize ili, ako ne postoji monografija farmakopeje, dve kompletne analize po specifikaciji.
12.1 Politika validacije
12.10 Sveukupna politika kompanije, planovi i pristup validaciji, uključujući i validaciju proizvodnih procesa, procedura čišćenja, analitičkih metoda, test procedura procesne kontrole, kompjuterizovanih sistema, kao i lica zadužena za izradu, pregled, odobravanje i dokumentovanje svake faze validacije, treba da se dokumentuju.
12.11 Kritične parametre/osobine po pravilu treba identifikovati tokom faze razvoja ili iz istorijskih podataka, a takođe treba odrediti i opsege neophodne za ponovljivost operacija. Ovo treba da podrazumeva sledeće:
- Definisanje aktivnog farmaceutskog sastojka (API) u pogledu njegovih kritičnih osobina proizvoda;
- Identifikovanje procesnih parametara koji mogu da utiču na kritične osobine kvaliteta aktivnog farmaceutskog sastojka (API);
- Utvrđivanje raspona vrednosti za svaki kritični procesni parametar za koji se očekuje da će se koristiti tokom rutinske proizvodnje i procesne kontrole.
12.12 Validacija treba da obuhvati one operacije za koje je utvrđeno da su kritične za kvalitet i čistoću aktivnog farmaceutskog sastojka (API).
12.2 Dokumentacija o validaciji
12.20 Potrebno je da postoji pisani protokol o validaciji u kome se navodi kako će se sprovesti validacija određenog procesa. Ovaj protokol treba da pregleda(ju) i odobri(e) služba(e) za kvalitet i druge zadužene službe.
12.21 U protokolu o validaciji treba da se navedu kritični procesni koraci i kriterijumi prihvatljivosti, kao i vrsta validacije koja će se sprovesti (npr. retrospektivna, prospektivna, tekuća), kao i broj serija.
12.22 Treba pripremiti izveštaj o validaciji koji se poziva na protokol o validaciji, i u kome se sumiraju dobijeni rezultati, daje komentar o bilo kakvim primećenim odstupanjima i izvlače odgovarajući zaključci, uključujući davanje preporuke za izmene kojima bi se korigovala odstupanja.
12.23 Bilo kakve varijacije protokola o validaciji treba da se dokumentuju uz odgovarajuće obrazloženje.
12.3 Kvalifikacija
12.30 Pre započinjanja aktivnosti validacije procesa, treba da se izvrši odgovarajuća kvalifikacija kritične opreme i pomoćnih sistema. Kvalifikacija se obično vrši sprovođenjem sledećih aktivnosti, pojedinačno ili kombinovano:
- Kvalifikacija dizajna (DQ): dokumentovano potvrđivanje da je predloženi dizajn postrojenja, opreme ili sistema pogodan za nameravanu svrhu;
- Instalaciona kvalifikacija (IQ): dokumentovano potvrđivanje da oprema ili sistemi, na način na koji su instalirani ili modifikovani, odgovaraju odobrenom dizajnu, preporukama proizvođača i/ili zahtevima korisnika;
- Operaciona kvalifikacija (OQ): dokumentovano potvrđivanje da oprema ili sistemi, na način na koji su instalirani ili modifikovani, funkcionišu kako je predviđeno u okviru očekivanog radnog opsega;
- Kvalifikacija performansi (PQ): dokumentovano potvrđivanje da oprema i pomoćni sistemi, na način na koji su povezani zajedno, mogu efektivno i ponovljivo da funkcionišu na osnovu odobrenog proizvodnog postupka i specifikacija.
12.4 Pristupi validaciji procesa
12.40 Validacija procesa (PV) je dokumentovano potvrđivanje da proces, kada se sprovodi u okviru uspostavljenih parametara, može da funkcioniše efektivno i ponovljivo i da proizvede međuproizvod ili aktivni farmaceutski sastojak (API) koji zadovoljava prethodno definisane specifikacije i karakteristike kvaliteta.
12.41 Postoje tri pristupa validaciji. Prospektivna validacija je poželjan pristup, ali postoje izuzeci kada se mogu primeniti drugi pristupi. Ovi pristupi i njihova primenljivost se navode u daljem tekstu.
12.42 Prospektivna validacija po pravilu treba da se vrši kod svih procesa proizvodnje aktivnih farmaceutskih sastojaka (API), kako je definisano u tački 12.12. Prospektivna validacija procesa proizvodnje aktivnog farmaceutskog sastojka (API) treba da se završi pre stavljanja u promet gotovog leka proizvedenog od tog aktivnog farmaceutskog sastojka (API).
12.43 Tekuća validacija se sprovedi u slučaju kada nisu dostupni podaci iz ponovljenih proizvodnih procesa zbog toga što je proizveden samo ograničen broj serija aktivnog farmaceutskog sastojka (API), zbog toga što se serije aktivnog farmaceutskog sastojka (API) proizvode retko, ili se proizvode validiranim procesom koji je modifikovan. Pre završetka tekuće validacije, serije aktivnog farmaceutskog sastojka (API) mogu da se puste u promet i koriste za proizvodnju leka za komercijalnu distribuciju na osnovu sveobuhvatnog monitoringa i testiranja serija aktivnog farmaceutskog sastojka (API).
12.44 U pogledu retrospektivne validacije može da se napraviti izuzetak za dobro uspostavljene procese koji se primenjuju bez značajnijih promena u pogledu kvaliteta aktivnog farmaceutskog sastojka (API) nastalih zbog promena u pogledu sirovinama, opreme, sistema, postrojenja/pogona ili proizvodnog procesa. Ovaj pristup validaciji može da se koristi u sledećim slučajevima:
(1) Kada su identifikovane kritične karakteristike kvaliteta i kritični parametri procesa;
(2) Kada su uspostavljeni odgovarajući kriterijumi prihvatljivosti i kontrole tokom procesa;
(3) Kada nije bilo značajnijih nedostataka/otkaza u procesu/kod proizvoda koji se ne mogu povezati sa greškom operatera ili otkazivanjem zbog neodgovarajuće opreme, i
(4) Kada su utvrđeni profili nečistoća za postojeći aktivni farmaceutski sastojak (API).
12.45 Serije odabrane za retrospektivnu validaciju treba da budu reprezentativne za sve serije proizvedene u toku perioda koji se pregleda, uključujući i sve serije koje nisu zadovoljile specifikacije, i treba da bude dovoljan broj serija kako bi se demonstrirala konzistentnost procesa. Kontrolni uzorci mogu da se testiraju u cilju dobijanja podataka za retrospektivnu validaciju procesa.
12.5 Program validacije procesa
12.50 Broj proizvedenih serija za validaciju zavisi od kompleksnosti procesa ili od veličine izmene procesa koji je u pitanju. Za prospektivnu i tekuću validaciju, po pravilu, treba koristiti serije proizvedene iz tri uzastopna uspešna proizvodna procesa, ali postoje situacije kada su potrebne dodatne serije koje treba da dokažu konzistentnost procesa (npr. kompleksni procesi proizvodnje aktivnog farmaceutskog sastojka (API) ili procesi proizvodnje aktivnog farmaceutskog sastojka (API) sa prolongiranim vremenom završetka). Kod retrospektivne validacije, po pravilu treba da se pregledaju podaci iz deset to trideset uzastopnih serija kako bi se procenila konzistentnost procesa, ali može da se ispita i manji broj serija ako to može da se opravda.
12.51 Tokom studija validacije procesa potrebno je kontrolisati i pratiti kritične parametre procesa. U proces validacije ne treba uključivati parametre procesa koji se ne odnose na kvalitet, kao što su, na primer, varijable/promenljive koje se kontrolišu kako bi se minimizirao utrošak električne energije ili korišćenje opreme.
12.52 Validacija procesa treba da potvrdi da je profil nečistoća svakog aktivnog farmaceutskog sastojka (API) u okviru utvrđenih limita. Profil nečistoća treba da bude sličan ili bolji od istorijskih podataka i, kada je to slučaj, profila utvrđenog tokom razvoja ili profila serija korišćenih za ključne kliničke i toksikološke studije.
12.6 Periodični pregled validiranih sistema
12.60 Sisteme i procese treba periodično proveravati kako bi se potvrdilo da i dalje funkcionišu na validan način. U slučaju kada nisu izvršene značajne izmene sistema ili procesa, a pregled kvaliteta potvrđuje da sistem ili proces konzistentno proizvode materijal koji je u skladu sa specifikacijama, po pravilu nije potrebna revalidacija.
12.7 Validacija čišćenja
12.70 Procedure čišćenja po pravilu treba da budu validirane. U načelu, validacija čišćenja treba da bude usmerena na situacije ili procesne korake u kojim kontaminacija ili prenošenje materijala predstavljaju najveći rizik za kvalitet aktivnog farmaceutskog sastojka (API). Na primer, u ranim fazama proizvodnje može da bude nepotrebno da se validiraju procedure čišćenja opreme kod kojih se rezidualne materije uklanjaju narednim fazama prečišćavanja.
12.71 Procedure validacije čišćenja treba da odražavaju trenutni način upotrebe opreme. U slučaju kada se različiti aktivni farmaceutski sastojci (API) ili međuproizvodi proizvode istom opremom i oprema se čisti primenom iste metode, za validaciju čišćenja može da se odabere reprezentativni međuproizvod ili aktivni farmaceutski sastojak (API). Izbor treba da se bazira na rastvorljivosti i težini čišćenja, kao i obračunu limita rezidua koji se zasniva na jačini, toksičnosti i stabilnosti.
12.72 U protokolu za validaciju čišćenja treba da se opiše oprema koja se čisti, procedure, materijali, prihvatljivi nivoi čistoće, parametri koje treba pratiti i kontrolisati i analitičke metode. U protokolu, takođe, treba da se navede vrsta uzoraka koje treba uzeti, kao i način na koji se oni prikupljaju i obeležavaju.
12.73 Uzorkovanje treba da uključi uzimanje brisa, ispiranje ili druge metode (npr. direktna ekstrakcija), prema konkretnom slučaju, kako bi se otkrili i rastvorljivi i nerastvorljivi rezidualni materijali. Metode uzorkovanja koje se primenjuju treba da budu takve da može kvantitativno da se odredi nivo rezidua preostalih na površini opreme posle čišćenja. Uzorkovanje brisom može da bude neizvodljivo kada kontaktne površine opreme nisu lako dostupne zbog dizajna opreme i/ili procesnih ograničenja (npr. unutrašnje površine creva, cevi za transfer, rezervoari reaktora sa malim prijemnim površinama ili rukovanje toksičnim materijalima, i mala "komplikovana" oprema kao što su mikronizatori i mikrofluidizatori).
12.74 Treba koristiti validirane analitičke metode koji su dovoljno osetljive da detektuju rezidue ili kontaminante. Limit detekcije svake analitičke metode treba da bude sa dovoljnom osetljivošću da mogu da detektuju uspostavljeni prihvatljivi nivoa rezidua ili kontaminananta. Za metode treba da se dokaže da je uspostavljen odgovarajući nivo izdvajanja ostatka (recovery). Rezidualni limiti treba da budu izvodljivi, dostižni, proverljivi i da budu zasnovani na najštetnijim reziduama. Limiti mogu se odrede na osnovu poznatog minimalnog farmakološkog, toksikološkog ili fiziološkog dejstva aktivnog farmaceutskog sastojka (API) ili njegove najštetnije komponente.
12.75 Studije čišćenja/sanitizacije opreme treba da se odnose na mikrobiološku i kontaminaciju endotoksinima kod onih procesa gde postoji potreba smanjenja ukupnog broja mikroorganizama ili količine endotoksina u aktivnom farmaceutskom sastojku (API), ili kod drugih procesa gde bi takva kontaminacija mogla da ima značaja (npr. korišćenje nesterilnih aktivnih farmaceutskih supstanci (API) u proizvodnji sterilnih proizvoda).
12.76 Procedure čišćenja treba da se prate u odgovarajućim intervalima posle validacije kako bi se osiguralo da su te procedure efektivne kada se koriste tokom rutinske proizvodnje. Čistoća opreme može da se prati analitičkim testiranjem i vizuelnim pregledom, gde je to izvodljivo. Vizuelni pregled može da omogući detekciju veće kontaminacije koncentrisane na malim površinama, koja bi inače mogla ostati neprimećena ako bi se primenilo samo uzorkovanje i/ili analiza.
12.8 Validacija analitičkih metoda
12.80 Analitičke metode treba da se validiraju, osim u slučaju kada je metoda koja se koristi opisana u farmakopeji ili drugoj priznatoj referentnoj knjizi standarda. Ipak, pogodnost svih korišćenih metoda testiranja treba proveriti u aktuelnim uslovima upotrebe i dokumentovati.
12.81 Metode treba da se validiraju uključujući i razmatranja o karakteristikama iz ICH smernica o validaciji analitičkih metoda. Nivo izvršene validacije treba da odgovara svrsi analize i fazi proizvodnog procesa aktivnog farmaceutskog sastojka (API).
12.82 Odgovarajuću kvalifikaciju analitičke opreme treba razmotriti pre započinjanja validacije analitičkih metoda.
12.83 O bilo kakvoj modifikaciji validirane analitičke metode treba da se vode kompletni zapisi. Ovi zapisi treba da sadrže razlog modifikacije i odgovarajuće podatke kojima se potvrđuje da modifikacija daje rezultate koji su precizni i pouzdani koliko i uspostavljeni metod.
13.10 Treba da se uspostavi formalni sistem kontrole izmena kako bi se procenile sve izmene koje mogu da utiču na proizvodnju i kontrolu međuproizvoda ili aktivnog farmaceutskog sastojka (API).
13.11 Pisane procedure treba da omoguće identifikaciju, dokumentovanje, odgovarajuću proveru i odobravanje izmena u pogledu sirovina, specifikacija, analitičkih metoda, postrojenja/pogona, pomoćnih sistema, opreme (uključujući kompjuterski hardver), procesnih koraka, materijala za obeležavanje i pakovanje i kompjuterskog softvera.
13.12 Bilo kakve predloge za izmene relevantne za Dobru proizvođačku praksu treba da sastave, pregledaju i odobre odgovarajuće organizacione službe, a služba(e) za kvalitet treba da ih pregleda(ju) i odobri(e).
13.13 Mogući uticaj predloženih izmena na kvalitet međuproizvoda ili aktivnog farmaceutskog sastojka treba da se proceni. Procedura klasifikacije može da bude korisna za određivanje nivoa testiranja, validacije i dokumentovanja neophodnog za obrazlaganje izmena validacionog procesa. Izmene se mogu klasifikovati (npr. kao manje ili veće) u zavisnosti od prirode i veličine izmena, kao i od efekata koje ove izmene mogu imati na proces. Na osnovu naučne procene treba da se odredi koja dodatna testiranja i studije validacije su odgovarajuće za obrazlaganje izmene validiranog procesa.
13.14 Prilikom implementacije odobrenih izmena, treba preduzeti mere koje će obezbedi reviziju svih dokumenata na koja se izmene odnose.
13.15 Nakon implementacije izmene, treba da se izvrši procena prvih serija proizvedenih ili testiranih nakon izmene.
13.16 Treba proceniti u kojoj meri kritične izmene mogu potencijalno da utiču na utvrđene datume ponovnog testiranja ili rok trajanja. Ako je potrebno, uzorci međuproizvoda ili aktivnog farmaceutskog sastojka (API) proizvedeni primenom modifikovanog procesa mogu da se podvrgnu ubrzanom programu studija stabilnosti i/ili mogu da se dodaju programu praćenja stabilnosti.
13.17 Aktuelnim proizvođačima farmaceutskih oblika treba prijaviti izmene u odnosu na uspostavljene procedure kontrole proizvodnje i procesa koje mogu da utiču na kvalitet aktivnog farmaceutskog sastojka (API).
14 Odbijanje i ponovna upotreba materijala
14.1 Odbijanje
14.10 Međuproizvodi i aktivni farmaceutski sastojci (API) koji ne zadovoljavaju zahteve uspostavljene specifikacije, kao takvi treba da se obeleže i stave u karantin. Ovi međuproizvodi ili aktivni farmaceutski sastojci (API) mogu da se dorade, reprocesiraju/prerade na način kako je opisano u sledećem odeljku. Treba da se vode zapisi o mestu konačnog odlaganja odbijenih materijala.
14.2 Prerada/reprocesiranje
14.20 Ponovno uvođenje u proces i reprocesiranje međuproizvoda ili aktivnog farmaceutskog sastojka (API), uključujući i one koji ne ispunjavaju zahteve standarda ili specifikacija, i to ponavljanjem faze kristalizacije ili drugih odgovarajućih faza hemijske ili fizičke manipulacije (npr. destilacija, filtracija, hromatografija, mlevenje), a koje predstavljaju deo uspostavljenog procesa proizvodnje, generalno se smatra prihvatljivim. Međutim, ako se takvo reprocesiranje koristi za veći broj serija, onda takvo reprocesiranje treba da bude sastavni deo standardnog procesa proizvodnje.
14.21 Nastavak procesne faze, nakon što je test procesne kontrole pokazao da faza nije završena, smatra se delom normalnog procesa. To se ne smatra preradom/reprocesiranjem.
14.22 Vraćanje neizreagovalog materijala u proces i ponavljanje neke hemijske reakcije smatra se preradom/reprocesiranjem, osim ako to nije deo uspostavljenog procesa. Takvoj preradi/reprocesiranju treba da prethodi pažljiva procena kojom se obezbeđuje da na kvalitet međuproizvoda ili aktivnog farmaceutskog sastojka (API) nije štetno delovalo potencijalno formiranje sporednih (nus) proizvoda i proizvoda prekomerne reakcije.
14.3 Dorada
14.30 Pre donošenja odluke o doradi serija koje ne ispunjavaju zahteve uspostavljenih standarda ili specifikacija, treba da se ispita razlog njihove neusaglašenosti.
14.31 Serije koje su dorađene treba podvrgnuti odgovarajućoj proceni, testiranju, ispitivanju stabilnosti ako je potrebno, i dokumentovanju kako bi se dokazalo da je dorađeni proizvod ekvivalentnog kvaliteta kao proizvod koji je proizveden u prvobitnom procesu. Tekuća validacija je često odgovarajući pristup validaciji procedure dorade. To se omogućava protokolom koji definiše proceduru dorade, način na koji će se ona sprovesti i rezultate koji se očekuju. Ako treba da se doradi samo jedna serija, može da se napiše izveštaj, a serija da se pusti u promet kada se ustanovi da je prihvatljivog kvaliteta.
14.32 Procedure treba da omoguće poređenje profila nečistoće svake dorađene serije sa serijama proizvedenim primenom uspostavljenih procesa. U slučaju kada su rutinske analitičke metode neadekvatne za karakterizaciju dorađene serije, potrebno je koristiti dodatne metode.
14.4 Regenerisanje materijala i rastvarača
14.40 Regenerisanje (npr. od matičnog rastvora ili filtrata) reaktanata, međuproizvoda ili aktivnih farmaceutskih sastojaka (API) smatra se prihvatljivim pod uslovom da postoje odobrene procedure za regenerisanje i kada regenerisani materijali ispunjavaju zahteve specifikacije uspostavljene za njihovu nameravanu upotrebu.
14.41 Rastvarači mogu da se regenerišu i ponovo upotrebe u istim ili različitim procesima pod uslovom da se procedure regenerisanja kontrolišu i prate kako bi se obezbedilo da rastvarači zadovoljavaju zahteve odgovarajućih standarda pre ponovne upotrebe ili mešanja sa drugim odobrenim materijalima.
14.42 Novi i regenerisani rastvarači i reagensi mogu da se mešaju ako je odgovarajućim testovima dokazano da su ove mešavine odgovarajuće za sve proizvodne procese u kojima treba da se upotrebe.
14.43 Upotreba regenerisanih rastvarača, matičnih rastvora i drugih regenerisanih materijala treba adekvatno da se dokumentuje.
14.5 Povraćaj
14.50 Vraćeni međuproizvodi ili aktivni farmaceutski sastojci (API) treba kao takvi da se obeleže i stave u karantin.
14.51 Ako uslovi pod kojima su vraćeni međuproizvodi ili aktivni farmaceutski sastojci (API) skladišteni ili transportovani pre ili za vreme vraćanja, ili ako stanje njihovih kontejnera, izazivaju sumnju u kvalitet, vraćene međuproizvode ili aktivne farmaceutske sastojke (API) treba preraditi/reprocesirati, doraditi ili uništiti, šta je od toga odgovarajuće.
14.52 Treba voditi zapise o vraćenim međuproizvodima ili aktivnim farmaceutskim sastojcima (API). Za svaki povraćaj dokumentacija treba da sadrži sledeće:
- Ime i adresa primaoca robe;
- Naziv međuproizvoda ili aktivnog farmaceutskog sastojka (API), broj serije i vraćenu količinu;
- Razlog za vraćanje;
- Upotreba ili odlaganje vraćenog međuproizvoda ili aktivnog farmaceutskog sastojka (API).
15 Reklamacije i povlačenja iz prometa
15.10 Sve reklamacije u vezi sa kvalitetom, bilo da su primljene usmeno ili pismeno, treba da se evidentiraju i istraže u skladu sa pisanom procedurom.
15.11 Zapisi o reklamacijama treba da sadrže sledeće:
- Ime i adresu podnosioca reklamacije;
- Ime (i, kada je to potrebno, funkciju) i telefonski broj lica koje podnosi reklamaciju;
- Prirodu/vrstu reklamacije (uključujući i naziv i broj serije aktivnog farmaceutskog sastojka (API));
- Datum prijema reklamacije;
- Mere koje su odmah preduzete (uključujući i datume i identitet lica koje je preduzelo mere);
- Bilo koju kasnije preduzetu meru;
- Odgovor dat podnosiocu reklamacije (uključujući datum slanja odgovora); i
- Konačnu odluku u vezi sa serijom ili lotom međuproizvoda ili aktivnog farmaceutskog sastojka (API).
15.12 Zapisi o reklamacijama treba da se vode tako da mogu da se procenjuju trendovi, učestalost po proizvodu i težina, sa ciljem preduzimanja dodatnih i, ako je potrebno, neodložnih korektivnih mera.
15.13 Treba da postoji pisana procedura kojom se definišu okolnosti u kojima treba razmotriti povlačenje nekog međuproizvoda ili aktivnog farmaceutskog sastojka (API).
15.14 Procedurom povlačenja treba da se odredi ko treba da bude uključen u procenu informacija, kako treba pokrenuti povlačenje, koga treba obavestiti o povlačenju i kako treba postupati sa povučenim materijalom.
15.15 U slučaju ozbiljne ili potencijalno po život opasne situacije potrebno je informisati lokalne, nacionalne i/ili međunarodne nadležne organe/institucije i zatražiti njihov savet.
16 Ugovorni proizvođači (uključujući i laboratorije)
16.10 Svi ugovorni proizvođači (uključujući i laboratorije) treba da su usaglašeni sa Dobrom proizvođačkom praksom definisanom u ovim smernicama. Posebnu pažnju treba obratiti na prevenciju unakrsne kontaminacije i održavanje sledljivosti.
16.11 Ugovorne proizvođače (uključujući i laboratorije) treba da proceni davalac ugovora, kako bi se obezbedila usaglašenost specifičnih operacija koje se sprovode na mestima izvršenja ugovora sa Dobrom proizvođačkom praksom.
16.12 Treba da postoji zaključen pisani ugovor ili formalni sporazum između davaoca i primaoca ugovora, koji detaljno definiše odgovornost svake od ugovornih strana u vezi sa Dobrom proizvođačkom praksom, uključujući i preduzimanje mera u vezi kvaliteta.
16.13 Ugovor treba da omogući davaocu ugovora da izvrši proveru postrojenja/pogona primaoca ugovora u pogledu usaglašenosti sa Dobrom proizvođačkom praksom.
16.14 Kada je ugovorom dozvoljeno podugovaranje, primalac ugovora ne sme da prenosi na treće lice nikakav posao koji mu je ugovorom poveren, bez prethodno obavljene procene od strane davaoca ugovora i njegovog odobrenja.
16.15 Zapise o proizvodnji i laboratorijskim analizama treba čuvati na mestu sprovođenja aktivnosti i one treba da budu dostupne u svakom trenutku.
16.16 Izmene procesa, opreme, metoda testiranja, specifikacija ili drugih ugovornih zahteva mogu da se vrše samo ako je davalac ugovora upoznat o tome i ako odobrava te izmene.
17 Zastupnici, posrednici, prodavci, distributeri, prepakivači i firme koje vrše ponovno obeležavanje
17.1 Primenljivost
17.10 Ovaj odeljak odnosi se na bilo koju firmu osim originalnog proizvođača, koja se bavi prodajom i/ili dolazi u posed, vrši prepakivanje, ponovno obeležavanje, rukovanje, distribuciju ili skladištenje aktivnog farmaceutskog sastojka (API) ili međuproizvoda.
17.11 Svi zastupnici, posrednici, prodavci, distributeri, prepakivači i firme koje vrše ponovno obeležavanje treba da posluju u skladu sa Dobrom proizvođačkom praksom onako kako je to utvrđeno u ovim smernicama.
17.2 Sledljivost distribuiranih aktivnih farmaceutskih sastojaka (API) i međuproizvoda
17.20 Zastupnici, posrednici, prodavci, distributeri, prepakivači ili firme koje vrše ponovno obeležavanje treba da održavaju potpunu sledljivost aktivnih farmaceutskih sastojaka (API) i međuproizvoda koje distribuiraju. Dokumenta koja treba zadržati i koja treba da stoje na raspolaganju su sledeća:
- Identitet originalnog proizvođača;
- Adresa originalnog proizvođača;
- Narudžbenice;
- Tovarni listovi (transportna dokumentacija);
- Dokumentacija o prijemu;
- Naziv ili oznaka aktivnog farmaceutskog sastojka (API) ili međuproizvoda;
- Proizvođačev broj serije;
- Zapisi o transportu i distribuciji;
- Sve autentične/originalne Sertifikate analiza, uključujući i one od originalnog proizvođača;
- Datum ponovnog testiranja ili rok trajanja.
17.3 Upravljanje kvalitetom
17.30 Zastupnici, posrednici, prodavci, distributeri, prepakivači ili firme koje vrše ponovno obeležavanje treba da uspostave, dokumentuju i implementiraju efektivan sistem upravljanja kvalitetom, kako je navedeno u Odeljku 2.
17.4 Prepakivanje, ponovno obeležavanje i čuvanje aktivnih farmaceutskih sastojaka (API) i međuproizvoda
17.40 Prepakivanje, ponovno obeležavanje i čuvanje aktivnih farmaceutskih sastojaka (API) i međuproizvoda treba da se vrši pod odgovarajućim kontrolama dobre proizvođačke prakse kako je predviđeno u ovim smernicama, a u cilju izbegavanja mešanja/zamena i gubitka identiteta ili čistoće aktivnog farmaceutskog sastojka (API) ili međuproizvoda.
17.41 Prepakivanje treba da se sprovodi pod odgovarajućim ambijentalnim uslovima kako bi se izbegla kontaminacija i unakrsna kontaminacija.
17.5 Stabilnost
17.50 U slučaju kada se vrši prepakivanje aktivnog farmaceutskog sastojka (API) ili međuproizvoda u kontejner čija se vrsta razlikuje od one koju je koristio proizvođač aktivnog farmaceutskog sastojka (API) ili međuproizvoda, treba sprovesti studije stabilnosti kako bi se opravdali definisani datumi roka trajanja ili ponovnog testiranja.
17.6 Prenošenje informacija
17.60 Zastupnici, posrednici, distributeri, prepakivači ili ponovni obeležavači treba da prenesu kupcu sve informacije, u vezi sa kvalitetom ili zakonskom regulativom, dobijene od proizvođača aktivnog farmaceutskog sastojka (API) ili međuproizvoda, kao i one dobijene od kupca proizvođaču aktivnog farmaceutskog sastojka (API) ili međuproizvoda.
17.61 Zastupnik, posrednik, prodavac, distributer, prepakivač ili firma koja vrši ponovno obeležavanje, koji isporučuje/snabdeva kupca aktivnim farmaceutskim sastojkom (API) ili međuproizvodom, treba da obezbedi podatke o imenu originalnog proizvođača aktivnog farmaceutskog sastojka (API) ili međuproizvoda, kao i broju(evima) serije(a) koja je isporučena.
17.62 Zastupnik, takođe, treba na zahtev regulatornih organa da im obezbedi i podatke o identitetu originalnog proizvođača aktivnog farmaceutskog sastojka (API) ili međuproizvoda. Originalni proizvođač može regulatornim organima da odgovori direktno ili preko svojih ovlašćenih zastupnika, u zavisnosti od pravnog odnosa između ovlašćenih zastupnika i originalnog proizvođača aktivnog farmaceutskog sastojka (API) ili međuproizvoda. (U ovom kontekstu "ovlašćen" znači ovlašćen od strane proizvođača).
17.63 Treba se pridržavati specifičnih uputstava za Sertifikate analiza opisanih u Odeljku 11.4.
17.7 Postupanje u slučaju reklamacija i povlačenja iz prometa
17.70 Zastupnici, posrednici, prodavci, distributeri, prepakivači ili firme koje vrše ponovno obeležavanje treba da vode zapise o reklamacijama i povlačenjima, kako je navedeno u Odeljku 15, za sve reklamacije i povlačenja o kojima imaju saznanje.
17.71 Ako to situacija zahteva, zastupnici, posrednici, prodavci, distributeri, prepakivači ili firme koje vrše ponovno obeležavanje treba da razmotre reklamaciju zajedno sa originalnim proizvođačem aktivnog farmaceutskog sastojka (API) ili međuproizvoda, kako bi utvrdili da li treba preduzeti bilo kakve dalje mere, bilo kod drugih kupaca koji su možda primili ovaj aktivni farmaceutski sastojak (API) ili međuproizvod, ili kod regulatornih organa, ili kod oboje. Odgovarajuća strana treba da sprovede i dokumentuje istragu o uzroku reklamacije ili povlačenja.
17.72 Kada je reklamacija upućena originalnom proizvođaču aktivnog farmaceutskog sastojka (API) ili međuproizvoda, zapisi koje vode zastupnici, posrednici, prodavci, distributeri, prepakivači ili firme koje vrše ponovno obeležavanje treba da sadrže i svaki odgovor dobijen od originalnog proizvođača aktivnog farmaceutskog sastojka (API) ili međuproizvoda (uključujući datum i dobijene informacije).
17.8 Rukovanje vraćenim proizvodima
17.80 Vraćenim proizvodima treba rukovati na način kako je opisano u Odeljku 14.52. Zastupnici, posrednici, prodavci, distributeri, prepakivači ili firme koje vrše ponovno obeležavanje treba da vode dokumentaciju o vraćenim aktivnim farmaceutskim sastojcima (API) ili međuproizvodima.
18 Posebno uputstvo za aktivne farmaceutske sastojke (API) koji se proizvode kultivacijom ćelija/fermentacijom
18.1 Opšte napomene
18.10 Odeljak 18 se odnosi na specifične kontrole aktivnih farmaceutskih sastojaka (API) ili međuproizvoda koji se proizvode kultivacijom ćelija ili fermentacijom, uz upotrebu prirodnih ili rekombinantnih organizama, a koje nisu na odgovarajući način obuhvaćene u prethodnim odeljcima. Namera nije da se ovaj odeljak sagledava mimo ostalih. Generalno, i u ovom slučaju se primenjuju principi dobre proizvođačke prakse opisani u drugim odeljcima ovih smernica. Treba napomenuti da su isti principi u slučaju fermentacije za "klasične" procese za proizvodnju malih molekula i za procese u kojima se koriste rekombinantni i ne-rekombinantni organizmi za proizvodnju proteina i/ili polipeptida, osim što se nivoi kontrole razlikuju. Kada god je to izvodljivo, u ovom odeljku se ukazuje na te razlike. Po pravilu, nivo kontrole biotehnoloških procesa koji se koriste za proizvodnju proteina i polipeptida je veći od onoga koji se primenjuje kod klasičnih procesa fermentacije.
18.11 Termin "biotehnološki proces" (biotech) odnosi se na upotrebu ćelija ili organizama koji su generisani ili modifikovani rekombinantnom DNK, hibridomom ili nekom drugom tehnologijom kako bi se proizveli aktivni farmaceutski sastojci (API). Aktivni farmaceutski sastojci (API) proizvedeni biotehnološkim procesima se obično sastoje od supstanci sa velikom molekulskom težinom, kao što su, na primer, proteini i polipeptidi, za koje se u ovom Odeljku daju posebna uputstva. Određeni aktivni farmaceutski sastojci (API) niske molekulske težine, kao što su, na primer, antibiotici, amino kiseline, vitamini i ugljeni hidrati mogu takođe da se proizvode tehnologijom rekombinantne DNK. Nivo kontrole ovih aktivnih farmaceutskih sastojaka (API) je sličan onom koji se koristi kod klasične fermentacije.
18.12 Termin "klasična fermentacija" odnosi se na procese kod kojih se u proizvodnji aktivnih farmaceutskih sastojaka (API) koriste mikroorganizmi koji postoje u prirodi i/ili oni koji su modifikovani konvencionalnim metodima (npr. zračenjem ili hemijskom mutagenezom). Aktivni farmaceutski sastojci (API) proizvedeni "klasičnom fermentacijom" su obično proizvodi niske molekularne težine, kao što su, na primer, antibiotici, amino kiseline, vitamini i ugljeni hidrati.
18.13 Proizvodnja aktivnih farmaceutskih sastojaka (API) ili međuproizvoda od ćelijskih kultura ili fermentacijom podrazumeva biološke procese kao što su kultivacija ćelija ili ekstrakcija i prečišćavanje materija iz živih organizama. Treba napomenuti da mogu da postoje dodatni procesni koraci, kao što je, na primer, fizičko-hemijska modifikacija, a koji predstavljaju deo proizvodnog procesa. Sirovine koje se koriste (podloge za kulture, puferske komponente) mogu da predstavljaju potencijal za rast mikrobioloških kontaminanata. U zavisnosti od izvora, metoda izrade i nameravane upotrebe aktivnog farmaceutskog sastojka (API) ili međuproizvoda, može da bude potrebna kontrola prethodnog biološkog opterećenja (bioburden), kontaminacije virusima i/ili endotoksinima tokom proizvodnje i monitoringa procesa u odgovarajućim fazama.
18.14 U svim fazama proizvodnje treba uspostaviti odgovarajuće kontrole kako bi se osigurao kvalitet međuproizvoda ili aktivnog farmaceutskog sastojka (API). Kako primena ove smernice počinju od faze kultivacije ćelija/fermentacije, prethodne faze (npr. stvaranje banke ćelija) treba da se vrše uz primenu odgovarajućih procesnih kontrola. Ove smernice se odnose na kultivaciju ćelija/fermentaciju od momenta kada se iz banke ćelija uzima bočica radi upotrebe u proizvodnji.
18.15 Treba obezbediti odgovarajuću ambijentalnu i kontrolu opreme kako bi se minimizirao rizik od kontaminacije. Kriterijumi prihvatljivosti u pogledu ambijentalnih uslova i učestalosti monitoringa treba da zavise od faze i uslova proizvodnje (otvoreni, zatvoreni ili izolovani sistemi).
18.16 Po pravilu, procesne kontrole treba da obuhvate sledeće:
- Održavanje radne banke ćelija (kada je to odgovarajuće);
- Pravilnu inokulaciju i širenje kulture;
- Kontrolu kritičnih operacionih parametara u toku fermentacije/kultivacije ćelija;
- Monitoring procesa rasta ćelija, održivosti (za većinu procesa ćelijskih kultura) i produktivnosti, kada je to odgovarajuće;
- Procedure berbe i prečišćavanja kojima se uklanjaju ćelije, ćelijski ostaci i komponente podloge, čime se vrši zaštita međuproizvoda ili aktivnog farmaceutskog sastojka (API) od kontaminacije (posebno mikrobiološke prirode) i od gubitka kvaliteta;
- Praćenje biološkog opterećenja, gde je to potrebno, nivoa endotoksina u odgovarajućim fazama proizvodnje; i
- Virusnu bezbednost, kao što je opisano u ICH Smernicama Q5A "Kvalitet biotehnoloških proizvoda: Procena virusne bezbednosti biotehnoloških proizvoda dobijenih iz ćelijskih linija ljudskog ili životinjskog porekla".
18.17 Kada je to potrebno, treba dokazati uklanjanje komponenata podloge, proteina ćelija domaćina, drugih nečistoća vezanih za proces, nečistoća vezanih za proizvod i kontaminanata.
18.2 Održavanje banke ćelija i vođenje zapisa
18.20 Pristup bankama ćelija treba da bude ograničen na ovlašćeno osoblje.
18.21 Uslovi skladištenja za banke ćelija treba da su takvi da se očuva vitalnost i spreči kontaminacija.
18.22 Treba voditi zapise o upotrebi bočica iz banaka ćelija i o uslovima skladištenja.
18.23 Kada je to odgovarajuće, banke ćelija treba periodično proveravati kako bi se odredila pogodnost za upotrebu.
18.24 Za kompletnije informacije o stvaranju banaka ćelija, pogledati ICH smernice Q5D "Kvalitet biotehnoloških proizvoda: Derivacija i karakterizacija ćelijskih substrata koji se koriste za proizvodnju biotehnoloških/bioloških proizvoda".
18.3 Kultivacija ćelija/fermentacija
18.30 Kada treba na aseptičan način dodati ćelijske supstrate, podloge, pufere i gasove, treba koristiti zatvorene ili izolovane sisteme gde god je to moguće. Ako se inokulacija u inicijalnom sudu ili naknadno transferisanje ili dodavanje (medijuma, pufera) vrši u otvorenim sudovima, treba da postoje kontrole i procedure kako bi se minimizirao rizik od kontaminacije.
18.31 U slučaju kada kvalitet aktivnog farmaceutskog sastojka (API) može da bude ugrožen kontaminacijom mikroorganizmima, tada aktivnosti u kojima se koriste otvoreni sudovi treba da se vrši u biološki bezbednom kabinetu ili na sličan način kontrolisanoj radnoj sredini.
18.32 Osoblje treba da nosi odgovarajuću odeću i da preduzima posebne mere predostrožnosti pri rukovanju kulturama.
18.33 Treba vršiti monitoring kritičnih operativnih, odnosno radnih parametara (na primer temperatura, pH, brzina agitacije, dodavanje gasova, pritisak) kako bi se obezbedila konzistentnost sa uspostavljenim procesom. Takođe, treba pratiti rast ćelija, vitalnost (kod većine procesa ćelijskih kultura), a kada je to odgovarajuće, i produktivnost. Kritični parametri će varirati od procesa do procesa, a kod klasične fermentacije određeni parametri (na primer, vitalnost ćelija) ne moraju da se prate.
18.34 Oprema za kultivaciju ćelija treba da se čisti i steriliše posle upotrebe. Kada je odgovarajuće, oprema za fermentaciju treba da se čisti i steriliše i sanitizuje ili steriliše.
18.35 Podloga za kulture treba da se steriliše pre upotrebe, kada je to odgovarajuće, kako bi se zaštitio kvalitet aktivnog farmaceutskog sastojka (API).
18.36 Treba da postoje odgovarajuće procedure za detekciju kontaminacije i određivanja mera koje je potrebno preduzeti. Ovo treba da obuhvati procedure kojima se određuje uticaj kontaminacije na proizvod i procedure za dekontaminaciju opreme i njeno vraćanje u upotrebno stanje za naredne serije. Strani organizmi uočeni tokom procesa fermentacije treba, kada je to odgovarajuće, da se identifikuju i, ukoliko je potrebno, treba da se proceni njihov uticaj na kvalitet proizvoda. Rezultati takvih procena treba da se uzmu u obzir prilikom odobravanja proizvedenog materijala.
18.37 Treba voditi zapise o slučajevima pojave kontaminacije.
18.38 Zajednička, višenamenska oprema (za više proizvoda) može da zahteva dodatno testiranje posle čišćenja između proizvodnje različitih proizvoda, kada je to odgovarajuće, da bi se na minimizirao rizik od unakrsne kontaminacije.
18.4 Berba, izolovanje i prečišćavanje
18.40 Faze berbe, bilo u cilju uklanjanja ćelija ili ćelijskih komponenti ili sakupljanja ćelijskih komponenti posle disrupcije, treba da se vrše upotrebom opreme i u prostorima koji su dizajnirani tako da se minimizira rizik od kontaminacije.
18.41 Procedure berbe i prečišćavanja za uklanjanje ili inaktivaciju proizvodnog organizma, ćelijskih ostataka i komponenti podloga (uz istovremeno minimiziranje razgrađivanja, kontaminacije i gubitka kvaliteta) treba da budu odgovarajuće kako bi se obezbedilo da su regenerisani međuproizvodi ili aktivni farmaceutski sastojci (API) konzistentnog kvaliteta.
18.42 Sva oprema treba da se pravilno očisti i, kada je to primenljivo, da se sanitizuje posle upotrebe. Uzastopna proizvodnja više serija bez čišćenja opreme je primenljiva ako se time ne ugrožava kvalitet međuproizvoda ili aktivnog farmaceutskog sastojka (API).
18.43 U slučaju kada se koriste otvoreni sistemi, prečišćavanje treba da se vrši pod ambijentalnim uslovima odgovarajućim za očuvanje kvaliteta proizvoda.
18.44 Dodatne kontrolne mere, kao što je, na primer, upotreba namenskih smola za hromatografiju ili dodatno testiranje, mogu da budu potrebne ako oprema treba da se koristi za više proizvoda.
18.5 Uklanjanje virusa /koraci inaktivacije
18.50 Pogledati ICH smernice Q5A "Kvalitet biotehnoloških proizvoda: Procena virusne bezbednosti biotehnoloških proizvoda dobijenih iz linija ćelija ljudskog ili životinjskog porekla" ukoliko su potrebne specifičnije informacije.
18.51 Uklanjanje virusa i koraci inaktivacije virusa su kritični procesni koraci za neke procese i treba ih obavljati u okviru validiranih parametara.
18.52 Treba preduzeti odgovarajuće mere predostrožnosti kako bi se sprečila potencijalna virusna kontaminacija iz prethodnih u naknadne korake uklanjanja/inaktivacije virusa. Stoga, upotrebu otvorenih sistema proizvodnje treba ograničiti u prostorima odvojenim od drugih procesnih aktivnosti, za koje su obezbeđeni odvojeni sistemi za vazduh.
18.53 Po pravilu, za različite faze prečišćavanja se ne koristi ista oprema. Međutim, ako je potrebno da se koristi ista oprema, ona treba da se na odgovarajući način čisti i sanitizuje pre ponovne upotrebe. Treba preduzeti odgovarajuće mere predostrožnosti da bi se sprečilo potencijalno prenošenje virusa (npr. preko opreme ili iz okruženja) iz prethodnih faza.
19 Aktivni farmaceutski sastojci (API) za upotrebu u kliničkim ispitivanjima
19.1 Opšte napomene
19.10 Nisu sve kontrolne mere, koje su opisane u prethodnim odeljcima ovih smernica, odgovarajuće za proizvodnju novog aktivnog farmaceutskog sastojka (API) za potrebe kliničkog ispitivanja u toku njegovog razvoja. U Odeljku 19 su data specifična uputstva za ove slučajeve.
19.11 Kontrole koje se primenjuju u proizvodnji aktivnih farmaceutskih sastojaka (API) za upotrebu u kliničkim ispitivanjima treba da budu u skladu sa fazom razvoja leka u čijem je sastavu aktivni farmaceutski sastojak (API). Proces i procedure testiranja treba da budu fleksibilni kako bi se omogućile izmene kako se saznanja o procesu povećavaju a kliničko ispitivanje leka napreduje od pretkliničkih faza do faza kliničkog ispitivanja. Onda kada razvoj leka dostigne fazu kada se aktivni farmaceutski sastojak (API) proizvodi za upotrebu u lekovima namenjenim za klinička ispitivanja, proizvođači treba da obezbede da se aktivni farmaceutski sastojci (API) proizvode u odgovarajućim postrojenjima/pogonima, upotrebom odgovarajućih proizvodnih i kontrolnih procedura, kako bi se obezbedio kvalitet aktivnog farmaceutskog sastojka (API).
19.2 Kvalitet
19.20 Treba primeniti odgovarajuće koncepte dobre proizvođačke prakse u proizvodnji aktivnih farmaceutskih sastojaka (API) namenjenih za upotrebu u kliničkim ispitivanjima sa odgovarajućim mehanizmom za odobravanje svake serije.
19.21 Potrebno je da postoji služba(e) za kvalitet nezavisna(e) od proizvodnje, radi odobravanja ili odbijanja svake serije aktivnog farmaceutskog sastojka (API) namenjenog za upotrebu u kliničkim ispitivanjima.
19.22 Neke od aktivnosti testiranja koje obično vrši(e) služba(e) za kvalitet mogu da se vrše u okviru drugih organizacionih jedinica.
19.23 Mere za postizanje kvaliteta treba da uključe sistem za testiranje sirovina, materijala za pakovanje, međuproizvoda i aktivnih farmaceutskih sastojaka (API).
19.24 Treba vršiti procenu problema u toku procesa i problema u vezi sa kvalitetom.
19.25 Obeležavanje aktivnih farmaceutskih sastojaka (API) namenjenih za upotrebu u kliničkim ispitivanjima treba da se kontroliše na odgovarajući način, a materijal namenjen za upotrebu u ispitivanjima treba da bude obeležen kao takav.
19.3 Oprema i postrojenja/pogoni
19.30 U toku svih faza kliničkog razvoja, uključujući i upotrebu pilot postrojenja ili laboratorija za proizvodnju serija aktivnih farmaceutskih sastojaka (API) za upotrebu u kliničkim ispitivanjima, treba da postoje procedure kako bi se obezbedilo da oprema bude kalibrisana, čista i pogodna za namenjenu upotrebu.
19.31 Procedure koje se odnose na korišćenje postrojenja/pogona treba da obezbede rukovanje materijalima na takav način koji minimizira rizik od kontaminacije i unakrsne kontaminacije.
19.4 Kontrola sirovina
19.40 Sirovine koje se koriste u proizvodnji aktivnih farmaceutskih sastojaka (API) namenjenih za upotrebu u kliničkim ispitivanjima treba da se procene testiranjem, ili da se dobiju sa izvršenom analizom od strane dobavljača i podvrgnu testiranju identifikacije. U slučaju materijala koji se smatra opasnim, dovoljna je analiza od strane dobavljača.
19.41 U nekim slučajevima, pogodnost sirovine može da se odredi pre upotrebe na osnovu prihvatljivosti u reakcijama malog nivoa (npr. test upotrebe), pre nego samo na osnovu analitičkog testiranja.
19.5 Proizvodnja
19.50 Proizvodnja aktivnih farmaceutskih sastojaka (API) za upotrebu u kliničkim ispitivanjima treba da se dokumentuje u laboratorijskim sveskama, Evidencijama o proizvodnji serije, ili na drugi odgovarajući način. Ova dokumenta treba da sadrže informacije o upotrebi proizvodnih materijala, opreme, o procesiranju i naučne opservacije.
19.51 Očekivani proizvodni prinosi mogu više da variraju i da budu manje definisani nego očekivani proizvodni doprinosi koji se koriste kod komercijalnih procesa. Nisu neophodne istrage varijacija proizvodnih prinosa.
19.6 Validacija
19.60 Validacija procesa u proizvodnji aktivnih farmaceutskih sastojaka (API) namenjenih za upotrebu u kliničkim ispitivanjima obično nije odgovarajuća kada se proizvodi samo jedna serija aktivnog farmaceutskog sastojka (API) ili kada je zbog izmena procesa nastalih tokom razvoja aktivnog farmaceutskog sastojka (API) ponovljivost serije otežana ili nedovoljno egzaktna. U toku faze razvoja, kvalitet aktivnog farmaceutskog sastojka (API) obezbeđuje se kombinacijom primene kontrola, kalibracijom i gde je to odgovarajuće kvalifikacijom opreme.
19.61 Validacija procesa treba da se sprovodi u skladu sa Odeljkom 12 kada se serije proizvode za komercijalnu upotrebu, čak i kada se takve serije proizvode kao probne ili kao male serije.
19.7 Izmene
19.70 U toku razvoja očekuju se izmene, kao posledica sticanja novih saznanja i podizanja nivoa proizvodnje. Svaku izmenu u pogledu proizvodnje, specifikacija ili procedura testiranja treba adekvatno evidentirati.
19.8 Laboratorijske kontrole
19.80 Iako analitičke metode koje se koriste za procenu serije aktivnog farmaceutskog sastojka (API) namenjenog za upotrebu u kliničkim ispitivanjima mogu da ne budu validirane, one treba da budu naučno utemeljene.
19.81 Treba da postoji sistem čuvanja rezervnih uzoraka svih serija. Ovim sistemom treba da se obezbedi čuvanje dovoljne količine svakog rezervnog uzorka u odgovarajućem vremenskom periodu posle odobravanja, završetka ili prestanka primene.
19.82 Određivanje roka trajanja i datuma ponovnog testiranja, onako kako je definisano u tački 11.6, primenljivo je na postojeće aktivne farmaceutske sastojke (API) koji se koriste u kliničkim ispitivanjima. Za nove farmaceutske sastojke (API), tačka 11.6 obično nije primenljiva u ranim fazama kliničkog ispitivanja.
19.9 Dokumentacija
19.90 Treba da postoji sistem kojim se obezbeđuje dokumentovanje i dostupnost informacija dobijenih tokom razvoja i proizvodnje aktivnih farmaceutskih sastojaka (API) namenjenih za upotrebu u kliničkim ispitivanjima.
19.91 Razvoj i primena analitičkih metoda koji se koriste kao podrška kod puštanja u promet serije aktivnog farmaceutskog sastojka (API) namenjenog za klinička ispitivanja treba da se na odgovarajući način dokumentuju.
19.92 Treba koristiti sistem za čuvanje zapisa i dokumenta o proizvodnji i kontrolama. Ovaj sistem treba da obezbedi da se zapisi i dokumenta čuvaju tokom odgovarajućeg vremenskog perioda posle odobravanja, završetka ili prestanka primene.
Aktivni farmaceutski sastojak (API) (ili lekovita supstanca)
Bilo koja supstanca ili mešavina supstanci namenjena za upotrebu u proizvodnji leka i koja, kada se koristi u proizvodnji leka, postaje aktivni sastojak proizvedenog leka. Namena ovih supstanci je da utiču na farmakološku aktivnost ili da na drugi način direktno utiču u dijagnostici, lečenju, ublažavanju, nezi ili prevenciji bolesti ili da utiču na strukturu i funkcionisanje tela.
Biološko opterećenje (bioburden)
Nivo i tip (npr. objektivnih ili ne) mikroorganizama koji mogu da budu prisutni u sirovinama, polaznim materijalima aktivnih supstanci, međuproizvodima ili aktivnim supstancama. Biološko opterećenje se ne smatra kontaminacijom osim ako nivoi nisu prekoračeni ili ako su utvrđeni objektivno prisutni organizmi.
Broj serije (ili broj lota)
Jedinstvena kombinacija brojeva, slova, i/ili simbola koja identifikuje seriju (ili lot) i na osnovu koje može da se odrediti istorija proizvodnje i distribucije.
Validacija
Dokumentovan postupak koji daje visok stepen sigurnosti da će određeni proces, metoda ili sistem konzistentno davati rezultat koji je u skladu sa prethodno utvrđenim kriterijumima prihvatljivosti.
Validacioni protokol
Pisani plan u kome se navodi kako će se sprovesti validacija i u kome su definisani kriterijumi prihvatljivosti. Na primer, validacioni protokol za proces proizvodnje identifikuje procesnu opremu, kritične parametre procesa/operacione opsege, karakteristike proizvoda, uzorkovanje, podatke koje je potrebno dobiti testiranjem, broj validacionih serija i prihvatljive rezultate testova.
Datum ponovnog testiranja
Datum kada je potrebno ponovo ispitati materijal kako bi se proverilo da je još uvek pogodan za upotrebu.
Dorada
Podvrgavanje međuproizvoda ili aktivnog farmaceutskog sastojka (API), koji ne zadovoljava standarde ili specifikacije, jednom ili više procesnih koraka koji se razlikuju od uspostavljenog proizvodnog procesa, kako bi se postigao prihvatljiv kvalitet međuproizvoda ili aktivnog farmaceutskog sastojka (npr. rekristalizacija sa drugim rastvaračem).
Kalibracija
Potvrđivanje da određeni instrument ili sredstvo daje rezultate koji su u okviru utvrđenih limita, poređenjem sa vrednostima koje daje referentni ili sledljivi standard u toku odgovarajućeg opsega merenja.
Karantin
Status materijala koji je izolovan fizički ili na neki drugi efikasan način u očekivanju odluke o odobravanju ili odbijanju.
Kvalifikacija
Dokumentovan postupak kojim se dokazuje da sva oprema i sistemi funkcionišu ispravno i dosledno daju očekivane rezultate. Kvalifikacija je deo validacije, ali pojedinačni koraci kvalifikacije sami ne čine proces validacije.
Kompjuterski sistem
Grupa komponenti hardvera i pratećeg softvera, projektovana i sklopljena tako da može da obavi posebnu funkciju ili niz funkcija.
Kompjuterizovani sistem
Proces ili operacija integrisani sa kompjuterskim sistemom.
Kontaminacija
Neželjeni unos nečistoće hemijske ili mikrobiološke prirode, ili strane materije, u ili na sirovinu, međuproizvod ili aktivnu supstancu u toku proizvodnje, uzorkovanja, pakovanja ili prepakiranja, skladištenja ili transporta.
Kontrola kvaliteta (QC)
Proveravanje ili testiranje ispunjenja zahteva iz specifikacija.
Kriterijumi prihvatljivosti
Numerički limiti, raspon vrednosti, ili druge odgovarajuće mere za prihvatanje rezultata ispitivanja.
Kritično
Opis procesnog koraka, uslova procesa, zahteva za testiranje ili drugih odgovarajućih parametara koje treba kontrolisati u okviru unapred utvrđenih kriterijuma kako bi se obezbedilo da aktivni farmaceutski sastojak bude u skladu sa specifikacijom.
Lek
Farmaceutski oblik u finalnom unutrašnjem pakovanju namenjen za puštanje u promet (referenca Q1A)
Lekovita supstanca
Videti pod aktivni farmaceutski sastojak
Materijal
Opšti izraz koji se koristi za sirovine (polazne materijale, reagense, rastvarače), pomoćne materijale, međuproizvode, aktivne farmaceutske sastojke i materijale za pakovanje i obeležavanje.
Materijal za pakovanje
Bilo koji materijal čija je namena da zaštiti međuproizvod ili aktivni farmaceutski sastojak u toku skladištenja i transporta.
Matični rastvor
Rezidualna tečnost koja zaostaje nakon procesa kristalizacije ili izolovanja. Matična tečnost može da sadrži neizreagovale materijale, međuproizvode, nivoe aktivnih farmaceutskih sastojaka i/ili nečistoće. Može da se koristi za dalje procesiranje.
Međuproizvod
Materijal proizveden u toku faza proizvodnje aktivnog farmaceutskog sastojka, a koji pre nego što postane aktivni farmaceutski sastojak (API) mora da se podvrgne daljoj molekulskoj izmeni ili prečišćavanju. Međuproizvodi mogu ili ne moraju da se izoluju.
(Napomena: ove smernice odnose se samo na one međuproizvode proizvedene nakon tačke koju je proizvođač odredio kao početak proizvodnje aktivnog farmaceutskog sastojka).
Nečistoća
Bilo koja neželjena komponenta prisutna u međuproizvodu ili aktivnoj farmaceutskoj supstanci.
Obezbeđenje kvaliteta (QA)
Sveukupne organizacione aktivnosti u cilju da se obezbedi da svi aktivni farmaceutski sastojci zahtevanog kvaliteta propisanog za njihovu namenu i da se sistemi kvaliteta održavaju.
Odstupanje
Nepoštovanje odobrenog uputstva ili ustanovljenog standarda.
Očekivani prinos
Količina materijala ili procenat teorijskog prinosa, očekivanog za bilo koju odgovarajuću fazu proizvodnje, a zasnovano na prethodno dobijenim podacima na laboratorijskom, pilot ili nivou proizvodnje.
Polazni materijal za proizvodnju aktivnog farmaceutskog sastojka (API)
Sirovine, međuproizvod ili aktivni farmaceutski sastojak (API) koji se koriste u proizvodnji aktivnog farmaceutskog sastojka i koji je ugrađen kao značajan deo u strukturi aktivnog farmaceutskog sastojka. Polazni materijal za proizvodnju aktivnog farmaceutskog sastojka može biti komercijalni proizvod, materijal nabavljen od jednog ili više dobavljača na osnovu ugovora ili komercijalnog sporazuma, ili interno proizveden. Polazni materijali za proizvodnju aktivnog farmaceutskog sastojka obično imaju utvrđene hemijske osobine i strukturu.
Rok trajanja
Datum koji se navodi na ambalaži/etiketi aktivnog farmaceutskog sastojka i koji označava vreme u toku koga se očekuje da aktivni sastojak ostane u okviru utvrđenih specifikacija u toku roka trajanja ako se čuva u skladu sa utvrđenim uslovima i nakon koga proizvod ne treba da se upotrebljava.
Pomoćni materijali
Materijali, isključujući rastvarače, koji se koriste kao pomoćni u proizvodnji međuproizvoda ili aktivnog farmaceutskog sastojka, a koji sami ne učestvuju u hemijskoj ili biološkoj reakciji (npr. filter, aktivni ugalj i dr.).
Potpisano (potpis)
Zapis lica koje je obavilo određenu operaciju ili pregled. Ovaj zapis može da bude u formi inicijala, punog svojeručnog potpisa, lični pečat, ili autentičan i bezbedan elektronski potpis.
Primarni referentni standard
Supstanca za koju je opsežnim analitičkim testiranjem dokazano da je autentičan materijal koji treba da je visokog nivoa čistoće. Ovaj standard može biti: (1) dobijen iz zvanično priznatog izvora, ili (2) dobijen nezavisnom sintezom, ili (3) dobijen iz postojećeg proizvodnog materijala visoke čistoće, ili (4) dobijen daljim prečišćavanjem postojećeg proizvodnog materijala.
Proizvodnja
Sve operacije koje obuhvataju prijem materijala, proces proizvodnje, pakovanje, prepakivanje, obeležavanje, ponovno obeležavanje, kontrolu kvaliteta, puštanje u promet, skladištenje i distribuciju aktivnih farmaceutskih sastojaka i odgovarajuće kontrole.
Profil nečistoća
Opis identifikovanih i neidentifikovanih nečistoća prisutnih u aktivnom farmaceutskom sastojku.
Procedura
Dokumentovan opis operacija koje treba da se sprovedu, mera predostrožnosti i drugih mera koje treba da se preduzmu direktno ili indirektno a u vezi sa proizvodnjom međuproizvoda ili aktivnog farmaceutskog sastojka.
Procesna kontrola (in-procesna kontrola)
Provere koje se sprovode u toku procesa proizvodnje kako bi se pratio i ako je potrebno prilagodio proces i/ili da bi se obezbedila usaglašenost međuproizvoda ili aktivnog farmaceutskog sastojka sa njihovim specifikacijama.
Proces proizvodnje
Sve operacije za izradu aktivnog farmaceutskog sastojka od prijema materijala preko procesiranja i pakovanja aktivnog farmaceutskog sastojka.
Rastvarač
Neorganska ili organska tečnost koja se koristi za pripremu rastvora ili suspenzija u proizvodnji međuproizvoda ili aktivnog farmaceutskog sastojka.
Reprocesiranje
Uvođenje međuproizvoda ili aktivnog farmaceutskog sastojka, uključujući i one koji nisu u skladu sa standardima ili specifikacijama, ponovo u proces i ponavljanje kristalizacije ili druge odgovarajuće hemijske ili fizičke operacije (npr. destilacija, filtracija, hromatografija, mlevenje), a koje su deo uspostavljenog proizvodnog procesa. Nastavak procesnih koraka, nakon procesne kontrole kojom je pokazano da proces nije završen, smatra se delom normalnog procesa, a ne reprocesiranjem.
Serija (ili lot)
Određena količina materijala proizvedena u procesu ili serijama procesa od koje se očekuje da je homogena u okviru određenih limita. U slučaju kontinuirane proizvodnje serija može da odgovara definisanoj frakciji proizvodnje. Veličina serije može da se utvrditi ili kao fiksna količina ili kao količina proizvedena u određenom vremenskom intervalu.
Sekundarni referentni standard
Supstanca ustanovljenog kvaliteta i čistoće, kao što je pokazano poređenjem sa primarnim referentnim standardom, a koja se koristi kao referentni standard za rutinske laboratorijske analize.
Sirovina
Opšti termin koji se koristi za polazne materijale, reagense i rastvarače namenjene za upotrebu u proizvodnji međuproizvoda ili aktivnih farmaceutskih sastojaka.
Služba(e) kvaliteta
Organizaciona jedinica nezavisna od proizvodnje koja ima odgovornost i za obezbeđenje kvaliteta i za kontrolu kvaliteta. Ova služba može da ima odvojene QA i QC jedinice ili jednu jedinstvenu grupu, u zavisnosti od veličine i strukture organizacije.
Specifikacija
Lista testova, referenci, odnosno upućivanja na analitičke procedure, sa odgovarajućim kriterijumima prihvatljivosti u formi numeričkih vrednosti, raspona vrednosti ili drugih kriterijuma za opisane testove. Ona uspostavlja set kriterijuma sa kojima materijal treba da bude usklađen kako bi se smatrao prihvatljivim za svoju namenu. "Usaglašen sa specifikacijom" znači da je materijal nakon testiranja prema navedenim analitičkim procedurama zadovoljio navedene kriterijume prihvatljivosti.
Teorijski prinos
Količina koja bi trebala da se proizvede u odgovarajućoj fazi proizvodnje, a na osnovu količine materijala koji će se iskoristiti, bez gubitaka ili grešaka u toku same proizvodnje.
Ugovorni proizvođač
Proizvođač koji obavlja neki deo proizvodnje za potrebe originalnog proizvođača.
Unakrsna kontaminacija
Kontaminacija materijala ili proizvoda drugim materijalom ili proizvod
DOKUMENTACIJA KOJA PODRŽAVA DOBRU PROIZVOĐAČKU PRAKSU
UPUTSTVO PROIZVOĐAČIMA LEKOVA ZA PRIPREMU DOKUMENTA - GLAVNA DOKUMENTACIJA MESTA PROIZVODNJE (SITE MASTER FILE)
1.1 Glavnu dokumentaciju mesta proizvodnje (Site Master File), priprema proizvođač i ona treba da sadrži specifične informacije o politici i aktivnostima Upravljanja kvalitetom na mestu proizvodnje, operacijama proizvodnje i/ili kontrole kvaliteta lekova koje se obavljaju na navedenom mestu proizvodnje, kao i sa njima povezanih operacija koje se obavljaju u susednim objektima. U slučaju kada se na navedenom mestu proizvodnje obavlja samo deo proizvodnje, na primer kontrola kvaliteta, pakovanje, i dr. u dokumentu Glavna dokumentacija mesta proizvodnje (Site Master File) treba opisati samo te operacije.
1.2. Glavna dokumentacija mesta proizvodnje (Site Master File), koja se podnosi nadležnom organu treba da pruži tačne i jasne informacije o svim aktivnostima proizvođača koje su u vezi sa Dobrom proizvođačkom praksom, a koje mogu da budu korisne za efikasnije planiranje i sprovođenje inspekcije u cilju utvrđivanja i kontrole usaglašenosti proizvodnje lekova sa Smernicama dobre proizvođačke prakse (GMP) od strane nadležnih inspektora.
1.3. Glavna dokumentacija mesta proizvodnje (Site Master File), treba da bude sažet dokument i, ukoliko je moguće, ne duži od oko 25-30 strana A4 formata. Osim toga, ovaj dokument treba da sadrži i potrebne dodatke (Priloge). Kad god je moguće, umesto tekstualnog dela treba koristiti crteže ili šematske prikaze. Veličinu takvih šematskih prikaza treba prilagoditi A4 formatu.
1.4 Glavna dokumentacija mesta proizvodnje (Site Master File), treba da bude deo dokumentacije Sistema upravljanja kvalitetom proizvođača lekova i da se redovno ažurira. Glavna dokumentacija mesta proizvodnje (Site Master File) treba da sadrži broj izdanja, datum stupanja na snagu i datum do kada važi, odnosno kada je planirana revizija. Ovaj dokument treba redovno da se pregleda kako bi se obezbedilo da je ažuran i da predstavlja sve aktivnosti koje se obavljaju na tom mestu proizvodnje. Svaki dodatak (Prilog) može da ima sopstveni datum stupanja na snagu, čime se obezbeđuje mogućnost ažuriranja samo tog dela dokumenta.
Ovo Uputstvo ima za cilj da proizvođačima lekova da smernice za izradu Glavne dokumentacije mesta proizvodnje (Site Master File) koja je neophodna nadležnim inspektorima za pripremu plana i sprovođenje inspekcije u cilju utvrđivanja i kontrole usaglašenosti proizvodnje lekova sa Smernicama Dobre proizvođačke prakse (GMP).
Ovo Uputstvo se odnosi na pripremu i sadržaj dokumenta Glavna dokumentacija mesta proizvodnje (Site Master File). Proizvođači treba da poštuju zahteve nacionalne regulative u pogledu potrebe pripreme dokumenta Glavna dokumentacija mesta proizvodnje (Site Master File).
Ovo Uputstvo se odnosi na sve vrste postupaka proizvodnje, odnosno operacija kao što su proces proizvodnje, pakovanje i obeležavanje, kontrola kvaliteta, odnosno testiranje, postupak primarnog pakovanja, sekundarnog pakovanja i ponovnog obeležavanja svih vrsta lekova. Ovo uputstvo može da se koristi i za pripremu Glavne dokumentacije mesta proizvodnje (Site Master File) ili ekvivalentnog dokumenta Ustanova ovlašćenih za prikupljanje krvi/tkiva, kao i proizvođača aktivnih supstanci koje se upotrebljavaju za proizvodnju lekova (API).
4. Sadržaj dokumenta glavna dokumentacija mesta proizvodnje (site master file)
Za formu koja se koristi videti aneks u prilogu.
SADRŽAJ GLAVNE DOKUMENTACIJE MESTA PROIZVODNJE
(SITE MASTER FILE)
1. Osnovne informacije o proizvođaču
1.1 Kontakt podaci/informacije
- Poslovno ime i adresa sedišta proizvođača;
- Naziv i puna adresa mesta proizvodnje, za sve objekte/zgrade i proizvodne jedinice koje pripadaju navedenom mestu proizvodnje;
- Kontakt podaci proizvođača, uključujući broj telefona osobe za 24-časovni kontakt u slučaju potrebe za povlačenjem leka iz prometa;
- Položaj mesta proizvodnje, npr. GPS podaci, ili bilo koji drugi sistem određivanja geografskog položaja (poštanska adresa i broj).
1.2 Aktivnosti za koje je izdata dozvola za proizvodnju za navedeno mesto proizvodnje
- Kopija važeće dozvole za proizvodnju, izdate od strane nadležnog organa, prilaže se kao Prilog broj 1. U slučaju kada nadležni organ, u skladu sa zakonom, ne izdaje dozvolu za proizvodnju za aktivnosti koje se obavljaju na tom mestu proizvodnje, to se navodi u ovoj tački;
- Sažet opis postupka proizvodnje, uvoz, izvoz, distribucija i druge aktivnosti na koje se odnosi dozvola za proizvodnju izdata od strane nadležnog organa, uključujući i ugovornu proizvodnju određenih farmaceutskih oblika, odnosno druge aktivnosti koje se obavljaju na navedenom mestu proizvodnje a koje nisu navedene u dozvoli za proizvodnju lekova;
- Vrsta lekova koji se, u vreme pripreme Glavne dokumentacije mesta proizvodnje (Site Master File), proizvode na navedenom mestu proizvodnje (spisak priložiti kao Prilog br. 2);
- Spisak svih izvršenih inspekcija u cilju utvrđivanja i kontrole usaglašenosti proizvodnje lekova sa Smernicama dobre proizvođačke prakse (GMP) u prethodnih pet godina, sa datumima i nazivom nadležnih organa koji su izvršili inspekciju. Ako je izdat, kopija svakog važećeg sertifikata dobre proizvođačke prakse (GMP sertifikat) prilaže se kao Prilog broj 3.
1.3 Ostale proizvodne aktivnosti koje se obavljaju na navedenom mestu proizvodnje
- Ako je primenljivo, navesti opis drugih proizvodnih aktivnosti koje nisu vezane za proizvodnju lekova za humanu upotrebu.
2. Sistem upravljanja kvalitetom proizvođača
2.1 Sistem upravljanja kvalitetom proizvođača
- Sažet opis Sistema upravljanja kvalitetom proizvođača sa navođenjem standarda koji se primenjuju;
- Odgovornosti u pogledu održavanja Sistema upravljanja kvalitetom, uključujući najviše rukovodstvo;
- Podaci o aktivnostima za koje je mesto proizvodnje akreditovano, odnosno sertifikovano, uključujući datum i obim akreditacije kao i naziv akreditacionog/sertifikacionog tela.
2.2 Procedura puštanja serije leka u promet
- Detaljan opis kvalifikacija (detalji u pogledu stručne spreme i iskustva) za sva Kvalifikovana lica odgovorna za puštanje serije leka u promet (QP);
- Sažet opis procedure puštanja serije leka u promet, koja se primenjuje na tom mestu proizvodnje;
- Uloga Kvalifikovanog lica odgovornog za puštanje serije leka u promet (QP) u pogledu određivanja statusa karantina, odobravanju za upotrebu i puštanje serije leka u promet, kao i proceni usaglašenosti sa dozvolom za stavljanje leka u promet;
- U slučaju kada je zvanično imenovano više Kvalifikovanih lica;
- odgovornih za puštanje serije leka u promet (QP), navesti njihov međusobni odnos povezanosti;
- Izjava o primeni kontrolne strategije koja podrazumeva Procesnu analitičku tehnologiju (PAT) i/ili Parametarsko puštanje serije leka u promet.
2.3 Upravljanje dobavljačima i poverenim aktivnostima
- Kratak sažetak uspostavljenog lanca nabavke materijala i usluga, kao i programa eksterne provere (audit) dobavljača;
- Sažet opis procedure kvalifikacije primaoca ugovora za poverene aktivnosti, dobavljača, odnosno proizvođača aktivnih supstanci (API) i drugog kritičnog materijala;
- Mere koje se preduzimaju u cilju obezbeđenja da su proizvedeni lekovi u skladu sa smernicama za transmisivnu spongiformnu encefalopatiju (TSE);
- Mere koje se preduzimaju u slučaju sumnje ili pojave falsifikovanih lekova, proizvoda u bulk-u (npr. neupakovane tablete), aktivnih ili pomoćnih supstanci (ekscipijenasa);
- Podatak o angažovanju spoljnjih naučnih, analitičkih ili drugih primaoca ugovora u vezi sa proizvodnjom i kontrolom kvaliteta;
- Kao Prilog broj 4 prilaže se spisak svih ugovornih mesta proizvodnje i kontrole kvaliteta (ugovornih laboratorija) sa adresama i kontakt podacima, kao i šematski prikaz lanca povezanosti sa poverenim aktivnostima proizvodnje i kontrole kvaliteta, npr. sterilizacija primarnog pakovnog materijala za aseptične procese, kontrola kvaliteta, odnosno testiranje polaznog materijala itd.;
- Sažet prikaz odgovornosti svake ugovorne strane, odnosno primaoca i davaoca ugovora za poverene aktivnosti, u pogledu obezbeđenja usaglašenosti sa dozvolom za stavljanje leka u promet (u slučajevima koji nisu obuhvaćeni tačkom 2.2).
2.4 Upravljanje rizikom kvaliteta (QRM)
- Kratak opis metodologije Upravljanja rizikom kvaliteta koji primenjuje proizvođač;
- Obim i fokus Upravljanja rizikom kvaliteta, uključujući kratak opis svih aktivnosti koje se obavljaju na korporativnom i lokalnom nivou. Treba da se navede primena Upravljanja rizikom kvaliteta u cilju obezbeđenja kontinuiranog snabdevanja.
2.5 Pregled kvaliteta proizvoda
- Sažet opis i metodologija koja se koristi za izradu Pregleda kvaliteta proizvoda.
- Organizaciona šema koja prikazuje odnos međusobne povezanosti rukovodećih pozicija, odnosno osoba odgovornih za upravljanje kvalitetom, proces proizvodnje i kontrolu kvaliteta, uključujući više rukovodstvo i Kvalifikovano lice odgovorno za puštanje serije leka u promet (QP);
- Podatak o ukupnom broju zaposlenih, kao i pojedinačno broj zaposlenih u upravljanju kvalitetom, proizvodnji, kontroli kvaliteta, skladištenju i distribuciji.
4.1 Prostorije
- Kratak opis fabrike, odnosno mesta proizvodnje, ukupna površina mesta proizvodnje i spisak svih zgrada/objekata na mestu proizvodnje. U slučaju kada se proizvodnja za razna tržišta (lokalno, tržište EU itd.) obavlja u različitim zgradama na istom mestu proizvodnje, pored svakog objekta u spisku, potrebno je da se navede i podatak o tržištu za koje se proizvode lekovi (ako nije navedeno u tački 1.1);
- Jednostavan plan ili opis prostorija za proizvodnju uz navođenje razmere (nisu potrebni arhitektonski ili tehnički crteži);
- Tlocrti (lay-out) i dijagrami toka kretanja u proizvodnim prostorijama (kao Prilog broj 6), sa prikazom klasa čistoće prostorija/prostora i razlike pritisaka između susednih prostorija/prostora, sa navođenjem proizvodnih operacija koje se u njima vrše (npr. mešanje, punjenje, skladištenje, pakovanje itd.);
- Tlocrti (lay-out) magacina i skladišnih prostora i, kada je primenljivo, sa označenim prostorima za skladištenje i rukovanje toksičnim, opasnim i senzibilizirajućim materijalom;
- Kada je primenljivo, a nije navedeno u tlocrtima (lay-out), daje se sažet opis posebnih uslova skladištenja.
4.1.1 Sažet opis sistema za grejanje, ventilaciju i hlađenje vazduha (HVAC)
- Principi za određivanje dovoda vazduha, temperature, vlage, razlike pritisaka i brzine izmene vazduha, sistem sa ili bez recirkulacije vazduha (%).
4.1.2 Sažet opis sistema za vodu
- kvalitet vode koja se proizvodi;
- šematski prikaz/crtež dati kao Prilog broj 7.
4.1.3 Kratak opis ostalih relevantnih pomoćnih sistema, kao što su npr. sistemi za paru, komprimovani vazduh, azot itd.
4.2 Oprema
4.2.1 Kao Prilog broj 8 prilaže se spisak glavne opreme za proizvodnju i kontrolu kvaliteta sa navedenim kritičnim delovima opreme.
4.2.2 Čišćenje i sanitizacija
- Sažet opis metoda čišćenja i sanitizacije kontaktnih delova opreme (npr. ručno čišćenje, automatizovani sistem čišćenja na mestu "clean-in-place" i sl.).
4.2.3 Kompjuterizovani sistemi kritični za Dobru proizvođačku praksu
- Opis kompjuterizovanih sistema kritičnih za Dobru proizvođačku praksu, osim Programskih logičkih kontrolera (PLC).
- Opis sistema dokumentacije (npr. u elektronskom obliku i/ili papirnom obliku);
- U slučaju kada se dokumentacija i zapisi ne čuvaju/arhiviraju na navedenom mestu proizvodnje (uključujući i podatke o farmakovigilanci, kada je primenljivo): spisak svih vrsta dokumentacije/zapisa, naziv i adresa mesta čuvanja i/ili arhive dokumentacije kao i prosečno vreme potrebno za povlačenje dokumentacije iz arhive.
6.1 Vrste proizvoda
(može da se upućuje na Prilog broj 1 i Prilog broj 2)
- Vrste lekova koje se proizvode uključujući;
- spisak farmaceutskih oblika lekova za humanu upotrebu i veterinarskih lekova koji se proizvode na navedenom mestu proizvodnje;
- spisak farmaceutskih oblika lekova namenjenih za kliničko ispitivanje (IMP) koji se proizvode na navedenom mestu proizvodnje i, kada se razlikuju od farmaceutskih oblika za komercijalnu proizvodnju, podatak o prostoru u kome se proizvode i zaposlenima;
- Toksične ili opasne supstance kojima se rukuje (npr. sa jakim farmakološkim dejstvom i/ili senzibilizirajućim svojstvima);
- Vrste lekova koji se proizvode u namenskim pogonima ili po principu proizvodnje u kampanjama, kada je primenljivo;
- Primena Procesne analitičke tehnologije (PAT), ako je primenljivo, uopštena izjava o relevantnoj tehnologiji i pripadajućim kompjuterizovanim sistemima.
6.2 Validacija procesa
- Kratak opis i opšta politika validacije procesa;
- Politika u vezi prerade i dorade serije leka.
6.3 Uravljanje materijalima i skladištenje
- Rukovanje polaznim materijalima, materijalima za pakovanje, poluproizvodima (proizvodima u bulk-u) i gotovim proizvodima, uključujući uzorkovanje, karantin, odobravanje za upotrebu i skladištenje;
- Rukovanje neusaglašenim materijalima i proizvodima.
- Opis aktivnosti Kontrole kvaliteta koje se vrše na navedenom mestu proizvodnje, u pogledu fizičkih, hemijskih, mikrobioloških i bioloških ispitivanja, odnosno testiranja.
8. Distribucija, reklamacije, defekti kvaliteta lekova i povlačenje iz prometa
8.1 Distribucija (deo za koji je odgovoran proizvođač lekova)
- Kupci (veleprodaje, proizvođači i dr.) i tržišta (lokalno, regionalno, EU/EEA itd.) kojima se proizvodi isporučuju sa navedenog mesta proizvodnje;
- Opis sistema koji se primenjuje za verifikaciju da je svaki kupac/primalac isporuke poseduje dozvolu, u skladu sa zakonom, za nabavku lekova od proizvođača;
- Sažet opis sistema kojim se obezbeđuju odgovarajući uslovi tokom transporta, npr. kontrola i monitoring temperature;
- Način distribucije lekova i metode za održavanje sledljivosti serije leka od proizvođača do kupca;
- Mere koje se preduzimaju za sprečavanje "ulaska" proizvedenih lekova u nelegalan lanac snabdevanja.
8.2 Reklamacije, defekti kvaliteta lekova i povlačenje leka iz prometa
- Sažet opis sistema za postupanje u slučaju reklamacija, defekta kvaliteta lekova i povlačenja leka iz prometa.
- Sažet opis programa internih provera sa navedenim kriterijumom za odabir oblasti tokom planirane interne provere, kao i aktivnosti koje se sprovode nakon izvršene interne provere.
Prilog broj 1 Kopija važeće dozvole za proizvodnju
Prilog broj 2 Spisak svih lekova i farmaceutskih oblika koji se proizvode uključujući INN ili uobičajeno ime (ako je primenljivo) aktivnih supstanci (API) koje se upotrebljavaju
Prilog broj 3 Kopija važećeg sertifikata dobre proizvođačke prakse (GMP sertifikat)
Prilog broj 4 Spisak ugovornih proizvođača i laboratorija sa adresama i kontakt podacima, kao i šematski prikaz lanca povezanosti sa poverenim aktivnostima
Prilog broj 5 Organizaciona šema
Prilog broj 6 Tlocrti (lay-out) proizvodnih prostorija, uključujući tokove kretanja materijala, zaposlenih i proizvoda, šematski prikaz procesa proizvodnje za svaku vrstu proizvoda (farmaceutski oblik)
Prilog broj 7 Šematski prikaz/crtež sistema za vodu
Prilog broj 8 Spisak glavne proizvodne i laboratorijske opreme
SMERNICA ZA POSTAVLJANJE ZDRAVSTVENO BEZBEDNIH LIMITA PRILIKOM IDENTIFIKACIJE RIZIKA U PROIZVODNJI RAZLIČITIH LEKOVA U ZAJEDNIČKIM PROIZVODNIM POGONIMA
Sažet pregled
Kada se različiti lekovi proizvode u zajedničkim pogonima, postoji bojazan od potencijalne unakrsne kontaminacije. Lekovi su korisni za pacijente ili životinje za koje su namenjeni; međutim, ukoliko se kontaminiraju mogu da predstavljaju rizik za pacijente ili životinje. Iz tog razloga, u vezi sa prisustvom kontaminanata, treba da se postupa u skladu sa rizikom koji oni predstavljaju, što je s druge strane povezano sa nivoima koji se mogu smatrati bezbednim za celu populaciju. U cilju identifikovanja rizika potrebno je da se iz zdravstveno bezbednih limita izvedu bezbedne granične vrednosti. Izvođenje takve granične vrednosti (npr. Dozvoljena/Prihvatljiva dnevna izloženost (PDE) ili Granična vrednost za toksikološku zabrinutost (TTC)) treba da bude rezultat strukturirane naučne procene svih dostupnih farmakoloških i toksikoloških podataka, kako kliničkih tako i nekliničkih. Ako se opravda na odgovarajući način, za određivanje bezbednih graničnih nivoa prihvatljivo je odstupanje od glavnog pristupa navedenog u ovoj smernici.
Tokom proizvodnje lekova slučajna unakrsna kontaminacija može da bude rezultat nekontrolisanog ispuštanja prašine, gasova, isparenja, aerosola, genetskog materijala ili organizama od aktivnih supstanci, drugih polaznih materijala i drugih proizvoda koji se istovremeno izrađuju, kao i ostataka na opremi, ili sa odeće radnika. U vezi sa navedenim rizikom za određene grupe lekova, uključujući "određene antibiotike, određene hormone, određene citotoksične i određene visoko aktivne lekove", ranije se postavljao zahtev da se oni proizvode u namenskim, ili odvojenim objektima, odnosno pogonima. Do sada nisu bile dostupne zvanične smernice za pružanje pomoći proizvođačima kako bi napravili razliku između pojedinih proizvoda u okviru ovih specifičnih grupa. Poglavlja 3 i 5 Smernica dobre proizvođačke prakse (GMP) su revidirana kako bi se unapredio naučni i na riziku zasnovan pristup koji se odnosi na "toksikološku procenu" za uspostavljanje graničnih vrednosti za identifikaciju rizika.
Čišćenje je mera za smanjenje rizika i limiti prenošenja za studije validacije čišćenja se u velikoj meri koriste u farmaceutskoj industriji. Postoji niz pristupa koji se koriste za uspostavljanje ovih limita koji često ne uzimaju u obzir dostupne farmakološke i toksikološke podatke. Zbog toga je neophodan naučni pristup, koji se primenjuje od slučaja do slučaja, radi identifikacije rizika i podrške merama smanjenja rizika za sve vrste farmaceutskih supstanci.
Cilj ove smernice je da se preporuči pristup za pregled i procenu farmakoloških i toksikoloških podataka pojedinačnih aktivnih supstanci i tako obezbedi određivanje graničnih vrednosti kako je navedeno u Smernicama dobre proizvođačke prakse (GMP). Ove vrednosti mogu da se koriste kao alat za identifikaciju rizika, a mogu da se koriste i za opravdavanje limita za prenošenje koji se koriste u validaciji čišćenja. Kako se aktivni farmaceutski sastojci (API) ne pominju u Poglavljima 3 i 5 Smernica dobre Proizvođačke prakse, opšti principi dati u ovoj smernici mogu da se koriste kada je potrebno određivanje graničnih vrednosti za identifikaciju rizika.
Odstupanje od glavnog pristupa istaknutog u ovoj smernici za određivanje bezbednih graničnih nivoa može da se prihvati ukoliko je adekvatno opravdano.
Cilj ove smernice je da osigura bezbednost pacijenata i životinja izloženih rezidualnim aktivnim supstancama prisutnim u lekovima, kao i potrošača koji potencijalno mogu da budu izloženi rezidualnim aktivnim supstancama prisutnim u hrani životinjskog porekla koje su rezultat lečenja životinja, koje se gaje za proizvodnju hrane, pomoću veterinarskih lekova u kojima se nalaze ostaci aktivnih supstanci. Radi toga, cilj ovog dokumenta je da preporuči pristup za određivanje naučno zasnovane granične vrednosti za pojedinačne aktivne supstance koje će se primenjivati za identifikaciju rizika. Smernica definiše na koji način podaci, na osnovu kojih se granična vrednost određuje, mogu da budu predstavljeni kako bi se postigao jasan i harmoničan pristup u celoj farmaceutskoj industriji.
Ovu smernicu treba čitati zajedno sa:
Smernicama dobre proizvođačke prakse (GMP), Prvi deo, Poglavlje 3 i 5.
Smernicama o nečistoćama: rezidualni rastvarači (CPMP/ICH/283/95 zajedno sa CPMP/ICH/1507/02, CPMP/ICH/1940/00, CPMP/QWP/450/03, EMEA/CVMP/511/03 i CPMP/QWP/8567/99).
VICH GL18(R) Nečistoće: rezidualni rastvarači u novim veterinarskim lekovima, aktivnim supstancama i ekscipijensima (EMA/CVMP/VICH/502/99-Rev.1).
Smernicama za ograničenja genotoksičnih nečistoća (EMEA/CHMP/QWP/251344/2006 i CPMP/SWP/5199/02).
4. Određivanje zdravstveno bezbednih limita
4.1 Izračunavanje Dozvoljene dnevne izloženosti (PDE)
Procedura koje se predlaže u ovom dokumentu za određivanje zdravstveno bezbednih limita za rezudialne aktivne supstance zasnovana je na metodi uspostavljanja takozvane Dozvoljene/Prihvatljive dnevne izloženosti (PDE) kao što je opisano u Dodatku 3 ICH Q3C (R4) "Nečistoće: rezidualni rastvarači" i Dodatku 3 VICH GL 18 o "Rezidualnim rastvaračima u novim veterinarskim lekovima, aktivnim supstancama i ekcipijensima (Revizija)". PDE predstavlja dozu za specifičnu supstancu koja ne dovodi do neželjenih efekata ukoliko je pojedinac izložen toj ili manjoj dozi svakog dana tokom života.
Određivanje PDE podrazumeva (i) identifikaciju opasnosti pregledom svih relevantnih podataka, (ii) identifikaciju "kritičnih efekata", (iii) utvrđivanje NOAEL vrednosti (Najveća doza za koju nisu uočeni neželjeni efekti), za svaki od efekata koji se smatraju kritičnim, i (iv) primenu nekoliko različitih faktora korekcije kako bi se objasnile različite vrste nesigurnosti. Za izračunavanje PDE u dodatku 3 ICH Q3C i VICH GL 18 smernica data je sledeća jednačina:
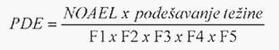
Za postavljanje zdravstveno bezbednih limita koji su prihvatljivi za veterinarske lekove, u principu je moguće koristiti PDE pristup za određivanje različitih limita za različite ciljne životinjske vrste. Međutim, ovo može da bude veoma nepraktično. Kao posledica toga, smatra se da je pragmatično da izvedene PDE vrednosti podrazumevaju izloženost ljudi. Nivo kontaminacije koji može da se prihvati se zatim preračunava iz PDE za ljude, čak i kada je proizvod koji može da bude kontaminiran zapravo veterinarski lek. Smatra se da je ovo pragmatičan pristup i da je u skladu sa pristupom u VICH GL 18, u kome se PDE koriste za izračunavanje limita rezidualnih rastvarača za veterinarske lekove.
Za određivanje limita potrebno je da se uzme u obzir i doza koja se daje, a koja zavisi od telesne težine vrste koja se tretira. Kako bi se ovo olakšalo, PDE treba da se izrazi u mg/kg (tj. korišćenjem brojke 1 za prilagođenu težinu) a ne po osobi.38
Kada je proizvod koji može da bude kontaminiran rezidualnim aktivnim supstancama veterinarski lek za davanje životinjama koje služe za proizvodnju hrane, limit prenošenja koji se koristi mora da uzme u obzir i bezbednost te životinje i bezbednost korisnika. Potrebno je, na osnovu scenarija najgoreg slučaja izloženosti, da se pokaže da ni životinja ni korisnik neće biti izloženi nivoima rezidualnih aktivnih supstanci koji premašuju PDE.
Takođe, mogu da se koriste i alternativni pristupi NOAEL-u kao što je Benchmark doza.
Korišćenje drugih pristupa za određivanje zdravstveno bezbednih limita može se smatrati prihvatljivim ukoliko su adekvatno i naučno opravdani.
______
38 Ako informacije o proizvodu
za sledeći lek koji se proizvodi predstavljaju dnevnu dozu po pacijentu, a
ne mg/kg, standardna telesna težina od 50 kg je ona koju treba koristiti za
lekove za ljude. Za veterinarske lekove doze su generalno izražene kao mg/kg.
U onim slučajevima u kojima ovo nije slučaj, uzima se u obzir standardna telesna
težina od 1 kg, jer ovo predstavlja donju granicu telesne težine kod životinja.
Zahtevi u pogledu podataka za identifikaciju opasnosti
Određivanje opasnosti jeste kvalitativna procena karakterističnog svojstva supstance koja dovodi do neželjenih efekata. Za određivanje opasnosti, treba pretražiti sve dostupne podatke za životinje i ljude u odnosu na svako jedinjenje. Podaci za određivanje opasnosti obuhvataju nekliničke farmakodinamske podatke, studije toksičnosti pri ponovljenoj dozi, studije karcinogenosti, in vitro i in vivo studije genotoksičnosti, studije reproduktivne i razvojne toksičnosti kao i kliničke podatke (terapijske i neželjene efekte). Dostupnost podataka za aktivne supstance varira u zavisnosti od faze razvoja i indikacije. Ukoliko su podaci nekompletni, utvrđene nedostatke treba kritički proceniti uzimajući u obzir uticaj koji ovo može da ima na određivanje pouzdanog zdravstveno bezbednog limita.
Određivanje kritičnih efekata
Kritični efekti podrazumevaju najosetljivije indikatore neželjenih dejstava uočenih u nekliničkim studijama toksičnosti osim ako ne postoje jasni dokazi (npr. iz mehanističkih studija, farmakodinamskih podataka, itd.) da ovakvi nalazi nisu relevantni za ljude ili ciljne životinje. Kritični efekat takođe podrazumeva sve kliničke terapijske i neželjene efekte.
Utvrđivanje NOAELa
Za sve identifikovane kritične efekte, potrebno je utvrditi NOAEL. NOAEL je najveća testirana doza pri kojoj se ne uočavaju "kritični" efekti. Ukoliko se uoči kritični efekat u nekoliko studija na životinjama, za računanje PDE vrednosti treba uzeti NOAEL koji se javlja pri najmanjoj dozi. Ukoliko se ne dobije NOAEL, može da se koristi LOAEL, odnosno Najniži nivo pri kome je uočen neželjeni efekat. NOAEL zasnovan na kliničkim farmakodinamskim efektima treba da odgovara najvećoj testiranoj dozi koja se smatra terapijski neefikasnom.
Primena faktora korekcije
PDE se izračunava deljenjem NOAEL-a za kritični efekat, sa različitim faktorima korekcije (takođe se nazivaju i faktorima bezbednosti, nesigurnosti, procene i modifikacije) da bi se objasnili različiti izvori nesigurnosti i da bi se omogućila ekstrapolacija za pouzdan i robustan nivo bez efekta po ljude ili ciljne životinje. Faktori od F1 do F5 se odnose na sledeće izvore nesigurnosti:
F1: faktor (vrednosti između 2 i 12) za omogućavanje ekstrapolacije između vrsta
F2: faktor od 10 za objašnjenje varijabilnosti između pojedinaca
F3: faktor 10 za objašnjenje studija kratkotrajne toksičnosti ponovljene doze, tj. manje od 4 nedelje
F4: faktor (1-10) koji se može primeniti u slučajevima ozbiljne toksičnosti, npr. negenotoksična karcinogenost, neurotoksičnost ili teratogenost
F5: varijabilni faktor koji se može primeniti ukoliko nije utvrđen nivo bez efekata. Onda kada je dostupan samo LOAEL, u zavisnosti od ozbiljnosti toksičnosti može da se koristi faktor iznad 10.
Korišćenje dodatnih modifikujućih faktora za preostale izvore nesigurnosti, koji nisu pokriveni gore pomenutim faktorima, može biti prihvatljivo ukoliko su poznati u literaturi i ako postoji adekvatna studija koje podržava njihovu upotrebu npr. nedostatak podataka za reproduktivnu i razvojnu toksičnost (videti tačku 5.4.).
Za dodatne smernice o izboru faktora korekcije F1 i F4 videti dodatke 3 smernice ICH Q3C (R4) i VICH GL 18. Upotreba i odabir faktora korekcije mora da se opravda. Ograničenje korišćenja F2 i potencijalno F5 može da bude prihvatljivo kada se PDE određuje na osnovu završnih rezultata ispitivanja kod ljudi. Odstupanja od zadatih vrednosti za faktore korekcije koji su ranije predstavljeni mogu da se prihvate ukoliko su adekvatno i naučno opravdani.
Odabir finalne PDE
Ukoliko je identifikovano nekoliko kritičnih efekata, što za rezultat ima izračunavanje više od jedne PDE vrednosti, odluku o najadekvatnijoj PDE koja će se koristiti za proces validacije čišćenja treba doneti uz adekvatno opravdanje. Po pravilu, podrazumeva se da se koristi najniža PDE vrednost.
4.2 Korišćenje kliničkih podataka
Cilj određivanja zdravstveno bezbednih limita jeste da se osigura bezbednost ljudi, i samim tim smatra se da su kvalitetni klinički podaci za ljude veoma relevantni. Neplanirani farmakodinamski efekti kod pacijenata do kojih dolazi usled kontaminacije aktivnih supstanci može da dovede do opasnosti i prema tome, pri identifikovanju kritičnih efekata treba uzeti u obzir farmakološke podatke. Potrebno je da se razmotri u kom obimu neželjeni efekti leka u kliničkim podacima mogu da se dovedu u vezu sa kontaminiranim aktivnim supstancama.
Ukoliko se najkritičniji efekat koji je identifikovan za određivanje zdravstveno bezbednih limita zasniva na farmakološkim i/ili toksikološkim efektima uočenim kod ljudi a ne kod životinja, korišćenje PDE formule može da bude neadekvatno, dok se procena specifičnih supstanci u kliničkim podacima može koristiti u tu svrhu.
4.3. Ekstrapolacija na druge načine primene
Mada je PDE vrednost dobijena za aktivnu supstancu (kontaminant) generalno zasnovana na studijama za planirani klinički način primene, ona može da se upotrebi i za drugačiji način primene aktivnih supstanci ili lekova proizvedenih u istim, odnosno zajedničkim objektima, odnosno pogonima. Promena načina primene može da izmeni bioraspoloživost; samim tim za ekstrapolaciju treba primenjivati faktore korekcije od jednog na drugi način primene ukoliko postoje jasne razlike (npr. > 40%) u bioraspoloživosti određenih načina primene. Kako bioraspoloživost može da varira između vrsta, za ekstrapolaciju od jednog na drugi način primene treba po mogućstvu da se primene faktori korekcije na podatke dobijene za ljude ili u slučaju veterinarskih lekova, na podatke koji su relevantni za ciljnu životinju.
U slučaju kada nisu dostupni podaci o bioraspoloživosti za ljude ili ciljane životinje, za druge načine primene i kada se očekuje da promena načina primene može da dovede do povećanja sistemske izloženosti kontaminantu (npr. promena oralnog načina primene u inhalacioni), konzervativan način ekstrapolacije može da se izvrši tako što se pretpostavlja 100% bioraspoloživost kontaminanta. Na primer, u slučaju ekstrapolacije oralnog na inhalacioni način primene, PDE dobijen na osnovu podataka za oralni način primene može da se koriguje množenjem sa sledećim korekcionim faktorom:
Korekcioni faktor (oralno na inhalacioni): % oralne apsorpcije/100% respiratorna apsorpcija
U slučaju kada podaci o bioraspoloživosti kod ljudi ili ciljnih životinja nisu dostupni za druge načine primene i kada se može očekivati da će sistemska izloženost kontaminantu biti niža korišćenjem određenog načina primene aktivne supstance/lekova koji su kontaminirani, nema potrebe da se primenjuje faktor korekcije za izračunavanje PDE. Očekuje se da se ekstrapolacija od jednog na drugi način primene izvrši na principu od slučaja do slučaja.
5.1 Aktivne supstance sa genotoksičnim potencijalom
Za genotoksične aktivne supstance za koje ne postoji prepoznatljiv granični nivo, smatra se da svaki nivo izloženosti nosi sa sobom rizik. Međutim, unapred određeni nivo prihvatljivog rizika za genotoksične supstance za koje ne postoji granični nivo, uspostavljen je u EMA Smernicama o granicama za genotoksične nečistoće u formi Graničnog nivoa za toksikološku zabrinutost (TTC) od 1,5 μg/po licu/dnevno. TTC predstavlja stepen izloženosti genotoksičnoj nečistoći koja je povezana sa teorijskim rizikom od nastanka kancera za 1 dodatni kancer na 100 000 pacijenata kada su izloženi tokom celokupnog perioda života. S obzirom na to da će trajanje izloženosti rezidualnim aktivnim supstancama u velikoj meri biti ograničeno (na primer zbog toga što je u praksi očekivano da se stepen prenošenja rezidualnih aktivnih supstanci smanjuje od serije do serije), limiti zasnovani na maksimumu, izloženost od 1,5 μg/po licu/dnevno u ovom slučaju neće premašiti teorijsku vrednost od 1 x 106 rizika od kancera. Prema tome, u slučaju rezidualnih aktivnih supstanci bez određenog graničnog nivoa, može da se primeni granična doza od 1,5 μg/po licu/na dan.
U slučaju kada je veterinarski lek proizvod koji može da bude kontaminiran rezidualnim aktivnim supstancama treba koristiti isti TTC, ali izražen po "kilogramu telesne mase" (tj. TTC je 0,03 μg/kgtm/dnevno). Kada je kontaminirani proizvod namenjen za primenu kod životinja od kojih se proizvodi hrana, limit prenošenja koji se primenjuje mora da uzme u obzir i razmatranje bezbednosti ciljne životinje i razmatranje bezbednosti korisnika hrane. Prema tome, potrebno je, na osnovu najgoreg slučaja izloženosti, pokazati da ni ciljna životinja ni korisnik hrane neće biti izloženi nivoima rezidualnih aktivnih supstanci koji premašuju TTC.
Za genotoksične aktivne supstance za koje postoji dovoljno podataka o karcinogenosti, treba primeniti procenu rizika specifičnu za jedinjenje kako bi se odredio prihvatljiv unos, umesto pristupa prihvatljivog unosa zasnovanog na TTC-u.
Za genotoksične farmaceutske supstance sa dovoljno dokaza o mehanizmu za određivanje graničnog nivoa, nivo bezbedne izloženosti bez znatnih rizika od genotoksičnosti može da se odredi korišćenjem PDE pristupa.
5.2 Aktivne supstance sa visokim potencijalom senzibilizacije
Imunoposredovana hipersenzitivna reakcija izazvana lekovima može da se razvije kod senzibilnih osoba. Posmatrane reakcije mogu imati raspon od blagih slučajeva senzibilizacije kontaktom do potencijalno smrtonosnih anafilaktičkih reakcija.
Kao što je objašnjeno u tački 3.6 Poglavlja 3, Prvi deo Smernica dobre proizvođačke prakse, namenske prostorije su neophodne za proizvodnju aktivnih supstanci i lekova sa visokim potencijalom senzibilizacije kod kojih naučni podaci ne podržavaju prihvatljiv nivo izloženosti ili kod kojih rizik povezan sa rukovanjem proizvodom u pogonu ne može da bude adekvatno kontrolisan organizacionim ili tehničkim merama. Pri klasifikaciji aktivne supstance ili leka sa visokim potencijalom senzibilizacije treba uzeti u obzir to da li supstanca pokazuje veliku učestalost javljanja senzibilizacije kod ljudi; ili verovatnoću javljanja visokog stepena senzibilizacije kod ljudi zasnovanu na podacima za životinje ili drugim validiranim testovima. Ozbiljnost ovih reakcija takođe treba uzeti u obzir i uključiti u procenu težine dokaza.
5.3 Terapijski makromolekuli i peptidi
Terapijski makromolekuli i peptidi su poznati po tome da se razgrađuju i denaturišu kada su izloženi ekstremnim vrednostima pH i/ili toploti, i da mogu postati farmakološki neaktivni. Čišćenje opreme za biofarmaceutsku proizvodnju obično se vrši pod uslovima pri kojima se površine opreme izlažu ekstremnim vrednostima pH i/ili toploti, što dovodi do degradacije i inaktivacije proizvoda na bazi proteina. S obzirom na to, određivanje zdravstveno bezbednih limita korišćenjem PDE limita aktivnog i neizmenjenog proizvoda možda nije neophodno.
Kada postoje drugi potencijalni načini unakrsne konaminacije, rizici treba da se razmatraju od slučaja do slučaja.
5.4 Nedostatak podataka o reproduktivnoj i razvojnoj toksičnosti za životinje
Kako bi se obezbedila zaštita celokupne populacije, prisustvo rezidualnih aktivnih supstanci treba da se svede na nivo koji neće predstavljati rizik za efekte reproduktivnih i razvojnih parametara. Međutim, u ranim fazama razvoja možda još uvek nisu prikupljeni neklinički podaci za procenu potencijala novih aktivnih supstanci koji dovode do reproduktivne i razvojne toksičnosti. Nedostaci naučnog znanja mogu takođe da postoje i za registrovane lekove, npr. potencijal lekova namenjenih muškarcima da dovedu do neželjenih efekata po razvoj embriona-fetusa. U ovim slučajevima, NOAEL iz sub-hroničnih/hroničnih studija može da se koristi za izračunavanje PDE uz primenu dodatnog faktora korekcije (npr. 10) ukoliko je to adekvatno opravdano. U slučajevima kada su dostupni odgovarajući podaci iz studija o reproduktivnoj i razvojnoj toksičnosti povezanih jedinjenja, za određivanje opasnosti netestiranog kontaminanta može da se koristi profil specifičan za klasu kroz primenu datog pristupa.
5.5 Lekovi namenjeni za kliničko ispitivanje
U ranoj fazi razvoja (faza I/II) procena PDE za lekove namenjene za kliničko ispitivanje (IMP) može da bude otežana sudeći po ograničenom obimu njihovih podataka. Gde je to očigledno, alternativni pristup koji koristi kategorizaciju u specifične određene vrednosti kategorija npr. na bazi male/velike očekivane farmakološke jačine, niske/visoke toksičnosti, genotoksičnosti/karcinogenosti, sličan višeslojnom pristupu određivanja graničnog nivoa za toksikološku zabrinutost, predloženog od strane Kroes et al. (2004.), Munro et al. (2008.) i Dolan et al. (2005.)39 može se smatrati da određuje zdravstveno bezbedne limite ukoliko je to adekvatno opravdano. Kako je većina određenih limita definisana za trajanje hroničnog izlaganja, gornja granica može da se opravda ukoliko se za lekovitu supstancu koristi ista/zajednička oprema sa drugom lekovitom supstancom koja je planirana za kratkotrajno kliničko ispitivanje (Bercu i Dolan, 2013.)40 Sa dostupnošću više farmakoloških i toksikoloških podataka, limiti za određena jedinjenja treba da se računaju kao što je ranije opisano za odstupanje od zdravstveno bezbednih limita.
______
39 Kroes R. Renwick A,
Cheeseman M, Kleiner J, Magenlsdorf I, Plersma A, Schilter B, Schatter J, van
Schothorst F, Vos JG, Wurtzen G. (2004.). Strukturno zasnovani pragovi toksikološke
zabrinutosti (TTC): smernica za primenu supstanci prisutnih na niskom nivou
u ishrani. Fd Chern Toxicol 42, 65-83.
Munro IC, Renwick AG, Danielewska-Nikiel B (2008.). Prag toksikološke zabrinutosti
(TTC) u proceni rizika.
Toxicol Lett 180, 156.
Dolan DG, Naumann BD, Sargent EV, Maler A, Dourson M (2005.). Primena praga
koncepta toksikološke zabrinutosti na farmakološke proizvođačke operacije.
Regul Toxicol Pharmacol, 43, 1-9.
40 Bercu JP & Dolan
DG (2013.). Primena praga koncepta toksikološke zabrinutosti kada se primenjuje
na farmakološke proizvođačke operacije namenjene za kratkoročna klinička ispitivanja.
Regul Toxicol Pharmacol, 2013 Feb; 65(1): 162-7.
6. Prijavljivanje strategije za određivanje PDE
Identifikacija "kritičnih efekata" u uspostavljanju PDE kako je navedeno u odeljku 4. treba da bude zasnovana na sveobuhvatnoj literaturi, uključujući priručnike i monografije, kao i pretraživanju elektronskih naučnih baza podataka. Strategija pretraživanja i rezultati pretraživanja moraju da budu jasno dokumentovani. Nakon pregleda od strane eksperta, kompanija treba da razmotri i obrazloži izbor krajnjih rezultata i doza koje će se koristiti u određivanju PDE. Ključne (pivotal) studije za ljude i životinje koje se koriste za određivanje PDE treba da imaju originalne reference i da budu pregledane po pitanju njihovog kvaliteta (dizajn studije, opis nalaza, preciznost izveštaja, itd.). Strategija za određivanje PDE treba da pruži jasno obrazloženje u vezi sa faktorima korekcije koji su primenjivani u određivanju PDE. Štaviše, kako bi se pružio uvid GMP-inspektorima, prva strana svakog pripremljenog dokumenta strategije za određivanje PDE treba da sadrži sažetak procesa procene (pogledati Aneks za primer obrasca).
Ova smernica je sačinjena kao alat za identifikaciju rizika kako bi se olakšala implementacija pristupa zasnovanog na nauci i rizicima za proizvodnju lekova u istim/zajedničkim objektima/pogonima u skladu sa Poglavljem 3 i 5, Prvi deo Smernica dobre proizvođačke prakse.
Skraćenice
F: faktori korekcije
GMP: Dobra proizvođača praksa
ICH: Međunarodne konferencija o harmonizaciji
LOAEL : Najniži nivo pri kome je uočen neželjeni efekat
PDE: Dozvoljena dnevna izloženost (ADE Prihvatljiva dnevna
Izloženost41)
NOAEL: Najveća doza za koju nisu uočeni neželjeni efekti
TTC: Granična vrednost za toksikološku zabrinutost
VICH: Veterinarska međunarodna konferencija o harmonizaciji
_______
41 PDE i ADE su sinonimi.
Aneks
Strategija određivanja PDE
Naziv kompanije |
|
Adresa kompanije |
|
Ime eksperta i potpis |
Datum |
Datum pregleda procene |
|
Hemijski naziv |
|
Identifikovana opasnost |
|
|
Da |
Ne |
Nepoznato |
Genotoksičnost |
o |
o |
o |
Reproduktivna i razvojna toksičnost |
o |
o |
o |
Karcinogenost |
o |
o |
o |
Visok potencijal senzibilizacije |
o |
o |
o |
Osnov za PDE:
Opravdanost za selekciju "vodećeg" kritičnog efekta koji se koristi za krajnje izračunavanje
PDE
NOAEL i primenjeni faktori korekcije na osnovu kojih je PDE određen
Reference:
Publikacija se koristi za identifikovanje kritičnog efekta i doze
Sažetak CV eksperta:
SMERNICE ZA FORMALIZOVANU PROCENU RIZIKA ZA ODREĐIVANJE ODGOVARAJUĆE DOBRE PROIZVOĐAČKE PRAKSE ZA POMOĆNE SUPSTANCE KOJE SE UPOTREBLJAVAJU U PROIZVODNJI LEKOVA ZA HUMANU UPOTREBU (2015/C 95/02)
Uvod
Ove smernice su donete na osnovu odredbe petog stava člana 47. Direktive 2001/83/EC.
U skladu sa tačkom (f) drugog stava člana 46. Direktive 2001/83/EC nosilac dozvole za proizvodnju lekova dužan je da, utvrđivanjem odgovarajuće deobe proizvođačke prakse, obezbedi da pomoćne supstance (ekscipijensi) budu odgovarajuće za upotrebu u proizvodnji lekova. Odgovarajuća dobra proizvođačka praksa za pomoćne supstance za proizvodnju lekova za humanu upotrebu utvrđuje se na osnovu formalizovane procene rizika u skladu sa ovim smernicama. Prilikom procene rizika moraju da se uzmu u obzir i zahtevi drugih odgovarajućih sistema kvaliteta, poreklo i predviđena upotreba pomoćnih supstanci, kao i prethodni slučajevi nedostataka u pogledu kvaliteta. Proizvođač lekova je dužan da obezbedi da se primenjuje utvrđena odgovarajuća dobra proizvođačka praksa. Proizvođač lekova je dužan da dokumentuje preduzete mere.
Procena rizika/procedura upravljanja rizikom za pomoćne supstance treba da bude deo Farmaceutskog sistema kvaliteta proizvođača lekova.
Proizvođači lekova moraju da obezbede da dokumentacija o proceni rizika/upravljanju rizikom za odgovarajuću dobru proizvođačku praksu za pomoćne supstance bude dostupna na uvid nadležnim inspektorima. Kako bi se omogućilo stalno poboljšanje, proizvođač lekova treba da razmenjuje relevantne informacije o proceni rizika sa proizvođačem pomoćne supstance.
PODRUČJE PRIMENE
1.1. Ove smernice se primenjuju za procenu rizika za potrebe utvrđivanja odgovarajuće dobre proizvođačke prakse za pomoćne supstance za proizvodnju lekova za humanu upotrebu. U skladu sa stavom 3b. člana 1. Direktive 2001/83/EC pomoćna supstanca je svaki sastojak leka osim aktivne supstance i materijala za pakovanje.
1.2. Ove smernice se ne odnose na supstance koje se dodaju kao stabilizatori aktivnih supstanci koje same po sebi, bez njihovog dodatka, nisu stabilne.
UTVRĐIVANJE ODGOVARAJUĆE DOBRE PROIZVOĐAČKE PRAKSE NA OSNOVU VRSTE I UPOTREBE POMOĆNE SUPSTANCE
2.1. Smernica ICH Q9, sadrži načela i primere alata za Upravljanje rizikom kvaliteta koji se mogu primeniti na različite aspekte farmaceutskog kvaliteta, uključujući i pomoćne supstance.
2.2. Načela Upravljanja rizikom kvaliteta treba primenjivati za procenu rizika kvaliteta, bezbednosti i funkcije svih pomoćnih supstanci, kao i za klasifikaciju pomoćne supstance, npr. kao niskorizične, srednjerizične ili visokorizične. U tu svrhu je potrebno koristiti alate za Upravljanje rizikom kvaliteta poput onih navedenih u Smernici ICH Q9 (npr. analiza opasnosti i kritične kontrolne tačke - HACCP).
2.3. Za svaku upotrebljenu pomoćnu supstancu svakog proizvođača, proizvođač lekova treba da utvrdi rizike u pogledu kvaliteta, bezbednosti i delovanja svake pomoćne supstance od njenog porekla - bilo životinjskog, mineralnog, biljnog, sintetskog itd. - do njenog ugrađivanja u gotov farmaceutski oblik. Potrebno je da se uzme u obzir najmanje sledeće:
(i) transmisivna spongiformna encefalopatija;
(ii) mogućnost virusne kontaminacije;
(iii) mogućnost mikrobiološke ili kontaminacije endotoksinima/pirogenima;
(iv) uopšteno, moguće prisustvo nečistoća poreklom iz sirovina, npr. aflatoksini ili pesticidi, ili nečistoća koje nastaju tokom procesa i prenose se u proizvod, npr. ostaci rastvarača i katalizatori;
(v) potvrda sterilnosti pomoćnih supstanci za koje je navedeno da su sterilne;
(vi) moguće prisustvo drugih nečistoća prenesenih iz drugih procesa, u nedostatku namenske opreme i/ili pogona;
(vii) kontrolu ambijentalnih i uslova skladištenja/transporta, uključujući i upravljanje hladnim lancem, ako je primenljivo;
(viii) složenost lanca snabdevanja;
(ix) stabilnost pomoćne supstance;
(x) dokaze o integritetu pakovanja.
2.4. Osim toga, u zavisnosti od upotrebe i funkcije svake pomoćne supstance, proizvođač lekova treba da uzme u obzir i sledeće:
(i) farmaceutski oblik i način primene leka koji sadrži pomoćnu supstancu;
(ii) funkciju pomoćne supstance u formulaciji, npr. lubrikans u proizvodu u obliku tablete ili konzervans u tečnom farmaceutskom obliku itd.;
(iii) udeo pomoćne supstance u sastavu leka;
(iv) dnevni unos pomoćne supstance od strane pacijenta;
(v) sve poznate defekte kvaliteta/falsifikovanja pomoćne supstance, kako na globalnom nivou, tako i na lokalnom nivou kompanije;
(vi) složenost sastava pomoćne supstance;
(vii) poznati ili mogući uticaj na kritična svojstva kvaliteta leka;
(viii) druge faktore za koje je utvrđeno ili je poznato da su bitni za obezbeđivanje bezbednosti pacijenata.
2.5. Nakon utvrđivanja i dokumentovanja profila rizika pomoćne supstance, proizvođač lekova treba da utvrdi i dokumentuje elemente iz važeće smernice dobre proizvođačke prakse, za koje smatra da su potrebni za kontrolu i održavanje kvaliteta pomoćne supstance, npr. Aneks 1 ili/i Aneks 2; Drugi deo: Osnovni zahtevi za proizvodnju aktivnih supstanci koje se upotrebljavaju u proizvodnji lekova.
2.6. Ti elementi zavise od porekla, lanca snabdevanja i upotrebe pomoćne supstance, pri čemu proizvođač lekova treba da uzme u obzir visok nivo najmanje sledećih elemenata dobre proizvođačke prakse:
(i) uspostavljanje i sprovođenje efektivnog Farmaceutskog sistema kvaliteta;
(ii) dovoljan broj stručnog osoblja odgovarajućih kvalifikacija;
(iii) jasne opise poslova za rukovodeći kadar i osobe odgovorne za nadzor aktivnosti povezanih sa proizvodnjom i kvalitetom;
(iv) program obuke za celokupno osoblje uključeno u aktivnosti povezane sa proizvodnjom i kvalitetom;
(v) program obuke u vezi sa zdravljem, higijenom i zaštitnom odećom, za koje je utvrđeno da su potrebni za planirane poslove;
(vi) obezbeđivanje i održavanje pogona i opreme koji su odgovarajući za planirane poslove;
(vii) sistem dokumentacije kojim su obuhvaćeni svi procesi i specifikacije za različite aktivnosti povezane sa proizvodnjom i kvalitetom;
(viii) sisteme za kodiranje i identifikaciju sirovina, intermedijera i pomoćnih supstanci kako bi se omogućila potpuna sledljivost;
(ix) program kvalifikacije dobavljača;
(x) sistem za kontrolu kvaliteta pomoćne supstance i osobu odgovornu za puštanje serija u promet, koja nije povezana sa proizvodnjom;
(xi) čuvanje dokumentacije o sirovinama i pomoćnim supstancama, kao i čuvanje uzoraka pomoćnih supstanci tokom perioda koji se zahteva, u skladu sa odredbama važeće smernice dobre proizvođačke prakse, Drugi deo;
(xii) sistem kojim se obezbeđuje da svaka poverena aktivnost bude predmet pisanog ugovora;
(xiii) održavanje efektivnog sistema za postupanje u slučaju reklamacija i eventualno povlačenje iz prometa pomoćnih supstanci;
(xiv) sistem za upravljanje izmenama i odstupanjima;
(xv) program internih provera;
(xvi) kontrolu ambijentalnih uslova i uslova skladištenja.
UTVRĐIVANJE PROFILA RIZIKA PROIZVOĐAČA POMOĆNE SUPSTANCE
3.1. Nakon utvrđivanja odgovarajuće dobre proizvođačke prakse potrebno je izvršiti analizu aktivnosti i sposobnosti proizvođača pomoćne supstance radi utvrđivanja razlika u odnosu na propisanu dobru proizvođačku praksu.
3.2. Podaci/dokazi za potrebe takve analize razlika treba da se dobiju na osnovu provere (audit) ili na osnovu informacija koje je dostavio proizvođač pomoćne supstance.
3.3. Potrebno je uzeti u obzir sertifikate sistema kvaliteta i/ili GMP sertifikate proizvođača pomoćne supstance, kao i standarde u odnosu na koje su ti sertifikati izdati, jer ti sertifikati moraju da budu u skladu sa zahtevima standarda.
3.4. Sve utvrđene razlike između aktivnosti i sposobnosti proizvođača pomoćne supstance i propisane dobre proizvođačke prakse treba da se dokumentuju. Osim toga, proizvođač lekova treba da izvrši dodatnu procenu rizika kako bi se za svakog proizvođača pomoćne supstance utvrdio profil rizika, npr. nizak rizik, srednji rizik ili visoki rizik. Za tu svrhu potrebno je koristiti Smernicu ICH Q9. Potrebno je koristiti alate za Upravljanje rizicima kvaliteta poput onih koji su navedeni (HACCP itd.).
3.5. Proizvođač lekova treba da obezbedi niz strategija za rangiranje proizvođača pomoćnih supstanci od prihvatanja na osnovu kontrole do neprihvatanja, za različite profile rizika, na osnovu kojih treba da utvrdi strategiju kontrole, npr. proveru (audit), pretraživanje dokumenata i testiranje.
POTVRDA PRIMENE ODGOVARAJUĆE DOBRE PROIZVOĐAČKE PRAKSE
4.1. Nakon utvrđivanja odgovarajuće dobre proizvođačke prakse za pomoćnu supstancu i profila rizika proizvođača pomoćne supstance, treba da se sprovodi stalna analiza rizika na osnovu mehanizama kao što su:
(i) broj defekata kvaliteta povezanih s primljenim serijama pomoćne supstance;
(ii) vrsta/ozbiljnost tih defekata kvaliteta;
(iii) praćenje i analiza trenda kvaliteta pomoćne supstance;
(iv) suspendovanje, odnosno ukidanje sertifikata relevantnog sistema kvaliteta i/ili GMP sertifikata za mesto proizvodnje pomoćne supstance;
(v) praćenje trenda karakteristika kvaliteta leka, u zavisnosti od prirode i namene pomoćne supstance;
(vi) uočene organizacione, proceduralne ili tehničke/procesne promene kod proizvođača pomoćne supstance;
(vii) provere/ponovljene provere (audit/re-audit) proizvođača pomoćne supstance;
(viii) upitnici.
Na osnovu rezultata analize rizika, potrebno je preispitivanje i izmena utvrđene strategije kontrole.
PRELAZNE I ZAVRŠNE ODREDBE
Danom početka primene ove smernice prestaju da važe smernice dobre proizvođačke prakse ("Službeni glasnik RS", br. 28/08 i 35/08) i Smernice dobre proizvođačke prakse - drugi deo ("Službeni glasnik RS", broj 86/10).
Ove smernice stupaju na snagu osmog dana od dana objavljivanja u "Službenom glasniku Republike Srbije", a primenjuju se od 1. januara 2018. godine, osim:
1) odredbi Smernice za postavljanje zdravstveno bezbednih limita prilikom identifikacije rizika u proizvodnji različitih lekova u zajedničkim proizvodnim pogonima, Trećeg dela Smernica dobre proizvođačke prakse koje se primenjuju:
(1) na lekove za humanu primenu, koji se po prvi put uvode u proizvodnju u zajedničkim pogonima/prostorijama po isteku šest meseci od dana stupanja na snagu ove smernice,
(2) na lekove za humanu primenu, iz grupe antibiotika, hormona, citotoksičnih i visoko aktivnih lekova, koji se već proizvode u zajedničkim pogonima/prostorijama po isteku 12 meseci od dana stupanja na snagu ove smernice,
(3) na ostale lekove za humanu primenu i na veterinarske lekove koji se već proizvode u zajedničkim pogonima/prostorijama 24 meseca od dana stupanja na snagu ove smernice;
2) odredbi Smernice za formalizovanu procenu rizika za određivanje odgovarajuće dobre proizvođačke prakse za pomoćne supstance koje se upotrebljavaju u proizvodnji lekova za humanu upotrebu, Trećeg dela Smernica dobre proizvođačke prakse koje se primenjuju:
(1) na pomoćne supstance koje se koriste za proizvodnju sterilnih lekova za humanu primenu za koje je izdata dozvola za stavljanje u promet od 1. marta 2018. godine,
(2) na pomoćne supstance koje se koriste za proizvodnju lekova za humanu primenu za koje je izdata dozvola za stavljanje u promet od 1. oktobra 2018. godine,
3) na pomoćne supstance koje se koriste za proizvodnju veterinarskih lekova za koje je izdata dozvola za stavljanje u promet 1. januara. 2019. godine.