PRIMERI DRUGIH METODA ZA ODREĐIVANJE SREDNJE MOLEKULSKE MASE PO BROJNOJ ZASTUPLJENOSTI (Mn) ZA POLIMERE
Gel propusna hromatografija (GPC) je preporučena metoda (posebno kada je dostupan set standarda koji ima sličnu strukturu kao i polimer) za određivanje vrednosti Mn. Kada postoje praktični problemi koji onemogućuju upotrebu ove metode ili ako se očekuje da supstanca neće ispuniti Mn kriterijume (što treba da bude potvrđeno) mogu se koristiti raspoložive alternativne metode, kao što su:
1. UPOTREBA KOLIGATIVNIH SVOJSTAVA
1.1. EBULIOSKOPIJA/KRIOSKOPIJA
Ova metoda obuhvata merenja povišenja tačke ključanja (ebulioskopija) ili sniženje tačke mržnjenja (krioskopija) rastvarača kada se doda polimer. Zasniva se na činjenici da uticaj rastvorenog polimera na tačku ključanja/mržnjenja tečnosti zavisi od molekulske mase polimera1,2. Primenljivost, za Mn < 20.000.
Ova metoda obuhvata merenje napona pare izabrane referentne tečnosti pre i posle dodavanja poznatih količina polimera1,2.
Primenljivost za Mn < 20.000 (teoretski, u praksi limitirana vrednost).
Ova metoda se zasniva na principu osmoze, tj. prirodnoj težnji molekula rastvarača da kroz polupropustljivu membranu pređu iz razblaženog u koncentrovani rastvor da bi se uspostavila ravnoteža. Pri ispitivanju, razblaženi rastvor ima koncentraciju nula, dok koncentrovani rastvor sadrži polimer. Efekat prolaska rastvarača kroz membranu dovodi do razlike u pritiscima što zavisi od koncentracije i molekulske mase polimera1,3,4.
Primenljivost, za Mn između 20.000 i 200.000.
Ova metoda podrazumeva poređenje brzine isparavanja čistog aerosola rastvarača i najmanje tri aerosola koji sadrže polimer u različitim koncentracijama1,5,6.
Primenljivost za Mn < 20.000.
Da bi se koristila ova metoda potrebno je poznavanje strukture polimera i vrste terminalnih grupa u njegovom lancu (koje se moraju razlikovati od osnovnog lanca npr. pomoću nuklearne magnetne rezonance (NMR) ili titracije/derivatizacije). Utvrđivanje molekulske koncentracije grupa kojima se završava polimerni lanac može se koristiti za utvrđivanja molekulske mase7,8,9.
Primenljivost za Mn do 50.000 (uz smanjenu pouzdanost).
1. Billmeyer, F.W. Jr., (1984). Textbook of Polymer Science, 3rd Edn., John Wiley, New York.
2. Glover, C.A., (1975). Absolute Colligative Property Methods. Chapter 4. In: Polymer Molecular Weights, Part I P.E. Slade, Jr. ed., Marcel Dekker, New York.
3. ASTM D 3750-79, (1979). Standard Practice for Determination of Number-Average Molecular Weightof Polymers by Membrane Osmometry. American Society for Testing and Materials, Philadelphia, Pennsylvania.
4. Coll, H. (1989). membrane Osmometry. In: Determination of Molecular Weight, A.R. Cooper ed., J.Wiley and Sons, pp. 25-52.
5. ASTM 3592-77, (1977). Standard Recommended Practice for Determination of Molecular Weight byVapour Pressure, American Society for Testing and Materials, Philadelphia, Pennsylvania.
6. Morris, C.E.M., (1989). Vapour Pressure osmometry. In: Determinationn of Molecular Weight, A.R.Cooper ed., John Wiley and Sons.
7. Schröder, E., Müller, G., and Arndt, K-F., (1989). Polymer Characterisation, Carl Hanser Verlag, Munich.
8. Garmon, R.G., (1975). End-Group Determinations, Chapter 3 In: Polymer Molecular Weights, Part I,P.E. Slade, Jr. ed. Marcel Dekker, New York.
9. Amiya, S., et al. (1990). Pure and Applied Chemistry, 62, 2139-2146.
A.19. SADRŽAJ MOLEKULA SA MALIM MOLEKULSKIM MASAMA U POLIMERU
Metoda gel propusne hromatografije zasniva se na metodi OECD TG 119 (1996). Osnovni principi i detaljnije tehničke informacije date su u literaturi.
Polimeri imaju različite osobine. Zbog navedenog nemoguće je dati jednu metodu koja postavlja precizne uslove za razdvajanje i procenu i koja pokriva sve mogućnosti i sve specifičnosti koje se javljaju tokom razdvajanja polimera.
Posebno važi za složene polimerne sisteme na koje se često ne može primeniti gel propusna hromatografija (Gel permeation chromatography, u daljem tekstu: GPC). Kada nije moguće primeniti GPC molekulska masa se određuje primenom drugih metoda (videti Deo drugi ove metode). U takvim slučajevima opisuju se svi detalji i navode razlozi zbog kojih se koristi druga metoda.
Opisana metoda zasniva se na Standardu SRPS ISO 138851. Detaljne informacije o izvođenju eksperimenta i načinu procene dobijenih podataka date su u navedenom standardu. U slučaju da je neophodno izvršiti izmenu eksperimentalnih uslova, ove izmene se moraju opravdati. Mogu se koristiti i drugi standardi ukoliko su potpuno navedeni u literaturi. Metoda koja je data koristi polistirenske uzorke poznate polidisperzivnosti za kalibraciju, ali može biti modifikovana, ako je neophodno, kako bi odgovarala određenim polimerima, npr. polimerima rastvornim u vodi ili dugolančanim razgranatim polimerima.
Molekuli sa malim molekulskim masama jesu molekuli sa molekulskom masom ispod 1.000 daltona.
Srednja molekulska masa po brojnoj zastupljenosti Mn i srednja molekulska masa po masenoj zastupljenosti Mw određuju se prema jednačinama:

pri čemu:
Hi jeste nivo signala detektora od bazne linije za retencionu zapreminu Vi;
Mi jeste molekulska masa frakcije polimera pri retencionoj zapremini Vi;
n jeste broj relevantnih tačaka.
Opseg raspodele molekulskih masa koji predstavlja meru disperzije sistema dat je kroz odnos Mw/Mn.
GPC je relativna metoda. Zbog navedenog se mora izvršiti kalibracija. Za kalibraciju se najčešće koriste standardi linearnog polistirena sa poznatim prosečnim molekulskim masama Mn i Mw i sa poznatom uskom distribucijom molekulske mase. Kalibraciona kriva može se koristiti samo za određivanje molekulske mase nepoznatog uzorka ukoliko su uslovi za razdvajanje uzorka i standarda odabrani na identičan način.
Određeni odnos molekulske mase i elucione zapremine validan je samo pod specifičnim uslovima određenog eksperimenta. Ovi uslovi obuhvataju, između ostalog, temperaturu, rastvarač (ili smešu rastvarača), uslove hromatografije i kolonu za razdvajanje ili sistem kolona.
Molekulske mase uzorka utvrđene na ovaj način jesu relativne vrednosti i nazivaju se: "molekulske mase koje odgovaraju polistirenu". Navedeno znači da u zavisnosti od strukturnih i hemijskih razlika između uzorka i standarda, molekulske mase mogu da odstupaju od apsolutnih vrednosti u manjoj ili većoj meri. Ukoliko se koriste drugi standardi, npr. poli(etilenglikol), poli(etilenoksid), poli(metil-metakrilat), poliakrilna kiselina, navode se i razlozi za njihovo korišćenje.
GPC metodom određuje se raspodela molekulske mase uzorka i srednje molekulske mase (Mn i Mw). GPC jeste posebna vrsta tečne hromatografije kod koje se uzorak razdvaja na osnovu hidrodinamičkih zapremina pojedinačnih sastojaka2.
Razdvajanje se zasniva na prolasku uzorka kroz kolonu ispunjenu nekim poroznim materijalom, obično nekim organskim gelom. Manji molekuli mogu da uđu u pore dok veliki molekuli prolaze bez zadržavanja. Put koji prolaze veći molekuli je kraći te oni prvi silaze sa kolone. Molekuli srednje veličine ulaze u neke od pora i oni kasnije silaze sa kolone. Najmanji molekuli, sa prosečnim hidrodinamičkim poluprečnikom manjim od pora gela, mogu da uđu u sve pore. Stoga oni poslednji silaze sa kolone.
U idealnim uslovima na razdvajanje utiče samo veličina molekula, ali u praksi je teško izbeći uticaj apsorpcionih efekata. Neujednačena pakovanja kolona i mrtve zapremine mogu da pogoršaju situaciju2.
Detekcija se vrši pomoću indeksa refrakcije ili UV apsorpcije, a rezultat je prosta kriva raspodele. Da bi se na krivu unele stvarne molekulske mase neophodno je da kolone budu kalibrisane tako što će kroz njih proći polimeri čija je molekulska masa poznata i, koji u idealnim uslovima, imaju sličnu strukturu kao što su različiti polistirenski standardi. Najčešće se dobija Gausova kriva, koju ponekad narušava mali rep na kraju na kome se nalaze male molekulske mase. Vertikalna osa krive predstavlja količinu, po težini, eluiranih molekula različitih masa, dok horizontalna osa predstavlja logaritamsku vrednost molekulskih masa.
Sadržaj molekula malih molekulskih masa očitava se sa navedene krive. Ovo računsko izvođenje je tačno samo ako molekuli različitih malih molekulskih masa odgovaraju, na osnovu mase, polimeru kao celini.
Ponovljivost (Relativna standardna devijacija) elucione zapremine treba da bude veća od 0,3 %. Zahtevana ponovljivost analiza obezbeđuje se korekcijom internim standardom ukoliko se hromatogram procenjuje na osnovu retencionih vremena i ne odgovara navedenom kriterijumu1. Polidisperzivnost zavisi od molekulskih masa standarda. Tipične vrednosti za polistirenske standarde su:
Mp < 2000 | Mw/Mn < 1,20 |
2000 ≤ Mp ≤ 106 | Mw/Mn < 1,05 |
Mp > 106 | Mw/Mn< 1,20 |
pri čemu:
Mp jeste molekulska masa standarda na maksimumu pika.
1.6.1. Priprema standardnih rastvora polistirena
Standardi polistirena rastvaraju se pažljivim mešanjem u izabranom eluentu. Pri pripremanju rastvora moraju se uzeti u obzir preporuke proizvođača. Koncentracije izabranih standarda zavise od različitih faktora, npr. zapremine koja se injektuje, viskoziteta rastvora i osetljivosti analitičkog detektora. Maksimalna zapremina koja se injektuje mora biti prilagođena dužini kolone, tako da se izbegne preopterećenje.
Tipične zapremine injektiranja za analitička razdvajanja u metodi gel propusne hromatografije, sa kolonama dimenzija 30 cm x 7,8 mm, kreću se između 40 µl i 100 µl. Moguće su i veće zapremine, ali one ne bi trebalo da prelaze 250 µl. Optimalni odnos između injektovane zapremine i koncentracije mora se odrediti pre kalibracije kolona.
1.6.2. Priprema rastvora uzorka
Na pripremu rastvora uzorka primenjuju se isti zahtevi kao i za pripremu standardnih rastvora. Uzorak se rastvara u odgovarajućem rastvaraču, npr. tetrahidrofuranu (u daljem tekstu: THF), pažljivim mućkanjem. Ne preporučuje se korišćenje ultrazvučne kade za rastvaranje. Kada je neophodno, rastvor uzorka se prečišćava pomoću membranskog filtera veličine pora između 0,2 µm i 2 µm.
Prisustvo nerastvornih čestica mora se navesti u završnom izveštaju jer se one mogu pojaviti usled prisustva čestica velike molekulske mase. Za određivanje masenog procenta nerastvornih čestica primenjuje se odgovarajuća metoda. Rastvore treba iskoristiti u roku od 24 h.
1.6.3. Korekcija sadržaja zbog prisutnih nečistoća i aditiva
Obično se vrši korekcija sadržaja molekula čija je M < 1.000 zbog udela specifičnih komponenti koje nisu polimeri, a koje su prisutne u rastvoru (npr. nečistoće i/ili aditivi), izuzev ukoliko izmereni sadržaj nije < 1 %. Ovo se postiže direktnim analizama rastvora polimera ili eluata. U slučajevima kada je eluent, nakon prolaska kroz kolonu, previše razblažen da bi se mogao analizirati, on se mora koncentrovati. Nekada se eluent mora upariti do suvog, pa zatim ponovo rastvoriti. Koncentrovanje eluenta mora se vršiti pod takvim uslovima da se spreče sve moguće izmene njegovog sastava. Obrada eluenta dobijenog metodom gel propusne hromatografije zavisi od analitičke metode koja se koristi za kvantitativno određivanje.
1.6.4. Aparatura
GPC aparatura se sastoji od:
- posude za rastvarač;
- uređaja za degaziranje (kada je neophodno);
- pumpe;
- pulsnog prigušivača (kada je neophodno);
- sistema za injektovanje;
- hromatografske kolone;
- detektora;
- merača protoka (kada je neophodno);
- procesora za prikupljanje podataka;
- posude za prikupljanje otpada.
Mora se obezbediti da GPC sistem bude inertan prema korišćenom rastvaraču (npr. upotreba čeličnih kapilara za THF kao rastvarač).
1.6.5. Sistem za injektovanje i uvođenje rastvarača
Određena zapremina rastvora uzorka uvodi se u kolonu pomoću automatskog unošenja uzorka ili ručno u precizno određenoj zoni. Prebrzo povlačenje ili pritiskanje klipa šprica, ukoliko se vrši ručno, može dovesti do promena u ispitivanoj raspodeli molekulske mase. Sistem za uvođenje rastvarača treba, u najvećoj mogućoj meri, da bude oslobođen od pulsiranja, ako je moguće tako što će sadržati pulsni prigušivač. Brzina protoka treba da bude u okviru 1 ml/min.
1.6.6. Kolona
U zavisnosti od uzorka, određivanje polimera vrši se upotrebom ili jedne kolone ili više međusobno povezanih kolona u nizu. Komercijalno su dostupni brojni porozni materijali za kolone sa definisanim svojstvima (npr. veličina pora, ekskluzioni limit (gornja granica molekulske mase iznad koje će se molekuli eluirati u retencionoj zapremini)) Izbor gela za razdvajanje ili dužina kolone zavise od osobina uzorka (hidrodinamičke zapremine, raspodele molekulske mase) i od specifičnih uslova za razdvajanje kao što su rastvarač, temperatura i brzina protoka1,2,3.
1.6.7. Teorijski podovi
Za kolonu ili kombinaciju kolona koje se koriste za razdvajanje mora se odrediti broj teorijskih podova. To podrazumeva, u slučaju primene THF kao rastvarača, nanošenje rastvora etil-benzena ili neke druge odgovarajuće nepolarne supstance na kolonu poznate dužine. Broj teorijskih podova određuje se pomoću jednačine:

pri čemu:
N jeste broj teorijskih podova;
Ve jeste eluciona zapremina na maksimumu pika;
W jeste širina pika na baznoj liniji;
W½ jeste širina pika na polovini visine.
1.6.8. Efikasnost razdvajanja
Pored broja teorijskih podova koji kvantitativno određuje širinu traka, važnu ulogu ima efikasnost razdvajanja koja je određena nagibom kalibracione krive. Efikasnost razdvajanja kolone dobija se na osnovu odnosa:
pri čemu:
Ve.Mx jeste eluciona zapremina polistirena molekulske mase Mx;
Ve(10Mx) jeste eluciona zapremina polistirena sa deset puta većom molekulskom masom.
Rezolucija sistema definiše se kao:
pri čemu:
Ve1 i Ve2 jesu elucione zapremine dva polistirenska standarda na maksimumu pika;
W1 i W2 jesu širine pikova na baznoj liniji;
M1 i M2 jesu molekulske mase na maksimumu pika (treba da se razlikuju za faktor 10).
R-vrednost za sistem kolona treba da bude veća od 1,74.
1.6.9. Rastvarači
Svi rastvarači moraju biti visoke čistoće (koristi se THF čistoće 99,5%). Posuda za rastvarač (ukoliko je neophodno u atmosferi inertnog gasa) mora biti dovoljna za kalibraciju kolone i nekoliko analiza uzorka.
Rastvarač se mora degazirati pre nego što se ubaci u kolonu uz pomoć pumpe.
1.6.10. Kontrola temperature
Temperatura kritičnih unutrašnjih delova (petlje za injektovanje, kolone, detektor i cevi) treba da bude konstantna i u skladu sa izabranim rastvaračem.
1.6.11. Detektor
Svrha detektora je da beleži koncentraciju uzorka eluiranog sa kolone. Da bi se izbeglo nepotrebno širenje pikova, zapremina kivete ćelije detektora mora da bude što je moguće manja. Ona ne sme da bude veća od 10 µl osim u slučaju detektora zasnovanih na rasipanju svetlosti i viskoznosti. Za detekciju se najčešće koristi diferencijalna refraktometrija. Ukoliko uzorak ili rastvarač imaju neka posebna svojstva, mogu se koristiti i drugi tipovi detektora, npr. UV/VIS, IC, detektori viskoznosti i dr.
Standard SRPS ISO 138851 služi kao literatura za detalje o kriterijumima za procenu kao i u vezi zahteva koji se odnose na prikupljanje i obradu podataka.
Za svaki uzorak moraju se izvršiti dva nezavisna eksperimenta. Oni se moraju odvojeno analizirati. U svim slučajevima važno je izvršiti ispitivanje slepe probe pod istim uslovima kao i uzorak.
Neophodno je jasno naznačiti da su izmerene vrednosti relativne vrednosti ekvivalentne molekulskim masama korišćenih standarda.
Nakon što se odrede retencione zapremine ili retenciona vremena (mogu se korigovati pomoću internih standarda) na grafik se ucrtavaju ove vrednosti prema logaritmu Mp vrednosti (pri čemu je Mp maksimum pika kalibracionog standarda). Potrebne su najmanje dve kalibracione tačke u dekadnom opsegu molekulskih masa (1 kD - 10 kD, 10 kD - 100 kD, 100 kD - 1.000 kD) i najmanje pet mernih tačaka za ceo grafik koje treba da pokriju raspon očekivanih molekulskih masa. Završna tačka malih molekulskih masa koja se nalazi na kraju kalibracione krive definiše se pomoću n-heksilbenzena ili nekog drugog odgovarajućeg nepolarnog rastvarača. Deo krive koji odgovara molekulskim masama ispod 1.000 kD određuje se i koriguje ako je potrebno zbog sadržaja nečistoća i aditiva. Podaci sa krive eluiranja uglavnom se obrađuju elektronski, ali se mogu vršiti i ručna izračunavanjaXXVII. Ukoliko se u koloni zadržao neki od nerastvornih polimera, njegova molekulska masa je verovatno veća od one koju ima rastvorna frakcija, i ukoliko se zanemari može doći do loše procene sadržaja molekula sa malim molekulskim masama.
Uputstvo za korigovanje sadržaja molekula sa malim molekulskim masama kod nerastvornih polimera dato je u Delu drugom ove metode.
Kriva raspodele mora biti data u obliku tabele ili slike (diferencijalna frekvencija ili zbir iznosa u procentima prema vrednosti log M). Kod grafičkog prikaza jedan dekadni opseg molekulskih masa mora biti širine oko 4 cm, a maksimalna visina pika mora iznositi 8 cm. U slučaju integraljenja krive raspodele razmak ordinate između 0 % i 100 % treba da bude oko 10 cm.
_______________
XXVII Koristi se ASTM D 3536-91
Izveštaj o ispitivanju sadrži podatke o:
2.2.1. Ispitivanoj supstanci:
- poznate podatke o ispitivanoj supstanci (identitet, aditivi, nečistoće);
- opis obrade uzorka, zapažanja problemi.
2.2.2. Instrumentima:
- posuda za rastvarač, inertni gas, degaziranje eluenta, sastav eluenta, nečistoće;
- pumpa, pulsni prigušivač, sistem za injektovanje;
- hromatografske kolone (proizvođač, informacije o karakteristikama kolona, kao što su veličina pora, vrsta materijala za odvajanje itd., broj, dužina i redosled upotrebljenih kolona);
- broj teorijskih podova kolone (ili kombinacije), efikasnost razdvajanja (rezolucija sistema);
- podatke o simetriji pikova;
- temperatura kolona, način kontrole temperature;
- detektor (princip merenja, vrsta, zapremina kivete);
- merač protoka ukoliko je korišćen (proizvođač, princip merenja);
- sistem za prikupljanje i obradu podataka (hardver i softver).
2.2.3. Kalibraciji sistema:
- detaljan opis metode korišćene u izradi kalibracione krive;
- podatke o kriterijumima kvaliteta koji se odnose na ovu metodu (npr. koeficijent korelacije, greška metodom najmanjih kvadrata, itd.);
- podatke o svim primenjenim ekstrapolacijama, pretpostavkama i aproksomacijama prilikom ispitivanja, proceni i obradi podataka;
- sva merenja korišćena pri izradi kalibracione krive moraju biti dokumentovana u vidu tabele koja mora da sadrži sledeće podatke za svaku kalibracionu tačku:
- ime uzorka;
- ime proizvođača uzorka;
- karakteristične vrednosti standarda Mp, Mn, Mw, Mw/Mn, onako kako ih je dostavio proizvođač ili koje su izvedene na osnovu dodatnih merenja zajedno sa detaljima o metodi njihovog određivanja;
- injektovana zapremina i injektovana koncentracija uzorka;
- Mp vrednost koja je korišćena za kalibraciju;
- eluciona zapremina ili korigovano retenciono vreme izmereno na maksimumu pika;
- Mp izračunato na maksimumu pika;
- procentualna greška izračunate vrednosti Mp i kalibrisane vrednosti.
2.2.4. Sadržaju molekula sa malim molekulskim masama:
- opis korišćene metode i način na koji su izvršeni eksperimenti;
- podatke o procentu molekula sa malim molekulskim masama (m/m) u odnosu na ceo uzorak;
- podatke o nečistoćama, aditivima i drugim vrstama koje nisu polimeri izražene kao maseni procenat u odnosu na ceo uzorak.
2.2.5. Proceni:
- procena na osnovu retencionog vremena: sve metode koje obezbeđuju zahtevanu reproduktivnost (metoda korekcije, interni standardi i dr.);
- podatak o tome da li je procena izvršena na osnovu elucione zapremine ili na osnovu retencionog vremena;
- podatke o ograničenjima procene ako pikovi nisu potpuno analizirani;
- opis metoda poravnavanja, ukoliko su korišćene;
- priprema i prethodna obrada uzorka;
- prisustvo nerastvornih čestica, ukoliko ih ima;
- injektovana zapremina (µ1) i koncentracija injektovanog uzorka (mg/ml);
- zapažanja koja se odnose na uticaje koji dovode do odstupanja od idealnog profila gel propusne hromatografije;
- detaljan opis svih izmena postupka ispitivanja;
- detalje o opsezima greške;
- druge podatke i zapažanja relevantne za tumačenje rezultata.
1. SRPS ISO 13885-1:2011, Punioci za boje i lakove - Gel propustljiva hromatografija - Deo I: tetrahidrofuran kao eluent
2. Yau, W.W., Kirkland, J.J., and Bly, D.D. eds, (1979). Modern Size Exclusion Liquid Chromatography, J. Wiley and Sons.
3. ASTM D 3536-91, (1991). Standard Test Method for Molecular Weight Averages and MolecularWeight Distribution by Liquid Exclusion Chromatography (Gel Permeation Chromatography-GPC). American Society for Testing and Materials, Philadelphia, Pennsylvania.
4. ASTM D 5296-92, (1992). Standard Test Method for Molecular Weight Averages and MolecularWeight Distribution of Polystyrene by High Performance Size-Exclusion Chromatography. American Society for Testing and Materials, Philadelphia, Pennsylvania.
UPUTSTVO ZA KORIGOVANJE SADRŽAJA MOLEKULA SA MALIM MOLEKULSKIM MASAMA ZBOG PRISUSTVA NERASTVORNIH POLIMERA
Kada je u uzorku prisutan nerastvorni polimer dolazi do gubitka mase u toku GPC analize. Nerastvorni polimer ireverzibilno se zadržava na koloni ili filteru dok njegov rastvorni deo prolazi kroz kolonu. U slučaju kada se može izmeriti ili pretpostaviti povećanje indeksa refrakcije (dn/dc) polimera, moguće je proceniti gubitak mase uzorka na koloni. U tom slučaju vrši se korekcija korišćenjem eksterne kalibracije sa standardnim materijalima poznate koncentracije i dn/dc da bi se kalibrisao odgovor refraktometra. U primeru koji sledi korišćen je standard poli(metil-metakrilata) (pMMA).
Kod eksterne kalibracije u analizi akrilnih polimera, pMMA standard poznate koncentracije u tetrahidrofuranu analizira se gel propusnom hromatografijom, a dobijeni rezultati koriste se za izračunavanje konstante refraktometra na osnovu jednačine:
K=R/(C x V x dn/dc)
pri čemu:
K jeste konstantna refraktometra (u mikrovoltima / sekund/ml);
R jeste odgovor pMMA standarda/ (u mikrovoltima / sekund);
C jeste koncentracija pMMA standarda (u mg/ml);
V jeste injektovana zapreminu (u ml);
dn/dc jeste uvećanje indeksa refrakcije za pMMA u tetrahidrofuranu (u ml/mg).
Za pMMA standard tipične vrednosti su:
R = 2 937 891
C = 1.07 mg/ml
V = 0,1 ml
dn/dc = 9 x 10-5 ml /mg
Na ovaj način dobijena vrednost K, 3.05 x 1011 koristi se da se izračuna teorijski odgovor detektora ukoliko je 100 % injektovanog polimera izdvojeno preko detektora.
A.20. PONAŠANJE POLIMERA U VODI
(RASTVORLJIVOST/EKSTRAKTIVNOST)
Ova metoda odgovara revidiranoj verziji metode OECD TG 120 (1997). Detaljnije tehničke informacije date su u literaturi1.
Za pojedine polimere, kao što su emulzioni polimeri, da bi se koristila ova metoda potrebna je prethodna priprema. Metoda se ne primenjuje na tečne polimere niti na polimere koji reaguju sa vodom pri uslovima ispitivanja.
Kada ispitivanje ovom metodom nije moguće ili nije praktično za izvođenje, ponašanje rastvorljivosti/ekstraktivnosti ispituje se drugim metodama. U takvim slučajevima navode se svi detalji i razlozi korišćenja tih metoda.
Nisu propisane.
Ponašanje polimera u vodenoj sredini rastvorljivost/ekstraktivnost određuje se primenom metode staklenog suda (videti metodu A.6. Rastvorljivost u vodi, metoda staklenog suda, koja je data u ovom prilogu) sa izmenama koje su date u ovoj metodi.
Nisu propisani.
1.5.1. Oprema
Za ovu metodu neophodno je:
- uređaj za mlevenje, tj. mlin za proizvodnju čestica poznatih veličina;
- aparat za mešanje sa mogućnošću kontrolisanja temperature;
- membranski sistem za filtriranje;
- odgovarajuća analitička oprema;
- standardizovana sita.
1.5.2. Priprema uzorka
Reprezentativni uzorak prvo mora da se pomoću odgovarajućih sita svede na čestice veličine od 0,125 mm do 0,25 mm. Nekada je potrebno ohladiti uzorak zbog njegove stabilnosti ili procesa mlevenja. Gumasti materijali mogu se usitniti na temperaturi tečnog azota1.
Ako nije moguće dobiti čestice traženih veličina, materijal se usitnjava što je više moguće, a postignut rezultat navodi se u izveštaju. U izveštaju se navodi način na koji je samleveni uzorak čuvan pre ispitivanja.
1.5.3. Postupak ispitivanja
Tri uzorka po 10 g supstance koja se ispituje odmeri se u svaku od tri posude sa staklenim zapušačima i doda 1.000 ml vode u svaku posudu. Ako se količina od 10 g polimera pokaže nepodesnom, koristi se sledeća najveća količina sa kojom se može raditi. Količinu vode prilagođava se u skladu sa tim.
Posude se čvrsto zapuše i zatim mućkaju na 20 °C. Koriste se uređaji za mućkanje ili mešanje koji mogu da rade na konstantnoj temperaturi. Nakon 24 časa, sadržaj svake posude se centrifugira ili filtrira, a koncentracija polimera u bistrom vodenom sloju određuje se odgovarajućom analitičkom metodom.
Ako ne postoje odgovarajuće analitičke metode za određivanje polimera u vodenoj fazi, ukupna rastvorljivost-ekstraktivnost procenjuje se iz mase osušenog taloga sa filtera ili osušenog taloga dobijenog centrifugiranjem.
Najčešće je potrebno da se napravi kvantitativna razlika između nečistoća i aditiva sa jedne strane, i polimera sa malim molekulskim masama sa druge strane. U slučaju gravimetrijskog određivanja važno je ispitati slepu probu u kojoj ispitivana supstanca nije prisutna, kako bi se izračunao talog koji nastaje u eksperimentalnom postupku.
Rastvorljivost/ekstraktivnost - ponašanje polimera u vodi na 37 °C na pH 2 i pH 9 određuje se na isti način kao što je opisano za eksperiment na 20 °C. pH vrednosti postižu se dodavanjem ili odgovarajućih pufera, ili odgovarajućih kiselina ili baza kao što su hlorovodonična kiselina, sirćetna kiselina, natrijum ili kalijum hidroksid analitičke čistoće ili NH3.
U zavisnosti od primenjene metode analize, vrši se jedno ili dva ispitivanja. Kada postoji dovoljno specifičnih metoda za direktnu analizu polimera u vodenoj fazi, dovoljno je jedno ispitivanje. Kada navedene metode ne postoje i kada je određivanje ponašanja polimera rastvorljivosti/ekstraktivnosti ograničeno na indirektne analize kojima se određuje samo ukupni sadržaj organskog ugljenika (Total organic carbon, u daljem tekstu: TOC) vodenog ekstrakta, vrše se i dodatna ispitivanja. Dodatno ispitivanje treba izvršiti na tri uzorka, koristeći deset puta manje količine uzorka polimera i iste količine vode kao u prvom ispitivanju.
1.5.4. Analiza
1.5.4.1. Ispitivanje izvršeno sa jednom količinom uzorka
Postoje metode za direktnu analizu komponenti polimera u vodenom ekstraktu. Alternativno se razmatra indirektna analiza rastvorenih/ekstrahovanih komponenti polimera određivanjem ukupnog sadržaja rastvornih komponenti korigovanog za nepolimerne komponente.
Analiza ukupnog sadržaja polimernih vrsta u vodenom ekstraktu može se izvesti:
1) ili dovoljno osetljivom metodom odnosno:
- TOC koristeći digestiju persulfatom ili dihromatom za prevođenje u CO2 koji se određuje infracrvenom spektrometrijom (u daljem tekstu: IR) ili hemijskom analizom;
- Atomska apsorpciona spektrometrija (u daljem tekstu: AAS) ili induktivno kuplovana plazma (u daljem tekstu: ICP), emisioni ekvivalent za polimere koji sadrže metale ili silicijum;
- UV apsorpcija ili spektrofluorimetrija za aril-polimere;
- LC-MS za uzorke male molekulske mase;
2) ili isparavanjem u vakuumu do suvog vodenog ekstrakta i spektroskopskom (IR, UV itd.) ili AAS/ICP analizom taloga.
Ako se analiza vodenog ekstrakta kao takva ne može primeniti, vodeni ekstrakt se ekstrahuje organskim rastvaračem koji se ne meša sa vodom, tj. hlorovanim ugljovodonikom. Rastvarač se zatim upari i talog analizira kako je opisano da bi se odredio sadržaj polimera. Svaka komponenta u ovom talogu koja je identifikovana kao nečistoća ili aditiv oduzima se u cilju određivanja stepena rastvorljivosti/ekstraktivnosti samog polimera.
Kada su prisutne relativno velike količine takvog materijala talog se analizira npr. HPLC ili GC analizom da bi se razlikovale nečistoće od monomera i prisutnih vrsta nastalih od monomera, tako da se može odrediti pravi sadržaj onoga što je nastalo.
U nekim slučajevima može biti dovoljno jednostavno isparavanje organskog rastvarača do suvog i merenje suvog ostatka.
1.5.4.2. Ispitivanje izvršeno sa dve različite količine uzorka
Svi ekstrakti taloga analiziraju se na TOC.
Nerastvorni/neekstrahovani deo uzorka određuje se gravimetrijski. Ukoliko, nakon centrifugiranja ili filtriranja sadržaja svake posude, talog polimera ostane zalepljen za zid posude, posuda se ispira filtratom sve dok se ne prebaci sav talog. Nakon toga, filtrat se opet centrifugira ili filtrira. Talog koji ostane na filteru ili u kiveti centrifuge suši se na 40 °C u vakuumu i meri se. Sušenje se nastavlja do konstantne mase.
2.1. ISPITIVANJE JEDNE KOLIČINE UZORKA
Navode se pojedinačni rezultati za svaku od tri boce i njihova srednja vrednost izražena u jedinicama mase po zapremini rastvora (uobičajeno mg/L) ili jedinicama mase po masi uzorka polimera (uobičajeno mg/g).
Navodi se i gubitak mase uzorka (izračunat kao masa rastvorene supstance podeljena sa masom početnog uzorka). Računaju se relativne standardne devijacije (RSD). Navode se pojedinačne cifre za ukupnu supstancu (polimer + glavni aditivi itd.) i samo za polimer (tj. nakon oduzimanja doprinosa aditiva).
2.2. ISPITIVANJE DVE RAZLIČITE KOLIČINE UZORKA
Pojedinačne TOC vrednosti vodenih ekstrakta iz dva eksperimenta pri kojima su vršena po tri ispitivanja i srednja vrednost za svaki eksperiment, izražavaju se kao jedinice mase po zapremini rastvora (uobičajeno mgC/L), kao i u jedinicama mase po masi početnog uzorka (uobičajeno mgC/g).
Ukoliko ne postoji razlika između rezultata dobijenih sa većim i manjim odnosom voda/uzorak, ovo može da ukazuje na to da su sve komponente koje mogu da se ekstrahuju zaista i bile ekstrahovane. U tom slučaju, direktna analiza nije potrebna.
Navode se pojedinačne mase taloga i izražavaju u procentima od početnih masa uzorka. Srednje vrednosti računaju se za svaki eksperiment. Razlike između 100 % i nađenih procenata predstavljaju procenat rastvornog materijala i materijala koji može da se ekstrahuje u originalnom uzorku.
Izveštaj o ispitivanju sadrži podatke o:
3.1.1. Supstanci koja se ispituje:
- dostupne podatke o ispitivanoj supstanci (identitet, aditivi, nečistoće, sadržaj molekula malih molekulskih masa).
3.1.2. Eksperimentalnim uslovima:
- opis postupaka i eksperimentalnih uslova;
- opis analitičkih metoda i metoda detekcije.
3.1.3. Rezultatima:
- rezultati rastvorljivosti/ekstraktivnosti u mg/l; pojedinačne i srednje vrednosti ekstrahovanja različitim rastvaračima, razdvojene na sadržaj polimera i nečistoća, aditiva, itd.;
- rezultati rastvorljivosti/ekstraktivnosti u mg/g polimera;
- TOC vrednosti vodenih ekstrakta, mase rastvorene supstance i izračunate procente, ako su merene;
- pH svakog uzorka;
- podatke o vrednostima slepih proba;
- kada je potrebno, napomene o hemijskoj nestabilnosti ispitivane supstance, tokom postupka ispitivanja i analitičkog postupka;
- sve podatke koji su važni za tumačenje rezultata.
1. DIN 53733 (1976) Zerkleinerung von Kunststofferzeugnissen für Prüfzwecke
A.21. OKSIDUJUĆA SVOJSTVA (ZA TEČNOSTI)
Ova metoda osmišljena je za merenje potencijala tečnih supstanci da povećaju i razviju brzinu ili intenzitet gorenja zapaljivih supstanci, ili da naprave smešu sa zapaljivom supstancom koja ima sposobnost spontanog paljenja, kada se ovakva smeša dobro izmeša. Zasniva se na UN metodi ispitivanja tečnosti sa oksidujućim svojstvima1. Metoda A.21. osmišljena je tako da pre svega ispunjava zahteve Uputstva EU broj 1907/2006, pa je potrebno izvršiti poređenje sa jednom referentnom supstancom. Ispitivanje i poređenje sa dodatnim referentnim supstancama može biti potrebno u slučaju kada se očekuje da će rezultati ispitivanja biti korišćeni u druge svrheXXVIII.
Ispitivanje se ne mora vršiti kada je na osnovu strukturne formule pouzdano jasno da supstanca nema sposobnost da egzotermno reaguje sa zapaljivim materijalom.
Pre nego što se pristupi ispitivanju korisno je imati preliminarne podatke o potencijalnim eksplozivnim svojstvima supstance.
Ovo ispitivanje se ne primenjuje na supstance u čvrstom stanju, gasove, eksplozive ili visoko zapaljive supstance ili organske perokside.
Kada postoje rezultati za ispitivanu supstancu u UN metodama ispitivanja za oksidujuće tečnosti1 nije neophodno izvršiti njeno ispitivanje.
________________
XXVIII Kao na primer u okviru propisa UN o transportu.
Vreme porasta pritiska jeste prosečna vrednost izmerenog vremena koje je potrebno da se pritisak smeše koja se ispituje podigne sa 690 kPa na 2.070 kPa iznad atmosferskog pritiska.
Kao referentna supstanca koristi se 65 % (m/m) vodeni rastvor azotne kiseline (analitičke čistoće)XXIX.
Ukoliko lice koje vrši ispitivanje smatra da se rezultati ovog ispitivanja mogu koristiti i u neke druge svrhe1, postoji mogućnost da se ispitaju i dodatne referentne supstanceXXX.
_______________
XXIX Kiselina se titruje pre ispitivanja kako bi se potvrdila njena koncentracija.
XXX Npr.: 50% (m/m) perhlorna kiselina i 40% (m/m) natrijum-hlorat se koriste u literaturi1.
Tečnost koja se ispituje meša se u masenom odnosu jedan prema jedan sa vlaknastom celulozom i stavlja se u sud pod pritiskom. Ukoliko tokom mešanja ili punjenja posude dođe do spontanog paljenja, nije potrebno dalje ispitivanje.
Ukoliko ne dođe do spontanog paljenja sprovodi se kompletno ispitivanje. Smeša se zagreva u posudi pod pritiskom i određuje se vreme koje je potrebno da se pritisak poveća sa 690 kPa na 2.070 kPa (iznad atmosferskog pritiska). Ova vrednost se upoređuje sa prosečnom vrednošću vremena porasta pritiska referentne supstance u smeši sa celulozom u odnosu 1:1.
U seriji od pet ispitivanja jedne supstance rezultati pojedinačnih ispitivanja ne treba da odstupaju za više od 30 % u odnosu na aritmetičku srednju vrednost. Rezultati koji odstupaju više od 30 % od srednje vrednosti odbacuju se, poboljšava se postupak mešanja supstanci i punjenja posude za ispitivanje i zatim se ispitivanje ponavlja.
1.6.1. Priprema
1.6.1.1. Zapaljive supstance
Osušena vlaknasta celuloza sa vlaknima dužine između 50 µm i 250 µm i srednjim prečnikom od 25µmXXXI koristi se kao zapaljivi materijal. Celuloza se suši do konstantne mase u sloju čija debljina ne prelazi 25 mm na temperaturi od 105 °C tokom 4 sata i drži se u eksikatoru bez sredstva za sušenje dok se ne ohladi i dalje do ispitivanja. Sadržaj vode u osušenoj celulozi ne treba da bude veći od 0,5% po jedinici suve maseXXXII. Ukoliko je potrebno, vreme sušenja se može produžitiXXXIII. Ista šarža celuloze koristi se u toku celog ispitivanja.
_______________
XXXI Npr. Vatman kolonska hromatografija celulozni prah CF 11, kataloški broj 4021 050
XXXII Potvrđena npr. Karl-Fišerovom titracijom
XXXIII Ovaj sadržaj vode se može postići i npr. zagrevanjem na 105°C u vakumu 24 časa.
1.6.1.2. Oprema
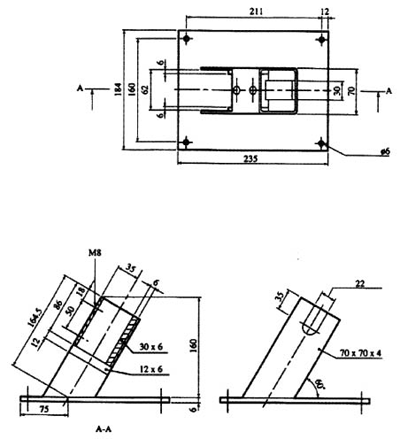
1.6.1.2.1. Sud pod pritiskom
Zahteva se korišćenje suda pod pritiskom. Ovaj sud se sastoji od cilindričnog tela izrađenog od čelika, dužine 89 mm i spoljnog prečnika od 60 mm (videti Sliku 1). Dve suprotne strane mašinski su obrađene (čime se poprečni presek posude smanjuje na 50 mm) da bi se olakšalo navijanje zapušača na kome se nalazi sistem za paljenje i ventil oduška. Sud, koji ima šupljinu prečnika 20 mm, iznutra se svodi na dubinu od 19 mm i narezuje se da primi 1˝ po Britanskom standardnom sistemu ili veličinu ekvivalentnu ovoj prema metričkom sistemu. Ventil za odušak, u obliku ručke koja se montira na bočnu stranu aparata, zavrne se za krivu površinu suda pod pritiskom na udaljenosti od 35 mm od jednog od njegovih krajeva i pod uglom od 90° u odnosu na prirubnice. Izdubi se otvor dubine 12 mm i nareže tako da može da primi veličinu od 1/2˝ po Britanskom standardnom sistemu (ili veličinu ekvivalentu ovoj prema metričkom sistemu) na kraju bočne strane. Po potrebi koristi se inertni zaptivač kako bi sud bio nepropustan za gasove. Ručka koja se nalazi sa strane proteže se 55 mm od tela suda pod pritiskom i ima navoj od 6 mm. Kraj ove ručke ima navoj koji omogućava da u njega stane pretvarač pritiska sa dijafragmom. Koristi se bilo koji uređaj za merenje pritiska pod uslovom da ne bude u kontaktu sa vrelim gasovima ili proizvodima razlaganja i ako može da izdrži porast pritiska od 690 kPa do 2.070 kPa u vremenu koje nije veće od 5 ms.
Kraj suda pod pritiskom koji je na većoj udaljenosti od ove ručke zatvara se zapušačem na kome se nalazi sistem za paljenje opremljen sa dve elektrode, od kojih je jedna izolovana u odnosu na telo zaptivača a druga uzemljena na njega. Drugi kraj suda pod pritiskom zatvara se sigurnosnim diskom koji štiti od eksplozije (pritisak eksplozije oko 2.200 kPa) koji je pričvršćen poklopcem za zaptivanje sa otvorom od 20 mm. Ako je potrebno koristi se inertni zaptivač kako bi sud bio nepropustan za gasove. Stalak (videti Sliku 2) drži aparaturu u odgovarajućem položaju u toku upotrebe. Sastoji se od osnove izrađene od mekog čelika dimenzija 235 mm x 184 mm x 6 mm i šupljeg četvrtastog profila dužine 185 mm i dimenzija 70 mm x 70 mm x 4 mm.
Sa jedne strane četvrtastog profila izrežu se po dužini dve suprotne stranice tako da se dobije konstrukcija sa dve noge ravnih stranica sa visinom kućišta od 86 mm. Krajevi ovih nogu ravnih stranica seku se pod uglom od 60° po horizontalnoj ravni da bi se zavarili za oslonac. Žleb širine 22 mm i dubine 46 mm montira se na jednu stranu kućišta suda tako da kada se sud spusti na oslonac zapušač na kome se nalazi sistem za paljenje bude okrenut prema izolatorskoj kutiji, a ručka koja je montirana sa strane upada u ovaj žleb. Komad čelika širine 30 mm i debljine 6 mm vari se za donju unutrašnju stranu izolatorske kutije da bi održavao rastojanje. Dva šrafa od 7 mm koji se prišrafljuju sa suprotne strane treba da drže sud pod pritiskom čvrsto na svom mestu. Dve trake od čelika širine 12 mm i debljine 6 mm zavarene sa donje strane gde se sastavni delovi dodiruju sa izolatorskom kutijom, obezbeđuju sud pod pritiskom odozdo.
1.6.1.2.2. Sistem za paljenje
Sistem za paljenje sastoji se od žičanog provodnika dužine 25 cm izrađenog od Ni/Cr, čiji je prečnik 0,6 mm i otpornost 3,85 Ω/m. Žica je navijena na šipku prečnika 5 mm, u obliku kalema i pričvršćena je za elektrode zapušača na kome se nalazi sistem za paljenje. Ovaj kalem treba da ima jedan od oblika koji su prikazani na Slici 3. Razmak između dna suda i donje strane provodnika pomoću koga se pali smeša treba da bude 20 mm. Ukoliko se elektrode ne mogu podešavati, krajevi provodnika pomoću koga se pali smeša i dna posude treba da budu izolovani keramičkom oblogom. Provodnik se zagreva stalnim izvorom struje od najmanje 10 A.
1.6.2. Postupak ispitivanjaXXXIV
Aparatura, spojena sa pretvaračem pritiska i sistemom za paljenje, ali bez sigurnosnog diska koji štiti od eksplozije, nalazi se na podlozi pri čemu je zapušač sa sistemom za paljenje u donjoj poziciji. U staklenoj čaši se pomeša 2,5 g tečnosti koja se ispituje sa 2,5 g osušene celuloze pomoću staklenog štapićaXXXV. Iz bezbednosnih razloga, prilikom mešanja lice koje rukuje smešom treba da bude zaštićeno sigurnosnim štitom. Ukoliko smeša počne da gori tokom mešanja ili stavljanja u posudu za ispitivanje, ispitivanje se ne mora sprovesti do kraja. Smeša se dodaje u malim količinama u sud pod pritiskom uz sabijanje. Vodi se računa da smeša bude postavljena oko provodnika pomoću koga se vrši paljenje smeše i da kontakt između smeše i provodnika bude dobar. Važno je da se provodnik ne iskrivi tokom procesa nanošenja smeše jer to može dovesti do pogrešnih rezultataXXXVI. Sigurnosni disk koji štiti od eksplozije stavlja se u odgovarajuću poziciju i pričvršćuje poklopcem za zaptivanje. Napunjen sud postavlja se na stalak tako da se sigurnosni disk koji štiti od eksplozije nalazi na vrhu, a aparat se postavlja u digestor ili u jedinicu za ispitivanje zapaljivih materija. Izvor struje pričvrsti se za spoljne kleme zapušača sa sistemom za paljenje i pusti se struja jačine 10 A. Vreme između pripreme smeše za ispitivanje i uključivanja struje ne treba da bude duže od 10 minuta.
Signal koji dolazi sa pretvarača pritiska beleži odgovarajući sistem koji istovremeno beleži podatke o razvoju pritiska tokom vremena i analizira ih (npr. program za beleženje podataka dobijenih tokom ispitivanja povezan sa programom za izradu grafikona). Smeša se zagreva sve dok ne pukne sigurnosni disk koji štiti od eksplozije ili najmanje 60 s. Ukoliko se sigurnosni disk koji štiti od eksplozije ne rasprsne, smeša se ostavlja da se ohladi pre nego što se aparat pažljivo rastavi, vodeći računa da može doći do pojave nadpritiska. Izvodi se po pet ispitivanja sa supstancom koja se ispituje i sa supstancom koja služi kao referentna supstanca. Beleži se vreme koje je potrebno da pritisak od 690 kPa poraste do pritiska od 2.070 kPa. Izračunava se srednja vrednost vremena koje protekne do porasta pritiska.
Može se dogoditi da supstanca dovodi do porasta pritiska (prebrzo ili presporo) usled hemijskih reakcija koje nisu karakteristične za oksidujuće osobine. Tada može biti potrebno da se ponovi ispitivanje sa nekom inertnom supstancom, npr dijatomejskom zemljom, umesto sa celulozom, kako bi se utvrdila priroda reakcije.
_______________
XXXIV Smeše oksidujućih supstanci sa celulozom potencijalno su eksplozivne i sa njima treba pažljivo rukovati.
XXXV U praksi se postiže pripremanjem smeše tečnosti koja se ispituje i celuloze u odnosu 1:1 u većoj količini od one koja je potrebna za ispitivanje i prebacivanjem 5±0,1 g u posudu pod pritiskom. Smeša treba da bude sveže pripremljena za svako ispitivanje.
XXXVI Kontakt između susednih namotaja treba izbegavati.
Vremena porasta pritiska ispitivane supstance i referentnih supstanci.
Vremena porasta pritiska inertne supstance ukoliko je takvo ispitivanje sprovedeno.
Izračunava se prosečno vreme porasta pritiska za ispitivanu supstancu i za referentne supstance.
Izračunava se i prosečno vreme porasta pritiska za inertnu supstancu (ukoliko su ispitivanja izvršena).
Primeri rezultata dati su u Tabeli 1.
Tabela 1.
Primeri rezultata(a)
Supstanca(b) | Prosečno vreme porasta |
Amonijum-dihromat, zasićeni vodeni rastvor | 20 800 |
Kalcijum-nitrat, zasićeni vodeni rastvor | 6 700 |
Feri-nitrat, zasićeni vodeni rastvor | 4 133 |
Litijum-perhlorat, zasićeni vodeni rastvor | 1 686 |
Magnezijum-perhlorat, zasićeni vodeni rastvor | 777 |
Nikal-nitrat, zasićeni vodeni rastvor | 6 250 |
Azotna kiselina, 65 % | 4 767(c) |
Perhlorna kiselina, 50 % | 121(c) |
Perhlorna kiselina, 55 % | 59 |
Kalijum nitrat, 30 % vodeni rastvor | 26 690 |
Srebro-nitrat, zasićeni vodeni rastvor | (d) |
Natrijum-hlorat, 40 % vodeni rastvor | 2 555(c) |
Natrijum-nitrat, 45 % vodeni rastvor | 4 133 |
Inertna supstanca |
|
Voda: celuloza | (d) |
_______________
(a) Videti u literaturi1 za klasifikaciju prema transportnoj šemi UN.
(b) Zasićeni rastvori treba da budu pripremljeni na 20°C.
(c) Srednja vrednost iz međulaboratorijskih uporednih ispitivanja.
(d) Maksimalni pritisak od 2070 kPa nije dostignut.
Izveštaj o ispitivanju sadrži podatke o:
- identitetu, sastavu, čistoći itd. podatke o supstanci koja se ispituje;
- koncentraciji ispitivane supstance;
- postupku sušenja celuloze koja je korišćena pri ispitivanju;
- sadržaju vode u celulozi koja je korišćena pri ispitivanju;
- rezultatima merenja;
- rezultatima ispitivanja sa inertnom supstancom, ako postoje;
- izračunatom prosečnom vremenu porasta pritiska;
- odstupanju od standardnog postupka ispitivanja i razloge za to;
- svim dodatnim informacijama i primedbama značajnim za tumačenje rezultata.
3.2. TUMAČENJE REZULTATAXXXVII
Rezultati ispitivanja procenjuju se na osnovu:
a) činjenice da li se smeša ispitivane supstance i celuloze spontano pali i
b) poređenjem prosečnih vremena porasta pritiska sa vrednosti 690 kPa na pritisak od 2.070 kPa ispitivane supstance i referentnih supstanci
Tečna supstanca smatra se oksidujućom supstancom ukoliko:
a) se smeša ispitivane supstance i celuloze u masenom odnosu 1:1 spontano pali ili
b) smeša ispitivane supstance i celuloze u masenom odnosu 1:1 ima prosečno vreme povećanja pritiska manje ili jednako smeši vodenog rastvora azotne kiseline 65 % (m/m) i celuloze u masenom odnosu 1:1.
Da bi se izbegao lažni pozitivni rezultat, prilikom analize dobijenih rezultata uzima se u razmatranje i ispitivanje sa inertnim materijalom.
______________
XXXVII Videti u literaturi1 za tumačenje rezultata koji su u okviru UN propisa o transportu za korišćenje nekoliko referentnih supstanci
1. Recommendations on the Transport of Dangerous Goods, Manual of Tests and Criteria. 3rd evised edition. UN Publication No: ST/SG/AC.10/11/Rev. 3, 1999, str. 342. Test O.2: Test for oxidising liquids.
Slika 1. Sud pod pritiskom
Pri čemu je:
A - Telo suda pod pritiskom;
B - Zadržni ventil diska koji štiti od eksplozije;
C - Zadržni ventil za vatru;
D - Zaptivač od mekog olova;
E - Disk koji štiti od eksplozije;
F - Ručka;
G - Glava prenosnika pritiska;
H - Zaptivač;
J - Izolovana elektroda;
K - Uzemljena elektroda;
L - Izolacija;
M - Čelična kupa;
N - Iskrivljeni žljeb zaptivača.
Slika 2. Oslonac
Slika 3. Sistem za paljenje
Pri čemu je:
A - Kalem za paljenje;
B - Izolacija;
C - Elektrode;
D - Zaptivač za vatru.
Napomena: Može se koristiti bilo koji od ovih sistema.
A. OPIS SVOJSTAVA ISPITIVANE SUPSTANCE
Pre početka studija toksičnosti treba znati sastav ispitivane supstance uključujući i glavne nečistoće i značajna fizička i hemijska svojstva uključujući stabilnost.
Fizička i hemijska svojstva ispitivane supstance važni su podaci za izbor puta primene, plana svake pojedinačne studije, kao i načina rukovanja i čuvanja ispitivane supstance.
Početku studije prethodi unapređivanje analitičke metode za kvalitativnu i kvantitativnu analizu ispitivane supstance (uključujući glavne nečistoće kada potrebno) u vehikulumu za primenu doze i biološkom materijalu.
U izveštaj o ispitivanju treba da budu uključeni svi podaci koje se odnose na identifikaciju, fizička i hemijska svojstva, čistoću i ponašanje ispitivane supstance.
Pri ispitivanju toksičnosti važna je stroga kontrola uslova smeštaja i tehnika o odgovarajućoj brizi o životinjama.
Uslovi smeštaja u prostorijama i kavezima za eksperimentalne životinje moraju da odgovaraju eksperimentalnoj vrsti koja se koristi. Za pacove, miševe i zamorce odgovarajući uslovi su: sobna temperatura od 22°C ± 3°C sa relativnom vlažnošću od 30% do 70%; a za kuniće temperatura treba da bude 20°C ± 3°C sa relativnom vlažnošću od 30% do 70%.
Neke eksperimentalne tehnike naročito su osetljive na efekte temperature i u tim slučajevima detalji odgovarajućih uslova uključeni su u opis metode ispitivanja.
U svim istraživanjima toksičnih efekata temperatura i vlažnost moraju da se prate, zabeleže i uključe u konačni izveštaj o ispitivanju.
Osvetljenje treba da bude veštačko sa smenjivanjem 12 sati svetla i 12 sati mraka. Detalji o osvetljenosti tokom eksperimenta beleže se i uključuju u konačni izveštaj o ispitivanju.
Ako nije drugačije propisano u metodi ispitivanja, životinje se mogu smestiti u odgovarajući smeštaj za pojedinačno i odvojeno držanje ili u kavezima u malim grupama istog pola. U slučaju grupnog smeštaja ne treba stavljati više od pet životinja u kavez.
U izveštaju o ispitivanju na životinjama važno je naznačiti tip kaveza i broj životinja smeštenih u svakom kavezu za vreme izlaganja hemikaliji i u svakom kasnijem periodu posmatranja.
Ishrana treba da zadovolji sve nutritivne zahteve vrste koja se koristi u ispitivanju. Kada se ispitivane supstance daju životinjama preko hrane, nutritivna vrednost može da bude smanjena usled međusobnog uticaja supstance i sastojaka hrane. Mogućnost ovakvog uticaja razmatra se pri tumačenju rezultata ispitivanja. Može se upotrebiti uobičajena laboratorijska hrana sa slobodnim pristupom vodi za piće. Na izbor hrane može da utiče potreba da se obezbedi odgovarajuća smeša ukoliko se ispitivana supstanca daje preko hrane.
Nečistoće u hrani za koje se zna da utiču na toksičnost ne bi trebalo da su prisutne u koncentracijama koje utiču na rezultate ispitivanja.
Evropska Unija promoviše razvoj i priznavanje alternativnih metoda koje mogu da daju isti nivo informacija kao sadašnja ispitivanja na životinjama, ali koje koriste manje životinja, izazivaju manje patnje ili izbegavaju upotrebu životinja.
Takve metode, kada budu dostupne, moraju se uzeti u obzir za karakterizaciju opasnosti i klasifikaciju koja sledi, kao i za obeležavanje opasnosti i procenu bezbednosti hemikalije kad god je to moguće.
Kada se ispitivanja procenjuju i tumače, moraju da se razmotre ograničenja direktne ekstrapolacije rezultata ispitivanja na životinjama i in vitro studija na čoveka, i zato se za potvrdu rezultata ispitivanja mogu, kada su dostupni, koristiti dokazi o štetnim efektima na ljude.
Većina ovih metoda razvijena je u okviru programa Organizacije za ekonomski razvoj i saradnju (u daljem tekstu: OECD) i sprovode se u skladu sa principima Dobre laboratorijske prakse, da bi se obezbedilo šire "uzajamno prihvatanje podataka".
Dodatne informacije mogu se naći u preporukama u OECD vodičima i literaturi.
B.1 bis. AKUTNA ORALNA TOKSIČNOST - METODA FIKSNIH DOZA
Ova metoda ispitivanja potpuno odgovara metodi OECD: TG 420 (2001).
U tradicionim metodama za određivanje akutne toksičnosti određene ispitivane supstance smrt životinja koristi se kao ciljni pokazatelj ispitivanja toksičnosti (endpoint). Britansko toksikološko udruženje predložilo je 1984. godine, na osnovu primene niza fiksnih doza1, novi pristup ispitivanja akutne toksičnosti. Ovaj pristup zasniva se na posmatranju jasnih znakova toksičnosti jednog od niza fiksnih doznih nivoa, kako bi se izbeglo uginuće životinja kao ciljni pokazatelj. Nakon in vivo validiranih ispitivanja (Velika Britanija2 i međunarodna3), postupak fiksnih doza je 1992. godine prihvaćen kao metoda ispitivanja. Kasnije su statistički podaci postupka fiksnih doza validirani pomoću matematičkih modela u nizu ispitivanja4,5,6. Zajedno su in vivo ispitivanja i studije na modelima pokazale da je postupak reproduktivan, koristi se manji broj životinja i u poređenju sa tradicionalnim metodama izaziva manju patnju životinja, a rangira toksičnost supstance podjednako dobro kao i druge razvijene metode ispitivanja akutne toksičnosti.
Uputstva za izbor najbolje metode ispitivanja za određenu namenu mogu se pronaći u literaturi7 koja sadrži dodatne informacije o izvođenju i tumačenju rezultata dobijenih metodom ispitivanja B.1bis.
Princip ove metode ispitivanja jeste da se u glavnom ispitivanju koriste samo umereno toksične doze, a izbegavaju potencijalno smrtonosne doze. Izbegava se i primena onih doza za koje je poznato da usled pojave korozivnog oštećenja ili jake iritacije izazivaju značajan bol ili stres kod životinja. Životinje koje su na samrti ili su jasno izložene intenzivnom bolu ili stresu, lišavaju se života na human način, a u konačnoj obradi rezultata tretiraju se na isti način kao i životinje koje uginu za vreme ispitivanja. U posebnom vodiču8 dati su kriterijumi prema kojima se životinje koje su na samrti ili jako pate lišavaju života, a definisani su i simptomi na osnovu kojih je lako prepoznati neminovnu smrt.
Ova metoda ispitivanja obezbeđuje podatke o opasnim svojstvima supstance i omogućava procenu i klasifikaciju prema Globalno harmonizovanom sistemu za klasifikaciju i obeležavanje UN (u daljem tekstu: GHS) u odnosu na akutnu toksičnost9.
Pre početka studije moraju se uzeti u obzir svi dostupni podaci o ispitivanoj supstanci. Podaci uključuju identitet i hemijsku strukturu supstance; njena fizička i hemijska svojstva; rezultate obavljenih in vitro ili in vivo ispitivanja toksičnosti; toksikološke podatke o strukturno sličnim supstancama; kao i predviđene načine korišćenja supstance. Ovi podaci ukazuju na važnost izvođenja studije za zaštitu zdravlja ljudi, a pomažu i pri izboru odgovarajuće početne doze.
Akutna oralna toksičnost jeste svojstvo hemikalije da izazove štetne efekte nakon primene pojedinačne peroralne doze ili nekoliko peroralnih doza u periodu od 24 sata.
Odložena smrt jeste uginuće životinja koje ne uginu ili nisu životno ugrožene tokom prvih 48 sati, već do uginuća dolazi u periodu posmatranja od 14 dana.
Doza jeste količina primenjene ispitivane supstance. Izražava se kao masa ispitivane supstance po jedinici telesne mase (TM) eksperimentalne životinje (mg/kg).
Evidentna toksičnost jeste toksični efekat kod koga se javljaju jasni znakovi toksičnosti nakon primene ispitivane supstance (za primere videti3), koji su toliko intenzivni da bi izlaganje sledećoj većoj fiksnoj dozi kod životinja verovatno dovelo do jakog bola, stresa, iscrpljenosti, stanja na samrti (kriterijumi su prikazani u Vodiču8 ili do smrtnog ishoda).
GHS jeste skraćenica za Globalno harmonizovan sistem za klasifikaciju, obeležavanje i pakovanje hemikalija UN. Razvoj ovog sistema je zajednički napor OECD, UN Komisije stručnjaka za transport opasnih hemikalija (fizička i hemijska svojstva) i Međunarodne organizacije rada (ILO), a koordinira ga Međuorganizacijski program za pravilno upravljanje hemikalijama (IOMC).
Neminovna smrt jeste očekivana smrt životinje koja je na samrti ili se njena smrt očekuje pre planiranog narednog vremena posmatranja. Simptomi koji ukazuju na ovo stanje kod glodara su konvulzije, lateralni položaj, ležeći položaj ili tremor (za detalje videti Vodič8).
LD50 (srednja smrtna doza) jeste statistički određena pojedinačna doza supstance za koju se očekuje da izaziva smrtnost kod 50 posto ispitivanih životinja kada se primeni peroralnim putem. Vrednost LD50 izražava se u jedinici mase ispitivane supstance po jedinici telesne mase eksperimentalne životinje (mg/kg).
Granična doza jeste gornja granična doza koja se koristi u ispitivanju (2.000 mg/kg ili 5.000 mg/kg).
Stanje na samrti jeste stanje definisano kao nemogućnost preživljavanja ili neminovna smrt životinje, čak i nakon eventualnog tretmana (za detalje videti Vodič8).
Predvidljiva smrt jeste stanje koje karakteriše prisutnost kliničkih znakova koji ukazuju na neminovnu smrt životinje pre završetka eksperimenta, na primer nemogućnost uzimanja vode ili hrane (za detalje videti Vodič8).
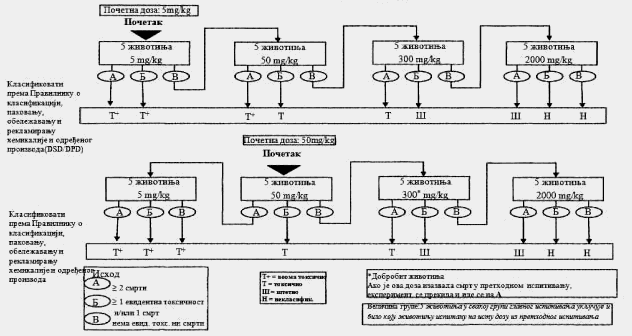
Na grupe životinja istog pola postupno se (korak po korak) primenjuju fiksne doze od 5 mg/kg, 50 mg/kg, 300 mg/kg i 2.000 mg/kg (izuzetno, može se razmotriti i primena još jedne fiksne doze od 5.000 mg/kg, videti odeljak 1.6.2. ove metode). Količina inicijalne doze bira se na osnovu prethodnih ispitivanja. Primenjuje se ona doza za koju se očekuje da će rezultirati nekim znakovima toksičnosti, pri čemu ova doza neće izazvati teško trovanje ili smrt. Klinički znakovi ili stanja koja upućuju na jak bol, patnju ili neminovnu smrt životinje detaljno su opisani u posebnom OECD Vodiču8. Nakon primene inicijalne doze grupe životinja koje se dalje uključuju u ispitivanje mogu se dozirati većim ili manjim fiksnim dozama, u zavisnosti od toga da li su prisutni znakovi koji ukazuju na toksičnost ili uginuće. Ovaj postupak se nastavlja do primene doze koja izaziva evidentnu toksičnost ili smrt najviše jedne životinje. Postupak se prekida kada najveća primenjena doza ne izazove toksične efekte ili kada najniža primenjena doza dovede do smrti životinja.
1.4.1. Izbor životinjske vrste
Preporučena vrsta glodara je pacov, iako se za ispitivanja koriste i druge životinjske vrste. Najčešće se koriste ženke7, jer je na osnovu literature koja se odnosi na ispitivanje LD50 uočeno da je mala razlika u osetljivosti polova pri primeni ove metode. U slučajevima u kojima je uočena razlika, ženke su pokazale nešto veću osetljivost10. Ako se u literaturi pronađu toksikološki ili toksikokinetički podaci za strukturno slične hemikalije koji ukazuju na to da su mužjaci osetljiviji na određenu ispitivanu supstancu, treba koristiti mužjake za ispitivanje. Kad se ispitivanje izvodi na mužjacima, navodi se opravdanost za njihovu primenu.
Ispitivanje se izvodi na zdravim mladim jedinkama onih laboratorijskih sojeva koji se uobičajeno koriste u ovakvim ispitivanjima. Ispitivanje se vrši na ženkama koje nisu ranije rađale i nisu gravidne. Svaka životinja, na početku ispitivanja i primene prvih doza ispitivane supstance, treba da bude stara između 8 i 12 nedelja, a njena telesna masa treba da bude u opsegu ± 20% od srednje vrednosti mase prethodno doziranih životinja.
1.4.2. Uslovi smeštaja i ishrana
Temperatura prostorije u kojoj se drže životinje treba da bude 22°C (± 3°C). Relativna vlažnost vazduha treba da iznosi najmanje 30%, ali ne više od 70% (osim kada se prostorije čiste). Idealno je vlažnost vazduha održavati između 50% i 60%. Osvetljenje treba da bude veštačko, i to u intervalima od 12 sati svetla i 12 sati mraka. Za ishranu se može primenjivati uobičajena hrana za laboratorijske životinje, sa slobodnim pristupom vodi za piće. Životinje se prema primenjenoj dozi ispitivane supstance mogu grupisati u kaveze. Broj životinja po kavezu ne sme ni na koji način da ometa proces praćenja i posmatranja svake životinje.
1.4.3. Priprema životinja
Životinje se biraju nasumce, obeležavaju radi lakšeg razlikovanja, a da bi se prilagodile na laboratorijske uslove drže se u kavezima najmanje pet dana pre početka eksperimenta i primene prve doze ispitivane supstance.
1.4.4. Priprema doza
Ispitivane supstance primenjuju se u konstantnim zapreminama, pa je neophodno prilagođavanje koncentracije za pripremanje različitih doza. Pri ispitivanju hemikalije u tečnom stanju, primena nerazblažene ispitivane supstance, odnosno supstance koja je u smeši u konstantnoj koncentraciji, može da bude značajna za kasniju procenu rizika od te supstance. Maksimalna pojedinačna zapremina doze ne sme da se prekorači. Maksimalna zapremina tečnosti koja sme da se primeni zavisi i od veličine eksperimentne životinje. Zapremina ispitivane supstance koja se primenjuje kod glodara ne bi smela da prelazi 1 ml/100g TM životinje; a ukoliko se primenjuje vodeni rastvor može se razmotriti i doza od 2 ml/100g TM životinje. Kad je reč o formulaciji i pripremi doze, prvenstveno se preporučuje primena vodenog rastvora/suspenzije/emulzije, a zatim rastvora/suspenzije/emulzije u ulju (npr. kukuruznom ulju) ili rastvor u nekom drugom vehikulumu. Za sve vehikulume osim vode, neophodno je znati njihove toksikološke karakteristike. Doze se pripremaju neposredno pre primene, osim ako se radi o supstanci za koju je poznato da je stabilna u rastvoru tokom dužeg vremenskog perioda.
1.5.1. Primena doza
Ispitivana supstanca primenjuje se u jednoj dozi sondom direktno u želudac ili intubiranjem kanilom. U posebnim okolnostima, kada jednokratna doza nije moguća, ispitivana supstanca može se primeniti u nekoliko manjih porcija tokom vremenskog perioda koji nije duži od 24 sata.
Pre početka primene doza ispitivane supstance, potrebno je izgladneti životinje (npr. pacovima je potrebno uskratiti hranu ali ne i vodu preko noći; miševima je potrebno uskratiti hranu ali ne i vodu na 3 do 4 sata). Nakon perioda gladovanja, potrebno je izmeriti telesnu masu životinja i primeniti ispitivanu supstancu. Nakon prve doze, hrana može ponovno da se uskrati, i to: kod pacova narednih 3 do 4 sata, a kod miševa naredna 1 do 2 sata. Kada se doza ispitivane supstance primeni u nekoliko manjih porcija u određenom vremenskom intervalu, može da se ukaže potreba za hranom i vodom ukoliko se radi o produženom vremenskom periodu.
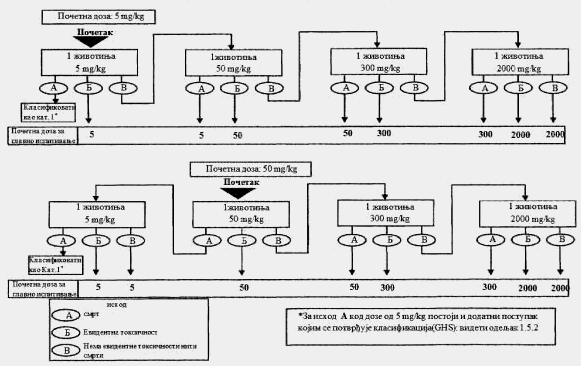
1.5.2. Prethodno ispitivanje
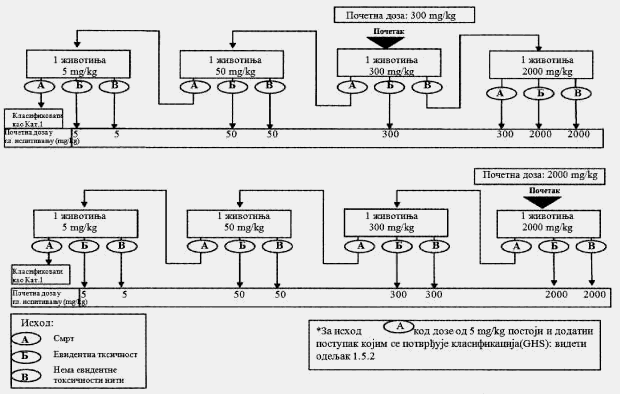
Cilj prethodnog ispitivanja životinja je određivanje odgovarajuće početne doze za glavno ispitivanje. Ispitivana supstanca primenjuje se na pojedinačnim životinjama postupno kao što je opisano u dijagramu toka ispitivanja koji je dat u Delu drugom ove metode. Prethodno ispitivanje je završeno kada je moguće doneti odluku o početnoj dozi (ili u slučajevima kada dođe do uginuća već kod najniže fiksne doze).
Početna doza za prethodno ispitivanje može da bude fiksni dozni nivo od 5 mg/kg, 50 mg/kg, 300 mg/kg i 2.000 mg/kg, a definisana je kao ona doza koje će izazvati jasne znakove toksičnosti, odabrana na osnovu podataka in vivo i in vitro ispitivanja za ispitivanu supstancu ili druge strukturno slične hemikalije. Ukoliko nema ovakvih podataka, za početnu dozu uzima se koncentracija od 300 mg/kg.
Potrebno je napraviti pauzu od najmanje 24 sata između primene doza ispitivane supstance kod svake pojedinačne životinje. Životinje je potrebno posmatrati kroz vremenski period od najmanje 14 dana.
Izuzetno, i samo u slučajevima kad to opravdavaju specifične potrebe, može da se razmotri primena još jedne veće fiksne doze od 5.000 mg/kg (videti Deo četvrti ove metode). Zbog dobrobiti životinja, ne preporučuje se ispitivanje na životinjama za klasifikaciju ispitivane supstance u Kategoriju 5 prema GHS-u (u opsegu doza od 2.000 mg/kg do 5.000 mg/kg), i razmatra se samo u slučajevima kada postoji velika verovatnoća da će rezultati ovakvog ispitivanja imati neposredan značaj za zaštitu zdravlja ljudi ili životne sredine.
U slučajevima kada u prethodnom ispitivanju već kod najniže primenjene fiksne doze (5 mg/kg) dođe do smrti eksperimentne životinje, uobičajen postupak je da se ispitivanje završi, a ispitivana supstanca klasifikuje u Kategoriju 1, prema GHS-u (kao što se može videti u Delu drugom ove metode). Ukoliko je potrebna dodatna potvrda za ovakvu klasifikaciju, može se sprovesti dodatno ispitivanje i to tako što se druga životinja dozira sa 5 mg/kg. Ako dođe do smrti i druge životinje, smatra se potvrđenom klasifikacija u Kategoriju 1 prema GHS-u, i obustavljaju se sva dalja ispitivanja. Ako druga životinja preživi, tada se na najviše tri dodatne životinje primenjuje doza od 5 mg/kg. Zbog visokog rizika od smrtnosti, naknadno uvedene životinje potrebno je uključivati u eksperiment jednu po jednu radi dobrobiti životinja. Vremenski razmak između doziranja kod pojedinačnih životinja treba da je dovoljno dugačak da može lako da se predvidi preživljavanje prethodne životinje. Ako ipak dođe do drugog slučaja smrti, mora odmah da se završi primena niza doza ispitivane supstance tako da se ispitivanje ne vrši dalje ni na jednoj životinji. Budući da pojava drugog slučaja uginuća (nevezano od broja životinja koje se ispituju u momentu kada se odluči da se eksperiment završi) spada pod ishod A koji je dat u Delu drugom ove metode (dve ili više smrti), primenjuje se klasifikaciono pravilo iz Dela trećeg ove metode pri fiksnoj dozi od 5 mg/kg (klasifikacija u Kategoriju 1 ako dođe do dve ili više slučaja smrti, ili u Kategoriju 2 ukoliko dođe do smrti kod jedne životinje). U Delu petom ove metode date su smernice za klasifikaciju prema Pravilniku o klasifikaciji, pakovanju, obeležavanju i oglašavanju hemikalije i određenog proizvoda ("Službeni glasnik RS", br. 59/10 i 25/11), dok ne počne sa primenom Pravilnika o klasifikaciji, pakovanju, obeležavanju i oglašavanju hemikalije i određenog proizvoda u skladu sa Globalno harmonizovanim sistemom za klasifikaciju i obeležavanje UN ("Službeni glasnik RS", br. 64/10 i 26/11).
1.5.3. Glavno ispitivanje
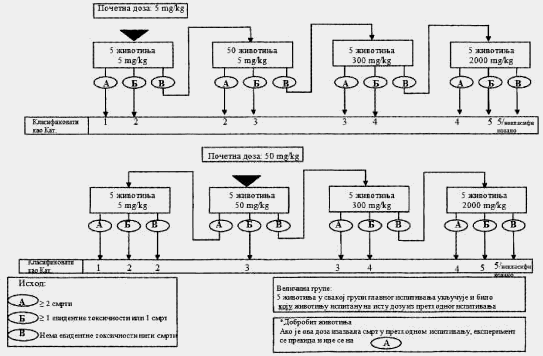
1.5.3.1. Broj životinja i dozni nivoi
Na dijagramu toka u Delu trećem ove metode prikazani su postupci koji se preduzimaju u ispitivanju nakon primene početnog doznog nivoa. Preduzima se jedan od tri koraka: prekid ispitivanja i klasifikacija u odgovarajuću klasu opasnosti ili ispitivanje većom fiksnom dozom ili ispitivanje manjom fiksnom dozom. Da bi se zaštitile životinje, dozni nivo koji je u prethodnom ispitivanju doveo do smrti životinje ne primenjuje se u glavnom ispitivanju (videti Deo treći ove metode). Iskustvo je pokazalo da je pri početnom doznom nivu najverovatniji ishod glavnog ispitivanja klasifikacija ispitivane supstance, tako da dalja ispitivanja nisu neophodna.
Za ispitivanje pri svakom doznom nivou koristi se ukupno pet životinja istog pola. Grupu od pet životinja čine jedna životinja iz prethodnog ispitivanja (kojoj je primenjena odabrana fiksna doza) i dodatne četiri životinje (osim u posebnim slučajevima kada se dozni nivo iz glavnog ispitivanja nije koristio u prethodnom ispitivanju).
Vremenski razmak između primene ispitivane supstance pri svakom doznom nivou određen je početkom, trajanjem i ozbiljnošću znakova toksičnosti. Tretman životinja sledećom dozom treba da se odloži sve dok se ne uverimo u preživljavanje prethodno tretiranih životinja. Potrebno je napraviti vremenski razmak od 3 do 4 dana između primene ispitivane supstance pri svakom doznom nivou, kako bi se omogućio dovoljno dug period za posmatranje eventualnih odloženih toksičnih reakcija. Ovaj vremenski interval može po potrebi da se menja, npr. u slučajevima u kojima su posmatranja nejasna. Kada se razmatra korišćenje fiksne doze od 5.000 mg/kg, potrebno je pratiti postupak koji je opisan u Delu četvrtom ove metode (videti odeljak 1.6.2. ove metode).
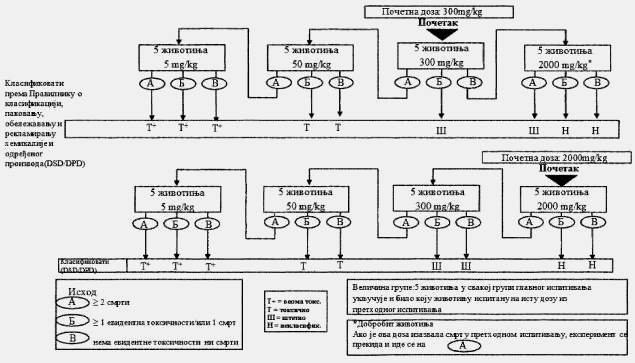
1.5.3.2. Ispitivanje granične doze
Ispitivanje granične doze primarno se koristi u situacijama u kojima istraživač ima podatke koji ukazuju da je ispitivana hemikalija verovatno netoksična, tj. da postaje toksična samo iznad propisanih graničnih doza. Podaci o toksičnosti ispitivane hemikalije mogu se preuzeti iz završenih ispitivanja sa sličnim supstancama ili smešama, ako se uzme u obzir identitet i koncentracija komponenata izražena u procentima, za koje se pouzdano zna da su toksikološki značajne. U slučajevima gde nema podataka o toksičnosti ili ih nema dovoljno, ili kada se očekuje da će ispitivana hemikalija biti toksična, potrebno je isplanirati i obaviti glavno ispitivanje.
Za ispitivanje granične doze koristi se već ustanovljen postupak, sa početnom dozom definisanom u prethodnom ispitivanju od 2.000 mg/kg (ili izuzetno 5.000 mg/kg) i sa naknadnim uvođenjem dodatne četiri eksperimentne životinje na koje će se primeniti ista doza.
Životinje se posmatraju pojedinačno nakon primene prve doze ispitivane supstance i to najmanje jednom tokom prvih 30 minuta i periodično tokom sledeća 24 sata, uz posebnu pažnju na prva 4 sata. Posmatranja se zatim obavljaju jedanput dnevno, u periodu od ukupno 14 dana, osim u slučajevima kada je životinju potrebno isključiti iz ispitivanja (ako je pronađena mrtva) ili je lišiti života na human način imajući u vidu dobrobit životinje. Trajanje posmatranja ne sme da bude strogo definisano, već ga određuju toksični efekti, početak i trajanje oporavka, a ukoliko postoji potreba može i da se produži. Važni su periodi u kojima se pojavljuju i nestaju prvi znaci toksičnosti, posebno ako se znaci toksičnosti javljaju odloženo11. Sva posmatranja sistematski se beleže, a za svaku životinju potrebno je voditi zasebni karton sa opažanjima.
Ako životinje neprekidno pokazuju znakove toksičnosti, potrebna su dodatna posmatranja. Potrebno je uključiti i promene na koži i krznu, očima i mukoznim membranama, kao i na respiratornom, cirkulatornom, autonomnom i centralnom nervnom sistemu, promene somatomotorne aktivnosti i promene ponašanja. Posebna pažnja mora da se obrati na pojavu tremora, konvulzija, salivacije, proliva, letargije, pospanosti i kome. Za definisanje ovih stanja koriste se principi i kriterijumi koji su dati u literaturi8. Životinje pronađene na samrti ili one koje trpe jak bol ili stres, lišavaju se života na human način. Kada su životinje lišene života iz humanih razloga ili su pronađene mrtve, potrebno je što preciznije zabeležiti vreme smrti.
1.6.1. Telesna masa
Individualna telesna masa životinja određuje se neposredno pre primene ispitivane supstance i najmanje jednom nedeljno nakon tog perioda. Beleže se i izračunavaju promene u telesnoj masi. Na kraju ispitivanja, meri se telesna masa preživelih životinja, a potom se lišavaju života na human način.
1.6.2. Patološka ispitivanja
Sve ispitivane životinje (uključujući i one koje uginu u toku ispitivanja ili su isključene iz ispitivanja zbog dobrobiti životinje) potrebno je postmortalno pregledati. Za svaku životinju beleže se sve značajne patološke promene. Mikroskopskim pregledom organa mogu se dobiti korisni podaci, pa je potrebno obaviti pregled organa koji su postmortalnim pregledom pokazali značajne patološke promene i to kod životinja koje su preživele 24 ili više sati nakon prve doze.
Potrebno je prikupiti podatke za svaku životinju. Svi podaci se tabelarno prikazuju, a za svaku ispitivanu grupu navodi se ukupan broj životinja u grupi, broj životinja koje su pokazale znakove toksičnosti, broj životinja koje su pronađene mrtve ili broj onih koje se lišavaju života na human način tokom ispitivanja, vreme smrti pojedinačnih životinja, opis i vremenski tok toksičnih efekata i njihovu reverzibilnost, kao i nalaze postmortalnog pregleda.
PISANJE IZVEŠTAJA
Izveštaj o ispitivanju sadrži:
1. Podatke o ispitivanoj supstanci:
- fizička svojstva, čistoću, i, kada je značajno, fizička i hemijska svojstva (uključujući izomerizaciju);
- identifikacione podatke koji uključuju i CAS broj.
2. Podatke o vehikulumu (ako je značajno):
- obrazloženje za izbor vehikuluma, ukoliko nije voda.
3. Podatke o eksperimentnoj životinji:
- vrsta/soj;
- mikrobiološki status životinje, ako je poznat;
- broj, starost i pol životinja (uključujući, kada je značajno, obrazloženje ukoliko se koriste mužjaci umesto ženki);
- izvor, uslove smeštaja, ishrane, itd.
4. Podatke o uslovima ispitivanja:
- detalje o formulaciji ispitivane supstance, uključujući fizičko stanje u kome je primenjena formulacija;
- detalje o primeni ispitivane supstance uključujući zapremine doza i vreme primene doze ispitivane supstance;
- detalje o kvalitetu hrane i vode uključujući detalje o vrsti i izvoru hrane i izvoru vode;
- obrazloženje za izbor početne doze.
5. Rezultate:
- tabelarni prikaz rezultata i primenjene doze za svaku životinju (životinje koje pokazuju znakove toksičnosti uključujući smrtnost, prirodu, intenzitet i trajanje toksičnih efekata);
- tabelarni prikaz telesne mase i promena telesne mase;
- individualnu telesnu masu životinja na dan primene doze ispitivane supstance, zatim u nedeljnim intervalima, i u vreme uginuća ili žrtvovanja;
- datum i vreme smrti, ako do nje dođe pre predviđenog žrtvovanja;
- vremenski tok pojave znakova toksičnosti, i da li su znakovi bili reverzibilni za svaku životinju;
- nalaze postmortalnih pregleda i histopatološki nalazi za svaku životinju, ukoliko su dostupni.
6. Diskusiju i tumačenje rezultata.
7. Zaključke.
1. British Toxicology Society Working Party on Toxicity (1984). Special report: a new approach to the classification of substances and preparations on the basis of their acute toxicity. Human Toxicol., 3, 85-92.
2. Van den Heuvel, M.J., Dayan, A.D. and Shillaker, R.O. (1987). Evaluation of the BTS approach to the testing of substances and preparations for their acute toxicity. Human Toxicol.‚ 6, 279-291.
3. Van den Heuvel, M.J., Clark, D.G., Fielder, R.J., Koundakjian, P.P., Oliver, G.J.A., Pelling, D., Tomlinson, N.J. and Walker, A.P. (1990). The international validation of a fixed-dose procedure as an alternative to the classical LD50 test. Fd. Chem. Toxicol. 28, 469-482.
4. Whitehead, A. and Curnow, R.N. (1992). Statistical evaluation of the fixed-dose procedure. Fd. Chem. Toxicol., 30, 313-324.
5. Stallard, N. and Whitehead, A. (1995). Reducing numbers in the fixed-dose procedure. Human Exptl. Toxicol. 14, 315-323. Human Exptl. Toxicol.
6. Stallard, N., Whitehead, A. and Ridgeway, P. (2002). Statistical evaluation of the revised fixed dose procedure. Hum. Exp. Toxicol., 21, 183 -196.
7. OECD (2001). Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris.
8. OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assesment N. 19.
9. OECD (1998). Harmonised Integrated Hazard Classification for Human Health and Environmental Effects of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p.11 [http://webnet1.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no-0,FF.html].
10. Lipnick, R.L., Cotruvo, J.A., Hill, R.N., Bruce, R.D., Stitzel, K.A., Walker, A.P., Chu, I., Goddard, M., Segal, L., Springer, J.A. and Myers, R.C. (1995). Comparison of the Up-and-Down, Conventional LD50, and Fixed-Dose Acute Toxicity Procedures. Fd. Chem. Toxicol. 33, 223-231.
11. Chan P.K and A.W. Hayes (1994) Chapter 16 Acute Toxicity and Eye Irritation. In: Principles and Methods of Toxicology. 3 rd Edition. A.W. Hayes, Editor. Raven Press, Ltd. New York, USA.
DIJAGRAM TOKA ZA PRETHODNO ISPITIVANJE
DIJAGRAM TOKA ZA GLAVNO ISPITIVANJE
KRITERIJUMI ZA KLASIFIKACIJU ISPITIVANIH SUPSTANCI SA OČEKIVANIM VREDNOSTIMA LD50 IZNAD 2.000 mg/kg ZA KOJE NIJE POTREBNO DODATNO ISPITIVANJE
Kriterijum za klasifikaciju u klasu opasnosti akutna toksičnost Kategorija 5 (po GHS-u) omogućava identifikovanje ispitivanih supstanci koje pokazuju nisku akutnu toksičnost, ali koje pod određenim okolnostima mogu da predstavljaju opasnost za osetljive populacije. Ove supstance imaju vrednosti LD50 (peroralno) i LD50 (dermalno) u opsegu doza od 2.000 mg/kg do 5.000 mg/kg ili potpuno odgovarajućih doza primenjenih drugim putevima unosa. Ispitivane supstance klasifikuju se u odgovarajuću kategoriju opasnosti (Kategorija 5 po GHS-u) ako je: 2.000 mg/kg < LD50 < 5.000 mg/kg, u sledećim slučajevima:
a) ako bilo koja od shema ispitivanja datih u Delu trećem ove metode upućuje na ovu kategoriju zbog učestalosti smrtnih slučajeva,
b) ako postoje pouzdani dokazi da je vrednost LD50 u opsegu vrednosti koji odgovara Kategoriji 5; ili ako druge studije toksičnosti sprovedene na životinjama ili ljudima ukazuju na potencijalne akutne toksične efekte na zdravlje ljudi,
v) ako se ekstrapolacijom, procenom ili merenjem podataka ne ustanovi pripadnost nekoj višoj klasi opasnosti, a:
- postoje pouzdani podaci koji ukazuju na značajne toksične efekte kod ljudi ili
- uoči se smrt pri ispitivanjima koja se vrše radi klasifikacije zaključno u Kategoriju 4, peroralnom primenom odgovarajuće doze ili
- stručnom procenom se potvrde značajni klinički znakovi toksičnosti, pri ispitivanjima koja se vrše radi klasifikacije zaključno u Kategoriju 4, pri čemu klinički znakovi ne uključuju proliv, piloerekciju ili zapušteni izgled ili
- se stručnom procenom potvrdi postojanje značajnih akutnih toksičnih efekata iz drugih ispitivanja sprovedenih na životinjama.
ISPITIVANJE DOZA IZNAD 2.000 mg/kg
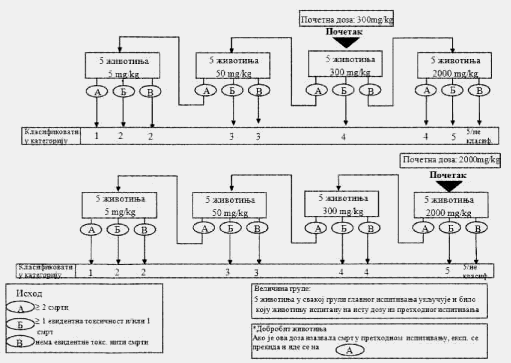
Izuzetno, u slučajevima kad to opravdavaju specifične potrebe, dodatno može da se razmotri primena fiksne doze od 5.000 mg/kg. Zbog zaštite životinja i njihove dobrobiti ne preporučuje se ispitivanje doze od 5.000 mg/kg. Primena ove doze razmatra se samo u slučajevima kad postoji velika verovatnoća da će rezultati ispitivanja imati značajan doprinos zaštiti zdravlja ljudi ili životinja9.
Pravila za primenu postupka koji se sastoji iz niza koraka koji je dat u Delu drugom ove metode, proširuju se na primenu doze od 5.000 mg/kg. Kada se u prethodnom ispitivanju koristi početna doza od 5.000 mg/kg, ishod A (smrt) zahteva ispitivanje i druge životinje na primenu doze od 2.000 mg/kg; ishodi B i V (evidentna toksičnost ili nema toksičnosti) dozvoljavaju primenu doze od 5.000 mg/kg kao početne doze u glavnom ispitivanju. Ako se ne koristi početna doza od 5.000 mg/kg, ispitivanje se nastavlja do primene doze od 5.000 mg/kg u slučaju ishoda pod B ili V pri dozi od 2.000 mg/kg; ako kod primenjene doze od 5.000 mg/kg dođe do ishoda A tada se u glavnom ispitivanju koristi početna doza od 2.000 mg/kg, a ishodi pod B i V nalažu početnu dozu od 5.000 mg/kg u glavnom ispitivanju.
Pravila za primenu postupka iz niza koraka koji je dat u Delu trećem ove metode, proširuju se na primenu doze od 5.000 mg/kg. Kada se u glavnom ispitivanju koristi početna doza od 5.000 mg/kg, ishod A (dve ili više smrti) uslovljava ispitivanje druge grupe životinja primenom doze od 2.000 mg/kg; dok ishod B (evidentna toksičnost i/ili jedna ili manje smrti) ili ishod V (nema toksičnosti) dovode do klasifikacije supstance prema GHS-u. Ako se ne koristi početna doza od 5.000 mg/kg, u slučaju ishoda V, pri dozi od 2.000 mg/kg, ispitivanje se nastavlja do primene doze od 5.000 mg/kg. Ishod A kod primenjene doze od 5.000 mg/kg dovodi do klasifikacije supstance u Kategoriju 5 (prema GHS-u). Ishodi B ili V dovode do nemogućnosti klasifikacije supstance.
METODA ISPITIVANJA B.1 bis-SMERNICE ZA KLASIFIKACIJU (PREUZETO IZ LITERATURE8)