
B.1 tris. AKUTNA ORALNA TOKSIČNOST - METODA ODREĐIVANJA KLASE AKUTNE TOKSIČNOSTI
Ova metoda ispitivanja potpuno odgovara metodi OECD: TG 423 (2001).
Metoda određivanja klase akutne toksičnosti1 koja je data u ovom ispitivanju jeste postupak (korak po korak) u kome se u svakom koraku koriste po tri životinje istog pola. U zavisnosti od smrtnosti odnosno stanja na samrti kod životinja, potrebno je da se prođe prosečno dva do četiri koraka da bi se doneo zaključak o akutnoj toksičnosti ispitivane supstance. Ovaj postupak je reproduktivan (ponovljiv), koristi veoma mali broj životinja i daje mogućnost klasifikacije supstanci na sličan način kao i ostale metode ispitivanja akutne toksičnosti. Metoda određivanja klase akutne toksičnosti zasnovana je na biometrijskim evaluacijama2, 3, 4, 5 sa fiksnim dozama koje su razdvojene na odgovarajući način kako bi se omogućilo rangiranje supstance za potrebe klasifikacije i procenu opasnosti. Kada je ova metoda ispitivanja usvojena, 1996. godine, bila je u velikoj meri validirana u in vivo ispitivanjima u odnosu na podatke o vrednosti LD50 koji su dobijeni iz nacionalne6 i međunarodne7 literature.
Uputstvo za izbor najpogodnije metode ispitivanja za određenu svrhu može se pronaći u literaturi8. Ovaj dokument sadrži i dodatne informacije o izvođenju i tumačenju rezultata dobijenih metodom ispitivanja B.1 tris.
Ispitivane supstance ne treba primenjivati na životinje u dozama za koje je poznato da izazivaju vidljiv bol i iscrpljenost usled korozivnog ili jakog iritativnog efekta. Životinje koje su na samrti, koje očito trpe jake bolove ili pokazuju znakove trajne iscrpljenosti lišavaju se života na human način, i pri tumačenju rezultata ispitivanja uzimaju se u obzir kao i životinje koje su uginule tokom ispitivanja. Kriterijum za donošenje odluke o lišavanju života bolesne ili životinje na samrti, kao i uputstva za prepoznavanje predstojeće i predvidljive smrti dati su u literaturi9.
U ovoj metodi ispitivanja koriste se unapred određene doze, a rezultati ispitivanja omogućavaju da se supstanca rangira i klasifikuje prema Pravilniku o klasifikaciji, pakovanju, obeležavanju i oglašavanju hemikalije i određenog proizvoda u skladu sa globalno harmonizovanim sistemom za klasifikaciju i obeležavanje UN odnosno GHS10.
Metoda ispitivanja nije namenjena izračunavanju precizne vrednosti LD50, ali omogućava utvrđivanje definisanih opsega doza gde je letalitet očekivan, jer se i u ovoj metodi kao ciljni pokazatelj ispitivanja još uvek koristi smrt određenog procenta životinja. Metoda ispitivanja omogućava određivanje vrednosti LD50 samo u slučaju kada najmanje dve primenjene doze dovode do letaliteta koji je viši od 0% a manji od 100%. Korišćenje unapred određenih doza koje su izabrane nezavisno od ispitivane supstance, zajedno sa klasifikacijom koja je jasno povezana sa brojem životinja posmatranih u različitim okolnostima, povećava mogućnost konzistentnih izveštaja i ponovljivost.
Pre početka studije moraju se uzeti u obzir svi dostupni podaci o ispitivanoj supstanci. Podaci uključuju identitet i hemijsku strukturu supstance, njena fizička i hemijska svojstva, rezultate drugih in vivo ili in vitro ispitivanja toksičnosti, toksikološke podatke strukturno sličnih supstanci, kao i predviđene načine korišćenja supstance. Ovi podaci su neophodni da bi se ukazalo na važnost izvođenja studije za zaštitu zdravlja ljudi, a pomažu i pri izboru odgovarajuće početne doze.
Akutna oralna toksičnost jeste svojstvo hemikalije da izazove štetne efekte nakon primene pojedinačne peroralne doze ili nekoliko peroralnih doza u periodu od 24 sata.
Odložena smrt jeste uginuće životinja koje ne uginu ili nisu životno ugrožene tokom prvih 48 sati, već do uginuća dolazi u periodu posmatranja od 14 dana.
Doza jeste količina primenjene ispitivane supstance. Izražava se kao masa ispitivane supstance po jedinici telesne mase eksperimentalne životinje (mg/kg).
Evidentna toksičnost jeste toksični efekat kod koga se javljaju jasni znakovi toksičnosti nakon primene ispitivane supstance (za primere videti3), koji su toliko intenzivni da bi izlaganje sledećoj većoj fiksnoj dozi kod životinja verovatno dovelo do jakog bola, stresa, iscrpljenosti, stanja na samrti (kriterijumi su prikazani u Vodiču8) ili smrtnog ishoda.
GHS jeste skraćenica za Globalno harmonizovan sistem za klasifikaciju, obeležavanje i pakovanje hemikalija UN. Razvoj ovog sistema je zajednički napor OECD, UN Komisije stručnjaka za transport opasnih hemikalija (fizička i hemijska svojstva) i Međunarodne organizacije rada (ILO), a koordinira ga Međuorganizacijski program za pravilno upravljanje hemikalijama (IOMC).
Neminovna smrt jeste očekivana smrt životinje koja je na samrti ili se njena smrt očekuje pre planiranog narednog vremena posmatranja. Simptomi koji ukazuju na ovo stanje kod glodara su konvulzije, lateralni položaj, ležeći položaj ili tremor (za detalje videti Vodič8).
LD50 (srednja smrtna doza) jeste statistički određena pojedinačna doza supstance za koju se očekuje da izaziva smrtnost kod 50 posto ispitivanih životinja kada se primeni peroralnim putem. Vrednost LD50 izražava se u jedinici mase ispitivane supstance po jedinici telesne mase eksperimentalne životinje (mg/kg).
Granična doza jeste gornja granična doza koja se koristi u ispitivanju (2.000 mg/kg ili 5.000 mg/kg).
Stanje na samrti jeste stanje definisano kao nemogućnost preživljavanja ili neminovna smrt životinje, čak i nakon eventualnog tretmana (za detalje videti Vodič 8).
Predvidljiva smrt jeste stanje koje karakteriše prisutnost kliničkih znakova koji ukazuju na neminovnu smrt životinje pre završetka eksperimenta, na primer nemogućnost uzimanja vode ili hrane (za detalje videti Vodič8).
Princip ispitivanja koje je zasnovano na postupku (korak po korak) uz korišćenje minimalnog broja životinja po koraku, jeste da se prikupi dovoljno podataka o akutnoj toksičnosti ispitivane supstance kako bi se omogućila njena klasifikacija. Supstanca se daje grupi eksperimentnih životinja peroralno u jednoj od određenih doza. Supstanca se ispituje primenom postupka (korak po korak), pri čemu se u svakom koraku koriste tri životinje istog pola (uglavnom ženke). Izostanak ili prisustvo znakova koji upućuju na smrt kod životinja kojima se primenjuje doza u jednom od koraka određuje sledeći korak postupka, odnosno:
- da dalja ispitivanja nisu potrebna,
- potrebu primene iste doze na dodatne tri životinje,
- potrebu primene sledeće više ili niže doze na dodatne tri životinje.
Detalji postupka ispitivanja dati su u Delu drugom ove metode. Ova metoda ispitivanja omogućava da se donese zaključak o klasifikaciji, pri čemu se u obzir uzima klasifikacija ispitivane supstance u jednu od niza klasa toksičnosti koje su definisane po fiksnim LD50 graničnim vrednostima.
1.4.1. Izbor životinjske vrste
Preporučena vrsta glodara je pacov, iako se za ispitivanja koriste i druge životinjske vrste. Najčešće se koriste ženke9 jer je na osnovu literature koja se odnosi na ispitivanje LD50 uočeno da je mala razlika u osetljivosti polova pri primeni ove metode. U slučajevima u kojima je uočena razlika, ženke su pokazale nešto veću osetljivost11. Ako se u literaturi nađu toksikološki ili toksikokinetički podaci za strukturno slične hemikalije koji ukazuju na to da su mužjaci osetljiviji na određenu ispitivanu supstancu, treba koristiti mužjake za ispitivanje. Kad se ispitivanje izvodi na mužjacima, navodi se opravdanost za njihovu primenu.
Ispitivanje se izvodi na zdravim mladim jedinkama onih laboratorijskih sojeva koji se uobičajeno koriste u ovakvim ispitivanjima. Ispitivanje se vrši na ženkama koje nisu ranije rađale i koje nisu gravidne. Svaka životinja na početku eksperimenta i primene prvih doza ispitivane supstance treba da bude stara između 8 i 12 nedelja, a njena telesna masa treba da bude u opsegu ± 20 % od srednje vrednosti mase prethodno doziranih životinja.
1.4.2. Uslovi smeštaja i ishrana
Temperatura prostorije u kojima se drže životinje treba da bude 22°C (± 3°C). Relativna vlažnost vazduha treba da iznosi najmanje 30%, ali ne više od 70% (osim kad se prostorije čiste), a idealno je vlažnost vazduha održavati između 50% i 60%. Osvetljenje treba da bude veštačko, i to u intervalima od 12 sati svetla i 12 sati mraka. Za ishranu se može primenjivati uobičajena hrana za laboratorijske životinje, sa slobodnim pristupom vodi za piće. Životinje se prema primenjenoj dozi ispitivane supstance mogu grupisati u kaveze. Broj životinja po kavezu ne sme ni na koji način da ometa proces praćenja i posmatranja svake životinje.
1.4.3. Priprema životinja
Životinje se biraju nasumce, obeležavaju radi lakšeg razlikovanja, a da bi se prilagodile na laboratorijske uslove drže se u kavezima najmanje pet dana pre početka eksperimenta i primene prve doze ispitivane supstance.
1.4.4. Priprema doza
Ispitivane supstance primenjuju se u konstantnim zapreminama, pa je neophodno prilagođavanje koncentracije za pripremanje različitih doza. Pri ispitivanju hemikalije u tečnom stanju, primena nerazblažene ispitivane supstance, odnosno supstance koja je u smeši u konstantnoj koncentraciji, može da bude značajna kasniju procenu rizika od te supstance. Maksimalna pojedinačna zapremina doze ne sme da se prekorači. Maksimalna zapremina tečnosti koja sme da se primeni zavisi i od veličine eksperimentne životinje. Zapremina ispitivane supstance koja se primenjuje kod glodara ne sme da prelazi 1 ml/100 g TM životinje, a ukoliko se primenjuje vodeni rastvor može se razmotriti i doza od 2 ml/100 g TM životinje. Kad je reč o formulaciji i pripremi doze, prvenstveno se preporučuje primena vodenog rastvora/suspenzije/emulzije, a zatim rastvora/suspenzije/emulzije u ulju (npr. kukuruznom ulju) ili rastvor u nekom drugom vehikulumu. Za sve vehikulume osim vode, neophodno je znati njihove toksikološke karakteristike. Doze se pripremaju neposredno pre primene, osim ako se radi o supstanci za koju je poznato da je stabilna u rastvoru tokom dužeg vremenskog perioda.
1.5.1. Primena doza
Ispitivana supstanca primenjuje se u jednoj dozi sondom direktno u želudac ili intubiranjem kanilom. U posebnim okolnostima, kada jednokratna doza nije moguća, ispitivana supstanca može se primeniti u nekoliko manjih porcija tokom vremenskog perioda koji nije duži od 24 sata.
Pre početka primene doza ispitivane supstance potrebno je izgladneti životinje (npr. pacovima je potrebno uskratiti hranu ali ne i vodu preko noći; miševima je potrebno uskratiti hranu ali ne i vodu na 3 do 4 sata). Nakon perioda gladovanja, potrebno je izmeriti telesnu masu životinja i primeniti ispitivanu supstancu. Nakon prve doze, hrana može ponovno da se uskrati, i to: kod pacova narednih 3 do 4 sata, a kod miševa naredna 1 do 2 sata. Kada se doza ispitivane supstance primeni u nekoliko manjih porcija u određenom vremenskom intervalu, može da se ukaže potreba za hranom i vodom ukoliko se radi o produženom vremenskom periodu.
1.5.2. Broj životinja i dozni nivoi
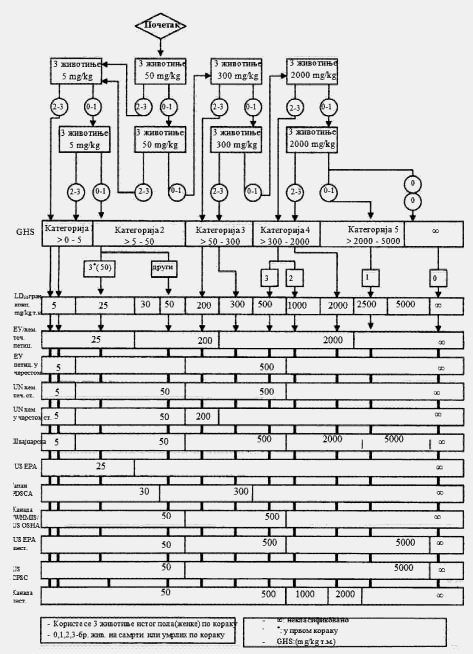
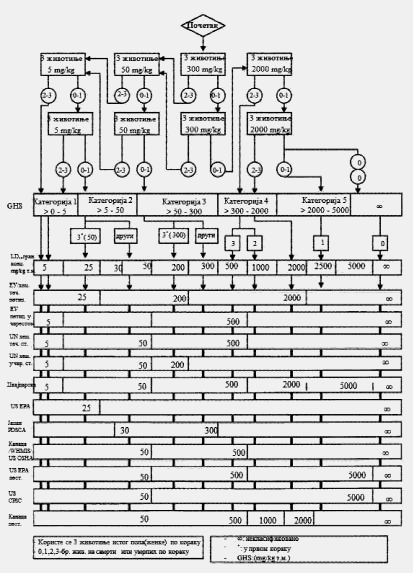
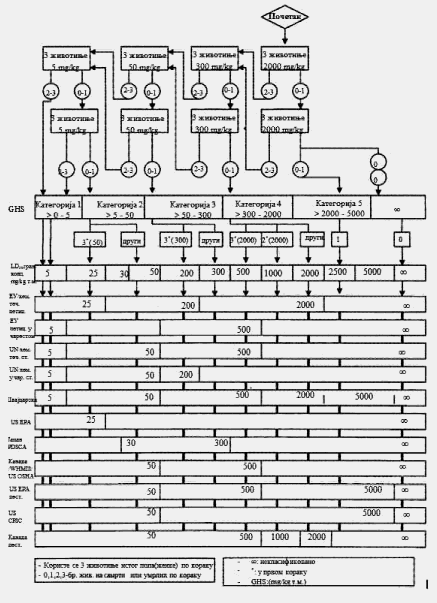
U svakom koraku koriste se po tri životinje. Dozni nivo koji će se koristiti kao početna doza jeste jedna od fiksnih doza od 5 mg/kg, 50 mg/kg, 300 mg/kg i 2.000 mg/kg TM. Početni dozni nivo jeste doza koja sa najvećom verovatnoćom treba da izazove smrt kod nekih od uključenih životinja. Dijagrami toka ispitivanja koji su dati u Delu drugom ove metode, opisuju postupak koji treba da se prati pri primeni svake početne doze. U Delu osmom ove metode date su smernice za klasifikaciju prema Pravilniku o klasifikaciji, pakovanju, obeležavanju i oglašavanju hemikalije i određenog proizvoda ("Službeni glasnik RS", br. 59/10 i 25/11), dok ne počne sa primenom Pravilnika o klasifikaciji, pakovanju, obeležavanju i oglašavanju hemikalije i određenog proizvoda u skladu sa Globalno harmonizovanim sistemom za klasifikaciju i obeležavanje UN ("Službeni glasnik RS", br. 64/10 i 26/11).
Ukoliko dostupni podaci ukazuju da pri primeni najviše početne doze (2.000 mg/kg TM) verovatno neće doći do smrti životinja, treba obaviti ispitivanje granične doze. Kad nema podataka o ispitivanoj supstanci, preporučeno je, zbog dobrobiti životinja, da početna doza bude od 300 mg/kg TM.
Vremenski razmak između primene ispitivane supstance pri svakom doznom nivou određen je početkom, trajanjem i ozbiljnošću znakova toksičnosti. Tretman životinja sledećom dozom treba da se odloži sve dok se ne uverimo u preživljavanje prethodno tretiranih životinja.
Izuzetno, i samo u slučajevima kada to opravdavaju specifične potrebe, može da se razmotri primena dodatnog doznog nivoa od 5.000 mg/kg TM (videti Deo sedmi ove metode). Zbog dobrobiti životinja, ne preporučuje se ispitivanje na životinjama radi klasifikacije ispitivane supstance u Kategoriju 5 (prema GHS-u) u opsegu doza od 2.000 mg/kg do 5000 mg/kg, i razmatra se samo u slučajevima kada postoji velika verovatnoća da će rezultati ispitivanja imati neposredan značaj za zaštitu zdravlja ljudi, životinja i životne sredine.
1.5.3. Ispitivanje granične doze
Ispitivanje granične doze primarno se koristi u situacijama kada istraživač ima pouzdane podatke da je ispitivana hemikalija netoksična, tj. da postaje toksična samo iznad propisanih graničnih doza. Podaci o toksičnosti ispitivanih hemikalija mogu se preuzeti iz završenih ispitivanja na sličnim hemikalijama, ako se uzme u obzir identitet i procenat komponenata za koje se pouzdano zna da su toksikološki značajne. U slučajevima gde nema podataka o toksičnosti ili ih nema dovoljno, ili kada se očekuje da će ispitivana hemikalija biti toksična, potrebno je isplanirati i obaviti glavno ispitivanje.
Ispitivanje granične doze, pri doznom nivou od 2.000 mg/kg TM, može se sprovesti na šest životinja (tri životinje po koraku) ili, izuzetno, pri doznom nivou od 5.000 mg/kg TM uvođenjem tri životinje po koraku (videti Deo sedmi ove metode). Ukoliko se pokaže da je smrt životinja povezana sa primenom ispitivane supstance potrebno je da se sprovede dalje ispitivanje i pri nižem doznom nivou.
Životinje se posmatraju pojedinačno nakon primene prve doze ispitivane supstance i to najmanje jednom tokom prvih 30 minuta i periodično tokom sledeća 24 sata, uz posebnu pažnju i naglasak na prva 4 sata. Posmatranja se zatim obavljaju jednom dnevno, u periodu od ukupno 14 dana, osim u slučajevima kada je životinju potrebno isključiti iz ispitivanja (ako je pronađena mrtva) ili je lišiti života na human način imajući u vidu dobrobit životinje. Trajanje posmatranja ne sme da bude strogo definisano, već ga određuju toksični efekti, početak i trajanje oporavka, a ukoliko postoji potreba može i da se produži. Važni su periodi u kojima se pojavljuju i nestaju prvi znaci toksičnosti, posebno ako se znaci toksičnosti javljaju odloženo12. Sva posmatranja sistematski se beleže, a za svaku životinju potrebno je voditi zasebni karton sa opažanjima.
Ako životinje neprekidno pokazuju znakove toksičnosti, potrebna su dodatna posmatranja. Potrebno je uključiti i promene na koži i krznu, očima i mukoznim membranama, kao i na respiratornom, cirkulatornom, autonomnom i centralnom nervnom sistemu, promene somatomotorne aktivnosti i promene ponašanja. Posebna pažnja mora da se obrati na pojavu tremora, konvulzija, salivacije, proliva, letargije, pospanosti i kome. Za definisanje ovih stanja koriste se principi i kriterijumi koji su dati u literaturi9. Životinje pronađene na samrti ili one koje trpe jak bol ili stres, lišavaju se života na human način. Kada su životinje lišene života iz humanih razloga ili pronađene mrtve, potrebno je što preciznije zabeležiti vreme smrti.
1.6.1. Telesna masa
Individualna telesna masa životinja određuje se neposredno pre primene ispitivane supstance i najmanje jednom nedeljno nakon tog perioda. Beleže se i izračunavaju i promene u telesnoj masi. Na kraju ispitivanja meri se telesna masa preživelih životinja, a potom se lišavaju života na human način.
1.6.2. Patološka ispitivanja
Sve ispitivane životinje (uključujući i one koje uginu za vreme ispitivanja ili su isključene iz ispitivanja zbog dobrobiti životinje) potrebno je postmortalno pregledati. Sve značajne patološke promene beleže se za svaku životinju. Mikroskopskim pregledom organa mogu se dobiti korisni podaci, pa je potrebno obaviti pregled organa koji su postmortalnim pregledom pokazali značajne patološke promene i to kod onih životinja koje su preživele 24 ili više sati nakon prve doze.
Potrebno je prikupiti podatke za svaku životinju. Svi podaci se tabelarno prikazuju, a za svaku ispitivanu grupu navodi se ukupan broj životinja u grupi, broj životinja koje su pokazale znakove toksičnosti, broj životinja koje su pronađene mrtve ili broj onih koje se lišavaju života na human način tokom ispitivanja, vreme smrti pojedinačnih životinja, opis i vremenski tok toksičnih efekata i njihovu reverzibilnost, kao i nalaze postmortalnog pregleda.
Izveštaj sadrži:
1. Podatke o ispitivanoj supstanci:
- fizička svojstva, čistoća, i kada je značajno, fizička i hemijska svojstva (uključujući izomerizaciju);
- identifikacione podatke, koji uključuju i CAS broj.
2. Podatke o vehikulumu (ako je značajno):
- obrazloženje za izbor vehikuluma, ukoliko nije voda.
3. Podatke o eksperimentalnoj životinji:
- vrsta/soj;
- mikrobiološki status životinje, ako je poznat;
- broj, starost i pol životinja (uključujući, kada je značajno, obrazloženje ukoliko se koriste mužjaci umesto ženki);
- izvor, uslove smeštaja, ishrane, itd.
4. Podatke o uslovima ispitivanja:
- detalje o formulaciji ispitivane supstance, uključujući fizičko stanje u kome je primenjena formulacija;
- detalje o primeni ispitivane supstance koji uključuju zapremine doza i vreme primene doze ispitivane supstance;
- detalje o kvalitetu hrane i vode (uključujući detalje o vrsti i izvoru hrane i izvoru vode);
- obrazloženje za izbor početne doze.
5. Rezultate:
- tabelarni prikaz rezultata i primenjene doze za svaku životinju (životinje koje pokazuju znakove toksičnosti uključujući smrtnost, prirodu, intenzitet i trajanje toksičnih efekata);
- tabelarni prikaz telesne mase i promena telesne mase;
- individualnu telesnu masu životinja na dan primene doze ispitivane supstance, zatim u nedeljnim intervalima, i u vreme uginuća ili žrtvovanja;
- datum i vreme smrti, ako do nje dođe pre predviđenog žrtvovanja;
- vremenski dijagram pojave znakova toksičnosti, kao i da li su znakovi bili reverzibilni za svaku životinju;
- nalaze postmortalnih pregleda i histopatološke nalaze za svaku životinju, ukoliko su dostupni.
6. Diskusiju i tumačenje rezultata.
7. Zaključke.
1. Roll R., Höfer-Bosse Th. And Kayser D. (1986). New Perspectives in Acute Toxicity Testing of Chemicals. Toxicol. Lett., Suppl. 31, 86.
2. Roll R., Riebschläger M., Mischke U. and Kayser D. (1989). Neue Wege zur Bestimmung der akuten Toxizität von Chemikalien. Bundesgesundheitsblatt 32, 336-341.
3. Diener W., Sichha L., Mischke U., Kayser D. and Schlede E. (1994). The Biometric Evaluation of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 68, 559-610.
4. Diener W., Mischke U., Kayser D. and Schlede E. (1995). The Biometric Evaluation of the OECD Modified Version of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, 729-734.
5. Diener W., and Schlede E. (1999) Acute Toxicity Class Methods: Alterations to LD/LC50 Tests. ALTEX 16, 129-134.
6. Schlede E., Mischke U., Roll R. and Kayser D. (1992). A National Validation Study of the Acute-Toxic- Class Method - An Alternative to the LD50 Test. Arch. Toxicol. 66, 455-470.
7. Schlede E., Mischke U., Diener W. and Kayser D. (1994). The International Validation Study of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, 659-670.
8. OECD (2001) Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris.
9. OECD (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment N 19.
10. OECD (1998) Harmonized Integrated Hazard Classification System For Human Health And Environmental Effects Of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p. 11 [http://webnet1.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no-0,FF.html].
11. Lipnick R L, Cotruvo, J A, Hill R N, Bruce R D, Stitzel K A, Walker A P, Chu I; Goddard M, Segal L, Springer J A and Myers R C (1995) Comparison of the Up and Down, Conventional LD50, and Fixed Dose Acute Toxicity Procedures. Fd. Chem. Toxicol 33, 223-231.
12. Chan P.K. and A.W. Hayes. (1994). Chap. 16. Acute Toxicity and Eye Irritancy. Principles and Methods of Toxicology. Third Edition. A.W. Hayes, Editor. Raven Press, Ltd., New York, USA.
U ovom Delu date su sheme ispitivanja za svaku početnu dozu:
- Deo treći: Početna doza je 5 mg/kg TM
- Deo četvrti: Početna doza je 50 mg/kg TM
- Deo peti: Početna doza je 300 mg/kg TM
- Deo šesti: Početna doza je 2000 mg/kg TM
U zavisnosti od broja životinja koje su lišene života na human način postupak ispitivanja označen je strelicama.
POSTUPAK ISPITIVANJA SA POČETNOM DOZOM OD 5 mg/kg TELESNE MASE

POSTUPAK ISPITIVANJA SA POČETNOM DOZOM OD 50 mg/kg TELESNE MASE

POSTUPAK ISPITIVANJA SA POČETNOM DOZOM OD 300 mg/kg TELESNE MASE
POSTUPAK ISPITIVANJA SA POČETNOM DOZOM OD 2000 mg/kg TELESNE MASE
KRITERIJUMI ZA KLASIFIKACIJU ISPITIVANIH SUPSTANCI SA OČEKIVANIM VREDNOSTIMA LD50 IZNAD 2.000 mg/kg ZA KOJE NIJE POTREBNO DODATNO ISPITIVANJE
Kriterijum za klasifikaciju u klasu opasnosti akutna toksičnost Kategorija 5 (po GHS-u) omogućava identifikovanje ispitivanih supstanci koje pokazuju nisku akutnu toksičnost, ali koje pod određenim okolnostima mogu da predstavljaju opasnost za osetljive populacije. Ove supstance imaju vrednosti LD50 (peroralno) i LD50 (dermalno) u opsegu doza od 2.000 mg/kg do 5.000 mg/kg ili potpuno odgovarajućih doza primenjenih drugim putevima unosa. Ispitivane supstance klasifikuju se u odgovarajuću kategoriju opasnosti (Kategorija 5 po) ako je: 2.000 mg/kg < LD50 < 5.000 mg/kg, u sledećim slučajevima:
a) ako bilo koja od shema ispitivanja datih u Delovima trećem, četvrtom, petom i šestom ove metode upućuje na ovu kategoriju zbog učestalosti smrtnih slučajeva,
b) ako postoje pouzdani dokazi da je vrednost LD50 u opsegu vrednosti koji odgovara kategoriji 5; ili ako druge studije toksičnosti sprovedene na životinjama ili ljudima ukazuju na potencijalne akutne toksične efekte na zdravlje ljudi,
v) ako se ekstrapolacijom, procenom ili merenjem podataka ne ustanovi pripadnost nekoj višoj klasi opasnosti, a:
- postoje pouzdani podaci koji ukazuju na značajne toksične efekte kod ljudi ili
- se uoči smrt pri ispitivanjima koja se vrše radi klasifikacije zaključno u Kategoriju 4, peroralnom primenom odgovarajuće doze ili
- se stručnom procenom potvrde značajni klinički znakovi toksičnosti, pri ispitivanjima koja se vrše radi klasifikacije zaključno u Kategoriju 4, pri čemu klinički znakovi ne uključuju proliv, piloerekciju ili zapušteni izgled ili
- se stručnom procenom potvrdi postojanje značajnih akutnih toksičnih efekata iz drugih ispitivanja sprovedenih na životinjama.
Ispitivanje doza iznad 2.000 mg/kg
Zbog zaštite životinja i njihove dobrobiti ne preporučuje se ispitivanje doze od 5.000 mg/kg za klasifikaciju u klasu opasnosti akutna toksičnost Kategorije 5 (po GHS-u). Primena ove doze razmatra se samo u slučajevima kad postoji velika verovatnoća da će rezultati ispitivanja imati značajan doprinos zaštiti zdravlja ljudi ili životinja10. Dalja ispitivanja sa primenom visokih doza se ne izvode.
Kada se ispituje doza od 5.000 mg/kg dovoljan je samo jedan korak (npr. tri životinje). Ako ugine prva životinja kojoj se primenjuje ispitivana supstanca, doza se spušta na 2.000 mg/kg prema pravilima datim u shemi iz Dela drugog ove metode. Ako prva životinja preživi, u ispitivanje se uključuju dodatne dve životinje. Ako ugine samo jedna od tri životinje, pretpostavlja se da je vrednost LD50 iznad 5.000 mg/kg. Ako uginu dve životinje, nastavlja se primena ispitivane supstance u dozi od 2.000 mg/kg.
METODA ISPITIVANJA B.1 tris-SMERNICE ZA KLASIFIKACIJU (PREUZETO IZ LITERATURE8)
B.2. AKUTNA INHALACIONA TOKSIČNOST
Korisno je imati prethodne podatke o svojstvima supstance kao što su: raspodela, veličina čestica, pritisak pare, tačka topljenja, tačka ključanja, tačka paljenja i eksplozivnost (ako se radi o eksplozivnoj supstanci).
Videti Opšti uvod, Deo A.
Videti Opšti uvod, Deo B.
Nisu propisane.
Nekoliko grupa eksperimentalnih životinja izlaže se ispitivanoj supstanci koja se primenjuje u rastućim koncentracijama kroz definisani vremenski period, tako da se na jednu grupu životinja primenjuje jedna koncentracija. Beleže se zapažanja o efektima primenjenih koncentracija i smrtnost kod životinja. One životinje koje uginu za vreme ispitivanja post-mortalno se pregledaju. Po završetku ispitivanja i preživele životinje se žrtvuju i post-mortalno pregledaju.
One životinje koje pokazuju teške i trajne znake toksičnosti i bola lišavaju se života na human način. Izbegava se primena ispitivane supstance u koncentracijama za koje se pouzdano zna da će kod životinja usled korozivnog ili jakog iritativnog svojstva izazvati značajan bol i patnju.
Nisu propisani.
1.6.1. Priprema
Životinje se čuvaju u odgovarajućim uslovima smeštaja i ishrane prema definisanom režimu najmanje pet dana pre početka eksperimenta. Zdrave mlade životinje nasumce se razvrstavaju u prethodno definisani broj grupa. Nije potrebno da se životinje podvrgnu simuliranom izlaganju, osim ako to nije posebno navedeno u uputstvu za aparaturu za inhalaciono izlaganje.
Čvrste ispitivane supstance usitnjavaju se do čestica odgovarajuće veličine.
Kada je neophodno, dodaje se vehikulum kojim se postiže odgovarajuća koncentracija ispitivane supstance u atmosferi. Za dodati vehikulum postavlja se i kontrolna grupa. Odabrani vehikulum i drugi aditivi koji se koriste da olakšaju primenu ispitivane supstance ne smeju da izazivaju toksične efekte. Ako je potrebno mogu se koristiti podaci iz literature.
1.6.2. Uslovi ispitivanja
1.6.2.1. Eksperimentalne životinje
Ako ne postoje kontraindikacije, preporučena vrsta je pacov i to sojevi koji se najčešće koriste u laboratorijskim ispitivanjima. Za oba pola, na početku ispitivanja, opseg u kome se kreće telesna masa životinja ne sme da prelazi ± 20 % od srednje vrednosti.
6.2.2.2. Broj i pol
Najmanje 10 glodara (pet ženki i pet mužjaka) koristi se za svaku ispitivanu koncentraciju. Ispitivanje se vrši na ženkama koje nisu ranije rađale i koje nisu gravidne.
Napomena: U ispitivanjima akutne toksičnosti na životinjama višeg reda od glodara, može se razmotriti i korišćenje manjeg broja jedinki. Doze moraju pažljivo da se odaberu, uz nastojanje da se izbegnu doze koje su veće od srednjih toksičnih doza. U ovakvim ispitivanjima ne smeju da se primenjuju letalne doze ispitivane supstance.
1.6.2.3. Koncentracije izlaganja
Koristi se najmanje tri koncentracije ispitivane supstance, a njihov izbor treba da pokrije opseg toksičnih efekata i stope smrtnosti. Podaci treba da omoguće konstruisanje krive zavisnosti koncentracije i smrtnosti, i gde je moguće, određivanje vrednosti LC50.
1.6.2.4. Ispitivanje granične doze
Ako se pet mužjaka i pet ženki izlože koncentraciji od 20 mg/L gasa ili 5 mg/L aerosola ili čestica u trajanju od četiri sata (ili se izlože maksimalnoj mogućoj koncentraciji, kada nije moguće postići ovu koncentraciju zbog fizičkih i hemijskih svojstava uključujući eksplozivna svojstva ispitivane supstance) i pri tome tokom 14 dana ne dođe do smrtnih slučajeva, dalja ispitivanja se obustavljaju.
1.6.2.5. Vreme izlaganja
Vreme izlaganja je četiri sata.
1.6.2.6. Oprema
Životinje se podvrgavaju ispitivanju pomoću opreme koja je dizajnirana tako da omogući dinamički protok vazduha sa najmanje 12 potpunih izmena u jednom satu, kako bi se omogućila odgovarajuća koncentracija kiseonika i ravnomeran raspored u atmosferi. Kada se koristi komora, ona mora da bude dovoljno prostrana za životinje i da omogući maksimalnu izloženost ispitivanoj supstanci udisanjem. Opšte pravilo koje obezbeđuje stabilnost atmosfere u komori, jeste da ukupna "zapremina" životinja na koje se primenjuje ispitivana supstanca ne sme da bude veća od 5% ukupne zapremine komore. Mogu se koristiti različiti tipovi komora koji omogućavaju izloženost čitavog tela, samo glave ili samo oro-nazalnih otvora životinje. Poslednje dve komore minimiziraju izloženost ispitivanoj supstanci pri drugim putevima unosa.
1.6.2.7. Vreme posmatranja
Posmatranja se obavljaju u trajanju od najmanje 14 dana. Ovaj vremenski interval nije fiksno određen. Njega određuju, između ostalog, toksični efekti, njihova učestalost, kao i vreme trajanja oporavka. Vreme posmatranja se, po potrebi, može i produžiti. Važno je zabeležiti vreme kod kojeg se jave ili nestanu prvi znaci toksičnosti, kao i vreme smrti, pogotovo ako postoji tendencija da vreme smrti bude odloženo.
1.6.3. Postupak
Neposredno pre nego što se eksperimentalna životinja izloži ispitivanoj supstanci meri se njena telesna masa. Životinje se u periodu od četiri sata izlažu ispitivanim koncentracijama u komorama koje su prethodno uravnotežene. Vreme potrebno za uravnoteženje koncentracija u komori treba da bude kratko. Temperatura na kojoj se obavlja ispitivanje mora da se održava na 22 °C ± 3 °C, a relativna vlažnost između 30% i 70%. U nekim slučajevima (npr. kod ispitivanja aerosola) ovo nije izvodljivo. Održavanjem negativnog pritiska unutar komore (≥ 5 mm vode) sprečiće se curenje isparavane supstance u okolnu zonu. Za vreme izlaganja ispitivanoj supstanci životinjama ne sme da se daje hrana i voda. U toku eksperimenta moraju da se koriste odgovarajući sistemi za održavanje i praćenje uslova unutar komore. Sistem mora da omogući stabilne uslove i njihovo uspostavljanje u što kraćem vremenskom roku. Komora mora da bude dizajnirana na takav način da omogućava homogenu distribuciju atmosfere za vreme ispitivanja.
Moraju da se rade merenja i da se prate sledeći parametri:
a) brzina protoka vazduha (neprekidno);
b) koncentracije ispitivane supstance u inhalacionoj zoni najmanje tri puta tokom izlaganja životinja (aerosoli na visokim temperaturama zahtevaju i češće praćenje). Tokom perioda izlaganja ispitivanoj supstanci, koncentracije ne smeju da variraju više od ± 15 % od srednje vrednosti. Kod aerosola teško se postiže ovaj nivo kontrole, pa se u tom slučaju tolerišu veće razlike u vrednostima. Za aerosole je potrebno obaviti i analizu veličine čestica (najmanje jedanput u svakoj grupi životinja);
v) temperatura i vlažnost (neprekidno, ako je moguće).
Zapažanja se beleže sistematično za vreme i nakon izlaganja ispitivanoj supstanci, i za svaku životinju vodi se zaseban karton. Prvog dana zapažanja se češće beleže. Pažljivi klinički pregled životinje potrebno je uraditi najmanje jedanput svakog radnog dana, a preostala posmatranja beleže se svakodnevno uz preduzimanje odgovarajućih aktivnosti kojima se na najmanju meru svodi gubitak životinja iz studije. Na uginulim životinjama radi se post-mortalni pregled ili se one odlažu na hlađenje, a životinje koje su izrazito slabe ili na samrti izdvajaju se iz grupe ili se žrtvuju.
Beleže se promene na koži i krznu, očima, mukoznim membranama, respiratornom, cirkulatornom, autonomnom i centralnom nervnom sistemu, kao i somatomotorna aktivnost i način ponašanja. Posebnu pažnju treba posvetiti načinu disanja, tremoru, konvulzijama, salivaciji, prolivu, letargiji, pospanosti i komi kod životinja. Vreme smrti beleži se što preciznije. Telesna masa svake pojedinačne životinje određuje se jednom nedeljno nakon prvobitnog izlaganja ispitivanoj supstanci, kao i u vreme smrti (žrtvovanja). Životinje koje uginu za vreme ispitivanja i one koje prežive do samog kraja post-mortalno se pregledaju sa posebnom pažnjom na promene u gornjem i donjem respiratornom traktu. Sve značajnije patološke promene moraju se zabeležiti. Kada je neophodno, uzimaju se i uzorci tkiva za histopatološka ispitivanja.
Podaci se navode tabelarno. Za svaku ispitivanu grupu životinja navodi se: broj životinja na početku ispitivanja, vreme smrti za svaku životinju, broj onih koje su pokazale znakove toksičnosti, opis toksičnih efekata i nalazi post-mortalnog pregleda. Kada životinje prežive duže od jednog dana izračunavaju se i beleže promene u njihovoj telesnoj masi. Životinje koje se lišavaju života na human način, zbog intenziteta izazvanog efekta ili bola, navode se kao uginuća izazvana delovanjem supstance. Vrednost LC50 određuje se primenom jedne od standardnih metoda ispitivanja.
Procena podatka mora da uključi i potencijalnu povezanost između izloženosti životinje ispitivanoj supstanci i učestalosti pojave i težine uočenih abnormalnosti. Navode se i promene u ponašanju, kliničke promene, pojava većih oštećenja, promene telesne mase, smrtnost, kao i drugi toksični efekti.
Izveštaj o ispitivanju, ako je moguće, sadrži podatke o:
1) Eksperimentalnoj životinji:
- vrsta, soj, izvor, uslovi smeštaja, ishrana itd.
2) Uslovima ispitivanja:
- opis aparature za inhalaciono izlaganje koja podrazumeva: dizajn, tip, dimenzije, izvor vazduha, sistem za stvaranje aerosola, metodu za kondicioniranje vazduha i način smeštaja životinja u komori kada se koristi. Opisuje se i aparatura za merenje temperature, vlažnosti, koncentracije aerosola i određivanje raspodele veličine čestica.
3) Izlaganju ispitivanoj supstanci:
Ovi podaci navode se tabelarno zajedno sa srednjim vrednostima i merama odstupanja (standardna devijacija), a, ako je moguće, uključuju i podatke o:
a) brzini protoka vazduha, opremi za inhalaciju;
b) temperaturi i vlažnosti vazduha;
v) nominalnoj koncentraciji (ukupnom sadržaju ispitivane supstance u opremi za inhalaciju, podeljenom sa zapreminom vazduha);
g) prirodi vehikuluma, ako je korišćen;
d) tačnoj koncentraciji supstance u zoni udisanja;
đ) prosečnom aerodinamičkom prečniku (The mass median aerodynamic diameter, MMAD) i geometrijskoj standardnoj devijaciji (The geometric standard deviation, GSD);
e) vremenu predviđenom za postizanje ravnoteže u komori;
ž) vremenu izlaganja;
4) Rezultatima:
- tabelarni prikaz podataka podeljenih prema polu i nivou izloženosti (broj mrtvih ili žrtvovanih životinja tokom trajanja ispitivanja; broj životinja koje su pokazale znake toksičnosti; broj izloženih životinja, itd.);
- vreme smrti za vreme ili nakon izlaganja, razlozi i kriterijumi za usmrćivanje životinja na human način;
- sva opažanja;
- LC50 vrednosti za svaki pol određene na kraju perioda posmatranja (sa propisanom metodom izračunavanja);
- 95% interval pouzdanosti za LC50 vrednosti (gde je moguće);
- kriva zavisnosti doza/smrtnost i nagib (ukoliko to omogućava metoda određivanja);
- nalazi post-mortalnih pregleda;
- svi histopatološki nalazi;
- obrazloženje rezultata (posebnu pažnju treba posvetiti uticaju koje može imati lišavanje života životinja iz humanih razloga za vreme ispitivanja na izračunatu vrednost LC50);
- tumačenje rezultata.
3.2. PROCENA PODATAKA I TUMAČENJE REZULTATA
Videti Opšti uvod, Deo G.
Videti opšti uvod, Deo D.
B.3. AKUTNA DERMALNA TOKSIČNOST
Videti opšti uvod, Deo A.
Videti opšti uvod, Deo B.
Nisu propisane.
Ispitivana supstanca primenjuje se na kožu kod više grupa životinja, u rastućim dozama, tako da se jednoj grupi životinja primenjuje jedna doza. Nakon toga posmatraju se efekti primenjenih doza i beleži broj uginulih životinja. Životinje koje uginu tokom ispitivanja post-mortalno se pregledaju. Na kraju ispitivanja i preživele životinje se žrtvuju i post-mortalno pregledaju.
Životinje koje pokazuju izrazite znakove patnje i bola, lišavaju se života na human način. Izbegava se primena ispitivane supstance u koncentracijama za koje se pouzdano zna da će kod životinja izazvati znatan bol i patnju usled iritacije ili korozivnog efekta.
Nisu propisani.
1.6.1. Priprema
Životinje se drže u eksperimentalnim kavezima i hrane se po definisanom eksperimentalnom režimu najmanje pet dana pre početka ispitivanja. Zdrave mlade životinje nasumce se dele u prethodno definisani broj grupa. Približno 24 sata pre početka ispitivanja životinjama se uklanja krzno brijanjem dorzalnog dela tela. Kod šišanja ili brijanja krzna potrebno je obratiti pažnju da se ne ozledi koža jer bi to moglo da utiče na njenu permeabilnost (propustljivost). Za primenu ispitivane supstance potrebno je da se pripremi najmanje 10% od ukupne površine kože životinje. Ako se ispituje čvrsta supstanca, koja se po potrebi može usitniti do praha, dobijeni prašak potrebno je dobro ovlažiti vodom ili nekim drugim vehikulomom kako bi se omogućio dobar kontakt sa kožom. Ako se koristi određeni vehikulum, mora se uzeti u obzir i njegov uticaj na penetraciju (prodiranje) ispitivane supstance kroz kožu. Ispitivane supstance koje se već nalaze u tečnom obliku najčešće se koriste nerazblažene.
1.6.2. Uslovi ispitivanja
1.6.2.1. Eksperimentalne životinje
Za ispitivanje najčešće se koriste kunići ili pacovi. I druge vrste životinja mogu da se koriste ali to zahteva dodatno obrazloženje, budući da se preporučuju već ustaljene životinjske vrste. Na početku ispitivanja, opseg telesne mase životinja za svaki pol ne sme da prelazi ± 20% od odgovarajuće srednje vrednosti.
1.6.2.2. Broj i pol
Najmanje pet životinja koristi se za svaki dozni nivo. Sve životinje moraju da budu istog pola. Ako se koriste ženke, ispitivanje se vrši na ženkama koje nisu ranije rađale i koje nisu gravidne. Ako postoje podaci na osnovu kojih je pokazano da je određeni pol osetljiviji kod ovakvih ispitivanja, koristi se taj pol.
Napomena: U ispitivanjima akutne toksičnosti na životinjama višeg reda od glodara, može da se razmotri i korišćenje manjeg broja životinja. Doze moraju pažljivo da se odaberu, i ne treba da se koriste doze veće od srednje toksičnih doza. U ovakvim ispitivanjima izbegavaju se letalne doze ispitivane supstance.
1.6.2.3. Dozni nivoi
Koristi se najmanje tri doze ispitivane supstance, a njihov izbor treba da je takav da kod ispitivane grupe životinja izazove čitav opseg toksičnih efekata i smrtnost. Kod određivanja primenjenih doza, moraju se uzeti u obzir potencijalni iritativni i korozivni efekti. Vodi se računa i o količini dobijenih podataka kako bi se mogla konstruisati kriva doza/odgovor, a gde je to moguće, određuje se i vrednost LD50.
1.6.2.4. Ispitivanje granične doze
Ispitivanje granične doze pri jednom doznom nivou može da se izvodi primenom ispitivane supstance od 2.000 mg/kg TM na grupi od pet mužjaka i pet ženki, prema postupku koji je opisan u Metodi ispitivanja B.1 bis., Deo prvi odeljak 1.5.3. Ako dođe do smrti usled primene navedene doze ispitivane supstance, mora da se razmotri cela studija.
1.6.2.5. Period posmatranja
Period posmatranja mora da traje najmanje 14 dana. Ovaj vremenski period nije strogo određen. Njega određuju, između ostalog, toksične reakcije, njihova učestalost, kao i vreme trajanja oporavka. Vreme posmatranja može da se produži. Važno je da se zabeleži vreme pojave ili nestanka prvih znakovi toksičnosti, kao i vreme smrti, pogotovo ako se primeti da je vreme smrti odloženo.
1.6.3. Postupak
Životinje se drže u kavezima za pojedinačno i odvojeno držanje. Ispitivana supstanca primenjuje se ravnomerno preko površine koja iznosi otprilike 10% od ukupne površine kože. Za primenu veoma toksičnih supstanci, izložena površina može da bude i manja, ali je u tom slučaju potrebno voditi računa da se primenjeni sloj ravnomerno rasporedi u što tanjem sloju.
Ispitivana supstanca drži se u kontaktu sa kožom tokom 24 sata pomoću porozne gaze na koju se nanosi, pri čemu se gaza ljepljivom trakom-flasterom prilepi na kožu životinje. Mesto primene dodatno se može prekriti kako bi se osiguralo da ispitivana supstanca ne dođe u kontakt sa ustima životinje. Ako je neophodno, na životinju se mogu staviti i dodatni štitnici kojima se sprečava peororalno unošenje ispitivane supstance. Ne preporučuje se potpuna imobilizacija životinje.
Nakon propisanog vremena izlaganja ispitivanoj supstanci, uklanja se višak ispitivane supstance ili vodom gde je to moguće ili nekim drugim odgovarajućim načinom za čišćenje kože.
Zapažanja se beleže sistematično. Za svaku životinju vodi se zasebni karton. Prvog dana zapažanja se češće beleže. Pažljivi klinički pregled životinje potrebno je uraditi najmanje jedanput svakog radnog dana, a preostala posmatranja beleže se svakodnevno uz preduzimanje odgovarajućih aktivnosti kojima se na najmanju meru svodi gubitak životinja iz studije. Na uginulim životinjama potrebno je uraditi post-mortalni pregled ili se one odlažu na hlađenje, a životinje koje su izrazito slabe ili na samrti izdvajaju se iz grupe ili žrtvuju.
Beleže se promene na koži i krznu, očima, mukoznim membranama, respiratornom, cirkulatornom, autonomnom i centralnom nervnom sistemu, kao i somatomotorna aktivnost i način ponašanja. Posebnu pažnju treba posvetiti načinu disanja, tremoru, konvulzijama, salivaciji, prolivu, letargiji, pospanosti i komi kod životinja. Vreme smrti beleži se što preciznije. Životinje koje uginu za vreme ispitivanja i one koje ostanu žive do samog kraja post-mortalno se pregledaju. Sve značajnije patološke promene moraju da se zabeleže. Kada postoje indikacije, moraju se uzeti i uzorci tkiva za histopatološka ispitivanja.
Procena toksičnosti kod suprotnog pola:
Po završetku studije u kojoj se koriste životinje samo jednog pola, ista doza ispitivane supstance primenjuje se na najmanje jednu grupu od pet životinja suprotnog pola da bi se utvrdilo da li suprotni pol pokazuje veću osetljivost pri primeni ispitivane supstance Može se razmotriti i korišćenje manjeg broja životinja, zavisno od okolnosti. Kada su dostupni odgovarajući podaci na osnovu kojih je pokazano da je pol životinja koje su odabrane u prvobitnom ispitivanju značajno osetljiviji na ispitivanu supstancu, izostavlja se ispitivanje na životinjama suprotnog pola.
Podaci se navode tabelarno. Za svaku ispitivanu grupu životinja navodi se: broj životinja na početku ispitivanja, vreme smrti za svaku životinju, broj onih koje su pokazale znakove toksičnosti, opis toksičnih efekata i nalaze post-mortalnog pregleda. Individualna telesna masa životinja meri se i beleži neposredno pre primene ispitivane supstance, zatim jednom nedeljno, i u vreme smrti. Kada životinje prežive duže od jednog dana izračunavaju se i beleže promene u njihovoj telesnoj masi. Životinje koje se lišavaju života na human način, zbog intenziteta patnje ili bola, navode se kao uginuća izazvana delovanjem supstance. Vrednost LD50 određuje se jednom od standardnih metoda ispitivanja.
Procena podatka mora da uključi i potencijalnu povezanost između izloženosti životinje ispitivanoj supstanci i učestalosti pojave i težine uočene abnormalnosti. Navode se promene u ponašanju, kliničke promene, pojava većih oštećenja, promene telesne mase, smrtnost kao i drugi toksični efekti.
Izveštaj o ispitivanju, ako je moguće, sadrži podatke o:
1) Eksperimentalnoj životinji:
- vrsta, soj, izvor, uslovi smeštaja, ishrana itd.
2) Uslovima ispitivanja:
- način korišćen za čišćenje kože i tip obloga; okluzivni ili ne-okluzivni;
- dozni nivoi (koncentracija vehikuluma, ako je korišćen);
- pol eksperimentalnih životinja;
3) Rezultatima:
- tabelarni prikaz podataka koji su podeljeni prema polu i doznim nivoima (broj uginulih ili žrtvovanih životinja tokom trajanja ispitivanja; broj životinja koje su pokazale znakove toksičnosti; broj izloženih životinja, itd.);
- vreme smrti nakon izlaganja, uzroci i kriterijumi za lišavanje života na human način;
- sva posmatranja;
- vrednost LD50 za onaj pol životinja koji je korišćen u ispitivanju, određen nakon 14 dana primenom propisane metode ispitivanja;
- 95% interval pouzdanosti za LD50 vrednosti (kada je moguće);
- kriva zavisnosti doza/smrtnost i nagib (kada metoda omogućava njeno konstruisanje);
- nalazi post-mortalnog pregleda;
- histopatološki nalazi;
- obrazloženje rezultata (posebna pažnja treba da se posveti uticaju koje lišavanje života na human način za vreme ispitivanja može da ima na izračunatu vrednost LD50);
- tumačenje rezultata.
3.2. PROCENA PODATAKA I TUMAČENJE REZULTATA
Videti Opšti uvod, Deo G.
Videti Opšti uvod, Deo D.
B.4. AKUTNA TOKSIČNOST: IRITACIJA/KOROZIVNO OŠTEĆENJE KOŽE
Ova metoda potpuno odgovara metodi OECD TG 404 (2002).
U pripremi ažurirane verzije ove metode ispitivanja, posebna pažnja posvećena je mogućim poboljšanjima u odnosu na dobrobit životinja, kao i proceni svih postojećih podataka o ispitivanoj supstanci, sa ciljem da se izbegnu nepotrebna ispitivanja na životinjama. Metoda ispitivanja zasniva se na preporuci da se pre in vivo ispitivanja iritativnog ili korozivnog efekta supstance obavi analiza kvaliteta postojećih podataka. Kada nema dovoljno podataka, moguće ih je dobiti primenom ispitivanja korak po korak1. Strategija ispitivanja uključuje i izvođenje validiranih i prihvaćenih in vitro ili ex vivo ispitivanja koja su opisana u Delu trećem ove metode. Kada je prihvatljivo u inicijalnom in vivo ispitivanju, preporučuje se sukcesivna (jedan za drugim), a ne istovremena, primena tri "patch" testa na životinju.
U interesu naučne zasnovanosti i dobrobiti životinja jeste da se in vivo ispitivanja započinju tek nakon analize kvaliteta svih dostupnih podataka koji su relevantni za procenu potencijala supstance da izazove iritaciju/korozivno oštećenje. Takvi podaci obuhvataju: dokaze na osnovu nalaza kod ljudi odnosno iz prethodno sprovedenih studija na laboratorijskim životinjama, dokaze o efektima iritacije/korozivnog oštećenja za jednu ili više strukturno sličnih supstanci ili smeša takvih supstanci, podatke koji ukazuju na jaku kiselost ili baznost ispitivane supstance2, 3, ili podatke iz prethodno validiranih i prihvaćenih in vitro ili ex vivo ispitivanja4, 5, 5a. Ovakva analiza smanjiće potrebu za in vivo ispitivanjima iritacije/korozivnog oštećenja kože za one supstance za koje postoji dovoljno indirektnih dokaza na tom polju.
U Delu trećem ove metode opisana je strategija ispitivanja korak po korak koja uključuje i obavljanje validiranih i prihvaćenih in vitro ili ex vivo ispitivanja iritacije/korozivnog oštećenja kože. Strategiju su razvili, kao jedinstveno prihvaćenu i preporučenu, članovi radne grupe OECD6, a prihvaćena je i uvršćena u preporučene strategije ispitivanja od strane Globalno harmonizovanog sistema za klasifikaciju (u daljem tekstu: GHS)7. Preporučuje se praćenje ove strategije pre preduzimanja bilo kakvih in vivo ispitivanja. Za nove supstance koje još nisu bile ispitivane za prikupljanje podataka o njihovim iritativnim/korozivnim efektima za kožu preporučen je pristup ispitivanja "korak po korak". Za supstance koje su već uključene u ispitivanja, ista strategija treba da se primeni za upotpunjavanje podataka o iritativnim/korozivnim efektima za kožu. Ukoliko se primeni drugačija strategija ispitivanja ili postupka, ili se odluči da se ne primeni ova metoda ispitivanja, potrebno je objasniti i obrazložiti razloge ovakve odluke.
Ako se određivanje iritativnih/korozivnih efekata ispitivane supstance na koži ne može utvrditi na osnovu analize kvaliteta postojećih podataka, u skladu sa strategijom ispitivanja korak po korak, potrebno je razmotriti obavljanje in vivo ispitivanja (videti Deo treći ove metode).
Iritacija kože jeste nastanak reverzibilnih oštećenja kože koja prate primenu ispitivane supstance nakon izlaganja u trajanju od 4 sata.
Korozivno oštećenje kože jeste nastanak ireverzibilnih oštećenja kože odnosno vidljive nekroze u epidermisu i dermisu nakon četvoročasovne primene ispitivane supstance. Korozivno oštećenje kože karakteriše se prema tipu izazvanog oštećenja kao: ulkus, krvarenje ili krvave kraste i na kraju perioda posmatranja od 14 dana prema promeni boje kože uslovljene perutanjem i pojavi površina sa alopecijom i ožiljnog tkiva. U cilju procene nejasnih oštećenja obavljaju se histopatološka ispitivanja.
Ispitivana supstanca primenjuje se u jednoj dozi na kožu eksperimentalne životinje, a netretirani delovi kože služe kao kontrola. Stepen iritativnih/korozivnih efekta na koži očitava se i ocenjuje u prethodno utvrđenim vremenskim intervalima, pri čemu se dodatno svaki efekat pojedinačno opisuje kako bi se dobila kompletna procena štetnih efekata. Studija mora dovoljno dugo da traje, da bi mogli da se donesu zaključci o reverzibilnosti ili ireverzibilnosti zabeleženih štetnih efekata.
Životinje koje u bilo kom delu ispitivanja pokazuju stalne znakove patnje ili bola, lišavaju se života na human način, a supstanca se procenjuje u skladu sa tim. Kriterijumi za donošenje odluke o lišavanju života na human način onih životinja koje su na samrti i pokazuju znake izrazite patnje, opisani su u literaturi8.
1.4.1. Priprema za in vivo ispitivanje
1.4.1.1. Izbor životinjske vrste
Preporučuje se korišćenje zdravih mladih jedinki albino kunića. Ukoliko se koristi druga životinjska vrsta, navode se razlozi za ovo korišćenje.
1.4.1.2. Priprema životinja
Približno 24 sata pre početka ispitivanja životinjama se uklanja krzno brijanjem dorzalnog dela tela. Kod brijanja krzna, potrebno je obratiti pažnju da se ne povredi koža jer se za ispitivanje koristite isključivo one životinje čija je koža neoštećena (intaktna).
Neke vrste kunića imaju gusto krzno na pojedinim delovima kože, zavisno od godišnjeg doba. Ispitivanje ne treba da se vrši na ovim površinama kože.
1.4.1.3. Uslovi smeštaja životinja i ishrana
Životinje se smeštaju u odgovarajući smeštaj za pojedinačno i odvojeno držanje. Temperatura smeštajnog prostora u kome se drže kunići treba da se održava na 20°C (± 3°C). Relativna vlažnost vazduha treba da bude najmanje 30% i da ne prelazi 70% (osim u slučajevima kada se prostorija sa životinjama čisti). Idealna vlažnost je između 50% i 60%. Osvetljenje mora da bude veštačko i to u intervalima od 12 sati svetla i 12 sati mraka. Životinje se hrane uobičajenom hranom za laboratorijske životinje, sa slobodnim pristupom vodi za piće.
1.4.2. Postupak
1.4.2.1. Primena ispitivane supstance
Ispitivana supstanca nanosi se na malu površinu kože (otprilike 6 cm2) i prekriva gazom koja se fiksira pomoću flastera. U slučajevima kad direktno nanošenje nije moguće (npr. kod tečnosti ili nekih pasta), ispitivana supstanca se prvo nanosi na gazu, a zatim se gaza postavlja na kožu. Obloga od gaze treba da bude u laganom kontaktu s kožom, tako da bude polu zatvorena (semi-okluzivna) tokom perioda izlaganja. Ako se ispitivana supstanca nanosi na oblogu, a ne direktno na kožu, obloga mora da se fiksira na kožu tako da se ostvari dobar kontakt i da se supstanca ravnomerno raspodeli po površini kože. Potrebno je onemogućiti pristup životinje oblozi, kao i inhalaciju ili dovođenje u kontakt sa ustima životinje (ingestiju) ispitivane supstance.
Ispitivane supstance koje se nalaze u tečnom stanju, najčešće se koriste nerazblažene. Ako se ispituje čvrsta supstanca, koja se po potrebi može usitniti do praha, dobijeni prašak potrebno je dobro ovlažiti u što manjoj zapremini vode ili nekom drugom vehikulumu kako bi se omogućio dobar kontakt sa kožom. Ako se koristi vehikulum koje nije voda, mogući uticaj tog vehikuluma na iritaciju kože mora da bude sveden na najmanju meru.
Nakon izlaganja, koje uobičajeno traje četiri sata, višak ispitivane supstance ispira se vodom ili se uklanja pomoću odgovarajućeg sredstva, bez promene efekata na koži i integriteta epidermisa.
1.4.2.2. Dozni nivo
Na pripremljeni deo kože nanosi se 0,5 mL tečne supstance ili 0,5 g čvrste supstance ili supstance u obliku paste.
1.4.2.3. Inicijalno ispitivanje
(in vivo ispitivanje iritacije/korozivnog oštećenja kože na jednoj životinji)
Stroga je preporuka da se in vivo ispitivanje inicijalno izvodi samo na jednoj životinji, naročito ako se sumnja da bi ispitivana supstanca mogla da izazove korozivno oštećenje kože. Ova preporuka je u skladu sa strategijom ispitivanja korak po korak iz Dela trećeg ove metode. Kada je na osnovu analize kvaliteta podataka doneta stručna procena da je ispitivana supstanca korozivna, nisu neophodna dalja ispitivanja na životinjama. Za većinu supstanci za koje se sumnja da izazivaju korozivno oštećenje kože ne smatraju se neophodnim dalja in vivo ispitivanja. U slučajevima kada nema dovoljno dokaza, potrebni su dodatni podaci, pri čemu se obavljaju ispitivanja granične doze korišćenjem sledećeg pristupa: najviše tri obloge se jedna za drugom (uzastopno) nanose na kožu životinje. Prva obloga se uklanja nakon tri minuta i ako se pri tome ne uoči jaka reakcija na koži, nanosi se i druga obloga koja se uklanja nakon jednog sata. Ako uočene promene u ovoj fazi ukazuju da se izlaganje ispitivanoj supstanci može proširiti na četiri sata, nanosi se i treća obloga koja se uklanja nakon četiri sata, a dobijeni nalaz se ocenjuje.
Ako se uoči korozivno oštećenje kože nakon bilo kog od tri uzastopna izlaganja ispitivanoj supstanci, ispitivanje se nakon tog izlaganja prekida. Ako ne dođe do pojave oštećenja na koži nakon što se ukloni i zadnja obloga, životinju je potrebno posmatrati još 14 dana, osim ukoliko ranije dođe do pojave korozivnog oštećenja.
U slučajevima kada se ne očekuje da će ispitivana supstanca dovesti do korozivnog oštećenja kože, ali se pretpostavlja da će izazvati iritaciju, dovoljno je primeniti oblogu na jednu životinju u trajanju od četiri sata.
1.4.2.4. Ispitivanje kojim se potvrđuje
(in vivo ispitivanje iritacije kože na dodatnim životinjama)
Ako se u inicijalnom ispitivanju ne uoči korozivno oštećenje, iritacija ili negativni nalaz kože potrebno je, radi potvrde, sprovesti ispitivanje na još dve dodatne životinje. Na svaku dodatnu životinju primenjuje se jedna obloga tokom perioda izlaganja u trajanju od četiri sata. Ako se u inicijalnom ispitivanju uoči iritacija kože, ispitivanje kojim se potvrđuje izvodi se po fazama ili istovremenim izlaganjem još dve dodatne životinje. U izuzetnom slučaju u kome se inicijalno ispitivanje ne izvodi, dve ili tri životinje mogu se tretirati po jednom oblogom koja se uklanja nakon četiri sata. Ako se koriste dve životinje i kod njih dođe do identičnih nalaza, nije neophodno dalje ispitivanje. U suprotnom, potrebno je i treću životinju uključiti u ispitivanje. Sumnjive (dvosmislene) nalaze ponekad je potrebno potvrditi ispitivanjima na dodatnim životinjama.
1.4.2.5. Period posmatranja
Period posmatranja mora da bude dovoljno dug kako bi se u potpunosti odredila reverzibilnost uočenih efekata. Eksperiment treba da se prekine u bilo kom trenutku ako životinja pokazuje neprekidne znakove jakog bola ili patnje. Da bi se odredila reverzibilnost efekata, potrebno je posmatrati životinje nakon uklanjanja obloge i to do 14 dana. Ako se reverzibilnost uoči pre 14 dana, eksperiment se prekida.
1.4.2.6. Klinička posmatranja i ocenjivanje reakcija na koži
Kod svih životinje potrebno je ispitati znakove eritema ili edema na koži i oceniti nalaz i to nakon 60 minuta, i kasnije: 24 sata, 48 sati i 72 sata nakon uklanjanja obloge. Kod inicijalnog ispitivanja na jednoj životinji, samo mesto ispitivanja na koži potrebno je pregledati neposredno nakon uklanjanja obloge. Reakcije na koži ocenjuju se i opisuju prema ocenama navedenim u Tabeli. Ako na koži postoji oštećenje koje ne može da se definiše kao iritacija ili korozivno oštećenje nakon 72 sata, posmatranje se produžava do 14 dana kako bi se odredila reverzibilnost efekata. Osim posmatranja iritacije kože, beleže se i opisuju i svi lokalni toksični efekti, poput sušenja kože kao i sistemski štetni efekti (npr. klinički znakovi toksičnosti ili promene u telesnoj masi). U slučaju nejasnih nalaza obavljaju se histopatološka ispitivanja.
Ocenjivanje nalaza kože po svojoj prirodi je subjektivno. Kako bi se podstaklo da ocenjivanje bude usklađeno među različitim laboratorijama, potrebno je osoblje laboratorija adekvatno obučiti za ocenjivanje (videti Tabelu). Dostupan je i ilustrovani vodič za ocenjivanje iritacije kože i drugih lezija9.
Rezultati ispitivanja navode se tabelarno u završnom izveštaju. Rezultati sadrže sve podatke navedene u odeljku 3.1. ove metode.
Ocena iritacije kože sprovodi se u saglasnosti sa prirodom i težinom oštećenja/lezija na koži, kao i sa njihovom reverzibilnošću ili ireverzibilnošću. Pojedinačne ocene same za sebe ne ukazuju na iritativno svojstvo ispitivane hemikalije, budući da se procenjuju i ostali efekti. Pojedinačne ocene treba imati u vidu kao preporuku, i značajne su samo ukoliko su podržane potpunim opisom i procenom svih uočenih efekata.
Kod procene iritativnog odgovora potrebno je razmotriti reverzibilnost oštećenja na koži. Ispitivana supstanca može se smatrati iritativnom kada su nalazi poput alopecije (na ograničenoj površini), hiperkeratoze, hiperplazije ili deskvamacije prisutni sve do kraja perioda posmatranja od 14 dana.
Izveštaj o ispitivanju sadrži podatke o:
1) Razlozima za izvođenje in vivo ispitivanja:
- analizu kvaliteta postojećih podataka, uključujući rezultate dobijene strategijom ispitivanja korak po korak;
- opis relevantnih podataka dobijenih iz prethodnih ispitivanja;
- podatke iz svakog pojedinačnog koraka strategije ispitivanja;
- opis izvedenih in vitro ispitivanja, koji uključuju detalje o postupku i rezultate dobijene za ispitivanu/referentnu supstancu;
- analizu kvaliteta podataka za izvođenje in vivo studije.
2) Ispitivanoj supstanci:
- identifikacioni podaci (npr. CAS broj; poreklo, stepen čistoće, poznate nečistoće, broj serije);
- fizičko stanje i fizička i hemijska svojstva (npr. pH, isparljivost, rastvorljivost, stabilnost);
- kod smeše: sastav i relativni procenti sastojaka.
3) Vehikulumu:
- identifikacija, koncentracija (po potrebi), zapremina koja se koristi;
- opravdanost izbora vehikuluma.
4) Eksperimentalnim životinjama:
- vrsta/soj, razlog korišćenja druge vrste, a ne albino kunića;
- broj životinja svakog pola;
- telesna masa pojedinačnih životinja na početku i kraju ispitivanja;
- starost na početku ispitivanja;
- izvor životinja, uslovi smeštaja, ishrana itd.
5) Uslovima ispitivanja:
- način pripreme kože na mestu gde se stavlja obloga;
- detalji o korišćenim materijalima za oblogu, kao i način nanošenja obloge;
- detalji o pripremi ispitivane supstance, primeni i uklanjanju.
6) Rezultatima:
- tabelarni prikaz ocene nalaza iritacije/korozivnog oštećenja kože za svaku životinju pri svakom vremenu posmatranja;
- opisi svih uočenih lezija;
- detaljan opis prirode i stepena iritacije ili korozivnog oštećenja kože, kao i histopatološki nalazi;
- opis svih drugih lokalnih štetnih efekata (npr. obezmašćivanje kože/sušenje) kao i sistemskih efekata.
- tumačenje rezultata.
1. Barratt, M.D., Castell, J.V., Chamberlain, M., Combes, R.D., Dearden, J.C., Fentem, J.H., Gerner, I., Giuliani, A., Gray, T.J.B., Livingston, D.J., Provan, W.M., Rutten, F.A.J.J.L., Verhaar, H.J.M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, 410 - 429.
2. Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In vitro, 2, 19 - 26.
3. Worth, A.P., Fentem, J.H., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Liebsch, M. (1998) Evaluation of the proposed OECD Testing Strategy for skin corrosion. ATLA 26, 709-720.
4. ECETOC (1990) Monograph No. 15, "Skin Irritation", European Chemical Industry, Ecology and Toxicology Centre, Brussels.
5. Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsail, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in vitro 12, pp.483 - 524.
5a. Testing Method B.40 Skin Corrosion.
6. OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22 - 24 January 1996 (http://www.oecd1.org/ehs/test/background.htm).
7. OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd1.org/ehs/Class/HCL6.htm).
8. OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 19 (http://www.oecd1.org/ehs/test/monos.htm).
9. EPA (1990). Atlas of Dermal Lesions, (20T-2004). United States Environmental Protection Agency, Office of Pesticides and Toxic Substances, Washington, DC, August 1990. (Dostupno na zahtev od sekreterijata OECD).