
C.1. AKUTNA TOKSIČNOST PO RIBE
Svrha ove metode je da se za ispitivanu supstancu utvrdi letalna akutna toksičnost po slatkovodne ribe. U ispitivanju se koristi sistem (statički, polu-statički ili protočni) koji je najprikladniji za konstantno održavanje ispitivanih koncentracija supstance u vodi. Izbor je olakšan kada se raspolaže podacima o rastvorljivosti u vodi, naponu pare, hemijskoj stabilnosti, konstantama disocijacije i biorazgradljivosti supstance.
Dodatne podatke (npr. podaci o strukturnoj formuli, stepenu čistoće, vrsti i procentu značajnih nečistoća, prisustvu i količini aditiva, koeficijent raspodele u sistemu n-oktanol/voda) treba uzeti u obzir pri planiranju ispitivanja i pri tumačenju dobijenih rezultata.
1.2. DEFINICIJE I MERNE JEDINICE
Akutna toksičnost jeste vidljivi štetan efekat koji nastaje u organizmu usled izlaganja supstanci u toku kratkog vremenskog perioda (dani). U ispitivanju, akutna toksičnost izražava se kao srednja letalna koncentracija (u daljem tekstu: LC50), odnosno koncentracija supstance u vodi koja dovodi do smrti 50% jedinki ispitivane grupe riba, koje su neprekidno izložene u toku unapred naznačenog vremenskog perioda.
Sve koncentracije supstance koje se ispituju moraju biti izražene u jedinicama mase po zapremini (mg/l) ili u masenim koncentracijama (mg/kg).
Na osnovu rezultata ispitivanja sa referentnom supstancom može da se utvrdi da li je u laboratorijskim uslovima ispitivanja došlo do značajne promene osetljivosti vrste na kojoj se vrši ispitivanje.
Za ovu metodu ispitivanja nisu propisane referentne supstance.
Preliminarno ispitivanje supstance vrši se za koncentraciju od 100 mg/l, kako bi se utvrdilo da je vrednost LC50 viša od ove koncentracije.
Ispitivanje traje 96 sati. U toku ovog vremena ribe se izlažu ispitivanoj supstanci koja se dodaje u vodu u opsegu koncentracija. Na najmanje svaka 24 sata, beleži se smrtnost riba i pritom se, kad god je moguće, izračunava vrednost LC50.
Kriterijumi kvaliteta primenjuju se na čitavu metodu ispitivanja, uključujući i preliminarno ispitivanje.
Na kraju ispitivanja smrtnost u kontrolnim grupama ne sme da prelazi 10% (ili više od jedne ribe u kontrolnoj grupi sa manje od 10 jedinki).
U toku čitavog ispitivanja koncentracija rastvorenog kiseonika u vodi mora da bude viša od 60% zasićenja.
U toku trajanja ispitivanja, koncentracije ispitivane supstance treba održavati u granicama od 80% od početnih koncentracija.
Za supstance koje se lako rastvaraju u ispitivanom medijumu i obrazuju stabilne rastvore, odnosno rastvore koji u znatnoj meri ne isparavaju, ne raspadaju se, ne podležu hidrolizi ili se ne adsorbuju, može se uzeti da je početna koncentracija jednaka nominalnoj koncentraciji. Sve vreme trajanja ispitivanja moraju biti zadovoljeni kriterijumi kvaliteta i koncentracije supstance održane u okviru propisanih vrednosti, za šta se prilažu dokazi.
Za supstance koje su slabo rastvorljive u ispitivanom mediju, ili imaju sposobnost obrazovanja stabilnih emulzija, ili disperzija, ili nisu stabilne u vodenim rastvorima, za početnu koncentraciju obavezno se uzima vrednost koncentracije koja je izmerena u rastvoru (ili ako ne postoji tehnička mogućnost, koncentracija izmerena u vodenom stubu) na početku ispitivanja. Koncentracija supstance se određuje nakon perioda stabilizacije i to pre uvođenja riba u sistem za ispitivanje.
U toku samog ispitivanja moraju se sprovoditi dodatna merenja kako bi se potvrdile stvarne koncentracije izlaganja, kao i ispunjavanje kriterijuma kvaliteta.
Vrednost pH ne treba da varira zaviše od 1.
U ispitivanju se koriste tri različita sistema:
1) statičan:
- u toku ispitivanja nema protoka ispitivanog rastvora (rastvori se ne obnavljaju u komorama za ispitivanje);
1) polu-statičan:
- ispitivani rastvor ne protiče, ali se u komorama za ispitivanje rastvori redovno obnavljaju u dužim vremenskim intervalima (npr. na svaka 24 sata).
2) protočni:
- ispitivani rastvor se stalno obnavlja, čime se obezbeđuje stalna koncentracija rastvora i sprečava nagomilavanje kontaminenata u komorama za ispitivanje.
1.6.1. Reagensi
1.6.1.1. Rastvori ispitivane supstance
Za pripremu osnovnih rastvora u koncentracijama predviđenim za ispitivanje upotrebljava se dejonizovana voda ili obična voda u skladu sa specifikacijom iz odeljka 1.6.1.2. ove metode.
Koncentracije koje su određene za ispitivanje pripremaju se razblaživanjem osnovnog rastvora. Ako se ispituju visoke koncentracije, supstanca se može odmah rastvoriti u vodi koja se koristi za razblaživanje.
Supstance se ispituju dok se ne dostigne granica rastvorljivosti. Za neke supstance, npr. one supstance koje imaju nisku rastvorljivost u vodi, ili visoku vrednost koeficijenta raspodele u sistemu n-oktanol/voda (u daljem tekstu: Pow), ili one supstance koje pre obrazuju stabilne disperzije nego prave vodene rastvore, prihvatljivo je da se izvrši ispitivanje koncentracije supstance koja je iznad granice rastvorljivosti, kako bi potvrdili da je postignuta koncentracija maksimalne rastvorljivosti, odnosno stabilna koncentracija. Treba imati u vidu da ova koncentracija na neki drugi način ne ometa sistem za ispitivanje (npr. obrazovanjem površinskog sloja koji sprečava oksigenaciju vode, itd.)
Ultrazvučna disperzija, organski rastvarači, emulgatori ili disperziona sredstva mogu se upotrebiti za pripremu osnovnog rastvora supstance čija je rastvorljivost u vodi niska ili da bi se pospešila disperzija u ispitivanom medijumu. U slučaju da se koriste, sve ispitivane koncentracije moraju da sadrže istu količinu pomoćnih supstanci. Istoj koncentraciji pomoćnih supstanci, koja se koristi u serijama ispitivanja, izlažu se i ribe u dodatnoj kontrolnoj grupi. Koncentraciju pomoćnih supstanci u ispitivanom medijumu treba svesti na minimum i ona ni u kom slučaju ne sme premašiti vrednost od 100 mg/l.
Ispitivanje se izvodi bez podešavanja pH vrednosti. Ako se utvrdi da je došlo do značajne promene pH vrednosti, prilažu se rezultati dobijeni u ponovljenom ispitivanju za koje je pH vrednost prethodno bila podešena. pH vrednost osnovnog rastvora se podešava prema pH vrednosti vode za razblaživanje, osim ako ne postoji konkretan razlog da se tako ne uradi. U tu svrhu prvenstveno se koriste HCl i NaOH. Podešavanje pH vrednosti se vrši na način kojim se neće u značajnijoj meri promeniti koncentracija ispitivane supstance. U izveštaju o ispitivanju treba navesti ukoliko usled podešavanja pH vrednosti dođe do bilo kakve hemijske reakcije ili precipitacije ispitivane supstance.
1.6.1.2. Voda za gajenje i razblaživanje
Za ovu namenu koristi se pitka voda (iz izvora koji nije zagađen potencijalno štetnim koncentracijama hlora, teških metala ili drugih supstanci), kvalitetna prirodna voda ili rekonstituisana voda (videti Deo drugi ove metode). Ukupna tvrdoća vode treba da bude između 10 mg/l CaCO3 i 250 mg/l CaCO3, a pH vrednost između 6,0 i 8,5.
1.6.2. Oprema
Oprema za ispitivanje sadrži:
- automatski sistem za razblaživanje (u ispitivanju sa protočnim sistemom);
- oksimetar;
- instrument za određivanje tvrdoće vode;
- odgovarajuću aparaturu za kontrolu temperature;
- pH metar.
Sva oprema mora biti izrađena od hemijski inertnog materijala.
1.6.3. Ribe
Ribe koje se koriste u ispitivanju moraju biti zdrave i bez vidljivih deformacija.
Vrsta ribe se bira na osnovu praktičnih kriterijuma: dostupnost vrste u toku čitave godine, jednostavnost održavanja, prikladnost za obavljanje ispitivanja, relativna osetljivost na hemikalije itd. Uzimaju se u obzir ekonomski, biološki i ekološki faktori koji mogu da utiču na konačan ishod ispitivanja. Kod izbora prikladne vrste riba treba uzeti u obzir i mogućnost poređenja rezultata i usklađenost između različitih laboratorija u svetu (videti u literaturi1).
Spisak vrsta riba koje se preporučuju za ispitivanje dat je u Delu trećem ove metode. Najčešće se koriste zebrica i kalifornijska pastrmka.
1.6.3.1. Čuvanje
Ribe moraju biti iz istog legla, a jedinke po mogućnosti slične veličine i starosti. Riba se najmanje 12 dana drži pod sledećim uslovima:
1) uvođenje riba:
- shodno sistemu u kom se vrši ispitivanje (recirkulacijski ili protočni) i vrsti ribe;
2) voda:
- videti odeljak 1.6.1.2. ove metode;
3) svetlost:
- 12 do 16 sati osvetljenja dnevno;
4) koncentracije rastvorenog kiseonika:
- najmanje 80% zasićenja;
5) ishrana:
- tri puta nedeljno ili jednom dnevno, sa pauzom od 24 sata pre početka ispitivanja.
1.6.3.2. Smrtnost
Nakon perioda stabilizacije od 48 sati, beleži se smrtnost riba primenom sledećih kriterijuma:
1) ako je smrtnost u prvih 7 dana viša od 10% ukupne populacije, čitava populacija se odbacuje;
2) ako je smrtnost između 5% i 10% ukupne populacije, populacija se čuva dodatnih 7 dana. Ako ne dođe do dodatnih uginuća, populacija se prihvata, u suprotnom, ako se zabeleži još koje uginuće, populacija se odbacuje;
3) ako je smrtnost niža od 5% ukupne populacije, populacija se prihvata.
1.6.4. Adaptacija
Voda u kojoj se gaje ribe i voda koja se koristi u ispitivanju moraju imati isti kvalitet i temperaturni režim i to najmanje sedam dana pre početka ispitivanja.
1.6.5. Postupak ispitivanja
U preliminarnom ispitivanju određuje se tačan opseg koncentracija za ispitivanje.
Zajedno sa čitavom serijom ispitivanih koncentracija, koristi se i jedna kontrola u koju se ne dodaje ispitivana supstanca, a po potrebi i jedna kontrola sa pomoćnom supstancom.
U zavisnosti od hemijskih i fizičkih svojstava ispitivane supstance, bira se odgovarajući sistem za ispitivanje: statički, polu-statički ili protočni, kako bi se zadržali kriterijumi kvaliteta.
Ribe se izlažu ispitivanoj supstanci na sledeći način:
1) 96 sati traje izlaganje;
2) najmanje po 7 jedinki riba za svaku ispitivanu koncentraciju;
3) komore za ispitivanje moraju biti odgovarajuće zapremine za zadati nasad;
4) nasad:
- maksimalni nasad je 1 g/l za statični i polu-statični sistem, a za protočni sistem nasad može biti i veći;
5) ispitivane koncentracije:
- najmanje pet koncentracija koje se razlikuju za faktor ne veći od 2,2 i odabranih tako da pokrivaju čitav opseg smrtnosti od 0% do 100%;
6) voda:
- videti odeljak 1.6.1.2;
7) svetlost:
- 12 do 16 sati osvetljenja dnevno;
8) temperatura:
- mora biti odgovarajuća za vrstu (videti Deo treći ove metode), ali unutar ±1°C za bilo koji sistem za ispitivanje;
9) koncentracije rastvorenog kiseonika:
- ne manja od 60% zasićenja pri odabranoj temperaturi;
10) ishrana:
- hrana se ne daje.
Ribe se proveravaju nakon prva 2 do 4 sata, a kasnije u intervalima od 24 sata. Ribe se smatraju mrtvim, ako dodirivanjem uske površine ispred leđnog peraja ne dođe do bilo kakve reakcije i ako se ne vide pokreti disanja. Mrtve ribe se uklanjaju odmah po opažanju, a smrtnost se stalno beleži. Beleže se i vidljive abnormalnosti (npr. gubitak ravnoteže, promene u načinu plivanja, poremećaj respiratornih funkcija, pigmentacije i sl.).
Svakodnevno se mere pH vrednost, koncentracija rastvorenog kiseonika i temperatura.
Granično ispitivanje
Uz pomoć postupaka opisanih u ovoj metodi, može se izvesti granično ispitivanje sa koncentracijom od 100 mg/l, kako bi se pokazalo da je LC50 veća od ove koncentracije.
Ako je priroda supstance takva da se ne može postići koncentracija od 100 mg/l, granično ispitivanje treba da se izvede sa koncentracijom koja je jednaka rastvorljivosti supstance (ili sa maksimalnom koncentracijom koja formira stabilnu disperziju) u medijumu (videti odeljak 1.6.1.1. ove metode).
Granično ispitivanje se izvodi sa 7 do 10 riba i sa istim brojem riba u kontroli. (Na osnovu binomne teoreme predviđa se da je u grupi od 10 riba sa nultom stopom smrtnosti, sa 99,9% intervalom poverenja, vrednost LC50 viša od koncentracije koja se koristila u graničnom ispitivanju. Ako u grupi od 7, 8 ili 9 riba nema smrtnosti, tada je najmanje sa 99% intervalom poverenja, LC50 viša od koncentracije koja se koristila).
Ako dođe do uginuća, mora se izvesti potpuno ispitivanje. Beleže se i subletalni efekti.
Za svaki vremenski interval u kom se beleže opažanja (nakon 24, 48, 72 i 96 sati), na logaritamskom papiru grafički se predstavlja procenat smrtnosti u funkciji koncentracije, za svako preporučeno vreme izlaganja.
Primenom standardnih postupaka, kada je to moguće, za svaki vremenski interval opažanja određuje se vrednost LC50 i interval poveranja (p=0,05). Ove vrednosti se zaokružuju na jednu ili najviše dve decimale.
U slučajevima kada je nagib krive koncentracija/procenat prevelik da bi omogućio tačno izračunavanje vrednosti LC50, dovoljno je grafički proceniti vrednosti.
Kada dve uzastopne koncentracije, u opsegu faktora 2,2 daju samo 0% ili 100% smrtnost, ove dve vrednosti dovoljne su za određivanje opsega u kom će se naći vrednosti LC50.
Ako se ustanovi da se stabilnost ili homogenost ispitivane supstance ne može održavati, ovo se opažanje mora zabeležiti sa posebnim osvrtom na tu činjenicu kod tumačenja rezultata.
Izveštaj, po mogućnosti, sadrži sledeće podatke:
- vrsta ribe koja se ispituje (latinski naziv vrste, soj, dobavljač, prethodni tretman, veličina i broj riba za svaku ispitivanu koncentraciju supstance);
- poreklo vode za razblaživanje i njena osnovna hemijska svojstva (pH, tvrdoća, temperatura);
- postupak pripreme osnovnog rastvora i ispitivanih koncentracija (u slučaju supstanci koje imaju nisku rastvorljivost u vodi);
- koncentracija svake pomoćne supstance;
- spisak svih ispitivanih koncentracija i sve dostupne informacije o stabilnosti ispitivane supstance u rastvoru;
- opis korišćenih metoda i dobijenih rezultata (u slučaju hemijske analize);
- rezultati graničnog ispitivanja (u slučaju da je izvedeno);
- razlozi izbora i detalji o korišćenom sistemu za ispitivanje (npr. statični, polu-statični, protočni, da li se vrši aeracija, način uvođenja riba, itd);
- opis opreme korišćene u ispitivanju;
- režim osvetljenja;
- koncentracije rastvorenog kiseonika, pH vrednost i temperatura ispitivanih rastvora na svakih 24 sata;
- dokazi da su ispunjeni kriterijumi kvaliteta;
- tablica koja pokazuje ukupnu smrtnost pri svakoj koncentraciji ispitivane supstance i kontrole (zajedno sa kontrolom pomoćne supstance, ako je potrebno) na kraju svakog vremenskog intervala;
- kriva dozne zavisnosti procenta smrtnosti od ispitivane koncentracije na kraju ispitivanja;
- ako je moguće, vrednosti LC50 na kraju svakog vremenskog intervala (sa 95% intervalom poverenja);
- statističke metode korišćene za određivanje LC50 vrednosti;
- (u slučaju da je korišćena referentna supstanca) uporedni rezultati ispitivanja;
- najviša ispitivana koncentracija koja nije dovela do uginuća ribe za vreme trajanja ispitivanja;
- najniža ispitivana test koncentracija koja je dovela do 100% smrtnosti za vreme trajanje ispitivanja.
1. OECD, Paris, 1981, Test Guideline 203, Decision of the Council C(81) 30 final and updates.
2. AFNOR - Determination of the acute toxicity of a substance to Brachydanio rerio - Static and Flow Through methods - NFT 90-303 June 1985.
3. AFNOR- Determination of the acute toxicity of a substance to Salmo gairdneri - Static and Flow Through methods - NFT 90-305 June 1985.
4. ISO 7346/1,/2 and/3 - Water Quality - Determination of the acute lethal toxicity of substances to a fresh water fish (Brachydanio rerio Hamilton-Buchanan-Teleostei, Cyprinidae). Part 1: Static method. Part 2: Semi-static method. Part 3: Flow-through method.
5. Eidgenössisches Department des Innern, Schweiz: Richtlinien fur Probenahme und Normung von Wasseruntersuchungsmethoden -Part II 1974.
6. DIN Testverfahren mit Wasserorganismen, 38 412 (11) und 1 (15).
7. JIS K 0102, Acute toxicity test for fish.
8. NEN 6506- Water -Bepaling van de akute toxiciteit met behulp van Poecilia reticulata, 1980.
9. Environmental Protection Agency, Methods for the acute toxicity tests with fish, macroinvertebrates and amphibians. The Committee on Methods for Toxicity Tests with Aquatic Organisms, Ecological Research Series EPA-660-75-009, 1975.
10. Environmental Protection Agency, Environmental monitoring and support laboratory, Office of Research and Development, EPA-600/4-78-012, January 1978.
11. Environmental Protection Agency, Toxic Substance Control, Part IV, 16 March 1979.
12. Standard methods for the examination of water and wastewater, fourteen edition, APHA-AWWAWPCF, 1975.
13. Commission of the European Communities, Inter-laboratory test programme concerning the study of the ecotoxicityof a chemical substance with respect to the fish. EEC Study D.8368, 22 March 1979.
14. Verfahrensvorschlag des Umweltbundesamtes zum akuten Fisch-Test. Rudolph, P. und Boje, R. Okotoxikologie, Grundlagen fur die okotoxikologische Bewertung von Umweltchemikalien nach dem Chemikaliengesetz, ecomed 1986.
15. Litchfield, J. T.and Wilcoxon, F., A simplified method for evaluating dose effects experiments, J. Pharm, tExp. Therap., 1949, vol. 96,99.
16. Finney, D.J. Statistical Methods in Biological Assay. Griffin, Weycombe, U.K., 1978.
17. Sprague, J.B. Measurement of pollutant toxicity to fish. Bioassay methods for acute toxicity. Water Res., 1969, vol. 3,793-821.
18. Sprague, J.B. Measurement of pollutant toxicity to fish. II Utilising and applying bioassay results. Water Res. 1970, vol. 4, 3-32.
19. Stephan, C.E. Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelink). American Society for Testing and Materials, ASTM STP 634,1977, 65-84.
20. Stephan, C.E., Busch, K.A., Smith, R., Burke, J. and Andrews, R.W. A computer program for calculating an LC50. US EPA.
Primer prikladnog izvora vode za razblaživanje
Sve hemikalije moraju biti analitičke čistoće.
Voda mora biti kvalitetna destilovana voda ili dejonizovana voda sa električnom provodljivošću manjom od 5 µS/cm.
Oprema za destilaciju vode ne sme da sadrži bakarne delove.
Rastvoriti 11,76 g CaCl2·2H2O (kalcijum-hlorid dihidrat) i dopuniti vodom do zapremine od 1 L.
Rastvoriti 4,93 g MgSO4·7H2O (magnezijum-sulfat heptahidrat) i dopuniti vodom do zapremine od 1 L.
Rastvoriti 2,59 g NaHCO3 (natrijum-hidrogenkarbonat) i dopuniti vodom do zapremine od 1 L.
Rastvoriti 0,23 g KCl (kalijum-hlorid) i dopuniti vodom do zapremine od 1 L.
Rekonstituisana voda za razblaživanje
Pomešati po 25 ml svakog osnovnog rastvora i dopuniti vodom do zapremine od 1 L. Aerisati sve dok se koncentracija rastvorenog kiseonika ne izjednači sa koncentracijom kiseonika u zasićenom vazduhu.
Vrednost pH podesiti na 7,8 ± 0,2.
Ako je potrebno, pH se podešava dodavanjem NaOH (natrijum hidroksida) ili HCl (hlorovodonične kiseline).
Ovako pripremljena voda za razblaživanje ostavi se da stoji oko 12 sati i dalje se ne aeriše.
Zbir Ca i Mg jona u ovom rastvoru iznosi 2,5 mol/l. Odnos Ca i Mg jona iznosi 4:1, a Na i K jona iznosi 10:1. Ukupan alkalitet rastvora iznosi 0,8 mmol/l.
Izmene u postupku pripreme vode za razblaživanje ne smeju da utiču na sastav ili svojstva vode.
VRSTE RIBA KOJE SE PREPORUČUJU ZA ISPITIVANJE
Preporučena vrsta | Preporučeni temperaturni opseg | Preporučena ukupna dužina test jedinke |
Brachydanio rerio (Teleostei, Cyprinidae) (Hamilton-Buchanan), zebrica | 20 do 24 | 3,0 ± 0,5 |
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) | 20 do 24 | 5,0 ± 2,5 |
Cyprinus carpio (Teleostei, Cyprinidae) (Linneaus 1758), šaran | 20 do 24 | 6,0 ± 2,0 |
Oryzias latipes (Teleostei, Poeciliidae) Cyprinodontidae (Tomminck and Schlege 1850) | 20 do 24 | 3,0 ± 1,0 |
Poecilia reticulata (Teleostei, Poeciliidae) (Peters 1859), gupi | 20 do 24 | 3,0 ± 1,0 |
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque Linneaus 1758) | 20 do 24 | 5,0 ± 2,0 |
Onchorhynchus mykiss (Teleostei, Salmonidae)(Walbaum 1988), kalifornijska pastrmka | 12 do 17 | 6,0 ± 2,0 |
Leuciscus idus (Teleostei, Cyprinidae) (Linneaus 1758), jaz | 20 do 24 | 6,0 ± 2,0 |
Navedene vrste riba lako se razmnožavaju i uzgajaju. U mnogim delovima sveta ove vrste riba mogu se nabaviti u toku cele godine. Kako su navedene vrste pogodne i za uzgajanje u laboratorijskim uslovima, zdravstveno stanje i poreklo jedinki koje se koriste za ispitivanje je, uz kontrolu prisustva parazita i bolesti, uvek poznato.
PRIMER ZAVISNOSTI KONCENTRACIJE OD PROCENTA SMRTNOSTI
Primer određivanja LC50 uz pomoć logaritamskog papira

C.2. METODA ISPITIVANJA AKUTNE TOKSIČNOSTI: IMOBILIZACIJA Daphnia sp.
Metoda se zasniva na OECD TG 202 (2004) uputstvu ispitivanja.
Metoda opisuje ispitivanje akutne toksičnosti koje služi za procenu efekta supstanci na dafnije. Postojeće metode ispitivanja korišćene su u najvećoj mogućoj meri1, 2, 3.
U ovoj metodi ispitivanja koriste se sledeće definicije:
Efektivna koncentracija (EC50)jeste koncentracija supstance za koju je procenjeno da dovodi do imobilizacije 50% jedinki populacije koje su izložene dejstvu supstance u toku unapred definisanog perioda. Dozvoljeno je korišćenje druge definicije uz objašnjenje i navođenje literaturnog izvora.
Imobilisane životinje jesu životinje koje ne zaplivaju 15 sekundi nakon što je rastvor u posudi za ispitivanje lagano uzburkan (čak i u slučaju da i dalje pokreću antene).
Mlade dafnije (neonate), starosti do 24 sata na početku ispitivanja, neprekidno se izlažu ispitivanoj supstanci u seriji koncentracija u toku 48 sati. Broj imobilisanih jedinki beleži sena svaka 24 i 48 sati, a vrednosti se porede sa vrednostima u kontrolnoj grupi. Analizom rezultata izračunava se EC50 nakon 48 sata (videti definicije iz odeljka 1.2. ove metode). Izračunavanje EC50 nakon 24 sata nije obavezno.
1.4. PODACI O ISPITIVANOJ SUPSTANCI
Potrebno je imati podatke o rastvorljivosti u vodi i naponu pare ispitivane supstance. Treba da bude dostupna i pouzdana analitička metoda za kvantifikaciju supstance u ispitivanom rastvoru sa podacima o efikasnosti i granicama detekcije. Od koristi su i podaci o strukturnoj formuli, čistoći supstance, stabilnosti u vodi i na svetlu, koeficijent raspodele u sistemun-oktanol/voda (Pow) i rezultati ispitivanja biorazgradljivosti (videti metodu C.4. koja je data u ovom prilogu).
Napomena: Smernice za izvođenje ispitivanja na supstancama sa fizičkim i hemijskim svojstvima koja ih čine teškim za ispitivanje mogu se naći u uputstvu4.
Efektivna koncentracija (EC50) referentne supstance određuje se da bi se potvrdila pouzdanost uslova ispitivanja. Za ovu namenu preporučuje se upotreba toksičnih supstanciLIV koje su korišćene u međulaboratorijskim ispitivanjima1, 5. Ispitivanja sa referentnom supstancom izvode se jednom mesečno, a najmanje dva puta godišnje.
______________
LIV Na osnovu rezultata međulaboratorijskih ispitivanja i Tehničke ispravke ISO 6341 standarda, opseg EC50 za kalijum-dihromat (K2Cr2O7) iznosi 0,6 mg/l do 1,7 mg/l.
Da bi ispitivanje bilo prihvaćeno, moraju se zadovoljiti sledeći kriterijumi kvaliteta:
U posudama za ispitivanje u kojima su kontrolne grupe (uključujući i grupe koje sadrže rastvarač), procenat imobilisanih dafnija na kraju ispitivanja ne sme biti veći od 10%.
U posudama za ispitivanje, uključujući i posude u kojima su kontrolne grupe, koncentracija rastvorenog kiseonika na kraju ispitivanja mora biti ≥ 3 mg/l.
Napomena: Da bi se zadovoljio prvi kriterijum, u kontrolnim grupama procenat imobilisanih dafnija ne sme biti veći od 10%. Pored toga, ne sme biti više od 10% jedinki koje pokazuju bilo kakve znake bolesti ili stresa, poput gubljenja boje, ili neko drugo nesvojstveno ponašanje.
1.7.1. Oprema
Posude za ispitivanje i ostala oprema koja dolazi u dodir sa ispitivanim rastvorom treba da bude od stakla ili nekog drugog hemijski inertnog materijala. Najčešće se kao posude za ispitivanje koriste epruvete ili čaše. Pre svake upotrebe posude moraju biti oprane standardnim postupkom za pranje laboratorijskog posuđa. Isparavanje vode i upadanje prašine u rastvor tokom ispitivanja, treba preduprediti poklapanjem posuda, ali tako da poklopac ne prijanja u potpunosti. Lako isparljive supstance treba ispitivati u dobro zatvorenim posudama, koje su napunjene do vrha ispitivanim rastvorom, dovoljno velike zapremine da se izbegne da kiseonik nedostaje ili pad koncentracije rastvorenog kiseonika ispod kriterijuma kvaliteta (videti odeljak 1.6. i prvi pasus odeljka 1.8.3. ove metode).
Neophodna je i sledeća oprema (sva ili samo pojedini aparati):
- oksimetar (sa mikro-kiseoničnom elektrodom ili neka druga oprema pogodna za merenje koncentracije kiseonika u maloj zapremini uzorka);
- pH metar;
- pogodna oprema za kontrolu temperature;
- oprema za određivanje koncentracije ukupnog organskog ugljenika (u daljem tekstu: TOC);
- oprema za određivanje hemijske potrošnje kiseonika (u daljem tekstu: HPK);
- oprema za određivanje tvrdoće vode, itd.
1.7.2. Ispitivani organizam
Za ispitivanje se koristi vrsta Daphnia magna Straus, a pogodne su i ostale vrste roda Daphnia (npr. Daphnia pulex). Na početku ispitivanja, jedinke (neonate) moraju biti mlađe od 24 sata, a da bi se smanjila varijabilnost, izričito se preporučuje da se ne uzimaju iz prvog legla adulta. Poreklo jedinki mora biti iz zdravog legla (u kom jedinke ne pokazuju bilo kakve znake stresa poput visoke smrtnosti, prisustva mužjaka, pojave omotača (ephippia), kašnjenja u dobijanju legla, obezbojene jedinke, itd). Sve jedinke koje se koriste u konkretnom ispitivanju treba da potiču iz legla koje je ustanovljeno iz jednog matičnog legla. Matična legla se gaje u uslovima koji su u pogledu svetlosnog i temperaturnog režima i medijuma slični onim u toku ispitivanja. U slučaju da je medijum za gajenje dafnija drugačiji od onog koji se koristi u ispitivanju, uvodi se aklimatizacioni period. Adultne jedinke, od kojih će se dobiti neonate koje se koriste u ispitivanju, prebacuju se u medijum za razblaživanje najmanje 48 sati pre početka ispitivanja i drže, do samog početka ispitivanja, na temperaturi na kojoj će se izvoditi ispitivanje.
1.7.3. Voda za gajenje i razblaživanje
Prirodna voda (površinska ili podzemna), rekonstituisana voda ili dehlorisana vodovodna voda predstavljaju pogodnu vodu za gajenje dafnija i vodu za razblaživanje ispitivanog rastvora, pod uslovom da dafnije u njima preživljavaju u toku uzgoja, aklimatizacionog perioda i u toku ispitivanja, ne pokazujući znake stresa. Bilo koja voda koja zadovoljava svojstva prihvatljive vode za razblaživanje (videti Deo drugi ove metode) pogodna je za ispitivanje. Kvalitet vode mora biti ujednačen u toku celog ispitivanja. Rekonstituisana voda se priprema tako što se u dejonizovanu ili destilovanu vodu dodaje tačna količina potrebnih sastojaka poznate analitičke čistoće. Primeri rekonstituisane vode mogu se naći u literaturi1, 6 i u Delu trećem ove metode. Važno je napomenuti da medijume koji sadrže helatizirajuće supstance, poput medijuma M4 i M7 (videti Deo treći ove metode), ne treba koristiti kada se ispituju supstance koje sadrže metale. Vrednost pH treba da bude u opsegu od 6 do 9. Za ispitivanje sa vrstom Daphnia magna preporučuje se tvrdoća vode od 140 mg/l CaCO3 do 250 mg/l CaCO3, dok je za druge vrste roda Daphnia pogodnija niža tvrdoća vode. Voda za razblaživanje se aeriše pre korišćenja u ispitivanju, da bi koncentracija rastvorenog kiseonika dostigla zasićenje.
Ako se koristi prirodna voda, parametre kvaliteta treba meriti najmanje dva puta godišnje ili kad god se posumnja da je došlo do značajnih promena karakteristika (videti prethodni pasus i Deo drugi ove metode). Treba izmeriti i sadržaj teških metala (npr. Cu, Pb, Zn, Hg, Cd, Ni). Ako se koristi dehlorisana vodovodna voda, poželjno je svakodnevno meriti sadržaj hlora. Ako se koristi površinska ili podzemna voda, treba izmeriti elektroprovodljivost i TOC ili HPK.
1.7.4. Ispitivani rastvori
Ispitivani rastvori izabranih koncentracija najčešće se prave razblaživanjem osnovnog rastvora. Zbog toga se osnovni rastvor dobija direktnim rastvaranjem ispitivane supstance u vodi za razblaživanje. Treba, u najvećoj mogućoj meri, izbegavati upotrebu rastvarača, emulzifikatora i disperezionih sredstava. U nekim slučajevima ove pomoćne supstance su neophodne kako bi se uspešno napravio koncentrovani osnovni rastvor. Upotreba rastvarača, emulzifikatora i disperzionih sredstava opisana je u literaturi4. Koncentracija ispitivane supstance u rastvoru ne sme da pređe granicu rastvorljivosti supstance u vodi za razblaživanje.
Ispitivanje treba izvesti bez podešavanja pH vrednosti. Ako dođe da značajnije promene pH vrednosti, preporučuje se ponavljanje ispitivanja uz podešavanje pH vrednosti na vrednost koju je voda za razblaživanje imala pre rastvaranja ispitivane supstance. Podešavanje pH vrednosti izvodi se tako da se koncentracija ispitivane supstance u osnovnom rastvoru značajnije ne promeni, kao i da se izbegne bilo kakva hemijska reakcija ili precipitacija ispitivane supstance. Za podešavanje pH vrednosti uglavnom se koriste rastvori HCl i NaOH.
1.8.1. Uslovi
1.8.1.1. Ispitivane i kontrolne grupe
Posude za ispitivanje pune se odgovarajućim zapreminama vode za razblaživanje i ispitivanim rastvorima. Zapreminski odnos vazduh/voda treba da bude jednak u svim ispitivanim i kontrolnim grupama. Nakon toga se dafnije unose u posude za ispitivanje. U ispitivanju se za svaku koncentraciju, kao i kontrolnu grupu, koristi najmanje po 20 jedinki, podeljenih u 4 grupe (ponavljanja) od po 5 jedinki. Zapremina rastvora mora biti dovoljna da obezbedi minimum 2 ml rastvora po jedinki, odnosno, minimalna zapremina po posudi za ispitivanje mora da bude 10 ml. Ispitivanje se odvija u polu-statičnim (uz kompletno periodično obnavljanje ispitivanog rastvora) ili u protočnim sistemima, ako koncentracije ispitivane supstanca nisu stabilne.
U svakom ispitivanju, obavezno je postaviti po jednu kontrolnu grupu (4 posude sa po 5 jedinki) isključivo sa vodom korišćenom za razblaživanje. Ukoliko je korišćena i pomoćna supstanca pri pravljenju rastvora, postavlja se i dodatna kontrolna grupa sa pomoćnom supstancom rastvorenom u vodi za razblaživanje.
1.8.1.2. Određivanje koncentracije
Kada nisu dostupni podaci o toksičnosti ispitivane supstance, a u cilju određivanja opsega ispitivanih koncentracija, izvodi se preliminarno ispitivanje. Preliminarno ispitivanje se izvodi u širokom opsegu koncentracija ispitivane supstance, pa je dovoljno postaviti po 5 jedinki po kontrolnoj i ispitivanoj grupi (bez ponavljanja). Dužina preliminarnog ispitivanja može biti 48 sati, ali ako se potrebni podaci dobiju u kraćem roku, ispitivanje se može prekinuti nakon 24 sata.
Preliminarno ispitivanje se postavlja u 5 ispitivanih koncentracija, u geometrijskoj seriji sa faktorom od minimum 2,2. Obrazloženje je neophodno ako se koristi manje od 5 različitih ispitivanih koncentracija. U preliminarnom ogledu, izlaganje dafnija najvišoj primenjenoj koncentracija treba da dovede do 100% imobilizacije, dok izlaganje najnižoj izabranoj koncentraciji ne treba da dovede do značajnijeg odgovora.
1.8.1.3. Uslovi u toku ispitivanja
Temperatura na kojoj se izvode ispitivanja za procenu akutne toksičnosti treba da bude u opsegu od 18 °C do 22 °C, a u toku jednog ispitivanja akutne toksičnosti, izabrana temperatura ne sme da varira više od ± 1 °C. Preporučuje se svetlosni režim od 16 sati svetla i 8 sati mraka, ali je kod fotonestabilnih supstanci dozvoljeno da se celo ispitivanje izvede u mraku.
U toku ispitivanja, nije dozvoljena aeracija rastvora u posudama. Ispitivanje treba izvesti bez podešavanja pH vrednosti. Životinje se ne hrane u toku trajanja ispitivanja.
1.8.1.4. Dužina ispitivanja
Ispitivanje traje 48 sati.
1.8.2. Posmatrani odgovor
Svaka posuda se proverava nakon 24 i 48 sati od početka ispitivanja (videti definicije iz odeljka 1.2. ove metode). Pored imobilizacije jedinki, prati se i beleži svako neuobičajeno ponašanje ili pojava.
1.8.3. Merenja
Koncentracija rastvorenog kiseonika i pH vrednost mere se na početku i na kraju ispitivanja u kontrolnoj i u ispitivanoj grupi u kojoj je primenjena najviša koncentracija ispitivane supstance. Koncentracija rastvorenog kiseonika u kontrolnim grupama mora zadovoljavati kriterijume kvaliteta (videti odeljak 1.6. ove metode). Ni u jednom ispitivanju pH vrednost ne treba da varira za više od 1,5. Temperatura se obično prati u posudama iz kontrolnih grupa ili u prostoriji u kojoj je postavljen ogled. Preporuka je da se temperatura neprekidno prati, a najmanje na početku i na kraju ispitivanja.
Koncentracije supstance treba izmeriti u grupama sa najnižom i najvišom koncentracijom, na početku i na kraju ispitivanja4. Preporučuje se da se rezultati tumače na osnovu izmerenih koncentracija. Ako se dokaže da se koncentracija ispitivane supstance ne menja u odnosu na nominalnu ili početno izmerenu za više od ± 20%, rezultati se mogu iskazati na osnovu nominalnih ili početno izmerenih vrednosti.
Uz pomoć postupaka opisanih u ovoj metodi, može se izvesti granična studija sa koncentracijom ispitivane supstance od 100 mg/l ili sa vrednošću koncentracije rastvorljivosti supstance u medijumu (uvek se bira niža od ove dve vrednosti) kako bi se pokazalo da je LC50 viša od ove koncentracije. Granična studija se izvodi sa 20 jedinki dafnije, podeljenih u 4 grupe od po 5 jedinki po posudi i sa istim brojem i rasporedom jedinki u kontrolnoj grupi. Ako dođe do imobilizacije jedinki u ispitivanoj grupi, obavezno se izvodi potpuno ispitivanje. Mora se zabeležiti svako neuobičajeno ponašanje jedinki.
Svi podaci dobijeni ispitivanjem akutne toksičnosti navode se tabelarno. Za svaku ispitivanu i kontrolnu grupu navodi se broj jedinki na početku ispitivanja i broj imobilisanih jedinki za svaki posmatrani interval.
Procenat imobilisanih jedinki nakon 24 i 48 sati grafički se prikazuje u funkciji ispitivanih koncentracija. Podaci se analiziraju primerenom statističkom metodom (npr. probit analiza), izračunava se nagib krive i EC50 sa 95% intervalima poverenja (p = 0,05).
Ukoliko za dobijene rezultate standardne metode za izračunavanje EC50 nisu primenljive, za aproksimaciju EC50 uzima se geometrijska sredina između dve ispitivane koncentracije - najviše ispitivane koncentracije koja nije dovela do imobilizacije i najniže ispitivane koncentracije koja je dovela do imobilizacije 100% jedinki u ispitivanoj grupi.
Izveštaj o ispitivanju mora da sadrži podatke o:
1) ispitivanoj supstanci:
- fizička i najvažnija fizička i hemijska svojstva;
- podaci o hemijskim svojstvima, uključujući čistoću supstance;
2) ispitivanoj vrsti:
- podaci o poreklu i vrsti dafnija, dobavljač (ako je poznat), uslovi laboratorijskog gajenja kulture (uključujući poreklo, količine i vrstu hrane, dinamiku ishrane);
3) uslovima u toku ispitivanja:
- opis posuda: tip posude, zapremina rastvora, broj jedinki po posudi, broj posuda po ispitivanoj koncentraciji (grupi);
- način pripreme osnovnog i ispitivanog rastvor, uključujući i podatke o upotrebi pomoćne supstance (vrsta i koncentracije);
- opis vode korišćene za razblaživanje; poreklo i osnovne svojstva (pH, tvrdoća, odnos Ca/Mg, odnos Na/K, alkalitet, elektroprovodljivost..), sastav rekonstituisane vode (ako je korišćena);
- uslovi inkubacije: temperatura, intenzitet svetla i svetlosni režim, koncentracija kiseonika, pH vrednost, itd;
4) rezultatima:
- broj i procenat imobilisanih jedinki ili jedinki koje su pokazale znake stresa (uključujući atipično ponašanje) u kontrolnim i svim ispitivanim grupama, u trenutku posmatranja, kao i opis uočenog odgovora;
- rezultate i datum ispitivanja sa referentom supstancom, ako su dostupni;
- nominalne koncentracije ispitivane supstance i rezultate svih merenja koncentracije ispitivane supstance u posudama, efikasnost analitičke metode korišćene za merenja i granice detekcije;
- rezultate svih merenja osnovnih fizičko-hemijskih parametara u toku ispitivanja (pH, koncentracija rastvorenog kiseonika);
- vrednost EC50 nakon 48 sati za imobilizaciju kao posmatrani parametar sa intervalom poverenja i grafički prikaz regresionog modela korišćenog za izračunavanje EC50 vrednosti; nagib krive dozne zavisnosti i standardna greška, statističke metode korišćene za izračunavanje EC50 vrednosti (ovi podaci se prilažu i ukoliko su izračunati za rezultate dobijene nakon perioda od 24 sata);
- objašnjenje za svako odstupanje od metode i da li je odstupanje uticalo na rezultate ispitivanja.
1. ISO 6341. (1996). Water quality - Determination of the inhibition of the mobility of Daphnia magna Straus (Cladocera, Crustacea) - Acute toxicity test. Third edition, 1996.
2. EPA OPPTS 850.1010. (1996). Ecological Effects Test Guidelines - Aquatic Invertebrate Acute Toxicity Test, Freshwater Daphnids.
3. Environment Canada. (1996) Biological test method. Acute Lethality Test Using Daphnia spp. EPS 1/RM/11. Environment Canada, Ottawa, Ontario, Canada.
4. Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publication. Series on Testing and Assessment. No 23. Paris 2000.
5. Commission of the European Communities. Study D8369. (1979). Inter-laboratory Test Programme concerning the study of the ecotoxicity of a chemical substance with respect to Daphnia.
6. OECD Guidelines for the Testing of Chemicals. Guideline 211: Daphnia magna Reproduction Test, adopted September 1998.
7. Stephan C.E. (1977). Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelink). ASTM STP 634 - American Society for Testing and Materials. p. 65-84
8. Finney D.J. (1978). Statistical Methods in Biological Assay. 3rd ed. London. Griffin, Weycombe, UK.
HEMIJSKE OSOBINE PRIHVATLJIVE VODE ZA RAZBLAŽIVANJE
Supstanca | Koncentracija |
Suspendovane materije | < 20 mg/l |
Ukupni organski ugljenik | < 2 mg/l |
Nejonizovan amonijak | < 1 μg/l |
Rezidualni hlor | < 10 μg/l |
Ukupni organofosforni pesticidi | < 50 ng/l |
Ukupni organohlorni pesticidi plus polihlorovani bifenili | < 50 ng/l |
Ukupni organski hlor | < 25 ng/l |
PRIMERI REKONSTITUISANE VODE ISO VODA ZA ISPITIVANJE1
Osnovni rastvori | Zapremine osnovnih rastvora koje treba dodati i dopuniti do 1 L vodeII radi pripreme rekonstituisane vode | |
Supstanca | Konc. supstance u vodiLV | |
Kalcijum-hlorid CaCl2·2H2O | 11,76 g/l | 25 ml |
Magnezijum-sulfat MgSO4·7H2O | 4,93 g/l | 25 ml |
Natrijum-bikarbonat NaHCO3 | 2,59 g/l | 25 ml |
Kalcijum-hlorid KCl | 0,23 g/l | 25 ml |
____________
LV voda prihvatljive čistoće, npr. dejonizovana, destilovana ili voda dobijena reverznom osmozom, sa električnom provodljivošću ispod 10 μS/cm
ELANDT M4 I M7 MEDIJUM
Adaptacija na Elandt M4 i M7 medijum
Laboratorije su imale poteškoće kod direktnog prebacivanja dafnija u Elandt M4 i M7 medijum. Bolji uspeh se postiže postepenom aklimatizacijom, na primer premeštanje dafnija iz sopstvenog u 30% Elandt, pa u 60% Elandt pa tek onda u 100% Elandt. Može biti potrebno i do mesec dana aklimatizacionog perioda.
Priprema
Mikronutrijenti
Posebni osnovni rastvori (I) pojedinih mikronutrijenata pripremaju se korišćenjem vode prihvatljive čistoće, npr. dejonizovane, destilovane ili vode dobijene reverznom osmozom. Od ovako pripremljenih osnovnih rastvora, pravi se sledeći osnovni rastvor (II), koji sadrži sve potrebne mikroelemente.
Osnovni rastvor (I): mikronutrijenti (pojedinačne supstance) | Količina koja se dodaje u vodu | Koncentracija (u odnosu na M4) | Za pripremu kombinovanog osnovnog rastvora (II), dodati sledeće zapremine osnovnih rastvora (I) i dopuniti do 1L vode* | |
M4 | M7 | |||
H3BO3 | 57.190 | 20.000 puta | 1 | 0,25 |
MnCl2·4H2O | 7.210 | 20.000 puta | 1 | 0,25 |
LiCl | 6.120 | 20.000 puta | 1 | 0,25 |
RbCl | 1.420 | 20.000 puta | 1 | 0,25 |
SrCl2·6H2O | 3.040 | 20.000 puta | 1 | 0,25 |
NaBr | 320 | 20.000 puta | 1 | 0,25 |
Na2MoO2·2H2O | 1.260 | 20.000 puta | 1 | 0,25 |
CuCl2 | 335 | 20.000 puta | 1 | 0,25 |
ZnCl2 | 260 | 20.000 puta | 1 | 1 |
CoCl2x6H2O | 200 | 20.000 puta | 1 | 1 |
KJ | 65 | 20.000 puta | 1 | 1 |
Na2SeO3 | 43,8 | 20.000 puta | 1 | 1 |
NH4VO3 | 11,5 | 20.000 puta | 1 | 1 |
Na2EDTA·2H2O | 5.000 | 2.000 puta | - | - |
FeSO4·7H2O | 1.991 | 2.000 puta | - | - |
Na2EDTA i FeSO4 pripremaju se pojedinačno, pomešaju i odmah autoklaviraju, što čini:
2 L rastvora Fe - EDTA |
| 1.000 puta | 20 | 5 |
Priprema Elandt M4 i M7 medijuma
M4 i M7 medijumi pripremaju se korišćenjem osnovnog rastvora (II), makronutrijenata i vitamina, na sledeći način:
| Količina koja se dodaje u vodu (mg/l) | Koncentracija (u odnosu na M4) | Količina osnovnog rastvora (II) koja se dodaje pri pripremi medijuma (mg/l) | |
M4 | M7 | |||
Osnovni rastvor (II) |
| 20 puta | 50 | 50 |
Osnovni rastvori makronutrijenata |
|
|
|
|
CaCl2·2H2O | 293.800 | 1.000 puta | 1,0 | 1,0 |
MgSO4·7H2O | 246.600 | 2.000 puta | 0,5 | 0,5 |
KCl | 58.000 | 10.000 puta | 0,1 | 0,1 |
NaHCO3 | 64.800 | 1.000 puta | 1,0 | 1,0 |
Na2SiO3·9H2O | 50.000 | 5.000 puta | 0,2 | 0,2 |
NaNO3 | 2.740 | 10.000 puta | 0,1 | 1,0 |
KH2PO4 | 1.430 | 10.000 puta | 0,1 | 1,0 |
K2HPO4 | 1.840 | 10.000 puta | 0,1 | 1,0 |
Kombinovani vitaminski rastvor |
|
| 0,1 | 0,1 |
Kombinovani vitaminski rastvor priprema se tako što se 3 vitamina dodaju u vodu na sledeći način:
Tiamin-hidrohlorid | 750 | 10.000 puta |
|
|
Cianokobalamin (B12) | 10 | 10.000 puta |
|
|
Biotin | 7,5 | 10.000 puta |
|
|
Kombinovani vitaminski rastvor se čuva u zamrzivaču, u malim porcijama. Vitaminski rastvor se dodaje u medijum neposredno pre upotrebe.
Napomena: Da se izbegne taloženje soli pri pripremi medijuma, pojedini rastvori se razblažuju u 500 ml do 800 ml dejonizovane vode i dopune do 1 L.
Napomena: Receptura za M4 je prvi put objavljena u "Elendt, B. P. (1990). Selenium deficiency in crustacea; an ultrastructual approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, 25-33".
C.3. ISPITIVANJE AKUTNE INHIBICIJE RASTA ALGI
Cilj ove metode ispitivanja je procena efekta supstance na rast jednoćelijskih zelenih algi. Relativno brza ispitivanja (u toku 72 sata) mogu dati procenu efekta na nekoliko generacija. Ova metoda može da se adaptira za ispitivanje nekoliko vrsta jednoćelijskih algi, ali se u tom slučaju u izveštaju o ispitivanju mora navesti detaljan opis primenjenog postupka.
Najlakša primena ove metode je kod ispitivanja supstanci koje su dobro rastvorljive u vodi i koje su stabilne u vodenim rastvorima u uslovima definisanim za ovu metodu.
Metoda se primenjuje za ispitivanje supstanci koje direktno ne ometaju merenje rasta algi.
Pre početka ispitivanja poželjno je imati, u što je većoj meri moguće, podatke o rastvorljivosti supstance u vodi, naponu pare, hemijskoj stabilnosti, konstantama disocijacije i biorazgradljivosti supstance.
Dodatni podaci (npr. strukturna formula, stepen čistoće, vrsta i procenat značajnih nečistoća, prisustvo i količina aditiva, kao i koeficijent raspodele u sistemun-oktanol/voda) uzimaju se u obzir pri planiranju ispitivanja i pri tumačenju rezultata.
1.2. DEFINICIJE I MERNE JEDINICE
Gustina ćelija jeste broj ćelija po mililitru.
Rast jeste povećanje gustine ćelija u toku trajanja ispitivanja.
Stepen rasta jeste povećanje gustine ćelija u jedinici vremena.
Efektivna koncentracija (u daljem tekstu: EC50) u ovoj metodi jeste koncentracija ispitivane supstance koja dovodi do smanjenja rasta od 50% (EbC50) ili stepena rasta (ErC50) u odnosu na kontrolu;
Koncentracija bez uočenog efekta (No Observed Effect Concentration, u daljem tekstu: NOEC) u ovoj metodi jeste najviša koncentracija ispitivane supstance pri kojoj nije uočena značajna inhibicija rasta u odnosu na kontrolu.
Sve koncentracije ispitivane supstance izražene su u mg/l. Koncentracije se mogu izraziti i u mg/kg.
Referentna supstanca se može ispitivati kako bi se pokazalo da se u laboratorijskim uslovima definisanim za datu metodu osetljivost vrste koja se koristi u ispitivanju nije značajno promenila.
Ako se ispituje referentna supstanca, rezultati se navode u izveštaju o ispitivanju. Kalijum-dihromat se može koristiti kao referentna supstanca, mada njegova boja može da utiče na kvalitet i intenzitet svetlosti koja je dostupna algama, kao i na spektrofotometrijska merenja ukoliko se koriste u ispitivanju. Kalijum-dihromat se koristi u međulaboratorijskim ispitivanjima (videti literaturu3 i Deo treći ove metode).
Granična studija se može izvesti sa ispitivanom supstancom u koncentraciji od 100 mg/l da bi se pokazalo da je vrednost EC50 veća od ove koncentracije.
Kulture izabrane vrste zelenih algi u eksponencijalnoj fazi rasta su izložene ispitivanoj supstanci u opsegu koncentracija u toku nekoliko generacija u unapred definisanim uslovima.
Rastvori ispitivane supstance koji suinokulirani sa kulturama algi inkubiraju se 72 sata. U toku ovog perioda meri se gustina ćelija u svakom rastvoru, najmanje na svaka 24 sata. Inhibicija rasta određuje se u odnosu na kontrolu.
Kriterijum kvaliteta se primenjuje na graničnu studiju kao i na konačno ispitivanje.
Gustina ćelija u kontroli treba da se poveća najmanje za faktor 16 nakon 3 dana.
Koncentracije ispitivane supstance moraju se održavati na 80% vrednosti od početnih koncentracija u toku celog perioda trajanja ispitivanja.
Za one supstance koje se dobro rastvaraju u medijumu koji se koristi u ispitivanju i obrazuju stabilne rastvore, odnosno rastvore supstance koji neće u velikoj meri isparavati, disosovati, hidrolizovati ili se adsorbovati, početna koncentracija se može smatrati ekvivalentnom nominalnoj koncentraciji. Moraju se priložiti dokazi da su koncentracije bile konstantne u toku trajanja čitavog ispitivanja i da su zadovoljeni kriterijumi kvaliteta.
Za supstance koje su slabo rastvorljive u medijumu koji se koristi u ispitivanju ili za supstance koje obrazuju stabilne emulzije ili disperzije ili za supstance koje nisu stabilne u vodenim rastvorima za početnu koncentraciju se uzima vrednost koncentracije izmerene u rastvoru na početku ispitivanja. Koncentracija se ponovo meri nakon perioda stabilizacije.
U bilo kom od navedenih slučajeva, koncentracije ispitivane supstance se moraju meriti u toku ispitivanja kako bi se utvrdila tačna koncentracija supstance kojoj su izloženi organizmi korišćeni u ispitivanju, odnosno da su zadovoljeni kriterijumi kvaliteta.
Potvrđeno je da značajne količine ispitivane supstance mogu biti ugrađene u algalnu biomasu u toku trajanja ispitivanja. U cilju utvrđivanja da li su zadovoljeni kriterijuma kvaliteta, mora se uzeti u obzir količina ispitivane supstance ugrađene u algalnu biomasu, kao i količina ispitivane supstance u rastvoru (ili, ako tehnički nije moguće izvesti, količina supstance izmerena u vodenom stubu). Merenje koncentracije ispitivane supstance u algalnoj biomasi može predstavljati značajan tehnički problem, te ispitivanje supstance u najvišoj koncentraciji bez prisustva algi i merenje koncentracije ispitivane supstance u medijumu koji se koristi u ispitivanju (ili kad to nije moguće, u vodenom stubu) na početku i na kraju ispitivanja služi kao pokazatelj da li su zadovoljeni kriterijumi kvaliteta
1.6.1. Reagensi
1.6.1.1. Ispitivani rastvori
Osnovni rastvori željene koncentracije pripremaju se rastvaranjem ispitivane supstance u dejonizovanoj vodi ili vodi prema specifikaciji iz odeljka 1.6.1.2. ove metode.
Izabrane koncentracije ispitivane supstance pripremaju se dodavanjem odgovarajućih alikvota u predkulture algi (videti Deo drugi ove metode).
Supstance se najčešće ispituju samo do granice rastvorljivosti. Za neke supstance, npr. supstance koje su slabo rastvorljive u vodi, ili imaju visok koeficijent raspodele u sistemun-oktanol/voda (Pow), ili supstance koje obrazuju stabilne disperzije, a ne prave vodene rastvore, moguće je isprobati i koncentracije iznad granice rastvorljivosti za supstancu, kako bi bili sigurni da je postignuta maksimalna rastvorljivost i koncentracija ispitivane supstance koje je stabilna u vodenom rastvoru. Važno je da ova koncentracija na drugi način ne ometa ispitivanje (npr. obrazovanjem filma na površini vode koji sprečava oksigenaciju vode, itd).
Prilikom pripreme osnovnog rastvora supstanci slabo rastvorljivih u vodi ili radi bolje disperzije ispitivane supstance direktno u medijumu koji se koristi u ispitivanju, mogu se koristiti ultrazvučna disperzija, organski rastvarači, emulgatori ili disperziona sredstva. Ako se koriste ove pomoćne supstance, svi rastvori ispitivane supstance, kao i dodatna kontrola, moraju da sadrže istu količinu pomoćnih supstanci. Upotrebu pomoćnih supstanci treba svesti na minimum i ni u kojem slučaju ne smeju da prelaze koncentraciju od 100 mg/l medijuma.
Ispitivanje se izvodi bez podešavanja pH vrednosti. Ako dođe do značajnije promene pH vrednosti, preporučuje se ponavljanje ispitivanja uz podešavanje pH vrednosti i beleženje novih rezultata. U tom slučaju, pH vrednost osnovnog rastvora mora se podesiti na pH vrednost vode koja se koristi za razblaživanje, osim u slučajevima kada postoje specifične kontraindikacije za ovaj postupak. Najčešće se za podešavanje pH vrednosti preporučuju rastvori HCl i NaOH. Podešavanje pH vrednosti mora da se izvede tako da se koncentracija ispitivane supstance u osnovnom rastvoru značajnije ne promeni. Ako u proceduri dođe do bilo kakve hemijske reakcije ili fizičkog taloženja ispitivane supstance, važno je zabeležiti ova opažanja.
1.6.1.2. Medijum koji se koristi u ispitivanju
Voda za pripremu medijuma mora biti destilovana voda visokog kvaliteta ili dejonizovana voda elektroprovodljivosti niže od 5 µS/cm. Oprema za destilaciju vode ne sme biti od bakra.
Priprema medijuma
Pripremaju se četiri osnovna rastvora, prema uputstvima datim u Tabeli. Osnovni rastvori se sterilišu membranskom filtracijom ili autoklaviranjem i skladište se u mraku na temperaturi od 4 °C. Osnovni rastvor broj 4 može se sterilisati samo membranskom filtracijom. Svi osnovni rastvori razblažuju se da bi se postigle konačne koncentracije nutrijenata u finalnim rastvorima ispitivane supstance.
Tabela:
Nutrijenti | Koncentracija u osnovnom rastvoru | Koncentracija u finalnom rastvoru |
Osnovni rastvor 1: makro nutrijenti | ||
NH4Cl | 1,5 g/l | 15 mg/l |
Osnovni rastvor 2: Fe - EDTA | ||
FeCl3 • 6H2O | 80 mg/l | 0,08 mg/l |
Osnovni rastvor 3: mikronutrijenti | ||
H3BO3 | 185 mg/l | 0,185 mg/l |
Osnovni rastvor 4: | ||
NaHCO3 | 50 g/l | 50 mg/l |
Nakon stabilizacije sa vazduhom, pH vrednost medijuma je oko 8.
1.6.2. Oprema
U opremu za ispitivanje spada:
- uobičajena laboratorijska oprema;
- posude odgovarajuće zapremine (npr. konusne posude od 250 ml su pogodne kad je količina rastvora ispitivane supstance 100 ml). Sve posude koje se koriste u ispitivanju moraju biti napravljene od istog materijala i biti istih dimenzija;
- soba ili komora za uzgajanje u kojoj se temperatura može održavati u opsegu od 21 °C do 25 °C sa odstupanjem od ± 2 °C i gde se može obezbediti neprekidno, ujednačeno osvetljenje u spektralnom opsegu od 400 nm do 700 nm. Ako su alge u kontrolnoj grupi dostigle preporučeni stepen rasta, može se pretpostaviti da su uslovi za rast, uključujući i intenzitet svetlosti, prihvatljivi.
Preporučena je upotreba svetlosti usmerene na srednji nivo visine rastvora ispitivane supstance u posudama, intenziteta od 60 µE/m2s do 120 µE/m2s (35 foton/m2s do 70 x 1.018 foton/m2s) kad se meri u području od 400 nm do 700 nm koristeći odgovarajući receptor. Za instrumente koji mere svetlost u luksima ekvivalentni prihvatljiv opseg je od 6.000 lux do 10.000 lux.
Željeni intenzitet svetlosti može se postići upotrebom 4 do 7 fluorescentnih lampi, univerzalnog belog tipa, od 30 W (temperature boje od prosečno 4300 K), na udaljenosti od 0,35 m od algalnih kultura.
Gustina algalnih ćelija meri se direktnim brojanjem živih ćelija; npr. upotrebom mikroskopa sa komorom za brojanje. Ostali postupci (fotometrija, turbidimetrija, itd) mogu da se koriste ukoliko se pokažu dovoljno osetljivim i ako dokazano postoji dobra korelacija sa gustinom ćelija.
1.6.3. Ispitivani organizmi
Preporučuju se vrste zelenih algi koje se karakterišu brzim rastom i koje su pogodne za uzgajanje i ispitivanje. Preporučuju se vrste Selenastrum capricornutum (npr. ATCCLVI 22662 ili CCAPLVII 278/4) i Scenedesmus subspicatus (npr. 86.81 SAGLVIII).
Ukoliko se ispituju druge vrste zelenih algi, u izveštaju o ispitivanju se navodi korišćena vrsta i soj.
______________
LVI American Type Culture Collection (USA)
LVII Culture Centre of Algae and Protozoa (UK)
LVIII Collection of algal culture (Gottingen, F.R.G.)
1.6.4. Procedura ispitivanja
Opseg koncentracija ispitivane supstance određuje se na osnovu rezultata preliminarnog ispitivanja.
Dve mere rasta (biomasa i stepen rasta) mogu dati potpuno različite rezultate kao meru inhibicije rasta. Koriste se oba parametra u preliminarnom ispitivanju da bi se obezbedilo da ispitivanje koncentracija u geometrijskom nizu omogućava procenu obe vrednosti EbC50 i ErC50.
Početna gustina algalnih ćelija
Preporučuje se da početna gustina algalnih ćelija bude približno 104 ćelija/ml za Selenastrum capricornutum i Scenedesmus subspicatus. Ukoliko se u ispitivanju koriste druge vrste, treba uporediti dobijene biomase.
Koncentracije ispitivane supstance
Za potrebe ispitivanja koristi se najmanje 5 koncentracija u geometrijskom nizu sa faktorom ne manjim od 2,2. Najniža primenjena koncentracija ispitivane supstance ne treba da izaziva uočljiv efekat na rast algi. Inhibicija rasta usled primene najviše koncentracije ispitivane supstance treba da iznosi najmanje 50% (a poželjno 100%) u odnosu na kontrolu.
Ponavljanja i kontrola
Ispitivanje uključuje tri ponavljanja za svaku koncentraciju ispitivane supstance. Moraju se uključiti i tri kontrole grupe bez ispitivane supstance, i, ukoliko je relevantno, dodatne tri kontrolne grupe za ispitivanje pomoćnih supstanci. Ukoliko je opravdano, ispitivanje se može izvesti sa povećanim brojem koncentracija i manjim brojem ponavljanja za svaku koncentraciju ispitivane supstance.
Izvođenje ispitivanja
Rastvori ispitivane supstance željenih koncentracija koji su inokulirani željenom količinom inokuluma algi pripremaju se dodavanjem alikvota osnovnih rastvora ispitivane supstance u odgovarajuću količini predkulturi algi (videti Deo drugi ove metode).
Posude za uzgajanje sa rastvorima ispitivane supstance inokuliranim algalnim ćelijama stavljaju se u aparaturu za uzgajanje. Algalne ćelije se održavaju u suspenziji mućkanjem, mešanjem ili aeracijom, da se obezbedi razmena gasova i smanji variranje vrednosti pH u ispitivanim rastvorima. Kulture se čuvaju na temperaturi od 21 °C do 25 °C, sa odstupanjima od ± 2 °C.
Gustina ćelija u svakoj posudi određuje se najmanje nakon 24, 48 i 72 sata od početka ispitivanja. Filtrirani medijum koji sadrži odgovarajuću koncentraciju ispitivane supstance koristi se kao slepa proba ukoliko se gustina ćelija ne određuje direktnim merenjem.
Vrednost pH meri se na početku ispitivanja i nakon 72 sata.
U toku ispitivanja pH vrednost u kontrolnom tretmanu ne sme da varira za više od 1,5.
Ispitivanje isparljivih supstanci
Ne postoji opšte prihvaćen način za ispitivanje isparljivih supstanci. Kada je poznato da je supstanca isparljiva, mogu se koristiti zatvorene posude sa povećanim vršnim delom. Verovatnoća nedostatka CO2 mora se uzeti u obzir kada se izračunava veličina vršnog dela zatvorenih posuda. Varijante ove metode date su u literaturi4.
Poželjno je odrediti količinu supstance u rastvoru koja nije isparila. Savetuje se oprez prilikom tumačenja rezultata ispitivanja sa isparljivim supstancama korišćenjem zatvorenih sistema.
Granična studija
Koristeći postupke opisane u ovoj metodi, granična studija se može izvesti u koncentraciji od 100 mg ispitivane supstance po litri medijuma da bi se dokazalo da je vrednost EC50 veća od ove koncentracije.
Ako su svojstva ispitivane supstance takve da se ne može dostići koncentracija od 100 mg/l u medijumu, granična studija se izvodi u koncentraciji jednakoj rastvorljivosti supstance (ili maksimalnoj koncentraciji koja formira stabilnu disperziju) u medijumu (videti specifikacije iz odeljka 1.6.1.1. ove metode).
Graničnu studiju treba uraditi najmanje u tri ponavljanja, sa istim brojem kontrola. Dve mere rasta (biomasa i stepen rasta) treba koristiti u graničnoj studiji.
Ukoliko je graničnom studijom utvrđena srednja vrednost inhibicije od 25% ili više, bilo u pogledu biomase ili stepena rasta u odnosu na kontrolnu, treba uraditi konačno ispitivanje.
Izmerena gustina algalnih ćelija u kulturama algi u ispitivanim i kontrolnim grupama prikazuje se u vidu tabela zajedno sa koncentracijama ispitivane supstance i vremenima merenja. Srednje vrednosti gustine algalnih ćelija za svaku od koncentracija ispitivane supstance i za kontrole prikazuju se grafički u funkciji vremena (0 do 72 sata) za dobijanje krive rasta.
Za određivanje dozne zavisnosti mogu se koristiti sledeća dva pristupa. Neke supstance mogu stimulisati rast u nižim koncentracijama. Uzimaju se u obzir samo podaci za koncentracije ispitivane supstance pri kojima je utvrđen procenat inhibicija u opsegu od 0% do 100%.
2.1. POREĐENJE POVRŠINA ISPOD KRIVE RASTA
Površina ograničena krivom rasta i horizontalnom linijom N = N0 može se izračunati prema formuli:
![]()
pri čemu: A jeste površina;
N0 jeste broj ćelija/ml u vremenu t0 (početak ispitivanja);
N1 jeste izmeren broj ćelija/ml u vremenu t1;
Nn jeste izmeren broj ćelija/ml u vremenu;
t1 jeste vreme prvog merenja nakon početka ispitivanja;
tn jeste vreme n-tog merenja nakon početka ispitivanja;
n jeste ukupan broj merenja nakon početka ispitivanja.
Procenat inhibicije rasta ćelija za svaku koncentraciju ispitivane supstance (IA) izračunava se prema formuli:
pri čemu:
Ac jeste površina ograničena krivom rasta za kontrolu i horizontalnom linijom N = N0;
At jeste površina ograničena krivom rasta za datu koncentraciju t i horizontalnom linijom N = N0.
IA vrednosti unose se na semilogaritamski papir ili na semilogaritamski probit papir u odnosu na odgovarajuće koncentracije ispitivane supstance. Ako se IA vrednosti unose na probit papir, tačke se linearizuju, proizvoljno ili kompjuterski.
Vrednost EC50 procenjuje se grafički očitavanjem koncentracije koja odgovara 50% inhibicije (IA = 50%). Za precizno definisanje ove EC50 vrednosti u odnosu na ovakav način procene, preporučeno je koristiti simbol EbC50. Važno je da se EbC50 navodi za odgovarajući vremenski period trajanja ispitivanja.
Prosečan specifičan stepen rasta (µ) za kulture u eksponencijalnoj fazi rasta izračunava se prema formuli:
pri čemu t0 jeste vreme početka ispitivanja.
Prosečna vrednost specifičnog stepena rasta se može odrediti i iz nagiba regresione prave koja se dobija plotovanjem vrednosti ln N u funkciji vremena.
Procenat inhibicije specifičnog stepena rasta za svaku koncentraciju ispitivane supstance (Iµt) izračunava se po formuli:
pri čemu:
µc jeste prosečna vrednost specifičnog stepena rasta u kontroli;
µt jeste prosečna vrednosti specifičnog stepena rasta za datu koncentraciju ispitivane supstance (t).
Procenat smanjenja prosečne vrednosti specifičnog stepena rasta za svaku koncentraciju u odnosu na vrednosti za kontrolu (t) prikazuje se grafički u funkciji logaritmovane vrednosti koncentracije. Vrednost EC50 može se očitati sa grafikona. Da bi se precizno definisala ova EC50 vrednost u odnosu na ovakav način procene, preporučeno je koristiti simbol ErC50. Vreme merenja mora biti označeno, npr. ako su vrednosti uzete za nulto vreme i 72. sat, označava se sa ErC50 (0-72h).
Napomena: specifičan stepen rasta je logaritamski termin i male promene u stepenu rasta mogu dovesti do velikih promena u biomasi. Vrednosti EbC i ErC nisu numerički uporedive.
2.3. IZRAČUNAVANJE NOEC VREDNOSTI
NOEC se procenjuje primenom odgovarajućih statističkih postupaka (npr. analiza varijanse ili Dunetov test), koristeći vrednosti za površine ispod krive rasta A za pojedinačna ponavljanja (videti odeljak 2.1. ove metode) ili vrednosti specifične stope rasta µ (videti odeljak 2.2. ove metode).
Izveštaj o ispitivanju, ako je moguće, sadrži podatke o:
1) ispitivanoj supstanci:
- podaci o hemijskoj identifikaciji;
2) organizmima koji su korišćeni u ispitivanju:
- poreklo, laboratorijska kultura, broj soja, metoda uzgajanja;
3) uslovima u kojima je ispitivanje izvođeno:
- datum početka i kraja ispitivanja, kao i trajanje ispitivanja;
- temperatura;
- sastav medijuma;
- oprema za uzgajanje;
- pH vrednost rastvora ispitivane supstance na na početku i na kraju ispitivanja (staviti dodatne napomene ukoliko su utvrđene promene pH vrednosti za više od 1,5 podeoka);
- pomoćne supstance i metode korišćene za rastvaranje ispitivane supstance, kao i koncentracija pomoćnih supstanci;
- intenzitet i kvalitet svetlosti;
- koncentracije ispitivane supstance (izmerene ili nominalne);
4) rezultatima:
- gustina algalnih ćelija za svaku posudu za svako merenje, kao i metoda merenja gustine ćelija;
- srednje vrednosti gustine algalnih ćelija;
- krive rasta;
- grafičko predstavljanje dozne zavisnosti;
- EC vrednosti i metode procene;
- NOEC;
- drugi uočeni odgovori.
1. OECD, Paris, 1981, Test Guideline 201, Decision of the Council C(81) 30 Final.
2. Umweltbundesamt, Berlin, 1984, Verfahrensvorschlag ‘Hemmung der Zellvermehrung bei der Grünalge Scenedesmus subspicatus', in: Rudolph/Boje: Ekotoxikologie, ecomed, Landsberg, 1986.
3. ISO 8692 - Water quality - Fresh water algal growth inhibition test with Scenedesmus subspicatus and Selenastrum capricornutum.
4. S. Galassi and M.Vighi - Chemosphere, 1981, vol. 10, 1123-1126.
PRIMER PROCEDURE ZA UZGAJANJE ALGALNIH KULTURA
Cilj ove procedure je obezbeđivanje algalnih kultura u optimalnom stanju za potrebe toksikoloških ispitivanja.
Koriste se odgovarajuće metode da bi se sprečila kontaminacija algalnih kultura sa bakterijama (ISO 4833). Neophodno je koristiti čiste algalne kulture, mada se mogu koristiti i "mešovite" kulture.
Potrebni su sterilni uslovi kako bi se sprečila kontaminacija bakterijama ili algama. Kontaminirane algalne kulture se odbacuju.
Procedura za uzgajanje algalnih kultura
Priprema rastvora nutrijenata (medijuma)
Medijum se može pripremiti razblaživanjem koncentrovanih osnovnih rastvora nutrijenata. Za čvrste medijume dodaje se 0,8% agara. Medijum mora biti sterilan. Sterilizacijom u autoklavu može doći do gubitka NH3.
Matična algalna kultura
Matične algalne kulture su manje kulture algi koje se redovno prenose u svež medijum i predstavljaju inicijalni materijal za ispitivanje. Ako se kulture ne koriste redovno prebacuju se na čvrsti agar.
Ove kulture se premeštaju u sveži medijum najmanje svaka dva meseca.
Matične algalne kulture uzgajaju se u konusnim posudama u odgovarajućem medijumu (količine oko 100 ml). Ako se algalne kulture inkubiraju pristalnom osvetljenju na temperaturi od 20 °C, jednom sedmično se prenose u svež medijum.
Za vreme prenošenja sterilnim pipetama manja količina "stare" kulture prenosi se u posudu sa svežim medijumom, tako da je kod brzorastućih vrsta algi početna koncentracija u svežem medijumu oko 100 puta manja nego u "staroj" kulturi.
Stepen rasta za datu vrstu algi može se odrediti iz krive rasta. Ukoliko se odredi kriva rasta za datu vrstu, moguće je proceniti pri kojoj gustini je poželjno preneti algalnu kulturu u svež medijum dok je još uvek u eksponencijalnoj fazi rasta.
Pred-kultura
Manja količina algi iz pred-kultura koristi se za inokulaciju rastvora ispitivane supstance. Pred-kultura se inkubira u uslovima identičnim uslovima u ispitivanju i koristi se dok je u fazi eksponencijalnog rasta uobičajeno nakon perioda inkubacije od tri dana. Algalne kulture se odbacuju ukoliko sadrže deformisane i abnormalne ćelije.
Rezultati uporednog ispitivanja (16 laboratorija) inhibicije rasta algi Scenedesmus subspicatus i Selenastrum capricornutumu svežoj vodiLIX sa kalijum-dihromatom:
| Srednje vrednosti (mg/l) | Interval poverenja (mg/l) |
ErC50 (0-72h) | 0,84 | 0,60 do 1,03 |
_____________
LIX ISO 8692 - kvalitet vode
C.4. ODREĐIVANJE BRZE BIORAZGRADLJIVOSTI
Za trijažu hemikalija prema brzoj biorazgradljivosti u aerobnom vodenom medijumu koriste se sledeće metode ispitivanja:
1. Nestajanje DOC (Metoda C.4-A);
2. Modifikovana OECD trijaža - Nestajanje DOC (Metoda C.4-B);
3. Razvijanje metode C.4-B (Modifikovani Sturm test) (Metoda C.4-C);
4. Manometrijska respirometrija (Metoda C.4-D);
5. Ispitivanje u zatvorenoj boci (Metoda C.4-E);
6. MITI ispitivanje (Metoda C.4-F).
Opšta i zajednička razmatranja svih šest metoda data su u odeljku 1. U odeljku 2. do 7. dati su posebni detalji za pojedine metode. Prilozi sadrže definicije, formule i uputstva.
Međulaboratorijsko poređenje, sprovedeno 1988. godine od strane OECD, pokazalo je da metode daju postojane rezultate. Zavisno od fizičkih svojstava ispitivane hemikalije, prioritet ima jedna ili druga metoda.
Rastvoreni kiseonik (Dissolved Oxygen, u daljem tekstu: DO) jeste koncentracija kiseonika rastvorenog u uzorku vode, izražava se u mg/l.
Biohemijska potrošnja kiseonika (u daljem tekstu: BPK) jeste količina kiseonika koju utroše mikroorganizmi pri razgradnji ispitivanog jedinjenja, izražava se u gramima. BPK se takođe izražava kao gram potrošenog kiseonika po gramu ispitivanog jedinjenja (videti Metodu C.5. koja je data u ovom prilogu).
Hemijska potrošnja kiseonika (u daljem tekstu: HPK) jeste količina kiseonika potrošenog u toku oksidacije ispitivanog jedinjenja sa vrućim, kiselim bihromatom; daje meru količine prisutne supstance koja oksidiše. Izražava se u gramima, i kao gram kiseonika potrošenog po gramu ispitivanog jedinjenja.
Rastvoreni organski ugljenik (Dissolved Organic Carbon, u daljem tekstu: DOC) jeste organski ugljenik prisutan u rastvoru ili onaj koji prolazi kroz 0,45 µ filter ili ostaje u supernatantu nakon centrifugiranja na 40.000 m/s2 (± 4000 g) u toku 15 minuta.
Teoretska potrošnja kiseonika (Theoretical Oxygen Demand, u daljem tekstu: ThOD) jeste ukupna količina kiseonika (u mg) potrebna da se hemikalija potpuno oksidiše. Izračunava se iz molekulske formule (videti odeljak 2.2) i takođe se izražava u mg potrebnog kiseonika po mg ispitivanog jedinjenja.
Teoretski ugljen-dioksid (Theoretical Carbon Dioxide, u daljem tekstu: ThC.4-B) jeste izračunata količina CO2 (u mg), koja nastaje iz poznatog ili izmerenog sadržaja ugljenika u ispitivanom jedinjenju, kada se ono u potpunosi mineralizuje; takođe se izražava u mg ugljen-dioksida po mg ispitivanog jedinjenja.
Ukupni organski ugljenik (TotalOrganic Carbon, u daljem tekstu: TOC) uzorka jeste suma organskog ugljenika u rastvoru i onog u suspenziji.
IC (Inorganic Carbon) jeste neorganski ugljenik.
Ukupni ugljenik (Total Carbon, u daljem tekstu: TC) jeste suma organskog i neorganskog ugljenika prisutnog u uzorku.
MITI (Ministry Of International Trade And Industry, Japan) jeste Ministarstvo međunarodne trgovine i industrije Japana.
Primarna biorazgradnja jeste promena u hemijskoj strukturi supstance izazvana biološkim delovanjem, koja dovodi do gubitka specifičnog svojstva te supstance.
Potpuna biorazgradnja (aerobna) jeste nivo razgradnje koji se postiže kada ispitivano jedinjenje u potpunosti iskoriste mikroorganizmi, pri čemu nastaju ugljen-dioksid, voda, mineralne soli i nove ćelijske strukture (biomase).
Brzo biorazgradljiva supstanca jeste arbitrarna klasifikacija hemikalija koje su prošle određene specifične skrining testove za potpunu biorazgradljivost. Ovi testovi su toliko striktni da se smatra da se takva jedinjenja brzo i potpuno biorazgrađuju u vodenoj životnoj sredini pri aerobnim uslovima.
Inherentno biorazgradljiva supstanca jeste klasifikacija hemikalija za koje, na osnovu ispitivanja biorazgradljivosti, postoji nedvosmislen dokaz da podležu biorazgradnji (primarnoj ili potpunoj).
Uklonjivost jeste podložnost jedinjenja uklanjanju putem biološkog prečišćavanja otpadnih voda, bez negativnog uticaja na uobičajeni proces obrade otpadnih voda. Brzo biorazgradljiva jedinjenja se mogu ukloniti, ali ne i sva inherentno biorazgradljiva jedinjenja. Procesu uklanjanja mogu doprineti i abiotički procesi.
Vreme kašnjenja jeste vreme od inokulacije, u ispitivanju nestanka, pa do momenta kada razgradnja dostigne nivo od najmanje 10%. Vreme kašnjenja veoma često varira i teško se reprodukuje.
Vreme razgradnje nastupa nakon vremena kašnjenja i traje do momenta kada se dostigne 90% od maksimalnog nivoa razgradnje.
Desetodnevni period je period od 10 dana koji nastupa odmah pošto se dostigne nivo razgradnje od 10%.
1.3. IZBOR ODGOVARAJUĆE METODE
Za izbor najprikladnije metode, neophodni su podaci o rastvorljivosti, naponu pare i adsorpcionim svojstvima hemikalije. Treba poznavati hemijsku strukturu ili formulu da bi se izračunale teoretske vrednosti, odnosno treba proveriti izmerene vrednosti parametara, npr. ThOD, ThC.4-B, DOC, TOC i HPK (videti Deo drugi ove metode).
Hemikalije čija rastvorljivost nije niža od 100 mg/l mogu se ispitivati svim metodama ako nisu isparljive i ako se ne adsorbuju. Za one hemikalije koje su slabo rastvorljive u vodi, isparljive ili se adsorbuju, pogodne metode su naznačene u Tabeli 1. Mogući načini postupanja sa hemikalijama koje su slabo rastvorljive u vodi i koje su isparljive opisan je u Delu trećem ove metode. Srednje isparljive hemikalije mogu se ispitati pomoću metode Nestajanje DOC (Metoda C.4-A), ako u ispitivanim posudama (koje treba da budu adekvatno zapušene) ima dovoljno prostora za gas. U ovom slučaju, obavezno se postavlja abiotička kontrola kako bi se uzeo u obzir i bilo kakav fizički gubitak.
Tabela 1: Primenljivost metoda ispitivanja
Metoda ispitivanja | Analitička metoda | Prikladnost za supstance: | ||
koje su slabo rastvorljive | koje su isparljive | koje se adsorbuju | ||
Nestajanje DOC | Rastvoreni organski ugljenik | - | - | +/- |
Modifikovana OECD trijaža - Nestajanje DOC | Rastvoreni organski ugljenik | - | - | +/- |
Razvijanje C.4-B | Respirometrija: | + | - | + |
Manometrijska respirometrija | Man. respirometrija: | + | +/- | + |
Ispitivanje u zatvorenoj boci (Metoda C.4-E) | Respirometrija: | +/- | + | + |
MITI ispitivanje | Respirometrija: | + | +/- | + |
Za tumačenje dobijenih rezultata neophodni su podaci o stepenu čistoće ili relativnom udelu glavnih sastojaka ispitivanog materijala, posebno kad su vrednosti rezultata niske ili granične.
Podaci o toksičnom dejstvu ispitivane hemikalije na bakterije (videti Deo četvrti ove metode) mogu biti vrlo korisni pri izboru prikladnih koncentracija za ispitivanje. Navedeni podaci mogu biti od suštinske važnosti za ispravno tumačenje niskih vrednosti biorazgradnje.
Za proveru postupka ispituju se referentne hemikalije koje ispunjavaju kriterijume brze biorazgradljivosti i to tako što se uporedo sa ispitivanim postave i posude sa referentnom supstancom.
Podesne hemikalije su anilin (sveže destilovan), natrijum acetat i natrijum benzoat. Referentne hemikalije razgrađuju se primenom ovih metoda čak i kad namerno nije dodat nikakav inokulum.
Sugerisano je da treba tražiti referentnu hemikaliju koja je brzo biorazgradljiva, ali zahteva dodavanje inokuluma. Predložen je kalijum hidrogen-ftalat, ali je neophodno da se pribavi još dokaza za ovu supstancu pre nego što se ona prihvati kao referentna supstanca.
U respirometrijskim ispitivanjima, jedinjenja koji sadrže azot mogu uticati na potrošnju kiseonika usled nitrifikacije (videti Deo drugi i peti ove metode).
Rastvor ili suspenzija ispitivane supstance u mineralnoj podlozi inokuliše se i inkubira u aerobnim uslovima u mraku ili pod difuznim osvetljenjem. Količina DOC u ispitivanom rastvoru koja je poreklom iz inokuluma mora da bude što niža u poređenju sa količinom DOC iz ispitivane supstance. Računa se i na endogenu aktivnost inokuluma. Uporedo se postavlja slepa proba sa inokulumom, ali bez ispitivane supstance, iako se endogena aktivnost ćelija u prisustvu supstance ne poklapa sa onom u endogenoj kontroli. Uporedo se ispituje i referentna supstanca, kako bi se proverilo izvođenje samog postupka.
Nakon razgradnje sledi određivanje parametara poput DOC, produkcija C.4-B i potrošnja kiseonika, a merenja se sprovode u dovoljno čestim vremenskim intervalima kako bi se omogućilo utvrđivanje početka i kraja biorazgradnje. Merenje se sprovodi kontinuirano automatskim respirometrima. DOC se ponekad meri uporedo sa nekim drugim parametrom, i to na početku ili na kraju ispitivanja. Procena primarne razgradnje ispitivane supstance, kao i utvrđivanje koncentracija međuproizvoda koji mogu nastati, može se utvrditi pomoću specifične hemijske analize (obavezno u MITI ispitivanju).
Ispitivanje obično traje 28 dana. Ispitivanje se može završiti i pre isteka 28 dana, odnosno čim kriva biorazgradnje dostigne plato u najmanje tri određivanja. Ispitivanje se može produžiti posle 28 dana kada se po krivoj može videti da je biorazgradnja započeta, ali plato nije dostignut 28. dana.
1.6.1. Ponovljivost
Zbog prirode biorazgradnje i mešanih populacija bakterija koje se koriste kao inokulumi, ispitivanje se mora sprovoditi najmanje u duplikatu.
Što je veća početna koncentracija mikroorganizama koja se prvobitno dodaje u ispitivanu podlogu, to je manje odstupanje između replika. Međulaboratorijska ispitivanja su pokazala da mogu postojati velika odstupanja među rezultatima dobijenih u različitim laboratorijama, mada se dobro slaganje obično postiže sa lako biorazgradljivim jedinjenjima.
1.6.2. Prihvatljivost ispitivanja
Ispitivanje se smatra validnim ukoliko na kraju ispitivanja ili na kraju 10-dnevnog perioda, zavisno od slučaja, razlika između krajnjih vrednosti, dobijenih pri dostizanju platoa razgradnje ispitivane supstance u ponovljenim ispitivanjima, iznosi manje od 20% i ako je procenat razgradnje referentne supstance dostigao nivo za brzu biorazgradljivosti od 14 dana.
Ako ni jedan od ovih uslova nije ispunjen, ispitivanje se mora ponoviti. Usled isključivosti metode, niske vrednosti nužno ne znače da ispitivana supstanca nije biorazgradljiva u uslovima životne sredine, ali ukazuju da je potrebno još rada da se ustanovi biorazgradljivost.
Ako se u ispitivanju toksičnosti, koje uključuje i ispitivanu supstancu i referentnu hemikaliju, desi manje od 35% razgradnje (na osnovu DOC) ili manje od 25% (na osnovu ThOD ili ThC.4-B) u roku od 14 dana, za ispitivanu hemikaliju se može pretpostaviti da je inhibitorna (videti Deo četvrti ove metode). Serije ispitivanja moraju se ponoviti, po mogućnosti korišćenjem niže koncentracije ispitivane hemikalije, odnosno više koncentracije inokuluma, ali ne više od 30 mg/l čvrste faze.
1.7. OPŠTE PROCEDURE I PREPARATI
Opšti uslovi koji se primenjuju u ispitivanjima navedeni su u Tabeli 2. Oprema i drugi uslovi ispitivanja specifični za svaku pojedinu metodu ispitivanja navedeni su u kod opisa konkretne metode.
Tabela 2: Uslovi u toku ispitivanja
Test | Nestajanje DOC | Razvijanje C.4-B | Manometrijska | Modif. OECD | Ispitivanje u zatvorenoj boci | MITI Ispitivanje (I) |
Koncentracija ispitivane |
|
|
|
|
|
|
kao mg/l |
|
| 100 |
| 2-10 | 100 |
mg DOC/l | 10-40 | 10-20 |
| 10-40 |
|
|
mg ThOD/l |
|
| 50-100 |
| 5-10 |
|
Koncentracija inokuluma | ≤ 30 mg/l SS | 0,5 ml sekund. efluenta/l (105) | ≤ 5 ml efluenta/l | 30 mg/l SS | ||
Koncentracija elemenata |
|
|
|
|
|
|
P | 116 | 11,6 | 29 | |||
N | 1,3 | 0,13 | 1,3 | |||
Na | 86 | 8,6 | 17,2 | |||
K | 122 | 12,2 | 36,5 | |||
Mg | 2,2 | 2,2 | 6,6 | |||
Ca | 9,9 | 9,9 | 29,7 | |||
Fe | 0,05-0,1 | 0,05-0,1 | 0,15 | |||
pH | 7,4 ± 0,2 | najbolje 7,0 | ||||
Temperatura | 22 °C ± 2 °C | 25 °C ± 1°C | ||||
SS - suspendovane čvrste materije | ||||||
1.7.1. Voda za razblaživanje
Koristi se dejonizovana ili destilovana voda, koja ne sadrži toksične supstance (npr. jone Cu2+) u inhibitornim koncentracijama. Voda ne sme sadržati više od 10% organskog ugljenika koji je unet sa ispitivanim materijalom. Visoka čistoća vode za razblaživanje neophodna je da se eliminišu visoke vrednosti u slepim probama. Kontaminacija može nastati zbog prirodno prisutnih nečistoća, kao i zbog smola jonskih izmenjivača i proizvoda razgradnje poreklom od bakterija i algi. U svakoj ispitivanoj seriji koristi se voda iz istog kontejnera, prethodno proverena pomoću DOC analize. Takva provera nije neophodna za ispitivanje u zatvorenoj boci, ali voda mora imati malu potrošnju kiseonika.
1.7.2. Osnovni rastvori mineralnih materija
Da bi se pripremili ispitivani rastvori, pripremaju se osnovni rastvori mineralnih materija u odgovarajućim koncentracijama. Mogu se koristiti sledeći osnovni rastvori (sa različitim faktorima razblaženja) za metode: nestajanje DOC, modifikovani OECD skrining test, razvijanje C.4-B, manometrijska respirometrija i ispitivanje u zatvorenoj boci.
Faktori razblaženja i priprema mineralne podloge specifična za MITI ispitivanje dati su u konkretnoj metodi ispitivanja.
Osnovni rastvori
Pomoću reagenasa analitičke čistoće pripremaju se osnovni rastvori:
1. rastvoriti u vodi i dopuniti do 1 L (pH rastvora mora biti 7,4):
- 8,50 g KH2PO4 (kalijum-dihidrogenfosfat);
- 21,75 g K2HPO4 (dikalijum-hidrogenfosfat);
- 33,40 g Na2HPO4x2H2O (dinatrijum-hidrogenfosfat dihidrat);
- 0,50 g NH4Cl (amonijum-hlorid);
2. rastvoriti u vodi i dopuniti do 1 L:
- 27,50 g CaCl2 (kalcijum-hlorid, bezvodni) ili
- 36,40 g CaCl2x2H2O (kalcijum-hlorid dihidrat);
3. rastvoriti u vodi i dopuniti do 1 L:
- 22,50 g MgSO4x7H2O (magnezijum-sulfat heptahidrat);
4. rastvoriti u vodi i dopuniti do 1 L:
- 0,25 g FeCl3x6H2O (gvožđe(III)-hlorid heksahidrat).
Napomena: Za izbegavanje pripreme ovog rastvora neposredno pre upotrebe, dodaje se jedna kapljica koncentrovane HCl ili 0,4 g/l natrijumove soli EDTA (etilendiamintetra sirćetna kiselina).
1.7.3. Osnovni rastvori hemikalija
U zavisnosti od potrebe, rastvori se od 1 g do 10 g ispitivane ili referentne hemikalije u dejonizovanoj vodi i dopuni do 1 L nakon što rastvorljivost premaši vrednost 1 g/l. U suprotnom, osnovni rastvori se pripremaju u mineralnoj podlozi ili se hemikalija dodaje direktno u mineralnu podlogu. Za postupanje sa slabije rastvorljivim hemikalijama, videti Deo treći ove metode. U MITI ispitivanju (Metoda C.4-F) ne dozvoljava se upotreba rastvarača ni emulgatora.
1.7.4. Inokulumi
Inokulum može da potiče iz raznih izvora, kao što su: aktivni mulj, otpadna voda (dehlorisana), površinske vode i zemljište ili iz smeše ovih izvora. Ako se u ispitivanjima nestajanja DOC, razvijanja C.4-B i manometrijskoj respirometriji koristi aktivni mulj, mulj se mora uzeti iz postrojenja za prečišćavanje otpadnih voda ili iz uređaja laboratorijskog tipa, koji prima pretežno otpadnu vodu iz domaćinstava. Pokazalo se da je rasipanje rezultata veće kad se koriste inokulumi iz drugih izvora. Za modifikovani OECD skrining test i ispitivanje u zatvorenoj boci, potreban je razređeniji inokulum bez folikula mulja, pa se uzima sekundarni efluent iz postrojenja za prečišćavanje komunalnih otpadnih voda ili uređaja laboratorijskog tipa. Za MITI ispitivanje, inokulum se izvodi iz mešanih izvora i dat je u konkretnoj metodi ispitivanja.
1.7.4.1. Inokulum iz aktivnog mulja
Svež uzorak aktivnog mulja uzima se iz aeracionog bazena postrojenja za prečišćavanje otpadnih voda ili uređaja laboratorijskog tipa u kojem se pretežno obrađuje komunalna otpadna voda. Veće grube čestice po potrebi se uklanjaju pomoću filtracije kroz fino sito, a mulj se nakon toga čuva u aerobnim uslovima.
Alternativno, nakon uklanjanja većih čestica, mulj se taloži ili centrifugira (npr. na 100 g u toku 10 minuta). Supernatant se baca. Mulj se može isprati u mineralnoj podlozi. Koncentrovani mulj se suspenduje u mineralnoj podlozi da se dobije koncentracija od 3 g do 5 g suspendovanih materija po litru i aeracija se sprovodi do upotrebe.
Mulj se uzima iz konvencionalnog uređaja koji ispravno radi. Mulj treba isprati ukoliko se uzima iz velikog uređaja za prečišćavanje ili se smatra da sadrži inhibitore. Nakon što se temeljno promeša, resuspendovani mulj se taloži ili centrifugira, supernatant se baca, a isprani mulj se ponovno resuspenduje u novoj zapremini mineralne podloge. Postupak se ponavlja sve dok se iz mulja ne odstrani višak supstrata ili inhibitora.
Nakon što se postigne potpuna resuspenzija ili sa neobrađenim muljem, uzima se uzorak neposredno pre određivanja suve mase suspendovanih materija.
Sledeća alternativa je homogenizacija aktivnog mulja (od 3 g/l do 5 g/l suspendovanih materija). Mulj se meša u mehaničkoj mešalici u toku 2 minuta umerenom brzinom. Promešani mulj se taloži 30 minuta ili duže, po potrebi, a tečni deo koji se koristi kao inokulum dekantuje se na 10 ml mineralne podloge.
1.7.4.2. Ostali izvori inokuluma
Inokulum može da se uzme iz sekundarnog efluenta iz postrojenja za prečišćavanje ili uređaja laboratorijskog tipa koji prima uglavnom otpadne vode iz domaćinstava. Uzme se sveži uzorak i čuva u aerobnim uslovima u toku transporta. Uzorak se taloži u toku 1 sata ili filtrira kroz grubi filter papir, a efluent ili filtrat se dekantuje i čuva u aerobnim uslovima do upotrebe. Može se koristiti do 100 ml ove vrste inokuluma po litru podloge.
Izvor inokuluma mogu da budu i površinske vode. U tom slučaju uzima se uzorak odgovarajuće površinske vode, npr. iz reke ili jezera, i čuva u aerobnim uslovima do upotrebe. Po potrebi, inokulum se koncentriše filtriranjem ili centrifugiranjem.
1.7.5. Prekondicioniranje inokuluma
Inokulumi se mogu prekondicionirati za ispitivane uslove, ali se ne mogu preadaptirati za ispitivanu hemikaliju. Prekondicioniranje se sastoji od aeracije aktivnog mulja u mineralnoj podlozi ili sekundarnom efluentu u toku 5 do 7 dana na ispitivanoj temperaturi. Prekondicioniranje nekada poboljšava preciznost postupka ispitivanja, jer smanjuje vrednosti slepe probe. Smatra se da nije potrebno prekondicionirati MITI inokulum.
1.7.6. Abiotička kontrola
Po potrebi se proverava moguća abiotička razgradnja ispitivane supstance određivanjem uklanjanja DOC, potrošnje kiseonika i razvijanja ugljen-dioksida u sterilnim kontrolama koje ne sadrže inokulum. Sterilizacija se vrši filtracijom kroz membranu promera od 0,2 µm do 0,45 µm ili dodavanjem odgovarajuće toksične supstance u odgovarajućoj koncentraciji. Ako se koristi membranska filtracija, uzorci se uzimaju aseptički da se održi sterilnost. Testovi koji mere biorazgradnju kao uklanjanje DOC, posebno sa inokulumima aktivnog mulja, treba da sadrže i abiotičku kontrolu, koja je inokulisana i otrovana, osim u slučaju kad se prethodno isključila adsorpcija ispitivane hemikalije.
1.7.7. Broj posuda za ispitivanje
Broj posuda u tipičnom načinu ispitivanja dat je u pojedinačnom ispitivanju.
Mogu se koristiti sledeće vrste posuda:
1) ispitivana suspenzija:
- sadrži ispitivanu supstancu i inokulum;
2) slepa proba sa inokulumom:
- sadrži samo inokulum;
3) kontrola postupka:
- sadrži referentnu supstancu i inokulum;
4) sterilna abiotička kontrola:
- sadrži ispitivanu supstancu (videti odeljak 1.7.6. ove metode);
5) kontrola adsorpcije:
- sadrži ispitivanu supstancu, inokulum i sredstvo za sterilizaciju;
6) kontrola toksičnosti:
- sadrži ispitivanu supstancu, referentnu supstancu i inokulum.
Određivanje u ispitivanoj suspenziji i slepoj probi sa inokulumom obavezno se rade uporedo. Savetuje se da se i određivanja u ostalim posudama rade uporedo.
Uporedo određivanje nekada nije moguće. Vodi se računa da se uzme dovoljno uzoraka i izvrši dovoljno merenja da se može proceniti procenat uklanjanja nakon desetodnevnog perioda.
Kad se izračunava procenat razgradnje (Dt) koriste se srednje vrednosti dvostrukih merenja parametara u posudi za ispitivanje i slepoj probi sa inokulumom. Formule za izračunavanje date su u pojedinim metodama ispitivanja. Tok razgradnje prikazuje se grafički i pokazuje se desetodnevni period. Izračunava se i prikazuje procenat uklanjanja koji je postignut na kraju desetodnevnog perioda i vrednost na platou ili na kraju ispitivanja, u zavisnosti šta je primerenije.
U respirometrijskim ispitivanjima jedinjenja koja sadrže azot mogu uticati na potrošnju kiseonika zbog nitrifikacije (videti Deo drugi i peti ove metode).
1.8.1. Razgradnja merena pomoću određivanja DOC
Procenat razgradnje (Dt) u trenutku uzimanja uzorka izračunava se posebno za svaku posudu koja sadrži ispitivanu supstancu pomoću srednjih vrednosti DOC iz dva merenja da bi se mogla proceniti prihvatljivost ispitivanja (videti odeljak 1.6.2. ove metode). Procenat razgradnje se izračunava prema jednačini:
![]()
pri čemu:
Dt jeste procenat razgradnje u vremenu t;
C0 jeste srednja početna koncentracija DOC u inokulisanoj podlozi koja sadrži ispitivanu supstancu (u mg DOC/l);
Ct jeste srednja koncentracija DOC u inokulisanoj podlozi koja sadrži ispitivanu supstancu u vremenu t (u mg DOC/l);
Cb0 jeste srednja početna koncentracija DOC u mineralnoj podlozi inokulisanoj slepom probom (u mg DOC/l);
Cbt jeste srednja koncentracija DOC u mineralnoj podlozi inokulisanom slepom probom u vremenu t (u mg DOC/l).
Sve koncentracije mere se eksperimentalno.
1.8.2. Razgradnja koja se meri pomoću specifične analize
Primarna biorazgradnja, kad postoje podaci za specifičnu analizu, izračunava se prema formuli:
pri čemu:
Dt jeste procenat razgradnje u vremenu t koje uobičajeno iznosi 28 dana;
Sa jeste ostatak ispitivane supstance u inokulisanoj podlozi na kraju ispitivanja (mg);
Sb jeste ostatak ispitivane supstance u slepoj probi sa vodom/podlogom kojoj je dodata samo ispitivana supstanca (mg).
1.8.3. Abiotička razgradnja
Procenat abiotičke razgradnje, kad se koristi abiotička sterilna kontrola, izračuna se pomoću formuli:
% abiotičke razgradnje = | Cs(0) - Cs(t) | x 100 |
Cs(0) |
pri čemu:
Cs(0) jeste DOC koncentracija u sterilnoj kontroli na dan 0;
Cs(t) jeste DOC koncentracija u sterilnoj kontroli na dan t.
Izveštaj o ispitivanju sadrži podatke o:
- ispitivanim i referentnim hemikalijama i njihovim čistoćama;
- uslovima u toku ispitivanja;
- inokulumu: priroda i mesto/mesta uzimanja uzorka, koncentracija i svaka obrada prekondicioniranjem;
- udelu i prirodi industrijskog otpada prisutnog u otpadnoj vodi (ako je poznato);
- dužini ispitivanja i temperaturi;
- u slučaju slabo rastvorljivih ispitivanih hemikalija, podatke o pripremi ukoliko je bilo,
- primenjenoj metodi ispitivanja(moraju se dati naučni razlozi i objašnjenja za svaku izmenu u postupku);
- obrascu za unos podataka;
- svakoj primećenoj pojavi inhibicije;
- svakoj primećenoj abiotičkoj razgradnji;
- specifičnim hemijskim analizama, ako postoje;
- analitičkim podacima o međuproizvodima, ako postoje;
- grafičkim prikazima procenta razgradnje u vremenu za određenu ispitivanu i referentnu supstancu; faza odgode, faza razgradnje, desetodnevni period i nagib moraju biti jasno označeni (videti odeljak 1.2. ove metode). Ako je ispitivanje zadovoljilo kriterijume prihvatljivosti, srednje vrednosti procenta razgradnje u posudama koje sadrže ispitivanu supstancu mogu se upotrebiti za izradu grafičkog prikaza;
- procentu uklanjanja nakon desetodnevnog perioda, kao i na platou ili na kraju ispitivanja.
2. METODA ISPITIVANJA NESTAJANJE DOC (METODA C.4-A)
Izmerena zapremina inokulisane mineralne podloge koja sadrži poznatu koncentraciju ispitivane supstance (10 mg DOC/l do 40 mg DOC/l) kao jedini nominalni izvor organskog ugljenika aeriše se u mraku ili pod difuznim osvetljenjem na temperaturi od (22 ± 2) °C.
Nakon razgradnje sledi DOC analiza u čestim vremenskim intervalima u toku perioda od 28 dana. Stepen biorazgradnje izračunava se prikazivanjem koncentracije uklonjenog DOC (korigovan za onaj DOC u kontroli sa inokulisanom slepom probom) kao procenta od koncentracije prisutne na početku. Stepen primarne biorazgradnje može se izračunati i iz dopunske hemijske analize sprovedene na početku i na kraju inkubacije.
2.2.1. Oprema
Oprema za ispitivanje sadrži:
- erlenmajer sudove 250 ml do 2 L, u zavisnosti od zapremine potrebne za DOC analizu;
- mešalicu u koju se mogu pričvrstiti erlenmajer sudovi (sa ili bez automatske kontrole temperature ili se koriste pri konstantnoj sobnoj temperaturi), dovoljne snage da održi aerobne uslove u svim posudama;
- uređaj za filtriranje, sa odgovarajućim membranama;
- DOC analizator;
- uređaj za određivanje rastvorenog kiseonika;
- centrifugu.
2.2.2. Priprema mineralne podloge
Za pripremu osnovnog rastvora videti odeljak 1.8.2. ove metode.
Pomeša se 10 ml osnovnog rastvora 1. sa 800 ml vode za razblaživanje, doda se 1 ml osnovnih rastvora 2. do 4. i dopuni se do 1 L vodom za razblaživanje.
2.2.3. Priprema i prekondicioniranje inokuluma
Inokulum se može uzeti iz raznih vrsta izvora: aktivnog mulja, komunalnog efluenta, površinskih voda, zemljišta ili smeše istih.
Videti odeljke 1.7.4, 1.7.4.1, 1.7.4.2. i 1.7.5. ove metode.
2.2.4. Priprema posuda za ispitivanje
Ulije se 800 ml mineralne podloge u dvolitarske erlenmajer sudove i dodaju se dovoljne zapremine osnovnih rastvora ispitivanih i referentnih supstanci u odvojene sudove tako da se dobije koncentracija hemijskog ekvivalenta 10 mg DOC/l do 40 mg DOC/l. Provere se pH vrednosti i dovedu, po potrebi, do 7,4. Aktivni mulj ili drugi izvori inokuluma (videti odeljak 1.7.4. ove metode) inokuliraju se u obične sudove tako da se dobije konačna koncentracija do najviše 30 mg/l suspendovanih materija. Pripreme se i kontrole inokuluma u mineralnoj podlozi, ali bez ispitivane ili referentne hemikalije.
Po potrebi, jedna posuda se koristi za proveru mogućeg inhibitornog efekta ispitivane hemikalije inokulacijom rastvora koji sadrži, u mineralnoj podlozi, slične koncentracije kako ispitivane, tako i referentne hemikalije.
Ako je potrebno postavi se još jedan sterilan običan sud da se pomoću neinokulisanog rastvora hemikalije proveri da li se hemikalija abiotički razgrađuje (videti odeljak 1.7.6. ove metode).
Ako se sumnja da se ispitivana hemikalija značajno adsorbuje na staklo, mulj, i dr. napravi se preliminarna procena da se odredi verovatni opseg adsorpcije i tako pogodnost metode ispitivanja za date hemikalije (videti Tabelu 1). Postavi se običan sud koji sadrži ispitivanu supstancu, inokulum i sredstvo za sterilizaciju.
Zapremina u svim običnim sudovima se dopuni do 1 L mineralnom podlogom i nakon mešanja, uzima se uzorak iz svakog običnog suda da se odredi početna koncentracija DOC (videti odeljak 2.4. ove metode). Otvori običnih sudova se pokriju, npr. aluminijskom folijom, ali tako da se omogući slobodna razmena vazduha između običnog suda i okolne atmosfere. Zatim se posuda stavi na mešalicu da bi se započelo ispitivanje.
2.2.5. Broj običnih sudova u tipičnom ispitivanju
- ispitivana suspenzija: obični sudovi br. 1 i 2;
- slepa proba sa inokulumom: obični sudovi br. 3 i 4;
- kontrola postupka: običan sud broj 5.
Preporučeno i po potrebi:
- sterilna abiotička kontrola: običan sud broj 6;
- kontrola adsorpcije: običan sud broj 7;
- kontrola toksičnosti: običan sud broj 8.
Videti odeljak 1.7.7. ove metode.
2.2.6. Postupak
Tokom ispitivanja, koncentracije DOC u svakom običnom sudu određuju se u duplikatu u poznatim vremenskim intervalima, dovoljno često da se može odrediti početak desetodnevnog perioda i procenat uklanjanja na kraju desetodnevnog perioda. Uzima se samo minimalna zapremina ispitivane suspenzije potrebna za svako određivanje.
Pre uzimanja uzoraka gubitak nastao isparavanjem iz tikvica po potrebi se nadoknađuje dodavanjem vode za razblaživanje (videti odeljak 1.8.1. ove metode) u odgovarajućoj količini. Pre uzimanja uzorka, podloga za kulturu temeljno se promeša i osigura se da materijal koji prileže uz zidove posude bude rastvoren i suspendovan. Filtrira se kroz membrane ili centrifugira (videti odeljak 2.4. ove metode) odmah nakon uzimanja uzorka. Filtrirani ili centrifugirani uzorci analiziraju se istog dana; u suprotnom, čuvaju se najviše 48 sati na temperaturi od 2 °C do 4 °C ili na temperaturi ispod -18 °C u toku dužeg perioda.
2.3.1. Obrada rezultata
Izračuna se procenat razgradnje u vremenu t kako je opisano u odeljku 1.8.1. ove metode (određivanje DOC) i, po izboru, u odeljku 1.8.2. ove metode (specifična analiza).
Rezultati se zapisuju na obrascima za unos podataka.
2.3.2. Prihvatljivost rezultata
Videti odeljak 1.6.2. ove metode.
2.3.3. Izveštaj
Videti odeljak 1.9. ove metode.
Primer obrasca za unos podataka:
METODA ISPITIVANJA NESTAJANJA DOC
1. LABORATORIJA
2. DATUM POČETKA ISPITIVANJA
3. ISPITIVANA SUPSTANCA
Hemijski naziv:
Koncentracija osnovnog rastvora:... mg/l kao hemikalija
Početna koncentracija u podlozi, do/prema:... mg/l kao hemikalija
4. INOKULUM
Izvor:
Sprovedena obrada:
Prekondicioniranje, ako je sprovedeno:
Koncentracija suspendovanih materija u reakcionoj smeši: … mg/l
5. ODREĐIVANJE UGLJENIKA
Analizator ugljenika:
6. PROCENA NEOBRAĐENIH PODATAKA
Napomena: Za referentne hemijske kontrole i kontrole toksičnosti mogu se koristiti slični obrasci.
7. ABIOTIČKA KONTROLA (po izboru)
| Vreme (u danima) | |
0 | t | |
DOC koncentracija (mg/l) u sterilnoj kontroli | Cs(0) | Cs(t) |
8. SPECIFIČNA HEMIJSKA ANALIZA (po izboru)
| rezidualna količina ispitivane supstance na kraju ispitivanja (mg/l) | % primarne |
Sterilna kontrola | Sb |
|
Inokulisana ispitivana podloga | Sa |
|
3. MODIFIKOVANI OECD SKRINING TEST (METODA C.4-B)
Izmerena zapremina mineralne podloge koja sadrži poznatu koncentraciju ispitivane supstance (10 mg DOC/l do 40 mg DOC/l) kao jedini nominalni izvor organskog ugljenika inokulira se sa 0,5 ml efluenta po litru medijuma. Smeša se aeriše u mraku ili pod difuznim osvetljenjem na 22 °C ± 2 °C.
Nakon razgradnje sledi DOC analiza u čestim razmacima u toku 28 dana. Stepen biorazgradnje izračunava se prikazivanjem koncentracije uklonjenog DOC (korigovanog za onaj u kontroli koju predstavlja inokulisana slepa proba) kao procenat od koncentracije prisutne na početku. Stepen primarne biorazgradnje može se izračunati i iz dodatne hemijske analize koja se radi na početku i na kraju inkubacije.
3.2.1. Oprema
Oprema za ispitivanje sadrži:
- erlenmajer sudove zapremine od 250 ml do 2 L, u zavisnosti od zapremine potrebne za DOC analizu;
- mešalicu (u koju se mogu pričvrstiti erlenmajer sudovi sa automatskom kontrolom temperature ili bez, ako se koriste pri konstantnoj sobnoj temperaturi) dovoljne snage da održi aerobne uslove u svim posudama;
- uređaj za filtriranje, sa odgovarajućim membranama;
- DOC analizator;
- uređaj za određivanje rastvorenog kiseonika;
- centrifugu.
3.2.2. Priprema mineralne podloge
Za pripremu osnovnog rastvora, videti odeljak 1.7.2. ove metode.
Pomešati 10 ml osnovnog rastvora 1. sa 80 ml vode za razblaživanje, dodati 1 ml osnovnog rastvora 2. do 4. i dopuniti vodom za razblaživanje do ukupne zapremine od 1 L.
U ovom postupku se koristi samo 0,5 ml/l efluenta kao inokulum, pa bi podlogu trebalo obogatiti elementima u tragovima i faktorima rasta. To se postiže dodatkom 1 ml svakog od sledećih rastvora po litru gotove podloge:
1. Rastvor elemenata u tragovima:
- 39,9 mg MnSO4x4H2O (mangan-sulfat tetrahidrat);
- 57,2 mg H3BO3 (borna kiselina);
- 42,8 mg ZnSO4x7H2O (cink-sulfat heptahidrat);
- 34,7 mg (NH4)6Mo7O24 (amonijum heptamolibdat);
- 100,0 mg FeCl3 i EDTA (helat gvožđa).
Rastvoriti u vodi za razblaživanje i dopuniti vodom do ukupno 1.000ml.
2. Rastvor vitamina:
- ekstrakt kvasca 15,0 mg.
Rastvoriti ekstrakt kvasca u 100 ml vode. Sterilisati filtracijom kroz membranu od 0,2 µ ili pripremiti neposredno pred upotrebu.
3.2.3. Priprema i prekondicioniranje inokuluma
Inokulum se uzima iz sekundarnog efluenta iz postrojenja za prečišćavanje ili uređaja laboratorijskog tipa koji prima pretežno otpadnu vodu iz domaćinstava. Videti odeljke 1.7.4.2. i 1.7.5. ove metode.
Koristi se 0,5 ml po litru mineralnog medijuma.
3.2.4. Priprema običnih sudova
Sipa se 800 ml mineralne podloge u dvolitarske erlenmajer sudove i doda se dovoljno velika zapremina osnovnih rastvora ispitivane i referentne supstance u odvojene obične sudove da se dobije koncentracija hemijskog ekvivalenta 10 mg DOC/l do 40 mg DOC/l. Proveri se pH vrednost i po potrebi dovede na 7,4. Izlazni efluent inokuliše se u obične sudove u koncentraciji od 0,5 ml po litru (videti odeljak 1.7.4.2. ove metode). Pripreme se i kontrole inokuluma u mineralnoj podlozi, ali bez ispitivane ili referentne hemikalije.
Po potrebi, koristi se jedna posuda da se proveri mogući inhibitorni efekat ispitivane hemikalije inokulacijom rastvora koji sadrži, u mineralnoj podlozi, slične koncentracije i ispitivane i referentne hemikalije.
Ako je potrebno, postavi se još jedan sterilan običan sud da se pomoću neinokulisanog rastvora hemikalije proveri da li se ispitivana hemikalija razgrađuje abiotički (videti odeljak 1.8.6. ove metode).
Ako se sumnja da se ispitivana hemikalija značajno adsorbuje na staklo, mulj, itd. radi se preliminarna procena da se odredi verovatni opseg adsorpcije i time pogodnost metode za ispitivanje te hemikalije (videti Tabelu 1). Postavi se običan sud koji sadrži ispitivanu supstancu, inokulum i sredstvo za sterilizaciju.
U sve obične sudove dodaje se mineralna podloga do zapremine od 1 L. Nakon mešanja, uzima se uzorak iz svakog pojedinog običnog suda da se odredi početna koncentracija DOC (videti odeljak 2.4. ove metode). Pokriju se otvori običnih sudova, npr. sa aluminijskom folijom, ali tako da se omogući razmena vazduha između običnog suda i okolne atmosfere. Zatim se posude stavljaju na mešalicu i započinje se sa ispitivanjem.
3.2.5. Broj običnih sudova u tipičnom ispitivanju
Redni broj običnih sudova:
- ispitivana suspenzija: obični sudovi br. 1 i 2;
- slepa proba sa inokulumom: obični sudovi br. 3 i 4;
- kontrola postupka: običan sud broj 5.
Preporučeno i po potrebi:
- sterilna abiotička kontrola: običan sud broj 6;
- kontrola adsorpcije: običan sud broj 7;
- kontrola toksičnosti: običan sud broj 8.
Videti odeljak 1.7.7. ove metode.
3.2.6. Postupak
Tokom čitavog ispitivanja, koncentracije DOC određuju se u svakom običnom sudu u duplikatu u poznatim vremenskim intervalima, dovoljno često da se može odrediti početak desetodnevnog perioda i procenat uklanjanja na kraju desetodnevnog perioda. Uzima se samo minimalna zapremina ispitivane suspenzije potrebne za svako određivanje.
Pre uzimanja uzoraka zapremina koja se izgubila isparavanjem iz tikvica nadoknađuje se po potrebi dodavanjem vode za razblaživanje (videti odeljak 1.7.1. ove metode) u odgovarajućoj količini. Pre uzimanja uzorka, podloga se temeljno promeša i pazi se da materijal koji prileže uz zidove posude bude rastvoren ili suspendovan. Odmah nakon uzimanja, uzorak se membranski filtrira ili centrifugira (videti odeljak 2.4. ove metode). Filtrirani ili centrifugirani uzorci analiziraju se istog dana; u suprotnom, čuvaju se na 2 °C do 4 °C u toku najviše 48 sati ili na temperaturi manjoj od -18 °C u toku dužeg perioda.
3.3.1. Obrada rezultata
Izračuna se procenat razgradnje u vremenu t kako je dato u odeljku 1.8.1. ove metode (DOC određivanje) i po izboru, u odeljku 1.8.2. ove metode (specifična analiza).
Rezultati se zapisuju na obrascima za unos podataka.
3.3.2. Prihvatljivost rezultata
Videti odeljak 1.6.2. ove metode.
3.3.3. Izveštaj
Videti odeljak 1.9. ove metode.
Primer obrasca za unos podataka:
MODIFIKOVANA OECD TRIJAŽA
1. LABORATORIJA
2. DATUM POČETKA ISPITIVANJA
3. ISPITIVANA SUPSTANCA
Hemijski naziv:
Koncentracija osnovnog rastvora:... mg/l kao hemikalija
Inicijalna koncentracija u podlozi, do:... mg/l kao hemikalija
4. INOKULUM
Izvor:
Obavljena obrada:
Prekondicioniranje, ako je obavljeno:
Koncentracija suspendovanih materija u reakcionoj smeši: … mg/l
5. ODREĐIVANJE UGLJENIKA
Analizator ugljenika:
http://s1.paragraflex.rs/documents/Old/t/t2011_06/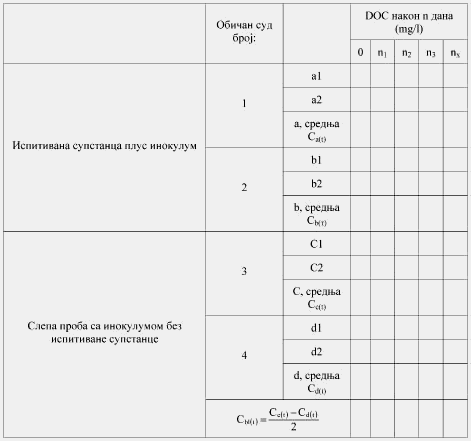
6. PROCENA NEOBRAĐENIH PODATAKA

Napomena: Za referentne hemijske kontrole i kontrole toksičnosti mogu se koristiti slični obrasci.
7. ABIOTIČKA KONTROLA (po izboru)
| Vreme (u danima) | |
0 | t | |
DOC koncentracija (mg/l) u sterilnoj kontroli | Cs(0) | Cs(t) |
![]()
8. SPECIFIČNA HEMIJSKA ANALIZA (po izboru)
| rezidualna količina ispitivane supstance na kraju ispitivanja (mg/l) | % primarne razgradnje |
Sterilna kontrola | Sb |
|
Inokulisana ispitivana podloga | Sa |
|
4. RAZVIJANJE METODE C.4-B (METODA C.4-C)
Izmerena zapremina inokulisane mineralne podloge koja sadrži poznatu koncentraciju ispitivane hemikalije (10 mg do 20 mg DOC ili TOC/l) kao jedini nominalni izvor organskog ugljenika aeriše se prolaskom vazduha bez ugljen-dioksida pri kontrolisanoj brzini u mraku ili pod difuznim osvetljenjem. Razgradnja se prati u toku 28 dana određivanjem proizvedenog ugljen-dioksida, koji se hvata barijum ili natrijum hidroksidom i meri titracijom rezidualnog hidroksida ili kao neorganski ugljenik. Količina ugljen-dioksida proizvedena iz ispitivane hemikalije (korigovano za onu količinu izvedenu iz slepe probe sa inokulumom) izražava se kao procenat ThC.4-B. Stepen biorazgradnje može se izračunati i iz dodatne DOC analize koja se obavlja na početku i na kraju inkubacije.
4.2.1. Oprema
Oprema za ispitivanje sadrži:
- obične sudove, od 2 L do 5 L, svaki opremljen sa cevčicom za vazduh koja doseže skoro do dna posude i otvorom;
- magnetne mešalice, ako se ispituju slabo rastvorljive hemikalije;
- boce za apsorpciju gasova;
- uređaj za kontrolu i merenje protoka vazduha;
- opremu za uklanjanje ugljen-dioksida, tj. za pripremu vazduha koji ne sadrži ugljen-dioksid; alternativno se može koristiti smeša kiseonika bez C.4-B i azota bez C.4-B, iz gasnih cilindara, u pravoj proporciji (20% O2 : 80% H 2);
- uređaj za određivanje ugljen-dioksida, ili titrimetrijski ili pomoću nekog tipa analizatora neorganskog ugljenika;
- uređaj za membransku filtraciju (nije obavezan);
- DOC analizator (nije obavezan).
4.2.2. Priprema mineralne podloge
Za pripremu osnovnog rastvora videti odeljak 1.8.2. ove metode.
Pomeša se 10 ml osnovnog rastvora 1. sa 800 ml vode za razblaživanje, doda se 1 ml osnovnog rastvora 2. do 4. i dopuni vodom za razblaživanje do ukupno 1 L.
4.2.3. Priprema i prekondicioniranje inokuluma
Inokulum se može uzeti iz raznih izvora: aktivnog mulja; efluenata otpadne vode; površinskih voda, zemljišta ili iz smeše istih.
Videti odeljke 1.7.4, 1.7.4.1, 1.7.4.2. i 1.7.5. ove metode.
4.2.4. Priprema običnih sudova
Kao primer, dole navedene zapremine i težine pokazuju vrednosti koje se koriste za petolitarske obične sudove koje sadrže 3 L suspenzije. Ako se koriste manje zapremine, vrednosti se moraju prilagoditi, s tim da se stvoreni ugljen-dioksid mora tačno meriti.
U svaki petolitarski običan sud sipa se 2.400 ml mineralne podloge. Doda se odgovarajuća zapremina pripremljenog aktivnog mulja (videti odeljak 1.7.4.1. i 1.7.5. ove metode) tako da se u konačnoj inokulisanoj mešavini od 3 L dobije koncentracija suspendovanih materija od najviše 30 mg/l. Alternativno, prvo se može razrediti pripremljeni mulj da se formira suspenzija od 500 mg/l do 1.000 mg/l u mineralnoj podlozi pre dodavanja uzorka - tako da se dobije koncentracija od 30 mg/l. Postupak obezbeđuje veću preciznost. Mogu se koristiti i ostali izvori inokuluma (videti odeljak 1.7.4.2. ove metode).
Inokulirane smeše aerišu se vazduhom koji ne sadrži C.4-B u toku noći, da se sistem pročisti od ugljen-dioksida.
Ispitivani materijal i referentna supstanca dodaju se odvojeno, kao poznate zapremine osnovnih rastvora, u običnim sudovima u duplikatu, tako da finalne koncentracije, kojima su doprinele dodate hemikalije, budu od 10 mg do 20 mg DOC ili TOC/l.U neke obične sudove ne dodaju se hemikalije i one služe kao kontrola inokuluma. Slabo rastvorljive ispitivane supstance dodaju se direktno u obične sudove na bazi težine ili zapremine, kao što je opisano u Delu trećem ove metode.
Po potrebi, jedan običan sud se koristi za proveru mogućeg inhibitornog efekata ispitivane hemikalije tako što se dodaju i ispitivana i referentna hemikalija u istim koncentracijama u kojima su prisutne u drugim običnim sudovima.
Po potrebi, jedan sterilan običan sud koristi se kako bi se upotrebom neinokulisanog rastvora hemikalije proverilo da li se ispitivana hemikalija razgrađuje abiotički (videti odeljak 1.8.6. ove metode). Steriliše se dodavanjem toksične supstance u odgovarajućoj koncentraciji.
Suspenzija se u svim običnim sudovima dopuni do zapremine od 3 L dodavanjem mineralne podloge prethodno aerisane vazduhom koji ne sadrži C.4-B. Po izboru, mogu se izvući uzorci za analizu DOC (videti Deo drugi ove metode), odnosno uzorci za specifičnu analizu. Apsorpcione boce spajaju se sa otvorima za vazduh na običnim sudovima.
Ako se koristi barijum-hidroksid, spoje se tri apsorpcione boce, od kojih svaka sadrži 100 ml rastvora barijum-hidroksida od 0,0125 M, u seriji sa svakim petolitarskim običnim sudom. Navedeni rastvor ne sme da sadrži istaloženi sulfat ni karbonat i njegova jačina mora da se odredi neposredno pre upotrebe. Ako se koristi natrijum hidroksid, spajaju se dve klopke, od kojih druga ima ulogu kontrole, da se pokaže da se sav ugljen-dioksid apsorbovao u prvoj. Pogodne su apsorpcione boce sa gumenim čepom. U svaku bocu se doda po 200 ml 0,05 M natrijum-hidroksida, što je dovoljno da se apsorbuje ukupna količina ugljen-dioksida koja se razvije kad ispitivana hemikalija bude potpuno razgrađena. Rastvor natrijum-hidroksida, čak i kad je sveže pripremljen, sadrži tragove karbonata, što se koriguje oduzimanjem vrednosti karbonata u slepoj probi.
4.2.5. Broj običnih sudova u tipičnom ispitivanju
Redni broj običnih sudova:
- ispitivana suspenzija: obični sudovi br. 1 i 2;
- slepa proba sa inokulumom: obični sudovi br. 3 i 4;
- kontrola postupka: običan sud broj 5.
Preporučeno i po potrebi:
- sterilna abiotička kontrola: običan sud broj 6;
- kontrola adsorpcije: običan sud broj 7;
- kontrola toksičnosti: običan sud broj 8.
Videti odeljak 1.7.7. ove metode.
4.2.6. Postupak
Ispitivanje započinje propuštanjem mehurića vazduha koji ne sadrži C.4-B kroz suspenzije brzinom od 30 ml/min do 100 ml/min. Periodično se uzimaju uzorci apsorbenta ugljen dioksida za analizu sadržaja C.4-B. Tokom prvih 10 dana preporučuje se da se analiza uradi svaki drugi ili treći dan, a zatim svaki peti dan sve do 28. dana, tako da se može identifikovati desetodnevni period.
Dvadesetosmog dana, uzimaju se uzorci (po izboru) za DOC, odnosno za specifičnu analizu, meri se pH suspenzije i dodaje 1 ml koncentrovane hlorovodonične kiseline u svaki običan sud. Preko noći obični sudovi se aerišu da se izvuče ugljen-dioksid prisutan u ispitivanim suspenzijama. Dvadesetdevetog dana radi se poslednja analiza stvorenog ugljen-dioksida.
Na dane merenja C.4-B, odvaja se apsorber sa barijum hidroksidom koji je najbliži običnom sudu i hidroksidni rastvor se titrira sa 0,05 M HCl, pri čemu se fenolftalein koristi kao indikator. Preostali apsorberi se pomiču za jedno mesto bliže običnom sudu i postavlja se novi apsorber koji sadrži 100 ml svežeg 0,0125 M barijum hidroksida na najdalji kraj serije. Titracije se rade po potrebi, npr. kad se vidi velika precipitacija u prvoj klopci, a pre nego postane vidljiva u drugoj, ili najmanje jednom nedeljno. Alternativno se može, sa NaOH kao apsorbentom, pipetom izvući mali uzorak (u zavisnosti od karakteristika upotrebljenog analizatora ugljenika) rastvora natrijum hidroksida u apsorberu bližem običnom sudu. Uzorak se injektira direktno u IC deo analizatora ugljenika za analizu nastalog ugljen-dioksida.
Sadržaj druge klopke analizira se na kraju ispitivanja, radi korekcije za eventualni preneti ugljen-dioksid.
4.3.1. Obrada rezultata
Kad se istitrira, količina C.4-B uhvaćenog u apsorberu izražava se pomoću formule:
mgCO2 = (100 x CB - 0.5 x C x CA) x 44
pri čemu:
V jeste zapremina HCl upotrebljene za titraciju 100 ml u apsorberu (ml);
CB jeste koncentracija rastvora barijum hidroksida (M);
CA jeste koncentracija rastvora hlorovodonične kiseline (M).
Ako CB iznosi 0,0125 M i CA iznosi 0,05 M, titracija za 100 ml barijum hidroksida jeste 50 ml, a masu C.4-B daje izraz:
0,05 | x 44 x ml titrirane HCL = 1,1 x ml HCL | |
2 |
U ovom slučaju, za prevođenje zapremine istitrovane HCl u mg proizvedenog C.4-B primenjuje se faktor 1,1.
Izračunaju se mase C.4-B proizvedenog iz čistog inokuluma i inokuluma sa ispitivanom hemikalijom pomoću odgovarajućih titracijskih vrednosti, a dobijena razlika je masa C.4-B proizvedenog samo iz ispitivane hemikalije.
Na primer, ako sam inokulum daje titraciju od 48 ml, a inokulum sa ispitivanom hemikalijom daje 45 ml:
C.4-B iz inokuluma = 1,1 x (50-48)=2,2 mg
C.4-B iz inokuluma sa ispitivanom
hemikalijom = 1,1 x (50-45) = 5,5 mg
Masa C.4-B proizvedenog iz ispitivane hemikalije iznosi 3,3 mg.
Procenat biorazgradnje izračunava se formulom:
% razgradnje = | mg proizvedenog C.4 - B x 100 | |
ThC.4 - B x mg dodate ispitivane hemikalije |
ili formulom:
% razgradnje = | mg proizvedenog C.4 - B x 100 | |
mg TO dodatog prilikom ispitivanja x 3.67 |
uz 3,67 kao faktor konverzije (44/12) za ugljenik u ugljen-dioksid.
Da bi se dobio procenat razgradnje nakon bilo kog vremenskog intervala, doda se procenat vrednosti ThC.4-B izračunate za svaki pojedini dan, do vremena na koji se radilo merenje.
Za apsorbere od natrijum hidroksida, izračuna se količina proizvedenog ugljen-dioksida, izražena kao IC (mg), množenjem koncentracije IC u apsorbentu sa zapreminom apsorbenta.
Procenat razgradnje izračunava se formulom:
% ThC.4 - B = | mg IC običnog suda - ml IC (slepe probe) | |
MG TOC dodat kao ispitivana hemikalija |
Uklanjanje DOC (po izboru) se izračuna na način iz odeljka 1.8. ove metode. Rezultati se zapisuju u obrascima za unos podataka.
4.3.2. Prihvatljivost rezultata
Sadržaj IC u suspenziji ispitivane hemikalije u mineralnoj podlozi na početku ispitivanja mora da iznosi manje od 5% TC, a ukupno razvijeni C.4-B u slepoj probi sa inokulumom na kraju ispitivanja ne sme normalno da premaši 40 mg/l podloge. Ako se dobiju vrednosti iznad 70 mg C.4-B/l, podaci i ispitivana tehnika se moraju kritički ispitati.
Videti odeljak 1.6.2. ove metode.
4.3.3. Izveštaj
Videti odeljak 1.9. ove metode.
Primer obrasca za unos podataka:
METODA ISPITIVANJA RAZVIJANJA C.4-B
1. LABORATORIJA
2. DATUM POČETKA ISPITIVANJA
3. ISPITIVANA SUPSTANCA
Hemijski naziv:
Koncentracija osnovnog rastvora:... mg/l kao hemikalija
Početna koncentracija u podlozi:... mg/l kao hemikalija
Ukupni C dodat u običnu posudu :... mg C
ThC.4-B: … mg C.4-B
4. INOKULUM
Izvor:
Sprovedena obrada:
Prekondicioniranje, ako je sprovedeno:
Koncentracija suspendovanih materija u reakcionoj smeši:... mg/l
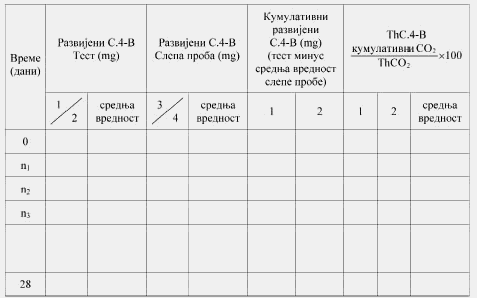
Napomena: Slični formati mogu se koristiti za referentne hemijske kontrole i kontrole toksičnosti.
6. ANALIZA UGLJENIKA (PO IZBORU)
Analizator ugljenika
Vreme (u danima) | Slepa proba (mg/l) | Test hemikalija (mg/l) |
0 | Cb(0) | C0 |
28 (*) | Cb(t) | Ct |
(*) ili na kraju inkubacije | ||
![]()
7. ABIOTIČKA RAZGRADNJA (po izboru)
% abiotičke razgradnje = | CO2 nastao u običnoj posudi nakon 28 dana[mg] | x 100 |
ThCO2[mg] |
5. MANOMETRIJSKA RESPIROMETRIJA (METODA C.4-D)
Odmerena zapremina inokulisane mineralne podloge, koja sadrži poznatu koncentraciju ispitivane hemikalije (100 mg/l ispitivane supstance, da se dobije najmanje 50 mg ThOD/l do 100 mg ThOD/l) kao jedini nominalni izvor organskog ugljenika, meša se u zatvorenom običnom sudu na stalnoj temperaturi (± 1°C ili manje) ne duže od 28 dana. Potrošnja kiseonika određuje se ili pomoću merenja količine kiseonika (proizvedenog elektrolizom) potrebnog da se održi konstantna zapremina gasa u običnom sudu respirometra ili iz promena u zapremini ili pritisku (ili kombinacijom ova dva načina) u opremi. Razvijeni ugljen-dioksid apsorbuje se u rastvoru kalijum hidroksida ili drugog pogodnog apsorbenta. Količina kiseonika koju potroši ispitivana hemikalija (korigovano za potrošnju inokuluma iz slepe probe, radi se uporedo) izražava se kao procenat ThOD ili HPK. Po izboru, primarna biorazgradnja može se izračunati i iz dodatne specifične analize urađene na početku i na kraju inkubacije, a krajnja biorazgradnja pomoću DOC analize.
5.2.1. Oprema
Oprema za ispitivanje sadrži:
- pogodni respirometar;
- kontrolu temperature, koja se održava unutar ± 1 °C ili manje;
- sistem za membransku filtraciju (nije obavezan);
- analizator ugljenika (nije obavezan).
5.2.2. Priprema mineralne podloge
Za pripremu osnovnog rastvora, videti odeljak 1.7.2. ove metode.
Pomeša se 10 ml osnovnog rastvora 1 sa 800 ml vode za razblaživanje, doda se 1 ml osnovnog rastvora 2 do 4 i dopuni do zapremine od 1 L sa vodom za razblaživanje.
5.2.3. Priprema i prekondicioniranje inokuluma
Inokulum se može uzeti iz raznih vrsta izvora: aktiviranog mulja, efluenta otpadnih voda, površinskih voda i zemljišta ili smeše istih.
Videti odeljke 1.7.4, 1.7.4.1, 1.7.4.2. i 1.7.5. ove metode.
5.2.4. Priprema običnog suda
Rastvori ispitivanih i referentnih hemikalija pripremaju se u odvojenim serijama, u mineralnoj podlozi ekvivalentno koncentraciji obično od 100 mg hemikalije/l (dajući najmanje 50 mg ThOD/ldo 100 mg ThOD/l), pomoću osnovnih rastvora.
ThOD se izračunava na osnovu nagrađenih soli amonijaka, osim u slučaju kad se očekuje nitrifikacija. Tada se izračunavanje bazira na stvaranju nitrata (videti odeljak 2.2. ove metode).
Odrede se pH vrednosti i po potrebi svedu na vrednosti od 7,4 ± 0,2.
Slabo rastvorljive supstance moraju se dodati u kasnijoj fazi.
Ako se određuje toksičnost ispitivane hemikalije, priprema se još jedan rastvor u mineralnoj podlozi koja sadrži i ispitivanu i referentnu hemikaliju u istim koncentracijama kao i pojedinačni rastvori.
Ako se mora meriti fizičko-hemijska potrošnja kiseonika, priprema se rastvor ispitivane hemikalije u koncentraciji obično od 100 mg ThOD/l koja je prethodno bila sterilisana dodatkom odgovarajuće toksične supstance (videti odeljak 1.7.6. ove metode).
Potrebna zapremina svakog od rastvora ispitivane i referentne hemikalije sipa se u najmanje dva obična suda. U ostale obične sudove dodaje se samo mineralna podloga (za kontrolu inokuluma) i po potrebi, pomešani rastvori ispitivane/referentne supstance i sterilni rastvor.
Ako je ispitivana supstanca slabo rastvorljiva, u ovoj fazi se ona dodaje direktno na osnovu mase ili zapremine, ili se obrađuje na način iz odeljka 3. ove metode. U odeljke C.4-B apsorbera dodaju se kalijum-hidroksid, zrnca natrijum i kalcijum-hidroksida (kreč) ili drugi apsorbensi.
5.2.5. Broj običnih sudova u tipičnom ispitivanju
Redni broj običnih sudova:
- ispitivana suspenzija: obični sudovi br. 1 i 2;
- slepa proba sa inokulumom: obični sudovi br. 3 i 4;
- kontrola postupka: običan sud broj 5.
Preporučeno i po potrebi:
- sterilna kontrola: običan sud broj 6;
- kontrola toksičnosti: običan sud broj 7.
Videti odeljak 1.7.7. ove metode.
5.2.6. Postupak
Nakon što se u posudama postigne željena temperatura, u odgovarajuće posude se inokuliše pripremljeni aktivni mulj ili inokulum iz drugog izvora da se dobije koncentracija suspendovanih materija ne veća od 30 mg/l. Sastavi se oprema, pokrene mešalica, proveri se izolacija vazduha i započne sa merenjem potrošnje kiseonika. Obično nije potreban dodatni oprez osim što se moraju raditi obavezna očitavanja i svakodnevno proveravati da je temperatura tačna i da mešalica radi.
Potrošnja kiseonika izračunava se iz očitavanja obavljenih u redovnim i čestim intervalima, pomoću postupaka koje je dao proizvođač opreme. Na kraju inkubacije, obično od 28 dana, izmeri se pH vrednost sadržaja običnih sudova, posebno ako je potrošnja kiseonika niska ili veća od ThODNH4 (za jedinjenja koja sadrže azot).
Po potrebi se uzimaju uzorci iz respirometrijskih običnih sudova, na početku i na kraju, za analizu DOC ili specifične hemikalije (videti odeljak 2.4. ove metode). Kad se prvi put uzimaju uzorci, mora se znati zapremina test suspenzije koja je preostala u običnom sudu. Kad test supstanca koja sadrži azot troši kiseonik, određuje se porast koncentracije nitrita ili nitrata u toku 28 dana i izračuna se korekcija za kiseonik potrošen u nitrifikaciji (videti Deo peti ove metode).
5.3.1. Obrada rezultata
Kiseonik (mg) koji je potrošila ispitivana hemikalija u određenom vremenskom periodu (korigovan za onaj pomoću kontrole slepe probe sa inokulumom u istom vremenskom periodu) podeli se sa masom upotrebljene ispitivane hemikalije. Time se dobije BPK izražen kao mg kiseonika po mg ispitivane hemikalije, to jest:
BPK = | mg potrošnja O2 ispitivane hemikalije - mg potrošnja O2 slepe probe | |
mg ispitivane hemikalije u običnom sudu |
= mg O2 po ispitivane mg hemikalije
Procenat biorazgradnje izračunava se pomoću jednačine:
% razgradnje = % ThOD = | BPK (mg O2 / mg ispitivane hemikalije) | x 100 |
ThOD (mg O2 / mg ispitivane hemikalije) |
ili jednačine:
% HPK = | BPK (mg O2 / mg ispitivane hemikalije) | x 100 |
HPK (mg O2 / mg ispitivane hemikalije) |
Mora se istaći da ova dva postupka ne daju obavezno iste vrednosti. Prednost se daje prvom postupku.
Za ispitivanje supstanci koje sadrže azot, koristi se odgovarajući ThOD (NH4 ili NO3) u zavisnosti od toga šta se zna ili šta se očekuje u vezi sa pojavom nitrifikacije (videti odeljak 2.2. ove metode). Ako nastupi nitrifikacija, ali ne bude potpuna, izračuna se korekcija za kiseonik potrošen u nitrifikaciji iz promena u koncentraciji nitrita i nitrata (videti Deo peti ove metode).
Kad se rade opciona određivanja organskog ugljenika, odnosno specifične hemikalije, procenat razgradnje se izračunava na način iz odeljka 1.8. ove metode.
Rezultati se zapisuju u obrasce za unos podataka.
5.3.2. Prihvatljivost rezultata
Potrošnja kiseonika slepe probe sa inokulumom normalno iznosi 20 mg/lO2 do 30 mg/l O2 i ne sme biti veća od 60 mg/l u 28 dana. Ako su vrednosti veće od 60 mg/l, treba kritički proveriti podatke i ispitivane tehnike. Ako pH vrednost izlazi izvan opsega od 6 do 8,5 i potrošnja kiseonika ispitivane hemikalije je manja od 60% kiseonika, ispitivanje se mora ponoviti sa nižim koncentracijama ispitivane hemikalije.
Videti odeljak 1.6.2. ove metode.
5.3.3. Izveštaj
Videti odeljak 1.9. ove metode.
Primer obrasca za unos podataka:
MANOMETRIJSKA RESPIROMETRIJA
1. LABORATORIJA
2. DATUM POČETKA ISPITIVANJA
3. ISPITIVANA SUPSTANCA
Hemijski naziv:
Koncentracija osnovnog rastvora:... mg/l
Početna koncentracija u podlozi, Co :... mg/l
Zapremina u običnom sudu (V):... ml
ThOD ili HPK:... mg O2/... mg ispitivane supstance (NH4 ili NO3)
4. INOKULUM
Izvor:
Sprovedena obrada:
Prekondicioniranje, ako je obavljeno:
Koncentracija suspendovanih materija u reakcionoj smesi:... mg/l
5. POTROŠNJA KISEONIKA: BIORAZGRADLJIVOST
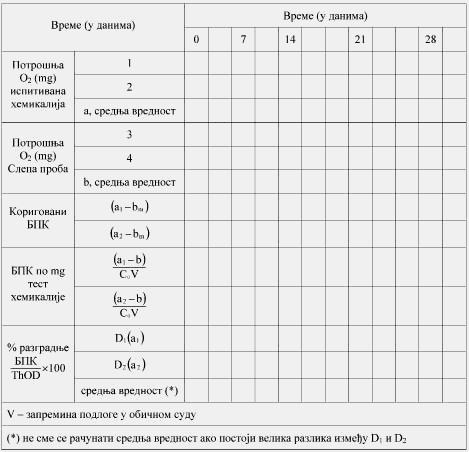
Napomena: Slični obrasci mogu se koristiti za referentnu hemikaliju i kontrolu toksičnosti.
6. KOREKCIJA ZBOG NITRIFIKACIJE (videti Deo peti ove metode)
Dan | 0 | 28 | razlika | |
(I) | Koncentracija nitrata (mg N/L) |
|
| (N) |
(II) | Ekvivalent kiseonika (4,57 × N × V) (mg) | - | - |
|
(III) | Koncentracija nitrita (mg N/L) |
|
| (N) |
(IV) | Ekvivalent kiseonika (3,43 × N × V) (mg) | - | - |
|
(II+IV) | Ukupni ekvivalent kiseonika | - | - |
|
7. ANALIZA UGLJENIKA (po izboru)
Analizator ugljenika:
Vreme (u danima) | Slepa proba (mg/l) | Test hemikalija (mg/l) |
0 | Cbl0 | C0 |
28 (*) | Cblt | Ct |
(*) ili na kraju inkubacije | ||
![]()
8. SPECIFIČNA HEMIKALIJA (po izboru)
Sb = koncentracija u fizičko-hemijskoj (sterilnoj) kontroli 28. dana
Sa = koncentracija u inokulisanom običnom sudu 28. dana
% biorazgradnje = | Sb - Sa | x 100 |
Sb |
Pri čemu:
Sb jeste koncentracija u fizičko-hemijskoj (sterilnoj) kontroli 28. dana;
Sa jeste koncentracija u inokulisanom običnom sudu 28. dana
9. ABIOTIČKA RAZGRADNJA (po izboru)
potrošnja O2 po mg ispitivane hemikalije = | a x 100 | |
CnV |
(videti odeljak 1. i 3.)
% abiotičke razgradnje = | a x 100 | |
CnV x ThOD |
Pri čemu a jeste potrošnja kiseonika u sterilnom običnom sudu nakon 28 dana, (mg).
6. METODA ISPITIVANJA U ZATVORENOJ BOCI (METODA C.4-E)
Rastvor ispitivane hemikalije u mineralnoj podlozi, obično 2 mg/l do 5 mg/l, inokuliše se sa relativno malim brojem mikroorganizama iz mešane populacije i čuva u potpuno punim, zatvorenim bocama u mraku na stalnoj temperaturi. Nakon razgradnje sledi analiza rastvorenog kiseonika u toku 28 dana. Količina kiseonika koju veže ispitivana hemikalija, korigovana za kiseonik koji je potrošila uporedna slepa proba sa inokulumom, izražava se kao procenat ThOD ili HPK.
6.2.1. Oprema
Oprema za ispitivanje sadrži:
- BPK boce sa staklenim zatvaračima, npr. 250 ml do 300 ml;
- vodeno kupatilo ili inkubator, za čuvanje boca na stalnoj temperaturi (± 1 °C ili manje) bez svetla;
- velike staklene boce (od 2 L do 5 L) za pripremu podloge i za punjenje BPK boca;
- kiseoničnu elektrodu i merni instrument ili opremu i reagense za Vinklerovu titraciju (Winkler titration).
6.2.2. Priprema mineralne podloge
Za pripremu osnovnog rastvora, videti odeljak 1.7.2. ove metode.
Pomeša se 1 (jedan) ml osnovnog rastvora 1 do 4 i dopuni do zapremine od 1 L sa vodom za razblaživanje.
6.2.3. Priprema inokuluma
Inokulum se normalno dobija iz sekundarnih otpadnih voda postrojenja za prečišćavanje ili uređaja laboratorijskog tipa koji prima uglavnom otpadnu vodu iz domaćinstava. Alternativni izvor inokuluma su površinske vode. Obično se koristi jedna kapljica (od 0,05 ml do 5,0 ml filtrata po litru podloge). Da bi se pronašla optimalna zapremina za određenu otpadnu vodu, ponekad će biti potrebno više pokušaja (videti odeljke 1.7.4.2. i 1.7.5. ove metode).
6.2.4. Priprema običnih sudova
Mineralna podloga se temeljno aeriše u toku najmanje 20 minuta. Svaka ispitivana serija postavlja se sa mineralnom podlogom dobijenom iz iste serije. Podloga je spremna za upotrebu nakon što odstoji 20 sati, na ispitivanoj temperaturi. Odredi se koncentracija rastvorenog kiseonika zbog kontrole. Vrednost koncentracije mora da iznosi oko 9 mg/l na 20 °C. Prilikom prenosa i punjenja podloge zasićene vazduhom ne smeju se stvoriti mehurići, što se postiže pomoću sifona.
Pripreme se paralelno grupe BPK boca za određivanje ispitivane i referentne hemikalije u uporednim serijama. Prikupi se dovoljan broj BPK boca, uključujući slepe probe sa inokulumom, da se potrošnja kiseonika može meriti najmanje u duplikatu u željenim intervalima, npr. nakon 0, 7, 14, 21 i 28 dana. Da bi se identifikovao desetodnevni period, može biti potrebno više boca.
Velike boce se pune potpuno aerisanom mineralnom podlogom do jedne trećine zapremine. Zatim se sipa dovoljno osnovnog rastvora ispitivane hemikalije i referentne hemikalije u odvojene velike boce, tako da konačna koncentracija hemikalije ne bude veća od 10 mg/l. U podlogu sa slepom probom kao kontrolnom u narednoj velikoj boci ne dodaju se nikakve hemikalije.
Da bi se osiguralo da aktivnost inokuluma ne bude ograničena, koncentracija rastvorenog kiseonika ne sme pasti ispod 0,5 mg/l u BPK bocama. Ovo ograničava koncentraciju ispitivane hemikalije na oko 2 mg/l. Za slabo razgradljiva jedinjenja i ona sa niskim ThOD, može se upotrebiti 5 mg/l do 10 mg/l. U nekim slučajevima, preporučljivo je postaviti uporedne serije ispitivane hemikalije u dve različite koncentracije, npr. od 2 mg/l do 5 mg/l. ThOD se računa na osnovu nagrađenih amonijevih soli, ali ako se očekuje ili se zna da postoji nitrifikacija, izračunava se na osnovu stvorenih nitrata (ThODNO3: videti odeljak 2.2. ove metode). Ako nitrifikacija nije potpuna, iako postoji, radi se korekcija za promene u koncentraciji nitrita i nitrata, određena analizom (videti Deo peti ove metode).
Ako se određuje toksičnost ispitivane hemikalije (u slučaju, npr. da je prethodno utvrđena niska vrednost biorazgradljivosti), potreban je još jedan niz boca.
Pripremi se još jedna velika boca i napuni aerisanom mineralnom podlogom (do otprilike jedne trećine zapremine boce) pa se u bocu dodaju ispitivana i referentna hemikalija u konačnim koncentracijama koje su iste kao i koncentracije u drugim velikim bocama.
Ovi rastvori se inokulišu u velike boce koje sadrže sekundarni efluent (jedna kapljica ili 0,05 ml/l do 5,0 ml/l) ili drugi izvor, kao što je rečna voda (videti odeljak 1.7.4.2. ove metode). Na kraju se pripremaju rastvori sa aerisanom mineralnom podlogom pomoću gumene cevi koja doseže do dna boce, da bi se postiglo odgovarajuće mešanje podloge i rastvora.
6.2.5. Broj običnih sudova u tipičnom ispitivanju
U tipičnom ispitivanju koristi se:
- najmanje 10 boca koje sadrže ispitivanu hemikaliju i inokulum (ispitivana suspenzija);
- najmanje 10 boca koje sadrže samo inokulum (slepa proba sa inokulumom);
- najmanje 10 boca koje sadrže referentnu hemikaliju i inokulum (kontrola postupka);
- i po potrebi, 6 boca koje sadrže ispitivanu hemikaliju, referentnu hemikaliju i inokulum (kontrola toksičnosti). Da bi se desetodnevni period mogao sa sigurnošću identifikovati, potrebno je najmanje dvostruko više boca.
6.2.6. Postupak
Pojedinačni pripremljeni rastvori iz donje četvrtine (ne sa dna) odgovarajuće velike boce odmah se raspodele pomoću cevi u odgovarajući niz BPK boca, tako da sve BPK boce budu potpuno pune. Nežnim kuckanjem po zidu boce uklone se mogući mehurići vazduha. Odmah se u nultom vremenu radi analiza rastvorenog kiseonika u BPK bocama pomoću Vinklerove metode ili elektroda. Sadržaj boca može se sačuvati za kasniju analizu Vinklerovom metodom dodavanjem mangan(II)-sulfata i natrijum-hidroksida (prvi Vinklerov reagens). Boce se čuvaju dobro zatvorene, jer je prisutan kiseonik fiksiran u obliku smeđeg mangan(III)-hidroksida, u mraku na temperaturi od 10 °C do 20 °C ne duže od 24 sata pre nastavka sa preostalim koracima Vinklerove metode. Zatvaračem se zatvore preostali duplikati boca (pazi se da u bocama ne ostanu mehurići vazduha) i inkubiraju se na 20 °C u mraku. Uz svaku seriju mora da postoji potpuno uporedna serija za određivanje podloge inokulirane slepom probom. Za potrebe analize uzimaju se najmanje po dve boce iz iste serije zbog analize rastvorenog kiseonika u određenim vremenskim intervalima (najmanje jedanput nedeljno) u toku 28 dana inkubacije.
Nedeljni uzorci treba da omoguće predviđanje procenta uklanjanja u razdoblju od 14 dana. Uzimanje uzoraka svaka 3 do 4 dana treba da omogući identifikaciju razdoblja od 10 dana, za što je potrebno dvostruko više boca.
Za ispitivane supstance koje sadrže azot, moraju se napraviti korekcije za potrošnju kiseonika zbog moguće nitrifikacije. Prvo se koristi metoda O2-elektrode da bi se odredila koncentracija rastvorenog kiseonika, a zatim se izvlači uzorak iz BPK boce za analizu na nitrate i nitrite. Iz povećanja u koncentraciji nitrata i nitrita, izračuna se potrošeni kiseonik (videti Deo peti ove metode).
6.3.1. Obrada rezultata
Prvo se izračuna BPK nakon svakog vremenskog intervala tako što se oduzme vrednost pada kiseonika (mg O2/l) iz slepe probe sa inokulumom od one koju je pokazala ispitivana hemikalija. Korigovani pad kiseonika podeli se sa koncentracijom (mg/l) ispitivane hemikalije, da se dobije specifični BPK kao mg kiseonika po mg ispitivane hemikalije. Izračuna se procenat biološke razgradljivosti deljenjem specifičnog BPK sa specifičnim ThOD (izračunati u skladu sa odeljkom 2.2. ove metode) ili HPK (određeno analizom, videti odeljak 2.3. ove metode), pa je:
BPK= | mg potrošnja O2 ispitivane hemikalije - mg potrošnja O2 slepe probe | |
mg ispitivane hemikalije u običnom sudu |
= mg O2 po mg ispitivane hemikalije
% razgradnje = | BPK (mg O2 / mg ispitivane hemikalije) | x 100 |
ThOD (mg O2 / mg ispitivane hemikalije) |
ili:
% razgradnje = | BPK (mg O2 / mg ispitivane hemikalije) | x 100 |
HPK (mg O2 / mg ispitivane hemikalije) |
Ova dva postupka ne daju obavezno iste vrednosti. Prednost se daje prvom postupku.
Za ispitivane supstance koje sadrže azot, koristi se odgovarajući ThOD (NH4 ili NO3) prema onome što se zna ili očekuje u pogledu pojave nitrifikacije (videti odeljak 2.2. ove metode). Ako je nitrifikacija prisutna, ali nije potpuna, izračuna se korekcija za kiseonik potrošen nitrifikacijom iz promena u koncentraciji nitrita i nitrata (videti Deo peti ove metode).
6.3.2. Prihvatljivost rezultata
Pad kiseonika u slepoj probi sa inokulumom ne sme da bude viši od 1,5 mg rastvorenog kiseonika po litru nakon 28 dana. Vrednosti veće od ove zahtevaju proveru eksperimentalnih tehnika. Rezidualna koncentracija kiseonika u ispitivanim bocama ne sme da se spusti na vrednosti niže od 0,5 mg/l ni u jednom trenutku. Tako niski nivoi kiseonika prihvatljivi su samo ako se postupkom koji se koristi za određivanje rastvorenog kiseonika mogu tačno meriti takve koncentracije.
Videti odeljak 1.6.2. ove metode.
6.3.3. Izveštaj
Videti odeljak 1.9. ove metode.
Primer obrasca za unos podataka:
METODA ISPITIVANJA U ZATVORENOJ BOCI
1. LABORATORIJA
2. DATUM POČETKA ISPITIVANJA
3. ISPITIVANA SUPSTANCA
Hemijski naziv:
Koncentracija osnovnog rastvora:... mg/l
Početna koncentracija u boci:... mg/l
ThOD ili HPK:... mg O2 /... mg ispitivane supstance
4. INOKULUM
Izvor:
Obavljena obrada:
Prekondicioniranje, ako ga je bilo:
Koncentracija u reakcionoj smesi:... mg/l
5. ODREĐIVANJE DO
Postupak: Vinkler/elektroda
Analize običnih sudova
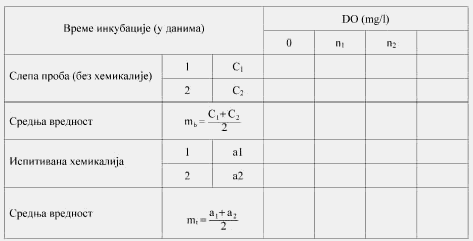
Napomena: Sličan obrazac može se koristiti za referentno jedinjenje i kontrolu toksičnosti.
6. KOREKCIJA ZBOG NITRIFIKACIJE (videti Deo peti ove metode)
Vreme inkubacije (u danima) | 0 | n1 | n2 | n3 | |
(I) | Koncentracija nitrata (mg N/l) |
|
|
|
|
(II) | Promena u koncentraciji nitrata (mg N/l) | - |
|
|
|
(III) | Ekvivalent kiseonika (mg/l) | - |
|
|
|
(IV) | Koncentracija nitrita (mg N/l) |
|
|
|
|
(V) | Promena u koncentraciji nitrita (mg N/l) | - |
|
|
|
(VI) | Ekvivalent kiseonika (mg/l) | - |
|
|
|
(III+VI) | Ukupni ekvivalent kiseonika (mg/l) | - |
|
|
|
7. PAD KONCENTRACIJE RASTVORENOG KISEONIKA (DO): PROCENAT RAZGRADNJE

Pri čemu:
mt0 jeste vrednost u običnom sudu u vremenu 0;
mtx jeste vrednost u običnom sudu u vremenu x;
mb0 jeste srednja vrednost slepe probe u vremenu 0;
mbx jeste srednja vrednost slepe probe u vremenu x.
Mora se primeniti korekcija zbog nitrifikacije u tački 6 (III + VI).
8. PAD KONCENTRACIJE RASTVORENOG KISEONIKA (DO) SLEPE PROBE
Potrošnja kiseonika slepe probe: (mbo - mb28) mg/l. Ova potrošnja je važna za prihvatljivost ispitivanja i mora biti niža od 1,5 mg/l.
7. MITI ISPITIVANJE (METODA C.4-F)
Kiseonik koji potroše mešani rastvor ili suspenzija, ispitivana hemikalija u mineralnoj podlozi, inokulisana sa specijalno uzgojenim, neprilagođenim mikroorganizmima, meri se automatski u toku 28 dana u zamračenom zatvorenom respirometru na temperaturi od 25 °C ± 1 °C. Ugljen-dioksid koji se razvije apsorbuje kreč. Biorazgradljivost se izražava kao procenat potrošnje kiseonika (korigovan za potrošnju kiseonika slepe probe) teoretske potrošnje (u daljem tekstu: ThOD). Procenat primarne biološke razgradljivosti izračunava seiz dodatne specifične hemijske analize urađene na početku i kraju inkubacije i opciono, DOC analizom.
7.2.1. Oprema
Oprema za ispitivanje sadrži:
- automatski elektrolitski BPK merač ili respirometar obično opremljen sa 6 boca, svaka zapremine od 300 ml i sa posudicama koje sadrže apsorbent za ugljen-dioksid;
- stalnu sobnu temperaturu, odnosno vodeno kupatilo temperature 25 °C ± 1 °C ili manje;
- sistem za membransku filtraciju (nije obavezan);
- uređaj za analizu ugljenika (nije obavezan).
7.2.2. Priprema mineralne podloge
Pripreme se sledeći osnovni rastvori, pomoću analitičkih reagenasa i vode (videti odeljak 1.7.1. ove metode):
1. rastvoriti u vodi i dopuniti do 1 L (pH rastvora mora biti 7,2):
- 8,50 g KH2PO4 (kalijum-dihidrogenfosfat);
- 21,75 g K2HPO4 (dikalijum-hidrogenfosfat);
- 44,60 g Na2HPO4x12H2O (dinatrijum-hidrogenfosfat dodekahidrat);
- 1,70 g NH4Cl (amonijum-hlorid);
2. rastvoriti u vodi i dopuniti do 1 L:
- 22,50 g MgSO4x7H2O (magnezijum-sulfat heptahidrat);
3. rastvoriti u vodi i dopuniti do 1 L:
- 27,50 g CaCl2 (kalcijum-hlorid, bezvodni);
4. rastvoriti u vodi i dopuniti do 1 L:
- 0,25 g FeCl3x6H2O (gvožđe(III)-hlorid heksahidrat).
Uzme se 3 ml osnovnog rastvora 1, 2, 3. i 4. i dopuni do 1 L.
7.2.3. Priprema inokuluma
Uzmu se sveži uzorci iz najmanje 10 različitih mesta, uglavnom u područjima u kojima se koriste i u koja se ispuštaju razne hemikalije. Sa lokacija, kao što su postrojenja za prečišćavanje otpadne vode iz domaćinstava, za obradu industrijske otpadnih voda, reka, jezera, mora, prikupi se 11 uzoraka mulja, površinskog zemljišta, vode, itd. i sve zajedno temeljno se promeša. Nakon uklanjanja plutajućih materija i nakon sleganja, supernatant se svede na pH (7 ± 1) pomoću natrijum hidroksida i fosforne kiseline.
Koristi se odgovarajuća zapremina filtriranog supernatanta da se napuni posuda za punjenje i izvlačenje aktivnog mulja, a tečnost se aeriše u toku otprilike 23 1/2 sata. Trideset minuta nakon aeracije, baci se oko jedne trećine ukupne zapremine supernatanta i istaloženom materijalu doda jednaka zapremina rastvora (pH 7) koji sadrži 0,1% glukoze, peptona i kalijum ortofosfata i ponovo aeriše. Ovaj postupak se ponavlja jedanput dnevno. Jedinicom za mulj mora se upravljati u skladu sa dobrom praksom: otpadna voda mora biti bistra, temperatura se mora održavati na 25 °C ± 2°C, pH treba da bude 7 ± 1, mulj se mora dobro taložiti, aeracija mora biti dovoljno dobra tako da smeša bude stalno u aerobnim uslovima, moraju biti prisutne protozoe, a aktivnost mulja se mora ispitati pomoću referentnih supstanci najmanje jednom u tri meseca. Mulj mora da se obrađuje na ovakav način najmanje mesec dana pre nego što se može iskoristiti kao inokulum, ali ne duže od četiri meseca. Nakon toga, uzima se uzorak iz najmanje 10 mesta u redovnim razmacima, jednom svaka tri meseca.
Da bi se održala ista aktivnost svežeg i starog mulja, filtrirani supernatant aktivnog mulja koji se koristi pomeša se sa jednakom zapreminom filtriranog supernatanta sveže smeše prikupljene sa 10 različitih izvora i tako kombinovana tečnost održava se u kulturi, kako je opisano. Mulj se koristi kao inokulum 18 do 24 sata nakon što je jedinica napunjena.
7.2.4. Priprema običnih sudova
Pripremi se 6 običnih sudova:
- 100 mg/l ispitivane hemikalija u vodi za razblaživanje: običan sud br. 1;
- 100 mg/l ispitivana hemikalija u mineralnoj podlozi: običan sud br. 2,3 i 4;
- 100 mg/l referentne hemikalije (npr. anilin) u mineralnoj podlozi: običan sud br. 5;
- samo mineralna podloga: običan sud br. 6.
Slabo rastvorljiva ispitivana hemikalija dodaje se direktno na bazi mase ili zapremine ili na način kako je opisano u Delu trećem ove metode, osim što se ne koriste ni rastvarači ni emulgatori. U sve obične sudove doda se apsorbens C.4-B u ponuđenim specijalnim posudicama. U običnim sudovima br. 2, 3 i 4 pH vrednost se svede na 7,0.
7.2.5. Izvođenje
Malom zapreminom inokuluma inokuliraju se obični sudovi br. 2, 3 i 4 (ispitivana suspenzija), broj 5 (kontrola aktivnosti) i broj 6 (slepa proba sa inokulumom) da se dobije koncentracija od 30 mg/l suspendovanih materija. Inokulum se ne dodaje u tikvicu broj 1, koja služi kao abiotička kontrola. Poveže se oprema i proveri da nema dotoka vazduha, pokrenu se mešalice i započne sa merenjem potrošnje kiseonika u mraku. Svakodnevno se proverava temperatura, rad mešalice i kulometrijski uređaj za zapisivanje potrošnje kiseonika i zapisuje se svaka promena u boji sadržaja običnih sudova. Potrošnja kiseonika u šest običnih sudova očitava se direktno odgovarajućim postupkom, npr. iz zapisa šesto-kanalnog čitača koji proizvodi BPK krivu. Na kraju inkubacije, obično nakon 28 dana, meri se pH sadržaja običnih sudova i određuje koncentracija rezidualne ispitivane hemikalije i svake koncentracije koja nastane u međuvremenu, a u slučaju supstanci rastvorljivih u vodi, i koncentracija DOC (videti odeljak 2.4. ove metode). Posebna pažnja se mora posvetiti nepostojanim hemijskim supstancama. Ako se očekuje nitrifikacija iako je moguće treba odrediti koncentraciju nitrata i nitrita.
7.3.1. Obrada rezultata
Potrošnja kiseonika (mg) ispitivane hemikalije u toku određenog vremena, korigovana za vrednost potrošnje kiseonika u kontrolnoj slepoj probi sa inokulumom za to isto vreme, podeli se sa masom upotrebljene ispitivane hemikalije. Ovo daje BPK izražen kao mg kiseonika/mg ispitivane hemikalije, odnosno:
BPK= | mg potrošnja O2 ispitivane hemikalije - mg potrošnja O2 slepe probe | |
mg ispitivane hemikalije u običnom sudu |
Procenat biorazgradnje se zatim izračunava prema formuli:
% biorazgradnje = % ThOD = | BPK (mg O2 / mg ispitivane hemikalije) | x 100 |
ThOD (mg O2 / mg ispitivane hemikalije) |
Za smeše, izračuna se ThOD iz elementarne analize, kao za jednostavna jedinjenja. Koristi se odgovarajuća ThOD (ThODNH4 ili ThODNO3) u zavisnosti od toga da li nitrifikacija ne postoji ili je nepotpuna (videti odeljak 2.2. ove metode). Ako nitrifikacija postoji, čak i samo delimična, radi se korekcija za kiseonik potrošen nitrifikacijom koji se izračuna iz promena u koncentracijama nitrita i nitrata (videti Deo peti ove metode).
Procenat primarne biorazgradnje izračunava se na osnovu gubitka početne hemikalije (videti odeljak 1.8.2. ove metode):
![]()
Ako se prilikom merenja fizičko-hemijskog uklanjanja izgubio deo ispitivane hemikalije u običnom sudu broj 1, to se mora navesti, a za izračunavanje procenta biorazgradnje koristi se koncentracija ispitivane hemikalije (Sb) u ovom običnom sudu nakon 28 dana.
Kad se odredi DOC (opciono), procenat potpune biorazgradnje računa se prema formuli:
![]()
Kao što je opisano u odeljku 1.8.1. ove metode ako postoji gubitak DOC u običnom sudu 1, merenjem fizičko-hemijskog uklanjanja, za izračunavanje procenta biorazgradnje koristi se koncentracija DOC u ovom običnom sudu.
Rezultati se upisuju u obrasce za unos podataka.
7.3.2. Prihvatljivost rezultata
Potrošnja kiseonika u slepoj probi sa inokulumom obično je 20 mg/lO2 do 30 mg/l O2 i ne sme da bude veća od 60 mg/lO2 u 28 dana. Vrednosti veće od 60 mg/lO2 zahtevaju kritičko preispitivanje podataka i procedura ispitivanja. Ako pH vrednost izlazi izvan opsega od 6 do 8,5 i potrošnja kiseonika ispitivane hemikalije je manja od 60%, ispitivanje mora da se ponovi uz niže koncentracije ispitivane hemikalije.
Videti odeljak 1.7.2. ove metode.
Ako procenat razgradnje aninila dobijen iz potrošnje kiseonika ne prelazi 40% nakon 7 dana i 65% nakon 14 dana, rezultati ispitivanja nisu prihvatljivi.
7.3.3. Izveštaj
Videti odeljak 1.9. ove metode.
Primer obrasca za unos podataka:
METODA ISPITIVANJA: MITI (I)
1. LABORATORIJA
2. DATUM POČETKA ISPITIVANJA
3. ISPITIVANA SUPSTANCA
Hemijski naziv:
Koncentracija osnovnog rastvora: … mg/l kao hemikalija
Početna koncentracija u podlozi, C0:... mg/l kao hemikalija
Zapremina reakcione smeše, V:... ml
ThOD:... mg/l O2
4. INOKULUM
Mesta uzimanja uzoraka mulja:
1)...,
2)...,
3)...,
4)...,
5)...,
6)...,
7)...,
8)...,
9)...,
10)...,
Koncentracija suspendovanih materija u aktivnom mulju nakon aklimatizacije sa sintetičkom otpadnom vodom =... mg/l
Zapremina aktivnog mulja po litru gotove podloge =... ml
Koncentracija mulja u gotovoj podlozi =... mg/l
5. POTROŠNJA KISEONIKA: BIORAZGRADLJIVOST
Vrsta upotrebljenog respirometra:
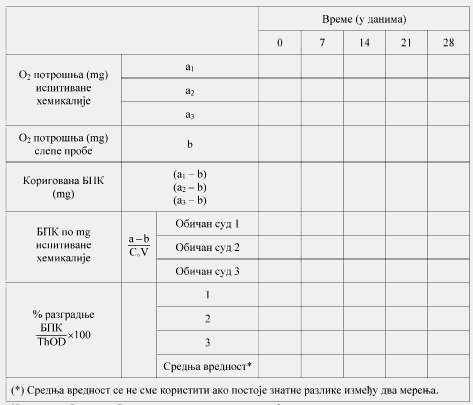
Napomena: Slični obrasci mogu se koristiti za referentnu supstancu.
6. ANALIZA UGLJENIKA (nije obavezno)
Analizator ugljenika
Običan sud | DOC | % uklonjenog DOC | Srednja vrednost | |||
izmereno | korigovano | |||||
Voda + ispitivana supstanca | a |
|
|
| - | - |
Mulj + ispitivana supstanca | b1 |
| b1 - c |
|
|
|
Mulj + ispitivana supstanca | b2 |
| b2 - c |
|
|
|
Mulj + ispitivana supstanca | b3 |
| b3 - c |
|
|
|
Kontrola slepom probom | c |
| - |
| - | - |
% uklonjenog DOC = | a1 - (b-c) | x 100 |
a |
7. PODACI SPECIFIČNE HEMIJSKE ANALIZE
| Rezidualna količina ispitivane supstance na kraju ispitivanja (mg/l) | % razgradnje |
Ispitivanje slepe probe sa vodom | Sb |
|
Inokulisana ispitivana podloga | Sa1 |
|
Sa2 |
| |
Sa3 |
|
% razgradnje = | Sb - Sa | x 100 |
Sb |
Izračunava se procenat razgradnje za obične sudove a1, a2 i a3.
8. NAPOMENE
Ako je moguće treba priložiti BPK krivu u funkciji vremena.
IZRAČUNAVANJE I ODREĐIVANJE ODGOVARAJUĆIH UKUPNIH PARAMETARA
U zavisnosti od izabrane metode ispitivanja, zahtevaju se određeni zbirni parametri. Ovaj deo opisuje postupak dobijanja njihovih vrednosti. Upotreba ovih parametara data je u pojedinim metodama ispitivanja.
Sadržaj ugljenika izračunava se iz poznatog sastava elemenata ili elemenata određenih analizom ispitivane supstance.
2. TEORIJSKA POTROŠNJA KISEONIKA (THOD)
Teorijska potrošnja kiseonika (u daljem tekstu: ThOD) može se izračunati ako je sastav elemenata poznat ili određen analizom elemenata. To je za jedinjenje:
CcHhClclNnNanaOoPpSs
bez nitrifikacije,
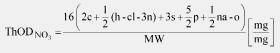
ili sa nitrifikacijom
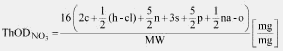
3. HEMIJSKA POTROŠNJA KISEONIKA (HPK)
Hemijska potrošnja kiseonika (u daljem tekstu: HPK) određuje se prema Metodi C.6. koja je data u ovom prilogu.
4. RASTVORENI ORGANSKI UGLJENIK (DOC)
Rastvoreni organski ugljenik (u daljem tekstu: DOC) jeste organski ugljenik bilo koje hemikalije ili smeše u vodi koji prolazi kroz filter promera 0,45 µ.
Izvuku se uzorci iz posuda za ispitivanje i odmah filtriraju u filtracijskom uređaju koji koristi odgovarajući membranski filter. Prvih 20 ml (količina se može smanjiti kad se koriste mali filteri) filtrata se bacaju. Zapremine od 10 ml do 20 ml ili manje, ako se injektiraju (zapremina zavisi od količine koja je potrebna za analizator ugljenika) zadržavaju se zbog analize ugljenika. Koncentracija DOC određuje se pomoću analizatora organskog ugljenika koji može tačno da izmeri koncentraciju ugljenika koja je jednaka ili niža od 10% početne koncentracije DOC korišćene u ispitivanju.
Filtrirani uzorci koji se ne mogu analizirati istog dana mogu da se sačuvaju u frižideru na temperaturi od 2°C do 4 °C u toku 48 sata ili na temperaturi ispod -18 °C u toku dužeg perioda.
Napomene:
Membranski filteri su često impregnirani površinski aktivnim materijama za hidrofilizaciju. Zato filter može sadržati do nekoliko mg rastvorenog organskog ugljenika koji utiče na određivanje biorazgradljivosti. Površinski aktivne materije i druga rastvorljiva organska jedinjenja uklanjaju se iz filtera kuvanjem filtera u dejonizovanoj vodi tri puta po sat vremena. Filteri se mogu čuvati u vodi nedelju dana. Ako se koriste jednokratna punjenja filtera, svako punjenje se mora proveriti da bi se potvrdilo da ne otpušta rastvorljivi organski ugljenik.
Membranski filter, zavisno od tipa, može usled adsorpcije zadržati test supstancu. Poželjno je proveriti da li filter zadržava ispitivanu hemikaliju.
Centrifugiranje na 40.000 m/s2 (4.000 g) u toku 15 minuta može se koristiti umesto filtracije za razlikovanje TOC od DOC. Postupak nije pouzdan pri početnim koncentracijama manjim od 10 mg DOC/l, s obzirom na to dali su ili nisu uklonjene sve bakterije ili se ugljenik kao deo bakterijske plazme ponovno rastvorio.
1. Standard Methods for the Examination of Water and Wastewater, 12th ed, Am. Pub. Hlth. Ass., Am. Wat. Poll. COntrol Fed., Oxygen Demand, 1965, P 65.
2. Wagner, R., Von Wasser, 1976, vol. 46, 139.
3. DIN-Entwurf 38 409 Teil 41 Deutsche Einheitsverfahren zur Wasser-, Abwasser- und Schlammuntersuchung, Summarische Wirkungs- und Stoffkenngrößen (Gruppe H). Bestimmung des Chemischen Sauerstoffbedarfs (CSB) (H 41), Normenausschuß Wasserwesen (NAW) in DIN Deutsches Institut für Normung e. V.
4. Gerike, P., The biodegradability testing of poorly water soluble COmpounds. Chemosphere, 1984, vol 13 (1), 169.
PROCENA BIOLOŠKE RAZGRADLJIVOSTI SLABO RASTVORLJIVIH SUPSTANCI
U ispitivanju biorazgradnje slabo rastvorljivih supstanci, posebnu pažnju treba posvetiti sledećim aspektima:
Dok su homogene tečnosti retko problem za uzimanje uzoraka, preporučuje se da čvrste supstance budu homogenizovane odgovarajućim sredstvima kako bi se izbegle greške usled nehomogenosti. Posebno se mora paziti kad su potrebni reprezentativni uzorci od nekoliko miligrama iz smeše hemikalija ili supstanci sa velikom količinom nečistoća.
Tokom ispitivanja mogu se koristiti različiti oblici mešanja. Hemikalija se mora mešati tek toliko da ostane dispergovana. Pregrejavanje, prekomerno stvaranje pene i preterane vučne sile moraju se izbegavati.
Može se koristiti emulgator koji omogućava stabilnu disperziju hemikalije. Emulgator ne sme da bude toksičan za bakterije i ne sme da bude biorazgradljiv ili da uzrokuje stvaranje pene u ispitivanim uslovima.
Na rastvarače se primenjuju isti kriterijumi kao i na emulgatore.
Ne preporučuje se korišćenje čvrstih nosača za ispitivane čvrste supstance, ali oni mogu biti pogodni samo za supstance.
Kad se koriste pomoćne supstance kao što su emulgatori, rastvarači i nosači, mora se ispitati posuda sa slepom probom koja sadrži te pomoćne supstance.
Za ispitivanje biorazgradljivosti slabo rastvorljivih jedinjenja može se koristiti bilo koji od tri respirometrijska ispitivanja: C.4-B, BPK, MITI.
1. de Morsier, A. et al., Biodegradation tests for poorly soluble COmpounds. Chemosphere, 1987, vol. 16, 833.
2. Gerike, P, The Biodegradability testing of poorly water soluble COmpounds. Chemosphere, 1984, vol. 13, 169.
PROCENA BIORAZGRADLJIVOSTI HEMIKALIJA ZA KOJE SE SUMNJA DA SU TOKSIČNE ZA INOKULUM
Kad se ispitivana hemikalija podvrgne ispitivanju biorazgradljivosti i pokaže se da nije brzo biorazgradljiva, preporučuje se sledeći postupak za utvrđivanje razlika između inibicije i inercije1:
Za ispitivanja toksičnosti i biorazgradnje, treba koristiti slične ili identične inokulume.
Da bi se ispitivanjem brze biorazgradljivosti procenila toksičnost hemikalije, primenjuje se jedan ili kombinacija postupaka za utvrđivanje inhibicije stepena respiracije mulja (ispitivanje inhibicije respiracije aktivnog mulja, videti u literaturi2), BPK, odnosno postupaka za utvrđivanje inhibicije rasta.
Ako se mora izbeći inhibicija izazvana toksičnošću, preporučuje se da koncentracije ispitivane supstance koja se koristi u ispitivanju brze biološke razgradljivosti budu manje od 1/10 EC50 vrednosti (ili manje od EC20 vrednosti) koja se dobije ispitivanjem toksičnosti. Jedinjenja sa EC50 vrednošću većom od 300 mg/l najverovatnije nemaju toksične efekte u ispitivanju brze biorazgradljivosti.
EC50 vrednosti manje od 20 mg/l verovatno predstavljaju ozbiljne probleme za dalje testove. Moraju se koristiti niske ispitivane koncentracije, zbog čega se mora koristiti stroga i osetljiva metoda ispitivanja u zatvorenoj boci ili materijal označen izotopom ugljenika C14. Alternativno, ako se radi sa aklimatizovanim inokulumom, mogu se koristiti više koncentracije ispitivane supstance. U tom slučaju, gubi se specifični kriterijum metode ispitivanja brze biološke razgradljivosti.
1. Reynolds, L. et al., Evaluation of the toxicity of substances to be assessed for biodegradability. Chemosphere, 1987, vol. 16, 2259.
2. Directive 87/302/EEC.
KOREKCIJA POTROŠNJE KISEONIKA ZBOG UTICAJA NITRIFIKACIJE
Greške zbog propusta da se uračuna nitrifikacija u procenu biorazgradljivosti ispitivane supstance koja ne sadrži N na osnovu potrošnje kiseonika su marginalne (ne veće od 5%), čak i ako je pojava oksidacije amonijačnog azota u podlozi vrlo nepravilna, kao između posuda za ispitivanje i posuda sa slepom probom. Kad ispitivane supstance sadrže N, mogu se javiti ozbiljne greške.
Ako je došlo do nitrifikacije, ali ona nije potpuna, opažena potrošnja kiseonika reakcione smeše može se korigovati za količinu kiseonika potrošenog u oksidaciji amonijaka na nitrite i nitrate, ako se promene u koncentraciji u toku inkubacije nitrita i nitrata određuju pomoću jednačina:
2NH4Cl+3O2 = 2HNO2 + 2HCl + 2H2O [1]
2HNO2 + O2 = 2HNO3 [2]
Ukupno:
2NH4Cl + 4O2 = 2HNO3 + 2HCl + 2H2O [3]
Iz jednačine [1] vidi se da 28 g azota iz amonijum hlorida (NH4Cl) potroši 96 g kiseonika u toku oksidacije do nitrita, odnosno faktor je 3,43 (96/28). Na isti način, iz jednačine (3) vidi se da 28 g azota potroši 128 g kiseonika u toku oksidacije do nitrata, odnosno faktor je 4,57 (128/28).
S obzirom da su reakcije sekvencijalne, a za njih su zaslužne različite bakterijske vrste, koncentracija nitrita se može povećati ili smanjiti. Dakle:
O2 potrošen u stvaranju nitrata = 4,57 x povećanje koncentracije nitrata [4]
i
O2 potrošen u stvaranju nitrita = 3,43 x povećanje koncentracije nitrata [5]
i
gubitak O2 zbog gubljenja nitrita = -3,43 x smanjenje koncentracije nitrata [6]
tako da je:
O2 potrošnja zbog nitrifikacije = ±3,43 x promena konc. nitrita + 4,57 x
povećanje koncentracije nitrata [7]
i stoga je:
O2 potrošnja zbog C oksidacije = ukupna opažena potrošnja zbog
nitrifikacije [8]
Alternativno, ako se određuje samo ukupni oksidovani N, može se prihvatiti da je potrošnja kiseonika zbog nitrifikacije, kao prva aproksimacija, 4,57 puta povećanje u oksidovanom N.
Korigovana vrednost za potrošnju kiseonika zbog C oksidacije se onda poredi sa ThODNH3, kao što je izračunato u Delu drugom ove metode.
C.5. RAZGRADNJA - BIOHEMIJSKA POTROŠNJA KISEONIKA
Cilj ove metode je merenje biohemijske potrošnje kiseonika (u daljem tekstu: BPK) za čvrste i tečne organske supstance.
Podaci dobijeni u ovom ispitivanju odnose se na jedinjenja rastvorljiva u vodi. Mogu se ispitivati i jedinjenja koja su isparljiva, kao i jedinjenja koja su slabo rastvorljiva u vodi.
Metoda se može primeniti samo za one organske supstance koje ne deluju inhibitorno na bakterije u koncentracijama koje se koriste u ispitivanju. Ako ispitivana supstanca nije rastvorljiva u izabranim koncentracijama, dodatne mere (kao što je ultrazvučna disperzija) mogu se koristiti kako bi se postigla dobra disperzija ispitivane supstance.
Podaci o toksičnosti ispitivane supstance mogu da budu korisni pri tumačenju rezultata ispitivanja gde su dobijene male vrednosti za BPK, a pomažu i u izboru odgovarajućih koncentracija za ispitivanje date supstance.
1.2. DEFINICIJE I MERNE JEDINICE
Biohemijska potrošnja kiseonika (BPK) jeste masa rastvorenog kiseonika potrebna za proces biohemijske oksidacije u specifičnoj zapremini rastvora ispitivane supstance pod uslovima definisanim za ovo ispitivanje.
Rezultati se izražavaju u gramima kao g BPK/g ispitivane supstance.
Poželjno je koristiti adekvatne referentne supstance da bi se proverila aktivnost inokuluma.
Unapred određena količina ispitivane supstance, koja je rastvorena ili dispergovana u dobro aerisanom medijumu, inokulira se sa mikroorganizmima i inkubira na tačno određenoj konstantnoj temperaturi u odsustvu svetlosti.
BPK se određuje kao razlika sadržaja rastvorenog kiseonika na početku i na kraju ispitivanja. Ispitivanje treba da traje najmanje pet dana, ali ne duže od 28 dana.
Kao slepu probu koristiti rezultate naporednog ispitivanja bez prisustva ispitivane supstance.
Određivanje BPK ne može da se smatra validnom merom biorazgradljivosti ispitivane supstance. Ovo ispitivanje se može posmatrati samo kao skrining test.
Preliminarni rastvor ili disperzija pripremaju se tako da se postigne odgovarajuća koncentracija BPK kompatibilna sa metodom koja se koristi. BPK se zatim određuje primenom bilo koje odgovarajuće standardizovane metode.
BPK za preliminarni rastvor ispitivane supstance izračunava se prema izabranoj standardizovanoj metodi i izražava se u gramima BPK po gramu ispitivane supstance.
U izveštaju o ispitivanju navodi se koja metoda je korišćena u ispitivanju.
Vrednost BPK predstavlja srednju vrednost za najmanje tri validna merenja.
Moraju se navesti i svi podaci i napomene relevantne za tumačenje rezultata, a posebno podaci koji su u vezi sa nečistoćama, fizičkim karakteristikama, toksičnim efektom i sastavom ispitivane supstance.
U izveštaju se mora navesti i upotreba aditiva koji se koriste radi sprečavanja biološke nitrifikacije.
Lista standardizovanih metoda:
1. NF T 90-103: Determination of the biochemical oxygen demand.
2. NBN 407: Biochemical oxygen demand.
3. NEN 32355.4: Bepaling van het biochemish zuurstofverbruik (BZV).
4. The determination of biochemical oxygen demand, Methods for the examination of water and associated materials, HMSO, London.
5. ISO 5815: Determination of biochemical oxygen demand after n days.
C.6. RAZGRADNJA - HEMIJSKA POTROŠNJA KISEONIKA
Cilj ove metode je merenje hemijske potrošnje kiseonika (u daljem tekstu: HPK) za čvrste i tečne organske supstance, u tačno definisanim laboratorijskim uslovima.
Poznavanje hemijske formule supstance korisno je za izvođenje metode ispitivanja kao i za tumačenje dobijenih rezultata (npr. soli halogenih elemenata, organske soli gvožđa, organohlorna jedinjenja).
1.2. DEFINICIJE I MERNE JEDINICE
Hemijska potrošnja kiseonika (HPK) jeste mera sposobnosti neke supstance da bude oksidovana, a izražava se kao ekvivalentna količina kiseonika oksidujućeg sredstva koja je potrebna za oksidaciju supstance u tačno definisanim laboratorijskim uslovima.
Rezultat se izražava u gramima, kao g HPK/g ispitivane supstance.
Referentne supstance ne moraju da se koriste u svim slučajevima prilikom testiranja novih supstanci. Referentne supstance služe prvenstveno za periodičnu kalibraciju metode i omogućavaju poređenje rezultata ukoliko se primenjuje neka druga metoda.
Unapred određena količina ispitivane supstance koja je rastvorena ili dispergovana u vodi, se oksiduje sa kalijum dihromatom u medijumu zakiseljenom sa sumpornom kiselinom i sa srebro-sulfatom kao katalizatorom, pod refluksom u toku 2 sata. Preostali dihromat se određuje titracijom pomoću standardizovanog gvožđe-amonijum sulfata.
U slučaju da ispitivane supstance sadrže hlor, treba dodati živu-sulfatLX da bi se smanjila interferencija hlorida.
____________
LX Nakon upotrebe, rastvori koje sadrže živine soli moraju se tretirati da bi se izbeglo ispuštanje žive u životnu sredinu
Zbog arbitrarnog načina određivanja, HPK je "indikator sposobnosti oksidovanja", pa se ova metoda koristi kao praktičan postupak za određivanje sadržaja organske materije.
Hloridi mogu da utiču na ovo ispitivanje. Neorganska redukujuća ili oksidujuća sredstva takođe mogu da utiču na određivanje HPK.
Neka ciklična jedinjenja i mnoge isparljive supstance (npr. niže masne kiseline) ne mogu se potpuno oksidovati primenom postupka opisanog u ovoj metodi.
Pripremi se preliminarni rastvor ili disperzija ispitivane supstance da se dobije HPK između 250 mg/l i 600 mg/l.
Napomene:
U slučaju da se radi o slabo rastvorljivim supstancama ili supstancama koje se ne mogu dispergovati, može se odmeriti količina praškaste supstance ili supstance u tečnom obliku koja odgovara količini od 5 mg HPK i staviti u posudu sa vodom.
HPK se često, i naročito u slučaju slabo rastvorljivih supstanci, pogodno određuje modifikacijom postupka, odnosno u zatvorenom sistemu sa izjednačavanjem pritiska1. Primenom ove modifikovane metode, supstance za koje nisu prikladne konvencionalne metode, kao npr. sirćetna kiselina, mogu se uspešno kvantifikovati. U slučaju piridina ova metoda nije primenljiva.
Ukoliko se koncentracija kalijum dihromata, kao što je preporučeno u literaturi1, poveća na 0,25 N (0,0416 M), olakšano je direktno merenje 5 mg do 10 mg supstance, što je neophodno za određivanje HPK za slabo rastvorljive supstance2.
U ostalim slučajevima, HPK se određuje primenom bilo koje odgovarajuće domaće ili međunarodne standardizovane metode ispitivanja.
HPK u posudi izračunava se prema izabranom normalizovanom postupku i pretvara se u grame HPK po gramu ispitivane supstance.
U izveštaju o ispitivanju navodi se koja metoda je korišćena pri ispitivanju.
HPK predstavlja srednju vrednost najmanje tri merenja. Svi podaci i napomene merodavne za tumačenje rezultata moraju biti navedene, naročito one koje se odnose na prisustvo nečistoća i svojstva ispitivane supstance (ako su poznata), koja bi mogla uticati na rezultate.
Navodi se i da li je korišćen živin sulfat u cilju smanjenja uticaja hlorida.
1. NBN T 91-201 Determination of the chemical oxygen demand.
2. ISBN O 11 7512494 Chemical oxygen demand (dichromate value) of polluted and waste waters.
3. NF T 90-101 Determination of the chemical oxygen demand.
4. DS 217 = water analysis Determination of the chemical oxygen demand.
5. DIN 38409-H-41 Determination of the chemical oxygen demand (COD) within the range above 15 mg
6. per litre.
7. NEN 3235 5.3 Bepaling van het chemisch zuurstofverbruik.
8. ISO 6060 Water quality: chemical oxygen demand dichromate methods.