
C.7. RAZGRADNJA - ABIOTIČKA RAZGRADNJA: HIDROLIZA KAO FUNKCIJA pH
Metoda se zasniva na OECD TG 111 (2004) uputstvu ispitivanja.
Hemikalije mogu dospeti u površinske vode direktnim unošenjem, raspršivanjem, izlivanjem, drenažom ili kao posledica odlaganja otpada iz industrije, domaćinstava i poljoprivrede, iz otpadnih voda ili atmosfere. Dospele hemikalije u površinskim vodama mogu biti transformisane hemijski (npr. hidroliza, oksidacija), fotohemijski, odnosno mikrobiološki. Ova metoda opisuje laboratorijsku metodu ispitivanja za procenu abiotičke hidrolitičke transformacije hemikalija u vodenim sistemima pri vrednostima pH koje su uobičajeno karakteristične (pH 4-9) i bazira se na uputstvima1, 2, 3, 4, 5, 6, 7.
Eksperimenti se izvode u cilju određivanja:
7) stepena hidrolize ispitivane supstance u funkciji pH i
8) prirode/načina i stepena obrazovanja i smanjenja produkata hidrolize kojima organizmi mogu biti izloženi.
Ovi eksperimenti mogu da budu obavezni za hemikalije koje se direktno primenjuju na površinske vode ili za hemikalije za koje postoji veliki stepen verovatnoće da će dospeti u životnu sredinu nekim od puteva unosa navedenim u ovom odeljku.
1.2. DEFINICIJE I MERNE JEDINICE
U svim ispitivanjima koriste se merne jedinice koje su obuhvaćene Međunarodnim sistemom jedinica (SI).
Ispitivana supstanca jeste bilo koja supstanca, odnosno polazna supstanca ili odgovarajući produkt hidrolize.
Produkti transformacije jesu sve supstance koje nastaju kao produkt u reakcijama biotičke ili abiotičke transformacije.
Produkti hidrolize jesu sve supstance koje nastaju kao produkti hidrolitičke transformacije ispitivane supstance.
Hidroliza jeste reakcija ispitivane supstance (u daljem tekstu: RX) sa vodom, sa zamenom X grupe sa OH grupom:
RX + XOX → POX + XX [1]
Stopa kojom se koncentracija RX smanjuje u pojednostavljenom postupku predstavlja se formulama:
stopa = k[X2O][RX], za reakcije drugog reda ili
stopa = k[RX], za reakcije prvog reda,
u zavisnosti od koraka kojim se određuje stopa.
S obzirom na to da je voda prisutna u znatno većoj količini u odnosu na ispitivanu supstancu, ovaj tip reakcije se uobičajeno opisuje kao reakcija pseudo-prvog reda u kojoj je zabeležena konstanta data odnosom:
kobs = k[X2O] [2]
i može biti određena izrazomLXI:
LXI Ukoliko se na grafičkom prikazu log-transformisanih podataka u funkciji vremena ne uočava linearna povezanost (u skladu sa konstantom prvog reda), upotreba jednačine [3] nije adekvatna za određivanje konstante stepena hidrolize ispitivane supstance.

pri čemu:
t jeste vreme;
C0, Ct jesu koncentracije RX u vremenu 0 i t.
Jedinica mere ove konstante jeste (vreme)-1.
Poluvreme reakcije jeste vreme potrebno za reakciju 50% RX koje se određuje formulom:

Vreme poluživota (t0,5) jeste vreme potrebno za 50% hidrolizu ispitivane supstance kada se hidroliza može opisati kinetikom prvog reda. Ova vrednost je nezavisna od koncentracije.
Vreme nestajanja 50 (u daljem tekstu: DT50) jeste vremenski period u okviru kojeg se koncentracija ispitivane supstance smanji za 50%. Razlikuje se od parametra t0,5 kada se hidroliza ne može opisati kao kinetika prvog reda.
PROCENA k NA RAZLIČITIM TEMPERATURAMA
Kada su poznate konstante stepena hidrolize za dve temperature, konstante stepena za druge temperature mogu se izračunati Arheniusovom jednačinom:
ili
Grafički prikaz odnosa lnk prema 1/T daje pravu sa nagibom - E/R, pri čemu:
K jeste konstanta stepena hidrolize, merena na različitim temperaturama;
E jeste energija aktivacije (kJ/mol);
T jeste apsolutna temperatura (T);
R jeste gasna konstanta (8.314 J/mol.K).
Energija aktivacije izračunava se regresionom analizom jednačinom:
pri čemu je T2> T1.
Metoda se primenjuje za hemijske supstance (obeležene ili neobeležene) za koje postoji dovoljno precizna i osetljiva analitička metoda. Metoda može da se primeni i za supstance koje nisu ili su u manjoj meri isparljive ukoliko su rastvorljive u vodi. Metodu ne treba primenjivati za hemikalije koje su u vodenim rastvorima lako isparljive (npr. fumiganti, organski rastvarači) i koje ne mogu da obrazuju stabilne rastvore u ispitivanim uslovima propisanim za ovu metodu. Ova metoda nije prikladna za supstance slabo rastvorljive u vodi.
Sterilni vodeni rastvori pufera različitih pH vrednosti (pH 4, 7 i 9) u kojima je rastvorena ispitivana supstanca inkubiraju se u mraku u kontrolisanim laboratorijskim uslovima (na konstantnoj temperaturi). Nakon odgovarajućeg vremena, puferski rastvori se analiziraju na ispitivanu supstancu i na produkte hidrolize. Ukoliko se ispituju obeležene supstance (npr. C14), može se lakše uspostaviti maseni bilans.
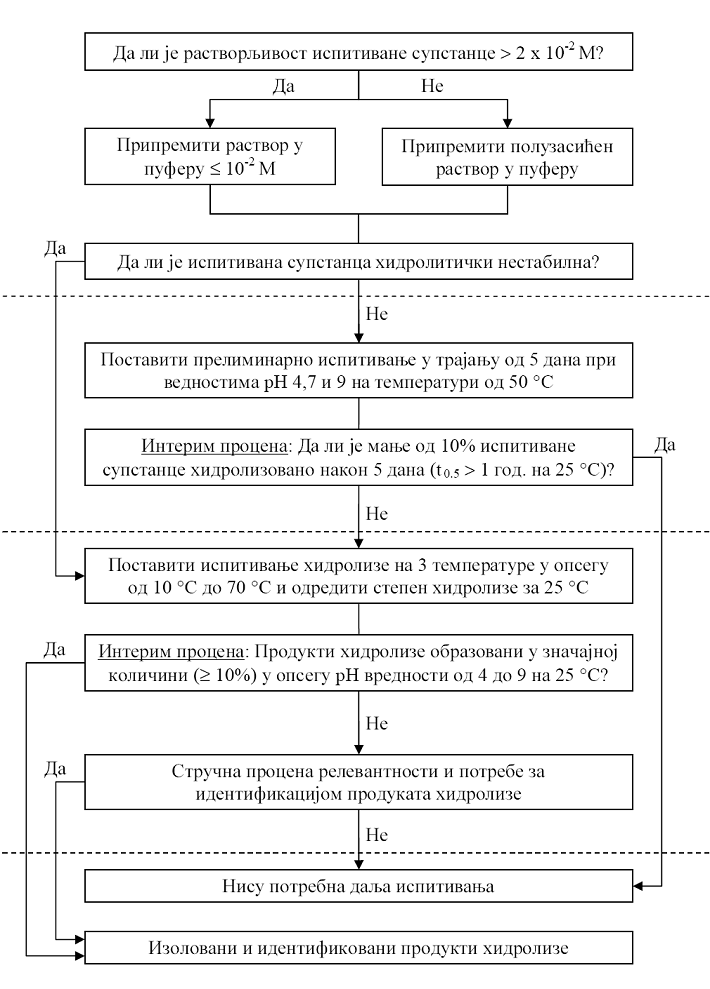
Ova metoda ispitivanja izvodi se kao etapni pristup koji je dat u Delu drugom ove metode. Izbor naredne etape ispitivanja određen je rezultatima prethodne etape.
1.5. PODACI O ISPITIVANOJ SUPSTANCI
Neobeležene ili obeležene supstance mogu se koristiti za merenje stepena hidrolize. Prednost za proučavanje puteva hidrolize i za uspostavljanje masenog balansa daje se obeleženim supstancama. U specijalnim slučajevima obeleževanje supstanci nije neophodno. Preporučuje se obeležavanje supstanci sa C14, ali se mogu upotrebljavati i drugi izotopi kao što su C13, N15, H3. Koliko je god moguće, potrebno je obeležiti najstabilniji deo molekula. Na primer, ukoliko ispitivana supstanca sadrži jedan prsten, obeležavanje ovog prstena je obavezno; ukoliko supstanca sadrži dva ili više prstena, potrebno je izvesti dodatne eksperimente da bi se procenila sudbina svakog pojedinačnog prstena koji je obeležen da bi se dobili podaci o obrazovanju produkata hidrolize. Procenat čistoće supstance treba da bude najmanje 95%.
Pre izvođenja ispitivanja, potrebno je o ispitivanoj supstanci imati podatke:
- rastvorljivost u vodi (videti Metodu A.6. koja je data u ovom pravilniku);
- rastvorljivost u organskim rastvaračima;
- napon pare (videti Metodu A.4. koja je data u ovom pravilniku) i Henrijeva konstanta;
- podeoni koeficijent n-oktanol/voda (videti Metodu A.8. koja je data u ovom pravilniku);
- konstantna disocijacije pKa (videti u literaturi9);
- stepen direktne i indirektne fototransformacije u vodi, ukoliko je potrebno.
Treba da budu poznati i podaci o analitičkim metodama za kvantifikaciju ispitivane supstance i ukoliko je relevantno, podaci o metodama za identifikaciju i kvantifikaciju produkata hidrolize u vodenim rastvorima (videti odeljak 1.7.2. ove metode).
Referentne supstance, kada je moguće, treba da se koriste za identifikaciju i kvanitifikaciju produkata hidrolize primenom spektroskopskih i hromatografskih metoda ili neke druge dovoljno osetiljive metode.
1.7.1. Efikasnost primenjene analitičke metode
Analiza puferskih rastvora ili njihovih ekstrakata neposredno nakon dodavanja ispitivane supstance u najmanje dva ponavljanja daje prve indicije o efikasnosti analitičke metode i ujednačenosti primene izabranog postupka za ispitivanu supstancu. Efikasnost za dalje faze eksperimenta određuje se na osnovu razlike mase (kada se koristi obeleženi materijal). Procenat efikasnosti treba da iznosi od 90% do 110% za obeležene i neobeležene hemikalije7. U slučaju da postoje tehničke poteškoće da se zadovolji ovaj kriterijum, efikasnost od 70% je prihvatljiva za neobeležene hemikalije, uz dodatno objašnjenje.
1.7.2. Ponovljivost i osetljivost analitičke metode
Ponovljivost analitičke metode kojom se kvantifikuje ispitivana supstanca i kasnije produkti hidrolize može se proveriti analizom puferskog rastvora (ili njihovih ekstrakata) u dva ponavljanja nakon što se obrazuju produkti hidrolize u dovoljnim količinama za kvantifikaciju.
Analitička metoda treba da je dovoljno osetljiva za kvantifikaciju do najviše 10% od početne koncentracije supstance. Ukoliko je relevantno, analitička metoda treba da bude dovoljno osetljiva i za kvantifikaciju bilo kojih produkata hidrolize koji predstavljaju 10% ili više (u bilo kom vremenu u periodu ispitivanja) od primenjene koncentracije, do 25% ili manje od najviše koncentracije.
1.7.3. Intervali poverenja za kinetičke podatke o hidrolizi
Intervali poverenja se izračunavaju za sve koeficijente regresione prave, konstante, vreme poluživota i bilo koje druge kinetičke parametre (npr. DT50).
1.8.1. Oprema i instrumenti
Eksperimenti se izvode u staklenim posudama (npr. epruvetama, tikvicama) u mraku i u sterilnim uslovima, ukoliko je neophodno, osim ukoliko preliminarni podaci (kao što je podeoni koeficijenti-oktanol/voda) ukazuju na to da supstanca prijanja za staklene površine. U tim slučajevima, može se razmatrati upotreba drugih materijala (kao što je teflon). Problem prijanjanja (adhezije) na staklo može se rešiti i:
- određivanjem mase ispitivane supstance i produkata hidrolize koji su sorbovani na zidove posude;
- upotrebom ultrazvučnih kupatila;
- spiranjem sa zidova posude sa rastvaračem pri svakom uzimanju uzoraka za analizu;
- korišćenjem formulisanih proizvoda;
- upotrebom dodatnih rastvarača za uvođenje ispitivane supstance u sistem, dodatni rastvarač ne sme da utiče na hidrolizu supstance.
Vodena kupatila sa mešalicom ili inkubatori sa termoregulacijom potrebni su za inkubaciju rastvora različitih koncentracija ispitivane supstance.
Potrebna je standardna laboratorijska oprema koja sadrži:
- pH-metar;
- instrumente za analitička merenja kao što su GC, HPLC, TLC uključujući i odgovarajuće sisteme za detekciju supstanci obeleženih ili neobeleženih radioizotopima ili metoda inverznog razblaženja izotopa;
- instrumente za identifikaciju (npr. MS, GC-MS, HPLC-MS, NMR, itd);
- tečni scintilatorski brojač;
- separacione levkove za tečno-tečnu ekstrakciju;
- opremu za koncentrovanje rastvora i ekstrakata (npr. rotirajući evaporator);
- opremu za održavanje temperature (npr. vodeno kupatilo).
Hemijski reagensi uključuju:
- organske rastvarače, analitičke čistoće, kao što je heksan, dihlorometan, itd;
- tečnost za scintilatorski brojač;
- puferski rastvori (videti odeljak 1.8.3. ove metode).
Sve staklene posude, redestilovana voda i puferski rastvori koji se koriste moraju da budu sterilni.
1.8.2. Uvođenje ispitivane supstance
Ispitivana supstanca se uvodi u puferski sistem u obliku vodenog rastvora (videti Deo četvrti ove metode). Upotreba malih količina rastvora koji se dobro mešaju sa vodom (kao što je acetonitril, aceton, etanol) dozvoljena je za uvođenje i distribuciju ispitivane supstance, ali količina ne treba da bude veća od 1% v/v. U slučaju da se razmatra upotreba veće količine rastvarača (npr. kod slabo rastvorljivih supstanci), ovo se može dozvoliti samo ako se dokaže da rastvarač nema uticaj na hidrolizu ispitivane supstance.
Za rutinsku upotrebu ne preporučuju se formulisani proizvodi, jer se ne može isključiti mogućnost da sastojci formulacije utiču na proces hidrolize. Za slabo rastvorljive supstance ili za supstance koje prijanjaju na staklene površine (videti odeljak 1.8.1. ove metode) upotreba formulisanih proizvoda može da bude odgovarajuća alternativa.
Ispituje se samo jedna koncentracija ispitivane supstance. Koncentracija ne sme da prelazi 0,01M ili polovinu koncentracije zasićenog rastvora.
1.8.3. Puferski rastvori
Ova metoda ispitivanja izvodi se pri vrednostima pH od 4, 7 i 9. Za potrebe ovog ispitivanja, puferski rastvori se pripremaju sa hemikalijama analitičke čistoće i redestilovanom vodom. Neki od puferskih sistema koji se koriste dati su u Delu trećem ove metode. Puferski sistem može da utiče na hidrolizu i ukoliko se uoče promene koristi se drugi puferski sistem.
Vrednosti pH svakog puferskog rastvora treba proveravati sa kalibrisanim pH-metrom sa preciznošću najmanje 0,1 u definisanim temperaturnim uslovima.
1.8.4. Uslovi ispitivanja
1.8.4.1. Temperatura
Ispitivanja hidrolize treba izvoditi na konstantnoj temperaturi. Radi ekstrapolacije rezultata, neophodno je održavati temperaturu sa minimalnim variranjem ± 0,5 °C.
Preliminarno ispitivanje (Etapa 1) izvodi se na temperaturi od 50 °C ukoliko se ne raspolaže podacima o načinu hidrolize supstance. Naredne etape kinetičkih ispitivanja izvode se na najmanje tri različite temperature (uključujući i ispitivanje na temperaturi od 50°C) osim ako je preliminirnim ispitivanjem (Etapa 1) dokazano da supstanca ne podleže hidrolizi. Preporučeni temperaturni opseg je 10 °C do 70 °C (poželjno je da se najmanje jedno ispitivanje izvede na temperaturi manjoj od 25 °C) koji obuhvata ne samo temperaturu od 25 °C za koju se podnosi izveštaj o ispitivanju, već i većinu vrednosti temperatura zabeleženih u prirodnim uslovima.
1.8.4.2. Osvetljenje i kiseonik
Za ispitivanje hidrolize potrebno je izabrati odgovarajuću metodu za minimiziranje fotolitičkih efekata. Preduzimaju se odgovarajuće mere za sprečavanje oksidacije (npr. uduvavanjem helijuma, azota ili argona 5 minuta pre pripreme rastvora).
1.8.4.3. Trajanje ispitivanja
Preliminarno ispitivanje (Etapa 1) treba da traje 5 dana. Naredne etape ispitivanja traju sve dok se 90% ispitivane supstance ne hidrolizuje ili 30 dana, zavisno od toga koji uslov se pre ispuni.
1.8.5. Izvođenje ispitivanja
1.8.5.1. Preliminarno ispitivanje (Etapa 1)
Preliminarno ispitivanje se izvodi na temperaturi od 50 °C ± 0,5 °C pri vrednostima pH od 4, 7 i 9. Ukoliko ispitivana supstanca hidrolizuje manje od 10% u toku perioda od 5 dana, (t0,5 25°C > 1 godine) za tu supstancu se smatra da ne podleže hidrolizi i nije potrebno dalje ispitivanje. Ako je za supstancu dokazano da podleže hidrolizi na ambijentalnoj temperaturiLXII nije neophodno preliminarno ispitivanje. Analitička metoda mora da bude dovoljno precizna i osetljiva da se može detektovati 10% redukcije početne koncentracije ispitivane supstance.
1.8.5.2. Hidroliza nestabilnih supstanci (Etapa 2)
Sledeća etapa ispitivanja izvodi se pri pH vrednostima pri kojima je data ispitivana supstanca nestabilna, a što je dokazano preliminarnim ispitivanjem. Puferski rastvori ispitivane supstance temperiraju se na izabranoj temperaturi. Za ispitivanje kinetike prvog reda, svaki rastvor ispitivane supstance treba da se analizira u određenim vremenskim intervalima što omogućava dobijanje najmanje šest pravilno raspoređenih vrednosti u opsegu od 10% do 90% hidrolize ispitivane supstance. Po jedan uzorak supstance uzima se za merenje u šest vremenskih intervala (ukoliko je ispitivanje postavljeno u najmanje dva ponavljanja u odvojenim posudama) i izuzima iz ispitivanja (dobija se set podataka od najmanje dvanaest vrednosti). Nije adekvatno postavljanje ispitivanja samo sa jedinstvenim uzorkom iz koga će se uzimati pojedinačne alikvote za merenja u vremenskim intervalima, jer ne omogućava analizu varijabilnosti podataka i može da dovede do kontaminacije rastvora ispitivane supstance. Ispitivanja kojima se utvrđuje da su eksperimentalni uslovi sterilni izvode se na kraju završnih etapa, odnosno nakon hidrolize 90% ispitivane supstance ili nakon 30 dana. Ako se ne uočava razgradnja (transformacija)supstance, nije neophodno izvoditi ova ispitivanja.
1.8.5.3. Identifikacija produkata hidrolize (Etapa 3)
Sve važnije produkte hidrolize, odnosno one produkte koji predstavljaju najmanje 10% primenjene doze ispitivane supstance treba identifikovati odgovarajućim analitičkim metodama.
1.8.5.4. Dodatna ispitivanja
Za ispitivanje supstanci koji ne podležu hidrolizi mogu biti neophodna dodatna ispitivanja koja se izvode pri različitim vrednostima pH od 4, 7 i 9.
_______________
LXII Ovi podaci mogu da potiču od drugih izvora kao što su: podaci o hidrolizi strukturno sličnih jedinjenja iz literature ili drugih preliminarnih, semi-kvantitativnih ispitivanja hidrolize sa ispitivanom supstancom u fazama razvijanja metode.
Na primer, kod proučavanja fizioloških procesa može biti potrebno izvoditi ispitivanje u kiseloj sredini (npr. pH 1,2) pri temperaturnim uslovima koji su fiziološki relevantni (37 °C).
Količina ispitivane supstance i produkata hidrolize izražava se u procentima u odnosu na primenjenu početnu koncentraciju ispitivane supstance, i kada je prikladno, u mg/l za svaki vremenski interval merenja i pri svim pH vrednostima i temperaturama. Kada se u ispitivanju koriste obeležene supstance maseni balans se izražava u procentima u odnosu na primenjenu početnu koncentraciju.
Rezultati ispitivanja predstavljaju se grafički: log-transformisani podaci za koncentraciju ispitivane supstance u funkciji vremena. Treba identifikovati sve važnije produkte hidrolize, odnosno produkte koji predstavljaju najmanje 10% primenjene doze ispitivane supstance. Podatke za koncentraciju produkata hidrolize treba transformisati u log-transformisane podatke (identično kao i za ispitivanu supstancu) da bi se uočio stepen obrazovanja i smanjenja produkata hidrolize.
Preciznije izračunavanje vrednosti poluživota ili vrednosti DT50 postiže se primenom odgovarajućih kinetičkih modela. Vrednosti poluživota, odnosno vrednosti DT50 (uključujući i intervale poverenja) prikazuju se za svaku pH vrednost i temperaturu sa opisom korišćenog modela, stepenom kinetike i koeficijenta korelacije (r2). Ove računice mogu se primeniti za produkte hidrolize.
Kada se ispitivanja izvode na različitim temperaturama, konstante hidrolize pseudo-prvog reda (kobs) treba opisati u funkciji temperature. Izračunavanja moraju da se zasnivaju na raščlanjivanju vrednosti kobs na vrednosti konstante za hidrolizu u kiseloj, neutralnoj i baznoj sredini (kH, kneutral i kOH) i Arheniusovoj jednačini:
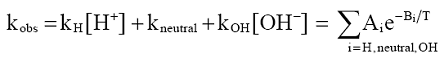
pri čemu:
Ai i Bi jesu vrednosti konstante za odsečak i konstante za nagib regresione prave dobijene regresionom analizom vrednosti ln ki u funkciji recipročnih vrednosti za apsolutnu temperaturu izraženih u Kelvinima (T).
Preko Arheniusove jednačine koja izražava vezu između konstanti za hidrolizu u kiseloj, neutralnoj i baznoj sredini, mogu se izračunati vrednosti konstante kinetike pseudo-prvog reda, a samim tim i vrednosti poluživota za različite temperature za koje nije moguće direktno eksperimentalno određivanje konstanti.
2.2 PROCENA I TUMAČENJE REZULTATA
Većina reakcija hidrolize odigrava se po kinetici prvog reda, te je vreme poluživota nezavisno od koncentracije (videti jednačinu 4 u Delu drugom ove metode). Ovo dozvoljava ekstrapolaciju rezultata dobijenih u laboratorijskim eksperimentima određenih za koncentracije od 10-2M do 10-3 M na uslove u životnoj sredini (≤ 10-6).
Primere dobre korelacije između stepena hidrolize izmerenih u ispitivanjima u čistoj i u ambijentalnoj vodi za set hemikalije, uz uslov da se mere pH vrednosti i temperatura, dali su Mabej i Mil1.
Izveštaj o ispitivanju mora da sadrži podatke o:
1) ispitivanoj supstanci:
- uobičajeni naziv, hemijski naziv, CAS broj, strukturna formula (sa naznačenom pozicijom molekula koji je obeležen radioizotopom) i relevantna fizička i hemijska svojstva (videti odeljak 1.5. ove metode);
- stepen čistoće supstance;
- stepen čistoće oznake i označene supstance, kao i molarna aktivnost (gde je prikladno);
- puferski rastvori;
- vreme i način pripreme;
- puferski rastvori i voda koji se koriste u ispitivanju;
- molarna koncentracija i pH vrednosti puferskih rastvora;
2) uslovima ispitivanja:
- datum izvođenja ispitivanja;
- količina ispitivane supstance;
- način uvođenja ispitivane supstance u rastvor pufera i vrsta rastvarača (kao i količina);
- zapremina puferskih rastvora koji se inkubiraju (pufeski rastvor u koji je rastvorena ispitivana supstanca);
- opis sistema za inkubaciju;
- pH vrednost i temperatura;
- vreme uzimanja uzoraka za analizu;
- način ekstrakcije;
- metode za kvantifikaciju i identifikaciju ispitivane supstance i produkata hidrolize u puferskim rastvorima;
- broj ponavljanja;
3) Rezultatima:
- ponovljivost i osetljivost primenjenih analitičkih metoda;
- efikasnost (kriterijumi za validnost ispitivanja dati su u odeljku 1.7.1. ove metode);
- podaci za pojedinačna ponavljanja i njihove srednje vrednosti izraženi u tabelama;
- maseni balans u toku i na kraju ispitivanja (kad se koriste obeležene supstance);
- rezultati preliminarnog ispitivanja;
- tumačenje rezultata;
- svi originalni (sirovi) podaci i grafici.
Kada je određen stepen hidrolize u izveštaju o ispitivanju navode se:
- grafički prikaz koncentracija ispitivane supstance u funkciji vremena, kada je moguće i za produkte hidrolize za svaku pH vrednost i temperaturu;
- rezultati Arhenijusove jednačine za temperaturu 20°C/25°C sa pH vrednostima, konstante (h-1 ili dan-1), vreme poluživota ili DT50, temperature (°C) uključujući i intervale poverenja i koeficijente korelacije (k2);
- predloženi put hidrolize.
1. OECD, (1981) Hydrolysis as a Function of pH. OECD Guideline for Testing of Chemicals No 111, adopted 12 May 1981.
2. US-Environmental Protection Agency, (1982) 40 CFR 796.3500, Hydrolysis as a Function of pH at 25 oC. Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
3. Agriculture Canada, (1987) Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
4. European Union (EU), (1995) COmmission Directive 95/36/EC amending COuncil Directive 91/414/EEC COncerning the placing of plant protection products on the market. Annex V: Fate and Behaviour in the Environment.
5. Dutch COmmission for Registration of Pesticides, (1991) Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
6. BBA, (1980) Merkblatt No 55, Teil I und II: Prüfung des Verhaltens von Pflanzenbehandlungsmitteln im Wasser (October 1980).
7. SETAC, (1995) Procedures for Assessing the Environmental Fate and ECOtoxicity of Pesticides. Mark R. Lynch, Ed.
8. OECD, (2000) Guidance document on aquatic toxicity testing of difficult substances and mixtures, OECD Environmental Health and Safety Publications Series on Testing and Assessment No 23.
9. OECD, (1993) Guidelines for the Testing of Chemicals. Paris. OECD (1994-2000): Addenda 6-11 to Guidelines for the Testing of Chemicals.
10. Nelson, H, Laskowski D, Thermes S, and Hendley P., (1997) ReCOmmended changes in pesticide fate study guidelines for improving input to COmputer models. (Text version of oral presentation at the 14th Annual Meeting of the Society of Environmental ToxiCOlogy and Chemistry, Dallas TX, November 1993).
11. Mabey, W. and Mill, T., (1978) Critical review of hydrolysis of organic COmpounds in water under environmental COnditions. J. Phys. Chem. Ref. Data 7, p. 383-415.
ŠEMA ETAPNOG ISPITIVANJA HIDROLIZE
Puferske smeše prema Klarku i Lubsu:
Sastav | pH63 |
0,2 N HCl and 0,2 N KCl na 20 °C | |
47,5 ml HCl + 25 ml KCl, rastvoriti od 100 ml | 1,0 |
32,25 ml HCl + 25 ml KCl, rastvoriti do 100 ml | 1,2 |
20,75 ml HCl + 25 ml KCl, rastvoriti do 100 ml | 1,4 |
13,15 ml HCl + 25 ml KCl, rastvoriti do 100 ml | 1,6 |
8,3 ml HCl + 25 ml KCl, rastvoriti do 100 ml | 1,8 |
5,3 ml HCl + 25 ml KCl, rastvoriti do 100 ml | 2,0 |
3,35 ml HCl + 25 ml KCl, rastvoriti do 100 ml | 2,2 |
0,1 M kalijum biftalat + 0,1 N HCl na 20 °C | |
46,70 ml 0,1 N HCl + 50 ml biftalata, dopuniti do 100 ml | 2,2 |
39,60 ml 0,1 N HCl + 50 ml biftalata, dopuniti do 100 ml | 2,4 |
32,95 ml 0,1 N HCl + 50 ml biftalata, dopuniti do 100 ml | 2,6 |
26,42 ml 0,1 N HCl + 50 ml biftalata, dopuniti do 100 ml | 2,8 |
20,32 ml 0,1 N HCl + 50 ml biftalata, dopuniti do 100 ml | 3,0 |
14,70 ml 0,1 N HCl + 50 ml biftalata, dopuniti do 100 ml | 3,2 |
9,90 ml 0,1 N HCl + 50 ml biftalata, dopuniti do 100 ml | 3,4 |
5,97 ml 0,1 N HCl + 50 ml biftalata, dopuniti do 100 ml | 3,6 |
2,63 ml 0,1 N HCl + 50 ml biftalata, dopuniti do 100 ml | 3,8 |
0,1 M kalijum biftalat + 0,1 N NaOH na 20 °C | |
0,40 ml 0,1 N NaOH + 50 ml biftalata, dopuniti do 100 ml | 4,0 |
3,70 ml 0,1 N NaOH + 50 ml biftalata, dopuniti do 100 ml | 4,2 |
7,50 ml 0,1 N NaOH + 50 ml biftalata, dopuniti do 100 ml | 4,4 |
12,15 ml 0,1 N NaOH + 50 ml biftalata, dopuniti do 100 ml | 4,6 |
17,70 ml 0,1 N NaOH + 50 ml biftalata, dopuniti do 100 ml | 4,8 |
23,85 ml 0,1 N NaOH + 50 ml biftalata, dopuniti do 100 ml | 5,0 |
29,95 ml 0,1 N NaOH + 50 ml biftalata, dopuniti do 100 ml | 5,2 |
35,45 ml 0,1 N NaOH + 50 ml biftalata, dopuniti do 100 ml | 5,4 |
39,85 ml 0,1 N NaOH + 50 ml biftalata, dopuniti do 100 ml | 5,6 |
43,00 ml 0,1 N NaOH + 50 ml biftalata, dopuniti do 100 ml | 5,8 |
45,45 ml 0,1 N NaOH + 50 ml biftalata, dopuniti do 100 ml | 6,0 |
0,1 M monokalijum fosfat + 0,1 N NaOH na 20 °C | |
5,70 ml 0,1 N NaOH + 50 ml fosfata, dopuniti do 100 ml | 6,0 |
8,60 ml 0,1 N NaOH + 50 ml fosfata, dopuniti do 100 ml | 6,2 |
12,60 ml 0,1 N NaOH + 50 ml fosfata, dopuniti do 100 ml | 6,4 |
17,80 ml 0,1 N NaOH + 50 ml fosfata, dopuniti do 100 ml | 6,6 |
23,45 ml 0,1 N NaOH + 50 ml fosfata, dopuniti do 100 ml | 6,8 |
29,63 ml 0,1 N NaOH + 50 ml fosfata, dopuniti do 100 ml | 7,0 |
35,00 ml 0,1 N NaOH + 50 ml fosfata, dopuniti do 100 ml | 7,2 |
39,50 ml 0,1 N NaOH + 50 ml fosfata, dopuniti do 100 ml | 7,4 |
42,80 ml 0,1 N NaOH + 50 ml fosfata, dopuniti do 100 ml | 7,6 |
45,20 ml 0,1 N NaOH + 50 ml fosfata, dopuniti do 100 ml | 7,8 |
46,80 ml 0,1 N NaOH + 50 ml fosfata, dopuniti do 100 ml | 8,0 |
0,1 M H3BO3 u 0,1 M KCl + 0,1 N NaOH na 20 °C | |
2,61 ml 0,1 N NaOH + 50 ml borne kis, dopuniti do 100 ml | 7,8 |
3,97 ml 0,1 N NaOH + 50 ml borne kis, dopuniti do 100 ml | 8,0 |
5,90 ml 0,1 N NaOH + 50 ml borne kis, dopuniti do 100 ml | 8,2 |
8,50 ml 0,1 N NaOH + 50 ml borne kis, dopuniti do 100 ml | 8,4 |
12,00 ml 0,1 N NaOH + 50 ml borne kis, dopuniti do 100 ml | 8,6 |
16,30 ml 0,1 N NaOH + 50 ml borne kis, dopuniti do 100 ml | 8,8 |
21,30 ml 0,1 N NaOH + 50 ml borne kis, dopuniti do 100 ml | 9,0 |
26,70 ml 0,1 N NaOH + 50 ml borne kis, dopuniti do 100 ml | 9,2 |
32,00 ml 0,1 N NaOH + 50 ml borne kis, dopuniti do 100 ml | 9,4 |
36,85 ml 0,1 N NaOH + 50 ml borne kis, dopuniti do 100 ml | 9,6 |
40,80 ml 0,1 N NaOH + 50 ml borne kis, dopuniti do 100 ml | 9,8 |
43,90 ml 0,1 N NaOH + 50 ml borne kis, dopuniti do 100 ml | 10,0 |
63 Vrednosti pH date u ovoj tabeli izračunate su Sorensenovim standarnim jednačinama (1909). Odgovarajuće pH vrednosti su za 0,04 pH jedinica veće od vrednosti datih u tabeli.
Citratni puferi prema Kolthofu i Vlišhoveru:
Sastav | pH |
0,1 M monokalijum citrat i 0,1 N HCl na 18 °C (*) | |
49,7 ml 0,1 N HCl + 50 ml citrata, dopuniti do 100 ml | 2,2 |
43,4 ml 0,1 N HCl + 50 ml citrata, dopuniti do 100 ml | 2,4 |
36,8 ml 0,1 N HCl + 50 ml citrata, dopuniti do 100 ml | 2,6 |
30,2 ml 0,1 N HCl + 50 ml citrata, dopuniti do 100 ml | 2,8 |
23,6 ml 0,1 N HCl + 50 ml citrata, dopuniti do 100 ml | 3,0 |
17,2 ml 0,1 N HCl + 50 ml citrata, dopuniti do 100 ml | 3,2 |
10,7 ml 0,1 N HCl + 50 ml citrata, dopuniti do 100 ml | 3,4 |
4,2 ml 0,1 N HCl + 50 ml citrata, dopuniti do 100 ml | 3,6 |
0,1 M monokalijum citrat i 0,1 N NaOH na 18°C64 | |
2,0 ml 0,1 N NaOH + 50 ml citrata, dopuniti do 100 ml | 3,8 |
9,0 ml 0,1 N NaOH + 50 ml citrata, dopuniti do 100 ml | 4,0 |
16,3 ml 0,1 N NaOH + 50 ml citrata, dopuniti do 100 ml | 4,2 |
23,7 ml 0,1 N NaOH + 50 ml citrata, dopuniti do 100 ml | 4,4 |
31,5 ml 0,1 N NaOH + 50 ml citrata, dopuniti do 100 ml | 4,6 |
39,2 ml 0,1 N NaOH + 50 ml citrata, dopuniti do 100 ml | 4,8 |
46,7 ml 0,1 N NaOH + 50 ml citrata, dopuniti do 100 ml | 5,0 |
54,2 ml 0,1 N NaOH + 50 ml citrata, dopuniti do 100 ml | 5,2 |
61,0 ml 0,1 N NaOH + 50 ml citrata, dopuniti do 100 ml | 5,4 |
68,0 ml 0,1 N NaOH + 50 ml citrata, dopuniti do 100 ml | 5,6 |
74,4 ml 0,1 N NaOH + 50 ml citrata, dopuniti do 100 ml | 5,8 |
81,2 ml 0,1 N NaOH + 50 ml citrata, dopuniti do 100 ml | 6,0 |
64 Dodati mali kristal tinola ili slične supstance da se spreči rast plesni.
Boratne smeše prema Sorensenu:
Sastav | Sorensen, | Valbum, pH na | ||||
boraks | HCl/NaOH | 10 °C | 40 °C | 70 °C | ||
0,05 M boraks + 0,1 N HCl | ||||||
5,25 | 4,75 | 7,62 | 7,64 | 7,55 | 7,47 | |
5,50 | 4,50 | 7,94 | 7,98 | 7,86 | 7,76 | |
5,75 | 4,25 | 8,14 | 8,17 | 8,06 | 7,95 | |
6,00 | 4,00 | 8,29 | 8,32 | 8,19 | 8,08 | |
6,50 | 3,50 | 8,51 | 8,54 | 8,40 | 8,28 | |
7,00 | 3,00 | 8,08 | 8,72 | 8,56. | 8,40 | |
7,50 | 2,50 | 8,80 | 8,84 | 8,67 | 8,50 | |
8,00 | 2,00 | 8,91 | 8,96 | 8,77 | 8,59 | |
8,50 | 1,50 | 9,01 | 9,06 | 8,86 | 8,67 | |
9,00 | 1,00 | 9,09 | 9,14 | 8,94 | 8,74 | |
9,50. | 0,50 | 9,17 | 9,22 | 9,01 | 8,80 | |
10,00 | 0,00 | 9,24 | 9,30 | 9,08 | 8,86 | |
0,05 M boraks + 0,1 N NaOH | ||||||
10,0 | 0,0 | 9,24 | 9,30 | 9,08 | 8,86 | |
9,0 | 1,0 | 9,36 | 9,42 | 9,18 | 8,94 | |
8,0 | 2,0 | 9,5 | 9,57 | 9,30 | 9,02 | |
7,0 | 3,0 | 9,68 | 9.76 | 9,44 | 9,12 | |
6,0 | 4,0 | 9,97 | 10,06 | 9,67 | 9,28 | |
Fosfatne smeše prema Sorensenu:
Sastav | pH |
0,0667 M monokalijum fosfat + 0,0667 M dinatrijum fosfat na 20 °C | |
99,2 ml KH2PO4 + 0,8 ml Na2HPO4 | 5,0 |
98,4 ml KH2PO4 + 1,6 ml Na2HPO4 | 5,2 |
97,3 ml KH2PO4 + 2,7 ml Na2HPO4 | 5,4 |
95,5 ml KH2PO4 + 4,5 ml Na2HPO4 | 5,6 |
92,8 ml KH2PO4 + 7,2 ml Na2HPO4 | 5,8 |
88,9 ml KH2PO4 + 11,1 ml Na2HPO4 | 6,0 |
83,0 ml KH2PO4 + 17,0 ml Na2HPO4 | 6,2 |
75,4 ml KH2PO4 + 24,6 ml Na2HPO4 | 6,4 |
65,3 ml KH2PO4 + 34,7 ml Na2HPO4 | 6,6 |
53,4 ml KH2PO4 + 46,6 ml Na2HPO4 | 6,8 |
41,3 ml KH2PO4 + 58,7 ml Na2HPO4 | 7,0 |
29,6 ml KH2PO4 + 70,4 ml Na2HPO4 | 7,2 |
19,7 ml KH2PO4 + 80,3 ml Na2HPO4 | 7,4 |
12,8 ml KH2PO4 + 87,2 ml Na2HPO4 | 7,6 |
7,4 ml KH2PO4 + 92,6 ml Na2HPO4 | 7,8 |
3,7 ml KH2PO4 + 96,3 ml Na2HPO4 | 8,0 |
C.8. TOKSIČNOST ZA KIŠNE GLISTE: METODA ISPITIVANJA SA VEŠTAČKIM ZEMLJIŠTEM
U ovoj laboratorijskoj metodi ispitivanja, ispitivana supstanca dodaje se u veštačko zemljište u koje se smeštaju kišne gliste. Nakon 14 dana (ili po izboru nakon 7 dana) ispituje se letalno dejstvo supstance na kišne gliste. Ovo ispitivanje predstavlja postupak kojim se u relativno kratkom roku može steći uvid u dejstvo hemikalija na kišne gliste, kod dermalnog i oralnog unosa supstance.
LC50 jeste koncentracija supstance koja izaziva smrt 50% ispitivanih jedinki u toku unapred utvrđenog perioda izlaganja.
Referentna supstanca se koristi povremeno kao sredstvo kojim se pokazuje da nije došlo do značajnih promena osetljivosti test sistema.
Kao referentna supstanca preporučuje se hloracetamid analitičke čistoće.
Zemljište je promenljiv medijum, te se za ovu metodu koristi precizno definisano veštačko zemljište koje sadrži ilovaču. Odrasle jedinke kišnih glista vrste Eisenia foetida (vidi belešku u Delu drugom ove metode) drže se u definisanom veštačkom zemljištu tretiranom različitim koncentracijama ispitivane supstance. Četrnaest dana (može i 7 dana) nakon početka ispitivanja, sadržaj posude iz svake esperimentalne grupe istrese se u plitku laboratorijsku kadicu i prebroje se preživele kišne gliste.
Metoda je osmišljena tako da je maksimalno ponovljiva, s obzirom na zemljišni supstrat i ispitivane organizme. Da bi ispitivanje bilo prihvaćeno, smrtnost u kontrolama ne sme premašiti 10% na kraju ispitivanja.
1.6.1. Materijal
1.6.1.1. Zemljišni supstrat
Kao osnovni ispitivani supstrat koristi se tačno definisano veštačko zemljište.
Osnovni supstrat (procenti na bazi suve mase) sadrži:
- 10% treseta (vrednosti pH što je moguće bliže 5,5 do 6,0, bez vidljivih ostataka biljaka, sitno mleven);
- 20% kaolinska glina sa po mogućnosti više od 50% kaolina;
- oko 69% industrijskog kvarcnog peska (pretežno sitni pesak sa više od 50% čestica veličine 0,05 mm do 0,2 mm). Ako se supstanca ne može dovoljno dobro dispergovati u vodi, treba ostaviti 10 g po sanduku da bi se kasnije pomešalo sa ispitivanom supstancom;
- oko 1% kalcijum karbonata (CaCO3), sprašenog, hemijski čistog, dodaje se za korekciju pH vrednosti na 6,0 ± 0,5.
Ispitivani supstrat sadrži:
- osnovni supstrat,
- ispitivanu supstancu i
- dejonizovanu vodu.
Sadržaj vode iznosi oko 25% do 42% suve mase osnovnog supstrata. Sadržaj vode u supstratu određuje se sušenjem uzorka do stalne težine na temperaturi od 105 °C. Ključni kriterijum je da veštačko zemljište mora biti ovlaženo do tačke u kojoj nema zadržavanja vode. Tokom mešanja mora se paziti da se dobije ravnomerna raspodela ispitivane supstance i supstrata. Mora se opisati način na koji se ispitivana supstanca dodaje u supstrat.
Kontrolni supstrat sadrži:
- osnovni supstrat i
- vodu.
Ako se koristi aditiv, dodatna kontrola mora da sadrži istu količinu aditiva.
1.6.1.2. Eksperimentalne posude
Staklena posuda zapremine oko 1 L (propisno pokrivena plastičnim poklopcem, sahatnim staklom ili plastičnom folijom sa otvorima za ventilaciju) napunjena ispitivanim i kontrolnim supstratom u količini ekvivalentnoj 500 g suve mase supstrata.
1.6.2. Uslovi u toku ispitivanja
Eksperimentalne posude treba držati u klima komorama na temperaturi od 20°C ± 2 °C sa stalnim osvetljenjem. Intenzitet svetla treba da bude između 400 lux i 800 lux.
Ispitivanje traje 14 dana, ali se smrtnost mora proceniti i 7 dana nakon početka ispitivanja.
1.6.3. Postupak metode ispitivanja
Ispitivane koncentracije
Koncentracije ispitivane supstance izražavaju se kao masa supstance po suvoj masi supstrata (mg/kg).
Preliminarna studije za utvrđivanje opsega koncentracija
Opseg koncentracija koje dovode do smrtnosti od 0% do 100% može se odrediti studijom za utvrđivanje opsega da bi se dobila informacija o opsegu koncentracija koje će se koristiti u definitivnom ispitivanju.
Supstanca se ispituje u sledećim koncentracijama: 1.000 mg; 100 mg; 10 mg; 1 mg i 0,1 mg supstance po kilogramu supstrata (suva masa).
Ako se radi konačno ispitivanje, po jedna ispitivana grupa od po 10 glista po koncentraciji i jedna grupa po kontroli, mogu biti dovoljne za studiju utvrđivanja opsega koncentracija.
Konačno ispitivanje
Rezultati studije za utvrđivanje opsega koncentracija koriste se za izbor najmanje 5 koncentracija u geometrijskom nizu sa faktorom ne većim od 1,8. Izabrane koncentracije obuhvataju opseg smrtnosti od 0% do 100%.
Ispitivanje serija koncentracija treba da omogući što precizniju procenu vrednosti LC50 i odgovarajućih intervala poverenja.
U definitivnom ispitivanju koriste se najmanje četiri eksperimentalne grupe od po 10 glista po koncentraciji i kontroli. Rezultati tretmana prikazuju se kao srednja vrednost iz 4 grupe sa standardnom devijacijom.
Kad dve uzastopne koncentracije, pri faktoru od 1,8 rezultiraju 0% i 100% smrtnošću, te dve vrednosti su dovoljne da pokažu opseg u kojem se nalazi LC50.
Mešavina osnovnog ispitivanog supstrata i ispitivane supstance
Ispitivani supstrat kad god je moguće priprema se izuzimajući vodu, bez i jednog dodatnog agensa. Neposredno pre početka ispitivanja, emulzija ili disperzija ispitivane supstance u dejoniziovanoj vodi ili drugom rastvaraču meša se sa osnovnim ispitivanim supstratom ili se ravnomerno rasprši po supstratu pomoću hromatografskog ili sličnog raspršivača za fino raspršivanje.
Ako nije rastvorljiva u vodi, ispitivana supstanca može se rastvoriti u najmanjoj mogućoj zapremini odgovarajućeg organskog rastvarača (npr. heksana, acetona ili hloroforma). Samo sredstva koja brzo isparavaju mogu se koristiti za rastvaranje, disperziju ili emulgovanje ispitivane supstance. Ispitivana supstanca se mora pre upotrebe provetriti. Količina vode koja ispari mora se nadoknaditi. Kontrola mora da sadrži istu količinu svakog upotrebljenog dodatnog sredstva.
Ako ispitivana supstanca nije rastvorljiva ili se ne može dispergovati ili emulgovati u organskim rastvaračima, 10 g mešavine sitno samlevenog kvarcnog peska i količina ispitivane supstance potrebna za tretman 500 g suve mase veštačkog zemljišta pomeša se sa 490 g suve mase ispitivane supstance.
U svakoj grupi, u svaku posudu stavlja se vlažan ispitivani supstrat u količini ekvivalentnoj 500 g suve mase, a zatim se na površinu supstrata stavlja po 10 kišnih glista po posudi. Gliste su prethodno aklimatizovane u toku 24 sata u slično vlažnom, osnovnom suptratu, a zatim brzo isprane. Pre stavljanja u ispitivani supstrat, suvišna voda sa glista upije se filter papirom.
Eksperimentalne posude pokriju se perforiranim plastičnim poklopcima, sahatnim staklom ili folijom, da bi se sprečilo sušenje supstrata. Posude se drže 14 dana u uslovima propisanim metodom.
Smrtnost se procenjuje 14 (opciono 7) dana nakon početka. Supstrat se prospe u plitak slakleni sud od nerđajućeg čelika. Kišne gliste se pregledaju i odredi se broj preživelih glista. Kišne gliste smatraju se mrtvim ako ne odgovaraju na nežan mehanički nadražaj na prednjem kraju.
Kada se smrtnost procenjuje nakon 7 dana, posuda se ponovno napuni supstratom i preživele gliste se vrate na površinu istog ispitivanog supstrata.
1.6.4. Ispitivani organizmi
Ispitivani organizmi su odrasle jedinke Eisenia foetida (videti Deo drugi ove metode), stare najmanje dva meseca sa klitelumom, pune težine između 300 mg i 600 mg (za postupak uzgajanja videti Deo drugi ove metode).
2.1. OBRADA I PROCENA REZULTATA
Koncentracija ispitivane supstance navodi se u odnosu na odgovarajuće procente mrtvih kišnih glista.
Kad su podaci dobri, vrednost LC50 sa intervalima poverenja (p = 0,05) može se odrediti pomoću standardnih metoda (videti uliteraturi4). LC50 se izražava u mg ispitivane supstance po kilogramu ispitivanog supstrata (suva masa).
U slučajevima kada je nagib krive dozne zavisnosti previše strm da bi se mogla izračunati LC50, dovoljna je grafička procena te vrednosti.
Kad dve uzastopne koncentracije pri faktoru od 1,8 dovode samo do 0% i 100% smrtnosti, te dve vrednosti su dovoljne da pokažu opseg u kojem se nalazi LC50.
Izveštaj o ispitivanju, ako je moguće, sadrži:
- izjavu da je ispitivanje izvedeno u skladu sa navedenim kriterijima kvaliteta;
- podatak koje je ispitivanje izvedeno (preliminarna studija za utvrđivanje opsega koncentracija ili definitivno ispitivanje);
- tačan opis uslova u toku ispitivanja ili izjavu da je ispitivanje bilo izvedeno u skladu sa postupkom (mora se navesti svako odstupanje);
- tačan opis načina na koji je ispitivana supstanca umešana u osnovni supstrat;
- podatke o ispitivanim organizmima (vrsta, starost, srednja vrednost i opseg težine, uslovi držanja i uzgajanja, snabdevač);
- podatak o metodi korišćenoj za određivanje LC50;
- rezultate ispitivanja, uključujući sve upotrebljene podatke;
- opis primećenih simptoma ili promena u ponašanju ispitivanih organizama;
- smrtnost u kontrolama;
- LC50 ili najvišu ispitivanu koncentraciju bez smrtnosti i najnižu ispitivanu koncentraciju sa smrtnošću od 100%, 14 dana (i po izboru 7 dana) od početka ispitivanja;
- grafički prikaz krive koncentracija/odgovor;
- rezultate dobijene sa referentnom supstancom (u vezi sa ovim ispitivanjem ili iz prethodnih ispitivanja kontrole kvaliteta).
1. OECD, Paris, 1981, Test Guideline 207, Decision of the Council C(81)30 final.
2. Edwards, C. A. and Lofty, J. R., 1977, Biology of Earthworms, Chapman and Hall, London, p. 331.
3. Bouche. M. B., 1972, Lombriciens de France, ECOlogie et Systematique, Institut National de la Recherche Agronomique, p. 671.
4. Litchfield, J. T. and Wilcoxon, F., A simplified method of evaluation dose effect experiments. I. Pharm. Exp. Therap., vol. 96, 1949, p. 99.
5. Commission of the European Communities, Development of a standardised laboratory method for assessing the toxicity of chemical substances to earthworms, Report EUR 8714 EN, 1983.
6. Umweltbundesamt/Biologische Bundesanstalt für land- und Forstwirtschaft, Berlin, 1984, Verfahrensvorschlag ‘Toxizitätstest am Regenwurm Eisenia foetida in künstlichem Boden’, in: Rudolph/Boje, Ökotoxikologie, ecomed, Landsberg, 1986.
UZGAJANJE I ČUVANJE GLISTA PRE ISPITIVANJA
Za uzgajanje životinja, 30 do 50 odraslih glista stavi se u sanduk za uzgajanje sa svežim supstratom iz koga se izvade nakon 14 dana. Gliste se mogu upotrebiti za uzgajanje daljih odgajivačkih grupa. Kišne gliste koje se izlegu iz kokona koriste se u ispitivanjima kad odrastu (u prepisanim uslovima nakon dva do tri meseca).
Uslovi za držanje i uzgoj životinja su:
Klima komora: temperatura 20 °C ± 2 °C po mogućnosti sa stalnim osvetljenjem (intenziteta 400 lux do 800 lux).
Sanduci za uzgoj: pogodni plitki sanduci zapremine od 10 L do 20 L.
Supstrat: Eisenia foetida može se uzgajati u ekskrementu različitih životinja. Kao supstrat se preporučuje mešavina treseta (50% zapremine) i kravlje ili konjske balege (50% zapremine). Supstrat mora da ima vrednost pH oko 6 do 7 (reguliše se kalcijum karbonatom) i nisku jonsku provodljivost (manje od 6 mmhos ili 0,5% koncentracije soli). Supstrat treba da bude vlažan, ali ne previše mokar.
Uz opisani postupak mogu se uspešno koristiti i druge procedure.
Napomena: Postoje dva tipa glista Eisenia foetida koje su taksonomi razdvojili u dve vrste (Vouche, 1972). Morfološki su slične, ali jedna vrsta (Eisenia foetidafoetida) ima na segmentima tipične poprečne pruge ili prstenove, dok ih druga vrsta (Eisenia foetida andrei) nema, odnosno ima crvenkaste šare. Kad god je moguće, treba koristiti vrsti Eisenia foetida andrei. Ostale vrste mogu se koristiti ako je na raspolaganju potrebna metodologija.
C.9. BIORAZGRADNJA - ZAHN-WELLENS METODA ISPITIVANJA
Cilj ove metode je procena mogućnosti potpune biorazgradljivosti dobro rastvorljivih, neisparljivih organskih supstanci na koje deluju mikroorganizmi u relativno visokim koncentracijama u ispitivanju u statičkim uslovima.
Prilikom tumačenja rezultata mora se uzeti u obzir mogućnost fizičko-hemijske adsorpcije na suspendovane materije (videti odeljak 3.2. ove metode).
Za koncentracije ispitivane supstance uzimaju se koncentracije koje korespondiraju vrednostima za koncentraciju rastvorenog organskog ugljenika(u daljem tekstu: DOC) u opsegu od 50 mg/l do 400 mg/l ili vrednostima za hemijsku potrošnju kiseonika (u daljem tekstu: HPK) u opsegu od 100 mg/ldo 1.000 mg/l. Ispitivanje ovako relativno visokih koncentracija povećava analitičku pouzdanost. Jedinjenja sa toksičnim svojstvima mogu usporiti i inhibirati proces razgradnje.
U ovoj metodi, DOC ili HPK koristi se za procenu potpune biorazgradljivosti ispitivane supstance.
Uporedno izvođenje specifičnih analitičkih metoda može dati procenu primarne biorazgradljivosti supstanci (nestanak polazne supstance).
Metoda se može primeniti samo za organske supstance koje, pri koncentracijama koje se koriste u ispitivanju:
- jesu rastvorljive u vodi u uslovima definisanim ovom metodom;
- imaju neznatan napon pare u uslovima definisanim ovom metodom;
- ne deluju inhibitorno na bakterije;
- koje se adsorbuju se unutar sistema samo u ograničenoj meri;
- ne obrazuju penu.
Podaci o proporcionalnom udelu glavnih sastojaka ispitivane supstance korisni su pri tumačenju dobijenih rezultata, naročito u slučajevima gde su vrednosti dobijenih rezultata niske ili ekstremne.
Podaci o toksičnosti ispitivane supstance na mikroorganizme poželjni su za tumačenje niskih dobijenih vrednosti i prilikom izbora odgovarajućih koncentracija za potrebe ispitivanja.
1.2. DEFINICIJE I MERNE JEDINICE
Stepen razgradnje koji se dostigne na kraju ispitivanja opisuje se kao biorazgradljivost u Zahn-Wellensispitivanju:
pri čemu:
Dt jeste procenat biorazgradnje (%) u vremenu T;
CA jeste DOC (ili HPK) vrednost izmerena u ispitivanoj smeši 3 sata nakon početka ispitivanja (mg/l);
Ct jesu DOC ili HPK vrednosti izmerene u ispitivanoj smeši u vremenu t (mg/l);
CB jesu DOC ili HPK vrednosti izmerene u kontroli u vremenu t (mg/l);
CBA jesu DOC ili HPK vrednosti izmerene u kontroli, tri sata nakon početka ispitivanja (mg/l).
Stepen razgradnje izražava se u procentima bez decimala.
Procenat razgradnje jeste procenat smanjenja vrednosti DOC (ili HPK) za datu supstancu.
Razlika između vrednosti izmerene nakon tri sata i izračunate vrednosti, ili po mogućnosti izmerene početne vrednosti, može dati koristan podatak o eliminaciji supstance (videti odeljak 3.2. ove metode).
Korišćenje referentnih supstanci može biti od koristi kada se ispituju nove supstance. Još uvek se ne mogu preporučiti određene referentne supstance.
Aktivni mulj, neorganski nutrijenti i ispitivana supstanca u vodenom rastvoru kao jedini izvor ugljenika sjedinjuju se, stavljaju u staklenu posudu zapremine jedan do četiri litra sa mešalicom i aeratorom. Ova smeša se meša i aeriše na temperaturi od 20 °C do 25 °C pod difuznim osvetljenjem ili u mračnoj komori u toku 28 dana. Proces razgradnje prati se određivanjem vrednosti DOC (ili HPK) u filtratu smeše sa jednodnevnom ili odgovarajućom redovnom dinamikom. Odnos vrednosti DOC (ili HPK) izmerene nakon svakog vremenskog intervala i vrednosti DOC (ili HPK) izmerene tri sata nakon početka ispitivanja izražava se kao procenat biorazgradnje i služi kao mera stepena razgradnje u datom vremenu. Ova vrednost se grafički prikazuje u funkciji vremena kako bi se dobila kriva biološke razgradnje.
Kad se koristi specifična analitička metoda, mogu se meriti promene u koncentraciji polazne supstance do kojih dolazi usled biorazgradnje (primarna biorazgradljivost).
Ponovljivost metode ispitivanja je dokazana interkalibracijskim ispitivanjima.
Osetljivost metode je u velikoj meri određena varijabilnošću rezultata slepe probe i u manjoj meri, preciznošću određivanja koncentracije rastvorenog organskog ugljenika i količini rastvorene ispitivane supstance.
1.6.1. Pripreme
1.6.1.1. Reagensi
Voda: voda za piće sa sadržajem organskog ugljenika < 5 mg/l. Zbirna koncentracija jona kalcijuma i magnezijuma ne sme biti veća od 2,7 mmol/l; u suprotnom, potrebno je napraviti odgovarajuće razblaživanje sa dejonizivanom ili destilovanom vodom.
Sumporna kiselina, analitičke čistoće: 50 g/l.
Rastvor natrijum-hidroksida, analitičke čistoće: 40 g/l.
Rastvor neorganskih nutrijenata (rastvoriti u 1 L dejonizovane vode):
- NH4Cl (amonijum-hlorid), analitičke čistoće: 38,5 g;
- NaH2PO4x2H2O (natrijum dihidrogenfosfat), analitičke čistoće:33,4 g;
- KH2PO4(kalijum-hidrogenfosfat), analitičke čistoće: 8,5 g;
- K2HPO4 (dikalijum-hidrogenfosfat), analitičke čistoće: 21,75 g.
Smeša služi kao rastvor nutrijenata i kao puferski rastvor.
1.6.1.2. Oprema
Oprema za ispitivanje sadrži:
- staklene posude zapremine od 1 L do 4 L (npr. cilindrične posude);
- mešalicu sa staklenom ili metalnom lopaticom na odgovarajućoj osovini (lopatica se mora rotirati na 5 cm do 10 cm iznad dna posude). Može se koristiti i magnetna mešalica sa magnetom za mešanje 7 cm do 10 cm;
- staklenu cevčicu sa unutrašnjim prečnikom 2 mm do 4 mm za aeraciju. Otvor cevčice treba da bude postavljen na oko 1 cm iznad dna posude;
- centrifugu (oko 3.550 g);
- pH-metar;
- oksimetar;
- filter papir;
- uređaj za membransku filtraciju;
- membranske filtere, promera pora 0,45 µm. Membranski filteri su pogodni ukoliko je onemogućeno oslobađanje ugljenika iz filter papira ili adsorbovanje ispitivane supstance u toku filtracije;
- analitičku opremu za određivanje sadržaja organskog ugljenika i hemijske potrošnje kiseonika.
1.6.1.3. Priprema inokuluma
Aktivni mulj iz postrojenja za biološku obradu ispira se (u više ponavljanja) centrifugiranjem ili taloženjem u vodi koja se koristi za potrebe ispitivanja.
Aktivni mulj mora biti u odgovarajućem stanju. Takav mulj može se dobiti iz postrojenja za obradu otpadnih voda koja ispravno rade. Da bi se dobilo što više različitih vrsta ili sojeva bakterija, poželjno je mešanje inokuluma iz različitih izvora (npr. iz različitih postrojenja za obradu, iz ekstrakata zemljišta, iz vode iz reka itd). Mešavina inokuluma dalje se tretira na navedeni način.
Za proveru aktivnosti aktivnog mulja videti odeljak "Funkcionalna kontrola" iz ove metode.
1.6.1.4. Priprema ispitivanih rastvora
U posudu dodati: 500 ml vode koja se koristi za potrebe ispitivanja, 2,5 ml/l rastvora neorganskih nutrijenata i aktivni mulj u količini koja korespondira 0,2 do 1,0 g suve materije/l u krajnjoj smeši. Dodati dovoljnu količinu osnovnog rastvora ispitivane supstance tako da se uspostavi vrednost DOC 50 mg/ldo 400 mg/l u krajnjoj smeši. Korespondirajuće vrednosti za HPK su 100 mg/l do 1.000 mg/l. Dopuniti posudu sa vodom koja se koristi za potrebe ispitivanja do zapremine 1 L ili 4 L (u zavisnosti od zapremine posude). Zapremina rastvora zavisi od broja uzoraka potrebnih za određivanje vrednosti DOC ili HPK, kao i zapremina uzoraka potrebnih za analitička merenja.
Zapremina od 2 L može se smatrati zadovoljavajućom. Za svaku koncentraciju ispitivane supstance paralelno se postavi minimum jedna kontrola, koja sadrži samo aktivni mulj i rastvor neorganskih nutrijenata u jednakoj zapremini vode kao u ostalim posudama.
1.6.2. Izvođenje ispitivanja
Rastvori ispitivane supstance mešaju se na magnetnoj mešalici ili mešalici sa lopaticom pod difuznim osvetljenjem ili u mračnoj komori na temperaturi 20 °C do 25 °C. Aeracija se obavlja pomoću komprimovanog vazduha koji se prečišćava pomoću staklene vune i pomoću špric-boce ukoliko se ukaže potreba. Mora se onemugućiti taloženje mulja i pad koncentracija kiseonika ispod 2 mg/l.
Vrednost pH mora da se proverava u jednakim vremenskim intervalima (npr. dnevno) i da se po potrebi podesi na pH vrednosti od 7 ili 8.
Gubici usled isparavanja nadoknađuju se dodavanjem potrebne količine dejoniziovane ili destilovane vode neposredno pre svakog uzimanja uzoraka. Poželjno je pre početka ispitivanja označiti nivo tečnosti u posudi. Nove oznake nivoa tečnosti stavljaju se na posudu nakon svakog uzimanja uzoraka (bez aeracijskog suvog mešanja). Prvi uzorci se uvek uzimaju tri sata nakon početka ispitivanja da bi se odredilo da li se ispitivana supstanca adsorbuje na aktivni mulj
Razgradnja ispitivane supstance prati se određivanjem vrednosti DOC koje se radi svakodnevno ili u određenim redovnim vremenskim intervalima. Uzorci iz eksperimentalnih posuda i kontrolnih posuda filtriraju se kroz pažljivo opran filter papir. Prvih 5 ml filtrata rastvora se odbacuje. Aktivni mulj koji je teško filtrirati može se prethodno ukloniti centrifugiranjem 10 minuta. Određivanje vrednosti DOC ili HPK radi se najmanje u dva ponavljanja. Ispitivanje se izvodi u trajanju do 28 dana.
Napomena: Filtrati koji ostaju zamućeni dalje se filtriraju kroz membranske filtere. Membranski filteri ne smeju otpuštati ili adsorbovati nijednu vrstu organskog materijala.
Kontrola aktivnog mulja
Uporedo sa svakom serijom koncentracija ispitivane supstance postavlja se paralelno ispitivanje da bi se proverila aktivnost aktivnog mulja. Za ovu namenu se dietilenglikol pokazao korisnim.
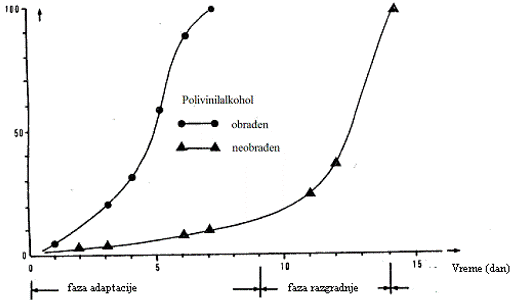
Adaptacija
Ukoliko se merenja obavljaju u relativno kratkim intervalima (npr. svakodnevno), adaptiranost se može jasno uočiti iz krive razgradnje (videti Sliku 2). Ispitivanje ne treba započeti neposredno pred vikend.
Ako adaptiranost nastupi na kraju perioda, ispitivanje se može produžiti sve dok se ne završi razgradnja.
Napomena: Ako je potrebno znati više o ponašanju adaptiranog mulja, isti aktivni mulj se još jednom tretira istom ispitivanom supstancom u skladu sa postupkom:
Isključiti mešalicu i aerator i ostaviti da se aktivni mulj istaloži. Odstraniti supernatant, napuniti posudu do 2 L zapremine sa vodom, mešati 15 minuta i ponovno ostaviti mulj da se istaloži. Nakon što se supernatant ponovno odstrani, istaloženi mulj se ponovo tretira istom ispitivanom supstancom u skladu sa odeljcima 1.6.1.4. i 1.6.2. ove metode. Aktivni mulj se može istaložiti i centrifugiranjem.
Adaptirani mulj može da se meša sa svežim muljem do koncentracije 0,2 g do 1 g suve težine/l.
Oprema za analitička merenja
Uzorci se filtriraju kroz pažljivo oprani filter papir (za pranje se koristi dejonizovana voda).
Filtrati koji ostaju zamućeni filtriraju se kroz membranske filtere promera 0,45 µm.
Vrednost DOC određuje se u dva ponavljanja u filtratima uzoraka (prvih 5 ml se odbacuje) pomoću TOC instrumenta. Ako se filtrat ne može analizirati istog dana, mora se čuvati u frižideru do sledećeg dana. Ne preporučuje se čuvanje materijala duže vreme.
HPK se određuje u filtratima uzorka prema postupku opisanom u literaturi2.
Vrednost DOC, odnosno HPK se određuje najmanje u dva ponavljanja u uzorcima u skladu sa smernicama datim u odeljku 1.6.2. Razgradnja u vremenu t izračunava se prema formuli (sa definicijama) datim u odeljku 1.2.
Stepen razgradnje koji se dostigne na kraju ispitivanja se opisuje kao "biorazgradljivost u Zahn-Wellens ispitivanju".
Napomena: Ako se potpuna razgradnja dostigne pre kraja ispitivanja i ako se ovaj rezultat potvrdi i u drugom navratu narednog dana, ispitivanje se može prekinuti.
Izveštaj o ispitivanju, ako je moguće, sadrži:
- početnu koncentraciju ispitivane supstance;
- sve ostale podatke i rezultate ispitivanja supstance, referentne supstance(ukoliko je korišćena) i slepe probe;
- koncentraciju ispitivane supstance nakon tri sata;
- biorazgradnju (kriva sa opisom);
- datum i mesto gde su uzeti organizmi koji su korišćeni u ispitivanju, nivo adaptiranosti aktvinog mulja, korišćene koncentracije, itd;
- naučno utemeljene razloge za eventualne promene u izvođenju ispitivanja.
Postepeno smanjenje vrednosti DOC (HPK) koje se registruje u toku nekoliko dana ili sedmica jeste pokazatelj da je ispitivana supstanca biorazgradljiva.
Na ispitivanje može da utiče fizičko-hemijska adsorpcija. To je slučaj kada se u toku prva tri sata ispitivanja, registruje potpuno ili delimično smanjenje vrednosti DOC (HPK), a razlika u nivou tečnosti između ispitivane grupe i kontrolne grupe ostaje neznatna.
Potrebno je izvesti dodatna ispitivanja za razgraničavanje procesa biorazgradnje (ili parcijalne biorazgradnje) od procesa adsorpcije. Najpouzdaniji način da se to uradi je da se u postavci ispitivanja (najbolje respirometrijsko ispitivanje), kao inokulum upotrebe supernatant ili mulj.
Supstance su potencijano biorazgradljive, ako se u ispitivanju registruje značajno smanjenje vrednosti DOC (HPK) koje nije posledica adsorpcije. Delimično smanjenje vrednosti DOC (HPK), koje nije posledica adsorpcije, ukazuje na to da je ispitivana supstanca biorazgradljiva u određenoj meri. Neznatno ili nulta vrednost smanjenja DOC (HPK) može biti posledica inhibitornog delovanja ispitivane supstance na mikroorganizme, što se primećuje po zamućenju supernatanta. U tom slučaju ispitivanje treba ponoviti sa nižim koncentracijama ispitivane supstance.
Precizniji rezultati dobijaju se upotrebom najpodesnije analitičke metode. Kada se u ispitivanju koristi obeležavanje izotopom C14, obrazovanje C14O2 potvrđuje da je došlo do biorazgradnje ispitivane supstance.
Kad su rezultati prikazani u smislu primarne biorazgradnje, po mogućnosti, treba objasniti promenu hemijske strukture koja uzrokuje smanjenje količine polazne supstance.
Potvrda analitičke metode mora se prikazati zajedno sa odgovorom dobijenim sa slepom probom (samo medijum, bez aktivnog mulja).
1. OECD, Paris, 1981, Test Guideline 302 B, Decision of the Council C(81) 30 final.
2. Annex V C.9 Degradation: Chemical Oxygen Demand, Commission Directive 84/449/EEC, (OJ L 251,19.9.1984, p. 1).
Organsko jedinjenje: 4-etoksibenzoeva kiselina
Teorijska koncentracija: 600 mg/l
Teorijska DOC vrednost: 390 mg/l
Inokulum postrojenje za obradu otpadne vode iz domaćinstava
Koncentracija: 1 g/l suve materije
Adaptiranost: nije adaptiran
Ispitivanje: određivanje DOC vrednosti
Količina uzorka: 3 ml
Kontrolna supstanca: dietilenglikol
Toksičnost jedinjenja: Nema toksičnog efekta u koncentraciji ispod 1.000 mg/l
Primenjeno ispitivanje: test fermentacije
Trajanje | Kontrolna supstanca | Ispitivana supstanca | |||||
Slepa proba DOC | DOC (1) | DOC neto (mg/l) | Razgradnja | DOC (1) | DOC neto (mg/l) | Razgradnja | |
0 | - | - | 300,0 | - | - | 390,0 | - |
3 sata | 4,0 | 298,0 | 294,0 | 2 | 371,6 | 367,6 | 6 |
1 dan | 6,1 | 288,3 | 282,2 | 6 | 373,3 | 367,2 | 6 |
2 dana | 5,0 | 281,2 | 276,2 | 8 | 360,0 | 355,0 | 9 |
5 dana | 6,3 | 270,5 | 264,2 | 12 | 193,8 | 187,5 | 52 |
6 dana | 7,4 | 253,3 | 245,9 | 18 | 143,9 | 136,5 | 65 |
7 dana | 11,3 | 212,5 | 201,2 | 33 | 104,5 | 93,2 | 76 |
8 dana | 7,8 | 142,5 | 134,7 | 55 | 58,9 | 51,1 | 87 |
9 dana | 7,0 | 35,0 | 28,0 | 91 | 18,1 | 11,1 | 97 |
10 dana | 18,0 | 37,0 | 19,0 | 94 | 20,0 | 2,0 | 99 |
(1) Srednja vrednost od tri merenja | |||||||
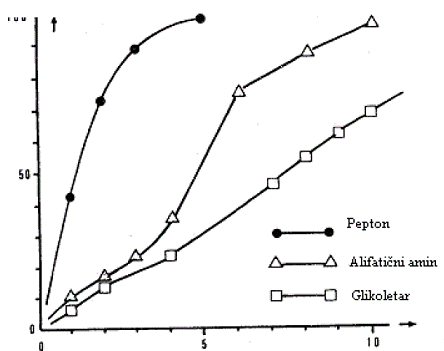
Slika 1: Primer krive biorazgradnje
Slika 2 Primer adaptacije aktivnog mulja
C.10. BIORAZGRADNJA - ISPITIVANJE SIMULACIJE AKTIVNOG MULJA
1.1.1. Opšte napomene
Metoda se primenjuje samo na organske supstance u koncentracijama koje se koriste u ispitivanju:
- rastvorljive u vodi za pripremu rastvora;
- imaju neznatan napon pare u uslovima definisanim ovom metodom;
- ne deluju inhibitorno na bakterije.
Podaci o procentualnom udelu glavnih sastojaka ispitivane supstance korisni su za tumačenje dobijenih rezultata, posebno u slučajevima gde su vrednosti dobijenih rezultata niske ili ekstremne.
Poželjno je imati podatke o toksičnosti ispitivane supstance za tumačenje niskih dobijenih vrednosti i prilikom izbora odgovarajućih koncentracija za potrebe ispitivanja.
1.1.2. Određivanje potpune biorazgradljivosti (DOC/HPK analiza)
Cilj metode je određivanje potpune biološke razgradljivosti što je određeno uklanjanjem ispitivane supstance i njenih metabolita iz sistema koji simulira postrojenje sa aktivnim muljem, pri koncentraciji koja odgovara vrednosti > 12 mg DOC/l (ili približno 40 mg HPK/l). Optimalnom vrednošću smatra se 20 mg DOC/l (DOC jeste koncentracija rastvorenog organskog ugljenika, HPK jeste hemijska potrošnja kiseonika).
Mora se utvrditi sadržaj organskog ugljenika (ili HPK) ispitivanog materijala.
1.1.3. Određivanje primarne biorazgradljivosti (specifična analiza)
Cilj ove metode je određivanje primarne biorazgradljivosti ispitivane supstance u sistemu koji simulira postrojenje sa aktivnim muljem, pri koncentraciji ispitivane supstance od približno 20 mg/l, pomoću specifične analitičke metode (niža ili viša koncentracija ispitivane supstance može se koristiti ukoliko je moguće primeniti izabranu analitičku metodu i ukoliko ispitivana supstanca u datim koncentracijama ne ispoljava toksično dejstvo). Ova analiza omogućava procenu primarne biorazgradljivosti ispitivane supstance (nestanak polazne hemijske supstance).
Cilj metode nije određivanje mineralizacije ispitivane supstance.
Mora biti dostupna odgovarajuća analitička metoda za odabranu ispitivanu supstancu.
1.2. DEFINICIJE I MERNE JEDINICE
1.2.1. DOC/HPK analiza
Stepen uklanjanja ispitivane supstance se izračunava formulom:
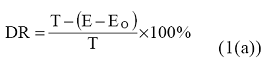
pri čemu:
DR jeste stepen uklanjanja ispitivane supstance izražen u procentima DOC (ili HPK) nakon unapred određenog retencionog perioda;
T jeste koncentracija ispitivane supstance u influentu izražena u mg DOC/l (ili u mg HPK/l);
E jeste koncentracija DOC (ili HPK) u efluentu izražena u mg DOC/l (ili u mg HPK/l);
Eo jeste koncentracija DOC (ili HPK) u efluentu u kontroli izražena u mg DOC/l (ili u mg HPK/l).
Razgradnja jeste procenat smanjenja DOC (ili HPK) ispitivane supstance nakon unapred određenog retencionog perioda
1.2.2. Specifična analiza
Procenat uklanjanja ispitivane supstance iz vodene faze (Rw) nakon unapred određenog vremena retencije izračunava se formulom:
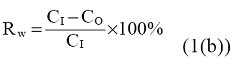
pri čemu:
CI jeste koncentracija ispitivane supstance u influentu sistema (izražena u mg/l, određeno specifičnom analizom);
Co jeste koncentracija ispitivane supstance u efluentu sistema (izražena u mg/l, određeno specifičnom analizom).
Referentne supstance za ovu metodu ispitivanja nisu određene.
1.4. PRINCIP METODE ISPITIVANJA
Za određivanje potpune biorazgradljivosti, uporedo se izvode dva ispitivanja u dva sistema (OECD potvrdno ispitivanje ili ispitivanje sa poroznim posudama). Ispitivana supstanca dodaje se influentu jednog sistema (sintetička otpadna voda ili komunalna otpadna voda), dok se u drugi sistem uvodi samo influent. Za određivanje primarne biorazgradnje specifičnom analizom u influentu i efluentu, koristi se samo jedan sistem.
DOC (ili HPK) koncentracije mere se u efluentu ili se koncentracija ispitivane supstance određuje specifičnim analizama.
DOC iz ispitivanog materijala se ne meri, već se samo navede.
Kad se određuju vrednosti DOC (ili HPK) smatra se da razlika između srednje vrednosti koncentracija u efluentu u kontroli i efluentu u tretmanu potiče od nerazgrađene ispitivane supstance.
Kad se izvode specifične analize, meri se promena u koncentraciji polazne supstance (primarna biorazgradljivost).
Sistemi mogu da se postave kao sistemi spojenih jedinica, uz proceduru transinokulacije.
Početna koncentracija ispitivane supstance zavisi od vrste primenjene analize i njenih ograničenja.
1.6.1. Priprema
1.6.1.1. Oprema
Potrebno je raspolagati sa par sistema istog tipa, osim kad se izvode specifične analize. Koriste se dva tipa sistema:
OECD potvrdno ispitivanje
Oprema (videti Deo drugi ove metode) se sastoji od spremnika (A) za sintetičke otpadne vode, pumpe za doziranje (B), aeratora (C), separatora (D), pumpe za recirkulaciju aktivnog mulja (E) i kolektora za tretirani efluent (F).
Posude (A) i (F) moraju biti od stakla ili pogodnog plastičnog materijala, zapremine najmanje 24 L. Pumpa za doziranje (B) mora da obezbedi stalan dotok sintetičkih otpadnih voda u aerator. Može se koristiti bilo koji pogodni sistem ako su obezbeđeni konstantan dotok i koncentracija. Tokom normalnog rada sistema otvor separatora (D) je pozicioniran tako da aerator može da primi zapreminu od 3 Lispitivane smeše. Perforirani difuzer vazduha (G) je postavljen u aerator (C) na sredini konusnog dna. Količina vazduha koja se uduvava u aerator prati se pomoću merača protoka.
Pumpa za recirkulaciju aktivnog mulja (E) postavljena je tako da se aktivni mulj iz separatora neprekidno recirkuliše u posudu za aeraciju (C).
"Porozna posuda"
Porozna posuda je napravljena od ploča poroznog polietilena (2 mm debljine, maksimalni promer pore je 95 µm), koje su oblikovane u cilindre prečnika 14 cm sa konusnom bazom pod uglom od 45° (Deo drugi Slike 1 i 2). Porozna posuda nalazi se u nepropusnoj posudi od odgovarajuće plastike, prečnika 15 cm, sa otvorom na visini od 17,2 cm na cilindričnom delu, koji određuje zapreminu (3 L) u loncu. Čvrsti potporni prsten, napravljen od odgovarajuće plastike, postavljen je oko vrha unutrašnje posude, tako da između unutarašnje i spoljašnje posude postoji prostor od 0,5 cm.
Porozna posuda se može postaviti u vodeno kupatilo. U osnovi unutrašnje posude su postavljeni difuzeri koji obezbeđuju dotok vazduha.
Posude (A) i (E) moraju biti od stakla ili odgovarajuće plastike, zapremine najmanje 24 L. Pumpa za recirkulaciju aktivnog mulja (B) mora da omogući stalni tok sintetičke otpadne vode u aerator. Može se koristiti bilo koji pogodan sistem ako su obezbeđeni stalan dotok i koncentracija.
Treba imati rezervne unutarašnje porozne posude ukoliko u toku rada sistema dođe do zapušenja. Zapušene posude potapaju se u rastvor hipohlorita, a zatim se temeljno isperu vodom iz česme.
1.6.1.2. Filtracija
Koristi se oprema za membransku filtraciju i membranski filteri promera 0,45 µm. Mora se voditi računa da se ugljenik ne oslobađa iz membranskih filtera i da se ispitivana supstanca ne adsorbuje u toku filtracije.
1.6.1.3. Otpadna voda
Koristiti se pogodna sintetička ili komunalna otpadna voda.
Primer sintetičke otpadne vode
U jednom litru vode iz česme rastvori se:
- 160 mg peptona,
- 10 mg mesnog ekstrakta,
- 30 mg uree,
- 7 mg NaCl,
- 4 mg CaCl2 • 2H2O,
- 2 mg MgSO4 • 7H2O i
- 28 mg K2HPO4.
Komunalna otpadna voda
Uzima se otpadna voda koja se preliva iz primarnog taložnika iz postrojenja koja dominantno prerađuju komunalne otpadne vode.
1.6.1.4. Osnovni rastvor ispitivane supstance
Osnovni rastvor ispitivane supstance, npr. 1%, priprema se pre izvođenja ispitivanja. Koncentracija ispitivane supstance mora biti definisana, kako bi se dodala odgovarajuća zapremina osnovnog rastvora u otpadnu vodu ili direktno u sistem.
1.6.1.5. Inokulum
Napomena: Kad se koristi komunalna otpadna voda, ne koristi se inokulum sa niskom koncentracijom bakterija, ali može da se koristi aktivni mulj.
Mogu se koristiti razni inokulumi. U ovoj metodi data su tri primera pogodnih inokuluma: inokulum iz sekundarnog efluenta, kompozitni i inokulum aktivnog mulja.
Inokulum iz sekundarnog efluenta
Inokulum se uzima iz sekundarnog efluenta zadovoljavajućeg kvaliteta prikupljenog iz postrojenja za obradu dominantno komunalnih otpadnih voda. Tokom perioda od uzimanja efluenta do njegove upotrebe, efluent mora da se čuva u aerobnim uslovima. Za pripremu inokuluma, uzorak efluenta se filtrira kroz grubi filter, a prvih 200 ml se baca. Filtrat se čuva u aerobnim uslovima do upotrebe. Inokulum se mora upotrebiti isti dan po uzimanju uzorka sekundarnog efluenta. Za inokulaciju se koristi najmanje 3 ml efluenta.
Kompozitni inokulum
Za pripremu kompozitnog inokuluma koriste se tri parcijalna inokuluma:
4) inokulum iz sekundarnog efluenta;
5) inokulum iz zemljišta:
- 100 g baštenskog zemljišta (plodnog, ne sterilnog)suspenduje se u 1.000 ml nehlorisane vode za piće. (Zemljište sa izuzetno velikim udelom gline, peska ili humusa nije pogodno.) Nakon mešanja, suspenzija se ostavi 30 minuta da se istaloži. Supernatant se filtrira kroz grubi filter papir, a prvih 200 ml se baca. Filtrat se aeriše odmah sve do upotrebe. Inokulum se mora upotrebiti isti dan po uzorkovanju;
6) inokulum iz površinske vode:
- deo za kompozitni inokulum uzima se iz mezo-saprobne površinske vode. Uzorci se filtriraju kroz grubi papir, a prvih 200 ml se baca. Filtrat se čuva u aerobnim uslovima sve do upotrebe. Inokulum se mora upotrebiti isti dan po uzorkovanju.
Kompozitni inokulum se uzima iz mešavine tri parcijalna inokuluma tako što se jednake zapremine sjedine i dobro promešaju. Za inokulaciju se upotrebljava najmanje 3 ml.
Inokulum aktivnog mulja
Uzima se najviše 3 L aktivnog mulja (sadržaj suspendovanih materija do 2,5 g/l) uzetog iz aeracionog bazena postrojenja za obradu dominantno komunalnih otpadnih voda.
1.6.2. Postupak
Ispitivanje se izvodi na sobnoj temperaturi, koja se mora održavati između 18 °C i 25 °C.
Ispitivanje se može izvesti i na nižim temperaturama (do 10 °C). Ako se supstanca razgrađuje, ne treba nastavljati ispitivanje. Ako se supstanca ne razgrađuje, ispitivanje se mora obaviti na stalnoj temperaturi između 18 °C i 25 °C.
1.6.2.1. Period stabilizacije: obrazovanje mulja/stabilizacija sistema
Period rasta/stabilizacije mulja je period u toku kojeg koncentracija suspendovanih materija aktivnog mulja kao i rad sistema dostiže stabilno stanje u uslovima definisanim ovom metodom.
Period stabilizacije jeste period koji traje od trenutka uvođenja ispitivane supstance u sistem do trenutka kad proces uklanjanja supstance dostigne plato, (relativno konstantnu vrednost). Ovaj period ne sme biti duži od šest sedmica.
Period evaluacije traje tri sedmice i to od trenutka kad uklanjanje ispitivane supstance dosegne relativno stalnu i najčešće visoku vrednost. Za one supstance koje se u prvih šest sedmica slabo ili uopšte biološki ne razgrade, za period evaluacije se uzimaju naredne tri sedmice.
Na početku se inokulum pomešan sa influentom uvodi u sisteme potrebne za jedno ispitivanje.
Zatim se uključuje aerator (u slučaju kad se koristi sistem OECD potvrdnog ispitivanja), a uključi se i pumpa za recirkulaciju (E) aktivnog mulja) i pumpa za doziranje (B).
Influent bez ispitivane supstance mora proći kroz aerator (C) brzinom 1 litar na sat ili 0,5 litara na sat, što omogućava retenciono vreme od 3 sata odnosno 6 sati.
Stepen aeracije treba namestiti tako da se onemogući taloženje sadržaja u posudi (C), dok sadržaj rastvorenog kiseonika mora da bude najmanje 2 mg/l.
Stvaranje pene mora se onemogućiti odgovarajućim sredstvima, ali samo ukoliko ne deluju ihibitorno na aktivni mulj.
Mulj koji se nakupi pri vrhu aeratora (C) (u slučaju sistema OECD potvrdnog ispitivanja pri dnu separatora (D) i u sistemu za recirkulaciju) mora se struganjem ili na neki drugi odgovarajući način vratiti u suspenziju najmanje jednom dnevno, svaki dan.
Ako se mulj ne taloži, može se povećati njegova gustina dodavanjem 2 ml 5% rastvora gvožđe-hlorida. Ovaj postupak se po potrebi ponavlja.
Efluent se prikuplja u posudi (E ili F) u toku 20 do 24 sata, a uzorak se uzima nakon temeljnog mešanja. Posuda (E ili F) mora se pažljivo očistiti.
Da bi se nadgledala i kontrolisala efikasnost postupka, mere se hemijska potrošnja kiseonika (HPK) ili rastvoreni organski ugljenik (DOC) u filtratu nakupljenog efluenta najmanje dva puta sedmično, kao i u filtratu influenta (koristeći membrane promera 0,45 µm, a prvih ≈ 20 ml filtrata se baca).
Kad se uspostavi približno ujednačena dnevna razgradnja, smanjenje DOC ili HPK treba da bude ujednačeno.
Sadržaj suve materije aktivnog mulja (g/l) u aeratoru određuje se dvaput sedmično. Sistemi mogu raditi na jedan od dva načina:
1) sadržaj suve materije u aktivnom mulju određuje se dvaput sedmično, pa ukoliko ga ima više od 2,5 g/l višak aktivnog mulja se odbacuje, ili
2) svakodnevno se ispušta 500 ml ispitivane smeše iz svake posude da se dobije srednje vreme retencije mulja od 6 dana.
Kada su izmereni i procenjeni parametri dva sistema dovoljno stabilni (efikasnost uklanjanja DOC ili HPK, mulj, koncentracija, taloženje mulja, zamućenost efluenta, itd.), ispitivana supstanca može se dodati influentu koji ulazi u jedan od sistema, kako je opisano u odeljku 1.6.2.2. ove metode.
Alternativno, ispitivana supstanca se može dodati na početku perioda rasta mulja (videti odeljak 1.6.2.1. ove metode), naročito kad se mulj dodaje kao inokulum.
1.6.2.2. Procedura ispitivanja
U periodu stabilizacije održavaju se konstantni uslovi rada sistema. Odgovarajuća količina rastvora ispitivane supstance (oko 1%) dodaje se u influent koji ulazi u sistem, tako da se dobije željena koncentracija ispitivane supstance (10 mg do 20 mg DOC/l ili 40 mg HPK/l) u influentu. To se može postići svakodnevnim mešanjem osnovnog rastvora ispitivane supstance sa influentom ili pomoću sekundarne pumpe. Željena koncentracija može se postići postepeno. Ukoliko ispitivana supstanca ne ispoljava toksično dejstvo na aktivni mulj, može se testirati i viša koncentracija.
U sistemu koji služi kao kontrola uvodi se samo influent bez ispitivane supstance. Odgovarajuće zapremine efluenta uzimaju se za analizu i filtriraju kroz membranske filtere (0,45 µm). Prvih (otprilike) 20 ml filtrata se baca.
Filtrirani uzorci moraju se analizirati istog dana; u suprotnom moraju se sačuvati pogodnom metodom, npr. korišćenjem 0,05 ml 1% rastvora žive-hlorida (HgCl2) na svakih 10 ml filtrata ili čuvanjem na temperaturi od 2 °C do 4 °C, najviše 24 sata ili na temperaturi nižoj od -18°C u toku dužeg vremena.
Period stabilizacije, uz dodatak ispitivane supstance, ne sme trajati duže od 6 sedmica i period evaluacije ne sme biti kraći od 3 sedmice, odnosno za izračunavanje konačnog rezultata treba imati oko 14 do 20 rezultata merenja.
Izvođenje sa spojenim sistemima
Spojeni sistemi rade tako da jednom dnevno između dva sistema dolazi do razmene 1,5 L ispitivane smeše (uključujući mulj) iz aeratora za aktivni mulj. U slučaju da ispitivana supstanca podleže adsorpciji, uzima se 1,5 L tečnog supernatanta iz taložnika jednog sistema i presipa u posude sa aktivnim muljem drugog sistema.
1.6.2.3. Analiza
U cilju praćenja osobina supstance vrše se dve vrste analiza: DOC i HPK.
Koncentracije DOC određuju se u dva ponavljanja pomoću analizatora ugljenika, odnosno vrednosti HPK prema literaturi2.
Specifična analiza
Koncentracije ispitivane supstance određuju se odgovarajućim analitičkim postupkom. Ukoliko je moguće, treba odrediti i količinu supstance koja se adsorbuje na aktivni mulj.
Kad se koriste spojeni sistemi, dnevni stepen uklanjanja (u daljem tekstu: DR) izračunava se na način opisan u odeljku 1.2.1. ove metode. DR se formulom (2) koriguje na DRc zbog prenosa ispitivane supstance na opisani način za srednje vreme retencije od 3 sata ili formulom (3) za srednje vreme retencije od 6 sati.
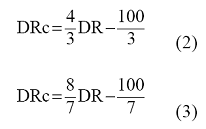
Izračunava se srednja vrednost i standardne devijacije za seriju vrednosti DRc prema jednačini (4):
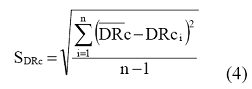
pri čemu:
![]() jeste standardna defijacija za niz DRc vrednosti;
jeste standardna defijacija za niz DRc vrednosti;
c = srednja vrednost DRc;
n jeste broj određivanja.
Ekstremne vrednosti u nizu vrednosti DRc odbacuju se odgovarajućim statističkim postupkom, npr. Nalimovim postupkom6, uz nivo verovatnoće od 95%, pa se srednja vrednost i standardna devijacija ponovo izračunavaju za skup podataka DRc bez ekstremnih vrednosti.
Konačan rezultat izračunava se prema jednačini (5):
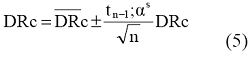
pri čemu:
tn-1;α jeste tabelarna vrednost t za n vrednost parova E i Eo i statistička pouzdanost P (P = 1- α) i time je P na 95%1.
Rezultat se izražava kao srednja vrednost sa 95% intervalima poverenja, standardnim devijacijama i brojem podataka u skupu podataka DRc bez ekstremnih vrednosti, te brojem ekstremnih podataka, npr:
DRc = 98,6 ± 2,3% uklonjenog DOC;
c jeste 4,65% uklonjenog DOC;
n jeste 18;
x jeste broj ekstremnih vrednosti.
Rad sistema se može proveriti pomoću sledećeg izraza:
procenat uklanjanja COD ili DOC = | COD ili DOC influenta - COD ili DOC efluenta | x 100 |
COD ili DOC influenta |
Ove vrednosti za dnevno uklanjanje DOC ili HPK mogu se prikazati grafički da bi se uočilo postojanje nekog trenda, npr. aklimatizacije.
2.2.1. Određivanje HPK/DOC
Kako se izračunava DR dato je u odeljku 1.2.1.
Izračuna se srednja vrednost za serije vrednosti DR. Uz to se računa i standardna devijacija prema sledećem izrazu:
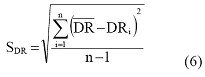
gde su:
| = standardna devijacija serije DRc vrednosti; | |
= srednja vrednost DRc vrednosti; |
n = broj određivanja.
Ekstremne vrednosti u nizu vrednosti DRc se odbacuju odgovarajućim statističkim postupkom, npr. Nalimovim postupkom6, uz nivo verovatnoće od 95%, pa se srednja vrednost i standardna devijacija ponovo izračunavaju za skup podataka DRc bez ekstremnih vrednosti.
Konačan rezultat se zatim izračuna prema formuli (7) kao:
gde su:
tn-1;α - tabelarna vrednost t za n vrednost parova E i Eo i statistička pouzdanost P (P = 1- α) čime je P postavljen na 95%1.
Rezultat se izražava kao srednja vrednost sa 95% intervalima poverenja, standardnim devijacijama i brojem podataka u skupu DR bez ekstremnih vrednosti, te brojem ekstremnih vrednosti, npr:
DR = (98,6 ± 2,3)% uklonjenog DOC;
c = (4,65)% uklonjenog DOC;
n = 18;
x = broj odstupajućih vrednosti.
2.2.2. Primena specifične analize
Kako se izračunava procenat uklanjanja ispitivane supstance iz vodene faze (Rw) dato je u odeljku 1.2.2.
Izveštaj, po mogućnosti, treba da sadrži sledeće:
- obrazac dat u Delu 3, sa opisanim uslovima u ispitivanju;
- odabrani sistem (OECD potvrdno ispitivanje ili "porozna posuda");
- odabrani način rada, spojeni sistem ili neki drugi;
- vrstu otpadnih voda: sintetičke ili komunalne otpadne vode (u slučaju komunalne otpadne vode navesti datum i mesto uzorkovanja);
- vrstu inokuluma, sa datumom i mestom uzorkovanja;
- opis primenjenog analitičkog postupka, ukoliko su se obavljale specifične analize;
- grafički prikaz vrednosti uklanjanja HPK ili DOC u funkciji vremena, uključujući period stabilizacije i period evaluacije;
- efikasnost analitičke metode za određivanja sadržaja ispitivane supstance preko vrednosti HPK ili DOC za osnovni rastvor ispitivane supstance;
- ukoliko su rađene specifične analize, grafički prikaz vrednosti procenta uklanjanja ispitivane supstance iz vodene faze u funkciji vremena (period stabilizacije i period evaluacije);
- srednja vrednost i standardna devijacija uklanjanja DOC ili HPK ispitivane supstance izračunavaju se iz podataka za period evaluacije, odnosno kad postoji ravnomerno uklanjanje ispitivane supstance ili period ustaljenog rada jedinica sistema;
- grafički prikaz koncentracije aktivnog mulja u funkciji vremena;
- sve napomene u vezi sa aktivnim muljem (odbacivanje suviška mulja, pojave agregacije, FeCl3 itd);
- koncentracije ispitivane supstance korišćene u ispitivanju;
- svi rezultati u vezi sa aktivnim muljem;
- svi podaci i rezultati ispitivanja u vezi sa ispitivanom i referentnim supstancama, ako su korišćene;
- naučno opravdani razlozi za eventualne izmene postupka ispitivanja.
Nizak stepen uklanjanja ispitivane supstance iz vodene faze može biti posledica inhibitornog delovanje ispitivane supstance na mikroorganizame aktivnog mulja. Ovo se, takođe, može dokazati opažanjem lize ćelija mikroorganizama i gubitka mulja, što daje zamućeni supernatant, kao i smanjenja efikasnosti rada postrojenja u uklanjanju HPK (ili DOC).
Ponekad može imati uticaja fizičko-hemijska adsorpcija. Razlike između biološkog delovanja na molekul i fizičko-hemijske adsorpcije se mogu otkriti analizom mulja nakon odgovarajuće desorpcije.
Dodatna ispitivanja su potrebna ukoliko se žele razlučiti procesi biološke razgradnje (ili delimične biološke razgradnje) od adsorpcije.
To se može uraditi na nekoliko načina, ali najbolje je koristiti supernatant za inokulum u bazičnom ispitivanju (najbolje respirometrijsko ispitivanje).
Ako se primeti visok stepen uklanjanja DOC ili HPK, onda je to posledica biorazgradnje. Pri nižem stepenu uklanjanja, proces biorazgradnje ne može se razlikovati od procesa eliminacije. Na primer, ako jedinjenje rastvorljivo u vodi pokazuje visok stepen adsorpcije od 98%, a dnevna stopa potrošnje mulja veća je za 10%, moguća je eliminacija do 40%; pri višku stope potrošnje mulja od 30%, eliminacija zbog adsorpcije na suvišak mulja i uklanjanja zajedno sa tim suviškom mulja može narasti i na 65%4.
Kad se izvode specifične analize, treba obratiti pažnju na odnos strukture supstance i vrste analiza koje se rade. U ovom slučaju, uočeni fenomen ne može se protumačiti kao mineralizacija supstance.
1. OECD, Paris, 1981, Test Guideline 303 A, Decision of the Council C(81) 30 final.
2. Annex V C9 Degradation Test - Chemical Oxygen Demand, Commission Directive 84/449/EEC, (OJ L251, 19.9.1984, p. 1).31.5.2008 EN Official Journal of the European Union L 142/553
3. Painter, H. A., King, E. F., WRC Porous-Pot method for assessing biodegradability, Technical Report TR70, June 1978, Water Research Centre, United Kingdom.
4. Wierich, P., Gerike, P., The fate of soluble, recalcitrant, and adsorbing Compounds in activated sludgeplants, Ecotoxicology and Environmental Safety, vol. 5, No 2, June 1981, p. 161-171.
5. Council Directives 82/242/EEC and 82/243/EEC, (OJ, No L 109, 22.4.1982, p. 1), amending Council Directives 73/404/EEC and 73/405/EEC on biodegradability of detergents, (OJ L 347, 17.12.1973, p.51).
6. Streuli, H., Fehlerhafte Interpretation und Anwendung von Ausreßertests, insbesondere bei Ringversuchenzur Oberprüfung analytisch-chemischer Untersuchungsmethoden, Fresenius-Zeitschrift fürAnalytische Chemie, 303 (1980), p. 406-408
A - spremnik
B - pumpa za doziranje
C - aerator
D - taložnik
E - pumpa za recirkulaciju mulja
F - kolektor
G - difuzer vazduha
H - merač protoka vazduha
Slika 1. Oprema koja se koristi za procenu biorazgradljivosti
A - spremnik B - pumpa za doziranje C - porozna posuda za aeraciju D - spoljni nepropustljivi ventil E - kolektor F - difuzer vazduha H - rotometar (opciono) |
Slika 2. Shema trolitarske porozne posude za aeraciju
|
| obruč |
| |
| unutrašnji dijametar | spoj |
| |
| spoljašnja | unutrašnja |
|
USLOVI U ISPITIVANJU SIMULACIJE AKTIVNOG MULJA
Upisati svaku grupu |
|
Oprema - vrsta sistema |
|
OECD potvrdno ispitivanje |
|
" porozna posuda" |
|
Način izvođenja ispitivanja |
|
pojedinačni |
|
spojeni sistemi |
|
ne-spojeni sistemi |
|
Transinokulacija |
|
ne |
|
aktivni mulj |
|
supernatant |
|
Srednje retenciono vreme |
|
3 sata |
|
6 sati |
|
Otpadna voda |
|
komunalna otpadna voda |
|
sintetička otpadna voda |
|
Inokulum |
|
sekundarni efluent |
|
kompozit |
|
aktivni mulj |
|
Uvođenje ispitivane supstance |
|
na početku ispitivanja |
|
postepeno uvođenje |
|
nakon stabilizacije aktivnog mulja |
|
Analize |
|
specifične analize |
|
određivanje HPK |
|
Određivanje DOC |
|
C.11. BIORAZGRADNJA - ISPITIVANJE INHIBICIJE RESPIRACIJE AKTIVNOG MULJA
Ovom metodom procenjuje se efekat ispitivane supstance (pri različitim koncentracijama) na mikroorganizme merenjem brzine respiracije u unapred definisanim uslovima.
Cilj metode je da se omogući brz skrining test kojim se identifikuju supstance koje mogu da imaju negativan uticaj na postrojenja za aerobno mikrobiološko prečišćavanje otpadnih voda i da se predlože smernice za izbor koncentracija ispitivane supstance za potrebe ispitivanja biorazgradljivosti.
Preliminarna studija može da se radi pre definitivnog ispitivanja. Ova studija daje podatke o opsegu koncentracija koje se koriste u definitivnom ispitivanju.
U postupak ispitivanja uključene su dve kontrole bez ispitivane supstance: jedna koja se postavlja na početku i druga na kraju, tj. nakon postavke svih serija koncentracija ispitivane supstance. Svaka kultura aktivnog mulja treba da se proveri ispitivanjem sa referentnom supstancom.
Metoda se najlakše primenjuje na supstance koje, zbog svoje rastvorljivosti u vodi i niske isparljivosti, obrazuju stabilne vodene rastvore.
Za supstance koje su slabo rastvorljive u medijumu koji se koristi za potrebe ovog ispitivanja nije uvek moguće odrediti vrednost EC50.
Rezultati koji se zasnivaju na potrošnji kiseonika mogu dovesti do pogrešnih zaključaka u slučaju kad ispitivana supstanca može da zaustavi oksidativnu fosforilaciju.
Za izvođenje ispitivanja poželjno je imati sledeće podatke o ispitivanoj supstanci:
- rastvorljivost u vodi;
- napon pare;
- strukturna formula;
- stepen čistoće ispitivane supstance.
Preporuka: Aktivni mulj može da sadrži potencijalno patogene organizme, pa je pri radu sa aktivnim muljem potreban oprez.
1.2. DEFINICIJE I MERNE JEDINICE
Brzina respiracije jeste potrošnja kiseonika mikroorganizama aktivnog mulja, koja se izražava kao mg O2 po mg mulja po satu.
Za izračunavanje inhibitornog efekta ispitivane supstance pri određenoj koncentraciji, brzina respiracije izražava se kao procenat srednje vrednosti brzine respiracije u dve kontrole:
inhibicija |
pri čemu:
Rc jeste brzina potrošnje kiseonika pri datoj koncentraciji ispitivane supstance;
Rc1 jeste brzina potrošnje kiseonika u kontroli 1;
Rc2 jeste brzina potrošnje kiseonika u kontroli 2.
U ovoj metodi EC50 jeste koncentracija ispitivane supstance pri kojoj brzina respiracije iznosi 50% u odnosu na brzine respiracije u kontroli pod uslovima definisanim za ovu metodu.
Kao referentna supstanca preporučuje se 3,5-dihlorofenol, supstanca koja je poznata kao inhibitor respiracije. Za proveru osetljivosti treba odrediti EC50 vrednost za ovu supstancu za svaku kulturu aktivnog mulja.
Brzina respiracije aktivnog mulja pomešanog sa standardnom količinom sintetičke otpadne vode meri se nakon kontakta od 30 minuta, tri sata ili u oba vremena. Brzina respiracije istog aktivnog mulja meri se nakon izlaganja različitim koncentracijama ispitivane supstance u identičnim uslovima. Inhibitorni efekat ispitivane supstance pri određenoj koncentraciji izražava se kao procenat srednje vrednosti brzine respiracije u odnosu na dve kontrole. Vrednost EC50 izračunava se iz rezultata za seriju koncentracija ispitivane supstance.
Rezultati ispitivanja su validni ako:
- vrednosti brzine respiracije u kontroli se razlikuju manje od 15%;
- EC50 (30 minuta, odnosno 3 sata) za 3,5-dihlorofenol se nalazi unutar prihvaćenog opsega od 5 do 30 mg/l.
1.6.1. Reagensi
1.6.1.1. Ispitivani rastvori
Na početku ispitivanja pripreme se sveži rastvori ispitivane supstance iz osnovnog rastvora. Osnovni rastvor ispitivane supstance od 0,5 g/l je odgovarajući ukoliko se ispitivanja izvode prema uputstvima datim u ovoj metodi.
1.6.1.2. Rastvor referente supstance
Rastvor 3,5-dihlorofenola može se pripremiti, tako što se, npr. rastvori 0,5 g 3,5-dihlorofenola u 10 ml 1M NaOH, dopuni do otprilike 30 ml sa destilovanom vodom, doda uz mešanje 0,5M H2SO4 sve dok se dođe do precipitacije - potrebno oko 8 ml 0,5M H2SO4 - i na kraju dopuni do jednog L sa destilovanom vodom. Vrednost pH treba da bude između 7 i 8.
1.6.1.3. Sintetičke otpadne vode
Sintetička otpadna voda se priprema rastvaranjem sledećih količina supstanci u 1 L vode:
- 16 g peptona;
- 11 g mesnog ekstrakta;
- 3 g uree;
- 0,7 g NaCl;
- 0,4 g CaCl2x2H2O;
- 0,2 g MgSO4x7H2O;
- 2,8 g K2HPO4.
Napomena 1: Ova sintetička otpadna voda je 100 puta koncentrovanija od otpadne vode opisane u literaturi9, uz dodatak dikalijum hidrogen fosfata.
Napomena 2: Ako se pripremljeni medijum ne koristi odmah, mora se čuvati u mraku na na temperaturi od 0 °C do 4 °C, ne duže od jedne sedmice u uslovima koji obezbeđuju njegovu stabilnost. Medijum se pre skladištenja može i sterilizovati, ili se pepton i mesni ekstrakt mogu dodati neposredno pre izvođenja ispitivanja. Pre upotrebe, medijum se mora temeljno promešati i prilagoditi vrednost pH.
1.6.2. Oprema
Aparatura za merenje: precizna postavka ispitivanja nije od presudne važnosti. Treba da postoji dovoljan slobodan prostor pri vrhu posude (headspace) i sonda treba čvrsto da prijanja uz vrat posude za merenje.
Potrebna je uobičajena laboratorijska oprema, a pogotovo:
- aparatura za merenje;
- aerator;
- pH-elektroda i oprema za merenje;
- O2-elektroda.
1.6.3. Priprema inokuluma
Aktivni mulj iz postrojenja za obradu dominantno komunalnih otpadnih voda koristi se kao mikrobiološki inokulum za potrebe ovog ispitivanja.
Ukoliko je potrebno, po povratku u laboratoriju, grube čestice se mogu ukloniti kratkotrajnim taloženjem, npr. 15 minuta, a zatim se dekantuje gornji sloj sa sitnijim česticama i koristi se za potrebe ispitivanja. Mulj se može promešati mikserom u trajanju od nekoliko sekundi.
Postoji sumnja da je prisutan materijal koji deluje inhibitorno, te se aktivni mulj mora isprati vodom iz česme ili izotoničnim rastvorom. Nakon centrifugiranja, supernatant se dekantuje (ovaj postupak se ponavlja tri puta).
Mala količina mulja se izmeri i osuši. Iz ovog rezultata može se izračunati količina vlažnog mulja koji mora biti suspendovan u vodi da bi se dobio aktivni mulj sa koncentracijom čvrstih suspendovanih materija u opsegu od 2 g/l do 4 g/l. Ovaj nivo odgovara koncentraciji između 0,8 g/l i 1,6 g/l u medijumu ukoliko se ispitivanje izvodi prema smernicama.
Ako se mulj ne može upotrebiti istog dana, dodaje se 50 ml sintetičke otpadne vode u svaki litar aktivnog mulja pripremljenog na prethodno opisan način. Zatim se aktivni mulj aeriše preko noći na temperaturi od (20 ± 2)°C i aeriše se sve do ispitivanja. Pre izvođenja ispitivanja, mora se proveriti pH vrednost i ukoliko je potrebno, podesiti na 6 do 8 pH jedinica. Koncentracija suspendovanih čvrstih čestica u tečnoj smeši određuje se na način opisan u prethodnom paragrafu.
Ukoliko se koristi ista kultura aktivnog mulja za ispitivanja narednih dana (maksimalno četiri dana), mora se dodati na 50 ml sintetičke otpadne vode po litru aktivnog mulja na kraju dana.
1.6.4. Izvođenje ispitivanja
Trajanje/kontaktno vreme: 30 minuta, odnosno 3 sata (neprekidna aeracija)
Voda: voda za piće (dehlorisana po potrebi)
Snabdevanje vazduhom: čist vazduh bez masnoća, dotok 0,5 L/min do 1 L/min
Aparatura za merenje: boce sa ravnim dnom, poput boca za određivanje BPK
Oksimetar: odgovarajuća elektroda za kiseonik, sa pisačem
Rastvor nutrijenata: sintetička otpadna voda
Ispitivana supstanca: sveže pripremljen rastvor supstance na početku ispitivanja
Referentna supstanca: npr. 3,5-dihlorofenol (ispituju se najmanje tri koncentracije)
Kontrole: inokuliran uzorak bez ispitivane supstance
Temperatura: 20 °C ± 2 °C
Za ispitivanje supstance i referentne supstance, u trajanju od 3 sata, predlaže se sledeći postupak:
- koristi se nekoliko posuda (npr. jednolitarske posude);
- ispituje se najmanje pet koncentracija ispitivane supstance, u geometrijskoj seriji sa faktorom povećanja 3,2;
- u nultom vremenu (t0) 16 ml sintetičke otpadne vode rastvori se sa vodom do 300 ml, doda se 200 ml mikrobiološkog inokuluma i dobijena smeša (500 ml) se presipa u prvu posudu (prva kontrola, K1);
- posude se neprekidno aerišu da bi se obezbedila koncentracija rastvorenog kiseonika iznad 2,5 mg/l i da bi neposredno pre merenja brzine respiracije, koncentracija rastvorenog kiseonika bila 6,5 mg/l;
- u vremenu t15 (15 minuta je arbitrarni, ali pogodan interval) ponovi se opisani postupak, s tim da se u 16 ml sintetičke otpadne vode doda 100 ml osnovnog rastvora ispitivane supstance, dopuni sa vodom do 300 ml i potom doda mikrobiološki inokulum do konačne zapremine od 500 ml. Dobijena smeša se presipa u drugu posudu i aeriše na isti način. Postupak se ponavlja svakih 15 minuta sa različitim zapreminama osnovnog rastvora ispitivane supstance, kako bi se dobio set posuda koje sadrže različite koncentracije ispitivane supstance. Na kraju se priprema druga kontrola (K2);
- nakon tri sata beleži se pH vrednost, a dobro promešani sadržaj iz prve posude presipa se u uređaj za merenje brzine respiracije u toku najviše 10 minuta;
- merenje se ponavlja sa sadržajem svake posude u intervalima od 15 minuta, kako bi vreme kontakta u svakoj posudi iznosilo 3 sata;
- referentna supstanca se na isti način ispituje na svakoj šarži mikrobiološkog inokuluma;
- primenjuje se drugačiji režim (npr. više od jednog oksimetra) u slučaju da se merenja vrše nakon 30 minuta;
- ako se meri hemijska potrošnja kiseonika, neophodno je pripremiti dodatne posude koje sadrže ispitivanu supstancu, sintetičke otpadne vode i običnu vodu, ali ne i aktivni mulj. Potrošnja kiseonika meri se i beleži nakon aeracije, tj. kontaktnog vremena.
Brzina respiracije izračunava se sa krive između otprilike 6,5 mg/l O2 i 2,5 mg/l O2 ili u toku desetominutnog perioda kad je brzina respiracije niska. Deo krive respiracije iz koje se meri brzina respiracije treba da bude linearan.
Ako se vrednosti brzina respiracije u dve kontrole razlikuju za više od 15% ili EC50 (30 minuta, odnosno tri sata) za referentnu supstancu nije u okviru prihvaćenog opsega (5 mg/l do 30 mg/l za 3,5-dihlorofenol), ispitivanje nije validno i mora se ponoviti.
Procenat inhibicije izračunava se za svaku koncentraciju ispitivane supstance (videti odeljak 1.2. ove metode). Vrednosti procenta inhibicije za svaku koncentraciju ispitivane supstance predstavljaju se grafički u funkciji koncentracija na logaritamaskom (ili log-probit) papiru i očitava se EC50 vrednost.
Intervali poverenja od 95% za EC50 vrednosti mogu se odrediti pomoću standardnih postupaka.
Izveštaj o ispitivanju treba da sadrži sledeće podatke:
1) Ispitivana supstanca:
- podaci o hemijskoj identifikaciji;
2) Sistem:
- izvor;
- koncentracija;
- predobrada aktivnog mulja (ako je rađena);
3) Uslovi ispitivanja:
- pH smeše pre merenja respiracije;
- temperatura;
- trajanje ispitivanja;
- referentna supstanca i izračunata vrednost EC50;
- abiotička potrošnja kiseonika (ukoliko postoji);
4) Rezultati:
- svi rezultati merenja;
- kriva inhibicije i postupak za izračunavanje EC50;
- EC50 i po mogućnosti 95% intervali poverenja, EC20 i EC80;
- sva opažanja i moguća odstupanja od ove metode ispitivanja koja mogu da utiču na rezultat.
EC50 vrednost se smatra samo pokazateljem potencijalnog negativnog delovanja ispitivane supstance na proces obrade otpadne vode aktivnim muljem ili na mikroorganizme iz otpadne vode, s obzirom na to da se složene interakcije koje se događaju u životnoj sredini ne mogu verno simulirati u laboratorijskim uslovima. Rezultati ispitivanja sa supstancom koja može imati inhibitorni efekat na proces oksidacije amonijaka mogu dati atipične krive inhibicije. Stoga se ovi rezultati i ovakve krive moraju tumačiti sa oprezom.
1. International Standard ISO 8192-1986.
2. Broecker, B., Zahn, R., Water Research 11,1977, p. 165.
3. Brown, D., Hitz, H. R., Schaefer, L., Chemosphere 10, 1981, p. 245.
4. ETAD (ECOlogical and Tox.icological Association of Dyestuffs Manufacturing Industries), Recommended Method No 103, also described by:
5. Robra, B., Wasserl Abwasser 117, 1976, p. 80.
6. Schefer, W., Textilveredlung 6,1977, p. 247.
7. OECD, Paris, 1981, Test Guideline 209, Decision of the Council C(84) 30 final.
8. OECD, June 11, 1976, Technical Report, ‘Proposed method for the determination of the biodegradability of surfactants used in synthetic detergents’.