
C.12. BIORAZGRADNJA - MODIFIKOVANA SCAS METODA ISPITIVANJA
Cilj ove metode je procena mogućnosti potpune biorazgradljivosti neisparljivih, organskih materija dobro rastvorljivih u vodi, ako su izložene relativno visokim koncentracijama mikroorganizama u toku dužeg vremenskog perioda. Životna aktivnost mikroorganizama održava se u toku tog perioda svakodnevnim dodavanjem taloga komunalne otpadne vode za prehranu. (Tokom vikenda, otpadna voda može se čuvati na temperaturi od 4°C. Može se koristiti i sintetička otpadna voda OECD potvrdnog ispitivanja.)
Prilikom tumačenja rezultata mora se uzeti u obzir mogućnost fizičko-hemijske adsorpcije na suspendovane materije. (videti odeljak 3.2. ove metode).
Zbog dugog vremena zadržavanja tečne faze (36 sati) i diskontinualnog dodavanja nutrijenata, metoda ne simulira uslove kakvi postoje u postrojenju za prečišćavanje otpadnih voda. Rezultati ispitivanja sa različitim supstancama pokazuju da ova metoda ima veliki potencijal biorazgradljivosti.
Uslovi u ovom ispitivanju izrazito su povoljni za izbor, odnosno adaptaciju mikroorganizama sposobnih da razgrade ispitivano jedinjenje. (Postupak se može koristiti i za proizvodnju aklimatizovanih inokuluma za korišćenje u drugim ispitivanjima.)
Pomoću ove metode, potpuna biorazgradljivost ispitivanih supstanci procenjuje se na osnovu izmerene koncentracije rastvorenog organskog ugljenika. DOC je bolje odrediti nakon zakiseljavanja i čišćenja nego ga izračunati kao razliku Cukupni - Canorganski.
Istovremeno korišćenje specifičnog analitičkog postupka može da omogući procenu primarne biorazgradljivosti supstanci (nestanak početne hemijske strukture).
Postupak se može primeniti samo na organske supstance koje su, u koncentraciji primenjenoj u ispitivanju:
- rastvorljive u vodi (najmanje 20 mg/lDOC);
- imaju zanemarljiv napon para;
- nemaju inhibitorni efekat na bakterije;
- ne adsorbuju se u značajnoj meri unutar test sistema;
- ne gube se stvaranjem pene iz test rastvora.
Mora se utvrditi sadržaj organskog ugljenika u ispitivanom materijalu.
Podaci o relativnom udelu glavnih sastojaka ispitivanog materijala korisni su pri tumačenju dobijenih rezultata, posebno u slučajevima kad su dobijene vrednosti niske ili granične.
Podaci o toksičnosti supstanci za mikroorganizme mogu biti korisni u tumačenju niskih vrednost i izboru odgovarajuće ispitivane koncentracije.
1.2. DEFINICIJE I JEDINICE MERE
CT jeste koncentracija ispitivane supstance izražena kao organski ugljenik prisutan u ili dodat talogu otpadne vode na početku perioda aeracije (mg/l).
Ct jeste koncentracija rastvorenog organskog ugljenika u tečnom supernatantu iz ispitivane grupe na kraju perioda aeracije (mg/l).
Cc jeste koncentracija rastvorenog organskog ugljenika u tečnom supernatantu iz kontrole na kraju perioda aeracije (mg/l).
U ovoj metodi biorazgradljivost jeste nestanak organskog ugljenika. Biorazgradljivost se može izraziti kao:
Procenat razgradnje one količine supstance koja se svakodnevno dodaje - Dda (degradation/daily addition) računa se prema formuli:

Procenat razgradnje one količine supstance koja je prisutna na početku svakog dana - Dssd (degradation/substance start of day) računa se prema formuli:

Pokazatelji i i (i + 1) odnose se na dan merenja.
Jednačina 2(a) preporučuje se ako DOC u izlaznoj vodi (efluentu) varira svakodnevno, dok se jednačina 2(b) može koristiti kad DOC izlazne vode ima relativno stalne vrednosti.
Referentne supstance mogu biti od koristi kada se ispituje nova supstanca. Za ovu metodu nije preporučena neka određena referentna supstanca.
Podaci o nekoliko jedinjenja procenjenih u međulaboratorijskom ispitivanju (ringtest) ponuđeni su (videti Deo drugi ove metode) u cilju povremene kalibracije postupka i da se omogući poređenje rezultata dobijenih nekim drugim postupkom.
1.4. NAČELO METODE ISPITIVANJA
Aktivni mulj iz postrojenja za obradu otpadnih voda stavlja se u jedinicu za polukontinualnu obradu aktivnog mulja (u daljem tekstu: SCAS). Dodaju se ispitivana supstanca i talog komunalne otpadne vode. Ova mešavina se aeriše u toku 23 sata. Aeracija se nakon toga prekida, mešavina se ostavlja da se istaloži mulj, a tečni suprenatant se ukloni.
Preostali talog se meša sa narednom količinom ispitivanog jedinjenja i otpadne vode u aeracionoj komori i postupak se ponavlja na isti način.
Biorazgradljivost se utvrđuje određivanjem količine rastvorenog organskog ugljenika u tečnom supernatantu. Ova vrednost se poredi sa vrednošću izmerenom u tečnoj fazi iz kontrole, u koju je dodat samo talog otpadne vode.
Kada se koristi specifični analitički postupak, mogu se meriti promene u koncentraciji izvornog molekula izazvane biorazgradnjom (primarna biorazgradnja).
Ponovljivost metode koja se bazira na uklanjanju rastvorenog organskog ugljenika nije utvrđena (kad se uzme u obzir primarna biorazgradljivost, dobiju se precizni podaci za materijale koji se dobro razgrađuju).
Osetljivost postupka zavisi od varijabilnosti slepe probe i u manjoj meri od preciznosti određivanja rastvorenog organskog ugljenika i koncentraciji test jedinjenja u tečnoj fazi na početku svakog ciklusa.
1.6.1. Priprema
Potreban je dovoljan broj čistih jedinica za aeraciju, alternativno se može koristiti originalna SCAS test jedinica zapremine 1,5 L i cevi za dovod vazduha (Slika 1) za svaku test supstancu i kontrole. Komprimovani vazduh pročišćen kroz vatu koji se dovodi u test jedinice ne sme da sadrži organski ugljenik i treba prethodno da bude zasićen vodom da se smanje gubici isparavanjem.
Uzorak tečne mešavine, koja sadrži od 1 g do 4 g suspendovanih materija po litru, dobija se iz postrojenja za obradu aktivnog mulja koje obrađuje pretežno komunalnu otpadnu vodu. Za svaku aeracionu jedinicu potrebno je oko 150 mg tečne mešavine.
Osnovni rastvori ispitivane supstance pripremaju se u destilovanoj vodi. Najčešće je potrebna koncentracija od 400 mg/l kao organski ugljenik, što daje koncentraciju ispitivane supstance od 20 mg/l ugljenika na početku svakog ciklusa aeracije, ako ne dolazi do biološke razgradnje.
Mogu se koristiti i više koncentracije ako ne uzrokuju toksičan efekat na mikroorganizme.
U osnovnom rastvoru meri se sadržaj organskog ugljenika.
1.6.2. Uslovi ispitivanja
Ispitivanje se izvodi na temperaturi od 20 °C do 25 °C.
Koristi se visoka koncentracija aerobnih mikroorganizama (najviše 1 g/l do 4 g/l suspendovanih materija), a delotvoran period zadržavanja je 36 sati. Materijal koji sadrži ugljenik u najvećoj meri se oksiduje u hranljivoj podlozi od otpadnih voda, obično unutar osam sati nakon početka svakog ciklusa aeracije. Nakon toga, mulj diše endogeno za vreme preostalog perioda aeracije, u toku kojeg je ispitivano jedinjenje jedini raspoloživi supstrat, osim u slučaju da se i ono brzo razgrađuje. Ove osobine, u kombinaciji sa dnevnom reinokulacijom kad se kao podloga koristi komunalna otpadna voda, obezbeđuju povoljne uslove za aklimatizaciju i za visoki stepen biološke razgradnje.
1.6.3. Postupak
Uzima se uzorak tečne mešavine iz uređaja laboratorijskog tipa ili pogodnog postrojenja za obradu aktivnog mulja iz pretežno komunalne otpadne vode i čuva u aerobnim uslovima do korišćenja u laboratoriji. Svaka aeraciona jedinica kao i kontrolna jedinica pune se sa po 150 mg tečne mešavine (ako se koristi originalna SCAS test jedinica, ta se zapremina množi sa 10) i započinje se sa aeracijom. Nakon 23 sata, aeracija se prekida i mulj se ostavlja 45 minuta da se istaloži. Naizmenično se otvaraju slavine svake posude i izvlači se po 100 mg tečnog supernatanta. Uzorak istaložene komunalne otpadne vode uzima se neposredno pre upotrebe, a 100 mg se dodaje mulju koji je preostao u svakoj aeracionoj jedinici. Ponovo se započinje sa aeracijom. U ovoj fazi ne dodaje se ispitivani materijal, a u jedinice se svakodnevno dodaje komunalna otpadna voda sve dok se nakon taloženja ne dobije supernatant u obliku bistre tečnosti. Za to je obično potrebno dve nedelje, a do kraja tog perioda rastvoreni organski ugljenik u tečnom supernatantu na kraju svakog aeracionog ciklusa približava se konstantnoj vrednosti.
Na kraju ovog perioda, pojedini istaloženi muljevi se pomešaju i u svaku jedinicu se doda po 50 mg ovako pripremljenog kompozita.
U kontrolne jedinice dodaje se po 95 mg istaložene otpadne vode i 5 mg vode, a u ispitivane jedinice 95 mg istaložene otpadne vode i 5 mg odgovarajućeg osnovnog rastvora ispitivanog jedinjenja (400 mg/l). Ponovo se započinje sa aeracijom koja traje 23 sata. Mulj se zatim ostavi 45 minuta da se slegne, izvuče se supernatant i analizira se sadržaj rastvorenog organskog ugljenika.
Opisani postupak ponavlja se svakodnevno u toku trajanja ispitivanja.
Pre taloženja, potrebno je očistiti čestice koje su se nakupile na zidovima jedinica iznad nivoa tečnosti. Za čišćenje svake jedinice mora se koristiti posebna strugalica ili četka da se spreči međusobna kontaminacija.
U idealnom slučaju, rastvoreni organski ugljenik u tečnom supernatantu određuje se svakog dana, ali analize mogu biti i ređe. Tečnosti se pre analize filtriraju kroz isprane membranske filtere od 0,45 µm ili se centrifugiraju. Odgovarajući membranski filteri su oni koji ne otpuštaju ugljenik niti apsorbuju supstance u toku filtracije. Temperatura uzorka za vreme centrifugiranja ne sme biti veća od 40 °C.
Dužina ispitivanja za jedinjenja koja se slabo ili uopšte biološki ne razgrađuju nije određena, ali na osnovu iskustva, treba da bude najmanje 12, a najviše 26 nedelja.
Vrednosti rastvorenog organskog ugljenika u tečnom supernatantu ispitivanih i kontrolnih jedinica grafički se prikazuju u funkciji vremena.
Kad se postigne biološka razgradnja, nivo te razgradnje u ispitivanim jedinicama približava se nivou razgradnje u kontrolnim jedinicama. Kad se razlika između dva nivoa u tri uzastopna merenja ustali, broj daljih merenja treba da bude dovoljan da omogući statističku obradu podataka i izračunavanje procenata biološke razgradnje (Dda ili Dssd, videti odeljak 1.2. ove metode).
Izveštaj o ispitivanju, ako je moguće, sadrži:
- sve podatke o vrsti otpadne vode, tipu upotrebljene jedinice i rezultatima koji se tiču ispitivane supstance, referentne supstance - ako je korišćena, i slepe probe;
- temperaturu;
- krivu uklanjanja sa opisom, način izračunavanja (videti odeljak 1.2. ove metode);
- datum i mesto gde su uzeti uzorci aktivnog mulja i otpadne vode, status adaptacije, koncentracija, itd;
- naučno utemeljene razloge za moguće izmene ispitivanja lnog postupka;
- potpis i datum.
Supstanca koja se mora ispitati ovom metodom nije biološki lako razgradljiva, te se do uklanjanja DOC izazvanog jedino biološkom razgradnjom dolazi postepeno u toku više dana ili nedelja, osim u slučaju kad naglo nastupi aklimatizacija na šta ukazuje nagli nestanak nakon nekoliko nedelja.
Fizičko-hemijska adsorpcija je nekada važna, što se vidi iz potpunog ili delimičnog uklanjanja dodatog DOC na početku ispitivanja. Ono što se dogodi nakon toga zavisi od faktora kao što je stepen adsorpcije i koncentracija suspendovanih materija u odbačenom efluentu. Obično se početno niska razlika između koncentracije DOC u kontrolnim i ispitivanim tečnim supernatantima postupno povećava i zatim se zadržava na novoj vrednosti do kraja ispitivanja, osim u slučaju aklimatizacije.
Ako se biorazgradljivost (ili delimična biorazgradljivost) želi razlikovati od adsorpcije, potrebno je sprovesti dodatna ispitivanja. Najbolje je za ovo koristiti tečni supernatant ili mulj kao inokulum u osnovnom eksperimentu (najbolje je uraditi respirometrijsko ispitivanje).
Kad se u ovom ispitivanju dobije visok stepen uklanjanja DOC bez adsorpcije, ispitivana supstanca se smatra potencijalno biorazgradljivom. Delimično neadsorptivno uklanjanje ukazuje na delimičnu biorazgradljivost ispitivane supstance.
Ako je uklanjanje DOC nisko ili do njega ne dolazi, uzrok može biti inhibitorno dejstvo ispitivane supstance na mikroorganizame. To se može otkriti lizom i gubitkom mulja, što daje zamućen supernatant. Ispitivanje treba ponoviti pomoću nižih koncentracija ispitivane supstance.
Upotreba posebnog analitičkog postupka ili ispitivane supstance obeležene izotopom ugljenika C14 može povećati osetljivost.
Ako se koriste ispitivana jedinjenja označena sa C14, pronalazak C14 potvrđuje da je došlo do biorazgradnje.
Kad se rezultati prikazuju na osnovu primarne biorazgradnje, treba dati objašnjenje o promeni hemijske strukture koja dovodi do gubitka odgovora izvorne ispitivane supstance.
Validacija analitičkog postupka mora se dati zajedno sa odgovorom dobijenim na ispitnoj podlozi koja je služila kao slepa proba.
1. OECD, Paris, 1981, Test Guideline 302 A, Decision of the Council C(81) 30 final.
SCAS METODA ISPITIVANJA: PRIMER REZULTATA
Supstanca | CT (mg/l) | Ct-Cc (mg/l) | Procenat biorazgradnje - Dda | Dužina |
4-acetil aminobenzen sulfonat | 17,2 | 2,0 | 85 | 40 |
tetrapropilen benzen sulfonat | 17,3 | 8,4 | 51,4 | 40 |
4-nitrofenol | 16,9 | 0,8 | 95,3 | 40 |
Dietilen glikol | 16,5 | 0,2 | 98,8 | 40 |
anilin | 16,9 | 1,7 | 95,9 | 40 |
ciklopentan tetrakarboksilat | 17,9 | 3,2 | 81,1 | 120 |
C.13. BIOKONCENTRACIJA: ISPITIVANJE NA RIBAMA U PROTOČNOM SISTEMU
Metoda se zasniva na OECD TG 305 (1996) uputstvu ispitivanja.
Ovom metodom ispitivanja određuje se potencijal biokoncentracije ispitivane supstance u ribama kada se one drže u protočnom sistemu. Iako je protočni sistem najpogodniji, ispitivanje se može izvesti i u polu-statičnom sistemu pod uslovom da su zadovoljeni kriterijumi kvaliteta.
U metodi su date precizne instrukcije za izvođenje ispitivanja, ali se dozvoljavaju modifikacije postupka ispitivanja u zavisnosti od laboratorijskih uslova, odnosno osobina ispitivane supstanci. Metoda je namenjena za ispitivanje stabilnih organskih supstanci sa vrednostima log Pow između 1,5 i 6,01, ali se mogu ispitivati i superlipofilne supstance (koje imaju vrednost log Pow > 6,0). Preliminarna procena faktora biokoncentracije (bioconcentration factor, u daljem tekstu: BCF), koji se ponekad označava sa KB, za takve superlipofilne supstance je veća od vrednosti faktora biokoncentracije u ravnotežnom stanju (steady-state bioconcentration factor, u daljem tekstu: BCFSS) do kojih se dolazi izvođenjem laboratorijskih ispitivanja. Preliminarne procene faktora biokoncentracije za organske supstance sa visokim vrednostima log Pow čak do 9,0 mogu se dobiti pomoću jednačine2. Parametri koji određuju biokoncentracioni potencijal uključuju konstantu brzine unosa (k1), konstantu brzine eliminacije (k2) i faktor biokoncentracije u ravnotežnom stanju BCFSS.
Ispitivanje sa obeleženim ispitivanim supstancama može olakšati analizu uzoraka vode i uzoraka tkiva ribe, ali može i pomoći u planiranju sledećih koraka - da li je potrebno identifikovati i kvantifikovati produkte razgradnje. Ukoliko se mere ukupni radioaktivni rezidijumi (npr. sagorevanjem ili rastvaranjem tkiva), BCF se odnosi na polaznu supstancu, preostale metabolite, kao i asimilirani ugljenik. Faktori biokoncentracije koji se baziraju na ukupnim radioaktivnim rezidijumima ne mogu se direktno porediti sa faktorima biokoncentracije koji su dobijeni specifičnim hemijskim analizama samo za polaznu supstancu.
Postupci čišćenja mogu se iskoristiti u ispitivanjima sa radioobeleženim supstancama da bi se odredila vrednost BCF za polaznu supstancu, a po potrebi se mogu okarakterisati i glavni metaboliti. Moguće je kombinovati studije proučavanja metabolizma riba i ispitivanja biokoncentracije putem analize i identifikacije rezidiuma u tkivima.
1.2. DEFINICIJE I JEDINICE MERE
Biokoncentracija/bioakumulacija jeste povećanje koncentracije ispitivane supstance u ili na organizmu (ili određenim tkivima) u odnosu na koncentraciju ispitivane supstance u odgovarajućem medijumu.
Faktor biokoncentracije (BCF ili KB) jeste odnos koncentracije ispitivane supstance u ili na ribi, ili određenim tkivima ribe (Cf se izražava u µg/g (ppm)) i koncentracije te supstance u okružujućem medijumu (Cw se izražava u µg/ml (ppm)), u bilo kom trenutku faze unosa tokom ispitivanja akumulacije supstance.
Faktor biokoncentracije u ravnotežnom stanju (BCFSS ili KB) se ne menja značajno u toku dužeg vremenskog perioda. Koncentracija ispitivane supstance u medijumu u toku ovog perioda je stalna.
Plato ili ravnotežno stanje se uočava kod grafičkog prikaza koncentracije ispitivane supstance u ribi (Cf) u funkciji vremena kao ravna linija paralelna sa x-osom. Ravnotežnim stanjem se smatra kada se rezultati tri uzastopna merenja koncentracije ispitivane supstance Cf u uzorcima uzetim u intervalima od najmanje dva dana međusobno razlikuju do ± 20% i kad ne postoje značajne razlike između tri perioda uzorkovanja. Kad se analiziraju združeni uzorci potrebno je uraditi najmanje četiri uzastopne analize. Za ispitivane supstance koje sporo usvajaju, pogodniji su intervali od sedam dana.
Faktor biokoncentracije koji se izračunava direktno preko vrednosti konstanti brzine unosa i eliminacije (k1/k2) jeste kinetički faktor biokoncentracije (u daljem tekstu: BCFK).
Koeficijent raspodele u sistemu n-oktanol/voda (Pow) jeste odnos vrednosti za rastvorljivost hemijske supstance u n-oktanolu i vrednosti za rastvorljivost u vodi u ravnotežnom stanju (Metoda A.8. koja je data u ovom pravilniku). Logaritam od Pow koristi se kao indikator biokoncentracionog potencijala hemijske supstance u akvatičnim organizmima.
Faza izloženosti ili unosa jeste vreme u toku kojeg je riba izložena ispitivanoj supstanci.
Konstanta brzine unosa (k1) jeste numerička vrednost kojom se definiše stepen porasta koncentracije ispitivane supstance u/na ribi (ili određenim tkivima ribe) kad je riba izložena datoj supstanci (k1 se izražava u dan-1).
Faza post-izloženosti ili faza eliminacije jeste period u kome dolazi do smanjenja (ili potpune eliminacije) ispitivane supstance iz jedinki (ribe) (ili određenog tkiva te ribe), a nastupa nakon premeštanja jedinki iz medijuma u čist medijum (tj. medijum koji ne sadrži ispitivanu supstancu).
Konstanta brzine eliminacije (k2) jeste numerička vrednost kojom se definiše stepen smanjenja koncentracije ispitivane supstance u jedinci (riba) (ili određenim tkivima te ribe) nakon transfera jedinki iz medijuma u čist medijum (k2 se izražava kao dan-1).
1.3. PRINCIP METODE ISPITIVANJA
Ispitivanje se sastoji iz dve faze: faze izloženosti (unosa) i faze post-izloženosti (eliminacije). Tokom faze unosa, pojedinačne grupe riba iste vrste izložene su ispitivanoj supstanci u najmanje dve koncentracije. Ribe se zatim prenose u čist medijum i nastupa faza eliminacije. Faza eliminacije je neophodna, osim ukoliko je unos ispitivane supstance u toku faze unosa bio neznatan (npr. BCF manji od 10). Koncentracija ispitivane supstance u ili na ribi (ili određenim tkivima ribe) se prati u toku obe faze ispitivanja. Uz dve koncentracije ispitivane supstance (dve ispitivane grupe), postavlja se i kontrola sa jedinkama riba u uslovima identičnim onima u ispitivanim grupama, osim što kod kontrole jedinke nisu izložene ispitivanoj supstanci. Na taj način se uočeni negativni efekti u ispitivanim grupama mogu pripisati isključivo delovanju ispitivane supstance.
Faza unosa treba da traje 28 dana, osim u slučaju kad se ravnotežno stanje uspostavi ranije. Trajanje faze unosa i vreme do postizanja ravnotežnog stanja može se predvideti pomoću jednačine iz Dela trećeg ove metode. Nakon toga započinje faza eliminacije: jedinke riba se premeštaju u drugi čisti akvarijum sa istim medijumom, ali bez ispitivane supstance. Kad je moguće, BCF treba izračunati i kao BCFSS, tj. kao odnos koncentracije supstance u ribi (Cf) i njene koncentracije u vodi (Cw) pri uočenom ravnotežnom stanju i kao BCFK, tj. odnos vrednosti konstanti brzine unosa (k1) i eliminacije (k2), ukoliko se proces može opisati kao kinetika prvog reda. Ukoliko se proces ne može opisati kao kinetika prvog reda, moraju se upotrebiti složeniji modeli (videti Deo šesti ove metode).
Ako se ravnotežno stanje ne postigne u roku od 28 dana, faza unosa mora se produžiti do trenutka uspostavljanja ravnoteže ili najviše do 60 dana, kada se započinje sa fazom eliminacije.
Vrednosti za konstantu brzine unosa, konstantu brzine eliminacije (gubitka) (ili više konstanti, kad su uključeni složeniji modeli), faktor biokoncentracije i gde je to moguće, intervali poverenja za svaki od ovih parametara izračunavaju se iz modela koji najbolje opisuje izmerene koncentracije ispitivane supstance u ribi i vodi.
BCF se izražava u funkciji ukupne sveže težine ribe. U posebnim slučajevima mogu se koristiti određena tkiva ili organi (npr. mišići, jetra) ako je riba dovoljno velika ili se može podeliti u jestive (fileti) i nejestive delove (unutrašnji organi). Za mnoge organske supstance postoji jasna veza između biokoncentracionog potencijala i lipofilnosti, te postoji i odgovarajući odnos između sadržaja lipida u jedinkama ribe i uočene biokoncentracije tih supstanci. Da se smanji ovaj izvor varijabilnosti rezultata ispitivanja za supstance sa izraženom lipofilnošću (odnosno sa log Pow> 3), biokoncentraciju treba izraziti u odnosu na ukupnu težinu jedinke i u odnosu na sadržaj lipida u organizmu.
Kad je moguće, sadržaj lipida treba odrediti na istom biološkom materijalu u kojem se meri koncentracija ispitivane supstance.
1.4. PODACI O ISPITIVANOJ SUPSTANCI
Pre izvođenja ispitivanja biokoncentracije, treba imati sledeće podatke o ispitivanoj supstanci:
- rastvorljivost u vodi;
- koeficijent raspodele u sistemu n-oktanol/voda, Pow (označava se i sa Kow, određuje se HPLC metodom opisanom u Metodi A.8);
- hidroliza;
- fototransformacija u vodi pod prirodnim ili veštačkim osvetljenjem i u uslovima osvetljenja koji su definisani ovom metodom3;
- površinski napon (odnosno za supstance gde se log Pow ne može odrediti);
- napon pare;
- brza biološka razgradljivost (ako je odgovarajuće).
Ostali potrebni podaci uključuju toksičnost ispitivane supstance za izabranu vrstu ribe koja se koristi u ispitivanju, po mogućnosti asimptotska LC50 (odnosno nezavisna od vremena). Na raspolaganju treba imati odgovarajuću analitičku metodu poznate tačnosti, preciznosti i osetljivosti za kvantifikaciju ispitivane supstance u rastvorima i u biološkom materijalu, kao i podatke o pripremi i čuvanju uzorka. Mora biti poznat limit detekcije ispitivane supstance kako u vodi, tako i u ribljim tkivima. Ako se koristi ispitivana supstanca obeležena sa izotopom ugljenika C14, treba znati i procenat radioaktivnosti koji se pripisuje nečistoćama.
Da bi se ispitivanje smatralo validnim moraju se zadovoljiti uslovi:
- variranje temperature manje od ± 2 °C;
- saturacija kiseonika veća od 60%;
- koncentracija ispitivane supstance u posudama (akvarijumima) održava se unutar ± 20% srednje vrednosti izmerene u toku faze unosa;
- smrtnost ili drugi štetni efekti/bolesti uočeni kod jedinki u kontroli i ispitivanim grupama mora biti manja od 10% na kraju ispitivanja. Kad je ispitivanje produženo na nekoliko sedmica ili meseci, smrtnost ili drugi štetni efekti u kontroli i ispitivanim grupama treba da budu manji od 5% mesečno i da ne premašuju ukupno 30% u toku trajanja celog ispitivanja.
Ispitivanje referentnih supstanci za koje se raspolaže podacima o biokoncentracionom potencijalu može biti korisno za proveru procedure ispitivanja. Nisu preporučene određene referentne supstance.
1.7.1. Oprema
Svaki deo opreme mora biti napravljen od inertnog materijala koji ne utiče štetno na jedinke koje se koriste u ispitivanju. Mogu se koristiti standardni pravougaoni ili cilindrični akvarijumi, napravljeni od hemijski inetrnog materijala i odgovarajuće zapremine koji odgovara dinamici nasada. Upotrebu mekih plastičnih cevi treba svesti na najmanju moguću meru. Prednost se daje teflonu, nerđajućem čeliku, odnosno staklenim cevima. Iskustvo je pokazalo da za supstance sa visokim koeficijentima adsorpcije, kao što su sintetički piretroidi, treba koristiti silanizirano staklo. Oprema se, u ovom slučaju, nakon upotrebe mora baciti.
1.7.2. Voda
Uobičajeno se koristi obična voda, koja mora da se dobije iz nekontaminiranog izvora sa ujednačenim kvalitetom. Kvalitet vode za razblaživanje mora biti takav da za vreme trajanja perioda aklimatizacije i perioda ispitivanja omogući preživljavanje odabrane vrste riba i da ne izaziva negativne promene u izgledu i ponašanju jedinki. U idealnom slučaju, treba pokazati da izabrana vrsta ribe može da preživi, raste i razmnožava se u vodi za razblaživanje (npr. u laboratorijskoj kulturi ili u toku ispitivanja toksičnosti). U opisu kvaliteta vode treba navesti pH vrednost, tvrdoću, ukupne suspendovane materije, ukupan organski ugljenik. Poželjno je navesti i sadržaj amonijaka, nitrita i alkalitet, a za morske vrste i salinitet. Parametri potrebni za optimalan rast i razvoj riba potpuno su poznati i u Delu drugom ove metode date su preporučene maksimalne koncentracije seta parametara za slatku i morsku vodu koja se koristi u ispitivanju.
Tokom trajanja ispitivanja, voda mora biti ujednačenog kvaliteta. Vrednost pH treba da bude između 6,0 i 8,5 i u toku ispitivanja mora se održavati unutar opsega od ± 0,5. Da bi se osiguralo da voda za razblaživanje neće uticati na rezultate ispitivanja (npr. kompleksiranjem ispitivane supstance) ili da neće štetno uticati na jedinke odabrane vrste riba, potrebno je periodično uzimati uzorke vode za analizu. Treba izmeriti koncentracije teških metala (npr. Cu, Pb, Zn, Hg, Cd, Ni), glavnih anjona i katjona (npr. Cu, Mg, Na, K, Cl, SO4), pesticida (npr. ukupne organofosforne i ukupne organohlorne pesticide), ukupnog organskog ugljenika i suspendovanih materija, npr. na svaka tri meseca ako se zna da je voda za razblaživanje relativno ujednačenog kvaliteta. Ako se utvrdi da je kvalitet vode ujednačen u toku najmanje godinu dana, provera kvaliteta može biti ređa, a intervali duži (npr. svakih 6 meseci).
Sadržaj prirodnih materija kao i ukupni organski ugljenik (u daljem tekstu: TOC) u vodi za razblaživanje treba da bude što manji da bi se izbegla adsorpcija ispitivane supstance na organsku materiju što može smanjiti biodostupnost supstance4. Maksimalna prihvatljiva vrednost za suspendovane materije je 5 mg/l (suve materije, ne prolazi filter od 0,45 µm) i za ukupni organski ugljenik 2 mg/l (videti Deo drugi ove metode). Voda se, po potrebi, filtrira pre upotrebe. Ekskreti jedinki, kao i ostaci hrane doprinose ukupnom sadržaju organskog ugljenika, pa ih treba svesti na minimalnu meru. Tokom čitavog perioda ispitivanja, koncentracija organskog ugljenika u akvarijumu ne treba da bude veća od koncentracije organskog ugljenika koja potiče od ispitivane supstance. Koncentracija rastvarača, ukoliko se koristi u ispitivanju, ne sme da bude veća od 10 mg/l (± 20%).
1.7.3. Ispitivani rastvori
Osnovni rastvor ispitivane supstance priprema se u odgovarajućoj koncentraciji. Osnovni rastvor se priprema mešanjem ili mućkanjem ispitivane supstance u vodi za razblaživanje. Ne preporučuje se upotreba rastvarača ili disperzionih sredstava. Nekada je neophodna upotreba ovih sredstava radi dobijanja osnovnih rastvora ispitivane supstance željene koncentracije. Rastvarači koji se mogu koristiti su etanol, metanol, etilenglikol monometil eter, etilenglikol dimetil eter, dimetilformamid i trietilen glikol. Disperziona sredstva koja se mogu koristi su Cremophor RH40, Tween 80, metilceluloza 0,01% i HCO-40. Mere opreza treba uzeti u obzir kad se koriste brzo biološki razgradljiva disperziona sredstva, jer mogu prouzrokovati probleme sa rastom bakterija u ispitivanju u protočnim uslovima. Ispitivana supstanca može se označiti radioaktivnim izotopom i treba da bude najvišeg stepena čistoće (po mogućnosti > 98%).
Za ispitivanje u protočnim uslovima potreban je sistem sa dispenzorom i diluterom rastvora ispitivane supstance (npr. pumpa sa meračem, sistem za proporcionalno razblaživanje, sistem za zasićenje) da bi se u akvarijumima održavala konstantna koncentracija te supstance. Poželjno je da se najmanje pet puta u toku dana izmeni celokupna zapremina akvarijuma. Prednost se daje ispitivanju u protočnim uslovima, ali u slučajevima gde to nije moguće (npr. kad postoje štetni efekti na organizme koje se koriste u ispitivanju) može se izvoditi i ispitivanje u semistatičkim uslovima, ako su zadovoljeni kriterijumi validnosti. Protok osnovnog rastvora ispitivane supstance i vode za razblaživanje proverava se 48 sati pre početka i zatim najmanje jedanput dnevno u toku ispitivanja. Ova provera uključuje određivanje protoka u svakom akvarijumu i protok ne sme da varira više od 20% u jednom akvarijumu, kao i između akvarijuma.
1.7.4. Odabir vrsta za potrebe ispitivanja
Kriterijumi za izbor vrste riba su da su lako dostupne, da se mogu dobiti u odgovarajućim veličinama i da se mogu na zadovoljavajući način uzgajati u laboratoriji. Drugi kriterijumi za izbor vrste uključuju njenu komercijalnu, rekreacionu i ekološku važnost, kao i mogućnost poređenja osetljivosti sa drugim vrstama, prethodnu uspešnu upotrebu u ispitivanjima, itd.
Preporučene vrste za potrebe ove metode navedene su Delu drugom ove metode. Mogu se koristiti i druge vrste, ali u tom slučaju treba modifikovati metodu ispitivanja kako bi se obezbedili pogodni uslovi. U izveštaju se mora dati objašnjenje za izbor vrste i metode ispitivanja.
1.7.5. Gajenje riba
Aklimatizacija matičnog jata riba traje najmanje dve sedmice u vodi pri temperaturnom režimu i režimu ishrane definisanim za samo ispitivanje.
Nakon perioda aklimatizacije od 48 sati, uočava se smrtnost i primenjuju sledeći kriterijumi:
- ako je smrtnost veća od 10% populacije u sedam dana, celo matično jato se odbacuje;
- ako je smrtnost između 5% i 10% populacije u sedam dana, matično jato se aklimatizuje još sedam dana;
- ako je smrtnost manja od 5% populacije u sedam dana, matično jato se prihvata;
- ako je smrtnost iznad 5% u narednih 5 dana, celo jato se odbacuje.
Treba voditi računa da jedinke ribe koje se koriste u ispitivanju nemaju vidljivih bolesti i abnormalnosti. Svaka obolela jedinka isključuje se iz ispitivanja. Jedinke se ne smeju lečiti dve sedmice pre početka ispitivanja, kao niti za vreme samog ispitivanja.
1.8.1. Preliminarno ispitivanje
Poželjno je izvesti preliminarno ispitivanje kako bi se postavili optimalni uslovi za konačno ispitivanje, npr. izbor ispitivanih koncentracija supstance, trajanje faza unosa i eliminacije.
1.8.2. Uslovi izloženosti
1.8.2.1. Trajanje faze unosa
Trajanja faze unosa može se predvideti na osnovu iskustva (npr. iz prethodnog ispitivanja, ili rezultata ispitivanja sa supstancom sličnog potencijala za akumulaciju) ili određenih empirijskih odnosa na osnovu poznavanja ili rastvorljivosti u vodi ili koeficijenta raspodele u sistemu n-oktanol/voda za ispitivanu supstancu (videti Deo četvrti ove metode).
Faza unosa treba da traje 28 dana, osim u slučaju kad se može uočiti da se ravnotežno stanje usupostavilo i ranije. Ako se ravnotežno stanje ne dostigne do kraja 28. dana, fazu unosa treba produžiti do dostizanja ravnotežnog stanja ili do 60 dana, zavisno od toga koji uslov se pre ispuni.
1.8.2.2. Trajanje faze eliminacije
Polovina vremena koliko traje faza unosa jeste dovoljno dug period da nastupi zadovoljavajuće smanjenje sadržaja ispitivane supstance u organizmu jedinke od npr. 95% (za objašnjenje procene videti Deo četvrti ove metode). Ako je vreme da se postigne 95% smanjenja nepraktično dugo i premašuje npr. dvostruku dužinu trajanja normalnog trajanja faze unosa (tj. više od 56 dana) može se koristiti kraći period (odnosno dok koncentracija ispitivane supstance ne dostigne vrednost manje od 10% ravnotežne koncentracije). Za određivanje konstanti brzine eliminacije supstanci kod kojih su procesi unosa i eliminacije složenijii ne predstavljaju kinetiku prvog reda, treba produžiti trajanje faze eliminacije. Taj period može biti određen vremenom u toku kojeg koncentracija ispitivane supstance u ribi ostaje iznad limita detekcije.
1.8.2.3. Broj jedinki riba
Broj jedinki riba za svaku ispitivanu koncentraciju treba da bude dovoljan da obezbedi najmanje četiri jedinke ribe po uzorkovanju. Za preciznija statistička određivanja, potrebno je imati na raspolaganju veći broj jedinki riba.
Ukoliko se u ispitivanju koriste odrasle jedinke riba, u izveštaju treba navesti da li se radi o mužjaku ili ženki ili se koriste jedinke oba pola. Ako se koriste jedinke oba pola, treba potvrditi da razlike u sadržaju lipida između mužjaka i ženki pre početka izlaganja ispitivanoj supstanci nisu značajne. Može biti neophodno da se objedine uzorci za sve jedinke muškog i za sve jedinke ženskog pola.
Za svako ispitivanje biraju se jedinke približno iste težine, tako da težina najmanjih primeraka nije manja od dve trećine težine najvećih primeraka. Sve jedinke treba da budu istog uzrasta i da potiču iz istog matičnog jata. Primećeno je da težina i uzrast jedinki riba imaju značajan uticaj na vrednost BCF1, pa se ovi podaci moraju navesti u izveštaju. Preporučuje se da se pre ispitivanja iz matičnog jata uzme nekoliko jedinki riba i izmeri njihova težina kako bi se procenila srednja težina jedinki matičnog jata.
1.8.2.4. Nasad
Velika količina vode u odnosu na težinu jedinki riba koristi se kako bi se smanjila redukcija vrednosti Cw prouzrokovana dodavanjem jedinki ribe na početku ispitivanja i da bi se izbeglo smanjenje koncentracije rastvorenog kiseonika. Važno je da režim nasada jedinki ribe odgovara vrsti ribe koja se koristi u ispitivanju. Preporučuje se režim nasada od 0,1 g do 1,0 g ribe (sveže mase) po litru vode na dan. Povećan unos se koristi ako se pokaže da se tražena koncentracija ispitivane supstance može održati unutar granica od ± 20% i da saturacija kiseonika ne pada ispod 60%.
U izboru odgovarajućeg režima unosa, uzima se u obzir prirodno stanište date vrste riba. Na primer, riba koja živi pri dnu može za istu zapreminu vode zahtevati veću površinu dna u akvarijumu u odnosu na pelagijske vrste.
1.8.2.5. Ishrana
Tokom perioda aklimatizacije i perioda trajanja ispitivanja, ribe se hrane odgovarajućom hranom poznatog sadržaja lipida i ukupnih belančevina, u količini dovoljnoj da ih održi zdravima i sa stalnom telesnom težinom. Ribe se hrane svaki dan u toku čitavog perioda aklimatizacije i u toku trajanja ispitivanja u količini od približno 1% do 2% telesne težine dnevno. Ovakav režim održava sadržaj lipida kod većine ribljih vrsta na relativno ujednačenom nivou u toku ispitivanja. Količina hrane mora se preračunati, npr. jednom sedmično, kako bi se održala ujednačena telesna težina i ujednačen sadržaj lipida. Za ovaj preračun, težina jedinki u svakom akvarijumu određuje se na osnovu težine jedinki ribe koje su prethodni put uzete za uzorkovanje iz tog akvarijumu. Ne meri se težina preostalih jedinki u akvarijumu.
Hrana koja nije pojedena i ekskrementi svakodnevno se ispuštaju iz akvarijuma nakon hranjenja (30 minuta do 1 sat). Akvarijumi se održavaju čistim, u što većoj mogućoj meri, u toku čitavog trajanja ispitivanja, tako da se koncentracija organske materije održava na što nižem nivou, s obzirom na to da prisustvo organskog ugljenika može ograničiti biodostupnost ispitivane supstance1.
Mnoge vrste riblje hrane napravljene su od ribljih prerađevina, te treba analizirati sadržaj te hrane na prisustvo ispitivane supstance. Bilo bi dobro analizirati pesticide i teške metale u hrani.
1.8.2.6. Svetlost i temperatura
Fotoperiod uobičajeno traje 12 do 16 sati, a temperatura (± 2 °C) treba da odgovara vrsti riba koja se koristi u ispitivanju (videti Deo treći ove metode). Vrsta i svojstva osvetljenja treba da budu poznati. Potreban je oprez zbog moguće transformacije ispitivane supstance pod uticajem svetlosti pri datim uslovima osvetljenja definisanim za ovu metodu. Koristi se odgovarajuće osvetljenje i izbegava izlaganje ribe veštačkom svetlu. U nekim slučajevima poželjno je koristiti odgovarajući filter za blokiranje UV zračenja talasne dužine ispod 290 nm.
1.8.2.7. Koncentracije ispitivane supstance
Ispitivanje se odvija u protočnom sistemu i ispituju se najmanje dve koncentracije ispitivane supstance. Viša ili najviša koncentracija ispitivane supstance obično je 1% akutne asimptotske vrednosti LC50 te supstance i mora da bude najmanje deset puta viša od limita detekcije primenjenog analitičkog postupka.
Najviša ispitivana koncentracija supstance može da se odredi deljenjem 96 h LC50 vrednosti za akutnu toksičnost sa odgovarajućom ACRLXV vrednošću (ACR nekih hemikalija se kreće u rasponu od 3 do 100). Ukoliko je moguće, u ispitivanju se koristi jedna ili više drugih koncentracija koje se od najviše ispitivane koncentracije razlikuju za faktor 10. Ako to nije moguće, zbog kriterijuma od 1% LC50 i limita detekcije analitičke metode, može da se upotrebi manji faktor ili se razmatra ispitivanje supstance koja je obeležena radioaktivnim izotopom ugljenika - C14. Nijedna koncentracija ne treba da bude jednaka maksimalnoj rastvorljivosti ispitivane supstance.
Kada se koristi rastvarač, njegova koncentracija ne treba da bude veća od 0,1 ml/l i treba da bude ista u svim tretmanima. Rastvarač zajedno sa ispitivanom supstancom doprinosi ukupnom sadržaju organskog ugljenika u medijumu i treba da bude poznat njegov udeo u ukupnom sadržaju organskog ugljenika. Upotrebu rastvarača treba svesti na najmanju moguću meru.
1.8.2.8. Kontrole
U ispitivanju je potrebno imati jednu kontrolnu grupu sa jedinkama ribe samo u čistom medijumu ili, ukoliko je relevantno, dodatnu kontrolnu grupu sa rastvaračem, po uslovom da je prethodno utvrđeno da dati rastvarač ne ispoljava efekat na jedinke. U suprotnom, moraju se postaviti obe kontrolne grupe
1.8.3. Učestalost merenja kvaliteta vode
Tokom ispitivanja u svim akvarijumima treba meriti: rastvoreni kiseonik, TOC, pH vrednost i temperaturu akvarijumima. Ukupna tvrdoća i salinitet, ukoliko su relevantni, mere se u kontrolama i u jednom akvarijumu sa višom (ili najvišom) koncentracijom. Rastvoreni kiseonik i salinitet, ukoliko je relevantno, mere se najmanje tri puta: na početku, oko sredine i na kraju faze unosa i jednom sedmično u toku faze eliminacije. TOC se meri na početku ispitivanja (24 sata i 48 sati pre početka faze unosa) pre unosa ribe i najmanje jedanput sedmično u toku faza unosa i eliminacije. Temperatura se meri svakodnevno. Vrednost pH se meri na početku i na kraju svake faze, a tvrdoća jedanput u toku ispitivanja. Poželjno je neprekidno meriti temperaturu najmanje u jednom akvarijumu.
____________
LXV Odnos akutne i hronične toksičnosti (acute/chronic toxicity ratio) je faktor koji služi za procenu hronične toksičnosti neke hemikalije na osnovu podataka o njenoj akutnoj toksičnosti i obrnuto.
1.8.4. Uzorkovanje i analiziranje ribe i vode
1.8.4.1. Raspored uzorkovanja ribe i vode
Uzorak vode iz komora za ispitivanje, radi određivanja koncentracije ispitivane supstance, uzima se pre unosa ribe i u toku faza unosa i eliminacije. Voda se uzima kad i riba i to pre njenog hranjenja. Tokom faze unosa, mere se koncentracije ispitivane supstance da bi se potvrdilo da su zadovoljeni kriterijumi kvaliteta.
Jedinke riba uzorkuju se najmanje pet puta u toku faze unosa i najmanje četiri puta u toku faze eliminacije. U nekim slučajevima je teško izračunati dovoljno preciznu procenu BCF vrednosti na osnovu ovog broja uzoraka, naročito kad se radi o procesu unosa i eliminacije koji se ne ponaša po modelu kinetike prvog reda, pa uzorkovanje treba obavljati češće u toku obe faze (videti Deo peti ove metode). Dodatni uzorci čuvaju se i analiziraju samo ako se rezultati prvog kruga analiza pokažu neodgovarajućima za izračunavanje BCF sa željenom preciznošću.
Primer prihvatljivog rasporeda uzimanja uzoraka dat je u Delu četvrtom ove metode. Drugi rasporedi mogu se odrediti pomoću drugih pretpostavljenih vrednosti Kow za izračunavanje trajanja izloženosti u kome dolazi do 95% unosa.
Uzorkovanje se nastavlja u toku faze unosa sve dok se ne uspostavi ravnotežno stanje ili u toku 28 dana, zavisno od toga koji se uslov pre ispuni. Ako se ravnotežno stanje ne postigne u toku 28 dana, uzorkovanje se nastavlja sve do postizanja ravnotežnog stanja ili do 60 dana, zavisno od toga koji uslov se pre ispuni. Pre početka faze eliminacije, jedinke riba se prenose u akvarijume sa čistim medijumom.
1.8.4.2. Uzimanje i priprema uzoraka
Uzorci vode za analizu uzimaju se npr. ispuštanjem vode kroz inertne cevi postavljene na sredini akvarijuma. Filtracija ni centrifugiranje ne odvajaju uvek frakcije ispitivane supstance koje nisu biodostupne od frakcija koje jesu biodostupne (važi naročito za superlipofilne hemikalije odnosno one hemikalije čiji je log Pow > 5)1, 5. Nije uvek potrebno raditi filtriranje ili centrifugiranje uzoraka. Umesto toga, potrebno je komore za ispitivanje držati što čistijim, a u toku faza unosa i faze eliminacije mora se pratiti sadržaj ukupnog organskog ugljenika.
Pri svakom uzorkovanju odgovarajući broj jedinki riba (obično najmanje četiri) uklanja se iz komore za ispitivanje. Uzorkovane jedinke brzo se ispiraju vodom, obrišu od suvišne tečnosti, trenutno ubijaju na najhumaniji način i izmere.
Poželjno je analizirati uzorke vode i jedinki riba odmah posle uzorkovanja, čime se izbegava razgradnja ili drugi načini gubitka i omogućava izračunavanje brzina unosa i eliminacije u toku ispitivanja. Brzom analizom se omogućava pravovremeno određivanje tačke postizanja ravnotežnog stanja.
Ako se analiza ne obavi odmah, uzorci se čuvaju na odgovarajući način. Pre početka ispitivanja potrebno je imati podatke o odgovarajućim načinima skladištenja za ispitivanu supstancu, npr. zamrzavanje, čuvanje na temperaturi od 4 °C, trajanje skladištenja, ekstrakcija, itd.
1.8.4.3. Kvalitet analitičkog postupka
Metoda ispitivanja zavisi od tačnosti, preciznosti i osetljivosti primenjene analitičke metode za datu ispitivanu supstancu, pa je neophodno ispitivanjem proveriti da li su preciznost i ponovljivost hemijske analize, kao i efikasnost analitičkog postupka za ispitivanu supstancu u vodi i ribi, zadovoljavajući za određeni analitički postupak. Mora se analizirati i voda za razblaživanje na prisustvo date ispitivane supstanca.
Po potrebi se koriguju vrednosti Cw i Cf dobijene iz ispitivanja i to pomoću vrednosti efikasnosti analitičke tehnike i vrednosti fona u kontroli. Potrebno je pažljivo rukovati uzorcima ribe i vode tako da se u najvećoj mogućoj meri onemogući kontaminacija i gubici (na primer gubici koji mogu nastati usled adsorpcije na opremu za uzorkovanje).
1.8.4.4. Analiza uzoraka ribe
Ako se u ispitivanju koriste obeležene supstance, može se analizirati ukupni radioobeleženi materijal (odnosno polazna supstanca i njeni metaboliti), ili uzorci mogu biti prečišćeni tako da se polazna supstance može analizirati posebno. Glavni metaboliti mogu se okarakterisati u ravnotežnom stanju ili na kraju faze unosa, zavisno od toga koji uslov se pre ispuni. Ako je BCF u smislu ukupnih radioaktivnih rezidijuma ± 1.000%, savetuje se (za određene kategorije hemikalija, kao što su pesticidi čvrsto preporučuje) da se identifikuju i kvantifikuju produkti razgradnje koji čine ± 10% ukupnih rezidijuma u tkivu ribe u ravnotežnom stanju. Ako se identifikuju i kvantifikuju produkti razgradnje koji čine ± 10% ukupnih radioaktivnih rezidijuma u ribljem tkivu, preporučuje se i identifikacija i kvantifikacija produkata razgradnje u medijumu.
Koncentracija ispitivane supstance treba da se meri u svakoj jedinki ribe koja je prethodno izmerena. Ako to nije moguće, koncentracija ispitivane supstance može se odrediti u objedinjenom uzorku, ali takvo određivanje smanjuje broj statističkih postupaka koji se mogu primeniti na date podatke. Ako se uzimaju u obzir specifični statistički postupak i statistička snaga, u ispitivanje se mora uključiti odgovarajući broj jedinki riba da bi se zadovoljili kriterijumi za željeni postupak analize objedinjenih uzoraka i za statistički značaj ispitivanja6, 7.
BCF se izražava u funkciji ukupne sveže mase, a za visoko lipofilne supstance i u funkciji sadržaja lipida. Sadržaj lipida u ribama određuje se pri svakom uzimanju uzoraka, ukoliko je to moguće. Za određivanje sadržaja lipida moraju se koristiti odgovarajuće metode (videti Deo četvrti8, 2 ove metode). Kao standardna metoda preporučuje se tehnika ekstrakcije hloroform/metanol9. Različite metode daju različite vrednosti10, pa je važno detaljno opisati primenjenu metodu. Analiza sadržaja lipida po mogućnosti se sprovodi u istom ekstraktu u kojem se meri i koncentracija ispitivane supstance, s obzirom na to da se lipidi često moraju ukloniti iz ekstrakta da bi se ekstrakt mogao analizirati metodom hromatografije. Sadržaj lipida u ribi (u mg/kg mokre težine) na kraju ispitivanja ne sme da se razlikuje za više od ± 25% u odnosu na sadržaj na početku ispitivanja. Mora se navesti i procenat suve materije tkiva da bi se omogućila konverzija vrednosti koncentracije lipida u funkciji sveže mase u koncentraciju lipida u funkciji suve mase.
Kriva unosa za ispitivanu supstancu dobija se grafičkim prikazom koncentracije ispitivane supstance u ili na ribi (ili određenim tkivima) u fazi unosa u funkciji vremena. Ako je kriva dostigla plato, odnosno ako je postala približno paralelna sa x-osom, BCFSS se izračunava formulom:
BCFSS = | Cf kao ravnotežno stanje (srednja vrednost) |
|
Cw kao ravnotežno stanje (srednja vrednost) |
|
Kad se ne dostigne ravnotežno stanje, moguće je izračunati BCFSS koji je dovoljno precizan za procenu rizika iz ravnotežnog stanja kao 80% (1,6/k2) ili 95% (3,0/k2) ekvilibrijuma.
Određuje se i BCFK kao odnos k1/k2, dve konstante kinetike prvog reda. Konstanta brzine eliminacije (k2) obično se određuje iz krive eliminacije (odnosno grafičkog prikaza smanjenja koncentracije ispitivane supstance u ribi u funkciji vremena). Zatim se izračunava konstanta brzine unosa (k1) s obzirom na k2 i vrednost Cf koja se određuje iz krive unosa (videti Deo šesti ove metode). Najbolji postupak za određivanje vrednosti BCFK i konstanti k1 i k2 je upotrebom računara korišćenjem metoda za procenu nelinearnih parametara11. Može se koristiti i grafički metod za izračunavanje k1 i k2. Ako kriva eliminacije očigledno nije kriva kinetike prvog reda, moraju se upotrebiti složeniji modeli (videti literaturu u Delu četvrtom ove metode) i potražiti savet statističara.
Treba biti oprezan prilikom tumačenja rezultata ispitivanja kada se izmerene koncentracije ispitivane supstance nalaze blizu limita detekcije primenjene analitičke metode.
Jasno definisane krive unosa i eliminacije su indikatori dobrog kvaliteta podataka. Razlika između vrednosti konstanti unosa/eliminacije za dve primenjene koncentracije ispitivane supstance treba da budu manje od 20%. U izveštaju o ispitivanju navode se i objašnjavaju opažene značajne razlike u brzinama unosa/eliminacije za dve primenjene koncentracije ispitivane supstance. Uobičajeno, intervali poverenja za vrednosti BCF iz dobro osmišljenog i izvedenog ispitivanja iznose oko ± 20%.
Izveštaj mora da sadrži sledeće podatke:
1) ispitivana supstanca:
- fizička priroda i ukoliko je relevantno, fizičke i hemijske osobine;
- podaci o hemijskoj identifikaciji (uključujući sadržaj organskog ugljenika, ukoliko je prikladno);
- ukoliko se ispituju obeležene supstance, tačan položaj radioaktivno obeleženih atoma i procenat radioaktivnosti povezan sa nečistoćama;
2) vrste koje se koriste u ispitivanju:
- latinski naziv, soj, poreklo, prethodni tretmani (ukoliko ih je bilo), aklimatizacija, uzrast, veličina jedinki, itd.
3) uslovi ispitivanja:
- primenjeni uslovi ispitivanja (npr. protočni ili semistatički);
- tip i svojstva primenjenog osvetljenja i trajanje fotoperioda;
- postavka ispitivanja (npr. broj i veličina akvarijuma, dinamika izmene medijuma u akvarijumima, broj ponavljanja, broj jedinki riba po ponavljanju, broj koncentracija ispitivane supstance, dužina trajanja faza unosa i eliminacije, učestalost uzimanja uzoraka ribe i vode);
- postupak pripreme osnovnih rastvora i učestalost izmene (ukoliko se koristi rastvarač za povećanje rastvorljivosti ispitivane supstance, mora se navesti koji rastvarač, njegova koncentracija i doprinos sadržaju ukupnom organskog ugljenika u medijumu);
- nominalne koncentracije ispitivane supstance, srednje vrednosti i standardne devijacije koncentracija izmerenih u akvarijumima i postupak kojim su određene;
- izvor vode za razblaživanje, opis svake prethodne obrade, rezultati bilo kog ispitivanja koji potvrđuje da jedinke ribe mogu da žive u toj vodi, kao i osobine vode: pH vrednost, tvrdoća, temperatura, koncentracija rastvorenog kiseonika, rezidijumi hlora (ukoliko je mereno), ukupni organski ugljenik, suspendovane materije, salinitet mediuma (ukoliko je primereno) i rezultati svih merenja koja su urađena u toku ispitivanja;
- kvalitet vode u akvarijumima, pH vrednost, tvrdoća, TOC, temperatura i koncentracija rastvorenog kiseonika;
- detaljni podaci o hranjenju (npr, vrsta hrane, poreklo, sastav - po mogućnosti, bar sadržaj lipida i proteina, količina hrane i učestalost hranjenja);
- podaci o obradi uzoraka ribe i vode, uključujući detalje o pripremi, čuvanju, ekstrakciji i analitičkim metodama (i preciznost) primenjenim na ispitivanoj supstanci i sadržaj lipida ukoliko je meren).
4) rezultati:
- rezultati svakog preliminarnog ispitivanja;
- smrtnost u kontrolnim i u svim ispitivanim grupama, kao i svako uočeno abnormalno ponašanje;
- sadržaj lipida u jedinkama ribe (ukoliko je određivano u toku ispitivanja);
- krive (uključujući sve podatke merenja) koje pokazuju unos i eliminaciju ispitivane supstance iz ribe i vreme do uspostavljanja ravnotežnog stanja;
- Cf i Cw (sa standardnom devijacijom i intervalima poverenja, ukoliko je primereno) za sva uzorkovanja (Cf izražen u µg/g mokre težine (ppm) cele ribe ili određenih tkiva ribe, npr. lipida, i Cw u mg/g (ppm). Cw vrednosti za kontrolu (vrednost fona se takođe mora navesti);
- BCFSS, odnosno BCFK, ukoliko je primenljivo, 95% intervali poverenja za konstante brzina unosa i eliminacije (sve izražene u odnosu na celu ribu, i ukupni sadržaj lipida ukoliko je izmeren, ribe ili određenih tkiva ribe), intervala poverenja i standardne devijacije (ukoliko se raspolaže tim podacima) i postupci izračunavanja/analize podataka za svaku koncentraciju ispitivane supstance;
- ako su korišćene obeležene supstance i ukoliko je zahtevano, može se prikazati akumulacija svih detektovanih metabolita;
- sva neobična opažanja u toku ispitivanja, sva odstupanja od ovde opisanih postupaka i sve ostale relevantne informacije;
Rezultati ispod limita detekcije ne koriste se za izračunavanje konstanti brzina.
1. Connell D.W. (1988) Bioaccumulation behaviour of persistent chemicals with aquatic organisms. Rev. Environ. Contam. Toxicol. 102, p. 117-156.
2. Bintein S., Devillers J. and Karcher W. (1993) Nonlinear dependence of fish bioconcentration on n-octanol/water partition coefficient. SAR and QSAR in Environmental Research, 1, p. 29-390.
3. OECD, Paris (1996) Direct Phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals. No 3.
4. Kristensen P. (1991) BioCOncentration in fish: Comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate organic matter to the bioavailability of chemicals. Water Quality Institute, Denmark.
5. US EPA 822-R-94-002 (1994) Great Lake Water Quality Initiative Technical Support Document for the Procedure to Determine Bioaccumulation Factors. July 1994.
6. US FDA, (Food and Drug Administration) Revision. Pesticide analytical manual, 1, 5600 Fisher‘s Lane, Rockville, MD 20852, July 1975.
7. US EPA (1974). Section 5, A(1) Analysis of Human or Animal Adipose Tissue, in Analysis of Pesticide Residues in Human and Environmental Samples, Thompson J.F. (ed.) Research Triangle Park, N.C. 27711.
8. COmpaan H. (1980) in ‘The determination of the possible effects of chemicals and wastes on the aquatic environment: degradation, toxicity, bioaccumulation’ Ch. 2.3, Part II. Government Publishing Office, The Hague, The Netherlands.
9. Gardner et al, (1995) Limn. & Oceanogr. 30, p. 1099-1105.
10. Randall R.C., Lee H., Ozretich R.J., Lake J.L. and Pruell R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Envir. Toxicol. Chem. 10, p. 1431-1436.
11. CEC, Bioconcentration of chemical substances in fish: the flow-through method-Ring Test Programme, 1984 to 1985. Final report March 1987. Authors: P. Kristensen and N. Nyholm.
12. ASTM E-1022-84 (Reapproved 1988) Standard
HEMIJSKE OSOBINE ODGOVARAJUĆE VODE ZA RAZBLAŽIVANJE
| Parametar | Granična koncentracija |
1 | Suspendovane materije | 5 mg/l |
2 | Ukupni organski ugljenik | 2 mg/l |
3 | Nejonizovani amonijak | 1 μg/l |
4 | Rezidijumi hlora | 10 μg/l |
5 | Ukupni organofosforni pesticidi | 50 ng/l |
6 | Ukupni organohlorni pesticidi plus PCB | 50 ng/l |
7 | Ukupni organski hlor | 25 ng/l |
8 | Aluminijum | 1 μg/l |
9 | Arsen | 1 μg/l |
10 | Hrom | 1 μg/l |
11 | Kobalt | 1 μg/l |
12 | Bakar | 1 μg/l |
13 | Gvožđe | 1 μg/l |
14 | Olovo | 1 μg/l |
15 | Nikl | 1 μg/l |
16 | Cink | 1 μg/l |
17 | Kadmijum | 100 ng/l |
18 | Živa | 100 ng/l |
19 | Srebro | 100 ng/l |
PREPORUČENE VRSTE RIBA ZA ISPITIVANJA
Preporučene vrste | Preporučeni opseg | Preporučena ukupna | |
1 | Danio rerioLXVI (Teleostei, Cyprinidae) (Hamilton-Buchanan), zebrica | 20 - 25 | 3,0 ± 0,5 |
2 | Pimephales promelas (Teleostei, Cyprinidae) | 20 - 25 | 5,0 ± 2,0 |
3 | Cyprinus carpio (Teleostei, Cyprinidae) | 20 - 25 | 5,0 ± 3,0 |
4 | Oryzias latipes (Teleostei, Poeciliidae) | 20 - 25 | 4,0 ± 1.0 |
5 | Poecilia reticulata (Teleostei, Poeciliidae) | 20 - 25 | 3,0 ± 1,0 |
6 | Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque) | 20 - 25 | 5,0 ± 2,0 |
7 | Oncorhynchus mykiss (Teleostei, Salmonidae) (Walbaum), kalifornijska pastrmka | 13 - 17 | 8,0 ± 4,0 |
8 | Gasterosteus aculeatus (Teleostei, Gasterosteidae) (Linnaeus) koljuška | 18 - 20 | 3,0 ± 1,0 |
Različite estuarske i morske vrste riba koje se koriste u drugim zemljama su: Leiostomus xanthurus, Cyprinodon variegatus, Menidia beryllina, Cymatogaster aggregata, Parophrys vetulus, Leptocottus armatus, Gasterosteus aculeatus, Dicentracus labrax i Alburnus alburnus.
PRIKUPLJANJE
Navedene vrste riba lako se razmnožavaju i uzgajaju. U mnogim delovima sveta ove vrste riba mogu se nabaviti u toku cele godine. Kako su navedene vrste pogodne i za uzgajanje u laboratorijskim uslovima, zdravstveno stanje i poreklo jedinki koje se koriste za ispitivanje je, uz kontrolu prisustva parazita i bolesti, uvek poznato.
PREDVIĐANJE TRAJANJA FAZA UNOSA I ELIMINACIJE
1. PREDVIĐANJE TRAJANJA FAZE UNOSA
Pre izvođenja ispitivanja, procena k2 i procena vremena potrebnog da se uspostavi ravnotežno stanje može se dobiti iz empirijskih odnosa između vrednosti k2 i koeficijenta raspodele u sistemu n-oktanol/voda (Pow) ili k2 i rastvorljivosti u vodi ispitivane supstance (s).
Procena k2 (dan-1) može se dobiti, npr. iz sledeće empirijske jednačine1:
log10k2 = -0.414 x log10 (Pow) + 1.47 x (r2 = 0.95) | (jednačina 1) |
Za ostale jednačine videti u literaturi2.
Ako podeoni koeficijent (Pow) nije poznat, može se napraviti procena3 na osnovu poznavanja rastvorljivosti ispitivane supstance u vodi koristeći jednačinu:
log10Pow = 0.862 x log10(s) + 0.710 x (r2 = 0.994) | (jednačina 2) |
pri čemu s jeste rastvorljivost (mol/l) : (n=36)
Ovi odnosi važe samo za supstance sa vrednostima log Pow između 2 i 6,54.
Vreme potrebno da se postigne određeni procenat ravnotežnog stanja može se dobiti iz opšte kinetičke jednačine koja opisuje unos i eliminaciju (kinetika prvog reda):
ili ako je vrednost Cw konstantna:
(jednačina 3)
_________
LXVI Meyer A., Orti G. (1993) Proc. Royal Society of London, Series B., Vol. 252, p. 231
Kad se približava dostizanje ravnotežnog stanja (t→∞), jednačina 3 može se svesti5, 6 na:
![]()
ili
Onda se iz izraza k1/k2×Cw može odrediti koncentracija ispitivane supstance u ribi pri ravnotežnom stanju (Cf,s).
Jednačina 3 može se pretvoriti u:
Cf = Cf,s x (1-e-k2t)
ili
(jednačina 4)
Primenom jednačine 4, vreme da se dostigne određeni procenat ravnotežnog stanja može se predvideti kad se k2 prethodno odredi koristeći jednačine 1 ili 2.
Kao smernica, statistički optimalno trajanje faze unosa za dobijanje statistički prihvatljivih podataka (BCFK) jeste period potreban da kriva koja predstavlja log-transformisane podatke za koncentraciju ispitivane supstance u funkciji vremena dostigne srednju tačku, ili 1,6/k2, ili 80% ravnotežnog stanja, ali ne više od 3,0/k2 ili 95% ravnotežnog stanja7.
Vreme potrebno da se dostigne 80% ravnotežnog stanja je (jednačina 4):
0,80 = 1-e-k2t80
ili
(jednačina 5)
Slično tome, vreme potrebno za dostizanje 95% ravnotežnog stanja je:
(jednačina 6)
Na primer, trajanje faze unosa (up) za ispitivanu supstancu sa log (Pow) = 4 bilo bi (primenom jednačina 1, 5 i 6):
log10k2 = -0,414.(4) + 1,47
k2 = 0,652 dana-1
up(80%) = 1,6/0,652 odnosno 2,45 dana (59 sati)
ili
up(95%) = 3,0/0,652 odnosno 4,6 dana (110 sati)
Slično tome, za ispitivanu supstancu sa s = 10-5 mol/L (log (s) = -5,0), trajanje faze unosa bilo bi (primenom jednačina 1,2,5,6):
log10(Pow) = -0,862 (-5,0) + 0,710 = 5,02
log10k2 = -0,414(5,02) + 1,47
k2 = 0,246 dana-1
up(80%) = 1,6/0,246 odnosno 6,5 dana (156 sati)
ili
up(95%) = 3,0/0,246 odnosno 12,2 dana(293 sata)
Alternativno tome, izraz:
teq = 6,45 x 10-3Pow + 55,31 (sati)
može se koristiti da se izračuna vreme potrebno za dostizanje efektivnog ravnotežnog stanja4.
2. PREDVIĐANJE TRAJANJA FAZE ELIMINACIJE
Predviđanje vremena potrebnog da se smanji koncentracija ispitivane supstance u organizmu koji se koristi u ovoj metodi do određenog procenta početne koncentracije može se dobiti i iz opšte jednačine koja opisuje unos i eliminaciju (kinetika prvog reda)1, 8.
Za fazu eliminacije, pretpostavlja se da je vrednost Cw nula. Jednačina se može redukovati na:
http://s1.paragraflex.rs/documents/Old/t/t2011_06/![]()
ili
Cf = Cf,o x e-k2t
pri čemu Cf,0 jeste koncentracija na početku perioda eliminacije. Eliminacija od 50% postiže se u vremenu t50:
ili
![]()
Slično tome, 95% eliminacija postiže se pri:
![]()
Ako se koristi 80% unosa za prvi period (1,6/k2) i 95% gubitka u fazi eliminacije (3,0/k2), onda faza eliminacije traje približno dva puta duže od faze unosa.
Ove procene se zasnivaju na pretpostavci da se procesi unosa i eliminacije mogu opisati kao kinetika prvog reda. Ukoliko se ne ponašaju po modelu kinetike prvog reda, moraju se koristiti složeniji modeli1.
1. Spacie A. and Hamelink J.L. (1982) Alternative models for describing the bioCOncentration of organics in fish. Environ. ToxiCOl. and Chem. 1, pp 309-320.
2. Kristensen P. (1991) BioCOncentration in fish: COmparison of BCF‘s derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Danish Water Quality Institute.
3. Chiou C.T. and Schmedding D.W. (1982) Partitioning of organic COmpounds in octanol-water systems. Environ. Sci. Technol. 16 (1), pp 4-10.
4. Hawker D.W. and COnnell D.W. (1988) Influence of partition COefficient of lipophilic COmpounds on bioCOncentration kinetics with fish. Wat. Res. 22 (6), pp 701-707.
5. Branson D.R., Blau G.E., Alexander H.C. and Neely W.B. (1975) Transactions of the American Fisheries Society, 104 (4), pp 785-792.
6. Ernst W. (1985) Accumulation in Aquatic organisms. In: Appraisal of tests to predict the environmental behaviour of chemicals. Ed. by Sheehman P., Korte F., Klein W. and Bourdeau P.H. Part 4.4 pp 243-255. SCOPE, 1985, John Wiley & Sons Ltd. N.Y.
7. Reilly P.M., Bajramovic R., Blau G.E., Branson D.R. and Sauerhoff M.W. (1977) Guidelines for the optimal design of experiments to estimate parameters in first order kinetic models, Can. J. Chem. Eng. 55, pp 614-622.
8. Könemann H. and Van Leeuwen K. (1980) ToxiCOkinetics in fish: Accumulation and Elimination of six Chlorobenzenes by Guppies. Chemosphere, 9, pp 3-19.
PRIMER UZORKOVANJA ZA ISPITIVANJE BIOKONCENTRACIJE ZA SUPSTANCE SA log Pow = 4
Uzorkovanje riba | Raspored uzimanja uzoraka | Broj uzoraka vode | Broj jedinki riba po uzorku | |
Najmanja potrebna učestalost (u danima) | Dodatno uzimanje uzoraka | |||
Faza unosa | -10 |
| 2LXVII | dodati 45-80 riba |
1. | 0,3 | 0,4 | 2 | 4 |
2. | 0,6 | 0,9 | 2 | 4 |
3. | 1,2 | 1,7 | 2 | 4 |
4. | 2,4 | 3,3 | 2 | 4 |
5. | 4,7 |
| 2 | 6 |
Faza eliminacije |
|
|
| Prenos jedinki u akvarijum sa čistim medijumom |
6. | 5,0 | 5,3 |
| 4 |
7. | 5,9 | 7,0 |
| 4 |
8. | 9,3 | 11,2 |
| 4 |
9. | 14,0 | 17,5 |
| 6 |
LXVII Uzorak vode nakon minumum tri zamene kompletne zapremine akvarijuma. Vrednosti u zagradama su broj uzoraka (vode, riba) koji će se uzeti ukoliko je potrebno dodatno uzorkovanje.
Napomena: Prethodna procena k2 za log Pow od 4,0 je 0,652 dana-1. Ukupno trajanje ispitivanja postavljeno je na 3 x up = 3 x 4,6 dana, odnosno 14 dana. Za procenu "up" videti Deo četvrti ove metode.
Većina podataka dobijenih iz ispitivanja biokoncentracije može se dobro opisati pomoću jednostavnog dvoparametarskog modela, što se vidi iz linearizovane krive za vrednosti koncentracija ispitivane supstance u ribi u toku faze eliminacije, kad se grafički prikaže na semi-logaritamskom papiru. (kada se ova kriva ne može linearizovati, moraju se upotrebiti složeniji modeli1).
Grafički postupak za određivanje konstante brzine eliminacije (gubitka) k2
Koncentracija ispitivane supstance izmerena u svakom uzorku ribe grafički se prikazuje u funkciji vremena uzimanja uzorka na semi-logaritamskom papiru. Nagib te prave je k2.
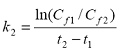
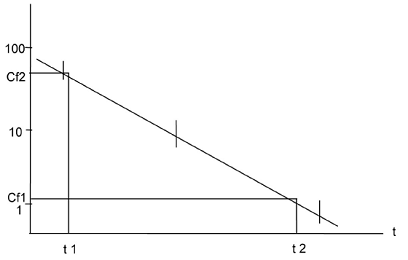
Napomena: Odstupanja od prave linije mogu ukazivati na to da se proces eliminacije ponaša po modelu koji je složeniji od kinetike prvog reda.
Grafički postupak može se primeniti za određivanje konstante brzine eliminacije kada dati proces odstupa od modela kinetike prvog reda.
Grafički postupak za određivanje konstante brzine unosa k1
Kad je poznata vrednost k2, k1 se izračunava na sledeći način:
![]()
(jednačina 1)
Vrednost Cf očitava se iz srednje tačke platoa krive unosa koja se dobija kad se log-transformisani podaci za koncentraciju grafički prikažu u funkciji vremena.
Kompjuterski postupak za izračunavanje konstanti brzina unosa i eliminacije (gubitka)
Najbolji način određivanja faktora biokoncentracije i konstante brzina k1 i k2 jeste da se koriste računar i metoda procene nelinearnih parametara. Ovakvi kompjuterski programi izračunavaju vrednosti za k1 i k2 na osnovu niza podataka o koncentracijama ispitivane supstance i sledećeg modela:
![]()
[jednačina 2]
![]()
[jednačina 3]
pri čemu tc jeste vreme na kraju faze unosa.
Ovakav pristup omogućava određivanje standardne devijacije za k1 i k2.
U većini slučajeva k2 se može proceniti iz krive eliminacije sa relativno visokom preciznošću, pa s obzirom na to da postoji jaka korelacija između parametara k1 i k2, ako se procenjuju istovremeno, savetuje se da se prvo izračuna k2 samo iz podataka iz faze eliminacije, a nakon toga da se izračuna k1 iz podataka iz faze unosa pomoću nelinearne regresione analize.
C.14. ISPITIVANJE RASTA RIBLJE MLAĐI
Metoda se zasniva na OECD TG 215 (2000) uputstvu ispitivanja.
Metoda ispitivanja osmišljena je za procenu efekta na rast nakon produženog izlaganja riblje mlađi hemikalijama. Bazira se na metodi, koja je razvijena i ispitana međulaboratorijskim ispitivanjem1, 2, za procenu efekta hemikalija na rast riblje mlađi kalifornijske pastrmke u protočnim uslovima. Mogu se koristiti i druge dobro opisane vrste. Postoje iskustva sa ispitivanjem rasta vrste DaniorerioLXVIII (zebrica)3, 4 i Oryziaslatipes5, 6, 7.
Videti i opšti uvod Priloga 3.
Najniža koncentracija koja dovodi do značajnih efekata (u daljem tekstu: LOEC) jeste najniža koncentracija ispitivane supstance pri kojoj je opažen značajan učinak (pri p < 0,05) u poređenju sa kontrolom. Sve ispitivane koncentracije iznad LOEC moraju imati štetne efekte jednake ili veće od onih opaženih pri LOEC.
Koncentracija koja ne dovodi do značajnog efekta (u daljem tekstu: NOEC) jeste koncentracija neposredno ispod LOEC.
ECx u ovoj metodi ispitivanja jeste koncentracija ispitivane supstance koja dovodi do x% promene u brzini rasta ribe u poređenju sa kontrolama.
Nasad jeste sveža masa riba po zapremini vode.
Gustina nasada jeste broj jedinki riba po zapremini vode.
Specifična brzina rasta pojedine ribe jeste brzina rasta jedinke u odnosu na njenu početnu težinu.
Prosečna specifična brzina rasta po komori za ispitivanje jeste srednja brzina rasta populacije riba u akvarijumu u jednom tretmanu (koncentraciji).
Pseudospecifična brzina rasta jeste pojedinačna brzina rasta u poređenju sa srednjom vrednošću početne težine populacije riba u akvarijumu.
Riblja mlađ u ekponencijalnoj fazi rasta se nakon merenja stavlja u komore za ispitivanje i izlaže opsegu subletalnih koncentracija ispitivane supstance rastvorene u vodi po mogućnosti u protočnim uslovima, ili ukoliko to nije moguće, u odgovarajućim polustatičnom sistemu (uz potpuno periodično obnavljanje ispitivanog medijuma). Ispitivanje traje 28 dana. Riba se svakodnevno hrani. Količina hrane određuje se na osnovu početne težine ribe i može se proračunati nakon 14 dana. Riba se ponovno meri na kraju ispitivanja. Efekti na stopu rasta analiziraju se pomoću regresionog modela da bi se procenila koncentracija koja je dovela do x % promene u stopi rasta, tj. ECx (npr. EC10, EC20, ili EC30). Alternativno, podaci se mogu porediti sa kontrolnim vrednostima da bi se odredila najniža koncentracija koja dovodi do značajnog efekta, a zatim i koncentracija koja ne dovodi do značajnog efekta.
1.4. PODACI O ISPITIVANOJ SUPSTANCI
Treba imati podatke o akutnoj toksičnosti (vidi metodu ispitivanja C.1) iz ispitivanja urađenom, po mogućnosti, na istoj vrsti riba. To znači da je poznata rastvorljivost u vodi i napon pare ispitivane supstance i da postoji pouzdani analitički postupak za kvantifikaciju supstance u rastvoru sa poznatom i dokumentovanom preciznošću i granicom detekcije.
Korisni podaci su i strukturne formule, čistoća supstance, stabilnost u vodi i na svetlu, pKa, Pow i rezultati ispitivanja brze biorazgradljivosti (vidi metodu ispitivanja C.4).
1.5. PRIHVATLJIVOST ISPITIVANJA
Da bi ispitivanje bilo prihvatljivo, treba da se zadovolje sledeći uslovi:
- smrtnost u kontrolama ne sme premašiti 10% na kraju ispitivanja
- porast srednje težine riba iz kontrolne grupe mora biti dovoljan da omogući detekciju minimalne varijacije stope rasta koja se smatra značajnom. Rezultati međulaboratorijskog ispitivanja2 sa kalifornijskom pastrmkom pokazali su da se u toku 28 dana srednja vrednost težine ribe u kontrolama mora povećati najmanje za polovinu (odnosno 50%) srednje vrednosti njihove početne težine; npr. 1 g/riba (= 100%), konačna težina nakon 28 dana: > 1,5 g/riba (> 150%);
____________
LXVIII Meyer, A., Bierman, C.H. and Orti, G. (1993). The phylogenetic position of the zebrafish (Danio rerio), a model system in developmental biology: an invitation to the comparative method. Proc. R. Soc. Lond. B. 252, 231-236.
- koncentracija rastvorenog kiseonika mora biti najmanje 60% vrednosti zasićenja vazduha (air saturation value, u daljem tekstu: ASV) u toku čitavog ispitivanja;
- temperatura vode u ispitivanim akvarijumima ne sme međusobno da se razlikuje za više od ± 1 °C u bilo kom trenutku u toku ispitivanja i treba da se održava unutar opsega ± 2 °C u okviru preporučenog opsega temperature za ispitivanu vrstu (videti Deo drugi ove metode).
1.6.1. Oprema
U ovoj metodi ispitivanja koristi se uobičajena laboratorijska oprema, a pogotovo:
- oksimetar i pH-metar;
- oprema za određivanje tvrdoće vode i alkaliteta;
- odgovarajuća oprema za kontrolu temperature i po mogućnosti kontinuirani nadzor;
- komore za ispitivanje od hemijski inertnog materijala i pogodnog kapaciteta shodno preporučenom nasadu i gustini nasada (videti odeljak 1.8.5. i Deo drugi ove metode);
- precizna vaga (tačnost ± 0,5%).
1.6.2. Voda
U ispitivanju se može koristiti svaka voda u kojoj ispitivana vrsta pokazuje zadovoljavajuće preživljavanje i rast u dužem vremenskom periodu. Voda mora da bude stalnog kvaliteta u toku čitavog trajanja ispitivanja. Vrednost pH vode treba da bude unutar opsega od 6,5 do 8,5 i u toku svakog konkretnog ispitivanja da bude unutar opsega od (0,5 pH jedinica. Preporučuje se tvrdoća iznad 140 mg/l CaCO3). Da bi se predupredio prekomeran uticaj vode za razblaživanje na rezultate ispitivanja (npr. kompleksiranjem ispitivane supstance), treba uzimati uzorke za analizu u određenim intervalima. Sadržaj teških metala (npr. Cu, Pb, Zn, Hg, Cd i Ni), glavnih anjona i katjona (npr. Ca, Mg, Na, K, Cl i SO4), pesticida (ukupni organofosforni i organohlorni pesticidi) ukupnog organskog ugljenika i suspendovanih materija treba odrediti svaka tri meseca ako se zna da je voda za razblaživanje relativno stalnog kvaliteta. Ako je voda pokazala konstantan kvalitet u toku prethodnih godinu dana, analize mogu da se rade ređe, a intervali mogu biti duži (svakih 6 meseci). Neke prihvatljive hemijske osobine vode za razblaživanje navedene su u Delu drugom ove metode.
1.6.3. Rastvori ispitivanih supstanci
Rastvori odabranih koncentracija test supstance pripremaju se razblaživanjem osnovnog rastvora.
Osnovni rastvor bi, po mogućnosti, trebalo pripremiti jednostavnim mešanjem ili mućkanjem ispitivane supstance u vodi mehaničkim putem (npr. mešanjem ili ultrazvučno). Za pripremu odgovarajućeg koncentrovanog osnovnog rastvora mogu se koristiti kolone zasićenja (kolone rastvorljivosti).
U nekim slučajevima je potrebno korišćenje rastvarača ili disperzionog sredstva (sredstva za povećanje rastvorljivosti) da bi se pripremio osnovni rastvor odgovarajuće koncentracije. U pogodne rastvarače ubrajaju se aceton, etanol, metanol, dimetilsulfoksid, dimetilformamid i trietilenglikol. Pogodna sredstva za disperziju su Cremophor RH40, Tween 80, metilceluloza 0,01% i HCO-40. Potreban je oprez pri korišćenju lako biorazgradljivih sredstava (npr. acetona), odnosno visoko isparljivih jedinjenja, jer mogu stvoriti probleme sa povećanjem broja bakterija u protočnim uslovima. Ako se koristi sredstvo za povećanje rastvorljivosti, ono ne sme imati značajne efekte na rast riba ni vidljive štetne efekte na riblju mlađ, što se može utvrditi kontrolnim tretmanom u kome se ribe izlažu samo dejstvu rastvarača.
Kod ispitivanja u protočnim uslovima potreban je sistem koji kontinuirano otpušta i razređuje osnovni rastvor ispitivane supstance (npr. merna pumpa, sistem za proporcionalno razblaživanje, sistem za regulaciju zasićenja) da bi se u ispitivane akvarijume dostavila serija različitih koncentracija. Tokom ispitivanja, protok osnovnih rastvora i vode za razblaživanje mora se proveravati u određenim intervalima, po mogućnosti svakog dana, i ne sme varirati više od 10% u toku čitavog ispitivanja. Rezultati međulaboratorijskog ispitivanja2 pokazali su da je 6 L po gramu ribe na dan prihvatljiva učestalost uklanjanja vode za kalifornijsku pastrmku u toku ispitivanja (videti deo 1.8.2.2).
Kod ispitivanja u polustatičnom sistemu (sa kompletnim periodičnim obnavljanjem medijuma), učestalost obnavljanja medijuma zavisi od stabilnosti ispitivane supstance, ali se preporučuje dnevno obnavljanje. Ako preliminarna ispitivanja stabilnosti (videti odeljak 1.4) pokažu da koncentracija ispitivane supstance nije stalna (odnosno nalazi se izvan opsega 80% do 120% nominalne koncentracije ili pada ispod 80% izmerene početne koncentracije) u toku perioda obnove, ispitivanje bi trebalo uraditi u protočnom sistemu.
1.6.4. Izbor vrste za ispitivanje
Za ispitivanje se preporučuje kalifornijska pastrmka, jer je na ovoj vrsti1, 2 dobijeno najviše podataka u međulaboratorijskim ispitivanjima. Mogu se koristiti i druge dobro opisane vrste, ali se u tom slučaju postupak ispitivanja mora prilagoditi da bi se stvorili pogodni uslovi ispitivanja. Postoje iskustva sa ispitivanjem rasta vrste Daniorerio (zebrica)3, 4 i Oryziaslatipes5, 6, 7. Kada se u ispitivanju koriste druge vrste, mora se navesti razlog za njihov izbor, kao i za izbor metode ispitivanja.
1.6.5. Uzgoj ribe
Jedinke se biraju iz populacije riba iz istog uzgoja, po mogućnosti iz istog mresta i uzgajaju najmanje dve nedelje pre ispitivanja u uslovima sličnim onima koji se koriste u ispitivanju, prvenstveno u pogledu kvaliteta vode i osvetljenja. Riba se mora hraniti minimalnim obrocima koji iznose 2% telesne težine dnevno, a ako je moguće 4% telesne težine dnevno u toku celog perioda uzgoja i ispitivanja.
Nakon 48 sati privikavanja, zapisuje se kolika je smrtnost i primenjuju se kriterijumi:
- ako je smrtnost iznad 10% populacije u roku od 7 dana, čitava serija se odbacuje;
- ako je smrtnost između 5% i 10% populacije, riba se aklimatizuje dodatnih 7 dana;
- ako je smrtnost veća od 5% u toku sledećih 7 dana, čitava serija se odbacuje;
- ako je smrtnost manja od 5% populacije u 7 dana, prihvata se čitava serija.
Dve nedelje pre, kao ni u toku ispitivanja riba se ne sme lečiti od bolesti.
"Postavka ispitivanja" odnosi se na izbor broja i razmaka u seriji ispitivanih koncentracija, broj akvarijuma sa svakom pojedinom koncentracijom i broj riba po akvarijumu. U idealnom slučaju, ispitivana postavka se bira na osnovu:
- cilja ispitivanja;
- statističke analize koja će se koristiti;
- raspoloživosti i cene ispitivanih resursa.
U opisu cilja ispitivanja treba precizirati statističku snagu pri kojoj treba odrediti minimalnu statistički značajnu razliku izabranog parametra (npr. brzina rasta) ili zahtevanu preciznost pri proceni ECx (npr. sa x = 10, 20 ili 30, po mogućnosti ne manji od 10). Bez toga se ne može tačno preporučiti obim ispitivanja.
Postupak ispitivanja koji je optimalan (jer najbolje iskorišćava resurse) pri primeni jedne metode statističke analize, nije nužno optimalan za drugu vrstu statističke analize. Preporučeni postupak ispitivanja za procenu LOEC/NOEC nije isti kao postupak koji se preporučuje za regresionu analizu.
U većini slučajeva, regresiona analiza ima prednost nad analizom varijanse8. Kad se ne može pronaći odgovarajući regresijski model (p2< 0,9) koristi se NOEC/LOEC.
1.7.1. Postavka ispitivanja za regresionu analizu
Pri postavci ispitivanja čiji će rezultati biti analizirani regresionim modelima moraju se uzeti u obzir sledeći važni aspekti:
- efektivna koncentracija (npr. EC10,20,30) i opseg koncentracija u kom se javlja efekat ispitivane supstance koji nas zanima mora da se nalazi unutar opsega koncentracija koje se primenjuju u ispitivanju. Najveća preciznost kojom se može proceniti efektivna koncentracija postiže se kad se efektivna koncentracija nalazi u sredini opsega koncentracija koje se koriste u ispitivanju. Preliminarno ispitivanje u cilju određivanja opsega koncentracija može pomoći u izboru odgovarajuće serije ispitivanih koncentracija;
- postavlja se najmanje jedna kontrolna i pet dodatnih komora za ispitivanje sa različitim koncentracijama da bi se omogućilo zadovoljavajuće statističko modelovanje. U slučajevima kad se koristi sredstvo za povećanje rastvorljivosti, uz seriju akvarijuma sa ispitivanom supstancom potrebno je postaviti jednu kontrolu koja sadrži sredstvo za povećanje rastvorljivosti u najvišoj test koncentraciji (videti odeljke 1.8.3. i 1.8.4. ove metode);
- mogu se koristiti odgovarajući geometrijske ili logaritamske serije9 (videti Deo četvrti ove metode). Prednost se daje logaritamskoj raspodeli koncentracija ispitivane supstance;
- ako je na raspolaganju više od šest komora za ispitivanje, dodatne se koriste za ponavljanje, ili se raspodeljuju unutar opsega koncentracija ispitivane supstance, kako bi razlika između pojedinih koncentracija bila manja. Obe mere su podjednako dobre.
1.7.2. Postavka ispitivanja za procenu NOEC/LOEC pomoću analize varijanse (ANOVA)
Za svaku ispitivanu koncentraciju, ako je moguće, treba postaviti po dve komore za ispitivanje sa istom koncentracijom ispitivane supstance, a statistička analiza se radi na nivou komore10. Ako se ne koriste ponavljanja (replike), ne sme postojati nikakva varijabilnost između komora za ispitivanje osim varijabilnosti na nivou jedinki. Iskustvo je pokazalo11 da je u konkretnom slučaju varijabilnost između komora bila vrlo mala u poređenju sa varijabilnošću unutar komora (tj. između jedinki u jednoj komori), pa je statistička analiza koja se radi na nivou jedinke u testu relativno prihvatljiva alternativa.
Obično se koristi najmanje pet test koncentracija u geometrijskoj seriji sa faktorom koji po mogućnosti nije veći od 3,2.
Kada se izvodi ispitivanje u duplikatu, broj replika kontrolne grupe, samim tim i broj riba, treba da bude dvostruko veći od broja koji se koristi za svaku ispitivanu koncentraciju, a koje treba da budu iste veličine12, 13, 14. Kad nema replika, broj jedinki u kontrolnoj grupi treba da bude isti kao i broj jedinki za svaku ispitivanu koncentraciju.
Ako se analiza varijanse (Analysis of Variance, u daljem tekstu: ANOVA) radi na nivou komore, a ne na bazi jedinke, što povlači označavanje pojedinih riba ili upotrebu pseudo specifičnih brzina rasta (videti odeljak 2.1.2. ove metode), treba postaviti dovoljan broj duplikata komora da bi se omogućilo određivanje standardne devijacije između komora unutar ispitivane koncentracije. To znači da stepeni slobode10 za grešku u analizi varijanse treba da iznose najmanje 5. Ako se postave samo duplikati kontrola, postoji opasnost od pomaka varijabilnosti greške, jer se ona može povećavati kako se povećava srednja vrednost brzine rasta. S obzirom na to da će se brzina rasta najverovatnije smanjivati sa povećanjem koncentracije, postoji mogućnost da se varijabilnost preceni.
1.8.1. Odabir i merenje ispitivanih jedinki riba
Važno je svesti na minimum varijacije u težini ribe na početku ispitivanja. Odgovarajući opseg veličine za različite vrste riba preporučene za upotrebu u ovoj metodi ispitivanja navedeni su u Delu drugom ove metode. Za čitavu seriju jedinki riba upotrebljenih u ispitivanju, težina jedinki na početku ispitivanja u idealnom slučaju treba da bude unutar opsega od ± 10% aritmetičke sredine težine i ni u kom slučaju ne sme da premaši 25%. Preporučuje se merenje poduzorka jedinki riba pre ispitivanja da bi se procenila srednja težina.
Populacija ribe iz istog uzgoja namenjena za ispitivanje ne sme se hraniti 24 sata pre ispitivanja. Jedinke se zatim biraju slučajnim izborom. Primenom opšte anestezije (npr. vodeni rastvor 100 mg/l trikain-metan sulfonata (MS 222) neutralisanog dodatkom dva dela natrijum-bikarbonata na jedan deo MS 222), svaka jedinka se izmeri i odredi joj se sveža masa (riba se prethodno obriše da se ukloni suvišna voda) sa tačnošću koja je navedena u Delu drugom ove metode. Ribe čija se telesna težina nalazi unutar odabranog opsega zadrže se i zatim nasumično raspoređuju u komore za ispitivanje. Zapisuje se ukupna sveža masa riba u svakojkomori. Upotreba anestetika kao i manipulacija ribom (uključujući brisanje i merenje) može prouzrokovati stres i ozlede riblje mlađi, posebno kod vrsta riba koje su male veličine. Ribljom mlađi se mora rukovati pažljivo da bi se izbegao stres i povreda životinja uključenih u ispitivanje.
Riba se ponovno meri 28. dana ispitivanja (videti odeljak 1.8.6. ove metode). Ako se smatra da je neophodno preračunati količinu hrane, riba se može ponovno meriti i 14. dana ispitivanja (videti odeljak 1.8.2.3. ove metode). Za određivanje promene u veličini ribe prema kojoj će se prilagoditi obroci hrane mogu se koristiti i drugi postupci, kao što je fotografska metoda.
1.8.2. Uslovi izlaganja
1.8.2.1. Dužina
Ispitivanje traje ≥ 28 dana.
1.8.2.2. Nasad i gustina nasada
Važno je da nasad i gustina nasada odgovaraju vrsti riba koja se koristi u ispitivanju (videti Deo drugi ove metode). Ako je gustina nasada previsoka, nastupiće stres zbog prenaseljenosti, koji može prouzrokovati smanjene brzine rasta i stvoriti mogućnost za razvoj bolesti. Ako je gustina nasada preniska, može izazvati teritorijalno ponašanje u riba, koje može da utiče na rast. Nasad treba da bude dovoljno nizak da se koncentracija rastvorenog kiseonika može održavati bez aeracije na nivou od najmanje 60% ASV. Međulaboratorijsko ispitivanje pokazalo je da prihvatljiva gustina nasada za kalifornijsku pastrmku iznosi 16 jedinki od 3 g do 5 g na zapreminu od 40 litara. Preporučena učestalost uklanjanja vode u toku ispitivanja je 6 L po gramu ribe na dan.
1.8.2.3. Ishrana
Riba se hrani odgovarajućom vrstom hrane (videti Deo drugi ove metode) i zadovoljavajućom količinom hrane koja omogućava prihvatljivu brzinu rasta. Ne sme doći do rasta mikroorganizama i zamućivanja vode. Za kalifornijsku pastrmku, brzina od 4% njihove telesne težine po danu verovatno će zadovoljiti ove uslove2, 15,16, 17. Dnevni obrok može da se podeli u dva jednaka dela i da se da ribama u dva obroka dnevno, u razmaku od najmanje 5 sati. Obrok se bazira na početnoj ukupnoj težini ribe u pojedinačnom akvarijumu. Ako se riba ponovno meri 14. dana, obrok se preračunava. Hranu ribama treba uskratiti 24 sata pre merenja.
Nepojedena hrana i fekalni sadržaj moraju se svakodnevno uklanjati iz akvarijuma pažljivim čišćenjem dna svakog akvarijuma i to pomoću usisavanja.
1.8.2.4. Svetlost i temperatura
Svetlosni režim i temperatura vode moraju odgovarati vrsti ribe koja se koristi u ispitivanju (videti Deo drugi ove metode).
1.8.3. Koncentracije ispitivane supstance
Obično je potrebno pet različitih koncentracija ispitivane supstance bez obzira na ispitivanu postavku (videti odeljak 1.7.2. ove metode). Prethodno poznavanje toksičnosti ispitivane supstance (npr. iz ispitivanja akutne toksičnosti, odnosno iz preliminarnog ispitivanja za određivanje opsega koncentracija) može da pomogne u izboru odgovarajućih uslova ispitivanja. Ako se ispitivanje obavlja u manje od pet koncentracija, navodi se objašnjenje. Najviša koncentracija test supstance ne sme da bude veća od granice rastvorljivosti supstance u vodi.
Kad se koristi sredstvo za povećanje rastvorljivosti kao pomoć u pripremi osnovnog rastvora, konačna koncentracija tog sredstva ne sme da bude veća od 0,1 ml/l i treba ako je moguće da bude ista u svim komorama za ispitivanje (videti odeljak 1.6.3. ove metode). Treba izbegavati upotrebu takvih sredstava kad god je moguće.
1.8.4. Kontrole
Broj kontrola sa vodom za razblaživanje zavisi od ispitivane postavke (videti odeljak 1.7. do 1.7.2. ove metode). Ako se koristi sredstvo za povećanje rastvorljivosti, mora se postaviti onoliko kontrola sa sredstvom za povećanje rastvorljivosti koliko ima kontrola sa vodom za razblaživanje.
1.8.5. Učestalost analitičkih određivanja i merenja
Tokom ispitivanja, koncentracije ispitivane supstance određuju se u regularnim intervalima.
U protočnom sistemu, protok razblaživača i toksični osnovni rastvori moraju se kontrolisati u određenim intervalima, ako je moguće svakog dana. Ne smeju da variraju više od 10% u toku čitavog ispitivanja. Gde se očekivane koncentracije ispitivane supstance nalaze unutar ± 20% nominalnih vrednosti (tj. unutar opsega 80% do 120%, videti odeljke 1.6.2. i 1.6.3. ove metode), preporučuje se da se analiziraju najmanje najviša i najniža koncentracija na početku ispitivanja i nakon toga u nedeljnim intervalima. U slučajevima kada se ne očekuje da će koncentracija ostati unutar ± 20% nominalne (na osnovu podataka o stabilnosti test supstance), moraju se analizirati sve ispitivane koncentracije, ali prema istom rasporedu.
U polustatičnom sistemu (sa potpunim periodičnim obnavljanjem medijuma) u kojima se očekuje da će koncentracija ispitivane supstance ostati unutar ± 20% nominalne vrednosti, preporučuje se da se analiziraju barem najviša i najniža koncentracija neposredno nakon pripreme i neposredno pre obnavljanja na početku ispitivanja, a nakon toga jednom nedeljno. U slučajevima kada se ne očekuje da će koncentracija ispitivane supstance biti unutar ± 20% nominalne, sve koncentracije moraju se analizirati po istom postupku i rasporedu kakvi se koriste za stabilnije materije.
Preporučuje se da se rezultati baziraju na izmerenim koncentracijama. Ako je dokazano da se koncentracija ispitivane supstance u rastvoru održavala unutar ± 20% nominalne ili izmerene početne koncentracije u toku čitavog trajanja ispitivanja, rezultati se mogu bazirati na nominalnim ili izmerenim vrednostima.
Uzorci možda moraju da se filtriraju (npr. korišćenjem veličine pora od 0,45 µm) ili centrifugiraju. Preporučuje se centrifugiranje. Ako se ispitivani materijal ne adsorbuje na filtere, filtracija može d bude prihvatljiv postupak.
Rastvoreni kiseonik, pH i temperatura moraju se meriti u svim komorama u toku ispitivanja. Ukupna tvrdoća, alkalitet i salinitet (ukoliko je relevantan) moraju se meriti u kontrolama i jednoj komori za ispitivanje sa najvišom koncentracijom. Rastvoreni kiseonik i salinitet (ukoliko je relevantan) mere se najmanje tri puta (na početku, sredini i kraju ispitivanja). Kod ispitivanja u polustatičkim uslovima, preporučuje se češće merenje rastvorenog kiseonika, po mogućnosti pre i nakon svakog obnavljanja vode ili najmanje jednom nedeljno. Vrednost pH se meri na početku i kraju svakog obnavljanja vode u ispitivanoj postavci sa statičkim obnavljanjem i najmanje jednom nedeljno u protočnim uslovima. Tvrdoća i alkalitet se mere jednom u toku svakog ispitivanja. Temperatura se, ako je moguće, neprekidno prati u najmanje jednoj komori.
1.8.6. Opažanja
Prati se težina riba. Na kraju ispitivanja, sva preživela riba mora se izmeriti i mora se odrediti sveža masa (nakon brisanja suvišne vode) izraženo za celu grupu riba po komori ili za jedinku. Merenje riba po grupama iz pojedinačnih komora ima prednost nad merenjem pojedinačnih jedinki, jer ovaj drugi način zahteva da riba bude pojedinačno označena. U slučaju merenja težine pojedine ribe da bi se odredila specifična stopa rasta ribe, odabrana tehnika označavanja ne sme da izazove stres kod ispitivanih jedinki (pogodna alternativa hladnom žigosanju je korišćenje tankog pecaroškog kanapa u boji).
Riba se u toku trajanja ispitivanja mora svakodnevno pregledati, a sve spoljašnje abnormalnosti (kao što su krvarenje, promena boje) i abnormalno ponašanje moraju se zabeležiti. Beleži se i smrtnost, a mrtvu ribu što pre treba ukloniti iz komora. Mrtva riba se ne zamenjuje živom, jer su nasad i gustina nasada dovoljne da promena u broju jedinki u komori neće imati nikakve efekte na rast. Količinu hrane treba prilagoditi.
Preporučljivo je uključiti statističara u proces izbora ispitivane postavke i analizu podataka, s obzirom da su ovom metodom ispitivanja dopuštene značajne varijacije u izvođenju, npr. u broju komora, ispitivanih koncentracija, riba, itd. S obzirom na opcije koje stoje na raspolaganju u smislu ispitivane postavke, ovde se ne daju posebne smernice u pogledu statističkih postupaka.
Brzine rasta se ne izračunavaju za komore u kojima je smrtnost veća od 10%. Stopa smrtnosti navodi se za sve ispitivane koncentracije.
Bilo koji postupak da se koristi za analizu podataka, uvek se određuje posebna brzina rasta r između vremena t1 i vremena t2. Može se definisati na nekoliko načina, u zavisnosti od toga da li je riba bila pojedinačno označena ili se traži prosek po komori.
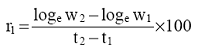
![]()
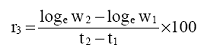
pri čemu:
r1 jeste specifična brzina rasta pojedine ribe;
r2 jeste prosečna brzina rasta specifična za komoru;
r3 jeste "pseudo" specifična brzina rasta;
w1 i w2 jesu težine određene ribe u vremenu t1 odnosno vremenu t2;
logew1 jeste logaritam težine pojedine ribe na početku ispitivanja;
logew2 jeste logaritam težine pojedine ribe na kraju ispitivanja;
logew1 jeste prosek logaritaskih vrednosti w1 za ribu u komori na početku ispitivanja;
logew2 jeste prosek logaritamskih vrednosti w2 za ribu u komori na kraju ispitivanja;
t1 i t2 jesu vreme (dani) na početku i kraju ispitivanog perioda.
r1, r2 i r3 mogu se izračunati za period od 0 do 28 dana i, ukoliko je primereno (tj. kad se radilo merenje 14. dana) za periode od 0 do 14 i od 14 do 28 dana.
2.1.1. Regresiona analiza rezultata (modelovanje odgovora na koncentraciju)
Ovom metodom analize utvrđuje se pogodan matematički odnos između specifične brzine rasta i koncentracije, što omogućava procenu ECx, tj. svake tražene EC vrednosti. Pomoću ovog postupka, nije potrebno izračunavati r za svaku pojedinu ribu (r1), već se analiza može bazirati na proseku komora za ispitivanje r (r2). Prednost se daje drugom postupku, koji više odgovara i u slučaju upotrebe najmanjih vrsta.
Prosek specifične brzine rasta za komoru (r2) mora grafički da se prikaže u odnosu na koncentraciju, da bi se utvrdila dozna zavisnost.
Da bi se izrazio odnos između r2 i koncentracije, mora se izabrati odgovarajući model, a izbor određenog modela mora se argumentovati na odgovarajući način.
Ako se broj preživelih jedinki riba razlikuje od jedne do druge komore, model se mora adaptirati, tako da se pondiranjem prevaziđe problem nejednake veličine grupa.
Postupak adaptacije na model mora omogućiti procenu, npr. EC20 i njenog rasipanja (standardne greške ili intervala poverenja). Grafik adaptacije na model treba da se prikaže u odnosu na podatke, tako da se može videti da je adaptacija na model bila primerena8, 18, 19, 20.
2.1.2. Analiza rezultata za procenu LOEC
Ako su u ispitivanju korišćeni duplikati komora za svaku ispitivanu koncentraciju, procena LOEC se može bazirati na ANOVA prosečne specifične stope rasta riba po komori (videti odeljak 2.1. ove metode). Nakon ove analize može slediti odgovarajući postupak12, 13, 14, 21 poređenja prosečnog r za svaku koncentraciju sa prosečnim r za kontrole, da se identifikuje najniža koncentracija pri kojoj postoji značajna razlika na nivou verovatnoće od 0,05. Ako nisu zadovoljene potrebne pretpostavke za parametarsku statistiku - nenormalna distribucija ili heterogena varijansa, pre ANOVA podaci se mogu transobrazovati da bi se homogenizovale varijanse ili se može uraditi pondirana ANOVA.
Ako u ispitivanju nisu korišćeni duplikati komora za svaku koncentraciju, ANOVA na bazi podataka za celu komoru neće biti osetljiva ili je neće biti moguće uraditi. Kompromis je da se uradi ANOVA na "pseudo" specifičnim stopama rasta r3 za pojedinačne jedinke riba.
Prosečni r3 za svaku koncentraciju može se zatim porediti sa prosečnim r3 za svaku kontrolu. LOEC se može identifikovati kao i ranije. Mora se istaći da ovaj postupak ne trpi, niti sprečava, varijabilnost između komora, osim varijabilnosti koja postoji zbog varijabilnosti između pojedinih jedinki riba. Iskustvo je pokazalo8 da je varijabilnost između komora vrlo mala u poređenju sa varijabilnošću između jedinki. Ako se pojedinačne jedinke riba ne uključe u analizu, mora se opisati postupak identifikacije ekstremnih vrednosti i opravdati njegova upotreba.
Rezultati se tumače sa oprezom kad se izmerene toksične koncentracije u rastvorima nalaze blizu granice detekcije primenjenog analitičkog postupka, ili kad se u polustatičnom sistemu za ispitivanje smanji koncentracija ispitivane supstance između sveže pripremljenog rastvora i pre obnavljanja.
Izveštaj o ispitivanju sadrži sledeće podatke:
5) ispitivana supstanca:
- priroda supstance i relevantna fizička i hemijska svojstva;
- podaci o hemijskoj identifikaciji, uključujući čistoću i analitički postupak za kvantifikaciju ispitivane supstance ukoliko je primenljivo.
6) ispitivana vrsta:
- latinski naziv, ako je moguće: soj, veličina, dobavljač, prethodna obrada (ako je rađena) itd.
7) uslovi ispitivanja:
- primenjeni postupak (npr. statički, polustatički, protočni i dr.);
- ispitivana postavka (npr. broj akvarijuma, koncentracije i duplikati, broj riba po komori);
- postupak pripreme osnovnog rastvora i učestalost obnavljanja (mora se navesti ako se koristilo sredstvo za povećanje rastvorljivosti i njegova koncentracija);
- nominalne koncentracije test supstance, srednja vrednost izmerenih vrednosti i njihove standardne devijacije u komorama i metoda kojom su dobijene, kao i dokaz da se merenja odnose na koncentracije ispitivane supstance u pravom rastvoru;
- svojstva vode za razblaživanje: pH, tvrdoća, alkalitet, temperatura, koncentracija rastvorenog kiseonika, nivo rezidualnog hlora (ukoliko je meren), ukupni organski ugljenik, suspendovane čestice, salinitet medijuma (ukoliko je meren) i sva druga obavljena merenja;
- kvalitet vode u komorama (pH, tvrdoća, temperatura i koncentracija rastvorenog kiseonika);
- detaljne podatke o ishrani (npr. vrsta, poreklo i količina hrane, ako i dinamika ishrane).
8) rezultati:
- dokaz da su kontrole zadovoljile kriterijume prihvatljivosti što se tiče preživljenja i podaci o smrtnosti pri svakoj pojedinoj koncentraciji test supstance;
- korišćene statističke analitičke tehnike, statistika utemeljena na duplikatima merenja ili na jedinki, obrada podataka i opravdanje za primenjene tehnike;
- podaci navedeni u tabeli o težini pojedinačnih riba i srednjoj težini riba nultog, 14. (ukoliko se težina merila 14. dana) i 28. dana prosečne vrednosti po akvarijumu ili pseudospecifične brzine rasta (ukoliko je primereno) za period od 0. do 28. dana i ako je moguće od 0. do 14. kao i od 14. do 28. dana;
- rezultati statističke analize (tj. regresione analize ili ANOVA) ako je moguće dati tabelarno ili u grafičkom obliku i LOEC (p = 0,05) i NOEC ili ECx sa, kad je moguće, standardnim greškama (ukoliko je primereno);
- pojava svih neobičnih reakcija riba i svakog vidljivog efekta koji uzrokuje ispitivana supstanca.
1. Solbe J.F. de LG (1987) Environmental Effects of Chemicals (CFM 9350 SLD). Report on a UK Ring Testof a Method for Studying the Effects of Chemicals on the Growth rate of Fish. WRc Report No PRD1388-M/2.
2. Ashley S., Mallett M.J. and Grandy N.J., (1990) EEC Ring Test of a Method for Determining the Effects of Chemicals on the Growth Rate of Fish. Final Report to the Commission of the European Communities. WRc Report No EEC 2600-M.
3. Crossland N.O. (1985) A method to evaluate effects of toxic chemicals on fish growth. Chemosphere, 14,p. 1855-1870.
4. Nagel R., Bresh H., Caspers N., Hansen P.D., Market M., Munk R., Scholz N. and Höfte B.B., (1991) Effectof 3,4-dichloroaniline on the early life stages of the Zebrafish (Brachydanio rerio): results of a comparativelaboratory study. Ecotox. Environ. Safety, 21, p. 157-164.
5. Yamamoto, Tokio., (1975) Series of stock cultures in biological field. Medaka (killifish) biology andstrains. Keigaku Publish. Tokio, Japan.
6. Holcombe, G.W., Benoit D.A., Hammermeister, D.E., Leonard, E.N. and Johnson, R.D., (1995) Acute andlong-term effects of nine chemicals on the Japanese medaka (Oryzias latipes).Arch. Environ. Conta.Toxicol. 28, p. 287-297.
7. Benoit, D.A., HolCOmbe, G.W. and Spehar, R.L., (1991) Guidelines for COnducting early life toxicity testswith Japanese medaka (Oryzias latipes). Ecological Research Series EPA-600/3-91-063. U.S. EnvironmentalProtection Agency, Duluth, Minesota.
8. Stephan C.E. and Rogers J.W., (1985) Advantages of using regression analysis to calculate results ofchronic toxicity tests. Aquatic Toxicology and Hazard Assessment: Eighth Symposium, ASTM STP 891,R C Bahner and D J Hansen, Eds., American Society for Testing and Materials, Philadelphia, p. 328-338.
9. Environment Canada, (1992) Biological test method: toxicity tests using early life stages of salmonid fish (rainbow trout, Coho salmon, or Atlantic salmon). Conservation and Protection, Ontario, Report EPS 1/RM/28, p. 81.
10. Cox D.R., (1958) Planning of experiments. Wiley Edt.
11. Pack S., (1991) Statistical issues Concerning the design of tests for determining the effects of chemicals onthe growth rate of fish. Room Document 4, OECD Ad Hoc Meeting of Experts on Aquatic ToxiCOlogy,WRc Medmenham, UK, 10-12 December 1991.
12. Dunnett C.W., (1955) A Multiple Comparisons Procedure for Comparing Several Treatments with aCOntrol, J. Amer. Statist. Assoc., 50, p. 1096-1121.
13. Dunnett C.W., (1964) New tables for multiple Comparisons with a Control. Biometrics, 20, p. 482-491.
14. Williams D.A., (1971) A test for differences between treatment means when several dose levels are Compared with a zero dose Control. Biometrics 27, p. 103-117.
15. Johnston, W.L., Atkinson, J.L., Glanville N.T., (1994) A technique using sequential feedings of different Coloured food to determine food intake by individual rainbow trout, Oncorhynchus mykiss: effect of feedinglevel. Aquaculture 120, p. 123-133.
16. Quinton, J. C. and Blake, R.W., (1990) The effect of feed cycling and ration level on the Compensatory growth response in rainbow trout, Oncorhynchus mykiss. Journal of Fish Biology, 37, p. 33-41.
17. Post, G., (1987) Nutrition and Nutritional Diseases of Fish. Chapter IX in Testbook of Fish Health. T.F.H. Publications, Inc. Neptune City, New Jersey, USA. p. 288.
18. Bruce, R.D. and Versteeg D.J., (1992) A statistical procedure for modelling continuous toxicity data.Environ. Toxicol. Chem. 11, p. 1485-1494.
19. De Graeve, G.M., Cooney, J.M., Pollock, T.L., Reichenbach, J.H., Dean, Marcus, M.D. and McIntyre, D.O.,(1989) Precision of EPA seven-day fathead minnow larval survival and growth test; intra andinterlaboratory study. report EA-6189 (American Petroleum Institute Publication, No 4468). ElectricPower Research Institute, Palo alto, CA.
20. Norbert-King T.J., (1988) An interpolation estimate for chronic toxicity: the ICp approach. USEnvironmental Protection Agency. Environmental Research Lab., Duluth, Minesota. Tech. Rep. No 05-88of National Effluent Toxicity Assesment Center. Sept. 1988. p. 12.
21. Williams D.A., (1972) The comparison of several dose levels with a zero dose control. Biometrics 28,p. 510-531.
VRSTE RIBA PREPORUČENE ZA ISPITIVANJE I POGODNI USLOVI ISPITIVANJA
Vrsta | Preporučeni | Foto- | Preporučeni opseg za početnu | Tražena preciznost merenja | Nasad | Gustina nasada | Hrana - dužina |
Preporučene vrste: |
| ||||||
Oncorhynchus mykiss | 12,5-16,0 | 12-16 | 1-5 | do najbližih 100 mg | 1,2-2,0 | 4 | suva ≥ 28 |
Ostale dobro opisane vrste: |
| ||||||
Danio rerio | 21-25 | 12-16 | 0,050-0,100 | do najbližih 1 mg | 0,2-1,0 | 5-10 | živa hrana ≥ 28 |
Oryzias latipes | 21-25 | 12-16 | 0,050-0,100 | do najbližih 1 mg | 0,2-1,0 | 5-20 | živa hrana ≥ 28 |
HEMIJSKE OSOBINE VODE ZA RAZBLAŽIVANJE PRIHVATLJIVOG KVALITETA
SUPSTANCA | KONCENTRACIJA |
Čestice | < 20 mg/l |
Ukupni organski ugljenik | < 2 mg/l |
Nejonizovani amonijak | < 1 µg/l |
Rezidualni hlor | < 10 µg/l |
Ukupni organofosfatni pesticidi | < 50 ng/l |
Ukupni organohlorni pesticidi plus polihlorovani bifenili | < 50 ng/l |
Ukupni organski hlor | < 25 ng/l |
LOGARITAMSKI NIZOVI KONCENTRACIJA KOJE SU POGODNE ZA ISPITIVANJE TOKSIČNOSTI9
Kolona (Broj koncentracija između 100 i 10 ili između 10 i 1)LXIX | ||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 |
100 | 100 | 100 | 100 | 100 | 100 | 100 |
32 | 46 | 56 | 63 | 68 | 72 | 75 |
10 | 22 | 32 | 40 | 46 | 52 | 56 |
3,2 | 10 | 18 | 25 | 32 | 37 | 42 |
1,0 | 4,6 | 10 | 16 | 22 | 27 | 32 |
| 2,2 | 5,6 | 10 | 15 | 19 | 24 |
| 1,0 | 3,2 | 6,3 | 10 | 14 | 18 |
|
| 1,8 | 4,0 | 6,8 | 10 | 13 |
|
| 1,0 | 2,5 | 4,6 | 7,2 | 10 |
|
|
| 1,6 | 3,2 | 5,2 | 7,5 |
|
|
| 1,0 | 2,2 | 3,7 | 5,6 |
|
|
|
| 1,5 | 2,7 | 4,2 |
|
|
|
| 1,0 | 1,9 | 3,2 |
|
|
|
|
| 1,4 | 2,4 |
|
|
|
|
| 1,0 | 1,8 |
|
|
|
|
|
| 1,3 |
|
|
|
|
|
| 1,0 |
C.15. RIBE: METODA ISPITIVANjA KRATKOROČNE TOKSIČNOSTI NA EMBRIONALNOM I LARVALNOM STADIJUMU
Metoda se zasniva na OECD TG 212 (1998) uputstvu ispitivanja.
Metoda ispitivanja kratkoročne toksičnosti na embrione i larve riba je kratkoročni test u okviru kog se ispitivanoj supstanci izlažu različiti razvojni stadijumi ribe, od tek oplođenog jajeta pa sve do stadijuma na isteku faze hranjenja putem žumančane kese. U metodi kojom se ispituje toksičnost na embrionalni i larveni stadijum hrana se ne dodaje pa se ispitivanje treba okončati u fazi dok se larve još hrane putem žumančane kese.
Namena metode je određivanje letalnih i u izvesnoj meri, subletalnih efekata hemikalija na specifične razvojne stadijume i ispitivane vrste. Metoda ispitivanja pruža korisne podatke koji mogu:
1. predstavljati sponu između ispitivanja letalnog i subletalnog dejstva,
2. biti korišćena kao skrining test u okviru ispitivanja toksičnosti u celoj ranoj fazi života ili u okviru ispitivanja hronične toksičnosti i
3. biti korišćena za ispitivanje vrsta čije tehnike uzgoja nisu dovoljno uznapredovale da bi omogućile studije razdoblja promene iz endogenog u egzogeni način ishrane.
Preciznu procenu hronične toksičnosti hemikalije na ispitivanu vrstu mogu dati isključivo ispitivanja koja obuhvataju sve faze životnog ciklusa ribe. Svako skraćivanje izlaganja, koje nije obuhvatilo sve faze životnog ciklusa, može smanjiti osetljivost metode ispitivanja i potceniti hroničnu toksičnost hemikalije. Očekuje se da će ispitivanje na embrionalnom i larvalnom stadijumu biti manje osetljivo od ispitivanja toksičnosti u celoj ranoj fazi života, posebno ako se ispituje toksičnost izrazito lipofilnih hemikalija (log Pow> 4) i hemikalija specifičnog toksičnog dejstva. Kod hemikalija nespecifičnog, narkotičkog delovanja, očekuje se da razlike u osetljivosti budu manje1.
__________
LXIX Niz od pet (ili više) uzastopnih koncentracija može se izabrati iz jedne od kolona u tabeli. Srednja tačka između dve koncentracija u n-toj koloni pronalaze se u koloni 2n + 1. Navedene vrednosti su koncentracije izražene u zapreminskim ili masenim procentima (mg/l ili µg/l). Vrednosti se mogu množiti ili deliti za faktor 10, po potrebi. Kolona 1 može se koristiti ako postoji značajna nesigurnost u vezi sa nivoom toksičnosti.
Pre objavljivanja ovog ispitivanja, najviše iskustava u ispitivanju toksičnosti na embrionalni i larvalni stadijum sakupljeno je na slatkovodnoj ribi Danio rerio Hamilton-Buchanan (Teleostei, Cyprinidae) - tzv. zebrica. Smernice za ispitivanja ove vrste ribe date su u Delu drugom ove metode. Mogu se koristiti i druge dobro proučene vrste (Tabela 1).
Najniža efektivna koncentracija (Lowest Observed Effect Concentration, u daljem tekstu: LOEC) jeste najniža koncentracija ispitivane supstance pri kojoj je uočeno da supstanca, u poređenju sa kontrolnom grupom, izaziva značajno dejstvo (kod p < 0,05). Sve koncentracije više od LOEC moraju u toku ispitivanja imati štetno dejstvo jednako onom ili veće od onog uočenog pri LOEC.
Koncentracija koja ne dovodi do uočljivog efekta (No Observed Effect Concentration, u daljem tekstu: NOEC) jeste koncentracija ispitivane supstance neposredno ispod LOEC.
Embrioni i larve riba izlažu se seriji koncentracija ispitivane supstance rastvorene u vodi. U okviru ispitivane postavke, moguć je izbor semistatičkih ili protočnih uslova. Izbor zavisi od prirode ispitivane supstance. Ispitivanje započinje postavljanjem oplođenih jaja u komore za ispitivanje, a završava se neposredno pre nego žumančana kesa bilo koje larve, u bilo kojoj od ispitivanih komora, bude u potpunosti apsorbovana, odnosno pre nego što se u kontrolnoj grupi uoči smrtnost usled izgladnjivanja. Procenjuju se letalni i subletalni efekti, koji se zatim porede sa vrednostima u kontroli, da bi se odredila najniža efektivna koncentracija a time i koncentracija koja ne dovodi do uočljivog efekta. Rezultati se mogu analizirati i pomoću regresionog modela, da bi se procenila koncentracija ispitivane supstance koja dovodi do određenog procentualnog efekta (LC/ECx, pri čemu je x procenat efekta).
1.4. PODACI O ISPITIVANOJ SUPSTANCI
Na raspolaganju treba imati rezultate ispitivanja akutne toksičnosti (videti Metodu C.1. koja je data u ovom prilogu), ako je moguće na istoj vrsti koja je izabrana za ispitivanje. Rezultati mogu biti od pomoći pri izboru prikladnog opsega koncentracija ispitivane supstance za metodu ispitivanja na ranim stadijumima razvoja. Potrebno je poznavati rastvorljivost ispitivane supstance u vodi (uključujući i rastvorljivost u vodi koja se koristi za ispitivanje) i napon para ispitivane supstance. Potrebno je i pouzdana analitička metoda kojom se može odrediti količina ispitivane supstance u rastvorima o čijoj tačnosti i granici detekcije postoje dostupni podaci.
U podatke o ispitivanoj supstanci koji su od koristi pri uspostavljanju uslova ispitivanja u kojima se obavlja ispitivanje, spadaju strukturna formula ispitivane supstance, podaci o hemijskoj čistoći, fotostabilnosti, stabilnosti u ispitivanim uslovima, pKa, Pow i rezultati ispitivanja biorazgradljivosti (videti Metodu C.4. koja je data u ovom prilogu).
1.5. PRIHVATLJIVOST ISPITIVANJA
Da bi ispitivanje bilo prihvatljivo, primenjuju se sledeći uslovi:
- ukupno preživljavanje oplođenih jaja u kontrolnim grupama i gde je relevantno, u posudama za ispitivanje punjenim samo rastvaračem, mora biti veće ili jednako granicama definisanim u Delu trećem i četvrtom ove metode;
- u toku celog ispitivanja, koncentracija rastvorenog kiseonika mora iznositi između 60% i 100% vrednosti zasićenja vazduha (ASV);
- u toku celog ispitivanja, temperatura vode u pojedinim komorama ili uzastopnim danima ne sme ni u kom satu međusobno da se razlikuje za više od ± 1,5 °C i mora se kretati u temperaturnom opsegu specificiranom za tu ispitivanu vrstu (videti Deo treći i četvrti ove metode).
1.6.1. Komore za ispitivanje
Može se koristiti bilo kakva staklena posuda ili posuda od hemijski inertnog materijala. Dimenzije posuda moraju biti dovoljno velike da ispitivanje bude izvedeno u skladu sa preporučenim vrednostima nasada (videti odeljak 1.7.1.2. ove metode). Posude za ispitivanje raspoređuju se po principu slučajnog rasporeda. Ako u laboratoriji postoje sistemski efekti koji se mogu kontrolisati blok sistemom, slučajni raspored u blokovima (gde je svaki tretman smešten u po jedan blok) ima prednost nad potpuno nasumičnim rasporedom. Ako se radi u blokovima, sistem se uzima u obzir kod analize podataka. Ispitivane komore treba zaštititi od neželjenog uznemiravanja.
1.6.2. Izbor vrste ribe
Preporučene vrste riba navedene su u Tabeli 1A. Moguće je korišćenje drugih vrsta (primeri su navedeni u Tabeli 1B), ali se u tom slučaju procedura modifikuje, da bi se obezbedili zadovoljavajući ispitivani uslovi. Ako se koriste druge vrste mora se dati objašnjenje za izbor vrste i opis ispitivane metode.
1.6.3. Održavanje laboratorijske populacije riba
Detalji o održavanju laboratorijske populacije riba u zadovoljavajućim uslovima mogu se naći u metodi OECD TG 210LXX i literaturi2, 3, 4, 5, 6.
1.6.4. Postupanje sa embrionima i larvama
Unutar glavne posude za ispitivanje, embrioni i larve mogu biti izloženi ispitivanoj supstanci u manjim posudama mrežastih zidova koji omogućavaju nesmetan protok ispitivanog rastvora kroz posudu. Ujednačen protok kroz ove male posude može se postići tako što se one okače o mehaničku ruku, nameštenu tako da posude pomiče gore-dole, držeći organizme neprekidno uronjene u medijum. Može se upotrebiti i sifonski sistem. Oplođena jaja salmonidnih riba mogu biti poduprta na šipkama ili mrežama čija su okca dovoljno velika da larve, nakon što se izlegu, mogu da propadnu kroz njih. U semistatičkim uslovima, u kojima je obezbeđeno svakodnevno obnavljanje rastvora, za uklanjanje embriona i larvi prikladno je upotrebiti Pasterove pipete (videti odeljak 1.6.6. ove metode).
Kada se za zadržavanje jaja unutar glavne posude koriste rešetke ili mreže, one se moraju ukloniti čim se larve izlegu, sa izuzetkom mreža koje su i dalje potrebne za sprečavanje bežanja larvi. Ako postoji potreba za premeštanjem larvi, one ne bi smele biti izložene vazduhu, niti se za puštanje ribe iz posudica za jaja smeju koristiti mrežice (ova mera opreza može biti suvišna ako se radi o nekoj manje osetljivoj vrsti ribe, npr. šaranu). Pogodan momenat za premeštanje larvi varira od vrste do vrste, a sam premeštaj nije uvek nužan. Ako se ispitivanje odvija u semistatičkim uslovima, mogu se koristiti laboratorijske čaše ili plitke posude, po potrebi opremljene mrežicom podignutom iznad dna posude. Premeštanje embriona ili larvi nije neophodno ako je zapremina ovih posuda dovoljna da zadovolji postavljene zahteve u pogledu nasada (videti odeljak 1.7.1.2. ove metode).
1.6.5. Voda
Svaka voda čija hemijska svojstva odgovaraju svojstvima prihvatljive vode za razblaživanje, (navedeno u Delu petom ove metode) i u kojoj jedinke ispitivane vrste u kontrolnim grupama preživljavaju barem u meri kako je opisano u Delu trećem i četvrtom ove metode, prikladna je za ispitivanje. Kvalitet vode mora ostati nepromenjen u toku celog ispitivanja. Vrednost pH treba održavati u opsegu od ± 0,5. Kako bi se osiguralo da voda koja se koristi za razblaživanje ne utiče prekomerno na rezultate ispitivanja (npr. kompleksiranjem ispitivane supstance) ili negativno ne utiče na ponašanje matičnog jata, uzorke vode povremeno treba analizirati. Ako se zna da se kvalitet vode korišćene za razblaživanje bitno ne menja, svaka tri meseca treba izmeriti koncentraciju teških metala (npr. Cu, Pb, Zn, Hg, Cd i Ni), glavnih anjona i katjona (npr. Ca, Mg, Na, K, Cl i CO4), pesticida (npr. ukupne organofosforne i organohlorne pesticide), ukupnu koncentraciju organskog ugljenika i u vodi suspendovanih materija. Ako se pokaže da je kvalitet vode konstantan u toku perioda od najmanje godinu dana, analize ovih pokazatelja ne moraju biti tako česte, pa se razmaci između dve analize mogu produžiti (na svakih šest meseci).
_________
LXX OECD, Paris, 1992, Test Guideline 210, "Fish, Early - life Stage Toxicity Test"
1.6.6. Rastvori ispitivane supstance
Rastvori ispitivane supstance izabrane koncentracije pripremaju se razblaživanjem osnovnog rastvora.
Osnovni rastvor se priprema tako što se ispitivana supstanca jednostavno mehanički promeša sa vodom za razblaživanje ili protrese u njoj (mešanjem i pomoću ultrazvuka). Odgovarajuća koncentracija osnovnog rastvora može se obezbediti upotrebom kolona zasićenja (kolona rastvorljivosti). Upotrebu rastvarača ili disperzionih sredstava (agensa koji olakšavaju rastvaranje) treba izbegavati kad god je moguće. Pripremanje osnovnog rastvora odgovarajuće koncentracije u nekim slučajevima iziskuje upotrebu ovih jedinjenja. U odgovarajuće rastvarače spadaju: aceton, etanol, metanol, dimetilformamid i trietilenglikol. U odgovarajuća disperziona sredstva spadaju: Cremophor RH40, Tween 80, metilceluloza 0,01% i HCO-40. Pri upotrebi biorazgradljivih agenasa (npr. acetona), odnosno lako isparljivih jedinjenja potrebno je preduzeti određene mere opreza, jer kod ispitivanja u protočnim uslovima mogu izazvati probleme u smislu bakterijske nadgradnje. Ako se koristi sredstvo koje olakšava rastvorljivost, ono ne sme imati nikakvih značajnih efekata na preživljavanje, niti vidljivih neželjenih efekata na rane razvojne oblike riba kontrolne grupe, izložene samo rastvaraču.
Ako se ispitivanje obavlja u polu-statičnom sistemu, obnavljanje ispitivanog rastvora može da se radi na dva načina: ispitivani rastvor se priprema u čistim posudama, a preživela jaja i larve u maloj zapremini starog rastvora nežno premeštaju u nove posude, izbegavajući pri tom pristup vazduha, ili se ispitivani organizmi zadrže u posudama, a promeni određeni deo (najmanje tri četvrtine) rastvora. Učestalost obnavljanja medijuma zavisi od stabilnosti ispitivane supstance, ali se preporučuje da bude svakodnevno. Ako se prema rezultatima skrining testa (videti odeljak 1.4. ove metode) pokaže da koncentracija ispitivane supstance u toku perioda između obnavljanja nije stabilna (tj. izlazi iz opsega od 80% do 120% nominalnih vrednosti, odnosno pada ispod 80% prvobitno izmerene koncentracije), nužno je razmotriti mogućnost ispitivanja u protočnim uslovima. U toku obnavljanja rastvora treba paziti da se izbegne stresogeno dejstvo na larve.
Za ispitivanja koja se izvode u protočnim uslovima neophodan je sistem koji će neprekidno raspršivati i razblaživati osnovni rastvor ispitivane supstance (npr. merna pumpa, proporcionalni razblaživač, sistem za zasićenje) kako bi ispitivana supstanca stizala u ispitivane komore u seriji koncentracija. Tokom trajanja ispitivanja, protok osnovnog rastvora i vode za razblaživanje povremeno treba proveriti, ako je moguće svakodnevno, a protok u toku celog trajanja ispitivanja ne sme da varira za više od 10%. Kao odgovarajući pokazao se 24-satni protok ekvivalentan ukupnoj zapremini minimum pet komora2 za ispitivanje.
Korisni podaci o ispitivanju toksičnosti na embrionima i larvama su dostupni u literaturi7, 8, 9.
1.7.1. Uslovi izlaganja
1.7.1.1. Trajanje
Ispitivanje treba započeti u prvih 30 minuta nakon oplodnje jaja. Embrioni se u ispitivani rastvor uranjaju pre nego što nastupi cepanje blastodiska, odnosno što pre nakon toga, ali u svakom slučaju pre početka stadijuma gastrule. Ako se koriste jaja nabavljena od komercijalnog dobavljača, može se dogoditi da sa ispitivanjem nije moguće započeti odmah nakon oplodnje. Kako odlaganje početka ispitivanja može značajno da naruši osetljivost metode, ispitivanje treba započeti najdalje osam sati od oplodnje. Larve se u toku perioda izlaganja ne hrane, pa ispitivanje treba okončati neposredno pre nego što žumančana kesa bilo koje larve, u bilo kojoj od ispitivanih komora, bude u potpunosti apsorbovana, odnosno pre nego što larve u kontrolnim grupama uginu od izgladnelosti. Trajanje ispitivanja zavisi od vrste ribe. Neke preporučene dužine trajanja ispitivanja navedene su u Delu trećem i četvrtom ove metode.
1.7.1.2. Nasad
Na početku ispitivanja broj oplođenih jaja mora da zadovolji statističke zahteve. Jaja treba nasumice rasporediti između tretmana. Svakoj koncentraciji ispitivane supstance treba izložiti najmanje 30 oplođenih jaja, koliko je moguće jednako raspodeljenih u najmanje tri replike (kod nekih vrsta riba teško je dobiti jednake serije). Nasad (biomasa po zapremini rastvora) mora biti dovoljno niska da se koncentracija rastvorenog kiseonika može bez aeracije održavati na minimum 60% ASV. Kod ispitivanjima u protočnim uslovima, preporučuje se da nasad u 24 sata ne prelazi 0,5 g/l, odnosno da ni u kom trenutku ne prelazi 5 g/l rastvora2.
1.7.1.3. Osvetljenje i temperatura
Fotoperiod i temperatura rastvora moraju biti odgovarajući za svaku ispitivanu vrstu (videti Deo treći i četvrti ove metode). Za praćenje temperature može biti prikladna upotreba dodatne posude za ispitivanje.
1.7.2. Koncentracije ispitivane supstance
Uobičajeno je da se ispitivanje obavlja u seriji od pet koncentracija ispitivane supstance u rastućem nizu, koji se međusobno razlikuju za konstantno isti faktor, ne veći od 3,2. Pri izboru opsega ispitivanih koncentracija treba uzeti u obzir krivu zavisnosti LC50 i vremena izlaganja, dobijenu ispitivanjem akutne toksičnosti. U nekim slučajevima, npr. kod ispitivanja namenjenih određivanju gornje granične koncentracije, ispitivanje se može obaviti u manje od pet koncentracija ili u seriji užeg opsega. Ako se ispitivanje obavlja u manje od pet koncentracija ispitivane supstance, potrebno je navesti objašnjenje. Koncentracije supstance koje prelaze 96 hLC50, odnosno 100 mg/l (zavisno od toga koja je od navedenih vrednosti niža) ne treba da se ispituju. Supstance ne treba ispitivati u koncentracijama koje prelaze granicu njihove rastvorljivosti u medijumu.
Ako se za pripremu ispitivanog rastvora koristi sredstvo koje olakšava rastvaranje (videti odeljak 1.6.6. ove metode), njegova krajnja koncentracija mora u svim posudama da bude jednaka i ne sme preći 0,1 ml/l.
1.7.3. Kontrolne grupe
Uz seriju koncentracija ispitivane supstance, mora se postaviti i jedna kontrolna grupa (u potrebnom broju ponavljanja) u kojoj se nalazi samo voda za razblaživanje i ukoliko je u konkretnom slučaju relevantno, jedna (u potrebnom broju ponavljanja) kontrolna grupa u kojoj medijum sadrži i sredstvo za lakše rastvaranje ispitivane supstance.
1.7.4. Učestalost analitičkih određivanja i merenja
Koncentracije ispitivane supstance određuju se u pravilnim vremenskim razmacima, tokom ispitivanja.
Ako se ispitivanja izvode u polu-statičkim uslovima, u kojima se očekuje da će se koncentracija ispitivane supstance zadržati unutar ± 20% nominalnih vrednosti, odnosno u opsegu od 80% do 120% (videti odeljke 1.4. i 1.6.6. ove metode), baremse tri puta u pravilnim vremenskim razmacima analiziraju uzorci najviše i najniže koncentracije, tako što se prve analize rade neposredno nakon pripreme rastvora, a zatim i odmah nakon njihovog obnavljanja. Znači da je potrebno analizirati uzorak istog rastvora - sveže pripremljen i prilikom obnavljanja.
U ispitivanjima kod kojih se na osnovu podataka o stabilnosti supstance ne očekuje da će se njena koncentracija zadržati unutar ± 20% nominalne vrednosti, neophodno je analizirati rastvore svih koncentracija neposredno nakon pripreme i prilikom njihovog obnavljanja, pridržavajući se opisanog režima kontrole (analiza se obavlja u najmanje 3 navrata u pravilnim vremenskim razmacima). Koncentraciju ispitivane supstance pre obnavljanja u svakom rastvoru neophodno je odrediti u jednoj od replika, u razmaku ne dužem od sedam dana. Preporučuje se da se rezultati ispitivanja baziraju na izmerenim koncentracijama. Ali, ako postoje dokazi da se ispitivana koncentracija na zadovoljavajući način održava unutar ± 20% nominalne ili izmerene prvobitne koncentracije, rezultati se mogu bazirati na nominalnim ili prvobitno izmerenim vrednostima.
Ako se ispitivanje izvodi u protočnim uslovima, prikladan je režim uzimanja uzorka za analizu sličan režimu opisanom za semistatičke uslove (ali u ovom slučaju merenje "starih" rastvora nije primenljivo). Ako ispitivanje traje duže od sedam dana, preporučljivo je da se poveća broj uzoraka uzetih u toku prve nedelje (obaviti tri serije merenja) da bi se osiguralo da ispitivane koncentracije i dalje budu stabilne.
Uzorci će možda morati da se centrifugiraju ili filtriraju (pomoću 0,45 μm filtera). Ali, ako ni u jednom od dva pomenuta načina pripreme uzoraka nije moguće razdvojiti bio dostupnu frakciju ispitivane supstance od bio nedostupne, uzorci se ne moraju podvrgnuti ovim postupcima.
Tokom ispitivanja, u svim posudama treba meriti rastvoreni kiseonik, pH i temperaturu. U kontrolnim posudama i posudi u kojoj je koncentracija ispitivane supstance najviša, neophodno je izmeriti ukupnu tvrdoću rastvora i salinitet, ukoliko je merodavan, najmanje tri puta (na početku, sredinom i na kraju ispitivanja). Ako se ispitivanje izvodi u semistatičkim uslovima, preporučuje se da se rastvoreni kiseonik meri češće, ako je moguće pre i nakon svakog obnavljanja vode, odnosno minimum jednom nedeljno. Pri ispitivanju u uslovima statičkog obnavljanja, pH vrednost treba meriti na početku i na kraju svakog obnavljanja vode, a pri ispitivanju u protočnim uslovima najmanje jednom nedeljno. Tvrdoću rastvora treba izmeriti jednom u toku ispitivanja. Temperaturu treba meriti svakodnevno, a preporučljivo je da se u najmanje jednoj od posuda prati neprekidno.
1.7.5. Zapažanja
1.7.5.1. Razvojni stadijum embriona
Na početku izlaganja ispitivanoj supstanci, embrionalni stadijum (tj. stadijum gastrule) treba potvrditi što je preciznije moguće. To se postiže pomoću reprezentativnog uzorka, adekvatno sačuvanih i očišćenih jaja. Opis i ilustracije razvojnih stadijuma dati su u literaturi(2)(5)(10)(11).
1.7.5.2. Izvaljivanje iz jaja i preživljavanje
Zapažanja koja se odnose na izvaljivanje iz jaja i preživljavanje, zapisuju se najmanje jednom dnevno. Na početku ispitivanja poželjno je da se zapažanja obave i češće (u toku prva tri sata na svakih 30 minuta), jer u nekim slučajevima (npr. kada se javljaju akutni toksični efekti), vremena preživljavanja mogu biti od veće važnosti nego broj uginulih primeraka. Uginule embrione i larve treba ukloniti odmah po opažanju, jer se mogu vrlo brzo raspasti. Pri odstranjivanju uginulih primeraka, posebnu pažnju treba posvetiti tome da se ne udare ili fizički oštete jaja/larve u neposrednoj blizini, koje su posebno nežne i osetljive. Kriterijumi za proglašavanje smrti variraju u zavisnosti od stadijuma životnog ciklusa:
- za jaja - primetan gubitak prozirnosti i promena boje uzrokovani zgrušavanjem, odnosno precipitacijom belančevina, što uslovljava beo, neproziran izgled, naročito u ranim razvojnim stadijumima;
- za embrione - odsustvo kretnji tela i/ili pulsa, odnosno promena boje i neproziran izgled vrsta čiji su embrioni u redovnim okolnostima prozirni;
- za larve - nepokretnost i/ili odsustvo pokreta disanja i/ili odsustvo pulsa i/ili belo neprozirno obojen centralni nervni sistem i/ili izostanak reakcije na mehanički nadražaj.
1.7.5.3. Patološki izgled
Broj larvi patološkog oblika tela, odnosno boje, kao i stadijum apsorpcije u kom se nalazi žumančana kesa, moraju se zabeležiti u adekvatnim vremenskim razmacima zavisno od dužine ispitivanja i prirode patološke promene koja se opisuje. Patološki oblici embriona i larvi javljaju se i prirodno, a njihova zastupljenost u kontrolnoj grupi (grupama) nekih vrsta može biti reda veličine nekoliko procenata. Životinje patoloških obeležja iz posude za ispitivanje treba ukloniti tek kad uginu.
1.7.5.4. Patološko ponašanje
Patološke promene, npr. hiperventilaciju, nekoordinisano plivanje i atipično mirovanje, treba zabeležiti u adekvatnim vremenskim razmacima u zavisnosti od dužine ispitivanja. Iako ih je teško kvantifikovati, ovi efekti kada se opaze mogu pomoći u tumačenju rezultata smrtnosti, tj. dati podatke o načinu toksičnog dejstva ispitivane supstance.
1.7.5.5. Dužina
Na kraju ispitivanja, preporučljivo je izmeriti dužinu svake jedinke. Moguće je meriti standardnu, poprečnu ili ukupnu dužinu. Ako repno peraje istrune ili erodira, mora se izmeriti standardna dužina. U dobro sprovedenom ispitivanju, koeficijent varijacije dužine replika uglavnom treba da iznosi ± 20%.
1.7.5.6. Težina
Na kraju ispitivanja može se izmeriti težina svake jedinke. Prednost se daje suvoj masi (riba sušena 24 sata na temperaturi od 60°C) u odnosu na svežu (površina ribljeg tela osuši se upijanjem). U dobro obavljenom ispitivanju, koeficijent varijacije težine replika mora iznositi ± 20%.
Ova zapažanja će rezultirati nekim ili svim navedenim podacima koji se mogu analizirati statistički:
- kumulativna smrtnost;
- broj zdravih larvi u pojedinoj replici zabeležen na kraju ispitivanja;
- vreme proteklo do početka, odnosno do okončanja izvaljivanja (tj. vreme koje je u svakoj replici bilo potrebno da se izlegne 90% larvi);
- broj larvi koji se dnevno izvalio;
- dužina (i težina) preživelih životinja na kraju ispitivanja;
- broj larvi patološkog oblika ili izgleda;
- broj larvi patološkog ponašanja.
Preporučuje se da u ispitivanu postavku i analizu bude uključen statističar, jer ova metoda omogućava znatne varijacije u ispitivanoj postavci, npr. u broju upotrebljenih ispitivanih posuda, broju ispitivanih koncentracija, početnom broju oplođenih jaja i mernim pokazateljima. S obzirom na broj opcija koje pri postavci ove metode ispitivanja stoje na raspolaganju, ovde nisu navedene specifične smernice za statističku obradu rezultata.
Ako treba odrediti LOEC/NOEC, neophodno je analizirati varijacije unutar svakog od setova replika, i to upotrebom analize varijance (ANOVA) ili postupcima koji koriste tablice kontingencije. Pri višestrukom poređenju rezultata dobijenih pri izlaganju pojedinim koncentracijama ispitivane supstance i rezultata dobijenih u kontrolnim grupama, može biti korisna Dunetova metoda12,13. Na raspolaganju su i druge korisne metode14,15. Veličina efekta koja se može detektovati pomoću ANOVA ili drugih postupaka statističke obrade (tj. statistička snaga), mora biti izračunata i navedena. Za statističku analizu putem ANOVA nisu prikladna sva zapažanja navedena u odeljku 1.7.5.6. ove metode. Na primer, kumulativna smrtnost i broj zdravih larvi u pojedinoj replici, zabeleženi na kraju ispitivanja, mogu se analizirati probit metodama.
Ako se određuje LC/ECx, adekvatnu krivu (kao što je logistička) treba prilagoditi značajnim podacima koristeći statističke metode poput metoda najmanjih kvadrata ili metoda nelinearnih najmanjih kvadrata. Krivu (krive) treba parametarski prilagoditi na način da se LC/ECx od interesa i njena standardna greška mogu direktno utvrditi. Ovo će značajno olakšati izračunavanje intervala poverenja oko vrednosti LC/ECx. Ako ne postoje dobri razlozi za davanje prednosti drugačijim nivoima poverenja, interval poverenja koji je potrebno navesti je dvostrani 95%-ni. Postupak prilagođavanja krive treba osigurati na način na koji će se proceniti statistički značaj neprilagođenosti. Za prilagođavanje krivih mogu se koristiti grafičke metode. Regresiona analiza je pogodna za analizu svih zapažanja nabrojenih u odeljku 1.7.5.6. ove metode.
Kada se izmerene koncentracije ispitivane supstance nalaze u koncentracijama bliskim granici detekcije analitičke metode, rezultate treba tumačiti oprezno. Treba paziti i kod tumačenja rezultata dobijenih pri izlaganju ispitivanih modela koncentracijama koje prelaze rastvorljivost ispitivane supstance u vodi.
Izveštaj o ispitivanju mora da sadrži podatke:
1) ispitivana supstanca:
- fizička priroda i relevantna fizička i hemijska svojstva;
- podaci od značaja za hemijsku identifikaciju supstance kao što su njena hemijska čistoća i gde je primereno, analitička metoda kojom se može kvantifikovati ispitivana supstanca.
2) ispitivana vrsta:
- latinski naziv, soj, broj roditeljskih jedinki riba (tj. koliko je ženki upotrebljeno da bi se u svakoj od replika obezbedio potreban broj jaja), izvor i metoda sakupljanja oplođenih jaja, kao i rukovanje njima.
3) uslovi ispitivanja:
- primenjena procedura ispitivanja (npr. polu-statični ili protočni sistem, vreme proteklo od oplodnje do početka ispitivanja, nasad, itd);
- fotoperiod;
- ispitivana postavka (npr. broj ispitivanih posuda i replika, broj embriona u svakoj od replika);
- metoda pripreme osnovnih rastvora i učestalost njihovog obnavljanja (koncentracija rastvarača ako se koristi);
- nominalne koncentracije ispitivane supstance, izmerene vrednosti, njihove aritmetičke sredine i standardna devijacija, metoda kojom su dobijene, i ukoliko je ispitivana supstanca u vodi rastvorljiva u koncentracijama nižim od ispitivanih dokazi da se merenja odnose na koncentracije ispitivane supstance u rastvoru;
- karakteristike vode za razblaživanje (pH, tvrdoća, temperatura, koncentracija rastvorenog kiseonika, nivoi rezidualnog hlora, ukoliko su izmereni, ukupni organski ugljenik, koncentracija suspendovanih materija, salinitet ispitivanog medijuma, ukoliko je izmeren) i rezultati bilo kojih drugih merenja;
- kvalitet vode u posudama za ispitivanje (pH, tvrdoća, temperatura i koncentracija rastvorenog kiseonika);
4) rezultati:
- rezultati svih prethodno obavljenih studija o stabilnosti ispitivane supstance;
- dokazi da je stopa preživljavanja u kontrolnim grupama zadovoljila standard prihvatljivosti za ispitivanu vrstu (videti deo treći i četvrti ove metode);
- podaci o smrtnosti/preživljavanju u embrionalnom i larvalnom stadijumu, i ukupna smrtnost/ukupno preživljavanje;
- broj dana do izvaljivanja i broj izvaljenih larvi;
- podaci o dužini (i težini);
- učestalost i opis patoloških morfoloških oblika, ako ih je bilo;
- učestalost i opis efekata ispitivane supstance na ponašanje ispitivanog modela, ukoliko je takvih bilo;
- statistička analiza i obrada podataka;
- za ispitivanja čiji su rezultati analizirani pomoću ANOVA, za svaki od utvrđenih odgovora ispitivanog modela na izlaganje ispitivanoj supstanci, najniža koncentracija ispitivane supstance pri kojoj se na nivou značaja od p = 0,05 javlja LOEC, odnosno ne javlja statistički značajan efekat NOEC, uključujući i opis primenjenih statističkih postupaka i naznaku veličine efekta koji se mogao detektovati;
- ako su rezultati ispitivanja analizirani regresionim tehnikama, LC/ECn i intervali poverenja kao i grafički prikaz prilagođenog modela korišćenog pri izračunavanju;
- objašnjenje bilo kakvog odstupanja od ove metode ispitivanja.
1. Kristensen P., (1990) Evaluation of the Sensitivity of Short Term Fish Early Life Stage Tests in Relation to other FELS Test Methods. Final report to the Commission of the European Communities, p. 60. June 1990.
2. ASTM (1988) Standard Guide for Conducting Early Life-Stage Toxicity Tests with Fishes. American Society for Testing and Materials. E 1241-88. p. 26
3. Brauhn J.L. and Schoettger R.A., (1975) Acquisition and Culture of Research Fish: Rainbow trout, Fathead minnows, Channel Catfish and Bluegills. p. 54, Ecological Research Series, EPA-660/3-75-011, Duluth, Minnesota.
4. Brungs W.A. and Jones B.R., (1977) Temperature Criteria for Freshwater Fish: Protocol and Procedures p. 128, Ecological Research Series EPA-600/3-77-061, Duluth, Minnesota.
5. Laale H.W., (1977) The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review. J. Biol. 10, p. 121-173.
6. Legault R. (1958) A Technique for Controlling the Time of Daily Spawning and Collecting Eggs of the Zebrafish, Brachydanio rerio (Hamilton-Buchanan) Copeia, 4, p. 328-330.
7. Dave G., Damgaard B., Grande M., Martelin J.E., Rosander B. and Viktor T., (1987) Ring Test of an Embryo-larval Toxicity Test with Zebrafish (Brachydanio rerio) Using Chromium and Zinc as Toxicants. Environmental Toxicology and Chemistry, 6, p. 61-71.
8. Birge J.W., Black J.A. and Westerman A.G., (1985) Short-term Fish and Amphibian Embryo-larval Tests for Determining the Effects of Toxicant Stress on Early Life Stages and Estimating Chronic Values for Single Compounds and Complex Effluents. Environmental Toxicology and Chemistry 4, p. 807-821.
9. Van Leeuwen C.J., Espeldoorn A. and Mol F. (1986) Aquatic Toxicological Aspects of Dithiocarbamates and Related Compounds. III. Embryolarval Studies with Rainbow Trout (Salmo gairdneri). J. Aquatic Toxicology, 9, p. 129-145.
10. Kirchen R.V. and W. R. West (1969) Teleostean Development. Carolina Tips 32(4): 1-4. Carolina Biological Supply Company.
11. Kirchen R.V. and W. R. West (1976) The Japanese Medaka. Its care and Development. Carolina Biological Supply Company, North Carolina. p. 36.
12. Dunnett C.W., (1955) A Multiple Comparisons Procedure for Comparing Several Treatments with Control. J. Amer. Statist. Assoc., 50, p. 1096-1121.
13. Dunnett C.W. (1964) New Tables for Multiple Comparisons with a Control. Biometrics, 20, p. 482-491.
14. Mc Clave J.T., Sullivan J.H. and Pearson J.G., (1980) Statistical Analysis of Fish Chronic Toxicity Test Data. Proceedings of 4th Aquatic Toxicology Symposium, ASTM, Philadelphia.
15. Van Leeuwen C.J., Adema D.M.M. and Hermes J., (1990) Quantitative Structure-Activity Relationships for Fish Early Life Stage Toxicity. Aquatic Toxicology, 16, p. 321-334.
16. Environment Canada., (1992) Toxicity Tests Using Early Life Stages of Salmonid Fish (Rainbow Trout, Coho Salmon or Atlantic Salmon). Biological Test Method Series. Report EPS 1/RM/28, December 1992, p. 81.
17. Dave G. and Xiu R., (1991) Toxicity of Mercury, Nickel, Lead and Cobalt to Embryos and Larvae of Zebrafish, Brachydanio rerio. Arch. of Environmental Contamination and Toxicology, 21, p. 126-134.
18. Meyer A., Bierman C.H. and Orti G., (1993) The phylogenetic position of the Zebrafish (Danio rerio), a model system in developmental biology - an invitation to the comperative methods. Proc. Royal Society of London, Series B, 252: 231-236.
19. Ghillebaert F., Chaillou C., Deschamps F. and Roubaud P., (1995) Toxic Effects, at Three pH Levels, of Two Reference Molecules on Common Carp Embryo. Ecotoxicology and Environmental Safety 32, p. 19-28.
20. US EPA, (1991) Guidelines for Culturing the Japanese Medaka, Oryzias latipes. EPA report EPA/600/3-91/064, Dec. 1991, EPA, Duluth.
21. US EPA, (1991) Guidelines for Conducting Early Life Stage Toxicity Tests with Japanese Medaka, (Oryzias latipes). EPA report EPA/600/3-91/063, Dec. 1991, EPA, Duluth.
22. De Graeve G.M., Cooney J.D., McIntyre D.O., Poccocic T.L., Reichenbach N.G., Dean J.H. and Marcus M.D., (1991) Validity in the performance of the seven-day Fathead minnow (Pimephales promelas) larval survival and growth test: an intra- and interlaboratory study. Environ. Tox. Chem. 10, p. 1189-1203.
23. Calow P., (1993) Handbook of Ecotoxicology, Blackwells, Oxford. Vol. 1, chapter 10: Methods for spawning, culturing and conducting toxicity tests with Early Life stages of Estuarine and Marine fish.
24. Balon E.K., (1985) Early life history of fishes: New developmental, ecological and evolutionary perspectives, Junk Publ., Dordrecht, p. 280.
25. Blaxter J.H.S., (1988) Pattern and variety in development, In: W.S. Hoar and D.J. Randall Eds., Fish Physiology, vol. XIA, Academic press, p. 1-58.
Tabela 1a: Preporučene vrste riba za metodu ispitivanja
SLATKOVODNE |
Oncorhynchus mykiss9, 16 (pastrmka) |
Danio rerio7, 17, 18 (zebrica) |
Cyprinus caprio8, 19 (šaran) |
Oryzias latipes20, 21 |
Pimephales promelas8, 22 |
Tabela 1b: Ostale dobro proučene vrste koje se mogu koristiti
SLATKOVODNA | MORSKE |
Carassius auratus (srebrni karaš/ babuška) | Menidia peninsulae23, 24, 25 |
Lepomis macrochirus8 (sunčanica) | Gadus morhua24, 25 (bakalar) |
| Cyprinodon variegatus23, 24, 25 (bjelica) |
UPUTSTVO ZA ISPITIVANJE TOKSIČNOSTI NA EMBRIONIMA I LARVAMA
Brachydanio rerio (zebrica)
Zebrica potiče sa indijske obale (Koromandel), gde naseljava brzake. Reč je o običnoj akvarijumskoj ribi iz porodice šarana, a podaci o postupcima držanja i uzgoja mogu se naći u standardnim priručnicima o tropskim ribama. Biologija ove ribe i njena upotreba u istraživanjima iz domena ribarstva, data je u literaturi1.
Primerci ove ribe retko su duži od 45 mm. Telo im je cilindričnog oblika, sa 7 do 9 tamnoplavih uzdužnih srebrnkastih pruga koje se protežu do repnog i analnog peraja. Dorzalna strana im je maslinastozelene boje. Mužjaci su vitkiji od ženki. Ženke su srebrnkastije, a abdomen im je rastegnut, naročito pre mresta.
Odrasle ribe podnose velike fluktuacije temperature, pH i tvrdoće vode. Međutim, da bi se dobila zdrava riba koja proizvodi kvalitetna jaja, potrebno je obezbediti optimalne uslove.
Tokom mresta, mužjak prati ženku i nasrće na nju, a jaja budu oplođena čim se izbace. Jaja, koja su prozirna i neljepljiva, padaju na dno, na kom ih roditelji mogu pojesti. Na mrest utiče svetlost. Ukoliko je jutarnje svetlo adekvatno, riba se mresti u ranim jutarnjim satima, u zoru.
Ženka u razmaku od po nedelju dana može proizvesti serije od nekoliko stotina jaja.
USLOVI KOJE TREBA OBEZBEDITI RODITELJSKOJ POPULACIJI, REPRODUKCIJA I RANI RAZVOJNI STADIJUMI
Izabere se odgovarajući broj zdravih jedinki i drže se u odgovarajućoj vodi (videti Deo peti ove metode) najmanje 2 nedelje pre mresta. Grupi riba treba dozvoliti da se razmnožava najmanje jednom pre nego što će se jaja koristiti u ispitivanju. Gustina populacije u toku ovog perioda ne sme da prelazi 1 gram ribe po litri. Redovna izmena vode ili upotreba sistema za prečišćavanje vode obezbeđuje veću gustinu. Temperaturu u akvarijumima treba održavati na (25 ± 2) °C. Ribama treba davati raznovrsnu ishranu koja se može sastojati od. pogodne komercijalne suve hrane, živih novoizleglih larvi artemija, hironomida, dafnija, enhitrada.
Postupci koji su u praksi obezbeđivali serije zdravih, oplođenih jaja, koja su korišćena za ispitivanja su:
U komoru za ispitivanje sa 50 L vode za razblaživanje smešta se osam ženki i 16 mužjaka, zaštiti od direktnog svetla i ostavi da uz što manje ometanja tamo borave najmanje 48 sati. Dan pre početka ispitivanja na dno komore se u poslepodnevnim satima postavlja posuda za mrest. Posuda se sastoji od okvira (od pleksiglasa ili nekog drugog prikladnog materijala), visine 5 cm do 7 cm, na čiji je vrh pričvršćena gruba mrežica promeraokaca 2 mm do 5 mm, a na dno se pričvrsti fina mrežica okaca od 10 μm do 30 μm. Na grubu mrežicu smeštenu na okvir pričvrsti se "drveće za mrest" napravljeno od raspletenog najlonskog užeta. Nakon što se riba 12 sati ostavi u mraku, upali se prigušeno svetlo koje stimuliše mrest. Dva do četiri sata nakon mresta, posuda za mrest se skloni i pokupe se jaja. Posuda za mrest sprečava ribe da pojedu jaja, a istovremeno omogućava da se ona lako sakupe. Pre mresta iz kojeg će se jaja koristiti u ispitivanjima, roditeljska grupa riba mora da ima najmanje jedan mrest iz koga se jaja ne koriste u ispitivanju.
Najmanje dve nedelje pre planiranog mresta, 5 do 10 mužjaka i ženki drže se pojedinačno. Nakon 5 do 10 dana, trbusi ženki se rastežu, a njihove genitalne papile postaju vidljive. Mužjaci nemaju papile. Mrest se obavlja u za to namenjenim komorama, opremljenim lažno-mrežastim dnom (kako je opisano). Komora se napuni vodom za razblaživanje, tako da visina vodenog stuba iznad mrežice iznosi 5 cm do 10 cm. Dan pre planiranog mresta, u komoru se smešta jedna ženka i dva mužjaka. Temperatura vode se postupno povećava do vrednosti koja je za jedan stepen viša od temperature na koju su se ribe aklimatizovale. Komora se ostavi u mraku, bez uznemiravanja. Ujutro se upali prigušeno svetlo, što stimuliše mrest. Nakon 2 do 4 sata ribe se uklone, a jaja pokupe. Ako postoji potreba za serijama jaja većim od onih koje se mogu dobiti od jedne ženke, istovremeno se može postaviti veći broj takvih komora. Beleženjem uspešnosti reprodukcije pojedinih ženki pre početka ispitivanja (veličine i kvaliteta serije njihovih jaja), za priplod se mogu odabrati ženke čija je reprodukcija najuspešnija.
Jaja se u posude za ispitivanje prenose pomoću staklenih pipeta (unutrašnjeg promera ne manjeg od 4 mm), koje imaju gumenu pumpicu. Količina vode u kojoj se jaja prenose mora biti što je moguće manja. Jaja su teža od vode pa lako iscure iz cevčice. Potrebno je preduzeti mere kojima se sprečava da jaja (i larve) dođu u dodir sa vazduhom. Uzorci serija se pregledaju mikroskopski, kako bi se uverilo da u početnim razvojnim stadijumima nema nepravilnosti. Dezinfekcija jaja nije dozvoljena.
Stopa smrtnosti jaja najviša je u prva 24 sata nakon oplodnje. Tokom ovog razdoblja često se uočava stopa smrtnosti od 5% do 40%. Jaja degenerišu zbog neuspešne oplodnje ili razvojnih mana. Čini se da kvalitet serije jaja zavisi od ženke, jer dok neke ženke dosledno proizvode kvalitetna jaja, kod drugih se to nikada neće dogoditi. Brzina razvoja i izvaljivanja larvi varira od serije do serije. Stopa preživljavanja uspešno oplođenih jaja i larvi je visoka, obično iznad 90%. Pri temperaturi od 25 °C larve se izvaljuju iz jaja 3 do 5 dana nakon oplodnje, a žumančana kesa se apsorbuje otprilike 13 dana nakon oplodnje.
Dobro je istražen embrionalni razvoj2. Zbog prozirnosti jaja i larvi koje su se iz njih izvalile, prati se razvoj jedinki i uočavaju patološki razvojni oblici. Otprilike četiri sata nakon mresta, neoplođena jaja mogu se razlikovati od oplođenih3. Da bi se izvršilo ovaj pregled, jaja i larve se stavljaju u posude male zapremine i pregledaju pod mikroskopom.
Uslovi pod kojim se obavlja ispitivanje ranih razvojnih oblika nabrojani su u Delu trećem ove metode. Optimalna tvrdoća vode koja se koristi za razblaživanje je 250 mg CaCO3/l, a pH vrednost 7,8.
Predlaže se dvostepeni pristup. Prvo se statistički analiziraju podaci o smrtnosti, patološkom razvoju i vremenu potrebnom da se larve izvale. Zatim se, kod riba izloženih koncentracijama ispitivane supstance pri kojima nisu uočeni nikakvi neželjeni efekti ni na jedan od ovih pokazatelja, statistički vrednuje dužina tela. Ovo je preporučljiv pristup jer toksična supstanca može selektivno letalno da deluje na manje jedinke, odloži vreme izvaljivanja i izazove makroskopski vidljive patološke oblike, dovodeći do odstupanja pri merenju dužine tela. Pri svakoj koncentraciji meri se u gruboj isti broj jedinki, čime se obezbeđuje valjanost statističke obrade rezultata ispitivanja.
Procenat preživelih embriona i larvi računa se i koriguje u odnosu na smrtnost zabeleženu u kontrolnim grupama, u skladu sa Abotovom jednačinom4:
![]()
pri čemu:
P jeste korigovani procenat preživljavanja;
P‘ jeste procenat preživljavanja uočen pri test koncentraciji;
C jeste procenat preživljavanja u kontrolnim grupama.
Ako postoji mogućnost, LC50 se određuje prikladnom metodom na kraju ispitivanja.
Ako je u statističku analizu EC50 potrebno uključiti i morfološke abnormalnosti, smernice i uputstvo dati su u literaturi5.
Cilj ispitivanja toksičnosti na embrionima i larvama je poređenje delovanja koncentracija ispitivane supstance većih od nule sa kontrolnim grupama, odnosno cilj metode je odrediti LOEC. Zbog toga treba primeniti postupke višestrukog poređenja6, 7, 8, 9, 10.
1. Laale H.W., (1977) The Biology and Use of the Zebrafish (Brachydanio rerio) in Fisheries Research. A Literature Review.J. Fish Biol. 10, p. 121-173.
2. Hisaoka K.K. and Battle H.I., (1958). The Normal Development Stages of the Zebrafish Brachydanio rerio(Hamilton-Buchanan) J. Morph., 102, p. 311.
3. Nagel R., (1986). Untersuchungen zur Eiproduktion beim Zebrabärbling (Brachydanio rerio Hamilton-Buchanan). Journal of Applied Ichthyology, 2, p. 173-181.
4. Finney D.J., (1971). Probit Analysis, 3rd ed., Cambridge University Press, Great Britain, p. 1-333.
5. Stephan C.E., (1982). Increasing the Usefulness of Acute Toxicity Tests. Aquatic Toxicology and Hazard Assessment:Fifth Conference, ASTM STP 766, J.G. Pearson, R.B. Foster and W.E. Bishop, Eds., American Society for Testing and Materials, p. 69-81.
6. Dunnett C.W. (1955). A Multiple Comparisons Procedure for Comparing Several Treatments with a Control. J. Amer. Statist. Assoc., 50, p. 1096-1121.
7. Dunnett C.W., (1964) New Tables for Multiple Comparisons with a Control. Biometrics, 20, p. 482-491.
8. Williams D.A., (1971). A Test for Differences Between Treatment Means when Several Dose Levels are Compared witha Zero Dose Control. Biometrics, 27, p. 103-117.
9. Williams D.A., (1972). The Comparison of Several Dose Levels with a Zero Dose Control. Biometrics 28, p. 519-531.
10. Sokal R.R. and Rohlf F.J., (1981). Biometry, the Principles and Practice of Statistics in Biological Research, W.H.Freeman and Co., San Francisco.
USLOVI ISPITIVANJA, TRAJANJE ISPITIVANJA I KRITERIJUMI OCENE PREŽIVLJAVANJA ZA VRSTE KOJE SU PREPORUČENE ZA OVU METODU ISPITIVANJA
VRSTE | TEMPERATURA | SALINITET | FOTOPERIOD | DUŽINA TRAJANJA STADIJUMA (DANI) | TIPIČNA DUŽINA ISPITIVANJA | PREŽIVLJAVANJE U KONTROLNIM GRUPAMA, | ||
| EMBRIONI | LARVE | USPEŠNO IZVALJIVANJE | POSLE IZVALJIVANJA | ||||
Slatkovodne | ||||||||
Brachydanio rerio | 25 ± 1 | - | 12-16 | 3-5 | 8-10 | odmah po oplodnji (rana faza gastrule) do 5 dana posle izvaljivanja (8 do 10 dana) | 80 | 90 |
Oncorhynchus mykiss (pastrmka) | 10 ± 1LXXI | - | 0LXXIII | 30-35 | 25-30 | odmah po oplodnji (rana faza gastrule) do 20 dana posle izvaljivanja (50 do 55 dana) | 66 | 70 |
Cyprinus carpio | 21 - 25 | - | 12-16 | 5 | > 4 | odmah po oplodnji (rana faza gastrule) do 4 dana posle izvaljivanja (8 do 9 dana) | 80 | 75 |
Oryzias latipes | 24 ± 1XV | - | 12-16 | 8-11 | 4-8 | odmah po oplodnji (rana faza gastrule) do 5 dana posle izvaljivanja (13 do 16 dana) | 80 | 80 |
Pimephales promelas | 25 ± 2 | - | 16 | 4-5 | 5 | odmah po oplodnji (rana faza gastrule) do 4 dana posle izvaljivanja (8 do 9 dana) | 60 | 70 |
USLOVI POD KOJIMA SE VRŠI ISPITIVANJE, DUŽINA ISPITIVANJA I KRITERIJUMI OCENE PREŽIVLJAVANJA ZA DRUGE DOBRO PROUČENE VRSTE
VRSTE | TEMPERATURA (°C) | SALINITET (0/00) | FOTOPERIOD (SATI) | DUŽINA TRAJANJA STADIJUMA (DANI) | TIPIČNA DUŽINA ISPITIVANJA | PREŽIVLJAVANJE U KONTROLNIM GRUPAMA(MINIMUM%) | ||
EMBRIONI | LARVE | USPEŠNO IZVALJIVANJE | POSLE IZVALJIVANJA | |||||
SLATKOVODNE | ||||||||
Carassius auratu | 24 ± 1 | - | - | 3-4 | > 4 | odmah po oplodnji (rana faza gastrule) do 4 dana posle izvaljivanja (7 dana) | - | 80 |
Leopomis macrochirus | 21 ± 1 | - | 16 | 3 | > 4 | odmah po oplodnji (rana faza gastrule) do 4 dana posle izvaljivanja (7 dana) | - | 75 |
MORSKE | ||||||||
Menidia peninsulae | 22-25 | 15-22 | 12 | 1,5 | > 4 | odmah po oplodnji (rana faza gastrule) do 5 dana posle izvaljivanja (6 do 7 dana) | 80 | 60 |
Clupea harengus | 10 ± 1 | 8-15 | 12 | 20-25 | 4-8 | odmah po oplodnji (rana faza gastrule) do 3 dana posle izvaljivanja (23 do 27 dana) | 60 | 80 |
Gadus morhua | 5 ± 1 | 5-30 | 12 | 14-16 | 5 | odmah po oplodnji (rana faza gastrule) do 3 dana posle izvaljivanja (18 dana) | 60 | 80 |
Cyprinodon variegatus | 25 ± 1 | 15-30 | 12 | - | - | odmah po oplodnji (rana faza gastrule) do 4/7 dana posle izvaljivanja (28 dana) | > 75 | 80 |
________
XV Za embrione
XVI Za larve
XVII Embrioni i larve do jedne nedelje nakon izvaljivanja drže se u mraku, osim kada se pregledaju. Od tada se primenjuje režim smanjenog osvetljenja.
HEMIJSKA SVOJSTVA VODE PRIHVATLJIVE ZA RAZBLAŽIVANJE
SUPSTANCA | KONCENTRACIJE |
Čestice | < 20 mg/l |
Ukupni organski ugljenik | < 2 mg/l |
Nejonizovani amonijak | < 1 (g/l |
Rezidualni hlor | < 10 (g/l |
Ukupni organofosforni pesticidi | < 50 ng/l |
Ukupni organohlorni pesticidi i polihlorovani bifenili | < 50 ng/l |
Ukupni organski hlor | < 25 ng/l |
C.16. PČELE - ISPITIVANJE AKUTNE ORALNE TOKSIČNOSTI
Metoda se zasniva na OECD TG 213 (1998) uputstvu ispitivanja.
Ova metoda ispitivanja toksičnosti jeste laboratorijska metoda dizajnirana za procenu akutne oralne toksičnosti sredstava za zaštitu bilja i drugih hemikalija na odrasle pčele-radilice.
Postupak procene i vrednovanja toksičnih osobina supstanci može zahtevati utvrđivanje akutne oralne toksičnosti kod pčela, npr. u slučajevima kada je verovatno da će pčele biti izložene datoj hemikaliji. Ispitivanje akutne oralne toksičnosti izvodi se da bi se utvrdila svojstvena toksičnost pesticida i drugih hemikalija na pčele. Rezultati ovog ispitivanja koriste se za utvrđivanje potrebe za daljim vrednovanjem. Metoda je posebno pogodna kod etapnih programa za procenu hazarda koji pesticidi predstavljaju za pčele, na osnovu hijerarhijskog redosleda, od laboratorijskih ispitivanja toksičnosti, do poliuterenskih i terenskih ispitivanja1. Pesticidi se mogu ispitivati kao aktivne supstance (u daljem tekstu: a.s) ili kao formulisani proizvodi.
Osetljivost pčela i preciznost postupka ispitivanja mora se potvrditi primenom standardnih toksičnih supstanci.
Akutna oralna toksičnost jesu štetne posledice koje se javljaju najkasnije 96 sati nakon oralne primene jednokratne doze ispitivane supstance.
Doza jeste količina konzumirane ispitivane supstance i izražava se kao masa (µg) ispitivane supstance po jedinki (µg/pčela). Prava doza za svaku pčelu ne može se izračunati s obzirom na to da se pčele hrane kolektivno, ali se može izračunati prosečna doza (u potpunosti konzumirana ispitivana supstanca po broju jedinki - pčela u jednom kavezu).
Oralna LD50 (srednja letalna doza) jeste statistički izvedena jednokratna doza supstance koja može izazvati smrt 50% životinja kad se primenjuje oralno. Vrednost LD50 izražava se u (µg) ispitivane supstance po pčeli. Ako se ispituje dejstvo pesticida, ispitivana supstanca može biti aktivna supstanca ili formulisani proizvod koji sadrži jednu ili više aktivnih supstanci.
Smrtnost jeste slučaj kada je jedinka potpuno nepomična i smatra se uginulom.
Odrasle pčele radilice (Apis melifera) izlažu se seriji doza ispitivane supstance, raspršene u rastvoru saharoze. Pčelama se nakon primene jednokratne doze daje ista hrana, ali bez ispitivane supstance. Smrtnost se beleži svakodnevno u toku najmanje 48 sati i poredi sa kontrolnim vrednostima. Ukoliko između 24 i 48 sata stopa smrtnosti raste, dok u kontrolnoj grupi i dalje ostaje na prihvatljivom nivou, odnosno < 10%, primereno je produžiti trajanje ispitivanja do najviše 96 sati. Rezultati ispitivanja se analiziraju da bi se izračunala vrednost LD50 nakon 24 i 48 sati, a u slučaju da je ispitivanje produženo i nakon 72 i 96 sati.
1.4. KRITERIJUMI PRIHVATLJIVOSTI ISPITIVANJA
Da bi ispitivanje bilo prihvaćeno, moraju biti zadovoljeni sledeći uslovi:
- prosečna smrtnost za ukupni broj kontrolnih grupa ne sme prelaziti 10% na kraju ispitivanja;
- LD50 standarda toksičnosti mora se nalaziti u određenom opsegu.
1.5.1. Sakupljanje pčela
Koriste se mlade odrasle pčele radilice istog roda, odnosno pčele jednake starosti, stanja uhranjenosti itd. Pčele treba nabaviti iz adekvatno hranjenih, zdravih kolonija, bez zabeleženih bolesti, koliko je moguće, ustrojenih po hijerarhijskom principu matice, poznatog pedigrea i fiziološkog statusa. Mogu se sakupiti onog jutra kada se planira početak ispitivanja ili prethodno veče, pa ih do sutradan držati u eksperimentalnim uslovima. Prikladne su pčele sakupljene sa okvira na kojima nema jaja. Sakupljanje pčela u rano proleće ili kasnu jesen treba izbegavati, jer je njihova fiziologija u to vreme promenjena. Ako se ispitivanje mora izvesti u rano proleće ili kasnu jesen, pčele se mogu izleći u inkubatoru i othraniti nedelju dana "pčelinjim hlebom" (polenom sakupljenim iz saća) i rastvorom saharoze. Pčele tretirane hemijskim supstancama (antibiotici, proizvodi za uništavanje Varroa grinja) nije dozvoljeno koristiti za ispitivanje toksičnosti četiri nedelje nakon završetka poslednjeg tretmana.
1.5.2. Uslovi smeštaja i ishrane
Koriste se kavezi koji se lako čiste i dobro provetravaju. Mogu biti od bilo kog prikladnog materijala, npr. nerđajućeg čelika, žičane mreže, plastike, a mogu se koristiti i drveni kavezi za jednokratnu upotrebu itd. Preporučuju se grupe od 10 pčela po kavezu. Veličina kaveza mora biti primerena broju pčela, kako bi im se pružio odgovarajući prostor.
Pčele treba držati u tamnoj laboratoriji na temperaturi od (25 ± 2) °C. Relativnu vlažnost, koja uobičajeno iznosi oko 50% do 70%, treba beležiti u toku trajanja celog ispitivanja. Postupci rukovanja, uključujući tretman i beleženje zapažanja, mogu se obavljati na dnevnom svetlu. Kao hrana koristi se vodeni rastvor saharoze, krajnje koncentracije od 500 g/l (50% odnosa težine i zapremine, w/v). Nakon što su date doze, hranu treba davati neograničeno (ad libitum). Sistem hranjenja treba da omogući praćenje unosa hrane za svaki kavez (videti odeljak 1.6.3.1. ove metode). Može se koristiti i staklena cevčica (dužine oko 50 mm, širine 10 mm, sa otvorenim krajem koji se sužava do promera od oko 2 mm).
1.5.3. Priprema pčela
Pčele sakupljene slučajnim rasporedom smeštaju se u kaveze koji se nalaze u laboratoriji, takođe po slučajnom rasporedu. Pčele se mogu izgladneti do 2 sata pre početka ispitivanja. Preporučuje se da se pčele ne hrane pre tretmana da bi na početku ispitivanja svim jedinkama crevni sadržaj bio isti. Pčele na umoru pre početka ispitivanja treba odbaciti i zameniti ih zdravim.
1.5.4. Priprema doza
Ako ispitivana supstanca spada u jedinjenja koja se mogu mešati sa vodom, može se direktno raspršiti u 50%-ni rastvor saharoze. Ako su u pitanju komercijalni proizvod i supstance slabo rastvorljive u vodi, mogu se upotrebiti nosači kao što su organski rastvarači, emulgatori ili disperziona sredstva niske toksičnosti za pčele (npr. aceton, dimetilformamid, dimetilsulfoksid). Koncentracija nosača zavisi od rastvorljivosti ispitivane supstance i u svim grupama, u svim koncentracijama mora da bude ista. Smatra se da je odgovarajuća koncentracija nosača 1% i ne treba je prekoračiti.
Potrebno je pripremiti adekvatne kontrolne rastvore koji sadrže nosač (rastvarač ili disperziono sredstvo). Koriste se dve odvojene kontrolne grupe sa vodenim rastvorom i sa rastvorom saharoze u koju je dodat nosač i to u koncentraciji primenjenoj u ispitivanim rastvorima.
1.6.1. Ispitivane i kontrolne grupe
Broj doza i broj ponavljanja mora zadovoljiti statističke zahteve u pogledu određivanja LD50 u intervalima poverenja od 95%. Obično se ispitivanje radi sa 5 doza u geometrijskoj seriji, sa faktorom ne većim od 2,2 tako da bude obuhvaćen opseg potreban za određivanje LD50. Faktor razblaženja i broj koncentracija za doziranje moraju se odrediti prema nagibu krive toksičnosti (doza prema smrtnosti), vodeći računa o zahtevima statističke metode odabrane za analizu rezultata. Preliminarna studija u cilju utvrđivanja opsega koncentracija omogućuje pravilan izbor ispitivanih koncentracija.
Najmanje tri grupe po 10 pčela u svakom kavezu moraju se izložiti svakoj ispitivanoj dozi. U svakom ispitivanju mora se obezbediti najmanje tri kontrolne grupe sa po 10 pčela po kavezu. Potrebno je uključiti i dodatne kontrolne grupe ako se koriste nosači (videti odeljak 1.5.4. ove metode).
1.6.2. Standard toksičnosti
U ispitivane serije mora se uključiti i studija toksičnosti standarda. Da bi se obuhvatila očekivana vrednost LD50, potrebno je odabrati najmanje tri doze standardna. Najmanje tri grupe po 10 pčela u svakom kavezu moraju se izložiti svakoj dozi standarda. Kao standard toksičnosti obično se koristi dimetoat, čija se LD50 nakon 24 sata peroralne primene kreće u opsegu od 0,10 µg do 0,35 µg a.s./pčeli2. Prihvatljivi su i drugi standardi toksičnosti, pod uslovom da se raspolaže dovoljnom količinom podataka o očekivanoj doznoj zavisnosti (npr. paration).
1.6.3. Izlaganje
1.6.3.1. Primena doza
Svakoj od ispitivanih grupa pčela mora se obezbediti 100 µl do 200 µl 50%-nog vodenog rastvora saharoze koji sadrži određenu koncentraciju ispitivane supstance. Ako se ispituju slabo rastvorljiva, netoksična ili jedinjenja koja se u komercijalnom proizvodu nalaze u niskim koncentracijama, mora se primeniti veća zapremina, jer njihov udeo u rastvoru saharoze mora biti veći. Neophodno je pratiti količinu tretirane hrane koju je konzumirala svaka od ispitivanih grupa. Kada ispitivane jedinke pojedu tretiranu hranu (obično u toku 3 do 4 sata), hranilicu treba ukloniti iz kaveza i zameniti je drugom koja sadrži samo rastvor saharoze. Rastvor saharoze pčelama se stavlja na raspolaganje ad libitum. Kod nekih jedinjenja u višim koncentracijama, pčele tretiranu hranu mogu odbijati, što dovodi do toga da pojedu malo hrane ili je ne pojedu uopšte. Nakon najviše 6 sati hranilica sa ostacima tretirane hrane mora se zameniti netretiranom rastvorom saharoze. Potrebno je proceniti koliko je tretirane hrane konzumirano (npr. merenjem odnosa zapremine ili mase ostataka tretirane hrane).
1.6.3.2. Dužina ispitivanja
Preporučuje se da, nakon što se ispitivani rastvor zameni netretiranim rastvorom saharoze, ispitivanje traje 48 sati. Ako se registruje rast smrtnosti nakon prva 24 sata za više od 10%, ispitivanje se mora se produžiti do najviše 96 sati, pod uslovom da smrtnost u kontrolnim grupama ne prelazi 10%.
1.6.4. Zapažanja
Smrtnost se beleži 4 sata nakon početka ispitivanja, zatim nakon 24 sata i 48 sati (nakon primene doze). Ukoliko se ukaže potreba da se ispitivanje produži, dalje procene treba vršiti u 24-satnim intervalima, najduže do ukupno 96 sati, pod uslovom da smrtnost u kontrolnim grupama ne prelazi 10%.
Potrebno je utvrditi količinu hrane koju je svaka grupa pčela konzumirala. Poređenje brzine konzumacije tretirane i netretirane hrane unutar određenog šestosatnog razdoblja može dati podatke o ukusu tretirane hrane.
Potrebno je zabeležiti sve pojave neuobičajenog ponašanja tokom ispitivanja.
1.6.5. Granična studija
U nekim slučajevima (npr. kada se očekuje da je ispitivana supstanca netoksična) može da se postavi granična studija, upotrebom 100 µg a.s./pčeli, da bi se pokazalo da LD50 prelazi ovu vrednost. Treba koristiti isti postupak, uključujući tri ispitivane grupe (replike) koje će se izložiti dozi, relevantne kontrolne grupe, procenu konzumirane količine tretirane hrane i upotrebu standarda toksičnosti. Ukoliko dođe do uginuća pčela, ispitivanje je neophodno izvesti u celosti, a beleže se i subletalni efekti (videti odeljak 1.6.4. ove metode).
Podaci se prikazuju u tabelarnoj formi. Za svaku ispitivanu grupu, bilo da je u pitanju kontrolna ili grupa standardne toksičnosti, navodi se broj ispitivanih jedinki, smrtnost u svakom izabranom trenutku opažanja, kao broj pčela sa neželjenim promenama u ponašanju. Podaci o smrtnosti se analiziraju pogodnim statističkim metodama (npr. probit-analizom, lutajućom srednjom vrednošću, binomnom verovatnoćom)3, 4. Potrebno je grafički prikazati krive dozne zavisnosti za svaki preporučeni sat posmatranja, izračunati nagib krive i srednju letalnu dozu (LD50) sa 95% intervalom poverenja. Ispravke vezane za smrtnost u kontrolnoj grupi se mogu uraditi pomoću Abotove korekcije4, 5. Ako tretirana hrana nije u potpunosti konzumirana, potrebno je odrediti dozu ispitivane supstance koju je zaista konzumirala svaka grupa. LD50 treba izraziti u µg ispitivane supstance po pčeli.
Izveštaj o ispitivanju mora da sadrži podatke:
1) ispitivana supstanca:
- fizičke osobine i relevantna fizička i hemijska svojstva (npr. postojanost u vodi, napon pare);
- podaci od značaja za hemijsku identifikaciju supstance, uključujući strukturnu formulu, čistoću (npr. ako se radi o pesticidima, generički naziv i koncentraciju aktivnih supstanci).
2) ispitivana vrsta:
- latinski naziv, rod, približna starost (u nedeljama), metoda prikupljanja, datum prikupljanja;
- podaci o kolonijama iz kojih su sakupljene pčele, uključujući zdravstveno stanje u tim kolonijama, postojanje bilo kakve bolesti odraslih primeraka, bilo kakav prethodni tretman, itd.
3) uslovi u toku ispitivanja:
- temperatura i relativna vlažnost u laboratoriji;
- uslovi smeštaja ispitivanih jedinki, uključujući vrstu, veličinu kaveza i materijal od kojeg su napravljeni;
- metode pripreme osnovnog i ispitivanih rastvora (ukoliko se koristi nosač, mora se navesti vrsta i koncentracija);
- postavka ispitivanja, npr. broj korišćenih koncentracija i broj kontrola (broj kaveza replikata i broj pčela po kavezu za svaku koncentraciju i kontrolu);
- datum ispitivanja.
4) rezultati:
- rezultati preliminarnog ispitivanja za određivanje opsega doza, ako je rađeno;
- neobrađeni podaci - smrtnost u svakoj od ispitivanih koncentracija, u svakom satu opažanja;
- grafički prikaz krive dozne zavisnosti na kraju ispitivanja;
- vrednosti LD50, sa 95% intervalom poverenja, u svakom od preporučenih momenata opažanja, za ispitivanu supstancu i toksični standard;
- statističke metode korišćene za određivanje LD50;
- smrtnost u kontrolama;
- drugi primećeni ili izmereni biološki odgovori i bilo kakvo neuobičajeno ponašanje pčela (uključujući odbijanje hrane tretirane ispitivanom dozom), brzina potrošnje hrane u tretiranim i netretiranim grupama;
- bilo kakvo odstupanje od postupka ovde opisane metode ispitivanja i bilo kakvi drugi važni podaci.
1. EPPO/Council of Europe (1993) Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Products - Honeybees. EPPO bulletin, vol. 23, N.1, 151-165. March 1993. 31.5.2008 EN Official Journal of the European Union L 142/621
2. Gough, H. J., McIndoe, E.C., Lewis, G.B., (1994) The use of dimethoate as a reference compound in laboratory acute toxicity tests on honeybees (Apis mellifera L.) 1981-1992. Journal of Apicultural Research, 22, p. 119-125.
3. Litchfield, J.T. and Wilcoxon, F., (1949) A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, p. 99-113.
4. Finney, D.J., (1971) Probit Analysis. 3rd ed., Cambridge, London and New-York.
5. Abbott, W.S., (1925) A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol., 18, p. 265-267.
C.17. PČELE - ISPITIVANJE AKUTNE KONTAKTNE TOKSIČNOSTI
Metoda se zasniva na OECD TG 214 (1998) uputstvu ispitivanja.
Ovo ispitivanje toksičnosti je laboratorijska metoda dizajnirana za procenu akutne kontaktne toksičnosti sredstava za zaštitu bilja i drugih hemikalija na odrasle pčele-radilice.
Postupak procene i vrednovanja toksičnih osobina supstanci može zahtevati utvrđivanje akutne kontaktne toksičnosti kod pčela, npr. u slučajevima kada je verovatno da će pčele biti izložene datoj hemikaliji. Ispitivanje akutne kontaktne toksičnosti izvodi se da bi se utvrdila svojstvena toksičnost pesticida i drugih hemikalija na pčele. Rezultati ovog ispitivanja koriste se za utvrđivanje potrebe za daljim postupanjem. Ova metoda je posebno pogodna kod etapnih programa za procenu opasnosti koju pesticidi predstavljaju za pčele, na osnovu hijerarhijskog redosleda, od laboratorijskih ispitivanja toksičnosti, do poluterenskih i terenskih ispitivanja1. Pesticidi se mogu ispitivati kao aktivne supstance (u daljem tekstu: a.s.) ili kao formulisani proizvodi.
Osetljivost pčela i preciznost postupka ispitivanja mora se potvrditi primenom standardnih toksičnih supstanci.
Akutna kontaktna toksičnost jesu štetne posledice koje se javljaju najkasnije 96 sati nakon kontaktne primene jednokratne doze ispitivane supstance.
Doza jeste količina primenjene ispitivane supstance. Doza se izražava kao masa (mg) ispitivane supstance po jedinki (µg/pčele).
Kontaktna LD50 (srednja letalna doza) jeste statistički izvedena jednokratna doza supstance koja može izazvati smrt 50% životinja koje dođu u kontakt sa njom. Vrednost LD50 izražava se u (mg) ispitivane supstance po pčeli. Ako se ispituje dejstvo pesticida, ispitivana supstanca može biti aktivna supstanca ili formulisani proizvod koji sadrži jednu ili više aktivnih supstanci.
Smrtnost jeste slučaj kada je jedinka potpuno nepomična i smatra se uginulom.
Odrasle pčele radilice (Apis melifera) izlažu se seriji doza ispitivane supstance, rastvorene u odgovarajućem nosaču, direktnim nanošenjem (kapljica) na grudni koš. Ispitivanje traje 48 sati. Ukoliko između 24 i 48 sata stopa smrtnosti raste, a u kontrolnoj grupi i dalje ostaje na prihvatljivom nivou, tj. < 10%, primereno je produžiti trajanje ispitivanja do najviše 96 sati. Smrtnost se beleži svakodnevno u toku najmanje 48 sati i poredi sa kontrolnim vrednostima. Rezultati ispitivanja se analiziraju, da bi se se izračunala vrednost LD50 nakon 24 i 48 sati, a u slučaju da je ispitivanje produženo i nakon 72 sata i 96 sati.
1.4. KRITERIJUMI PRIHVATLJIVOSTI ISPITIVANJA
Da bi ispitivanje bilo prihvaćen, moraju biti zadovoljeni sledeći uslovi:
- prosečna smrtnost u kontrolnoj grupi ne sme prelaziti 10% na kraju ispitivanja;
- LD50 standarda toksičnosti mora se nalaziti u određenom opsegu.
1.5.1. Sakupljanje pčela
Koriste se mlade odrasle pčele radilice istog roda, tj. pčele jednake starosti, stanja uhranjenosti itd. Pčele se nabavljaju iz adekvatno hranjenih, zdravih kolonija, bez zabeleženih bolesti, koliko je moguće, ustrojenih po hijerarhijskom principu matice, poznatog pedigrea i fiziološkog statusa. Mogu se sakupiti onog jutra kada se planira početak ispitivanja, ili prethodno veče, pa se do sutradan drže u uslovima koji će vladati u toku ispitivanja. Prikladne su pčele sakupljene sa okvira na kojima nema jaja. Sakupljanje pčela u rano proleće ili kasnu jesen treba izbegavati, jer je njihova fiziologija u to vreme promenjena. Ako se ispitivanje mora izvesti u rano proleće ili kasnu jesen, pčele se mogu izleći u inkubatoru i othraniti nedelju dana "pčelinjim hlebom" (polenom sakupljenim iz saća) i rastvorom saharoze. Pčele tretirane hemijskim supstancama (antibiotici, proizvodi za uništavanje Varroa grinja) nije dozvoljeno koristiti za ispitivanje toksičnosti četiri nedelje nakon završetka poslednjeg tretmana.
1.5.2. Uslovi smeštaja i ishrane
Koriste se kavezi koji se lako čiste i dobro provetravaju. Mogu biti od bilo kog prikladnog materijala, npr. nerđajućeg čelika, žičane mreže, plastike, a mogu se koristiti i drveni kavezi za jednokratnu upotrebu, itd. Preporučuju se grupe od 10 pčela po kavezu. Veličina kaveza mora biti primerena broju pčela, kako bi im se pružio odgovarajući prostor.
Pčele treba držati u tamnoj laboratoriji na temperaturi od (25 ± 2) °C. Relativnu vlažnost, koja uobičajeno iznosi oko 50% do 70%, treba beležiti u toku trajanja celog ispitivanja. Postupci rukovanja, uključujući tretman i beleženje zapažanja, mogu se obavljati na dnevnom svetlu. Kao hrana se koristi vodeni rastvor saharoze, krajnje koncentracije od 500 g/l (50% odnosa težine i zapremine, w/v). Nakon što su date doze, hranu treba davati neograničeno (ad libitum), koristeći hranilicu za pčele. Za tu namenu se može koristiti i staklena cevčica (dužine oko 50 mm, širine 10 mm, sa otvorenim krajem koji se sužava do promera od oko 2 mm).
1.5.3. Priprema pčela
Da bi se omogućilo nanošenje ispitivane supstance, sakupljene pčele se mogu anestezirati ugljen-dioksidom ili azotom. Količinu upotrebljenog anestetika i trajanje anestezije treba svesti na najmanju moguću meru. Pčele na umoru pre početka ispitivanja treba odbaciti i zameniti zdravim.
1.5.4. Priprema doza
Ispitivanu supstancu treba primeniti kao rastvor u nosaču, tj. rastvorenu u organskom rastvaraču ili vodi, uz sredstvo koje osigurava vlažnost. Kada je reč o organskom rastvaraču, prednost se daje acetonu, ali se mogu upotrebiti i drugi, po pčele netoksični organski rastvarači (npr. dimetilformamid, dimetilsulfoksid). Rastvori se mogu lakše naneti ako se pripreme u blagom rastvoru komercijalnog sredstva koje osigurava vlažnost (Agral, Cittowett, Lubrol, Triton, Tween). Reč je o komercijalnim proizvodima dispergovanim u vodi i visokopolarnim organskim supstancama koje se nerastvaraju u organskim rastvaračima.
Potrebno je pripremiti i pogodne kontrolne rastvore, tj. kod ispitivanja gde se za rastvaranje ispitivane supstance koristi rastvarač ili disperziono sredstvo, treba koristiti dve odvojene kontrolne grupe, jednu tretiranu vodom i drugu tretiranu rastvračem/disperzionim sredstvom.
1.6.1. Ispitivane i kontrolne grupe
Broj ispitivanih doza i njihovih replika mora zadovoljiti statističke zahteve u pogledu određivanja LD50 u intervalima poverenja od 95%. Obično se ispitivanje postavlja sa pet doza ispitivane supstance, u geometrijskoj seriji, sa faktorom ne većim od 2,2 tako da bude obuhvaćen opseg potreban za određivanje LD50. Faktor razblaženja i broj koncentracija za doziranje moraju se odrediti prema nagibu krive toksičnosti (doza prema smrtnosti), vodeći računa o zahtevima statističke metode odabrane za analizu rezultata. Preliminarna studija u cilju utvrđivanja opsega ispitivanih koncentracija omogućuje pravilan izbor ispitivanih koncentracija.
Minimalno tri grupe replika, svaka po deset pčela, treba izložiti dozama ispitivane supstance.
U svakom ispitivanju mora se obezbediti najmanje tri kontrolne grupe sa po 10 pčela. Ako je korišćen neki organski rastvarač ili sredstvo koje osigurava vlažnost, potrebno je uključiti još tri dodatne kontrolne serije sa po 10 pčela u svakoj od njih, koje će se tretirati samo rastvaračem, odnosno samo agensom koji osigurava vlažnost.
1.6.2. Standard toksičnosti
U ispitivane serije mora se uključiti i ispitivanje toksičnosti standarda. Da bi se obuhvatila očekivana vrednost LD50, potrebno je odabrati najmanje tri doze standarda. Najmanje tri grupe po 10 pčela u svakom kavezu moraju se izložiti svakoj dozi standarda. Kao standard toksičnosti obično se koristi dimetoat, čija se LD50 nakon 24 sata peroralne primene kreće u opsegu od 0,10 mg do 0,35 mg a.s./pčeli2. Koriste se i drugi standardi toksičnosti, pod uslovom da se raspolaže dovoljnom količinom podataka o očekivanoj doznoj zavisnosti (npr. paration).
1.6.3. Izlaganje
1.6.3.1. Primena doza
Anestezirane pčele, svaka individua pojedinačno, tretiraju se ispitivanom supstancom. Pčele se grupišu slučajnim rasporedom u ispitivane i kontrolne grupe i tretiraju različitim dozama ispitivane supstance. Po 1 ml rastvora koji sadrži ispitivanu supstancu u datoj koncentraciji potrebno je naneti mikroaplikatorom na dorzalnu stranu toraksa svake jedinke. Ako za to postoji opravdanje, mogu se upotrebiti i druge zapremine ispitivane supstance. Nakon nanošenja ispitivane supstance, pčele se stavljaju u kaveze i obezbedi im se rastvor saharoze.
1.6.3.2. Dužina ispitivanja
Preporučuje se da ispitivanje traje 48 sati. Ukoliko smrtnost između 24 i 48 sata nastavi da raste za više od 10%, ispitivanje se mora produžiti do najviše 96 sati, pod uslovom da smrtnost u kontrolnim grupama ne prelazi 10%.
1.6.4. Zapažanja
Smrtnost se beleži 4 sata nakon primene ispitivane supstance, pa nakon 24 sata i 48 sati. Ukoliko se ukaže potreba da se ispitivanje produži, naredne procene treba obaviti u 24-satnim intervalima, najduže do ukupno 96 sati, pod uslovom da smrtnost u kontrolnim grupama ne prelazi 10%.
Potrebno je zabeležiti sve pojave neuobičajenog ponašanja tokom ispitivanja.
1.6.5. Granična studija
U nekim slučajevima (npr. kada se očekuje da je ispitivana supstanca netoksična) može se uraditi granična studija upotrebom 100 mg a.s./pčeli da bi se pokazalo da LD50 prelazi ovu vrednost. Treba koristiti isti postupak, uključujući tri ispitivane grupe (replike) koje se izlažu dozi, relevantne kontrolne grupe, procenu konzumirane količine tretirane hrane i upotrebu standarda toksičnosti. Ukoliko dođe do uginuća pčela, ispitivanje je neophodno izvesti u celosti. Ako se uoče subletalni efekti (videti odeljak 1.6.4. ove metode) treba ih zabeležiti.
Podaci se prikazuju u tabelarnoj formi. Za svaku ispitivanu grupu, bilo da je u pitanju kontrolna ili grupa standardne toksičnosti, navodi se broj ispitivanih jedinki, smrtnost u svakom izabranom trenutku opažanja, kao broj pčela sa neželjenim promenama u ponašanju. Podaci o smrtnosti se analiziraju pogodnim statističkim metodama (npr. probit-analizom, lutajućom srednjom vrednošću, binomnom verovatnoćom)3, 4. Potrebno je grafički prikazati krive dozne zavisnosti za svaki preporučeni sat posmatranja, izračunati nagib krive i srednju letalnu dozu (LD50) sa 95% intervalom poverenja. Ispravke vezane za smrtnost u kontrolnoj grupi se mogu uraditi pomoću Abotove korekcije4, 5. Ako tretirana hrana nije u potpunosti konzumirana, potrebno je odrediti dozu ispitivane supstance koju je zaista konzumirala svaka grupa. LD50 treba izraziti u µg ispitivane supstance po pčeli.
Izvještaj o ispitivanju mora da sadrži podatke o:
1) ispitivana supstanca:
- fizičke osobine i relevantna fizička i hemijska svojstva (npr. postojanost u vodi, napon pare);
- podaci od značaja za hemijsku identifikaciju supstance, uključujući strukturnu formulu, čistoću (npr. ako se radi o pesticidima, generički naziv i koncentraciju aktivnih supstanci).
2) ispitivana vrsta:
- latinski naziv, rod, približna starost (u nedeljama), metoda prikupljanja, datum prikupljanja;
- podaci o kolonijama iz kojih su sakupljene pčele, uključujući zdravstveno stanje kolonija, prisustvo bolesti kod odraslih primeraka, bilo kakav prethodni tretman, itd.
3) uslovi tokom ispitivanja:
- temperatura i relativna vlažnost u laboratoriji;
- uslovi smeštaja ispitivanih jedinki, uključujući vrstu, veličinu kaveza i materijal od kojeg su napravljeni;
- metode primene ispitivane supstance, npr. korišćen rastvarač-nosač, primenjena zapremina rastvora, korišćeni anestetici;
- postavka ispitivanja, npr. broj korišćenih koncentracija i broj kontrola (broj kaveza replikata i broj pčela po kavezu za svaku koncentraciju i kontrolu);
- datum ispitivanja.
4) rezultati:
- rezultati preliminarnog ispitivanja za određivanje opsega doza, ako je rađena;
- neobrađeni podaci - smrtnost u svakoj od ispitivanih koncentracija, u svakom satu opažanja;
- grafički prikaz krive dozne zavisnosti na kraju ispitivanja
- vrednosti LD50, sa 95% intervalom poverenja, u svakom od preporučenih momenata opažanja, za ispitivanu supstancu i toksični standard;
- statističke metode korišćene za određivanje LD50;
- smrtnost u kontrolama;
- drugi biološki odgovori i bilo kakvo neuobičajeno ponašanje pčela;
- bilo kakvo odstupanje od postupka ovde opisane metode ispitivanja i drugi bitni podaci.
1. EPPO/Council of Europe (1993) Decision-Making Scheme for the Environmental Risk Assessment ofPlant Protection Products - Honeybees. EPPO bulletin, vol. 23, N.1, p. 151-165. March, 1993.
2. Gough, H. J., McIndoe, E.C., Lewis, G.B., (1994) The use of dimethoate as a reference compound inlaboratory acute toxicity tests on honeybees (Apis mellifera L.), 1981-1992. Journal of ApiculturalResearch 22, p. 119-125.
3. Litchfield, J.T. and Wilcoxon, F., (1949) A simplified method of evaluating dose-effect experiments. Jour.Pharmacol. and Exper. Ther., 96, p. 99-113.
4. Finney, D.J., (1971) Probit Analysis. 3rd ed., Cambridge, London and New-York.
5. Abbott, W.S., (1925) A method for computing the effectiveness of an insecticide. Jour. Econ. Entomol., 18, p. 265-267.