
C.20. METODA ISPITIVANJA TOKSIČNOSTI PO REPRODUKCIJU VRSTE
Daphnia magna
Metoda se zasniva na OECD TG 211 (1998) uputstvu ispitivanja.
Osnovni cilj metode ispitivanja je procena uticaja hemikalija na reprodukciju Daphnia magna.
1.2. DEFINICIJE I MERNE JEDINICE
Ispitivane jedinke jesu ženke dafnije koje su na početku ispitivanja u stadijumu neonate i kod kojih se ispituje sposobnost stvaranja potomstva.
Potomstvo jesu mlade dafnije nastale partenogenezom ispitivanih jedinki u toku trajanja ispitivanja.
Najniža efektivna koncentracija (Lowest Observed Effect Concentration, u daljem tekstu: LOEC) jeste najniža koncentracija ispitivane supstance koja dovodi do statistički značajnih promena na nivou razmnožavanja i preživljavanja ispitivanog organizama (pri p < 0,05) u poređenju sa kontrolom unutar navedenog perioda izloženosti. Sve ispitivane koncentracije iznad LOEC imaju štetan uticaj, jednak ili veći od onih primećenih kod LOEC. Kada se ne mogu zadovoljiti ova dva uslova, mora se dati detaljno objašnjenje na koji je način izabrana LOEC (a time i NOEC) .
Koncentracija bez uočenog efekta (No Observed Effect Concentration, u daljem tekstu: NOEC) jeste najviša ispitivana koncentracija, a prva ispod LOEC, koja u poređenju sa kontrolom ne dovodi do statistički značajne promene (p < 0,05) posmatranog parametra unutar navedenog perioda izloženosti.
ECx je koncentracija ispitivane supstance rastvorene u vodi koja rezultira sa x posto smanjenja reprodukcije Daphnia magna unutar naznačenog perioda izloženosti.
Stvarna brzina rasta je mera rasta populacije koja objedinjuje sposobnost razmnožavanja i smrtnost specifičnu za određenu starost. Ako je populacija u ravnotežnom stanju stvarna brzina rasta biće nula. Za rastuće populacije stvarna brzina rasta biće pozitivna, a za populaciju koja se smanjuje biće negativna i dovešće do njenog izumiranja.
Granica detekcije jeste najniža koncentracija koja se može detektovati, ali ne i kvantifikovati.
Granica određivanja jeste najniža koncentracija koja se može kvantitativno odrediti.
Mortalitet životinja jeste slučaj kada se jedinka smatra uginulom jer je nepokretna, tj. kada ne može da zapliva, ili kada nema vidljivih pokreta ekstremiteta ili postabdomenalni 15 sekundi nakon pažljivog protresanja posude za ispitivanje.LXXXVII
Mlade ženke dafnija (ispitivane jedinke - neonate) stare manje od 24 sata na početku ispitivanja, izlažu se ispitivanoj supstanci koja se dodaje u vodu u određenom opsegu koncentracija. Dužina ispitivanja je 21 dan. Na kraju ispitivanja određuje se ukupan broj preživelog potomstva koje je dobijeno partenogenezom jedinki koje su preživele ispitivanje. Ne broji se potomstvo ispitivanih jedinki koje su u uginule u toku studije. To znači da se ne broji potomstvo ispitivanih jedinki koje su, u međuvremenu, uginule. Sposobnost razmnožavanja ispitivanih jedinki se može izraziti i na druge načine (npr. kao živo potomstvo po ispitivanoj jedinki na određeni dan, od prvog dana kad se uoče prvi potomci), ali bi se o njima trebalo izvestiti zajedno sa ukupnim brojem potomstva po živoj ispitivanoj jedinki na kraju ispitivanja. Sposobnost razmnožavanja životinja izloženih ispitivanoj supstanci poredi se sa kontrolama da bi se odredili LOEC i NOEC. Podaci se analiziraju pomoću regresionog modela kako bi se odredila koncentracija koja dovodi do smanjenja sposobnosti reprodukcije za x% (tj. EC50, EC20 ili EC10).
_________
LXXXVII Upotreba drugih definicija se obrazlaže uz navode odgovarajuće literature.
Moraju se navesti i podaci o preživljavanju ispitivanih jedinki i o vremenu potrebnom za stvaranje prve generacije potomaka. Mogu se utvrditi i ostala dejstva ispitivane supstance na parametre kao što su rast (dužina) i ako je moguće stvarna brzina rasta.
1.4. PODACI O ISPITIVANOJ SUPSTANCI
Treba imati rezultate ispitivanja akutne toksičnosti (videti Deo drugi metode C.2. ovog priloga) izvedenog sa vrstom Daphnia magna. Rezultat može biti koristan pri izboru odgovarajućeg opsega ispitivanih koncentracija kod ispitivanja toksičnosti po reprodukciju. Rastvorljivost u vodi i napon para ispitivane supstance treba da budu poznati i treba da bude dostupna pouzdana analitička metoda za kvantifikaciju supstance u rastvorima sa naznačenim vrednostima efikasnosti analitičke metode i granice određivanja.
Među podatke o ispitivanoj supstanci koji bi mogli biti korisni u određivanju ispitivanih uslova ubrajaju se strukturna formula, čistoća supstance, stabilnost na svetlu, stabilnost u uslovima ispitivanja, pKa, Pow i rezultati ispitivanja biorazgradivosti (videti metodu C.4. koja je data u ovom prilogu).
Da bi ispitivanje bilo prihvatljivo, moraju se zadovoljiti sledeći kriterijumi kvaliteta u kontrolama:
- smrtnost ispitivanih jedinki (ženke dafnija) ne prelazi 20% na kraju ispitivanja;
- prosečan broj živih potomaka po ispitivanoj jedinki na kraju ispitivanja mora biti ≥ 60.
1.6.1. Aparatura
Posude za ispitivanje i ostala aparatura koja dolazi u kontakt sa ispitivanim rastvorima mora biti isključivo od stakla ili drugog hemijski inertnog materijala. Posude za ispitivanje su najčešće staklene čaše.
Dodatno trebaju:
- oksimetar (s mikroelektrodama ili drugom prikladnom opremom za merenje rastvorenog kiseonika u uzorcima male zapremine);
- adekvatna oprema za kontrolu temperature;
- pH metar;
- oprema za određivanje tvrdoće vode;
- oprema za određivanje TOC u vodi ili oprema za određivanje HPK;
- adekvatna aparatura za kontrolu svetlosnog režima i merenje jačine svetlosti.
1.6.2. Ispitivani organizmi
Vrsta koje se koristi u metodi ispitivanja je Daphnia magna Straus. Druge vrste roda Daphnia se mogu koristiti ako zadovoljavaju kriterijume prihvatljivosti (za korišćenje vrsta roda Daphnia merodavan kriterijum prihvatljivosti je sposobnost razmnožavanja u kontrolnim uslovima koji vredi za vrste roda Daphnia). Ako se koriste druge vrste roda Daphnia to mora biti jasno definisano i njihova upotreba opravdana.
Najbolje je da se klon odredi genotipizacijom. Istraživanja1 su pokazala da reproduktivni potencijal Klona A3 konzistentno odgovara kriterijumu prihvatljivosti srednje vrednosti od ≥ 60 neonata po preživeloj jedinki, uzgajanoj u uslovima opisanim u ovoj metodi. Prihvatljivi su doduše i drugi klonovi, pod uslovom da kultura dafnija zadovoljava kriterijume prihvatljivosti.
Na početku ispitivanja, životinje moraju biti stare manje od 24 sata (tzv. neonate) i ne bi smele biti prva generacija potomstva. Moraju poticati iz zdrave matične linije (odnosno bez znakova stresa kao što su visoka smrtnost, prisustvo mužjaka i zimskih jaja (ephippia), kašnjenje u pojavi prve generacije potomstva, depigmentisane životinje, itd). Matična linija životinja se mora održavati u konstantnim laboratorijskim uslovima (svetlo, temperatura, medijum, ishrana i broj jedinki po jedinici zapremine) koji su slični onima u ispitivanju. Ako se medijum sa kulturom dafnija koji se koristi u ispitivanju razlikuje od rutinske kulture dafnija, poželjno je omogućiti period aklimatizacije pre ispitivanja od obično 3 nedelje (koliko je potrebno da se dobije jedna generacija životinja) da bi se izbegao stres za ispitivanih jedinki.
1.6.3. Medijum
Preporučuje se upotreba potpuno definisanog medijuma. Time se izbegava upotreba aditiva (npr. morska trava, ekstrakt zemljišta, itd) koje je teško okarakterisati i unapređuje se međulaboratorijska standardizacija. Elandt medijumi M4 i M7 (videti Deo drugi ove metode) smatraju se prikladnima u ove svrhe. Prihvatljivi su i drugi medijijumi5,6 pod uslovom da se pokaže da kultura dafnija zadovoljava kriterijume prihvatljivosti ispitivanja.
Ako se koriste medijumi sa nedefinisanim aditivima, te aditive treba navesti i u izveštaju o ispitivanju izneti podatke o sastavu medijuma, pogotovo s obzirom na sadržaj ugljenika, jer to može uticati na hranu kojom se životinje hrane. Preporučuje se da se odredi TOC, odnosno HPK u medijumu matične linije i da se proceni njihov udeo u TOC/HPK medijuma u kojem će se izvesti. Preporučuje se da sadržaj TOC u medijumu (pre dodavanja algi) bude manji od 3 mg/l2.
Pri ispitivanju supstanci koje sadrže metale, važno je imati na umu da sastav medijuma (npr. tvrdoća, nagradnja helata) može uticati na procenu toksičnosti ispitivane supstance. Poželjno je da medijum bude potpuno definisan. Za sada se od sasvim definisanih medijuma prikladnih za održavanje vrste Daphnia magna u dugotrajnoj kulturi, zna samo za Elandt medijume M4 i M7. Oba medijuma sadrže helatizirajuće jedinjenje EDTA. Pokazalo2 se da je "prividna toksičnost" kadmijuma generalno niža kada se u ispitivanju toksičnosti po reprodukciju koriste medijumi M4 ili M7 umesto medijuma koji ne sadrže EDTA. Stoga se korišćenje M4 ni M7 ne preporučuje za ispitivanje supstanci koje sadrže metale, a treba izbegavati i ostale medijume za koje se zna da sadrže helatizirajuća jedinjenja. Za ispitivanje supstanci koje sadrže metale bilo bi preporučljivo koristiti alternativne medijume, poput, npr. tvrde vode rekonstituisane prema ASTM7, koja ne sadrži EDTA i kojoj se dodaje ekstrakt morskih algi8. Ta kombinacija tvrde vode pripremljene prema ASTM i ekstrakta morskih algi prikladna je i za održavanje vrste Daphnia magna2 u dugotrajnoj kulturi, premda još uvek ima slabu helatiziirajuću aktivnost zbog organskih sastojaka dodatog ekstrakta morskih algi.
Na početku i u toku ispitivanja koncentracija rastvorenog kiseonika mora biti iznad 3 mg/l. Vrednost pH treba da bude u opsegu od 6 do 9 i u normalnim okolnostima ne sme da koleba za više od 1,5 jedinice ni u jednom testu. Preporučuje se tvrdoća veća od 140 mg/l (kao CaCO3). Testovi izvedeni pri toj ili većim koncentracijama pokazali su da je sposobnost razmnožavanja u skladu sa kriterijumima prihvatljivosti9, 10.
1.6.4. Test rastvori
Test rastvori izabranih koncentracija pripremaju se razblaživanjem osnovnog rastvora. Osnovne rastvore treba pripremati rastvaranjem supstance u test mediju.
U nekim slučajevima može se ukazati potreba za korišćenjem organskih rastvarača ili disperzionih sredstava, kako bi se pripremio osnovni rastvor željene koncentracije. Upotrebu navedenih materijala treba, ukoliko je moguće, izbegavati. Prikladni rastvarači su: aceton, etanol, metanol, dimetilformamid i trietilenglikol. Prikladna disperziona sredstva su: Cremophor RH40, 0,01% metilceluloza i HCO-40. Koncentracija ispitivane supstance u rastvoru ne sme da bude veća od granične rastvorljivosti te supstance u medijumu.
Rastvarači se koriste za pripremu osnovnog rastvora koji će moći precizno da se dozira. Pri preporučenim koncentracijama rastvarača u konačnom medijumu (≤ 0,1 ml/l) navedeni rastvarači ne deluju toksično i ne povećavaju rastvorljivost ispitivane supstance u vodi.
Disperziona sredstva mogu omogućiti precizno doziranje i disperziju. Pri preporučenim koncentracijama u konačnom, medijumu (≤ 0,1 ml/l) navedena disperziona sredstva ne deluju toksično i ne povećavaju rastvorljivost ispitivane supstance u vodi.
Tretmani (koncentracije) raspoređuju se po posudama za ispitivanje po slučajnom rasporedu. U suprotnom, moguće je dobiti neobjektive rezultate koji se pogrešno mogu pripisati razlikama u koncentraciji ispitivane supstance. Ako se eksperimentalni postupci izvode u stalnom redosledu od niže prema višoj koncentraciji, moguća je pojava određenih vremenski-zavisnih efekata poput zamora lica koje vrši ispitivanje ili neke druge greške, što može dovesti do prividnog pojačanja efekta ispitivane supstance u tretmanima sa višim koncentracijama. Ako postoji mogućnost da rezultati ispitivanja zavise od početnih uslova ili uslova okoline, npr. od mesta u laboratoriji, treba razmotriti mogućnost ispitivanja u blok-sistemu.
1.8.1. Uslovi pri izlaganju
1.8.1.1. Dužina ispitivanja
Ispitivanje traje 21 dan.
1.8.1.2. Gustina nasada ispitivanih jedinki
Ispitivane jedinke drže se odvojeno, po jedna u svakoj ispitivanoj posudi, u 50 ml do 100 ml medijuma u svakoj posudi. Ponekad su potrebne veće zapremine, da bi se zadovoljili zahtevi analitičkog postupka koji se koristi za određivanje koncentracije ispitivane supstance, a dopušteno je i objedinjavanje uzoraka iz više posuda za ispitivanje istog tretmana potrebnih za hemijsku analizu. Ako se koriste zapremine veće od 100 ml, dozvoljeno je povećati količinu hrane koja se daje dafnijama da bi se obezbedila adekvatna dostupnost hrane i da bi se zadovoljili kriterijumi kvaliteta. Kod ispitivanja u protočnim uslovima, postavka može, zbog tehničkih razloga, biti i drugačija (npr. četiri grupe po 10 jedinki, u ispitivanim posudama u većoj zapremini), ali sve izmene u postavci treba navesti u izveštaju.
1.8.1.3. Broj jedinki
Za ispitivanja u polu-statičnom sistemu, potrebno je najmanje 10 jedinki po tretmanu (koncentraciji) postavljenih pojedinačno u ispitivanoj posudi i isto toliko u kontrolnom tretmanu.
Kod ispitivanja u protočnim uslovima pokazala se zadovoljavajućom postavka sa 40 jedinki podeljenih u četiri grupe po 10 jedinki za svaki tretman (koncentraciju ispitivane supstance)1. Može se raditi i sa manjim brojem životinja, ali se preporučuje najmanje 20 životinja po koncentraciji, podeljenih u dve ili više paralelnih grupa (replika, kopija) sa jednakim brojem životinja u svakoj grupi (npr. po četiri replike sa po pet dafnija u svakoj). Pri postavci sa više od jedne dafnije po posudi za ispitivanje, nije moguće reprodukciju izraziti kao ukupni broj živih potomaka po ispitivanoj jedinki preživeloj do kraja ispitivanja, ako jedinka ugine pre kraja ispitivanja. U takvim slučajevima reprodukciju treba izraziti kao ukupni broj živih potomaka dobijen od ispitivanih jedinki prisutnih sa početka ispitivanja.
1.8.1.4. Ishrana
Pri postavci u polu-statičnom sistemu, jedinke je poželjno hraniti svaki dan, a najmanje tri puta nedeljno (tj. pri promeni medijuma). Ako se odstupi od ovakvog režima ishrane (npr. kod postavke u protočnim uslovima), to treba navesti u izveštaju o ispitivanju.
Tokom trajanja ispitivanja, ispitivane jedinke treba hraniti živim algama jedne ili više vrsta: vrste roda Chlorella, Selenastrum capricornutum (sada Pseudokirchneriella subcapitata11) i Scenedesmus subspicatus. Količinu hrane treba odrediti prema količini organskog ugljenika (C) potrebnog svakoj ispitivanoj jedinki. Istraživanja12 su pokazala da je za održavanje vrste Daphnia magna dovoljna koncentracija od 0,1 do 0,2 g/C/jedinki/dan, da bi se dobio broj potomaka potreban u skladu sa kriterijuma za prihvatljivost rezultata ispitivanja. Hranu treba davati ili u stalnoj količini u toku trajanja ispitivanja ili po želji, na početku davati manje količine, a potom u toku ispitivanja kako ispitivane jedinke rastu količinu postepeno povećavati. Količina hrane mora se kretati u preporučenom opsegu od 0,1 do 0,2 g/C/individue/dan.
Ako se za izračunavanje količine potrebne hrane koriste alternativni pokazatelji, kao što je broj algalnih ćelija ili absorbanca (radi lakše procene, jer je merenje sadržaja ugljenika zahtevna dugotrajna metoda), svaka laboratorija treba da napravi sopstveni nomogram procene sadržaja ugljenika u algama na osnovu alternativnih pokazatelja (za preporuke o izradi nomograma videti Deo treći ove metode). Nomogrami se proveravaju najmanje jednom godišnje ili češće, ako su se promenili uslovi u kulturama algi. Apsorbancija se pokazala boljim alternativnim pokazateljem sadržaja ugljenika nego broj ćelija13.
Dafnije treba hraniti koncentrovanom suspenzijom algi, kako bi količina medijuma za algalne kulture koja će se dodati medijumu svela na minimum. Suspenzija algi se može napraviti centrifugiranjem i ponovnim resuspendiranjem u destilovanoj vodi, dejonizovanoj vodi ili u mediju za gajenje dafnija.
1.8.1.5. Svetlosni režim
16 sati svetla jačine koja ne prelazi 15-20 μE/m2c-1.
1.8.1.6. Temperatura
Temperatura medijuma u kojem se izvodi ispitivanje mora biti u opsegu od 18 °C do 22 °C. Bez obzira na vrstu ispitivanja, temperatura unutar opsega ne sme da varira za više od 2 °C (treba npr. da je 18 °C do 20 °C, 19 °C do 21°C ili 20 °C do 22 °C). Može se pokazati prikladnim pripremiti dodatnu posudu za ispitivanje sa medijumom za praćenje temperature.
1.8.1.7. Aeracija
Posude za ispitivanje ne smeju se aerisati u toku ispitivanja.
1.8.2. Koncentracija ispitivane supstance
Uobičajeno je da se ispitivanje izvodi u najmanje 5 koncentracija ispitivane supstance u geometrijskoj seriji koncentracija, raspoređenim sa faktorom ne većim od 3,2 i u potrebnom broju ponavljanja (replika) po tretmanu (videti odeljak 1.8.1.3. ove metode). Ako se ispitivanje izvodi sa manje od pet koncentracija, treba obrazložiti razloge. Supstance ne treba ispitivati u koncentracijama višim od njihove rastvorljivosti u medijumu.
Pri određivanju opsega koncentracija treba voditi računa o sledećem:
- ako je cilj dobijanje vrednosti LOEC/NOEC, najniža ispitivana koncentracija mora biti dovoljno niska, tako da fekundidet pri toj koncentraciji ne bude statistički značajno niži od one u kontrolama. U slučaju drugačijeg odgovora, ispitivanje treba ponoviti sa sniženom najnižom ispitivanom koncentracijom;
- ako je cilj dobijanje vrednosti LOEC/NOEC, najviša ispitivana koncentracija mora biti dovoljno visoka, tako da fekunditet pri toj koncentraciji bude statistički značajno niži nego u kontrolnim uslovima. U slučaju drugačijeg odgovora, ispitivanje treba ponoviti sa višom najvišom ispitivanom koncentracijom;
- ako se određuje ECx, efektivna koncentracija koja utiče na sposobnost razmnožavanja, preporučuljivo je primeniti dovoljan opseg koncentracija, kako bi se ECx odredila sa zadovoljavajućim intervalima poverenja. Ako se određuje EC50, efektivna koncentracija za sposobnost razmnožavanja, preporučljivo je da najviša primenjena koncentracija bude veća od EC50. U suprotnom će, iako će EC50 moći da se odredi, interval poverenja za EC50 biti veoma širok i možda neće biti moguće na zadovoljavajući način oceniti adekvatnost izabranog modela;
- treba nastojati da se u seriju ispitivanih koncentracija ne uključi nijedna koja ima statistički značajno dejstvo na preživljavanje odraslih životinja, jer bi se time promenila priroda ispitivanja; to više ne bi bilo samo ispitivanje toksičnosti po reprodukciju, već kombinovano ispitivanje toksičnosti po reprodukciju i smrtnost, pa bi i statistička analiza dobijenih rezultata morala biti mnogo složenija.
Prethodno poznavanje toksičnosti ispitivane supstance (npr. rezultati ispitivanja akutne toksičnosti, odnosno rezultati preliminarnog ispitivanja postavljenog u cilju određivanja opsega ispitivanih koncentracija) mogu pomoći pri odabiru adekvatne serije adekvatnog opsega ispitivanih koncentracija.
U slučajevima kada se za pripremu ispitivanih rastvora koristi rastvarač ili disperziono sredstvo (videti odeljak 1.6.4), njegova finalna koncentracija u ispitivanim posudama ne sme biti veća od 0,1 ml/l i mora biti jednaka u svim posudama.
1.8.3. Kontrole
Pri svakom ispitivanju treba postaviti jednu kontrolu sa medijumom i ukoliko je potrebno, jednu seriju kontrola sa rastvaračem ili disperzionim sredstvom. Kada se koristi rastvarač ili disperziono sredstvo, njegova koncentracija u kontrolnom medijumu mora biti jednaka onoj u ispitivanim posudama sa ispitivanom supstancom. Treba pripremiti potreban broj replika (paralelnih uzoraka, kopija) (videti odeljak 1.8.1.3).
Pri dobro izvedenom ispitivanju, koeficijent varijacije broja živih potomaka dobijenih od ispitivanih jedinki u kontrolnim grupama treba da iznosi ≤ 25%, i to treba navesti u izveštaju o ispitivanju kada se ispitivanje izvodi sa po jednom jedinkom u svakoj ispitivanoj posudi.
1.8.4. Promena ispitivanog medijuma
Dinamika promene ispitivanog medijuma zavisi od stabilnosti supstance koja se ispituje, ali medijum treba menjati najmanje tri puta nedeljno. Ako preliminarno ispitivanje stabilnosti (videti odeljak 1.4. ove metode) pokaže da koncentracija ispitivane supstance nije stabilna, t.j. da je izvan nominalnog opsega od 80% do 120% ili da iznosi manje od 80% početne koncentracije u toku najdužeg perioda u kome se menja medijum - tri dana, treba razmotriti mogućnost češće promene medijuma, ili ispitivanje u protočnim uslovima.
Kada se medijum menja u toku ispitivanja u semistatičkim uslovima, treba pripremiti još jednu seriju posuda za ispitivanje i u njih prebaciti ispitivane jedinke, npr. pomoću staklenih pipeta adekvatnog promera. Treba paziti da se pri tom u novu posudu sa dafnijom prebaci što manje medijuma.
1.8.5. Posmatranje
Rezultate posmatranja treba beležiti u odgovarajuće obrasce (za primere videti Deo četvrti i peti ove metode). Ako su potrebna i druga merenja (videti odeljak 1.3. i 1.8.8. ove metode), može se pokazati potrebnim i dodatno promatranje.
1.8.6. Potomstvo
Potomstvo svake ispitivane jedinke treba, po mogućnosti, svakodnevno odvajati i brojati, od pojave prve generacije potomaka, kako bi se izbeglo da potomstvo troši hranu namenjenu roditeljskim jedinkama. Za potrebe ove metode broje se samo živi potomci, no može se beležiti i prisustvo abortiranih jaja i uginulih potomaka.
1.8.7. Mortalitet
Smrtnost među ispitivanim jedinkama prati se svakodnevno ili najmanje onoliko često koliko se broje i dobijeni potomci.
1.8.8. Ostali parametri
Iako je ova metoda namenjena prvenstveno proceni dejstva supstanci na reprodukcioni potencijal, njome se mogu određivati kvantitativno i drugi efekti, u dovoljnoj meri da to omogući statističku analizu. Poželjno je pratiti rast, jer se time dobija podatak o mogućim subletalnim efektima koji može biti korisniji od samog merenja sposobnosti reprodukcije. Preporučuje se i merenje dužine ispitivanih jedinki (t.j. dužine tela bez analnog nastavka) na kraju ispitivanja. Među ostale pokazatelje koji se mogu meriti ili izračunati ubrajaju se vreme potrebno za pojavu prve generacije potomaka (i idućih generacija), broj i veličina legla po životinji, broj odbačenih legla, prisutnost mužjaka ili efipija, kao i stvarna stopa rasta populacije.
1.8.9. Učestalost analitičkih određivanja i merenja
Koncentraciju kiseonika, temperaturu, tvrdoću i pH vrednost treba meriti najmanje jednom nedeljno, u svežem i starom medijumu i to u kontrolama i u medijumu sa najvišom koncentracijom ispitivane supstance.
Tokom ispitivanja se u pravilnim vremenskim intervalima meri i koncentracija ispitivane supstance.
Pri ispitivanju u polu-statičnom sistemu, kod kojih se očekuje da koncentracije ispitivane supstance ne variraju za više od ± 20% od nominalnih vrednosti (t.j. da se kreću u opsegu 80% do 120% - videti odeljak 1.4 i 1.8.4), preporučuje se da se analiziraju barem najviša i najniža ispitivana koncentracija i to pri pripremi svežeg medijuma i jednom nedeljno u toku ispitivanja, promeni medijuma (t.j. analizu treba obaviti u uzorku iste koncentracije, pri pripremi te koncentracije i pri promeni medijuma). Ta određivanja treba ponavljati u intervalima od najmanje jednom nedeljno.
Pri ispitivanjima kod kojih se očekuje da koncentracije ispitivane supstance variraju za više ± 20% od nominalnih vrednosti, neophodno je analizirati sve ispitivane koncentracije, pri njihovoj pripremi i pri promeni medijuma. Kod ispitivanja kod kojih merenje početne koncentracije ispitivane supstance pokaže da ona nije unutar opsega od ± 20% nominalne vrednosti, ali ima dovoljno dokaza da se te početne koncentracije mogu ponavljati i da su stabilne (tj. da se kreću u opsegu 80% do 120% od početnih), hemijska određivanja u 2. i 3. nedelji ispitivanja mogu da se ograniče na proveru najniže i najviše koncentracije. U svakom slučaju, koncentraciju ispitivane supstance pre promene medijuma treba proveriti samo u jednoj od replika (paralelnih uzoraka) za svaku od koncentracija.
Ako se ispitivanje sprovodi u protočnom sistemu, primeren je sličan režim uzimanja uzorka kao i u polu-statičnom sistemu (osim što se u tom slučaju ne može meriti koncentracija supstance u ranijim uzorcima). Od koristi je da se poveća broj uzoraka uzetih u toku prve nedelje ispitivanja, odnosno da se obavljaju tri kompleta merenja kako bi se osiguralo da koncentracije ostanu stabilne. Pri ispitivanjima u protočnom sistemu treba svakodnevno proveravati brzinu protoka medijuma i ispitivane supstance.
Ako se dokaže da se koncentracija ispitivane supstance u toku ispitivanja održava unutar zadovoljavajućeg opsega od ± 20% od nominalne vrednosti ili vrednosti izmerene na početku ispitivanja, rezultati se mogu zasnivati na nominalnoj ili na izmerenoj početnoj vrednosti. Ako odstupanja od nominalne ili početne izmerene vrednosti prelaze ± 20%, rezultate treba izraziti u terminima srednje vrednosti u funkciji vremena (videti Deo šesti ove metode).
Cilj ove metode ispitivanja je određivanje uticaja ispitivane supstance na ukupni broj živih potomaka dobijenih po živoj ispitivanoj jedinki na kraju ispitivanja. Ukupni broj živih potomaka po ispitivanoj jedinki treba izračunati za svaku posudu za ispitivanje (tj. za svaku repliku ili paralelni uzorak). Uzorak u kojem je ispitivana jedinka u toku ispitivanja uginula ili se pokaže da je ispitivana jedinka bila mužjak, treba isključiti iz analize. U tom slučaju će se analiza zasnivati na smanjenom broju replika.
Kada se, u sklopu procene uticaja hemikalije na sposobnost reprodukcije određuje LOEC, a time i NOEC, potrebno je izračunati srednju vrednost reprodukcije za sve replike pri određenoj koncentraciji, kao i rezidualnu standardnu devijaciju, što se može učiniti analizom varijanse (u daljem tekstu: ANOVA). Srednja vrednost dobijena za svaku koncentraciju mora se porediti sa srednjom vrednošću kontrolnog tretmana, služeći se adekvatnom, statističkom metodom za višestruka poređenja. Ispitivanja koja u ovu svrhu mogu biti od koristi data su u literaturi14, 15, 16, 17. Neophodno je proveriti da li vredi ANOVA pretpostavka o homogenosti varijanse. Preporučuje se da se to učini grafički, a ne formalnim izračunavanjem statističke značajnosti18. Alternativno, može poslužiti i Bartletov test. Ako pretpostavka ne vredi, tada pre izvođenja ANOVA treba razmotriti mogućnost transformacije podataka radi homogenizovanja varijanse ili umesto ANOVA izvesti pondiranu ANOVA. Treba izračunati i navesti i osetljivost ANOVA (najmanju statistički značajnu razliku).
Za određivanje EC50 iz dobijenih rezultata treba izračunati odgovarajuću krivu, npr. logističku krivu, služeći se adekvatnom statističkom metodom, npr. metodom najmanjih kvadrata. Kriva se može parametrizovati, tako da se EC50 i njena standardna greška mogu direktno odrediti. Time se znatno olakšava izračunavanje intervala poverenja za EC50. Treba navesti dvostrani 95%-tni interval poverenja, osim ako ne postoje dobri razlozi da se prednost da nekom drugom nivou pouzdanosti. Postupak uklapanja krive treba da obezbedi i način za ocenu statističkog značaja izostanka podudarnosti sa krivom. To se može učiniti grafički ili deljenjem ostatka sume kvadrata u kategoriju "nedostatak podudarnosti" (lack of fit) i u kategoriju "komponente čiste greške" (pure error components) i testom statističkog značaja za nedostatak podudarnosti. Budući da u tretmanima sa visokim fekunditetom postoji tendencija veće varijanse u broju potomstva nego u tretmanima sa niskim fekunditetom, pa treba razmotriti i mogućnost pondiranja dobijenih vrednosti, kako bi se uvažila različitost varijansi između tretmana (videti u literaturi18).
Pri analizi podataka dobijenih u međulaboratorijskoj proveri2, logistička kriva je izračunata pomoću sledećeg modela, iako se mogu koristiti i drugi adekvatni modeli:

pri čemu:
Y jeste ukupni broj potomaka po živoj roditeljskoj životinji na kraju ispitivanja (izračunato za svaku ispitivanu posudu);
x jeste koncentracija ispitivane supstance;
s jeste očekivani broj potomaka kada je x = 0;
x0 jeste EC50 u populaciji;
b jeste nagib krive.
Ovaj model je najverovatnije prikladan za veći broj situacija, ali ima i situacija za koje neće odgovarati. Zato treba proveriti valjanost modela, kao što je gore navedeno. U nekim slučajevima mogao bi da odgovara hormezis model u kom niske koncentracije imaju pojačano dejstvo.
Mogu se proceniti i druge efektivne koncentracije, npr. EC10 ili EC20, i ako u tom slučaju prednost treba dati drugačijoj parametrizaciji modela od one koja se koristila za procenu EC50.
Izveštaj o ispitivanju mora da sadrži podatke:
1) ispitivana supstanca:
- priroda supstance i merodavna fizičko-hemijska svojstva,
- podaci o identifikaciji hemikalije, uključujući čistoću;
2) ispitivana vrsta:
- klon (genotipiziran ili ne), dobavljač ili izvor (ako je poznat) i uslovi gajenja kulture. Ako se ne koristi vrsta Daphnia magna, navodi se obrazloženje;
3) uslovi ispitivanja:
- korišćeni postupak (npr. semistatični ili protočni sistem, zapremina, broj dafnija po litri),
- fotoperiod i jačina svetla,
- postavka ispitivanja (npr. broj replika, broj roditeljskih jedinki po replici),
- detalji o korišćenom mediju za gajenje kulture,
- podaci o organskom materijalu, ako je korišćen, uključujući podatke o sastavu, izvoru, metodi pripreme, TOC/HPK osnovnog rastvora, vrednosti TOC/HPK izmerene u medijumu,
- detaljne podatke o ishrani, uključujući količinu hrane u mg/C/Dafnija/dan) i režim (npr. vrsta hrane - ako je reč o algama, navesti tačno ime vrste i ako je poznato, navesti soj i uslove gajenja u kulturi),
- metode pripreme osnovnih rastvora i dinamiku izmene (treba navesti rastvarač ili disperziono sredstvo, ako je korišćeno);
4) rezultati:
- rezultati bilo kakvih preliminarnih studija o stabilnosti ispitivane supstance,
- nominalna koncentracija i rezultati svih merenja koncentracije ispitivane supstance u ispitivanim posudama (videti primer obrasca u Delu petom ove metode), podaci o efikasnosti analitičke metode i granicama detekcije,
- kvalitet vode u ispitivanim posudama, tj. podaci o pH, temperaturi i koncentraciji rastvorenog kiseonika, podaci o TOC, odnosno HPK i tvrdoći (videti primer obrasca u Delu četvrtom ove metode);
- potpuni podaci o potomstvu dobijenom od svake roditeljske jedinke (videti primer obrasca u Delu četvrtom ove metode);
- broj uginulih roditeljskih jedinki i dan kada su uginule (videti primer obrasca u Delu četvrtom ove metode);
- koeficijent varijacije fekunditeta u kontrolnim grupama (zasniva sena ukupnom broju živih potomaka po živoj roditeljskoj jedinki na kraju ispitivanja);
- grafički prikaz zavisnosti ukupnog broja živih potomaka po živoj roditeljskoj jedinki (za svaku repliku) na kraju ispitivanja nasuprot koncentraciji ispitivane supstance;
- LOEC po reprodukciju, uključujući opis primenjenih statističkih postupaka i naznaka o najnižoj statistički značajnoj razlici koja se može detektovati, kao i ako je primenljivo, podatak o najvišoj ispitivanoj koncentraciji koja ne dovodi do NOEC. Navesti i podatak o LOEC/NOEC za smrtnost roditeljskih jedinki;
- gde je prikladno, navesti ECx za reprodukciju, intervale poverenja i grafički prikaz modela upotrebljenog za njihovo izračunavanje, nagib krive dozne zavisnosti i njegovu standardnu grešku;
- ostali uočeni biološki efekti i merenja - navesti podatke o svim ostalim biološkim efektima koji su uočeni ili izmereni (npr. rast roditeljskih jedinki), uključujući odgovarajuće obrazloženje;
- obrazloženje za svako odstupanje od metode ispitivanja.
1. OECD Test Guideline Programme, Report of the Workshop on the Daphnia magna Pilot Ring Test, Sheffield University, UK, 20-21 March 1993.
2. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No6. Report of the Final Ring Test of the Daphnia magna Reproduction Test Paris. 1997.
3. Baird D.J., Barber J., Bradley M.C., Soares A.M.V.M. and Calow P. (1991) A comparative study of genotype sensitivity to acute toxic stress using clones of Daphnia magna Strauss. Ecotoxicology and Environmental Safety, 21, p. 257-265.
4. Elendt B.P., (1990) Selenium deficiency in Crustacea; An ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, p. 25-33.
5. EPA (1993) Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms. (Fourth ed.). EPA/600/4-90/027F. C. I. Weber (ed), USEPA, Cincinnati, Ohio.
6. Vigano L., (1991) Suitability of commercially available spring waters as standard medium for culturing Daphnia magna. Bull. Environ. Contam. Toxicol., 47, p. 775-782.
7. ASTM (1988) Standard Guide for Conducting Acute Toxicity Tests with Fishes, Macroinvertebrates and Amphibians. E729-88a. American Society for Testing and Materials, Philadelphia P.A. p. 20.
8. Baird D.J., Soares A.M.V.M., Girling A., Barber J., Bradley M.C. and Calow P., (1989) The long term maintenance of Daphnia magna Straus for use in ecotoxicological tests; problems and prospects. In: Proceedings of the 1st European Conference on Ecotoxicology. Copenhagen 1988 (H.Løkke, H. Tyle & F. Bro-Rasmussen. Eds.) p. 144-148.
9. Parkhurst B.R., Forte J.L. and Wright G.P., (1981) Reproducibility of a life-cycle toxicity test with Daphnia magna. Bull. Environ. Contam. and Toxicol., 26, p. 1-8.
10. Cowgill U.M. and Milazzo D.P., (1990) The sensitivity of two cladocerans to water quality variables: salinity and hardness. Arch. Hydrobiol., 120(2), p. 185-196.
11. Korshikov (1990) Pseudokirchneriella subcapitata Hindak, F-1990. Biologice Prace, 36, p. 209.
12. Sims I.R., Watson S. and Holmes D., (1993) Toward a standard Daphnia juvenile production test. Environmental Toxicology and Chemistry, 12, p. 2053-2058.
13. Sims I., (1993) Measuring the growth of phytoplankton: the relationship between total organic carbon with three commonly used parameters of algal growth. Arch. Hydrobiol., 128, 459-466.
14. Dunnett C.W., (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, p. 1096-1121.
15. Dunnett C.W., (1964) New tables for multiple comparisons with a control. Biometrics, 20, p. 482-491.
16. Williams D.A., (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, p. 103-117.
17. Williams D.A., (1972) The comparison of several dose levels with a zero dose control. Biometrics, 28, p. 510-531.
18. Draper N.R. and Smith H., (1981) Applied Regression Analysis, second edition, Wiley, N.Y.
19. Brain P. and Cousens R., (1989) An equation to describe dose responses where there is stimulation of growth at low doses. Weed Research, 29, p. 93-96.
20. Wilson E.O. and Bossert, W.H., (1971) A Primer of Population Biology. Sinauer Associates Inc. Publishers.
PRIPREMA POTPUNO DEFINISANIH MEDIJUMA ELANDT M7 I M4
Aklimatizacija na medijume Elandt M7 i M4
Neke laboratorije su imale poteškoća pri direktnom premeštanju dafnija u medijume M41 i M7. Određen uspeh je postignut postupnom aklimatizacijom, odnosno premeštanjem životinja iz prirodnog medijuma u 30%, potom 60% i na kraju 100% Elandt. Aklimatizacioni period može potrajati i mesec dana.
Prvo se pripremaju odvojeni osnovni rastvori (I) svakog pojedinog elemenata u tragovima u vodi odgovarajuće čistoće, npr. dejonizovanoj, destilovanoj ili vodom dobijenom reverznom osmozom. Iz tih različitih osnovnih rastvora (II) priprema se jedan rastvor (II) koji sadrži sve elemente u tragovima (kombinovani rastvor), npr.:
Osnovni rastvori I | Količina | Koncentracija | Za pripremanje | |
M 4 | M 7 | |||
H3BO3 | 57.190 | 20.000 | 1,0 | 0,25 |
MnCl2 x 4H2O | 7.210 | 20.000 | 1,0 | 0,25 |
LiCl | 6.120 | 20.000 | 1,0 | 0,25 |
RbCl | 1.420 | 20.000 | 1,0 | 0,25 |
SrCl2 x 6H2O | 3.040 | 20.000 | 1,0 | 0,25 |
NaBr | 320 | 20.000 | 1,0 | 0,25 |
Na2MoO4 x 2H2O | 1.260 | 20.000 | 1,0 | 0,25 |
CuCl2 x 2H2O | 335 | 20.000 | 1,0 | 0,25 |
ZnCl2 | 260 | 20.000 | 1,0 | 1,0 |
CoCl2 x 6H2O | 200 | 20.000 | 1,0 | 1,0 |
KI | 65 | 20.000 | 1,0 | 1,0 |
Na2SeO3 | 43,8 | 20.000 | 1,0 | 1,0 |
NH4VO3 | 11,5 | 20.000 | 1,0 | 1,0 |
Na2EDTA x 2H2O | 5.000 | 2.000 | - | - |
FeSO4 x 7H2O | 1.991 | 2.000 | - | - |
Rastvori Na2EDTA i FeSO4 se pripremaju odvojeno, spoje i odmah autoklaviraju. To daje: | ||||
21 Fe-EDTA Rastvor |
| 1.000 puta | 20,0 | 5,0 |
Medijumi M4 i M7 pripremaju se od rastvora II, makronutrijenata i vitaminima na sledeći način:
| Količina koja se dodaje u vodu | Koncentracija (u poređenju sa medijumom M4) puta | Za pripremanje | |
M 4 | M 7 | |||
Kombinovani rastvor II |
| 20 | 50 | 50 |
Osnovni rastvor sa makronutrijentima (pojedinačne supstanca) | ||||
CaCl2 x 2H2O | 293.800 | 1.000 | 1,0 | 1,0 |
MgSO4 x 7H2O | 246.600 | 2.000 | 0,5 | 0,5 |
KCl | 58.000 | 10.000 | 0,1 | 0,1 |
NaHCO3 | 64.800 | 1.000 | 1,0 | 1,0 |
Na2SiO3 x 9H2O | 50.000 | 5.000 | 0,2 | 0,2 |
NaNO3 | 2.740 | 10.000 | 0,1 | 0,1 |
KH2PO4 | 1.430 | 10.000 | 0,1 | 0,1 |
K2HPO4 | 1.840 | 10.000 | 0,1 | 0,1 |
Kombinovani rastvor | - | 10.000 | 0,1 | 0,1 |
Kombinovani rastvor sa vitaminima se priprema dodavanjem 3 vitamina u 1 litru vode kako je prikazano dole: | ||||
Tiamin hidrohlorid | 750 | 10.000 | - | - |
Cijankobalamin (B12) | 10 | 10.000 | - | - |
Biotin | 7,5 | 10.000 | - | - |
Kombinovani rastvor sa vitaminima se čuva zamrznut u malim porcijama. Vitamini se dodaju medijumu neposredno pre upotrebe. | ||||
ANALIZA UKUPNOG ORGANSKOG UGLJENIKA (TOC) I IZRADA NOMOGRAMA ZA ODREĐIVANJE SADRŽAJA TOC U HRANI OD ALGI
Sadržaj ugljenika u hrani od algi u normalnim okolnostima ne određuje se direktno, već na osnovu poređenja (tj. nomograma), merenjem surogat pokazatelja poput broja algalnih ćelija ili apsorbance svetla.
TOC treba meriti metodom oksidacije pri visokoj temperaturi88, a ne UV ili persulfatnom metodom.
Za izradu nomograma, alge treba centrifugiranjem odvojiti od hranljive podloge i potom resuspendovati u destilovanoj vodi. U svakom uzorku treba, u triplikatu, izmeriti surogat pokazatelj i koncentraciju TOC. Kao slepa proba uzima se destilovana voda. Određuje se i koncentracija TOC u destilovanoj vodi, koja se zatim oduzme od koncentracije TOC dobijene iz uzoraka algi.
Nomogram mora biti linearan u opsegu predviđenih koncentracija ugljenika. U nastavku su dati primeri.
Napomena 1: Primeri se ne smeju koristiti za preračunavanje - svaka laboratorija mora da izradi sopstveni nomogram.
____________
88 The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB
Slika 1:

Slika 2:
Slika 3:
PRIMER OBRASCA SA PODACIMA O PROMENI MEDIJUMA, PRAĆENJU FIZIČKO-HEMIJSKIH SVOJSTAVA, ISHRANI, RAZMNOŽAVANJU DAFNIJA I SMRTNOSTI ODRASLIH JEDINKI
Eksperiment br: | Datum početka: | Klon: | Medijum: | Vrsta hrane: | Ispitivana supstanca: | Nominalna konc.: |
Dan | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
|
|
Promena |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pHLXXXIX |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 2. merenje |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 1. merenje |
| |
O2 mg/lXXVIII |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 2. merenje |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 1. merenje |
| |
Temperatura(°C)XXVII |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 2. merenje |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 1. merenje |
| |
Hrana data |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Broj živih |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Ukupno |
Posuda 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Ukupno |
Kumulativna |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
________
LXXXIX Naznačiti koja posuda se koristila za testiranje.
XC Navestismrtnost odraslih jedinki kao "M" u odgovarajuće polje.
XCI Navesti odbačena legla kao "o.l." u odgovarajuća polja
PRIMER OBRASCA SA PODACIMA O REZULTATIMA HEMIJSKIH ANALIZA
Izmerene koncentracije
Nominalna | Uzorak 1. sedmice | Uzorak 2. sedmice | Uzorak 3. sedmice | |||
Novo | Staro | Novo | Staro | Novo | Staro | |
|
|
|
|
|
|
|
Izmerene koncentracije kao procenat nominalne
Nominalna koncentracija | Uzorak 1. sedmice | Uzorak 2. sedmice | Uzorak 3. sedmice | |||
Novo | Staro | Novo | Staro | Novo | Staro | |
|
|
|
|
|
|
|
IZRAČUNAVANJE SREDNJE VREDNOSTI KONCENTRACIJE U FUNKCIJI VREMENA
Težinska srednja vrednost u funkciji vremena
Ako se uzme da se koncentracija ispitivane supstance može smanjiti između dve promene medijuma, važno je odrediti koja će koncentracija predstavljati opseg koncentracija kojima je roditeljska jedinka bila izložena. Izbor se bazira na biološkim i statističkim pokazateljima. Na primer, ako se zaključi da na sposobnost razmnožavanja najviše utiče najviša koncentracija ispitivane supstance, onda se najviša koncentracija i uzima. Ako se zaključi da su važniji efekti koji se akumuliraju ili da je važnije dugoročno delovanje, onda je merodavnija prosečna koncentracija. U tom slučaju primerenije je služiti se težinskom srednjom vrednošću koncentracije u funkciji vremena, jer se tako uzimaju u obzir i kolebanja koncentracije koja se zbivaju u toku vremena.
Slika 1: Primer težinske srednje vrednosti
Dani
Slika 1 prikazuje (pojednostavljen) primer ispitivanja koje traje 7 dana sa prosečnom promenom medijuma nultog, 2. i 4. dana:
- tanka cik-cak crta prikazuje koncentraciju u bilo kojoj vremenskoj tački. Pretpostavka je da se smanjenje koncentracije zbiva po eksponencijalnom obrascu.
- šest ucrtanih tačaka predstavljaju koncentracije izmerene na početku i na kraju svakog razdoblja promene medijuma.
- puna debela crta pokazuje položaj težinske srednje vrednosti u funkciji vremena.
Težinska srednja vrednost u funkciji vremena računa se tako da se uzme da je površina ispod krive srednje vrednosti u toku vremena jednaka površini ispod krive koncentracije. Način računanja u gornjem primeru prikazan je u Tabeli 1.
Tabela 1: Izračunavanje težinske srednje vrednosti u funkciji vremena
Broj | Dani | Conc0 | Conc1 | ln(Conc0) | ln(Conc1) | Površina |
1 | 2 | 10,000 | 4,493 | 2,303 | 1,503 | 13,767 |
2 | 2 | 11,000 | 6,037 | 2,398 | 1,798 | 16,544 |
3 | 3 | 10,000 | 4,066 | 2,303 | 1,403 | 19,781 |
Ukupni dani: 7 | Ukupna površina | 50,091 | ||||
| Težinska srednja vrednost | 7,156 | ||||
Dani označavaju broj dana u razdoblju jedne promene medijuma.
Conc0 jeste koncentracija izmerena na početku svakog razdoblja promene medijuma.
Conc1 jeste koncentracija izmerena na kraju svakog razdoblja promene medijuma.
ln(Conc0) jeste prirodni logaritam Conc0.
ln(Conc1) jeste prirodni logaritam Conc1.
Površina jeste površina ispod eksponencijalne krive za svako razdoblje promene medijuma, a računa se:
Površina = | Conc0 - Conc1 | x Dani |
ln(Conc0) - ln(Conc1) |
Težinska srednja vrednost jeste ukupna površina podeljena ukupnim danima.
Za ispitivanje toksičnosti po reprodukciju dafnije tabela treba da obuhvati 21 dan ispitivanja.
Ako se merenja obavljaju samo na početku i na kraju razdoblja promene medijuma, nije moguće potvrditi da je proces smanjivanja koncentracije ispitivane supstance zapravo eksponencijalan. Ako kriva izgleda drugačije, menja se i vrednost površine. Eksponencijalni obrazac smanjivanja koncentracije ispitivane supstance nije neprihvatljiv i to je verovatno najupotrebljivija kriva u nedostatku drugih podataka.
Neophodan je oprez ako se hemijskom analizom na kraju razdoblja promene medijuma ispitivana supstanca ne nađe. Osim ako je moguće meriti kojom brzinom supstanca nestaje iz rastvora, nema načina da se dobije verodostojna površina ispod krive, te je u tom slučaju zapravo nemoguće dobiti smislenu srednju vrednost u funkciji vremena.
C.21. ZEMLJIŠNI MIKROORGANIZMI: ISPITIVANJE TRANSFORMACIJE AZOTA
Metoda se zasniva na OECD TG 216 (2000) uputstvu ispitivanja.
Ova metoda ispitivanja opisuje laboratorijsku metodu za procenu dugoročnih efekata hemikalija na proces mikrobiološke transformacije azota u zemljištu, pri jednokratnom izlaganju. Metoda se bazira na preporukama Evropske i Mediteranske Organizacije za zaštitu bilja1. Uzete su u obzir i smernice Nemačkog državnog instituta za biologiju2, Američke agencije za zaštitu životne sredine3, SETAC4 i Međunarodne organizacije za standardizaciju5. Na OECD radionici na temu izbora zemljišta/sedimenta6 postignut je dogovor o broju i tipu zemljišta za potrebe ovog ispitivanja. Preporuke za sakupljanje, rukovanje i skladištenje uzoraka zemljišta baziraju se na ISO standardu7 i preporukama sa radionice. U proceni i evaluaciji toksičnih svojstava ispitivane supstance, u nekim slučajevima je potrebno odrediti njihov uticaj na aktivnost zemljišnih mikroorganizama. Recimo kada su potrebni podaci o mogućem negativnom delovanju sredstava za zaštitu bilja na zemljišnu mikrofloru, ili kada se očekuje izloženost zemljišnih mikroorganizama drugim hemikalijama. Ispitivanje transformacije azota služi za procenu efekata takvih hemikalija na zemljišne mikroorganizme. Ako se ispituju agrohemikalije (sredstva za zaštitu bilja, đubriva, hemikalije u šumarstvu) izvodi se i ispitivanje transformacije ugljenika uporedo sa ispitivanjem transfromacije azota. Ako se ispituju hemikalije koje se ne koriste u poljoprivredne svrhe, ispitivanje transformacije azota je dovoljno. Ukoliko se vrednost EC50 dobijena iz ispitivanja transformacije azota za date hemikalije nalazi u opsegu EC50 vrednosti koje su utvrđene za komercijalno dostupne inhibitore nitrifikacije (npr. nitrapirin), može se izvesti ispitivanje transformacije ugljenika da bi se dobilo više podataka.
Zemljište se sastoji od žive i nežive komponente koje egzistiraju u kompleksnim i heterogenim smešama. Mikroorganizmi igraju važnu ulogu u razgradnji i transformaciji organske materije. U plodnim zemljištima, veliki broj vrsta mikroorganizama doprinosi različitim aspektima plodnosti zemljišta. Bilo kakav dugoročni uticaj na ove biohemijske procese može potencijalno uticati na procese kruženja nutrijenata, što može uticati na plodnost zemljišta. Transformacija ugljenika i azota odvija se u svim tipovima plodnih zemljišta. Iako se mikrobiološke zajednice razlikuju od zemljišta do zemljišta, putevi transformacije nutrijenata su u osnovi isti.
Ova metoda ispitivanja služi za procenu dugoročnih negativnih efekata supstanci na proces transformacije azota u aerobnim površinskim slojevima zemljišta. Metoda omogućava i procenu efekta supstance na transformaciju ugljenika od strane zemljišnih mikroorganizama. Obrazovanje nitrata se događa nakon prekidanja hemijske veze ugljenik-azot. Ako su zabeležene iste brzine obrazovanja nitrata u tretmanima i u kontroli, može se pretpostaviti da ne postoji negativan uticaj na glavne puteve razgradnje ugljenika. Supstrat za potrebe ispitivanja (hranivo od lucerke u prahu) ima povoljan odnos ugljenik/azot (obično između 12/1 i 16/1). Zahvaljujući tome, dovoljna količina ugljenika je na raspolaganju mikroorganizmima u toku ispitivanja, a ukoliko se ispolji negativno dejstvo hemikalija na mikrobnu zajednicu, mogu se oporaviti u periodu od 100 dana.
Ispitivanja na kojima se zasniva ova metoda primarno su bila osmišljena za supstance za koje se može proceniti u kojoj količini dospevaju u zemljište. To je npr. slučaj sa sredstvima za zaštitu bilja za koje je poznat režim primene. Kad je reč o agrohemikalijama dovoljno je ispitivanje dve doze koje odgovaraju očekivanom ili predviđenom režimu primene u polju. Agrohemikalije se mogu ispitivati kao aktivni sastojci ili kao formulacije. Ispitivanje nije ograničeno samo na agrohemikalije. Promenom količine ispitivane supstance primenjene na zemljište i načina na koji se podaci evaluiraju mogu se ispitivati i hemikalije za koje nije poznato u kojoj količini dospevaju do zemljišta. Za hemikalije koje nisu agrohemikalije, određuje se serija koncentracija i ispituje njihov efekat na transformaciju azota. Podaci iz ovih ispitivanja koriste se za dobijanje krive dozne zavisnosti i za procenu ECx vrednosti, gde je x unapred definisani procenat efekta.
Transformacija azota jeste potpuna mikrobiološka razgradnja organske materije koja sadrži azot, preko procesa stvaranja amonijaka i nitrita do obrazovanja nitrata.
Efektivna koncentracija (u daljem tekstu: ECx) jeste koncentracija ispitivane supstance u zemljištu za koju se procenjuje inhibicija transformacije azota u nitrate za unapred definisan procenat x.
Srednja efektivna koncentracija (u daljem tekstu: EC50) jeste koncentracija ispitivane supstance u zemljištu za koju se procenjuje 50% inhibicija transformacije azota u nitrate.
Za ovu metodu ispitivanja nisu propisane referentne supstance.
Prosejano zemljište obogaćuje se biljnim hranivom u prahu i zatim se tretira sa ispitivanom supstancom ili ostavi netretirano (kontrola). Ako se ispituju agrohemikalije, preporučuje se ispitivanje minimalno dve koncentracije ispitivane supstance i one treba da budu određene u odnosu na najveću koncentraciju očekivanu na njivama. Nakon 0, 7, 14 i 28 dana inkubacije, uzorci zemljišta za ispitivanu i kontrolnu grupu se ekstrahuju sa odgovarajućim rastvaračem i određuje se količina azota u ekstraktima. Brzina obrazovanja azota u ispitivanim grupama poredi se sa brzinom obrazovanja u kontrolnim grupama i izračunava se procenat odstupanja u odnosu na kontrolu. Sva ispitivanja traju najmanje 28 dana. Ako je 28. dana razlika između ispitivanih i kontrolnih grupa jednaka ili veća od 25%, ispitivanje se produžuje do maksimalno 100 dana. Ako se ispituju hemikalije koje nisu agrohemikalije, ispitivana supstanca se dodaje uzorcima zemljišta u seriji koncentracija i meri se količina obrazovanog azota u ispitivanim i kontrolnih grupama nakon 28 dana inkubacije. Rezultati ispitivanja sa više koncentracija ispitivane supstance analiziraju se regresionom analizom i izračunavaju se ECx vrednosti (npr. EC50, EC25, odnosno EC10).
Procene rezultata dobijenih ispitivanjem agrohemikalija baziraju se na relativno malim razlikama (npr. prosečna vrednost ± 25%) između koncentracija nitrata u ispitivanim i kontrolnih grupama, pa veliki procenat varijacije rezultata u kontrolnim grupama može dovesti do pogrešnih rezultata. Varijacija u kontroli treba da budu manja od ± 15%.
1.6.1. Oprema
Koriste se posude napravljene od hemijski inertnog materijala. Posude treba da budu odgovarajuće zapremine u skladu sa procedurom za inkubaciju zemljišta, npr. inkubacija jedinstvenog uzorka ili u seriji pojedinačnih uzoraka zemljišta (videti odeljak 1.7.1.2. ove metode). Treba preduzeti mere za smanjenje gubitka vode i obezbediti nesmetanu razmenu gasova u toku ispitivanja (npr. posude se mogu prekriti perforiranom polietilenskom folijom). Pri ispitivanju isparljivih supstanci koriste se posude koje se mogu hermetički zatvoriti. Zapremina posuda treba da bude četiri puta veća od zapremine samog uzorka zemljišta
Pored standardne laboratorijske aparature koriste se:
- mešalica (mehanički uređaj ili druga odgovarajuća oprema);
- centrifuga (3.000 g) ili uređaj za filtraciju (filter papir bez nitrata);
- uređaj za analizu nitrata odgovarajuće osetljivosti i ponovljivosti merenja.
1.6.2. Izbor i broj vrsta zemljišta
Koristi se jedna vrsta zemljišta. Preporučena svojstva zemljišta su:
- sadržaj peska ne manji od 50% i ne veći od 75%;
- pH vrednost 5,5 do 7,5;
- sadržaj organskog ugljenika 0,5% do 1,5%;
- najmanje 1% ukupnog sadržaja organskog ugljenika u zemljištu potiče iz mikrobiološke biomase8, 9 koju treba izmeriti.
U većini slučajeva ovakav sastav zemljišta odlikuju najlošija svojstva, s obzirom na to da je adsorpcija ispitivane supstance minimalna, a njena biodostupnost maksimalna. Prema tome, ispitivanja sa drugim tipovima zemljišta nisu neophodna. Ipak u određenim slučajevima, npr. kada se očekuje najviša primena ispitivane supstance na posebnim tipovima zemljišta poput kiselih šumskih zemljišta, ili su u pitanju hemikalije sa elektrostatičkim nabojem, postoji potreba za dodatnim ispitivanjem i drugih vrsta zemljišta.
1.6.3. Sakupljanje i skladištenje uzoraka zemljišta
1.6.3.1. Sakupljanje
Potrebno je raspolagati detaljnim podacima o lokalitetu sa kog su uzeti uzorci zemljišta za potrebe ispitivanja. Podaci uključuju tačnu lokaciju uzorkovanja, biljni pokrivač, datume primene sredstava za zaštitu bilja, tretmane sa organskim i neorganskim đubrivima, upotrebu bioloških materijala ili kontaminacije usled nesrećnog slučaja. Mesto izabrano za uzimanje uzoraka zemljišta treba da omogući dugotrajnu upotrebu. Pogodni lokaliteti za uzorkovanje su trajni pašnjaci, njive pod jednogodišnjim žitaricama (osim kukuruza), ili gusto zasejane, nađubrene površine. Izabrani lokalitet ne sme biti tretiran nikakvim organskim đubrivom najmanje šest meseci. Upotreba mineralnih đubriva je prihvatljiva samo u količini potrebnoj za normalan rast i razvoj bilja, a uzorci zemljišta se mogu uzimati najmanje tri meseca nakon primene đubriva. Treba izbegavati ispitivanje zemljišta tretiranog đubrivima sa poznatim biocidnim efektima, npr. kalcijum-cijanamidom.
Uzorkovanje treba izbegavati u toku ili neposredno nakon dugih perioda suše (dužih od 30 dana), ili zadržavanja vode. Za preorana zemljišta treba uzimati uzorke sa dubine od 0 cm do 20 cm. Za travnjake (pašnjake) ili druga zemljišta koja nisu duže vreme orana (najmanje jednu sezonu), maksimalna dubina uzorkovanja može biti nešto viša od 20 cm, npr. do 25 cm).
Uzorke zemljišta treba transportovati u odgovarajućim posudama i temperaturnim uslovima koji omogućavaju nepromenjivost svojstva zemljišta u toku transporta.
1.6.3.2. Skladištenje
Poželjno je ispitivati uzorke zemljišta neposredno nakon uzorkovanja. Ukoliko se uzorci ne mogu odmah ispitivati, skladište se u mraku na temperaturi od 4°C ± 2 °C, maksimum tri meseca. U toku skladištenja moraju se obezbediti aerobni uslovi. Ako se uzorci zemljišta uzimaju sa mesta gde je zemljište smrznuto najmanje tri meseca u toku godine, može se razmotriti skladištenje uzorka na temperaturi od -18 °C do - 22 °C. Mikrobiološka biomasa skladištenih uzoraka zemljišta meri se pre početka svakog ispitivanja, a sadržaj ugljenika u biomasi treba da bude najmanje 1% ukupnog organskog ugljenika u zemljištu (videti odeljak 1.6.2. ove metode).
1.6.4. Rukovanje i priprema uzoraka zemljišta za ispitivanje
1.6.4.1. Predinkubacija
Ako su uzorci zemljišta skladišteni (videti odeljak 1.6.3.2. ove metode), preporučuje se predinkubacija u trajanju od 2 do 28 dana. Temperatura i sadržaj vlage u uzorcima u toku predinkubacije treba da budu približni zahtevima ispitivanja (videti odeljak 1.6.4.2. i 1.7.1.3. ove metode).
1.6.4.2. Fizička i hemijska svojstva
Uzorci zemljišta se ručno čiste od velikih predmeta (npr. kamenje, delovi biljaka, itd) i mokro prosejavaju bez suvišnog sušenja na čestice veličine manje ili jednake od 2 mm. Sadržaj vlage u uzorku zemljišta treba podesiti destilovanom ili dejonizovanom vodom na vrednost između 40% i 60% maksimalnog kapaciteta zadržavanja vode.
1.6.4.3. Obogaćivanje organskim supstratom
Zemljište treba obogatiti odgovarajućim organskim supstratom, npr. hranivom od lucerke u prahu (glavni sastojak: Medicago sativa) sa odnosom C/N između 12/1 i 16/1. Preporučen odnos lucerke i zemljišta je 5 g lucerke po kilogramu zemljišta (suve težine).
1.6.5. Priprema ispitivane supstance za ispitivanje na uzorcima zemljišta
Ispitivana supstanca se obično primenjuje uz upotrebu nosača. Nosač može biti voda (za supstance rastvorljive u vodi) ili inertni materijal poput finog kvarcnog peska (veličina čestica: 0,1 mm do 0,5 mm). Treba izbegavati upotrebu tečnih nosača, osim vode (npr. organski rastvarači kao aceton, hloroform) s obzirom na to da deluju negativno na mikrofloru. Ukoliko se koristi pesak kao nosač, može se prekriti sa ispitivanom supstancom rastvorenom ili suspendovanom u odgovarajući rastvarač. U takvim slučajevima, rastvarač treba ukloniti isparavanjem pre mešanja sa zemljištem. Za optimalnu distribuciju ispitivane supstance u zemljištu, preporučuje se odnos od 10 g peska po kilogramu zemljišta (suve težine). Kontrolni uzorci se tretiraju samo sa ekvivalentnom količinom vode, odnosno kvarcnog peska.
Kod ispitivanja isparljivih supstanci treba izbegavati gubitke u toku ispitivanja i omogućiti njenu homogenu raspodelu u zemljištu (npr. ispitivanu supstancu injektirati u zemljište na nekoliko mesta).
1.6.6. Koncentracije ispitivane supstance
Ako se isputuju agrohemikalije, treba koristiti najmanje dve koncentracije ispitivane supstance. Niža koncentracija treba da odgovara najmanje maksimalnoj količini ispitivane supstance za koju se očekuje da će dospeti do zemljišta u realnim uslovima, dok viša koncentracija treba da bude umnožak niže koncentracije. Koncentracije ispitivane supstance dodate uzorcima zemljišta izračunavaju se uz pretpostavku da je ona ravnomerno raspodeljena do dubine od 5 cm i da je gustina zemljišta 1,5. Za agrohemikalije koje se primenjuju direktno na zemljište, ili za hemikalije za koje se može predvideti količina koja dospeva do zemljišta, preporučene koncentracije za ispitivanje su maksimalna predvidljiva koncentracija u životnoj sredini (Predictable Environmental Concentration, u daljem tekstu: PEC) i koncentracije pet puta veće od vrednosti PEC. Supstance koje će biti primenjene na zemljište više puta u jednoj sezoni treba ispitivati u koncentracijama dobijenim množenjem vrednosti PEC sa maksimalnim brojem predviđenih primena. Ipak, viša koncentracija ne sme biti veća od desetostruke vrednosti najveće primenjene koncentracije po pojedinačnoj primeni. Ako se ispituju hemikalije koje nisu agrohemikalije. Koristi se geometrijska serija od najmanje pet koncentracija ispitivane supstance. Koncentracije ispitivane supstance bi trebale pokrivati opseg potreban za određivanje ECx vrednosti.
1.7.1. Uslovi izloženost
1.7.1.1. Ispitivane i kontrolne grupe
Ukoliko se ispituju agrohemikalije, zemljišta se deli u tri uzorka jednake težine. Dva uzorka se mešaju sa nosačem koji sadrži ispitivanu supstancu, a treći sa nosačem bez ispitivane supstance (kontrola). Preporučuju se minimalno tri ponavljanja za svaki uzorak, sa i bez ispitivane supstance. Ako se ispituju hemikalije koje nisu agrohemikalije, zemljište se deli u šest uzoraka jednake težine. Pet uzoraka se meša sa nosačem koji sadrži ispitivanu supstancu, a šesti sa nosačem bez ispitivane supstance. Preporučaju se tri ponavljanja po svakom uzorku, sa i bez ispitivane supstance. Treba omogućiti homogenu raspodelu supstance u ispitivanim uzorcima zemljišta. Tokom mešanja treba izbegavati presovanje ili gnječenje zemljišta.
1.7.1.2. Inkubacija uzoraka zemljišta
Razlikuju se dva načina inkubacija uzoraka zemljišta zavisno od toga da li su u pitanju jedinstveni uzorci svakog ispitivanog i svakog kontrolnog uzorka zemljišta ili serije pojedinačnih poduzoraka jednake veličine za ispitivane i za kontrolne uzorke zemljišta. U slučaju isparljivih supstanci ispitivanje, ipak, treba izvesti samo sa serijama pojedinačnih poduzoraka. Kada se zemljište inkubira kao jedan jedinstveni uzorak, pripremaju se velike količine zemljišta za ispitivane i kontrolne grupe i po potrebi uzimaju se poduzorci i analiziraju. Količina inicijalno pripremljenih uzoraka za eksperimentlane i kontrolne grupe zavisi od veličine poduzoraka, broja ponavljanja i predviđenog maksimalnog broja uzorkovanja. Zemljišta inkubirana kao jedinstveni uzorak treba dobro promešati pre uzimanja poduzoraka. Kada se uzorci inkubiraju u seriji pojedinačnih poduzoraka zemljišta, osnovni uzorak za ispitivane i kontrolne uzorke deli se na traženi broj poduzoraka i oni se koriste po potrebi. U ispitivanjima gde se može očekivati više od dva uzorkovanja, treba obezbediti dovoljan broj poduzoraka koji može da bude dovoljan za sva ponavljanja i svako uzorkovanje. Treba uraditi najmanje tri ponavljanja po koncentraciji ispitivane supstance i inkubirati u aerobnim uslovima (videti odeljak 1.7.1.1. ove metode). Tokom svih ispitivanja, treba koristiti adekvatne posude koje onemogućavaju razvijanje anaerobnih uslova. U slučaju isparljivih supstanci, ispitivanje se izvodi samo sa serijom pojedinačnih poduzoraka.
1.7.1.3. Uslovi i trajanje ispitivanja
Ispitivanje se vrši u mraku na temperaturi 20°C ± 2 °C. Sadržaj vlage u uzorcima zemljišta treba održavati između 40% i 60% maksimalnog kapaciteta zadržavanja vode u zemljištu (videti odeljak 1.6.4.2. ove metode) sa odstupanjima od ± 5%. Po potrebi, može se dodavati destilovana, dejonizovana voda.
Minimalno trajanje ispitivanja je 28 dana. Ako se ispituju agrohemikalije, upoređuju se brzine stvaranja nitrata u ispitivanim grupama u odnosu na kontrolu. Ako se 28. dana ove vrednosti razlikuju za više od 25% ispitivanje se nastavlja dok se ne postigne razlika ≤ 25% ili maksimalno do 100 dana, zavisno koji uslov se pre ispuni. Ako se ispituju hemikalije koje nisu agrohemikalije, ispitivanje se prekida nakon 28 dana. Tada se određuju količine nitrata u ispitivanim i kontrolnim uzorcima zemljišta i izračunava ECx vrednost.
1.7.2. Uzorkovanje i analiza zemljišta
1.7.2.1. Šema uzorkovanja zemljišta
Ukoliko se ispituju agrohemikalije, određuje se sadržaj nitrata u uzorcima zemljišta na početku ispitivanja, 7, 14. i 28. dana. Ako je potrebno produžiti ispitivanje, treba obaviti dodatna merenja svakih 14 dana nakon 28. dana.
Ako se ispituju supstance koje nisu agrohemikalije, ispituje se najmanje pet koncentracija ispitivane supstance i sadržaj nitrata se određuje u uzorcima zemljišta na početku (dan 0) i na kraju perioda izlaganja (28. dan). Ukoliko se pokaže potrebnim dodatno merenje se može obaviti sredinom tog perioda, npr. sedmog dana. Podaci dobijeni 28. dana koriste se u određivanju ECx vrednosti za datu hemikaliju. Podaci dobijeni iz kontrolnih uzoraka na početku ispitivanja mogu se koristiti i u procenjivanju sadržaja nitrata u zemljištu.
1.7.2.2. Analiza uzoraka zemljišta
Količina obrazovanog azota u svakom ponavljanju za uzorke zemljišta ispitivane i kontrolne grupe određuje se pri svakom vremenu uzorkovanja. Nitrati se ekstrahuju iz zemljišta mešanjem uzoraka sa odgovarajućim ekstrakcionim sredstvima, npr. 0,1 M rastvor kalijum hlorida. Preporučuje se odnos od 5 ml rastvora KCl po gramu suve težine ekvivalenta zemljišta. Da bi ekstrakcija bila optimalna, posude sa zemljištem i ekstrakcionim sredstvom ne treba da budu napunjene više od polovine. Smeše se mešaju na 150 rpm 60 minuta. Smeše se centrifugiraju ili filtriraju i u supernatantu se određuje sadržaj nitrata. Supernatant se može pre analize čuvati do šest meseci na - 20°C ± 5 °C.
Ako se ispituju agrohemikalije, beleži se količina obrazovanog azota u svakom poduzorku zemljišta, a srednje vrednosti svih poduzoraka za kontrolnu i ispitivanu grupu treba prikazati tabelarno. Brzina transformacije azota određuje se odgovarajućim i opšteprihvatljivim statističkim metodama (F-test, nivo značaja 5%). Količina obrazovanog azota izražava se u mg azota/kg suve težine zemljišta/dan. Brzina stvaranja azota u svakoj ispitivanoj grupi poredi se sa kontrolnom grupom i računa se procenat odstupanja od kontrole.
Ako se ispituju hemikalije koje nisu agrohemikalije, određuju se količine obrazovanog azota u svakom poduzorku i pravi se kriva dozne zavisnosti za procenu ECx vrednosti. Količine azota (npr. mg azota/kg suve težine zemljišta) u ispitivanim grupama nakon 28 dana porede se sa količinom azota nastalom u kontroli. Iz tih podataka se računa procenat inhibicije za svaku koncentraciju ispitivane supstance. Vrednosti procenata inhibicije prikazuju se grafički u funkciji koncentracija ispitivane supstance, a za određivanje ECx vrednosti koriste se statističke procedure. Intervali poverenja (p = 0,95) za izračunate ECx određuju se i putem standardnih procedura10, 11, 12.
Supstance koje sadrže visoke količine azota doprinose količini azota koja nastaje u toku ispitivanja. Ako se te supstance ispituju u višoj koncentraciji (hemikalije za koje se očekuje da će se primenjivati u više navrata), u ispitivanje se moraju uključiti odgovarajuće kontrole (npr. zemljište sa ispitivanom supstancom, ali bez biljnog hraniva). Podaci iz tih kontrola moraju se uzeti u obzir pri računanju ECx vrednosti.
Kada se procenjuju rezultati ispitivanja sa agrohemikalijama i kad je razlika u brzini stvaranja azota između prve ispitivane grupe u seriji (maksimalna predviđena koncentracija) i kontrole ≤ 25% u bilo kojem vremenu uzorkovanja nakon 28. dana, za date hemikalije se može oceniti da nemaju dugoročni uticaj na transformaciju azota u zemljištu. Kada se procenjuju rezultati dobijeni ispitivanjem supstanci koje nisu agrohemikalije, koriste se EC50, EC25, odnosno EC10 vrednosti.
Izveštaj o ispitivanju mora da sadrži:
1) potpunu identifikaciju korišćenog zemljišta, uključujući:
- geografske odrednice mesta (geografska širina i dužina);
- podatke o istoriji mesta (npr. biljni pokrivač, tretmani sredstvima za zaštitu bilja, tretmani đubrivima, akcedentne kontaminacije itd);
- upotreba zemljišta (npr. poljoprivredno zemljište, šuma itd);
- dubina uzorkovanja (cm);
- sadržaj peska/mulja/gline (% suve težine);
- pH vrednosti (u vodi);
- sadržaj organskog ugljenika (% suve težine);
- sadržaj azota (% suve težine);
- početna koncentracija azota (mg azota/kg suve težine);
- jonsko izmenjivački kapacitet (mmol/kg);
- početna biomasa mikroorganizama u procentima u odnosu na ukupan organski ugljenik;
- reference svih metoda korišćenih za određivanje svakog parametra;
- svi podaci u vezi sa sakupljanjem i skladištenjem uzoraka zemljišta;
- detalji o predinkubaciji, ako postoje.
2) Podatke o ispitivanoj supstanci:
- fizičke osobine i gde je bitno, fizičko-hemijske osobine;
- podaci za hemijsku identifikaciju, gde je bitno, uključujući strukturnu formulu, stepen čistoće (npr. za sredstva za zaštitu bilja, procenat aktivnog sastojka), sadržaj azota.
3) supstrat:
- poreklo supstrata;
- sastav (npr. hraniva sa lucerkom);
- sadržaj ugljenika, azota (% suve težine);
- veličina sita (mm).
4) uslovi ispitivanja:
- opis načina obogaćivanja zemljišta organskim supstratom;
- broj koncentracija ispitivane supstance i gde je prikladno, opravdanje za odabir datih koncentracija;
- opis uvođenja ispitivane supstance u zemljište;
- temperatura inkubacije;
- sadržaj vlage u zemljištu na početku i u toku ispitivanja;
- korišćena metoda inkubacije zemljišta (npr. kao jedinstveni uzorak ili kao serija pojedinačnih poduzoraka);
- broj ponavljanja;
- broj uzorkovanja;
- metoda korišćena za ekstrakciju azota iz zemljišta;
5) rezultati:
- procedure i oprema za analitičko određivanje azota;
- tabelarni podaci uključujući pojedinačne i srednje vrednosti za merenje azota;
- varijansa u kontrolnim i eksperimentalnim grupama;
- objašnjene korekcija u izračunavanju, ukoliko je bitno;
- procenat razlike brzine stvaranja azota pri svakom vremenu uzorkovanja, ili, ako je prikladno, EC50 sa 95% intervalima poverenja, druge ECx vrednosti (npr. EC25 ili EC10) sa intervalima pouzdanosti i grafik krive dozne zavisnosti;
- statistička obrada rezultata;
- sve dodatne podatke i opažanja potrebne za tumačenje rezultata.
1. EPPO, (1994) Decision-Making Scheme for the Environmental Risk Assessment of Plant ProtectionChemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1-16, 1994.
2. BBA, (1990) Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (2nd eds., 1990).
3. EPA (1987) Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987.
4. SETAC-Europe, (1995) Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed.M.R. Lynch, Pub. SETAC-Europe, Brussels.
5. ISO/DIS 14238 (1995) Soil Quality - Determination of Nitrogen Mineralisation and Nitrification in Soils and the Influence of Chemicals on these Processes. Technical Committee ISO/TC 190/SC 4: SoilQuality - Biological Methods.
6. OECD, (1995) Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18-20 January 1995.
7. ISO 10381-6 (1993) Soil quality - Sampling. Guidance on the collection, handling and storage of soilfor the assessment of aerobic microbial processes in the laboratory.
8. ISO 14240-1, (1997) Soil quality - Determination of soil microbial biomass - Part 1: Substrateinducedrespiration method.
9. ISO 14240-2, (1997) Soil quality - Determination of soil microbial biomass - Part 2: Fumigationextractionmethod.
10. Litchfield, J.T. and Wilcoxon F., (1949) A simplified method of evaluating dose-effect experiments. Jour.Pharmacol. and Exper. Ther., 96, p. 99-113.
11. Finney, D.J., (1971) Probit Analysis. 3rd ed., Cambridge, London and New-York.
12. Finney, D.J., (1978) Statistical Methods in biological Assay. Griffin, Weycombe, UK.
C.22. ZEMLJIŠNI MIKROORGANIZMI: ISPITIVANJE TRANSFORMACIJE UGLJENIKA
Metoda se zasniva na OECD TG 217 (2000) uputstvu ispitivanja.
Ova metoda ispitivanja opisuje laboratorijski postupak za procenu dugoročnih potencijalnih efekata sredstava za zaštitu bilja i po mogućnosti, drugih hemikalija na aktivnost transformacije ugljenika od strane zemljišnih mikroorganizama pri jednokratnom izlaganju. Metoda se bazira na preporukama Evropske i Mediteranske Organizacije za zaštitu bilja (European and Mediterranean Plant Protection Organization)1. Uzete su u obzir i druge smernice, uključujući smernice Nemačkog državnog instituta za biologiju (Biologische Bundesanstalt)2, Američke agencije za zaštitu životne sredine (US Environmental Protection Agency)3 i SETAC4. Na OECD radionici na temu izbora zemljišta/sedimenta5 postignut je dogovor o broju i tipu zemljišta za potrebe ovog ispitivanja. Preporuke za sakupljanje, rukovanje i skladištenje uzoraka zemljišta temelje se na ISO standardu6 i preporukama radionice.
U proceni i evaluaciji toksičnih efekata ispitivane supstance, utvrđivanje efekta na aktivnost zemljišnih mikroorganizama može biti neophodno, npr. kada se traže podaci o mogućem negativnom delovanju sredstava za zaštitu bilja na zemljišnu mikrofloru ili kada se očekuje izloženost zemljišnih mikroorganizama drugim hemikalijama koje ne spadaju u sredstva za zaštitu bilja. Ispitivanje transformacije ugljenika izvodi se u cilju procene efekta hemikalija na zemljišnu mikrofloru. Ako se ispituju agrohemikalije (npr. sredstva za zaštitu bilja, đubriva, hemikalije u šumarstvu), izvodi se i ispitivanje transformacije ugljenika i transformacije azota. Ako se ispituju druge hemikalije, ispitivanje transformacije azota je dovoljno. Ukoliko se vrednost EC50 dobijena iz ispitivanja transformacije azota za date hemikalije nalazi u opsegu EC50 vrednosti koje su utvrđene za komercijalno dostupne inhibitore nitrifikacije (npr. nitrapyrin), može se izvesti ispitivanje transformacije ugljenika da bi se dobilo više podataka.
Zemljište se sastoji od žive i nežive komponente koje egzistiraju u kompleksnim i heterogenim smešama. Mikroorganizmi igraju važnu ulogu u razgradnji i transformaciji organske materije. U plodnim zemljištima sa velikim brojem vrsta, mikroorganizami doprinose različitim aspektima plodnosti zemljišta. Bilo kakav dugoročni uticaj na biohemijske procese može potencijalno odraziti na procese kruženja nutrijenata, a ovo opet na plodnost zemljišta. Transformacija ugljenika i azota odvija se u svim tipovima plodnih zemljišta. Iako se mikrobiološke zajednice razlikuju od zemljišta do zemljišta, putevi transformacije nutrijenata su u osnovi isti.
Ova metoda ispitivanja služi za procenu dugoročnih negativnih efekata supstanci na proces transformacije ugljenika u aerobnim površinskim slojevima zemljišta. Metoda je dovoljno osetljiva da detektuje promene u veličini i aktivnosti mikrobnih zajednica koje su odgovorne za transformaciju ugljenika s obzirom na to da su ovim ispitivanjem te zajednice izložene stresu usled izlaganja hemikalijama i stresu zbog smanjene količine ugljenika. Za potrebe ispitivanja koristi se peskovito zemljište sa niskim sadržajem organske materije. Zemljište se tretira sa ispitivanom supstancom i inkubira u uslovima koji omogućavaju brz mikrobiološki metabolizam. U ovakvim uslovima izvori raspoloživog ugljenika u zemljištu brzo se iscrpljuju. Smanjenje količine raspoloživog ugljenika na kraju dovodi do nestanka mikroorganizama ili nastupa faza dormancije, odnosno sporulacije. Ako ispitivanje traje više od 28 dana, posledice ovih reakcija mogu se meriti u kontroli (netretirano zemljište) kao progresivan gubitak metabolički aktivne mikrobiološke biomase7. Ako na biomasu mikroorganizama sa smanjenom količinom raspoloživog ugljenika u zemljištu, u uslovima definisanim za ovu metodu, deluje ispitivana supstanca, oporavak možda nije moguć. U većini slučajeva negativni uticaji uzrokovani ispitivanom supstancom u bilo kom momentu ispitivanja, traju do kraja ispitivanja.
Ispitivanja na kojima se zasniva ova metoda primarno su bila osmišljena za supstance za koje se može proceniti u kojoj količini mogu dospeti u zemljište. To je slučaj kod sredstava za zaštitu bilja sa poznatim režimom primene. Za agrohemikalije, dovoljno je ispitivanje dve doze koje odgovaraju očekivanom ili predviđenom režimu primene u polju. Agrohemikalije se mogu ispitivati kao aktivni sastojci ili kao formulacije. Ispitivanje nije ograničeno samo na hemikalije za koje se mogu predvideti njihove koncentracije u životnoj sredini. Promenom količine ispitivane supstance primenjene na zemljište i načina na koji se podaci procenjuju, ispitivanje se može koristiti i za hemikalije za koje se ne zna u kojoj količini dospevaju do zemljišta. Za hemikalije koje nisu agrohemikalije, određuje se serija koncentracija i ispituje njihov efekat na transformaciju ugljenika. Podaci iz ovih ispitivanja koriste se za dobijanje krive dozne zavisnosti i za procenu ECx vrednosti, gde je x unapred definisan procenat efekta.
Transformacija ugljenika jeste mikrobiološka razgradnja organske materije u ugljen-dioksid.
Efektivna koncentracija (u daljem tekstu: ECx) jeste koncentracija ispitivane supstance u zemljištu za koju se procenjuje inhibicija transformacije ugljenika u ugljen-dioksid za unapred definisan procenat inhibicije x.
Srednja efektivna koncentracija (u daljem tekstu: EC50) jeste koncentracija ispitivane supstance u zemljištu za koju se procenjuje 50% inhibicija transformacije ugljenika u ugljen-dioksid.
Za ovu metodu ispitivanja nisu određene referentne supstance.
Prosejano zemljište se tretira ispitivanom supstancom ili se ostavi netretirano (kontrola). Ako se ispituju agrohemikalije, preporučuje se ispitivanje najmanje dve koncentracije ispitivane supstance i one treba da budu određene u odnosu na najveću koncentraciju koja će se primeniti. Nakon 0, 7, 14 i 28 dana inkubacije, uzorci zemljišta ispitivane i kontrolne grupu mešaju se sa glukozom i meri se brzina glukozom indukovane respiracije za narednih 12 sati. Brzina respiracije izražava se kao oslobođeni ugljen-dioksid (mg ugljen-dioksida/ kg suvog zemljišta/h) ili kao utrošeni kiseonik (mg kiseonika/kg zemljišta/h). Srednja vrednost brzine respiracije u ispitivanim grupama poredi se sa brzinom u kontrolnim grupama i izračunava se procenat smanjenja u odnosu na kontrolu. Sva ispitivanja se izvode u trajanju najmanje 28 dana.
Ako su 28. dana razlike u brzini respiracije između ispitivanih i kontrolnih grupa ≥ 25%, merenja se nastavljaju na svakih 14 dana u trajanju najviše do 100 dana. Ako su u pitanju supstance koje nisu agrohemikalije, ispituju se i dodatne koncentracije te supstance (ne samo dve) i meri se glukozom indukovana brzina respiracije (npr. srednja vrednost oslobođenog ugljen-dioksida ili utrošenog kiseonika) nakon 28 dana. Rezultati ispitivanja serije koncentracija analiziraju se korišćenjem regresionih modela i izračunavaju se ECx vrednosti (npr. EC50, EC25, odnosno EC10).
Procene rezultata dobijenih ispitivanjem agrohemikalija baziraju se na relativno malim razlikama (prosečna vrednost ± 25%) između oslobođenog ugljen-dioksida ili utrošenog kiseonika u ispitivanim i kontrolnim grupama, pa veliki procenat varijacije u kontrolnim grupama može uzrokovati pogrešan rezultat. Varijansa u kontroli treba da bude manja od ± 15%.
1.6.1. Oprema
Koriste se posude napravljene od hemijski inertnog materijala. Posude treba da budu odgovarajuće zapremine u skladu sa postupkom za inkubaciju zemljišta, npr. inkubacija jedinstvenog uzorka ili u seriji pojedinačnih poduzoraka zemljišta (videti odeljak 1.7.1.2. ove metode). Treba preduzeti mere za smanjenje gubitka vode i obezbediti nesmetanu razmenu gasove u toku ispitivanja (posude se mogu prekriti perforiranom polietilenskom folijom). Kada se ispituju isparljive supstance, treba koristiti zatvorene posude koje se mogu hermetički zatvoriti. Zapremina posuda treba da bude četiri puta veća od zapremine samog uzorka zemljišta.
Za određivanje glukozom indukovane respiracije, potrebni su sistemi za inkubaciju i instrumenti za merenje produkcije ugljen-dioksida ili potrošnje kiseonika. Primeri takvih sistema i instrumenata su u literaturi8, 9, 10,11.
1.6.2. Izbor i broj vrsta zemljišta
Koristi se jedna vrsta zemljišta. Preporučena svojstva zemljišta su:
- sadržaj peska ne manji od 50% i ne veći od 75%;
- pH vrednost 5,5 do 7,5;
- sadržaj organskog ugljenika 0,5% do 1,5%;
- najmanje 1% ukupnog sadržaja organskog ugljenika u zemljištu potiče iz mikrobiološke biomase8, 9 koju treba izmeriti.
U većini slučajeva ovakav sastav zemljišta odlikuju najlošija svojstva, s obzirom na to da je adsorpcija ispitivane supstance minimalna, a njena biodostupnost maksimalna. Prema tome, ispitivanja sa drugim tipovima zemljišta nisu neophodna. Ipak u određenim slučajevima, npr. kada se očekuje najviša primena ispitivane supstance na posebnim tipovima zemljišta poput kiselih šumskih zemljišta, ili su u pitanju hemikalije sa elektrostatičkim nabojem, postoji potreba za dodatnim ispitivanjem i drugih vrsta zemljišta.
1.6.3. Sakupljanje i skladištenje uzoraka zemljišta
1.6.3.1. Sakupljanje
Potrebno je raspolagati detaljnim podacima o lokalitetu sa kog su uzeti uzorci zemljišta za potrebe ispitivanja. Podaci uključuju tačnu lokaciju uzorkovanja, biljni pokrivač, datume primene sredstava za zaštitu bilja, tretmane sa organskim i neorganskim đubrivima, upotrebu bioloških materijala ili kontaminacije usled nesrećnog slučaja. Mesto izabrano za uzimanje uzoraka zemljišta treba da omogući dugotrajnu upotrebu. Pogodni lokaliteti za uzorkovanje su trajni pašnjaci, njive pod jednogodišnjim žitaricama (osim kukuruza), ili gusto zasejane, nađubrene površine. Izabrani lokalitet ne sme biti tretiran nikakvim organskim đubrivom najmanje šest meseci. Upotreba mineralnih đubriva je prihvatljiva samo u količini potrebnoj za normalan rast i razvoj bilja, a uzorci zemljišta se mogu uzimati najmanje tri meseca nakon primene đubriva. Treba izbegavati ispitivanje zemljišta tretiranog đubrivima sa poznatim biocidnim efektima, npr. kalcijum-cijanamidom.
Uzorkovanje treba izbegavati u toku ili neposredno nakon dugih perioda suše (dužih od 30 dana), ili zadržavanja vode. Za preorana zemljišta treba uzimati uzorke sa dubine od 0 cm do 20 cm. Za travnjake (pašnjake) ili druga zemljišta koja nisu duže vreme orana (najmanje jednu sezonu), maksimalna dubina uzorkovanja može biti nešto viša od 20 cm, npr. do 25 cm).
Uzorke zemljišta treba transportovati u odgovarajućim posudama i temperaturnim uslovima koji omogućavaju nepromenjivost svojstva zemljišta u toku transporta.
1.6.3.2. Skladištenje
Poželjno je ispitivati uzorke zemljišta neposredno nakon uzorkovanja. Ukoliko se uzorci ne mogu odmah ispitivati, skladište se u mraku na temperaturi od 4°C ± 2 °C, maksimum tri meseca. U toku skladištenja moraju se obezbediti aerobni uslovi. Ako se uzorci zemljišta uzimaju sa mesta gde je zemljište smrznuto najmanje tri meseca u toku godine, može se razmotriti skladištenje uzorka na temperaturi od -18 °C. Mikrobiološka biomasa skladištenih uzoraka zemljišta meri se pre početka svakog ispitivanja, a sadržaj ugljenika u biomasi treba da bude najmanje 1% ukupnog organskog ugljenika u zemljištu (videti odeljak 1.6.2. ove metode).
1.6.4. Rukovanje i priprema uzoraka zemljišta za ispitivanje
1.6.4.1. Predinkubacija
Ako su uzorci zemljišta skladišteni (videti odeljak 1.6.3.2. ove metode), preporučuje se predinkubacija u trajanju od 2 do 28 dana. Temperatura i sadržaj vlage u uzorcima u toku predinkubacije treba da budu približni zahtevima ispitivanja (videti odeljak 1.6.4.2. i 1.7.1.3. ove metode).
1.6.4.2. Fizička i hemijska svojstva
Uzorci zemljišta se ručno čiste od velikih predmeta (npr. kamenje, delovi biljaka, itd) i mokro prosejavaju bez suvišnog sušenja na čestice veličine manje ili jednake od 2 mm. Sadržaj vlage u uzorku zemljišta treba podesiti destilovanom ili dejonizovanom vodom na vrednost između 40% i 60% maksimalnog kapaciteta zadržavanja vode.
1.6.5. Priprema ispitivane supstance za ispitivanje na uzorcima zemljišta
Ispitivana supstanca se obično primenjuje uz upotrebu nosača. Nosač može biti voda (za supstance rastvorljive u vodi) ili inertni materijal poput finog kvarcnog peska (veličina čestica: 0,1 mm do 0,5 mm). Treba izbegavati upotrebu tečnih nosača, osim vode (npr. organski rastvarači kao aceton, hloroform) s obzirom na to da deluju negativno na mikrofloru. Ukoliko se koristi pesak kao nosač, može se prekriti sa ispitivanom supstancom rastvorenom ili suspendovanom u odgovarajući rastvarač. U takvim slučajevima, rastvarač treba ukloniti isparavanjem pre mešanja sa zemljištem. Za optimalnu distribuciju ispitivane supstance u zemljištu, preporučuje se odnos od 10 g peska po kilogramu zemljišta (suve težine). Kontrolni uzorci se tretiraju samo sa ekvivalentnom količinom vode, odnosno kvarcnog peska.
Kod ispitivanja isparljivih supstanci treba izbegavati gubitke u toku ispitivanja i omogućiti njenu homogenu raspodelu u zemljištu (npr. ispitivanu supstancu injektirati u zemljište na nekoliko mesta).
1.6.6. Koncentracije ispitivane supstance
Ako se ispituju sredstva za zaštitu bilja ili druge hemikalije sa predvidljivim koncentracijama u životnoj sredini treba koristiti najmanje dve koncentracije ispitivane supstance. Niža koncentracija treba da odgovara najmanje maksimalnoj količini ispitivane supstance za koju se očekuje da će dospeti do zemljišta u realnim uslovima, dok viša koncentracija treba da bude umnožak niže koncentracije. Koncentracije ispitivane supstance dodate uzorcima zemljišta izračunavaju se uz pretpostavku da je ona ravnomerno raspodeljena do dubine od 5 cm i da je gustina zemljišta 1,5. Za agrohemikalije koje se primenjuju direktno na zemljište, ili za hemikalije za koje se može predvideti količina koja dospeva do zemljišta, preporučene koncentracije za ispitivanje su PEC i koncentracije pet puta veće od vrednosti PEC. Supstance koje će biti primenjene na zemljište više puta u jednoj sezoni treba ispitivati u koncentracijama dobijenim množenjem vrednosti PEC sa maksimalnim brojem predviđenih primena. Ipak, viša koncentracija ne sme biti veća od desetostruke vrednosti najveće primenjene koncentracije po pojedinačnoj primeni.
Ako se ispituju hemikalije koje nisu agrohemikalije. Koristi se geometrijska serija od najmanje pet koncentracija ispitivane supstance. Koncentracije ispitivane supstance bi trebale pokrivati opseg potreban za određivanje ECx vrednosti.
1.7.1. Uslovi izloženosti
1.7.1.1. Ispitivanjalne i kontrolne grupe
Ukoliko se ispituju agrohemikalije, zemljišta se deli u tri uzorka jednake težine. Dva uzorka se mešaju sa nosačem koji sadrži ispitivanu supstancu, a treći sa nosačem bez ispitivane supstance (kontrola). Preporučuju se minimalno tri ponavljanja za svaki uzorak, sa i bez ispitivane supstance. Ako se ispituju hemikalije koje nisu agrohemikalije, zemljište se deli u šest uzoraka jednake težine. Pet uzoraka se meša sa nosačem koji sadrži ispitivanu supstancu, a šesti sa nosačem bez ispitivane supstance. Preporučaju se tri ponavljanja po svakom uzorku, sa i bez ispitivane supstance. Treba omogućiti homogenu raspodelu supstance u ispitivanim uzorcima zemljišta. Tokom mešanja treba izbegavati presovanje ili gnječenje zemljišta.
1.7.1.2. Inkubacija uzoraka zemljišta
Razlikuju se dva načina inkubacija uzoraka zemljišta zavisno od toga da li su u pitanju jedinstveni uzorci svakog ispitivanog i svakog kontrolnog uzorka zemljišta ili serije pojedinačnih poduzoraka jednake veličine za ispitivane i za kontrolne uzorke zemljišta. U slučaju isparljivih supstanci ispitivanje, ipak, treba izvesti samo sa serijama pojedinačnih poduzoraka. Kada se zemljište inkubira kao jedan jedinstveni uzorak, pripremaju se velike količine zemljišta za ispitivane i kontrolne grupe i po potrebi uzimaju se poduzorci i analiziraju. Količina inicijalno pripremljenih uzoraka za eksperimentlane i kontrolne grupe zavisi od veličine poduzoraka, broja ponavljanja i predviđenog maksimalnog broja uzorkovanja. Zemljišta inkubirana kao jedinstveni uzorak treba dobro promešati pre uzimanja poduzoraka. Kada se uzorci inkubiraju u seriji pojedinačnih poduzoraka zemljišta, osnovni uzorak za ispitivane i kontrolne uzorke deli se na traženi broj poduzoraka i oni se koriste po potrebi. U ispitivanjima gde se može očekivati više od dva uzorkovanja, treba obezbediti dovoljan broj poduzoraka koji može da bude dovoljan za sva ponavljanja i svako uzorkovanje. Treba uraditi najmanje tri ponavljanja po koncentraciji ispitivane supstance i inkubirati u aerobnim uslovima (videti odeljak 1.7.1.1. ove metode). Tokom svih ispitivanja, treba koristiti adekvatne posude koje onemogućavaju razvijanje anaerobnih uslova. U slučaju isparljivih supstanci, ispitivanje se izvodi samo sa serijom pojedinačnih poduzoraka.
1.7.1.3. Uslovi i trajanje ispitivanja
Ispitivanje se vrši u mraku na temperaturi 20°C ± 2 °C. Sadržaj vlage u uzorcima zemljišta treba održavati između 40% i 60% maksimalnog kapaciteta zadržavanja vode u zemljištu (videti odeljak 1.6.4.2. ove metode) sa odstupanjima od ± 5%. Po potrebi, može se dodavati destilovana, dejonizovana voda.
Minimalno trajanje ispitivanja je 28 dana. Ako se ispituju agrohemikalije, porede se količine nastalog ugljen-dioksida i utrošenog kiseonika u ispitivanim grupama u odnosu na kontrolu. Ako se 28. dana ove vrednosti razlikuju za više od 25% ispitivanje se nastavlja dok se ne postigne razlika ≤ 25% ili maksimalno do 100 dana, zavisno koji uslov se pre ispuni. Ako se ispituju hemikalije koje nisu agrohemikalije, ispitivanje se prekida nakon 28 dana. Tada se određuju količine nastalog ugljen-dioksida i utrošenog kiseonika u ispitivanim i kontrolnim uzorcima zemljišta i izračunava ECx vrednost.
1.7.2. Uzorkovanje i analiza zemljišta
1.7.2.1. Šema uzorkovanja zemljišta
Ukoliko se ispituju agrohemikalije, određuje se brzina glukozom indukovane respiracije u uzorcima zemljišta na početku ispitivanja, 7, 14. i 28. dana. Ako je potrebno produžiti ispitivanje, treba obaviti dodatna merenja svakih 14 dana nakon 28. dana.
Ako se ispituju supstance koje nisu agrohemikalije, ispituje se najmanje pet koncentracija ispitivane supstance i određuje se brzina glukozom indukovane brzine respiracije u uzorcima zemljišta na početku (dan 0) i na kraju perioda izlaganja (28. dan). Ukoliko se pokaže potrebnim dodatno merenje se može obaviti sredinom tog perioda, npr. sedmog dana. Podaci dobijeni 28. dana koriste se u određivanju ECx vrednosti za datu hemikaliju. Podaci dobijeni iz kontrolnih uzoraka na početku ispitivanja mogu koristiti u određivanju inicijalnih količina metabolički aktivne mikrobiološke biomase u zemljištu12.
1.7.2.2. Merenje glukozom indukovane brzine respiracije
Glukozom indukovana brzina respiracije u svakom ponavljanju za uzorke zemljišta ispitivane i kontrolne grupe određuje se pri svakom vremenu uzorkovanja. Uzorci zemljišta se mešaju sa dovoljnom količinom glukoze da se izazove maksimalni respiratorni odgovor. Količina glukoze potrebna za izazivanje maksimalnog respiratornog odgovora za dato zemljište može se odrediti u preliminarnom ispitivanju ispitujući seriju koncentracija glukoze14. Za peskovita zemljišta sa sadržajem organskog ugljenika 0,5% do 1,5%, obično je dovoljno 2.000 mg do 4.000 mg glukoze po kilogramu suve težine zemljišta. Glukoza se može samleti u prah sa čistim kvarcnim peskom (10 g peska/kg suve težine zemljišta) i homogenizovati sa zemljištem.
Uzorci zemljišta obogaćeni glukozom inkubiraju se u odgovarajućoj posudi za merenje brzine respiracije u kontinuitetu, ili na svaki sat, ili na svaka dva sata (videti odeljak 1.6.1. ove metode), na temperaturi 20 °C ± 2 °C. Količina oslobođenog ugljen-dioksida i utrošenog kiseonika meri se narednih 12 sati, a merenje treba početi što je pre moguće, poželjno 1 do 2 sata nakon dodavanja glukoze. Ukupna količine oslobođenog ugljen-dioksida ili utrošenog kiseonika u toku 12 sati meri se i određuje srednja brzina respiracije.
Ukoliko se ispituju agrohemikalije, treba zabeležiti količinu nastalog ugljen-dioksida ili utrošenog kiseonika za sve uzorke ispitivane grupe, a srednje vrednosti za sva ponavljanja navesti u tabelarnoj formi. Rezultate treba proceniti odgovarajućim i opšte prihvaćenim statističkim metodama (npr. F-test, nivo značaja 5%). Brzina glukozom indukovane respiracije se izražava u mg ugljen-dioksida/kg suve težine zemljišta/h ili mg kiseonika/suve težine/h. Srednja vrednost brzine nastajanja ugljen-dioksida ili srednja vrednost brzine potrošnje kiseonika u svakoj ispitivanoj grupi poredi se sa kontrolnom grupom i računa se procenat odstupanja od vrednosti u kontroli.
Ako se ispituju supstance koje nisu agrohemikalije, određuju se količine oslobođenog ugljen-dioksida ili utrošenog kiseonika za svaki uzorak ispitivane grupe i pravi se kriva dozne zavisnosti za procenu ECx vrednosti. Brzina glukozom indukovane respiracije (npr. mg CO2/kg suve težine zemljišta/h ili mg kiseonika/suve težine zemljišta/h) u ispitivanim uzorcima nakon 28 dana poredi se sa vrednostima u kontroli. Iz tih podataka računa se procenat vrednosti inhibicije za svaku koncentraciju ispitivane supstance. Ovi rezultati prikazuju se grafički u funkciji koncentracija ispitivane supstance, a za određivanje ECx vrednosti koriste se statističke procedure. Intervali poverenja (p = 0,95) za izračunate ECx vrednosti i putem standardnih procedura15, 16, 17.
Kada se procenjuju rezultati ispitivanja sa agrohemikalijama i kad je razlika u brzini respiracije između prve ispitivane grupe u seriji (maksimalna predviđena koncentracija) i kontrole ≤ 25% u bilo kom vremenu uzorkovanja nakon 28. dana, za date hemikalije se može oceniti da nemaju dugoročni uticaj na transformaciju ugljenik u zemljištu. Kada se procenjuju rezultati dobijeni ispitivanjem supstanci koje nisu agrohemikalije, koriste se EC50, EC25, odnosno EC10 vrednosti.
Izveštaj o ispitivanju mora da sadrži:
1) potpunu identifikaciju korišćenog zemljišta, uključujući:
- geografske odrednice mesta (geografska širina i dužina);
- podatke o istoriji mesta (npr. biljni pokrivač, tretmani sredstvima za zaštitu bilja, tretmani đubrivima, kontaminacije usled nesrećnog slučaja itd);
- upotreba zemljišta (npr. poljoprivredno zemljište, šuma itd);
- dubina uzorkovanja (cm);
- sadržaj peska/mulja/gline (% suve težine);
- pH vrednost (u vodi);
- sadržaj organskog ugljenika (% suve težine);
- sadržaj azota (% suve težine);
- jonsko izmenjivački kapacitet (mmol/kg);
- početna biomasa mikroorganizama u procentima u odnosu na ukupan organski ugljenik;
- literatura vezano za sve metode korišćene za određivanje svakog parametra;
- svi podaci u vezi sa sakupljanjem i skladištenjem uzoraka zemljišta;
- detalji o predinkubaciji, ako postoje;
2) podatke o ispitivanoj supstanci:
- fizičke osobine i gde je bitno, fizička i hemijska svojstva;
- podaci za identifikaciju hemikalije, uključujući strukturnu formulu i stepen čistoće (npr. za sredstva za zaštitu bilja, procenat aktivnog sastojka), sadržaj azota.
3) podatke o uslovima ispitivanja:
- opis obogaćivanja zemljišta organskim supstratom;
- broj koncentracija ispitivane supstance i gde je prikladno, objašnjenje za odabir datih koncentracija;
- opis načina uvođenja ispitivane supstance u zemljište;
- temperatura inkubacije;
- sadržaj vlage u zemljištu na početku i u toku ispitivanja;
- korišćena metoda inkubacije zemljišta (jedinstven uzorak ili serija pojedinačnih poduzoraka);
- broj ponavljanja;
- broj uzorkovanja;
4) rezultati:
- metoda i oprema za merenje brzine respiracije;
- tabelarni podaci uključujući pojedinačne i srednje vrednosti za količinu ugljen-dioksida ili kiseonika;
- varijansa u kontrolnim i eksperimentalnim grupama;
- objašnjenje korekcija u izračunavanju, ukoliko je bitno;
- procenat razlike glukozom indukovane brzine respiracije pri svakom vremenu uzorkovanja, ili, ukoliko je prikladno EC50 sa 95% intervalima proveravanja, druge ECx vrednosti (npr. EC25 ili EC10) sa intervalima poverenja i grafički prikaz krive dozne zavisnosti;
- statistička obrada rezultata, gde je prikladno;
- sve dodatne podatke i opažanja potrebne za za tumačenje rezultata.
1. EPPO, (1994) Decision-Making Scheme for the Environmental Risk Assessment of Plant Protection Chemicals. Chapter 7: Soil Microflora. EPPO Bulletin 24: 1-16, 1994.
2. BBA, (1990) Effects on the Activity of the Soil Microflora. BBA Guidelines for the Official Testing of Plant Protection Products, VI, 1-1 (2nd eds., 1990).
3. EPA, (1987) Soil Microbial Community Toxicity Test. EPA 40 CFR Part 797.3700. Toxic Substances Control Act Test Guidelines; Proposed rule. September 28, 1987.
4. SETAC-Europe, (1995) Procedures for assessing the environmental fate and ecotoxicity of pesticides, Ed. M.R. Lynch, Pub. SETAC-Europe, Brussels.
5. OECD, (1995) Final Report of the OECD Workshop on Selection of Soils/Sediments, Belgirate, Italy, 18-20 January 1995.
6. ISO 10381-6, (1993) Soil quality - Sampling. Guidance on the collection, handling and storage of soil for the assessment of aerobic microbial processes in the laboratory.
7. Anderson, J.P.E., (1987) Handling and Storage of Soils for Pesticide Experiments, in ‘Pesticide Effects on Soil Microflora’. Eds. L. Somerville and M.P. Greaves, Chap. 3: 45-60.
8. Anderson, J.P.E., (1982) Soil Respiration, in ‘Methods of Soil Analysis - Part 2: Chemical and Microbiological Properties’. Agronomy Monograph No 9. Eds. A.L. Page, R.H. Miller and D.R. Keeney. 41: 831- 871.
9. ISO 11266-1, (1993) Soil Quality - Guidance on Laboratory Tests for Biodegradation in Soil: Part 1. Aerobic Conditions.
10. ISO 14239, (1997E) Soil Quality - Laboratory incubation systems for measuring the mineralisation of organic chemicals in soil under aerobic conditions.
11. Heinemeyer O., Insam, H., Kaiser, E.A, and Walenzik, G., (1989) Soil microbial biomass and respiration measurements; an automated technique based on infrared gas analyses. Plant and Soil, 116: 77-81.
12. ISO 14240-1, (1997) Soil quality - Determination of soil microbial biomass - Part 1: Substrateinduced respiration method.
13. ISO 14240-2, (1997) Soil quality - Determination of soil microbial biomass - Part 2: Fumigationextraction method.
14. Malkomes, H.-P., (1986) Einfluß von Glukosemenge auf die Reaktion der Kurzzeit-Atmung im Boden Gegenüber Pflanzenschutzmitteln, Dargestellt am Beispiel eines Herbizide. (Influence of the Amount of Glucose Added to the Soil on the Effect of Pesticides in Short-Term Respiration, using a Herbicide as an Example). Nachrichtenbl. Deut. Pflanzenschutzd., Braunschweig, 38: 113-120.
15. Litchfield, J.T. and Wilcoxon, F., (1949) A simplified method of evaluating dose-effect experiments. Jour. Pharmacol. and Exper. Ther., 96, 99-113.
16. Finney, D.J., (1971) Probit Analysis. 3rd ed., Cambridge, London and New-York.
17. Finney D.J., (1978) Statistical Methods in biological Assay. Griffin, Weycombe, UK.
C.23. AEROBNA I ANAEROBNA TRANSFORMACIJA U ZEMLJIŠTU
Metoda se zasniva na OECD TG 307 (2002) uputstvu ispitivanja.
Ova metoda bazira se na postojećim smernicama1, 2, 3, 4, 5, 6, 7, 8, 9. Opisana metoda osmišljena je za procenu aerobne i anaerobne transformacije hemikalija u zemljištu. Ispitivanja se obavljaju da bi se utvrdila: 1. brzina transformacije ispitivane supstance i 2. priroda i brzina stvaranja i razlaganja proizvoda transformacije kojima bi biljke i zemljišni organizmi mogli biti izloženi. Ovakva ispitivanja su potrebna za hemikalije koje se primenjuju direktno na zemljište ili koje dospevaju u zemljište. Rezultati takvih laboratorijskih ispitivanja mogu se koristiti i pri razvijanju protokola uzimanja uzoraka i analize za srodna istraživanja u ovom području.
Aerobne i anaerobne studije sa jednim tipom zemljišta obično su dovoljne za procenu puteva transformacije8,10, 11. Brzina transformacije treba da se odredi u najmanje tri dodatna tipa zemljišta8, 10.
Na OECD radionici o izboru zemljišta i sedimenta10 dogovoren je broj i tip zemljišta koja se koriste u ovoj metodi ispitivanja. Tipovi ispitivanih zemljišta treba da predstavljaju uslove u životnoj sredini gde će se hemikalije upotrebljavati ili ispustiti. Na primer, hemikalije koje bi se mogle ispuštati u suptropskim i tropskim klimatima treba ispitivati na ferasolu i nitosolu (FAO sistem). Date su i preporuke u vezi sakupljanja, rukovanja i skladištenja uzoraka zemljišta, prema ISO standardu15. Upotreba pirinčanih polja se podjednako uzima u obzir u ovoj metodi.
Ispitivana supstanca jeste bilo koja supstanca, izvorna supstanca ili proizvodi transformacije.
Proizvodi transformacija jesu sve supstance koje su rezultat biotičkih i abiotičkih reakcija transformacija ispitivane supstance, uključujući CO2 i vezane rezidue.
Vezane rezidue jesu jedinjenja u zemljištu, biljkama ili životinjama koje se zadržavaju u matriksu u obliku izvorne supstance ili njenih metabolita/proizvoda transformacije posle ekstrakcije. Metoda ekstrakcije ne sme bitno menjati supstance ili strukturu matriksa. Priroda veze se može delimično objasniti metodama ekstrakcije koje menjaju matriks i sofisticiranim analitičkim tehnikama. Na ovaj način su do danas identifiovani kovalentna jonska i sorptivna veza i molekulske zamke. Vezivanje rezidua znatno smanjuje biodostupnost i bioraspoloživost12 (izmenjen IUPAC 1984 izveštaj13).
Aerobna transformacije jesu reakcije koje se odvijaju u prisustvu molekulskog kiseonika14.
Anaerobna transformacije jesu reakcije koje se odvijaju bez prisustva molekulskog kiseonika14.
Zemljište jeste mešavina mineralnih i organskih hemijskih sastojaka koje čine jedinjenja sa visokim procentom ugljenika i azota, kao i jedinjenja velikih molekulskih masa, u kojima uglavnom žive mikroorganizmi. Zemljište može biti u jednom od dva stanja:
- neporemećeno, kako se vremenom razvilo, u karakterističnim horizontima i raznim tipovima zemljišta;
- poremećeno, kakvo se obično nalazi na oranicama, ili kakvo se javlja u uzorcima koji se iskopaju i koriste u ovoj metodi ispitivanja14.
Mineralizacija jeste potpuno razlaganje organske materije na CO2 i H2O u aerobnim uslovima i do CH4, CO2 i H2O u anaerobnim uslovima. U ovoj metodi kad se koristi jedinjenje obeleženo ugljenikom C14, mineralizacija jeste ekstenzivno razlaganje u toku kojeg označeni ugljenikov atom oksiduje uz otpuštanje određene količine C14O214.
Poluživot (t0,5) jeste vreme potrebno za transformaciju 50% ispitivane supstance, u slučajevima kada se transformacija može opisati kinetikom prvog reda i ne zavisi od početne koncentracije.
Vreme nestajanja 50 (u daljem tekstu: DT50) jeste vreme u toku koga se početna koncentracija ispitivane supstance smanji za 50%, razlikuje se od poluživota t0,5 kada transformacija ne sledi kinetiku prvog reda.
Vreme nestajanja 75 (u daljem tekstu DT75) jeste vreme u toku koga se početna koncentracija ispitivane supstance smanji za 75%.
Vreme nestajanja 90 (u daljem tekstu: DT90) jeste vreme u toku koga se početna koncentracija ispitivane supstance smanji za 90%.
Referentne supstance se koriste za identifikaciju i kvantifikaciju proizvoda transformacije spektroskopskim i hromatografskim metodama.
Metoda je primenljiva na supstance (neobeležene ili obeležene) za koje je dostupna dovoljno precizna i osetljiva analitička metoda. Primenljiva je na slabo isparljiva jedinjenja, neisparljiva jedinjenja, jedinjenja rastvorljiva u vodi ili jedinjenja nerastvorljiva u vodi. Metoda ispitivanja se ne primenjuje na jedinjenja koja su jako isparljiva iz zemljišta (npr. fumiganti, organski rastvarači) i zato se ne mogu držati u zemljištu u ispitivanim uslovima ove metode.
1.5. PODACI O ISPITIVANOJ SUPSTANCI
Neobeležene ili obeležene supstance mogu se koristiti za merenje brzine transformacije. Za proučavanje puteva transformacije i određivanja masenog balansa potreban je obeleženi materijal. Obeležavanje ugljenikom C14 se preporučuje, ali upotreba drugih izotopa kao što su C13, N15, H3, P32 takođe može biti od koristi. Molekul treba označiti u što je moguće stabilnijem delu. Čistoća ispitivane supstance treba da bude najmanje 95%.
Pre ispitivanja aerobne i anaerobne transformacije u zemljištu, o ispitivanoj supstanci treba da budu dostupni podaci:
- rastvorljivost u vodi (Metoda A.6. koja je data u ovom pravilniku);
- rastvorljivost u organskim rastvaračima;
- napon para (Metoda A.4. koja je data u ovom pravilniku) i Henrijeva konstanta;
- koeficijent raspodele u sistemu n-oktanol/voda (Metoda A.8. koja je data u ovom pravilniku);
- hemijska stabilnost u mraku (hidroliza) (Metoda C.7. koja je data u ovom prilogu);
- pKa, ako je molekul sklon protonaciji i deprotonaciji (OECD smernice 112)16.
Ostali korisni podaci mogu uključivati podatke o toksičnosti ispitivane supstance za zemljišne mikroorganizme (Metode C.21. i C.22. koje su date u ovom prilogu)16.
Analitičke metode (uključujući metode ekstrakcije i čišćenja) za identifikaciju i kvantifikaciju ispitivane supstance i njenih proizvoda transformacije treba da budu dostupne.
Uzorci zemljišta tretiraju se ispitivanom supstancom i inkubiraju u mraku u bocama tipa biometra ili u protočnim sistemima u kontrolisanim laboratorijskim uslovima (pri konstantnoj temperaturi i vlažnosti zemljišta). Nakon predviđenih vremenskih intervala, uzorci zemljišta se ekstrahuju i analiziraju na izvorne supstance i proizvode transformacije. Isparljivi proizvodi se takođe skupljaju za analizu koristeći potrebne uređaje za adsorpciju. Koristeći materijal obeležen sa C14, mogu se izmeriti razne brzine mineralizacije ispitivane supstance, hvatanjem C14O2 koji se razvio masenim balansom, uključujući stvaranje veznih rezidua zemljišta.
1.7.1. Efikasnost analitičke tehnike
Ekstrakcija i analiza najmanje dva uzorka zemljišta neposredno nakon dodavanja ispitivane supstance daje prvu naznaku o ponovljivosti analitičke metode i ujednačenosti postupka primene za ispitivanu supstancu. Efikasnost analitičke tehnike u kasnijim fazama ispitivanja određuje se iz masenih balansa. Efikasnost analitičke tehnike treba da bude u opsegu od 90% do 110% za obeležene hemikalije8 i od 70% do 110% za neobeležene hemikalije3.
1.7.2. Ponovljivost i osetljivost analitičke metode
Ponovljivost analitičke metode (isključujući početnu efikasnost ekstrakcije) u kvantifikovanju ispitivane supstance i proizvoda transformacije može se proveriti analizama istog ekstrakta zemljišta u duplikatu, inkubiranog dovoljno dugo da bi se stvorili proizvodi transformacije.
Granica detekcije (Limit of Detection, u daljem tekstu: LOD) analitičke metode za ispitivanu supstancu i za proizvode transformacije treba da bude najmanje 0,01 mg/kg zemljišta (kao ispitivana supstanca) ili 1% primenjene doze, koja doza je niža. Granica kvantifikacije (Limit of Quantification, u daljem tekstu: LOQ) takođe treba da bude određena.
1.7.3. Preciznost podataka o transformaciji
Regresiona analiza koncentracija ispitivane supstance u funkciji vremena daje adekvatne podatke o pouzdanosti transformacione krive i omogućava izračunavanje intervala poverenja za poluživot (ako je primenljiva kinetika pseudo prvog reda), ili DT50 vrednosti i ako su primenljive, DT75 i DT90 vrednosti.
1.8.1. Oprema i hemijski reagensi
Inkubacioni sistemi se sastoje od statičkih zatvorenih sistema ili adekvatnih protočnih sistema7, 17. Primeri odgovarajućih aparata za protočnu inkubaciju i boca tipa biometara prikazani su na slikama 1 i 2. Oba tipa inkubacionih sistema imaju prednosti i ograničenja7, 17.
Potrebna je standardna laboratorijska oprema, a posebno:
- analitički instrumenti kao što su GLC, HPLC, TLC, uključujući odgovarajuće sisteme za detekciju i za analizu radioizotopima obeleženih, ili neobeleženih supstanci, ili oprema za metodu inverznog razređenja izotopa;
- instrumenti za identifikaciju (MS, GC-MS, HPLC-MS, NMR, itd.);
- tečni scintilacioni brojač;
- oksidator za spaljivanje radioaktivnog materijala;
- centrifuga;
- aparatura za ekstrakciju (na primer, kivete za centrifugu kod hladne ekstrakcije i Soxhlet aparatura za kontinuiranu ekstrakciju pod refluksom);
- instrumenti za koncentrovanje rastvora i ekstrakta (npr. rotirajući isparivač);
- vodeno kupatilo;
- mehanička mešalica (npr. mašina za mešanje, rotirajući mikser).
Hemijski reagensi koji se koriste uključuju na primer:
- NaOH, analitičke čistoće, 2 mol/dm3, ili druge adekvatne baze (npr. KOH, etanolamin);
- H2SO4, analitičke čistoće, 0,05 mol/dm3;
- etilenglikol, analitičke čistoće;
- čvrsti materijali za apsorpciju kao što su krečnjak i poliuretanski čepovi;
- organski rastvarači, analitičke čistoće, kao što su aceton, metanol itd.;
- scintilacione tečnosti.
1.8.2. Nanošenje ispitivane supstance
Za dodavanje i raspodelu u zemljištu, ispitivana supstanca se može rastvoriti u vodi (dejonizovanoj ili destilovanoj), ili kada je potrebno, u minimalnim količinama acetona ili drugog organskog rastvarača6 u kome je ispitivana supstanca dovoljno rastvorljiva i stabilna. Količina izabranog rastvarača ne sme bitnije da utiče na mikrobiološku aktivnost zemljišta (videti odeljke 1.5. i 1.9.2. do 1.9.3. ove metode). Upotrebu rastvarača koji sprečavaju mikrobiološku aktivnost zemljišta, kao što su hloroform, dihlormetan i ostali halogeni rastvarači, treba izbegavati.
Ispitivana supstanca se može dodati i kao čvrsta supstanca, npr. mešana sa kvarcnim peskom6 ili u malim poduzorcima ispitivanog zemljišta koji su osušeni na vazduhu i sterilisani. Ako se ispitivana supstanca dodaje sa rastvaračem, rastvarač treba upariti pre nego što se poduzorak doda originalnom nesterilnom uzorku zemljišta.
U slučaju hemikalija, čiji je glavni put unosa u zemljište kanalizacioni mulj, ili njihova upotreba u poljoprivredi, ispitivanu supstancu prvo treba dodati u mulj, koji se potom uvodi u uzorak zemljišta (videti odeljke 1.9.2. i 1.9.3. ove metode).
Ne preporučuje se rutinska upotreba formulisanih proizvoda. Za slabo rastvorljive supstance, upotreba formulisanog materijala može biti primerena alternativa.
1.8.3. Zemljišta
1.8.3.1. Izbor zemljišta
Za određivanje puta transformacije može se koristiti reprezentativno zemljište: peskovita ilovača, muljevita ilovača, ilovača ili pesak sa ilovačom (po FAO i USDA klasifikaciji18) sa pH od 5,5 do 8,0. Preporučuje se udeo organskog ugljenika od 0,5% do 2,5% i mikrobiološke biomase od najmanje 1% od ukupnog organskog ugljenika10.
Za ispitivanje brzine transformacije treba koristiti najmanje tri dodatna tipa zemljišta koji predstavljaju opseg relevantnih tipova. Zemljišta treba da variraju u udelu organskog ugljenika, pH vrednosti, udelu gline i mikrobiološke biomase10.
Sve vrste zemljišta treba okarakterisati barem po teksturi (% peska, % mulja, % gline, po FAO i USDA klasifikaciji18), pH vrednosti, katjonskom izmenjivačkom kapacitetu, sadržaju organskog ugljenika, gustini, kapacitetu zadržavanjaXCII vode i mikrobiološke biomase (samo za aerobna ispitivanja). Dodatni podaci o karakteristikama zemljišta mogu biti korisni kod tumačenja rezultata. Za određivanje karakteristika zemljišta mogu se koristiti metode navedene u literaturi19, 20, 21, 22, 23. Mikrobiološku biomasu treba odrediti koristeći metodu25, 26 supstrat-indukovanog disanja (SIR) ili alternativnim metodama20.
1.8.3.2. Sakupljanje, rukovanje i skladištenje zemljišta
Treba raspolagati detaljnim podacima o istorijatu lokacije na terenu odakle se skupljaju uzorci ispitivanog zemljišta. Detalji uključuju tačnu lokaciju, biljni pokrivač, tretiranje hemikalijama, tretman sa organskim i mineralnim đubrivima, dodatak bioloških materijala ili druge kontaminacije. Zemljišta tretirana sa ispitivanom supstancom ili njenim strukturnim analozima, u prethodne četiri godine ne smeju se koristiti u ispitivanju transformacije10, 15.
Zemljište za ispitivanje treba da bude sveže skupljeno sa polja (od horizonta A ili 20 cm površinskog sloja) sa sadržajem vode koje olakšava prosejavanje. Za sva zemljišta osim onih sa pirinčanih polja, uzorke ne bi trebalo uzimati u toku ili odmah nakon dugih perioda (> 30 dana) suše, smrzavanja ili plavljenja14. Uzorci se transportuju na način koji minimalizuje promene u sadržaju vode u zemljištu i treba da se drže u mraku, u prisustvu vazduha, koliko god je moguće. Labavo vezana polietilenska vreća je obično dobra za ovu svrhu.
Zemljište treba obraditi što je ranije moguće nakon uzimanja uzoraka. Vegetaciju, veću faunu zemljišta i kamenje treba ukloniti pre prosejavanja zemljišta kroz sito promera 2 mm koje uklanja manje kamenje, faunu i ostatke bilja. Treba izbegavati jače sušenje i drobljenje zemljišta pre prosejavanja15.
Kad je uzimanje uzoraka otežano, zimi u polju (zemljište je zamrznuto ili prekriveno slojevima snega), uzorak se može uzeti sa gomile zemljišta uskladištenog u stakleniku pod biljnim pokrivačem (npr. trava ili mešano trava-detelina). Za ispitivanja se strogo preporučuje upotreba uzoraka zemljišta koji su neposredno sakupljeni sa polja, ali ako se obrađeno i procesirano zemljište mora skladištiti pre početka ispitivanja, uslovi skladištenja moraju biti adekvatni i samo na ograničeno vreme (temperatura od 4 °C ± 2 °C, na maksimalno 3 meseca) da bi se održala mikrobiološka aktivnostXCIII. Detaljnija uputstva o sakupljanju, rukovanju i skladištenju zemljišta koja se koriste u metodi ispitivanja transformacije data su u literaturi8, 10, 15, 26, 27.
Pre ispitivanja zemljište treba da bude predinkubirano da bi se dopustilo klijanje i uklanjanje semena kako bi se ponovno uspostavila ravnoteža mikrobiološkog metabolizma, prateći promene od uzorkovanja, ili uslova skladištenja do uslova inkubacije. Predinkubacioni period između 2 i 28 dana u toku koga se aproksimiraju uslovi temperature i vlage konkretne metode ispitivanja je opšte prihvaćen15. Vreme skladištenja i predinkubacije zajedno ne treba da traje duže od tri meseca.
1.9.1. Uslovi u toku ispitivanja
1.9.1.1. Temperatura
Tokom čitavog ispitivanja, uzorke zemljišta treba inkubirati u mraku na konstantnoj temperaturi reprezentativnoj za uslove klime gde će se ispitivana supstanca upotrebljavati ili ispuštati. Temperatura od 20 °C ± 2 °C preporučuje se za sve ispitivane supstance koje mogu dopreti do zemljišta u umerenoj klimi. Temperatura se mora pratiti.
__________
XCII Kapacitet zadržavanja vode u zemljištu se može meriti kao poljski kapacitet vlažnosti, kao kapacitet zadržavanja vode ili jačina upijanja vode (pF). Za objašnjenja videti Deo drugi ove metode. U izveštaju treba navesti ako su karakteristike retencije vode i gustoća mase zemljišta određeni u neporemećenim ili poremećenim (obrađenim) uzorcima.
XCIII Rezultati nedavnih istraživanja ukazuju da se zemljišta iz umerenih zona mogu skladištiti na temperaturi -20 °C, više od tri meseca28, 29 , bez značajnog gubitka mikrobiološke aktivnosti.
Za hemikalije koje se primenjuju ili ispuštaju u hladnijoj klimi (recimo u severnim zemljama, u toku jeseni/zime) treba inkubirati dodatne uzorke zemljišta, ali na nižoj temperaturi (10 °C ± 2 °C).
1.9.1.2. Sadržaj vlage
Za ispitivanje transformacije u aerobnim uslovima, sadržaj vlage u zemljištuXCIV treba prilagoditi i održati na pF između 2,0 i 2,53. Sadržaj vlage u zemljištu se izražava kao masa vode po masi suvog zemljišta i treba se redovno kontrolisati (npr. u intervalima od 2 nedelje) merenjem boca za inkubaciju, a gubitak vode nadoknaditi njenim dodavanjem (najbolje sterilnom, filtriranom vodovodnom vodom). Treba paziti da se pri dodavanju vode spreče ili minimalizuju gubici ispitivane supstance, odnosno proizvoda transformacije isparavanjem i/ili fotodegradacijom (ako se desi).
Za ispitivanje transformacije u anaerobnim uslovima i uslovima pirinčanih polja, zemljište treba da bude saturisano vodom, plavljenjem.
1.9.1.3. Aerobni uslovi inkubacije
U protočnim sistemima, aerobni uslovi se održavaju isprekidanim ispiranjem ili kontinuiranim provetravanjem vlažnim vazduhom. U bocama tipa biometra, razmena vazduha se postiže difuzijom.
1.9.1.4. Sterilni aerobni uslovi
Da bi se dobili podaci o značaju abiotičke transformacije ispitivane supstance, uzorci zemljišta se mogu sterilisati (za metode sterilizacije videti u literaturi16, 29), tretirani sterilnom ispitivanom supstancom (npr. dodavanje rastvora kroz sterilni filtar) i provetravati ovlaženim, sterilnim vazduhom kako je opisano u odeljku 1.9.1.3. ove metode. Za zemljišta sa pirinčanih polja, voda i zemljište treba da budu sterilisani, a inkubacija se obavlja kako je opisano u odeljku 1.9.1.6. ove metode.
1.9.1.5. Anaerobni uslovi inkubacije
Da bi se uspostavili i održali anaerobni uslovi, zemljište koje je tretirano sa ispitivanom supstancom i inkubirano u aerobnim uslovima 30 dana ili u toku poluživota ili DT50 (u zavisnosti od toga koje je vreme kraće) stavlja se u vodu (1 cm do 3 cm sloja vode) i inkubacioni sistem se ispere inertnim gasom (npr. azotom ili argonom)XCV. Ispitivani sistem mora omogućiti merenja poput pH vrednosti, koncentracije kiseonika i redoks potencijala i sadržavati aparaturu za hvatanje isparljivih proizvoda. Sistem tipa biometra mora biti zatvoren da se izbegne ulazak vazduha difuzijom.
1.9.1.6. Uslovi inkubacije za zemljišta sa pirinčanih polja
Da bi se ispitala transformacija u zemljištima pirinčanih polja, zemljište se plavi slojem vode od oko 1 cm do 5 cm i ispitivana supstanca se dodaje u vodenu fazu9. Preporučuje se dubina zemljišta od najmanje 5 cm. Sistem se aeriše u aerobnim uslovima. Vrednost pH, koncentraciju kiseonika i redoks potencijal vodenog sloja treba pratiti i navesti. Potreban je predinkubacioni period od najmanje dve nedelje pre početka ispitivanja transformacije (videti odeljak 1.8.3.2. ove metode).
__________
XCIV Zemljište treba da bude ni previše vlažno ni previše suvo da bi se održala adekvatna aeracija i ishrana zemljišne mikroflore. Sadržaj vlage za optimalni mikrobiološki rast je u rasponu od 40% do 60% kapaciteta zadržavanja vode (water holding capacity, WHC) i od 0,1 bara do 0,33 bara. Taj raspon je ekvivalentan rasponu pF od 2,0 do 2,5 jedinica. Tipičan sadržaj vlage raznih tipova zemljišta dat je u Delu trećem ove metode.
XCV Aerobni uslovi su dominantni u površinskom i čak u pod-površinskom zemljištu, kao što je vidljivo iz istraživačkog projekta sponzorisanog od EU [K. Takagi et al. (1992). Microbial diversity and activity in subsoils: Methods, field site, seasonal variation in subsoil temperatures and oxygen contents. Proc. Internat. Symp. Environm. Aspects Pesticides Microbiol., 270-277, 17-21 August 1992, Sigtuna, Sweden]. Anaerobni uslovi se mogu pojaviti samo povremeno, tokom poplava nakon jakih kiša, ili kad se uspostavljaju uslovi posebnog navodnjavanja u pirinčanim poljima.
1.9.1.7. Dužina ispitivanja
Ispitivanja brzine i puteva ne treba da budu duža od 120 danaXCVI, 3, 6, 8, jer bi se nakon toga, vremenom, očekivalo smanjenje mikrobiološke aktivnosti, u veštačkom laboratorijskom sistemu, izolovanom od prirodnog nadopunjavanja. Ispitivanja se mogu produžiti na duže periode tamo gde je potrebno okarakterisati smanjenje ispitivane supstance i stvaranje i razlaganje glavnih proizvoda transformacije. (npr. 6 ili 12 meseci)8. Duže periode inkubacije treba obrazložiti u izveštaju o ispitivanju uz propratna merenja biomase u toku i na kraju ovih perioda.
1.9.2. Tok ispitivanja
Otprilike 50 g do 200 g zemljišta (suve mase) stavlja se u svaku inkubacionu bocu (videti Sliku 1 i 2 u Delu trećem ove metode) i zemljište se tretira ispitivanom supstancom, korišćenjem neke od metoda opisanih u odeljku 1.8.2.ove metode. Ako se koriste organski rastvarači za nanošenje ispitivane supstance, oni treba da se uklone iz zemljišta isparavanjem. Zemljište se dobro promeša spatulom, odnosno boca se protrese. Ako se ispitivanje izvodi u uslovima pirinčanih polja, zemljište treba dobro promešati sa vodom nakon primene ispitivane supstance. Manje uzorke (npr. od 1 g) tretiranog zemljišta treba analizirati na ispitivanu supstancu da bi se proverila ravnomernost raspodele.
Ispitivana doza treba da bude usaglašena sa najvišom primenjenom dozom sredstva za zaštitu bilja preporučenom u uputstvu za upotrebu i ravnomerne primene na odgovarajućim dubinama u polju (u gornjih 10 cm slojaXCVII zemljišta). Na primer, za hemikalije koje se primenjuju na lišće ili zemljište, ali bez inkorporacije, 2,5 cm je prikladna dubina za izračunavanje koliko hemikalije treba dodati u svaku bocu je. Za hemikalije unete u zemljište, prikladna dubina je ona navedena u uputstvima za upotrebu. Uopšteno, za hemikalije brzina primene treba da se proceni prema najznačajnijem putu ulaska. Na primer, kad je glavni put ulaska preko kanalizacionog mulja, hemikaliju treba dozirati u mulj, u koncentraciji koja odražava očekivanu koncentraciju mulja, a količina dodatog mulja treba da odražava uobičajeni mulj koji se dodaje poljoprivrednim zemljištima. Ako ova koncentracija nije dovoljno visoka da omogući identifikaciju glavnih proizvoda transformacije, mogla bi pomoći inkubacija odvojenih uzoraka zemljišta koji sadrže veći opseg, ali treba izbegavati prevelike količine koje utiču na mikrobiološke funkcije zemljišta (videti odeljke 1.5. i 1.8.2. ove metode).
Veći komad zemljišta (npr. 1kg do 2 kg) može se tretirati ispitivanom supstancom, pažljivo pomešati u odgovarajućoj mešalici i podeliti u manje porcije od 50 g do 200 g u boce za inkubaciju (korišćenjem razvodnika). Manje alikvote (npr. 1 g) tretiranog zemljišta treba analizirati na ispitivanu supstancu da bi se proverila ravnomernost raspodele. Takva procedura ima prednosti jer dopušta ravnomerniju raspodelu ispitivane supstance u zemljištu.
Neobrađeni uzorci se takođe inkubiraju u istim uslovima (aerobnim) kao i uzorci tretirani ispitivanom supstancom. Ti uzorci se koriste za merenje biomase u toku i na kraju ispitivanja.
Kada se ispitivana supstanca primenjuje na zemljište rastvorena u organskim rastvaračima, uzorci zemljišta tretirani istom količinom rastvarača inkubiraju se u istim uslovima (aerobnim), kao i uzorci tretirani ispitivanom supstancom. Ovi uzorci se koriste za merenje biomase u početku, u toku i na kraju ispitivanja, da bi se proverili efekti rastvarača na mikrobiološku biomasu.
___________
XCVI Aerobna ispitivanja se mogu prekinuti mnogo pre 120 dana ako se za to vreme utvrde konačni put transformacije i postigne potpuna mineralizacija. Prekid ispitivanja je moguć posle 120 dana, ili kada se barem 90% ispitivane supstance transformiše, ali samo ako se formira najmanje 5% CO2.
XCVII Izračunavanje početne koncentracije na bazi površine dato je jednačinom:
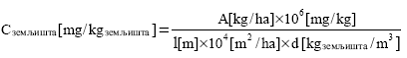
Pri čemu:
Czemljišta jeste početna koncentracija u zemljištu (mg/kg);
A jeste doza za primenu (mg/kg);
l jeste debljina zemljišnog sloja u polju [m]; d = gustina suve zemljišne mase (kg/m3).
Aproksimativno, doza primene od 1 kg/ha jeste približno 1 mg/kg zemljišne koncentracije u sloju od 10 cm (pretpostavljajući gustinu mase od 1 g/cm3).
Boce koje sadrže tretirano zemljište se ili spajaju na protočne sisteme opisane na Slici 1, ili se zatvaraju apsorpcionom kolonom prikazanom na Slici 2 (videti Deo četvrti ove metode).
1.9.3. Uzimanje uzoraka i merenje
Duple boce za inkubaciju uklanjaju se u odgovarajućim vremenskim intervalima i uzorci zemljišta ekstrahuju odgovarajućim rastvaračima različite polarnosti i analiziraju na ispitivanu supstancu, odnosno proizvode transformacije. Dobro osmišljeno ispitivanje uključuje dovoljno boca tako da se dve boce mogu odbaciti pri svakom uzimanju uzoraka. Rastvori za apsorpciju ili kruti materijali za apsorpciju uklanjaju se u različitim vremenskim intervalima (7-dnevni intervali u toku prvog meseca i 17-dnevni intervali nakon prvog meseca), u toku i na kraju inkubacije svakog uzorka zemljišta i analiziraju na isparljive produkte. Osim uzorka zemljišta uzetog neposredno nakon primene (uzorak, nultog dana) treba uključiti najmanje 5 dodatnih tačaka uzorkovanja. Vremenske intervale treba izabrati tako da se obrazac opadanja ispitivane supstance i obrasci stvaranja i razlaganja produkata transformacije mogu uspostaviti (npr. 0, 1, 3, 7. dan; 2, 3. nedelja; 1, 2, 3. mesec, itd).
Kada se koristi ispitivana supstanca označena ugljenikom C14, radioaktivnost koja se ne može ekstrahovati kvantifikovaće se spaljivanjem, a maseni balans će se izračunati za svaki interval uzorkovanja.
U slučaju anaerobne inkubacije i inkubacije navodnjavanih uzoraka, faza zemljišta i vode zajedno se analiziraju na ispitivanu supstancu i proizvode transformacije, ili se odvajaju filtracijom, ili centrifugom pre ekstrakcije i analize.
1.9.4. Fakultativna ispitivanja
Aerobna, nesterilna ispitivanja na dodatnim temperaturama mogu biti korisne za procenu uticaja temperature i vlage u zemljištu na brzinu transformacije ispitivane supstance, odnosno njenih proizvoda transformacije u zemljištu.
Dodatna karakterizacija radioaktivnosti koja se ne može ekstrahovati može se pokušati upotrebom, na primer superkritične tečne ekstrakcije.
Količine ispitivane supstance, proizvoda transformacije, isparljivih supstanci (samo u procentima) i supstanci koje se ne mogu ekstrahovati izražavaju se u procentu primenjene početne koncentracije i gde je prikladno, kao mg/kg zemljišta (na bazi suve mase zemljišta) za svaki interval uzorkovanja. Maseni balans se izražava kao procenat primenjene početne koncentracije za svaki interval uzorkovanja. Grafički prikaz koncentracija supstance u funkciji vremena omogućiće procenu poluživota ili DT50. Glavni proizvodi transformacije identifikuju se i njihove koncentracije se takođe prikazuju u funkciji vremena, da bi se pokazala brzina njihovog nastanka i raspada. Glavni proizvod transformacije je bilo koji proizvod koji predstavlja ≥ 10% primenjene doze, u bilo koje vreme u toku ispitivanja.
Isparljivi proizvodi koji se uhvate daju naznaku potencijala isparljivosti ispitivane supstance i njenih proizvoda transformacije iz zemljišta.
Preciznija određivanja poluživota ili DT50 vrednosti i ako je prikladno, DT75 i DT90 vrednosti postižu se primenom odgovarajućih kalkulacija pomoću kinetičkih modela. Poluživot ili DT50 vrednosti navode se u izveštaju zajedno sa opisom modela koji je korišćen, kao i redom kinetike i koeficijentom određivanja (r2). Poželjnija je kinetika prvog reda, osim ako je r2 < 0,7. Ako je prikladno, kalkulacije se takođe primenjuju na glavne proizvode transformacije. Primeri prikladnih modela dati su u literaturi31-35.
U slučaju ispitivanja brzina na različitim temperaturama, brzine transformacije opisane su Arenijusovom jednačinom, kao funkcija temperature unutar opsega ispitivane temperature:
k = A x e-B/T
ili
Ink = InA - | B |
|
T |
pri čemu:
ln A i B jesu konstante regresije iz prekida i nagiba, najbolje aproksimiranog pravca generisanog linearnom regresijom ln k prema 1/T;
k jeste konstanta brzine na temperaturi T;
T jeste temperatura u kelvinima (K). Treba paziti na ograničeni opseg temperatura za koje će Arenijusova relacija biti važeća u slučaju da je transformacija dirigovana mikrobiološkom aktivnošću.
2.2. PROCENA I TUMAČENJE REZULTATA
Iako se ispitivanja izvode u veštačkim laboratorijskim uslovima, rezultati omogućavaju procenu brzine transformacije ispitivane supstance, kao i brzinu stvaranja i raspada proizvoda transformacije u terenskim uslovima36, 37.
Studija puteva transformacije ispitivane supstance daje podatke o načinu na koji se primenjena supstanca strukturno menja u zemljištu hemijskim i mikrobiološkim reakcijama.
Izveštaj o ispitivanju mora da sadrži podatke:
1) ispitivana supstanca:
- ime, hemijski naziv, CAS broj, strukturna formula (naznačujući mesto obeležavanja, kad se koristi materijal označen radioizotopima) i odgovarajuća fizička i hemijska svojstva (videti odeljak 1.5. ove metode);
- čistoća (nečistoće) ispitivane supstance;
- radiohemijska čistoća obeležene hemikalije i specifična aktivnost (gde je prikladno);
2) referentne supstance:
- hemijski naziv i struktura referentnih supstanci koje se koriste za karakterizaciju, odnosno identifikaciju proizvoda transformacije;
3) ispitivano zemljište:
- detalji o mestu sakupljanja;
- datum i procedura uzimanja uzoraka zemljišta;
- svojstva zemljišta, kao što su pH vrednost, sadržaj organskog ugljenika, tekstura (% peska, % mulja, % gline), katjonski izmenjivački kapacitet, gustoća mase, svojstva zadržavanja vode i mikrobiološka biomasa;
- dužina skladištenja zemljišta i uslovi skladištenja (ako je skladišteno);
4) uslovi u toku ispitivanja:
- datumi ispitivanja;
- količina primenjene ispitivane supstance;
- upotrebljeni rastvarači i metoda njihove primene na ispitivanu supstancu;
- masa zemljišta tretiranog u početku i uzorkovanog u svakom intervalu za analizu;
- opis korišćenog sistema za inkubaciju;
- protoci vazduha (samo za protočne sisteme);
- temperature u ispitivanom sistemu;
- sadržaj vlage u zemljištu u toku inkubacije;
- mikrobiološka biomasa u početku, u toku i na kraju aerobnih studija;
- pH, koncentracija kiseonika i redoks potencijal u početku, u toku i na kraju anaerobnih i studija pirinčanih polja;
- metode ekstrakcije;
- metode za kvantifikaciju i identifikaciju ispitivane supstance i glavnih proizvoda a transformacije u zemljištu i apsorpcionim materijalima;
- broj replika i broj kontrola.
5) rezultati:
- rezultat određivanja mikrobiološke aktivnosti;
- ponovljivost i osetljivost korišćenih analitičkih metoda;
- efikasnost primenjene analitičke tehnike (procenat vrednosti za prihvatljivu studiju su date u odeljku 1.7.1. ove metode);
- tabela rezultata izražena u procentima primenjene početne doze i gde je prikladno, u mg/kg tla (na bazi suve mase);
- maseni balans u toku i na kraju studije;
- karakterizacija radioaktivnosti koja se ne može ekstrahovati (vezana) ili rezidua u zemljištu;
- kvantifikacija ispuštenog CO2 i ostalih isparljivih materija;
- grafički prikaz koncentracija u zemljištu u funkciji vremena za ispitivanu supstancu i gde je prikladno, za glavne proizvode transformacije;
- polu-život ili DT50, DT75 i DT90 za ispitivanu supstancu i gde je prikladno, za glavne proizvode transformacije uključujući intervale poverenja;
- procena abiotičke degradacije u sterilnim uslovima;
- procena kinetike transformacije za ispitivanu supstancu i gde je prikladno, za glavne proizvode transformacije;
- predložen put transformacije, gde je prikladno;
- tumačenje rezultata;
- neobrađeni podaci (npr. primeri hromatograma, uzorci kalkulacija brzina transformacije i načina za identifikaciju proizvoda transformacije).
1. US - Environmental Protection Agency, (1982) Pesticide Assessment Guidelines, Subdivision N.Chemistry: Environmental Fate.
2. Agriculture Canada, (1987) Environmental Chemistry and Fate. Guidelines for registration of pesticidesin Canada.
3. European Union (EU), (1995) Commission Directive 95/36/EC of 14 July 1995 amending CouncilDirective 91/414/EEC concerning the placing of plant protection products on the market. Annex II, Part A and Annex III, Part A: Fate and Behaviour in the Environment.
4. Dutch Commission for Registration of Pesticides, (1995) Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
5. BBA, (1986) Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-1. Verbleib von Pflanzenschutzmitteln im Boden - Abbau, Umwandlung und Metabolismus.
6. ISO/DIS 11266-1, (1994) Soil Quality - Guidance on laboratory tests for biodegradation of organicchemicals in soil - Part 1: Aerobic conditions.
7. ISO 14239, (1997) Soil Quality - Laboratory incubation systems for measuring the mineralisation oforganic chemicals in soil under aerobic conditions.
8. SETAC, (1995) Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R.Lynch, Ed.
9. MAFF - Japan 2000 - Draft Guidelines for transformation studies of pesticides in soil - Aerobicmetabolism study in soil under paddy field conditions (flooded).
10. OECD, (1995) Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy, 18-20 January 1995.
11. Guth, J.A., (1980) The study of transformations. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, p. 123-157.
12. DFG: Pesticide Bound Residues in Soil. Wiley - VCH (1998).
13. T.R. Roberts: Non-extractable pesticide residue in soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC 1984).
14. OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adopted 12 May 1981).
15. ISO 10381-6 (1993) Soil Quality - Sampling - Part 6: Guidance on the collection, handling andstorage of soil for the assessment of aerobic microbial processes in the laboratory.
16. Appendix V to Directive 67/548/EEC.
17. Guth, J.A., (1981) Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol 1, 85-114.
18. Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc.Amer. Proc. 26:305 (1962).
19. Methods of Soil Analysis (1986) Part 1, Physical and Mineralogical Methods. A. Klute, Ed.) Agronomy Series No 9, 2nd Edition.
20. Methods of Soil Analysis (1982) Part 2, Chemical and Microbiological Properties. A.L. Page, R.H. Millerand D.R. Kelney, Eds. Agronomy Series No 9, 2nd Edition.
21. ISO Standard Compendium Environment (1994) Soil Quality - General aspects; chemical and physicalmethods of analysis; biological methods of analysis. First Edition.
22. Mückenhausen, E., (1975) Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischenund petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
23. Scheffer, F., Schachtschabel, P., (1975) Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
24. Anderson, J.P.E., Domsch, K.H., (1978) A physiological method for the quantitative measurement of microbial biomass in soils. Soil Biol. Biochem. 10, p. 215-221.
25. ISO 14240-1 and 2 (1997) Soil Quality - Determination of soil microbial biomass - Part 1: Substrateinducedrespiration method. Part 2: fumigation-extraction method.
26. Anderson, J.P.E., (1987) Handling and storage of soils for pesticide experiments. In Pesticide Effects on Soil Microflora. L. Somerville, M.P. Greaves, Eds. Taylor & Francis, 45-60.
27. Kato, Yasuhiro. (1998) Mechanism of pesticide transformation in the environment: Aerobic and biotransformationof pesticides in aqueous environment. Proceedings of the 16th Symposium on Environmental Science of Pesticide, p. 105-120.
28. Keuken O., Anderson J.P.E., (1996) Influence of storage on biochemical processes in soil. In Pesticides, Soil Microbiology and Soil Quality, 59-63 (SETAC-Europe).
29. Stenberg B., Johansson M., Pell M., Sjödahl-Svensson K., Stenström J., Torstensson L. (1996) Effect offreeze and cold storage of soil on microbial activities and biomass. In Pesticides, Soil Microbiology and Soil Quality, 68-69 (SETAC-Europe).
30. Gennari, M., Negre, M., Ambrosoli, R., (1987) Effects of ethylene oxide on soil microbial content andsome chemical characteristics. Plant and Soil 102, p. 197-200.
31. Anderson, J.P.E. (1975) Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegungvon Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, p. 141-146.
32. Hamaker, J.W., (1976) The application of mathematical modelling to the soil persistence and accumulation of pesticides. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, p. 181-199.
33. Goring, C.A.I., Laskowski, D.A., Hamaker, J.W., Meikle, R.W., (1975) Principles of pesticide degradation in soil. In ‘Environmental Dynamics of Pesticides’. R. Haque and V.H. Freed, Eds., p. 135-172.
34. Timme, G., Frehse, H., Laska, V., (1986) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. II. Pflanzenschutz - Nachrichten Bayer 39, p. 188-204.
35. Timme, G., Frehse, H., (1980) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. I. Pflanzenschutz - Nachrichten Bayer 33, p. 47-60.
36. Gustafson D.I., Holden L.R., (1990) Non-linear pesticide dissipation in soil; a new model based on spatial variability. Environm. Sci. Technol. 24, p. 1032-1041.
Hurle K., Walker A., (1980) Persistence and its prediction. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, p. 83-122.
Napon vode, poljski kapacitet zemljišta (FC) i kapacitet zadržavanja vode (WHC)XCVIII
Visina vodenog stuba (cm) | pFXCIX | barC | Napomene |
107 | 7 | 104 | Suvo zemljište |
1,6 x 104 | 4,2 | 16 | Tačka uvenuća |
104 | 4 | 10 |
|
103 | 3 | 1 |
|
6 x 102 | 2,8 | 0,6 |
|
3,3 x 102 | 2,5 | 0,33CI | |
102 | 2 | 0,1 | |
60 | 1,8 | 0,06 | |
33 | 1,5 | 0,033 | |
10 | 1 | 0,01 | WHC (približno) |
1 | 0 | 0,001 | Tlo zasićeno vodom |
___________
XCVIII Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
XCIX pF = log visine vodenog stuba
C 1 bar = 105 Pa
CI Odgovara približnomsadržaju vode od 10% u pesku, 35% u ilovači i 45% u glini.
CII Poljski kapacitet nije konstantan nego varira sa tipom zemljišta između pF 1,5 i 2,5.
Napon vode meri se u centimetrima vodenog stuba ili u barima. Zahvaljujući velikom opsegu sukcijske tenzije, izražava se kao pF vrednost koja je ekvivalent logaritmu cm vodenog stuba.
Poljski kapacitet se definiše kao količina vode koja se može zadržati u zemljištu suprotno sili teže dva dana nakon dužeg kišnog perioda, ili nakon dovoljno navodnjavanja. Određuje se u neporemećenom zemljištu na terenu in situ. Merenja nisu primenjiva na poremećene laboratorijske uzorke zemljišta. FC-vrednosti određene u poremećenim zemljištima mogu pokazati velike sistemske varijanse.
Kapacitet zadržavanja vodeXII (water holding capacity, u daljem tekstu: WHC) određuje se u laboratoriji sa neporemećenim i poremećenim zemljištima zasićenjem zemljišnog stuba vodom, kapilarnim transportom. Posebno je korisno za poremećena zemljišta i može biti i do 30% veći od poljskog kapaciteta. Ispitivanjem je lakše odrediti WHC od pouzdane FC-vrednosti.
Sadržaj vlage u tlu (g vode na 100 g suvog tla) različitih tipova zemljišta iz različitih država
tip zemljišta | država | sadržaj vlage u tlu pri | ||
WHC* | pF = 1,8 | pF = 2,5 | ||
Pesak | Nemačka | 28,7 | 8,8 | 3,9 |
Pesak sa ilovačom | Nemačka | 50,4 | 17,9 | 12,1 |
Pesak sa ilovačom | Švajcarska | 44,0 | 35,3 | 9,2 |
Muljevita ilovača | Švajcarska | 72,8 | 56,6 | 28,4 |
Glinena ilovača | Brazil | 69,7 | 38,4 | 27,3 |
Glinena ilovača | Japan | 74,4 | 57,8 | 31,4 |
Peščana ilovača | Japan | 82,4 | 59.2 | 36,0 |
Muljevita ilovača | SAD | 47,2 | 33,2 | 18,8 |
Peščana ilovača | SAD | 40,4 | 25,2 | 13,3 |
* kapacitet zadržavanja vode (water holding capacity) | ||||
Slika 1: Primer protočne aparature za ispitivanje transformacije hemikalija u zemljištuCIII, CIV
Vazduh |
Pri čemu je:
1 - igličasti ventil;
2 - boca za ispiranje vazduhom koja sadrži vodu;
3 - ultramembrana (samo sterilni uslovi) veličina pora: 0,2 µm;
4 - boca za metabolizam zemljišta (uronjena u vodu samo za aerobne uslove i uslove pirinčanih polja);
5 - etilenglikol za hvatanje organskih isparljivih jedinjenja;
6 - sumporna kiselina za hvatanje alkalnih isparljivih jedinjenja;
7, 8 - natrijum hidroksid za hvatanje CO2 i drugih kiselih isparljivih materija;
9 - merač protoka.
Slika 2: Primer boca tipa biometra za ispitivanje transformacije hemikalija u zemljištuCV
Na - kreč za apsorbovanje CO2 | |
Staklena vuna tretirana uljem ili poliuretenskom penom za apsorbovanje organskih isparljivih jedinjenja | |
Zemljište + ispitivana supstanca |
__________
CIII Guth, J.A. (1980). The study of transformations. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, 123-157.
CIV Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol 1, 85-114.
CV Anderson, J.P.E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, p. 141-146.
C.24. AEROBNE I ANAEROBNE TRANSFORMACIJE U SISTEMIMA VODA - SEDIMENT
Metoda se zasniva na OECD TG 308 (2002) uputstvu ispitivanja.
Hemikalije dospevaju u plitke ili duboke površinske vode usled neposredne primene, putem raspršivanja, spiranja, drenaže, odlaganja otpada, otpadnih voda iz industrije, domaćinstava ili poljoprivrede i atmosferskog taloženja. Ova metoda ispitivanja opisuje laboratorijski postupak za procenu aerobne i anaerobne konverzije organskih hemikalija u sistemima voda-sediment. Metoda se zasniva na uputstvima koja su navedena u literaturi1, 2, 3, 4, 5, 6. Broj i tip sedimenata koji se koriste u ovom ispitivanju utvrđen je na OECD radionici o izboru zemljišta/sedimenta7. Tom prilikom date su preporuke za sakupljanje, rukovanje i skladištenje uzoraka sedimenata zasnovane na ISO standardu8. Ispitivanje je neophodno za hemikalije koje se neposredno dodaju u vodu ili dospevaju u vodu ostalim navedenim putevima.
Uslovi u prirodnim sistemima voda-sediment su često aerobni u gornjoj vodenoj fazi. Površinski sloj sedimenta je ili aeroban ili anaeroban, dok je dublji sediment najčešće anaeroban. Da bi se obuhvatile sve ove mogućnosti, pojedinačno su opisana i aerobna i anaerobna ispitivanja. Aerobno ispitivanje simulira aerobni vodeni stub iznad aerobnog sloja sedimenta koji je naglašen anaerobnim gradijentom. Anaerobno ispitivanje simulira potpuno anaerobni sistem voda-sediment. U slučaju značajnog odstupanja od navedenih postavki, npr. kada se koriste intaktna sedimentna jezgra ili sedimenti koji su već bili izloženi ispitivanim supstancama, na raspolaganju su druge metode ispitivanja9.
Koriste se standardne međunarodne merne jedinice (SI).
Ispitivana supstanca jeste bilo koja supstanca, bilo da je u pitanju polazna supstanca ili odgovarajući proizvodi konverzije.
Proizvodi transformacije jesu sve supstance koje proističu iz biotičkih i abiotičkih reakcija transformacije ispitivane supstance uključujući i CO2 i vezane ostatke.
Vezani ostaci jesu jedinjenja u zemljištu, biljkama ili životinjama koja opstaju u matriksu bilo u obliku polazne supstance, ili njenih metabolita nakon procesa ekstrakcije. Metoda ekstrakcije ne sme ne sme da dovede do značajne izmene samih jedinjenja ili strukture matriksa. Priroda veze može se delom objasniti metodama ekstrakcije koje menjaju matriks i sofisticiranim analitičkim tehnikama. Do danas su, npr. na ovaj način otkrivene kovalente jonske i sorptivne veze, kao i molekulske klopke. U principu, obrazovanje vezanih ostataka značajno smanjuje biodostupnost i bioraspoloživost10 (modifikovani IUPAC 198411izveštaj).
Aerobna konverzija jesu oksidujuće reakcije koje se odvijaju u prisustvu molekularnog kiseonika12.
Anaerobna konverzija jesu redukujuće reakcije koje se odvijaju u odsustvu molekularnog kiseonika12.
Prirodne vode jesu površinske vode iz jezera, reka ili potoka itd.
Sediment jeste mešavina neorganskih i organskih hemijskih sastojka. Organski sastojci sadrže jedinjenja sa visokim sadržajem ugljenika i azota i visoke molekulske mase. Taloži se putem prirodne vode i integriše se sa tom vodom.
Mineralizacija jeste potpuna razgradnja nekog organskog jedinjenja do CO2, H2O u aerobnim uslovima, ili do CH4, CO2 i H2O u anaerobnim uslovima. U ovoj metodi ispitivanja, kada se koristi jedinjenje obeleženo radioizotopom, mineralizacija označava sveobuhvatnu razgradnju molekula u toku koje se obeleženi atom ugljenika oksiduje ili se redukuje srazmerno oslobođenoj količini C14O2 ili C14H4.
Vreme polu-raspada (t0,5) jeste vreme potrebno za konverziju 50% ispitivane supstance, u slučaju kada se konverzija može objasniti kinetikom prvog reda, nezavisno od početne koncentracije.
Vreme polu-raspada 50 (u daljem tekstu: DT50) jeste vreme tokom kojeg je početna koncentracija ispitivane supstance smanjena za 50%.
Vreme polu-raspada 75 (u daljem tekstu: DT75) jeste vreme tokom kojeg je početna koncentracija ispitivane supstance smanjena za 75%.
Vreme polu-raspada 90 (u daljem tekstu: DT90) jeste vreme tokom kojeg je početna koncentracija ispitivane supstance smanjena za 90%.
Referentne supstance se koriste za identifikaciju i kvantifikaciju proizvoda konverzije uz pomoć spektroskopskih i hromatografskih metoda.
1.4. PODACI O ISPITIVANIM SUPSTANCAMA
Neobeležene ispitivane supstance kao i ispitivane supstance obeležene izotopima mogu se koristiti u merenju stope transformacije iako se za ovo preporučuje obeleženi materijal. Obeleženi materijal je potreban za proučavanje puteva transformacije i za utvrđivanje masenog bilansa. C14 označavanje se preporučuje ali i upotreba ostalih izotopa kao što su C13, N15, H3, P32, može biti korisna. Kadagod je moguće, izotopska oznaka treba da bude ugrađena u najstabilniji deo molekulaCVI. Hemijska, odnosno radiohemijska čistoća ispitivane supstance mora biti najmanje 95%. Pre početka ispitivanja sledeće informacije o supstanci koja se ispituje moraju biti na raspolaganju:
CVI Na primer, ukoliko supstanca sadrži samo jedan prsten, on se obavezno obeležava. Ukoliko ispitivana supstanca sadrži dva ili više prstenova, mogu biti neophodna pojedinačna istraživanja da bi se procenila sudbina svakog obeleženog prstena i dobili odgovarajući podaci o formiranju proizvoda konverzije.
- rastvorljivost u vodi (videti metodu A.6. u Prilogu 1 ovog pravilnika);
- rastvorljivost u organskim rastvaračima;
- pritisak pri isparavanju (videti metodu A.4. u Prilogu 1 ovog pravilnika) i Henrijeva konstanta;
- koeficijent raspodele u sistemun-oktanol/voda (videti metodu A.8. u Prilogu 1 ovog pravilnika);
- koeficijent adsorpcije - Kd, Kf ili Koc, kada je moguće (videti metodu C.18. ovog priloga);
- hidroliza (videti metodu C.7. ovog priloga);
- konstanta disocijacije - pKa (smernice OEBS 112)13;
- hemijska struktura ispitivane supstance i mesto vezivanja izotopa, ukoliko je moguće.
Napomena: treba zabeležiti temperaturu na kojoj su rađena merenja.
Korisno je imati i podatke o toksičnosti ispitivane supstance po mikroorganizme, podatke o brzoj, odnosno inherentnoj biorazgradljivosti, i podatke o aerobnoj i anaerobnoj konverziji u zemljištu.
Treba da budu dostupne analitičke metode (uključujući i metode ekstrakcije i ispiranja) za identifikaciju i kvantifikaciju ispitivane supstance i proizvoda njene konverzije u vodi i sedimentu (videti odeljak 1.7.2 ove metode).
1.5. PRINCIP METODE ISPITIVANJA
U ispitivanju se koristi aerobni i anaerobni sistem voda-sediment (videti Deo drugi ove metode) koji omogućava:
- merenje stope konverzije ispitivane supstance u sistemu voda-sediment;
- merenje stope konverzije ispitivane supstance u sedimentu;
- merenje stope mineralizacije ispitivane supstance, odnosno produkata konverzije (kada se koristi ispitivana supstanca obeležena radioizotopom C14);
- identifikaciju i kvantifikaciju proizvoda konverzije u vodi i sedimentu uključujući i maseni bilans (kada se koristi obeležena ispitivana supstanca);
- merenje distribucije ispitivane supstance i njenih proizvoda konverzije između dve faze u periodu inkubacije u zamračenim uslovima na konstantnoj temperaturi (da bi se izbeglo, npr. cvetanje algi). DT50, DT75 i DT90 vrednosti se određuju u kratkom roku nakon ispitivanja i ne mogu biti izvedene mnogo posle perioda ispitivanja (videti odeljak 1.2).
Potrebna su najmanje dva tipa sedimenta i odgovarajućih uzoraka vodenog stuba kako za aerobno tako i za anaerobno ispitivanje7. Postoje slučajevi kada bi trebalo koristiti više od dva tipa sedimenta, npr. za hemikalije koje se mogu naći u slatkovodnom, odnosno morskom okruženju.
Metoda se u većini slučajeva primenjuje za ispitivanje supstanci (obeleženih ili neobeleženih) za koje postoji dovoljno precizan i osetljiv analitički postupak. Primenjuje se na jedinjenja koja su minimalno isparljiva, neisparljiva, rastvorljiva i nerastvorna u vodi. Ova ispitivanja ne bi trebalo da se primenjuju na hemikalije koje su visoko isparljive iz vodenog rastvora (npr. fumiganti, organski rastvarači) i zbog toga se u ne mogu zadržati u vodi, odnosno sedimentu pod ispitivanim uslovima.
Do sada se ovaj metod primenjivao da bi se izučile konverzije hemikalija u slatkoj vodi i sedimentima, ali može primeniti i na estuarske/morske ekosisteme. Nije preporučljivo da se simuliraju uslovi u tekućim vodama (npr. reke) ili otvorenom moru.
1.7.1. Efikasnost primenjene analitičke tehnike
Ekstrakcija i analiza, najmanje u duplikatu, svih uzoraka vode i sedimenta, odmah nakon dodavanja ispitivane supstance, daje prve indikacije o efikasnosti analitičke metode i identičnosti postupaka koji se primenjuju na supstance. Efikasnost u kasnijim fazama ispitivanja su data u odgovarajućem balansu mase (onda kada se koristi obeleženi materijal). Efikasnost mora biti u opsegu od 90% do 110% za obeležene hemikalije6 i od 70% do 110% za neobeležene hemikalije.
1.7.2. Ponovljivost i osetljivost analitičke metode
Ponovljivost analitičke metode (isključujući inicijalnu efikasnost ekstrakcije) radi kvantifikacije ispitivane supstance i proizvoda transformacije se može proveravati ponovljenom analizom (dva ponavljanja) istog ekstrakta vode ili uzorka sedimenta koji su bili inkubirani dovoljno dugo da bi se formirali proizvodi transformacije.
Granica detekcije (LOD) analitičke metode za ispitivane supstance i proizvode konverzije mora biti najmanje 0,01 mg/kg u vodi ili sedimentu (kao ispitivana supstanca) ili 1% početne količine koja je primenjena na ispitivani sistem. Kao granica detekcije primenjuje se uvek niža vrednost. Takođe treba navesti granicu kvantifikacije (LOQ).
1.7.3. Preciznost podataka konverzije
Regresiona analiza koncentracije ispitivane supstance u funkciji vremena daje odgovarajuće informacije o preciznosti krive konverzije i omogućava izračunavanje intervala poverenja za vrednosti polu-raspada (ako se može primeniti pseudo kinetika prvog reda) ili vrednosti DT50 i ako više odgovara, vrednosti DT75 i DT90.
1.8.1. Ispitivanjalni sistem i aparatura
Istraživanje se sprovodi u staklenim posudama (npr. flaše, kivete), osem ukoliko prethodne informacije (poput koeficijenta raspodele u sistemun-oktanol/voda, podaci o sorpciji, itd) pokažu da ispitivana supstanca prijanja uz staklo, u tom slučaju se koristi altrenativni materijal (kao što je teflon). Ako je poznato da ispitivana supstanca prijanja uz staklo moguće je prevazići ovaj problem korišćenjem jednog ili više navedenih postupaka:
- odrediti masu ispitivane supstance i proizvoda konverzije koji prijanjaju uz staklo;
- na kraju ispitivanja obezbediti ispiranje sudova rastvaračem;
- korišćenje formulisanih proizvoda (videti odeljak 1.9.2. ove metode);
- uvećavanjem količine ko-rastvarača radi dodavanja ispitivane supstance u sistem; ukoliko se koristi ko-rastvarač onda on treba da bude takav da ne rastvori ispitivanu supstancu.
Primeri tipične ispitivane aparature odnosno gas-protočnog i biometarskog sistema, su dati u Delu trećem i četvrtom14. Ostali korisni inkubacioni sistemi su opisani u literaturnom navodu15. Dizajn apararature koja se koristi pri eksperimentu bi trebalo da omogući razmenu vazduha ili azota i hvatanje isparljivih proizvoda. Dimenzije aparature moraju biti takve da ispunjavaju uslove koji se zahtevaju u ispitivanju (videti odeljak 1.9.1). Ventilacija se može obezbediti bilo laganim mešanjem ili propuštanjem vazduha ili azota po vodenoj površini. U drugom slučaju preporučljivo je lagano mešanje vode odozgo radi bolje distribucije kiseonika ili azota u vodi. Vazduh koji ne sadrži CO2 se ne bi trebao koristiti jer bi to dovelo do povećanja pH vode. U svakom slučaju poremećaji sedimenta su nepoželjni i treba ih izbegavati koliko god je to moguće. Blago isparljive hemikalije bi trebalo da se ispituju u sistemu biometarskog tipa pri laganom mešanju vodene površine. Mogu da se koriste i zatvorene posude sa slobodnim prostorom na vrhu, bilo za atmosferski vazduh ili azot i unutrašnjim sistemom koji služi za zadržavanje isparljivih proizvoda konverzije16. Kod ispitivanja aerobnih konverzija neophodna je redovna razmena gasa na vrhu epruvete da bi se kompenzovala potrošnja kiseonika od strane biomase.
Za sakupljanje isparljivih proizvoda konverzije koristi se 1 mol/dm3 rastvora natrijum-hidroksida ili kalijum-hidroksida za ugljen dioksidCVII i etilen glukol, etanolamin ili 2% parafinske kiseline za organska jedinjenja. Isparljiva jedinjenja koja nastaju u anaerobnim uslovima, kao što je metan, mogu se sakupiti npr. pomoću molekulskih sita. Takva isparenja se napr. sagorevaju do CO2 prilikom propuštanja gasa kroz kvarcnu cev napunjenu sa CuO na temperaturi od 900 (C i hvatanjem nastalog CO2 u absorber sa bazama17.
Potrebni su laboratorijski merni instrumenti za hemijsku analizu ispitivane supstance i proizvoda konverzije (npr. hromatografija tečnog gasa - GLC, tečna hromatografija visokih performansi - HPLC, hromatografija tankog sloja - TLC, spektroskopija mase - MS), hromatografija gasa-spektroskopija mase - GC-MS, tečna hromatografija-spektroskopija mase - LC-MS, nuklearna magnetska rezonanca - NMR, itd), uključujući i sisteme za otkrivanje hemikalija koje su obeležene ili neobeležene radioizotopima, kada je to moguće. Kada se koristi materijal radio izotopski obeležen takođe je potreban i tečni scintilacioni brojač i oksidant sagorevanja (za sagorevanje uzoraka sedimenta pre radioaktivne analize).
Po potrebi, može biti neophodna i ostala standardna laboratorijska oprema za fizičko hemijska i biološka određivanja (videti Tabelu 1. u odeljku 1.8.2.2. ove metode), laboratorijsko staklo, hemikalije i reagensi.
1.8.2. Izbor i broj uzoraka vodenih sedimenata
Mesto za uzimanje uzorka sedimenta se određuje za svaku posebnu situaciju u skladu sa svrhom ispitivanja. Prilikom izbora mesta za uzimanje uzorka, mora se uzeti u obzir prethodni uticaj poljoprivrede, industrije i domaćinstava na slivno područje, kao i na sektor neposredno uzvodno od lokaliteta. Sedimenti se ne smeju koristiti ukoliko su zagađeni ispitivanom supstancom ili njenim strukturnim analozima u prethodne četiri godine.
1.8.2.1. Izbor sedimenta
Dva tipa sedimenta se obično koriste pri aerobnim studijama7. Dva izabrana uzorka sedimenta se moraju razlikovati po sadržaju organskog ugljenika i granulometrijskom sastavu. Jedan sediment treba da ima visok sadržaj organskog ugljenika (2,5-7,5%) i da ga dominantno čine fine frakcije, a drugi sediment treba da ima niži sadržaj organskog ugljenika (0,5-2,5%) i da dominiraju krupne frakcije. Razlika u sadržaju organskog ugljenika treba da bude najmanje 2%. Muljevito-glinovitiCVIII sediment sadrži > 50% fine frakcije, za razliku od glinovito-muljevitog sedimenta kod koga je taj sadržaj < 50%. Razlika između sadržaja mulja i gline dva sedimenta treba da bude najmanje 20%. U slučajevima kada hemikalija dospe u morske vode, najmanje jedan od sistema sediment - voda mora biti morskog porekla.
_________
CVII Kako ovi alkalni apsorpcioni rastvori apsorbuju i ugljen dioksid iz ventilacionog vazduha i ugljen dioksid koji nastaje u proces udisanja pri aerobnom ispitivanju, oni moraju da se zamenjuju u redovnim intervalima da bi se izbeglo njihovo zasićenje, a time i gubitak apsorbcionog kapaciteta.
CVIII Glina - mulj je mineralna frakcija sedimenta veličine < 50 μm.
Za striktno anaerobna istraživanja, dva uzorka sedimenta (uključujući i pripadajuće vode) treba uzeti iz anaerobnih zona površinske vode7. I uzorci vode i uzorci sedimenta moraju se pažljivo transportovati bez prisustva kiseonika.
Ostali parametri koji mogu biti od važnosti prilikom odabira sedimenta posmatraće se od slučaja do slučaja. Npr. pH vrednost sedimenta je važan parametar za ispitivanje hemikalija čija razgradljivost, odnosno sorpcija zavisi od pH vrednosti. pH zavisnost može da se ogleda preko pKa ispitivane supstance.
1.8.2.2. Karakterizacija uzoraka sistema voda - sediment
Ključni parametri koji se moraju meriti i beležiti (uz navođenje upotrebljene metode) kako u vodi tako i u sedimentu, kao i vremenska dinamika merenja, navedeni su u tabeli ispod. Informativno, metode za određivanje ovih parametara date su u literaturi17, 18, 19, 20. Zavisno od slučaja može se ukazati potreba za merenjem i prikazivanjem vrednosti i drugih parametara (npr. za svežu vodu - čestice, alkalitet, tvrdoća, provodljivost, NO3/PO4 odnos i pojedinačne vrednosti; za sedimente - jonska izmena, vodni kapacitet, karbonati, ukupni azot i fosfor; za morske sisteme - salinitet). Analiza sedimenata i vode na nitrate, sulfate, bio dostupno gvožđe i moguće druge elektron akceptore može biti od koristi u proceni redukcionih procesa, naročito kod anaerobne transformacije.
Merenje parametara za karakterizaciju uzoraka sistema sediment-voda7, 21, 22
| Faza postupka | |||||
uzimanje uzoraka na terenu | naknadno rukovanje | početak aklimatizacije | početak | u toku | kraj | |
Voda |
|
|
|
|
|
|
Poreklo/ izvor | x |
|
|
|
|
|
Temperatura | x |
|
|
|
|
|
pH | x |
| x | x | x | x |
TOC |
|
| x | x |
| x |
Konc. O2CIX | x |
| x | x | x | x |
Oksido-redukcioni |
|
| x | x | x | x |
Sediment |
|
|
|
|
|
|
Poreklo/ izvor | x |
|
|
|
|
|
Dubina sloja | x |
|
|
|
|
|
pH |
| x | x | x | x | x |
Granulo-metrijski sastav |
| x |
|
|
|
|
TOC |
| x | x | x |
| x |
Biomasa |
| x |
| x |
| x |
Oksido-redukcioni potencijalCX | Opažanje |
| x | x | x | x |
1.8.3. Sakupljanje, rukovanje i skladištenje
1.8.3.1. Sakupljanje
Za uzorkovanje sedimenta dna koristi se ISO standard8 Uzorci se uzimaju iz gornjeg sloja sedimenta dubine 5 cm do 10 cm. Voda koja se koristi treba da se uzme sa istog mesta ili lokacije i u isto vreme kada i sediment. Za anaerobnu studiju, uzorci sedimenta i vode koji se koriste treba da budu uzeti bez kiseonika27 (videti odeljak 1.8.2.1. ove metode). Neki od uređaja za uzimanje uzoraka su opisani u literaturi8, 22.
___________
CIX Metoda stope mikrobne respiracije26 , metod fumigacije27 ili brojanje na Petrijevim šoljama (npr. broj bakterija, aktinomiceta, gljiva i ukupan broj kolonija) za aerobne studije, a stopa metanogeneze za anaerobne studije.
CX Rezultati novijih istraživanja su pokazali da merenja koncentracije kiseonika u vodi i oksidaciono redukcionog potencijala nemaju ni mehanističku niti vrednost u cilju predviđanja rasta i razvoja populacije mikroorganizama u površinskim slojevima voda24, 25 . Određivanje biohemijske potrošnje kiseonika (BPK), prilikom uzimanja uzoraka na terenu, na početku i na kraju ispitivanja) i koncentracija mikro/makro nutrijenata Ca, Mg i Mn (na početku i kraju ispitivanja) u vodi kao i ukupni N i ukupni P u sedimentu (prilikom uzimanja uzoraka na terenu i na kraju ispitivanja) predstavljaju bolje parametre za tumačenje i procenu i stope i puteva biotransformacije.
1.8.3.2. Rukovanje
Sediment se odvaja filtracijom kroz sito promera 2 mm pomoću viška vode koja se potom odbacuje. Poznata količina sedimenta i vode meša se u potrebnom odnosu (videti odeljak 1.9.1. ove metode) u inkubacionim bocama i priprema za period inkubacije (videti odeljak 1.8.4. ove metode). Za anaerbonu studiju svi koraci u postupku se sprovode bez prisustva kiseonika28, 1, 30, 31, 32.
1.8.3.3. Skladištenje
Preporučuje se korišćenje svežeg sedimenta i vode, ali ukoliko je potrebno skladištenje, sediment i voda se prosejavaju na gore opisan načini i skladište se zajedno, vodeni stub (6 cm do 10 cm vodenog sloja), u mračnoj prostoriji, najduže dve nedelje7, 8, 22 na temperaturi od (4 ± 2) °C. Uzorci koji se koriste u aerobnim studijama se skladište tako da imaju dotok vazduha (pr. otvoreni kontejneri), dok se oni koji se koriste za anaerobne studije skladište bez kiseonika. Zamrzavanje sedimenta i vode ili isušivanje sedimenta se ne sme dogoditi u toku transporta i skladištenja.
1.8.4. Priprema uzoraka sedimenta/vode za ispitivanje
Period aklimatizacije treba da bude pre dodavanja ispitivane supstance i svaki od uzoraka sediment/voda koji se koristi u glavnom ispitivanju stavlja se u inkubacioni sud. Aklimatizacija treba da bude pod istim uslovima kao i inkubacija (videti odeljak 1.9.1. ove metode). Pod periodom aklimatizacije se podrazumeva vremenski period potreban za postizanje određene stabilnosti, na šta ukazuju pH vrednost, koncentracija kiseonika u vodi, oksido-redukcioni potencijal sedimenta u vodi i makroskopska podela faza. Period aklimatizacije uobičajeno traje jednu do dve nedelje, a ne bi trebalo da traje duže od četiri nedelje. Rezultate ispitivanja koja su urađena u ovom periodu treba zabeležiti.
1.9.1. Uslovi pod kojima se obavlja ispitivanje
Ispitivanje se izvodi u inkubacionoj aparaturi (videti odeljak 1.8.1. ove metode) u zapreminskom odnosu voda: sediment između 3:1 i 4:1 i sloja sedimenta dubine 2,5 cm (± 0,5 cm)CXI. Minimalna preporučena količina sedimenta je 50 g suve mase po inkubacionom sudu.
Ispitivanje se izvodi u mračnoj prostoriji na ujednačenoj temperaturi od 10 °C do 30 °C. Odgovarajuća temperatura je (20 ± 2) °C. Ukoliko je moguće, zavisno od slučaja do slučaja, može se uzeti u obzir dodatna niža temperatura (npr. 10 °C), zavisno od informacije koja treba da se dobije iz ispitivanja. Inkubaciona temperatura se kontroliše i beleži.
1.9.2. Priprema i uvođenje ispitivane supstance
Koristi se uvek jedna doza ispitivane hemikalijeCXII. U slučajevima u kojima su sredstva za zaštitu bilja direktno uneta u vodu, smatra se da je maksimalno dozvoljena količina navedena na etiketi datog sredstva maksimalna koncentracija na površini suda u kome se obavlja eksperiment. Mora se koristiti maksimalna doza koja je data na etiketi. U svim ostalim slučajevima, koncentracija koja se koristi treba da se bazira na proračunima iz emisija u životnu sredinu. Mora se voditi računa da se obezbedi primena odgovarajuće količine ispitivane supstance kako bi se izvršila karakterizacija puteva konverzije, kao i obrazovanje i razgradnja proizvoda konverzije. Možda je potrebno upotrebiti veće doze (npr. 10 puta) u situacijama kada su koncentracije ispitivane supstance blizu granice detekcije na početku studije, odnosno kada se glavni produkti konverzije ne mogu odmah opaziti kada su prisutni u udelu od najmanje 10% u odnosu na ispitivanu supstancu. Međutim, ukoliko se koriste veće ispitivane koncentracije one ne bi trebalo da imaju značajnije štetno dejstvo na aktivnosti mikroorganizama sistema voda-sediment. Da bi se postigla stalna koncentracija ispitivane supstance u posudama različitih dimenzija, može se uzeti u obzir prilagođavanje količine materijala koji se koristi, na osnovu dubine vodenog stuba u posudi u odnosu na dubinu vode na terenu (pretpostavlja se da je 100 cm, ali i ostale dubine se mogu uzeti u obzir). Primer kalkulacije videti u Delu petom ove metode.
_________
CXI Preporučuje se količina od najmanje 50 g sedimenta (suve mase) po inkubacionoj posudi.
CXII Ispitivanje sa drugom koncentracijom može biti od koristi za hemikalije koje dospevaju u površinske vode različitim putevima unosa i kao rezultat imaju dramatično različitu koncentraciju, sve dok se niža koncentracija može analizirati sa dovoljnom preciznošću.
U idealnim okolnostima ispitivana supstanca se primenjuje kao vodeni rastvor u vodenoj fazi sistema za ispitivanje. Ukoliko se ne može izbeći, dozvoljeno je korišćenje male količine rastvarača koji se mešaju sa vodom (kao što je aceton, etanol) radi upotrebe i distribucije ispitivane supstance, ali ona ne sme da bude veća od 1% v/v i ne sme da ima štetno dejstvo na mikrobnu aktivnost sistema za ispitivanje. Treba obratiti pažnju na sakupljanje vodenog rastvora ispitivane supstance - korišćenje generatora kolone i prethodno mešanje se može koristiti da bi se obezbedila totalna homogenost. Nakon dodavanja vodenog rastvora u ispitivanjalni sistem, preporučuje se lagano mešanje vodene faze, vodeći računa da se što manje narušava sediment.
Ne preporučuje se rutinsko korišćenje formulisanih produkata pošto sastojci formulacije mogu da utiču na raspored ispitivane supstance, odnosno proizvoda konverzije između vodene i sedimentne faza. Međutim, korišćenje formulisanih materijala može biti odgovarajuća alternative za supstance koje se slabo rastvaraju u vodi.
Broj inkubacionih posuda zavisi od različite dužine vremena prilikom uzimanja uzoraka (videti odeljak 1.9.3. ove metode). Trebalo bi uključiti dovoljno veliki broj ispitivanjalnih sistema da bi se dva eksperimentalna sistema mogla žrtvovati pri svakom uzorkovanju. Kada se koriste kontrolne jedinice svakog sistema voda-sediment, ne bi trebalo da se drže zajedno sa ispitivanom supstancom.
Kontrolne jedinice se mogu koristiti za određivanje biomase mikroorganizama sedimenta i ukupnog organskog ugljenika vode i sedimenta prilikom završetka studije. Dve kontrolne jedinice (odnosno jedna kontrolna jedinica za svaki sistem voda sediment) se može koristiti da bi se pratili traženi parametri u sedimentu i vodi u toku perioda aklimatizacije (videti tabelu u odeljku 1.8.2.2. ove metode). Dve dodatne kontrolne jedinice se moraju uključiti u slučaju da se ispitivana supstanca primenjuje putem rastvarača da bi se izmerila štetna dejstva na aktivnosti mikroorganizama u ispitivanom sistemu.
1.9.3. Trajanje ispitivanja i uzimanje uzoraka
Eksperiment ne bi trebalo da traje duže od 100 dana6, i nastavlja se sve dok se ne uspostave putevi konverzije i distribucije vode/sedimetna ili kada kada dođe do raspada ispitivane supstance od 90% bilo razgradnjom, odnosno isparavanjem. Broj uzoraka u toku trajanja ispitivanja bi trebalo da bude najmanje šest (uključujući i nulto vreme), uz korišćenje opcione preliminarne studije (videti odeljak 1.9.4. ove metode) da bi se ustanovio pravilan režim uzimanja uzoraka i dužina trajanja ispitivanja, osem ukoliko ne postoje dovoljne informacije o ispitivanoj supstanci iz prethodnih studija. Za hidrofobne supstance, u toku inicijalnog perioda studije je možda potrebno uzeti dodatne uzorke, da bi se odredila stopa distribucije između vode i sedimentnih faza.
Pri odgovarajućem vremenu uzorkovanja, celi inkubacioni sudovi (u kopiji) se sklanjaju radi analize. Sediment koji se nalazi u vodi analizira se posebnoCXIII. Površinske vode se pažljivo uklanjaju uz minimalno uznemiravanje sedimenta. Ekstrakcija i karakterizacija ispitivane supstance i proizvoda konverzije prati odgovarajuće analitičke procedure. Treba voditi računa da se ukloni materijal koji se absorbovao u inkubacionom sudu ili u povezanim epruvetama koje se koriste za sakupljanje isparenja.
1.9.4. Opciona preliminarna studija
Ukoliko se režim uzimanja uzoraka i njegova dužina ne mogu odrediti iz ostalih relevantnih studija na ispitivanoj supstanci, može se uzeti u razmatranje opciono preliminarno ispitivanje, koja se izvodi u istim uslovima koji su predloženi za krajnju studiju. U slučaju da se preliminarno ispitivanje izvodi treba ukratko navesti merodavne uslove ispitivanja i dobijene rezultate.
_________
CXIII U slučajevima kada može da dođe do rapidne re-oksidacije anaerobnih proizvoda razgradnje, anerobni uslovi se moraju održati tokom analize i uzimanja uzoraka
1.9.5. Merenja i analize
Koncentracija ispitivane supstance i proizvoda konverzije pri svakom uzorkovanju u vodi i sedimentu meri se i zapisuje (ili kao koncentracija ili kao procenat od nanete supstance). U bilo kom vremenu uzimanja uzoraka identifikuju se proizvodi konverzije uočeni na ≥ 10% primenjene radioaktivnosti u ukupnom sistemu voda-sediment, osim ukoliko ne postoje opravdani razlozi da se drugačije postupi. Prilikom identifikacije uzimaju se u obzir i proizvodi konverzije čije se koncentracije konstantno povećavaju tokom ispitivanja, čak i ako njihove koncentracije ne prelaze utvrđene nivoe, jer ovo ukazuje na njihovu perzistenciju. Perzistentnost supstance se razmatra od slučaja do slučaja i obrazlaže u izveštaju.
Rezultati dobijeni iz sistema za hvatanje gasova/isparenja (CO2 i ostali, odnosno isparljiva organska jedinjenja) treba da budu zabeleženi pri svakom uzorkovanju. Stope mineralizacije se beleže. Neizdvojivi (vezani) ostaci u sedimentu se beleže prilikom svakog uzimanja uzoraka.
2.1. POSTUPANJE SA REZULTATIMA
Ukupan maseni balans ili efikasnost (videti odeljak 1.7.1. ove metode) dodate radioaktivnosti se izračunava pri svakom uzimanju uzoraka. Rezultati se beleže kao procenat dodate radioaktivnosti. Distribucija radioaktivnosti između vode i sedimenta se beleže ili kao koncentracija ili kao procenat, pri svakom uzimanju uzoraka.
DT50 i ukoliko je moguće, DT75 i DT90 ispitivane supstance se izračunava zajedno sa odgovarajućim intervalima poverenja (videti odeljak 1.7.3. ove metode). Podaci o stopi rasipanja ispitivane supstance u vodi i sedimentu se mogu dobiti korišćenjem odgovarajuće pseudo kinetike prvog reda, odnosno tehnike empirijskog određivanja krive koja primenjuje grafička ili numerička rešenja ili još kompleksnijih procena u vidu pojedinačnih ili multi-dimenzionalnih modela. Detaljnije videti u literaturi34, 35, 36.
Svi ovi pristupi imaju svoje dobre i loše strane i značajno variraju u svojoj kompleksnosti. Pretpostavljena kinetika prvog reda može biti preterano pojednostavljenje konverzije i procesa raspodele, ali kada je god je to moguće daje vremensku odrednicu (stopu konstante ili polu-život), koja se jednostavno razume i od velikog je značaja u modelima simulacije i kalkulacijama procesa konverzije i raspodele predviđenih koncentracija u životnoj sredini. Empirijski pristupi ili linearna transformacija mogu dovesti do boljeg prilagođavanja krive podacima i doprineti boljoj proceni polu-života, DT50 i kad god je moguće, vrednosti DT75 i DT90. Korišćenje izvedenih konstanti je ograničeno. Modeli odvojenih posuda mogu generisati znatan broj korisnih vrednosnih konstanti u proceni rizika koje opisuje stopu konverzije u različitim posudama i raspodele hemikalije. Izbor metode u svakom slučaju mora biti opravdan a ekseprimetnator je dužan da grafički ili statistički dokumentuje da je izbor metoda odgovarajući.
Izveštaj mora da sadrži sledeće podatke:
1) ispitivana supstanca:
- uobičajeni naziv, hemijski naziv, CAS broj, strukturnu formulu (naznačiti poziciju izotop kada se koristi radioobeleženi materijal) i relevantne fizičko hemijske osobine;
- čistoća (nečistoća) ispitivane supstance;
- radiohemijska čistoća obeležene hemikalije i aktivnosti molekula (kada je to moguće);
2) referentne supstance:
- hemijski naziv i struktura referentne supstance koja se koristi za karakterizaciju, odnosno identifikaciju proizvoda konverzije;
- Sediment i voda korišćeni u ispitivanju:
- lokacija i opis mesta na kome su uzeti uzorci sedimenta, uključujući, ukoliko ih imamo, podatke o prethodnom zagađenju;
- sve informacije vezane za sakupljanje, skladištenje (ukoliko postoje) i aklimatizaciju sistema voda-sediment;
- svojstva sistema voda-sediment na način prikazan u tabeli u odeljku 1.8.2.2;
3) uslovi pod kojima se obavlja ispitivanje:
- ispitivanjalni sistem koji se koristi (npr. protočni sistem, biometar, način ventilacije, metod mešanja, zapremina vode, masa sedimenta, visina vode i sedimentnog sloja, dimenzije posuda u kojima se obavlja ispitivanje, itd.
- uvođenje ispitivane supstance u ispitivanjalni sistem: korišćena koncentracija, broj duplikata i kontrola, način primene ispitivane supstance (npr. korišćenje rastvarača ukoliko ih ima), itd;
- temperatura inkubacije;
- vreme uzimanja uzoraka;
- ekstrakcione metode i efikasnost kao i analitičke metode i granice detekcije;
- metode za karakterizaciju/identifikaciju proizvoda konverzije;
- odstupanja od protokola metode ispitivanja ili uslova u kojim se odvija ispitivanje u toku studije;
4) rezultati:
- neobrađeni podaci repreznetativnih analiza (svi neobrađeni podaci treba da se arhiviraju u skladu sa principima dobre laboratorijske prakse - GLP);
- ponovljivost i osetljivost korišćenog analitičkog metoda;
- efikasnost analitičke tehnike (% vrednosti validne studije su dati u odeljku 1.7.1);
- tabele sa rezultatima izražene u % primenjene doze i u mg/kg vode, sedimenta i ukupnog sistema (samo u %) za ispitivanu supstancu i ukoliko je moguće za proizvode konverzije i neizdvojivu radioaktivnost;
- maseni balans u toku i na kraju ispitivanja;
- grafički prikaz transformacije posebno u vodi i sedimentu kao i u ukupnom sistemu (uključujući i mineralizaciju);
- stope mineralizacije;
- poluživot, DT50 i ukoliko je moguće, DT75 i DT90 vrednosti za ispitivanu supstancu, i gde postoji mogućnost za glavne proizvode konverzije, uključiti i intervale poverenja u vodi sedimentu i ukupnom sistemu;
- procena kinetike transformacije ispitivane supstance, i kada je moguće glavnih proizvoda konverzije;
- predložene puteve transformacije, kada je to moguće;
- prodiskutovati rezultate.
1. BBA-Guidelines for the examination of plant protectors in the registration process., (1990) Part IV, Section 5-1: Degradability and fate of plant protectors in the water/sediment system. Germany.
2. Commission for registration of pesticides: Application for registration of a pesticide., (1991) Part G. Behaviour of the product and its metabolites in soil, water and air, Section G.2.1 (a). The Netherlands.
3. MAFF Pesticides Safety Directorate., (1992) Preliminary guideline for the conduct of biodegradability tests on pesticides in natural sediment/water systems. Ref No SC 9046. United-Kingdom.
4. Agriculture Canada: Environmental chemistry and fate., (1987) Guidelines for registration of pesticides in Canada. Aquatic (Laboratory) - Anaerobic and aerobic. Canada. p. 35-37.
5. US-EPA: Pesticide assessment guidelines, Subdivision N. Chemistry: Environmental fate (1982) Section 162-3, Anaerobic aquatic metabolism.
6. SETAC-Europe publication., (1995) Procedures for assessing the environmental fate and eCOtoxicity of pesticides. Ed. Dr Mark R. Lynch. SETAC-Europe, Brussels.
7. OECD Test Guidelines Programme., (1995) Final Report of the OECD Workshop on Selection of Soils/sediments, Belgirate, Italy, 18-20 January 1995.
8. ISO/DIS 5667-12., (1994) Water quality - Sampling - Part 12: Guidance on sampling of bottom sediments.
9. US-EPA (1998a) Sediment/water microcosm biodegradation test. Harmonised Test Guidelines (OPPTS 835.3180). EPA 712-C-98-080.
10. DFG: Pesticide Bound Residues in Soil. Wiley-VCH (1998).
11. (11) T.R. Roberts: Non-extractable pesticide residues in soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC 1984).
12. OECD Test Guideline 304A: Inherent Biodegradability in Soil (adopted 12 May 1981).
13. OECD (1993): Guidelines for Testing of Chemicals. Paris. OECD (1994-2000): Addenda 6-11 to Guidelines for the Testing of Chemicals.
14. Scholz, K., Fritz R., Anderson C. and Spiteller M. (1988) Degradation of pesticides in an aquatic model ecosystem. BCPC - Pests and Diseases, 3B-4, p. 149-158.
15. Guth, J.A., (1981) Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry (D.H. Hutson, T.R. Roberts, Eds.), Vol. 1, 85-114. J. Wiley & Sons.
16. Madsen, T., Kristensen, P. (1997) Effects of bacterial inoculation and non-ionic surfactants on degradation of polycyclic aromatic hydrocarbons in soil. Environ. ToxiCOl. Chem. 16, p. 631-637.
17. Steber, J., Wierich, P. (1987) The anaerobic degradation of detergent range fatty alCOhol ethoxylates. Studies with 14C-labelled model surfactants. Water Research 21, p. 661-667.
18. Black, C.A. (1965). Methods of Soil Analysis. Agronomy Monograph No 9. American Society of Agronomy, Madison.
19. APHA (1989) Standard Methods for Examination of Water and Wastewater (17th edition). American Public Health Association, American Water Works Association and Water Pollution Control Federation, Washington D.C.
20. Rowell, D.L. (1994) Soil Science Methods and Applications. Longman.
21. Light, T.S., (1972). Standard solution for redox potential measurements. Anal. Chemistry 44, p. 1038-1039.
22. SETAC-Europe publication (1991) Guidance document on testing procedures for pesticides in freshwater mesocosms. From the Workshop ‘A Meeting of Experts on Guidelines for Static Field Mesocosms Tests’, 3-4 July 1991.
23. SETAC-Europe publication. (1993) Guidance document on sediment toxicity tests and bioassays for freshwater and marine environments. From the Workshop on Sediment Toxicity Assessment (WOSTA), 8-10 November 1993. Eds.: I.R. Hill, P. Matthiessen and F. Heimbach.
24. Vink, J.P.M., van der Zee, S.E.A.T.M. (1997) Pesticide biotransformation in surface waters: multivariate analyses of environmental factors at field sites. Water Research 31, p. 2858-2868.
25. Vink, J.P.M., Schraa, G., van der Zee, S.E.A.T.M. (1999) Nutrient effects on microbial transformation of pesticides in nitrifying waters. Environ. Toxicol, p. 329-338.
26. Anderson, T.H., Domsch, K.H. (1985) Maintenance carbon requirements of actively-metabolising microbial populations under in-situ Conditions. Soil Biol. Biochem. 17, p. 197-203.
27. ISO-14240-2., (1997) Soil quality - Determination of soil microbial biomass - Part 2: Fumigationextraction method.
28. Beelen, P. Van and F. Van Keulen., (1990), The Kinetics of the Degradation of Chloroform and Benzene in Anaerobic Sediment from the River Rhine. Hydrobiol. Bull. 24 (1), p. 13-21.
29. Shelton, D.R. and Tiedje, J.M. (1984) General method for determining anaerobic biodegradation potential. App. Environ. Microbiol. 47, p. 850-857.
30. Birch, R.R., Biver, C., Campagna, R., Gledhill, W.E., Pagga, U., Steber, J., Reust, H. and Bontinck, W.J. (1989) Screening of chemicals for anaerobic biodegradation. Chemosphere 19, p. 1527-1550.
31. Pagga, U. and Beimborn, D.B. (1993) Anaerobic biodegradation tests for organic Compounds. Chemoshpere 27, p. 1499-1509.
32. Nuck, B.A. and Federle, T.W., (1986) A batch test for assessing the mineralisation of 14C-radiolabelled Compounds under realistic anaerobic Conditions. Environ. Sci. Technol. 30, p. 3597-3603.
33. US-EPA (1998b). Anaerobic biodegradability of organic chemicals. Harmonised Test Guidelines (OPPTS 835.3400). EPA 712-C-98-090.
34. Sijm, Haller and Schrap (1997) Influence of storage on sediment characteristics and drying sediment on sorption Coefficients of organic Contaminants. Bulletin Environ. Contam. ToxiCol. 58, p. 961-968.
35. Timme, G., Frehse H. and Laska V. (1986) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues II. Pflanzenschutz - Nachrichten Bayer, 39, p. 187-203.
36. Timme, G., Frehse, H. (1980) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues I. Pflanzenschutz - Nachrichten Bayer, 33, p. 47-60.
37. Carlton, R.R., and Allen, R., (1994) The use of a Compartment model for evaluating the fate of pesticides in sediment/water systems. Brighton Crop Protection Conference - Pest and Diseases, p. 1349-1354.
SMERNICE ZA AEROBNE I ANAEROBNE SISTEME ZA ISPITIVANJE
Aerobni sistem za ispitivanje opisan u ovoj metodi ispitivanja sastoji se od aerobnog vodenog sloja (tipična koncentracija kiseonika varira od 7 mg/l do 10 mg/l) i sedimentnog sloja, koji je aeroban na površini a anaerobni ispod površine (tipični prosečni redoks potencijal (Ex) u anaerobnoj zoni sedimenta varira od -80 do -190 mV). Vlažni vazduh se pušta po površini vode u svakoj inkubacionoj jedinici da bi se održao odgovarajući nivo kiseonika u svakoj gornjem delu suda.
Anaerobni sistem za ispitivanje
Za anaerobne ispitivane sisteme, postupak ispitivanja je u suštini isti kao i kod opisanog aerobnog sistema, sa izuzetkom da se vlažni azot pušta po površini vode u svakoj inkubacionoj jedinici da bi se održao novo azota u gornjem delu suda. Sediment i voda se smatraju anaerobnim ako je redoks potencijal (Ex) niži od -100 mV.
U anaerobnoj studiji, procena mineralizacije uključuje merenje ugljen dioksida i metana.
PRIMER GAS - PROTOČNE APARATURE
PRIMER GAS - PROTOČNE
APARATURE
vazduh | RAZGRADNJA U VODENOM SEDIMENTU |
|
|
|
| vakum |
| površinska voda |
| cevovod izlaznog ventila akvarijuma |
|
| sediment |
|
|
|
dejonizovana voda | sigurnosni trap | sigurnosni trap | trap 1 | trap 2 | trap 3 | trap 4 | dejonizovana voda |
ULAZNI | INKUBACIONA JEDINICA | VOLATILNI TRAPOVI | IZLAZNI |
http://s1.paragraflex.rs/documents/Old/t/t2011_06/ | sistem za apsorpciju CO2 i |
volatilnih organskih jedinjenja | |
| |
uređaj za izdvajanje CO2 | |
| |
otvor za određivanje O2 u vodi | |
| |
otvor za određivanje gasa | |
(zatvoren ventil) | |
mešalica | |
| |
voda | |
sediment | |
magnetna mešalica |
|
PRIMER RAČUNANJA ZA PRIMENU DOZE NA POSUDE ZA ISPITIVANJE
Unutrašnji promer cilindra: 8 cm
Dubina kolone sa vodom ne uključujući sediment: 12 cm
Površina: 3,142 × 42 = 50,3 cm2
Doza koja se preporučuje za primenu:
500 g ispitivane substance/ha odgovara 5 μg/cm2
Ukupno μg: 5 × 50,3 = 251,5 μg
Podesiti količinu u odnosu na dubinu od 100 cm:
12 × 251,5 ÷ 100 = 30,18 μg
Zapremina kolone sa vodom: 50,3 × 12 = 603 ml
Koncentracija u vodi: 30,18 ÷ 603= 0,050 μg/ml ili 5