Metode ispitivanja svojstava hemikalija koja utiču na život i zdravlje ljudi
OPŠTI UVOD
A. OPIS SVOJSTAVA ISPITIVANE SUPSTANCE
Pre početka studija toksičnosti potrebno je znati sastav ispitivane supstance uključujući i glavne nečistoće i značajna fizička i hemijska svojstva uključujući stabilnost.
Fizička i hemijska svojstva ispitivane supstance važni su podaci za izbor puta primene, plana svake pojedinačne studije, kao i načina rukovanja i čuvanja ispitivane supstance.
Početku studije prethodi unapređivanje analitičke metode za kvalitativnu i kvantitativnu analizu ispitivane supstance (uključujući glavne nečistoće kada potrebno) u vehikulumu za primenu doze i biološkom materijalu.
U izveštaj o ispitivanju uključuju se svi podaci koje se odnose na identifikaciju, fizička i hemijska svojstva, čistoću i ponašanje ispitivane supstance.
B. BRIGA O ŽIVOTINJAMA
Pri ispitivanju toksičnosti važna je stroga kontrola uslova smeštaja i tehnika o odgovarajućoj brizi o životinjama.
a) Uslovi smeštaja
Uslovi smeštaja u prostorijama i kavezima za eksperimentalne životinje odgovaraju eksperimentalnoj vrsti koja se koristi. Za pacove, miševe i zamorce odgovarajući uslovi su: sobna temperatura od 22 °C ± 3 °C sa relativnom vlažnošću od 30% do 70%; a za kuniće temperatura je 20 °C ± 3° C sa relativnom vlažnošću od 30% do 70%.
Neke eksperimentalne tehnike naročito su osetljive na efekte temperature i u tim slučajevima detalji odgovarajućih uslova uključeni su u opis metode ispitivanja.
U svim istraživanjima toksičnih efekata temperatura i vlažnost se prate, beleže i uključuju u konačni izveštaj o ispitivanju.
Osvetljenje je veštačko sa smenjivanjem 12 sati svetla i 12 sati mraka. Detalji o osvetljenosti tokom eksperimenta beleže se i uključuju u konačni izveštaj o ispitivanju.
Ako nije drugačije propisano u metodi ispitivanja, životinje se mogu smestiti u odgovarajući smeštaj za pojedinačno i odvojeno držanje ili u kavezima u malim grupama istog pola. U slučaju grupnog smeštaja ne stavljan se više od pet životinja u kavez.
U izveštaju o ispitivanju na životinjama važno je naznačiti tip kaveza i broj životinja smeštenih u svakom kavezu za vreme izlaganja hemikaliji i u svakom kasnijem periodu posmatranja.
b) Ishrana
Ishrana zadovoljava sve nutritivne zahteve vrste koja se koristi u ispitivanju. Kada se ispitivane supstance daju životinjama preko hrane, nutritivna vrednost može da bude smanjena usled međusobnog uticaja supstance i sastojaka hrane. Mogućnost ovakvog uticaja razmatra se pri tumačenju rezultata ispitivanja. Može se upotrebiti uobičajena laboratorijska hrana sa slobodnim pristupom vodi za piće. Na izbor hrane može da utiče potreba da se obezbedi odgovarajuća smeša ukoliko se ispitivana supstanca daje preko hrane.
Nečistoće u hrani za koje se zna da utiču na toksičnost ne bi trebalo da su prisutne u koncentracijama koje utiču na rezultate ispitivanja.
V. ALTERNATIVNA ISPITIVANJA
Evropska unija promoviše razvoj i priznavanje alternativnih metoda koje mogu da daju isti nivo informacija kao sadašnja ispitivanja na životinjama, ali koje koriste manje životinja, izazivaju manje patnje ili izbegavaju upotrebu životinja.
Takve metode, kada budu dostupne, uzimaju se u obzir za karakterizaciju opasnosti i klasifikaciju koja sledi, kao i za obeležavanje opasnosti i procenu bezbednosti hemikalije kad god je to moguće.
G. PROCENA I TUMAČENJE
Kada se ispitivanja procenjuju i tumače, razmatraju se ograničenja direktne ekstrapolacije rezultata ispitivanja na životinjama i In vitro studija na čoveka, i zato se za potvrdu rezultata ispitivanja mogu, kada su dostupni, koristiti dokazi o štetnim efektima na ljude.
D. LITERATURA
Većina ovih metoda razvijena je u okviru programa Organizacije za ekonomski razvoj i saradnju (u daljem tekstu: OECD) i sprovode se u skladu sa principima Dobre laboratorijske prakse, da bi se obezbedilo šire "uzajamno prihvatanje podataka".
Dodatne informacije mogu se naći u preporukama u OECD vodičima i literaturi.
B.1 bis. AKUTNA ORALNA TOKSIČNOST - METODA FIKSNIH DOZA
Deo prvi
1. METODA ISPITIVANJA
Ova metoda ispitivanja zasniva se na Uputstvu za ispitivanje OECD 420 (2001).
1.1. UVOD
U tradicionim metodama za određivanje akutne toksičnosti određene ispitivane supstance smrt životinja koristi se kao ciljni pokazatelj ispitivanja toksičnosti (endpoint). Britansko toksikološko udruženje predložilo je 1984. godine, na osnovu primene niza fiksnih doza1, novi pristup ispitivanja akutne toksičnosti. Ovaj pristup zasniva se na posmatranju jasnih znakova toksičnosti jednog od niza fiksnih doznih nivoa, kako bi se izbeglo uginuće životinja kao ciljni pokazatelj. Nakon in vivo validiranih ispitivanja (Velika Britanija2 i međunarodna3), postupak fiksnih doza je 1992. godine prihvaćen kao metoda ispitivanja. Kasnije su statistički podaci postupka fiksnih doza validirani pomoću matematičkih modela u nizu ispitivanja4,5,6. Zajedno su in vivo ispitivanja i studije na modelima pokazale da je postupak reproduktivan, koristi se manji broj životinja i u poređenju sa tradicionalnim metodama izaziva manju patnju životinja, a rangira toksičnost supstance podjednako dobro kao i druge razvijene metode ispitivanja akutne toksičnosti.
Uputstva za izbor najbolje metode ispitivanja za određenu namenu mogu se pronaći u literaturi7 koja sadrži dodatne informacije o izvođenju i tumačenju rezultata dobijenih metodom ispitivanja B.1 bis.
Princip ove metode ispitivanja jeste da se u glavnom ispitivanju koriste samo umereno toksične doze, a izbegavaju potencijalno smrtonosne doze. Izbegava se i primena onih doza za koje je poznato da usled pojave korozivnog oštećenja ili jake iritacije izazivaju značajan bol ili stres kod životinja. Životinje koje su na samrti ili su jasno izložene intenzivnom bolu ili stresu, lišavaju se života na human način, a u konačnoj obradi rezultata tretiraju se na isti način kao i životinje koje uginu za vreme ispitivanja. U posebnom vodiču8 dati su kriterijumi prema kojima se životinje koje su na samrti ili jako pate lišavaju života na human način, a definisani su i simptomi na osnovu kojih je lako prepoznati neminovnu smrt.
Ova metoda ispitivanja obezbeđuje podatke o opasnim svojstvima supstance i omogućava procenu i klasifikaciju prema Globalno harmonizovanom sistemu za klasifikaciju i obeležavanje UN (u daljem tekstu: GHS) u odnosu na akutnu toksičnost9.
Pre početka studije uzimaju se u obzir svi dostupni podaci o ispitivanoj supstanci. Podaci uključuju identitet i hemijsku strukturu supstance; njena fizička i hemijska svojstva; rezultate obavljenih in vitro ili in vivo ispitivanja toksičnosti; toksikološke podatke o strukturno sličnim supstancama; kao i predviđene načine korišćenja supstance. Ovi podaci ukazuju na važnost izvođenja studije za zaštitu zdravlja ljudi, a pomažu i pri izboru odgovarajuće početne doze.
1.2. DEFINICIJE
Akutna oralna toksičnost jeste svojstvo hemikalije da izazove štetne efekte nakon primene pojedinačne peroralne doze ili nekoliko peroralnih doza u periodu od 24 sata.
Odložena smrt jeste uginuće životinja koje ne uginu ili nisu životno ugrožene tokom prvih 48 sati, već do uginuća dolazi u periodu posmatranja od 14 dana.
Doza jeste količina primenjene ispitivane supstance. Izražava se kao masa ispitivane supstance po jedinici telesne mase (TM) eksperimentalne životinje (mg/kg).
Evidentna toksičnost jeste toksični efekat kod koga se javljaju jasni znakovi toksičnosti nakon primene ispitivane supstance (za primere videti u literaturi3), koji su toliko intenzivni da bi izlaganje sledećoj većoj fiksnoj dozi kod životinja verovatno dovelo do jakog bola, stresa, iscrpljenosti, stanja na samrti (kriterijumi su prikazani u Vodiču8 ili do smrtnog ishoda).
GHS jeste skraćenica za Globalno harmonizovan sistem za klasifikaciju i obeležavanje hemikalija UN. Razvoj ovog sistema je zajednički napor OECD, UN Komiteta stručnjaka za transport opasnog tereta (fizička i hemijska svojstva) i Međunarodne organizacije rada (ILO), a koordinira ga Međuorganizacijski program za pravilno upravljanje hemikalijama (IOMC).
Neminovna smrt jeste očekivana smrt životinje koja je na samrti ili se njena smrt očekuje pre planiranog narednog vremena posmatranja. Simptomi koji ukazuju na ovo stanje kod glodara su konvulzije, lateralni položaj, ležeći položaj ili tremor (za detalje videti u literaturi8).
LD50 (srednja smrtna doza) jeste statistički određena pojedinačna doza supstance za koju se očekuje da izaziva smrtnost kod 50 posto ispitivanih životinja kada se primeni peroralnim putem. Vrednost LD50 izražava se u jedinici mase ispitivane supstance po jedinici telesne mase eksperimentalne životinje (mg/kg).
Granična doza jeste gornja granična doza koja se koristi u ispitivanju (2.000 mg/kg ili 5.000 mg/kg).
Stanje na samrti jeste stanje definisano kao nemogućnost preživljavanja ili neminovna smrt životinje, čak i nakon eventualnog tretmana (za detalje videti u literaturi8).
Predvidljiva smrt jeste stanje koje karakteriše prisutnost kliničkih znakova koji ukazuju na neminovnu smrt životinje pre završetka eksperimenta, na primer nemogućnost uzimanja vode ili hrane (za detalje videti u literaturi8).
1.3. PRINCIP METODE
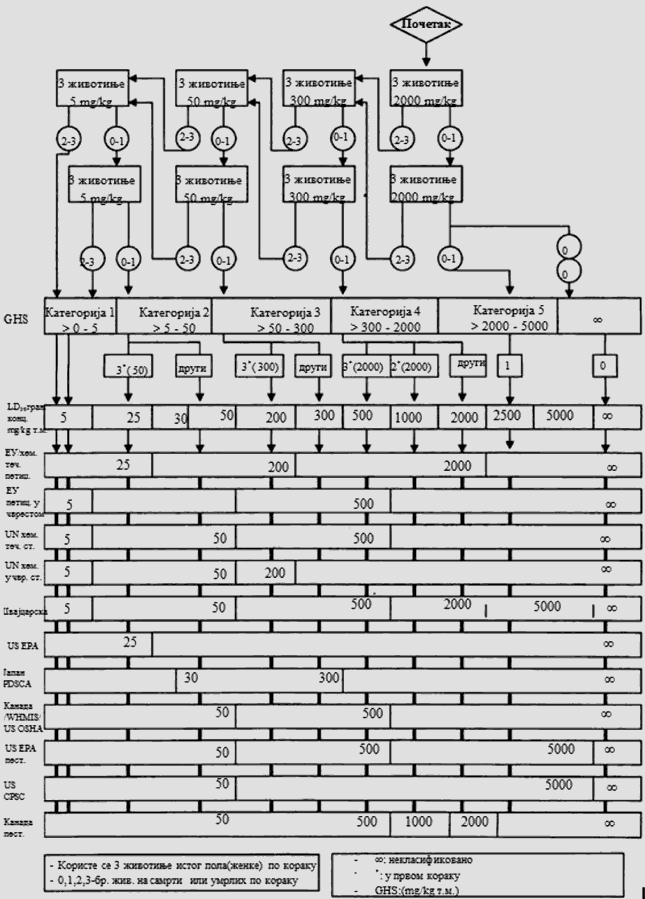
Na grupe životinja istog pola postupno se (korak po korak) primenjuju fiksne doze od 5 mg/kg, 50 mg/kg, 300 mg/kg i 2.000 mg/kg (izuzetno, može se razmotriti i primena još jedne fiksne doze od 5.000 mg/kg, videti odeljak 1.6.2 ove metode). Količina inicijalne doze bira se na osnovu prethodnih ispitivanja. Primenjuje se ona doza za koju se očekuje da će rezultirati nekim znakovima toksičnosti, pri čemu ova doza neće izazvati teško trovanje ili smrt. Klinički znakovi ili stanja koja upućuju na jak bol, patnju ili neminovnu smrt životinje detaljno su opisani u posebnom OECD Vodiču8. Nakon primene inicijalne doze grupe životinja koje se dalje uključuju u ispitivanje mogu se dozirati većim ili manjim fiksnim dozama, u zavisnosti od toga da li su prisutni znakovi koji ukazuju na toksičnost ili uginuće. Ovaj postupak se nastavlja do primene doze koja izaziva evidentnu toksičnost ili smrt najviše jedne životinje. Postupak se prekida kada najveća primenjena doza ne izazove toksične efekte ili kada najniža primenjena doza dovede do smrti životinja.
1.4. OPIS METODE
1.4.1. Izbor životinjske vrste
Preporučena vrsta glodara je pacov, iako se za ispitivanja koriste i druge životinjske vrste. Najčešće se koriste ženke7, jer je na osnovu literature koja se odnosi na ispitivanje LD50 uočeno da je mala razlika u osetljivosti polova pri primeni ove metode. U slučajevima u kojima je uočena razlika, ženke su pokazale nešto veću osetljivost10. Ako se u literaturi pronađu toksikološki ili toksikokinetički podaci za strukturno slične hemikalije koji ukazuju na to da su mužjaci osetljiviji na određenu ispitivanu supstancu, koriste se mužjaci za ispitivanje. Kad se ispitivanje izvodi na mužjacima, navodi se opravdanost za njihovu primenu.
Ispitivanje se izvodi na zdravim mladim jedinkama onih laboratorijskih sojeva koji se uobičajeno koriste u ovakvim ispitivanjima. Ispitivanje se vrši na ženkama koje nisu ranije rađale i nisu gravidne. Svaka životinja, na početku ispitivanja i primene prvih doza ispitivane supstance, treba da bude stara između 8 i 12 nedelja, a njena telesna masa treba da bude u opsegu ± 20% od srednje vrednosti mase prethodno doziranih životinja.
1.4.2. Uslovi smeštaja i ishrana
Temperatura prostorije u kojoj se drže životinje je 22° C (± 3° C). Relativna vlažnost vazduha je najmanje 30%, ali ne više od 70% (osim kada se prostorije čiste). Idealno je vlažnost vazduha održavati između 50% i 60%. Osvetljenje je veštačko, i to u intervalima od 12 sati svetla i 12 sati mraka. Za ishranu se može primenjivati uobičajena hrana za laboratorijske životinje, sa slobodnim pristupom vodi za piće. Životinje se prema primenjenoj dozi ispitivane supstance mogu grupisati u kaveze. Broj životinja po kavezu ne sme ni na koji način da ometa proces praćenja i posmatranja svake životinje.
1.4.3. Priprema životinja
Životinje se biraju nasumce, obeležavaju radi lakšeg razlikovanja, a da bi se prilagodile na laboratorijske uslove drže se u kavezima najmanje pet dana pre početka eksperimenta i primene prve doze ispitivane supstance.
1.4.4. Priprema doza
Ispitivane supstance primenjuju se u konstantnim zapreminama, pa je neophodno prilagođavanje koncentracije za pripremanje različitih doza. Pri ispitivanju hemikalije u tečnom stanju, primena nerazblažene ispitivane supstance, odnosno supstance koja je u smeši u konstantnoj koncentraciji, može da bude značajna za kasniju procenu rizika od te supstance. Maksimalna pojedinačna zapremina doze ne sme da se prekorači. Maksimalna zapremina tečnosti koja sme da se primeni zavisi i od veličine eksperimentne životinje. Zapremina ispitivane supstance koja se primenjuje kod glodara ne bi smela da prelazi 1 ml/100g TM životinje; a ukoliko se primenjuje vodeni rastvor može se razmotriti i doza od 2 ml/100g TM životinje. Kad je reč o formulaciji i pripremi doze, prvenstveno se preporučuje primena vodenog rastvora/suspenzije/emulzije, a zatim rastvora/suspenzije/emulzije u ulju (npr. kukuruznom ulju) ili rastvor u nekom drugom vehikulumu. Za sve vehikulume osim vode neophodno je znati njihove toksikološke karakteristike. Doze se pripremaju neposredno pre primene, osim ako se radi o supstanci za koju je poznato da je stabilna u rastvoru tokom dužeg vremenskog perioda.
1.5. POSTUPAK
1.5.1. Primena doza
Ispitivana supstanca primenjuje se u jednoj dozi sondom direktno u želudac ili intubiranjem kanilom. U posebnim okolnostima, kada jednokratna doza nije moguća, ispitivana supstanca može se primeniti u nekoliko manjih porcija tokom vremenskog perioda koji nije duži od 24 sata.
Pre početka primene doza ispitivane supstance, potrebno je izgladneti životinje (npr. pacovima je potrebno uskratiti hranu ali ne i vodu preko noći; miševima je potrebno uskratiti hranu ali ne i vodu na 3 do 4 sata). Nakon perioda gladovanja, potrebno je izmeriti telesnu masu životinja i primeniti ispitivanu supstancu. Nakon prve doze, hrana može ponovno da se uskrati, i to: kod pacova narednih 3 do 4 sata, a kod miševa naredna 1 do 2 sata. Kada se doza ispitivane supstance primeni u nekoliko manjih porcija u određenom vremenskom intervalu, može da se ukaže potreba za hranom i vodom ukoliko se radi o produženom vremenskom periodu.
1.5.2. Prethodno ispitivanje
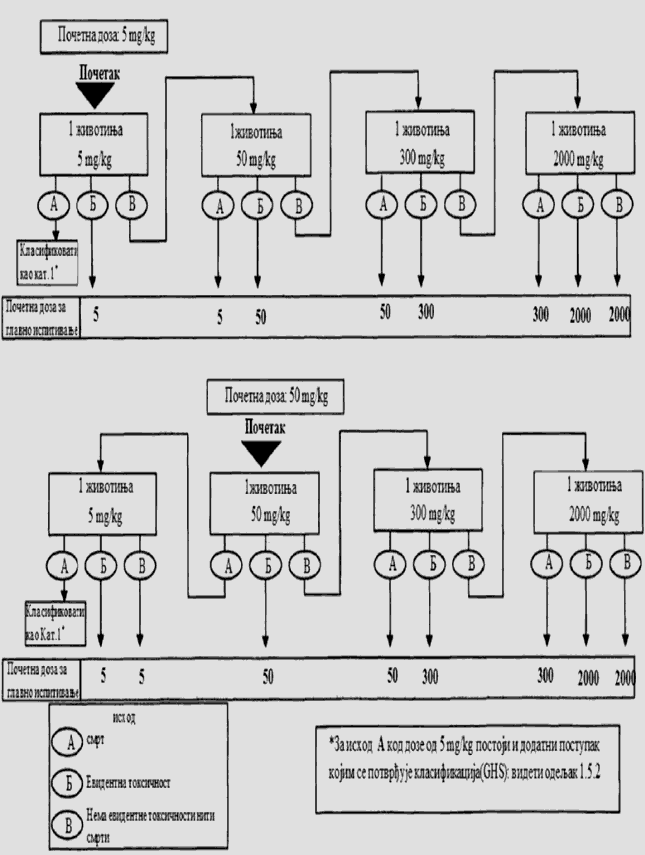
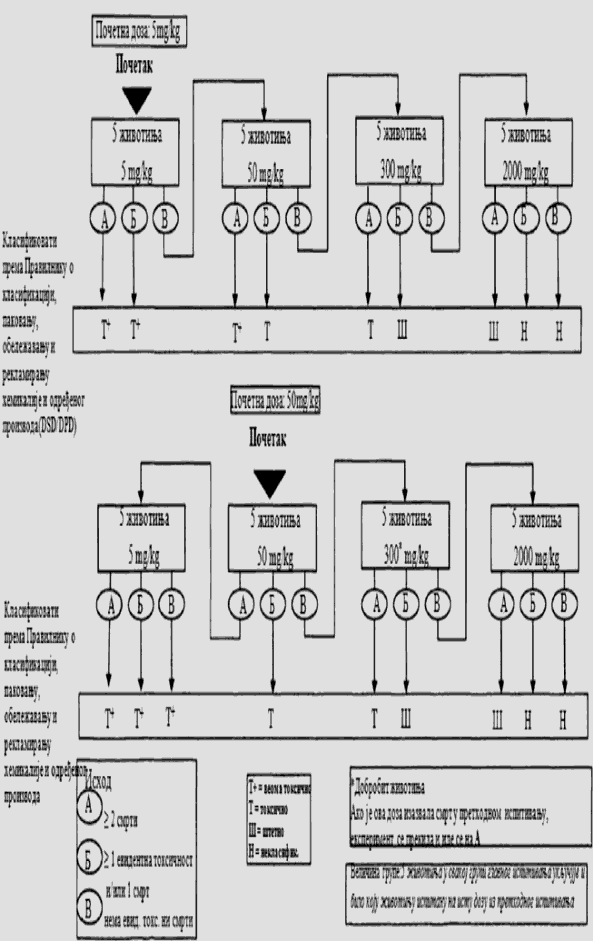
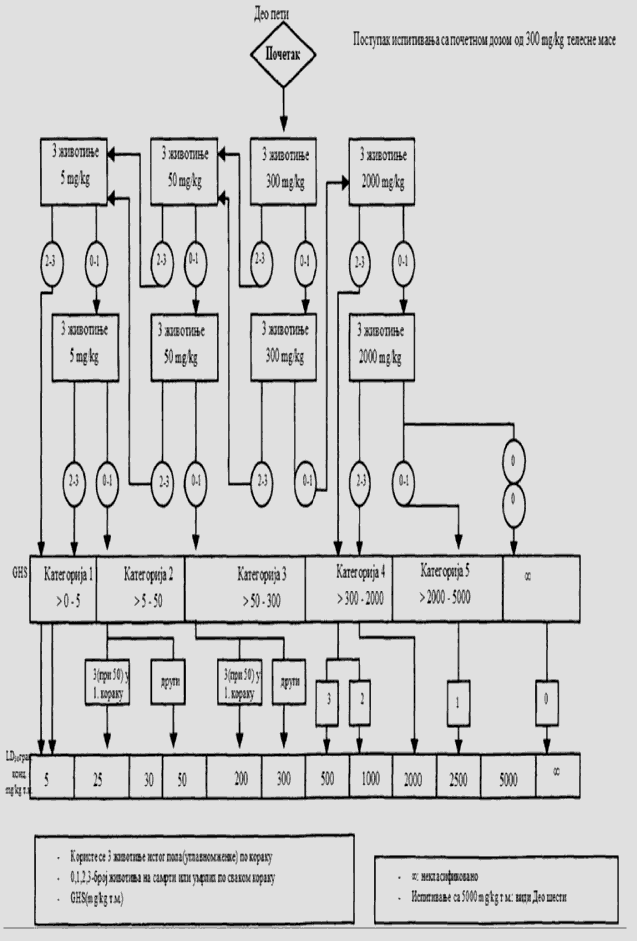
Cilj prethodnog ispitivanja životinja je određivanje odgovarajuće početne doze za glavno ispitivanje. Ispitivana supstanca primenjuje se na pojedinačnim životinjama postupno kao što je opisano u dijagramu toka ispitivanja koji je dat u Delu drugom ove metode. Prethodno ispitivanje je završeno kada je moguće doneti odluku o početnoj dozi (ili u slučajevima kada dođe do uginuća već kod najniže fiksne doze).
Početna doza za prethodno ispitivanje može da bude fiksni dozni nivo od 5 mg/kg, 50 mg/kg, 300 mg/kg i 2.000 mg/kg, a definisana je kao ona doza koje će izazvati jasne znakove toksičnosti, odabrana na osnovu podataka in vivo i in vitro ispitivanja za ispitivanu supstancu ili druge strukturno slične hemikalije. Ukoliko nema ovakvih podataka, za početnu dozu uzima se koncentracija od 300 mg/kg.
Potrebno je napraviti pauzu od najmanje 24 sata između primene doza ispitivane supstance kod svake pojedinačne životinje. Životinje je potrebno posmatrati kroz vremenski period od najmanje 14 dana.
Izuzetno, i samo u slučajevima kad to opravdavaju specifične potrebe, može da se razmotri primena još jedne veće fiksne doze od 5.000 mg/kg (videti Deo četvrti ove metode). Zbog dobrobiti životinja, ne preporučuje se ispitivanje na životinjama za klasifikaciju ispitivane supstance u Kategoriju 5 prema GHS-u (u opsegu doza od 2.000 mg/kg do 5.000 mg/kg), i razmatra se samo u slučajevima kada postoji velika verovatnoća da će rezultati ovakvog ispitivanja imati neposredan značaj za zaštitu zdravlja ljudi ili životne sredine.
U slučajevima kada u prethodnom ispitivanju već kod najniže primenjene fiksne doze (5 mg/kg) dođe do smrti eksperimentne životinje, uobičajen postupak je da se ispitivanje završi, a ispitivana supstanca klasifikuje u Kategoriju 1, prema GHS-u (kao što se može videti u Delu drugom ove metode). Ukoliko je potrebna dodatna potvrda za ovakvu klasifikaciju, može se sprovesti dodatno ispitivanje i to tako što se druga životinja dozira sa 5 mg/kg. Ako dođe do smrti i druge životinje, smatra se potvrđenom klasifikacija u Kategoriju 1 prema GHS-u, i obustavljaju se sva dalja ispitivanja. Ako druga životinja preživi, tada se na najviše tri dodatne životinje primenjuje doza od 5 mg/kg. Zbog visokog rizika od smrtnosti, naknadno uvedene životinje potrebno je uključivati u eksperiment jednu po jednu radi dobrobiti životinja. Vremenski razmak između doziranja kod pojedinačnih životinja je dovoljno dugačak da može lako da se predvidi preživljavanje prethodne životinje. Ako ipak dođe do drugog slučaja smrti, odmah se završava primena niza doza ispitivane supstance tako da se ispitivanje ne vrši dalje ni na jednoj životinji. Budući da pojava drugog slučaja uginuća (nevezano od broja životinja koje se ispituju u momentu kada se odluči da se eksperiment završi) spada pod ishod A koji je dat u Delu drugom ove metode (dve ili više smrti), primenjuje se klasifikaciono pravilo iz Dela trećeg ove metode pri fiksnoj dozi od 5 mg/kg (klasifikacija u Kategoriju 1 ako dođe do dve ili više slučaja smrti, ili u Kategoriju 2 ukoliko dođe do smrti kod jedne životinje). U Delu petom ove metode date su smernice za klasifikaciju prema Pravilniku o klasifikaciji, pakovanju, obeležavanju i oglašavanju hemikalije i određenog proizvoda ("Službeni glasnik RS", br. 59/10, 25/11 i 5/12), dok ne počne sa primenom Pravilnika o klasifikaciji, pakovanju, obeležavanju i oglašavanju hemikalije i određenog proizvoda u skladu sa Globalno harmonizovanim sistemom za klasifikaciju i obeležavanje UN ("Službeni glasnik RS", br. 64/10 i 26/11).
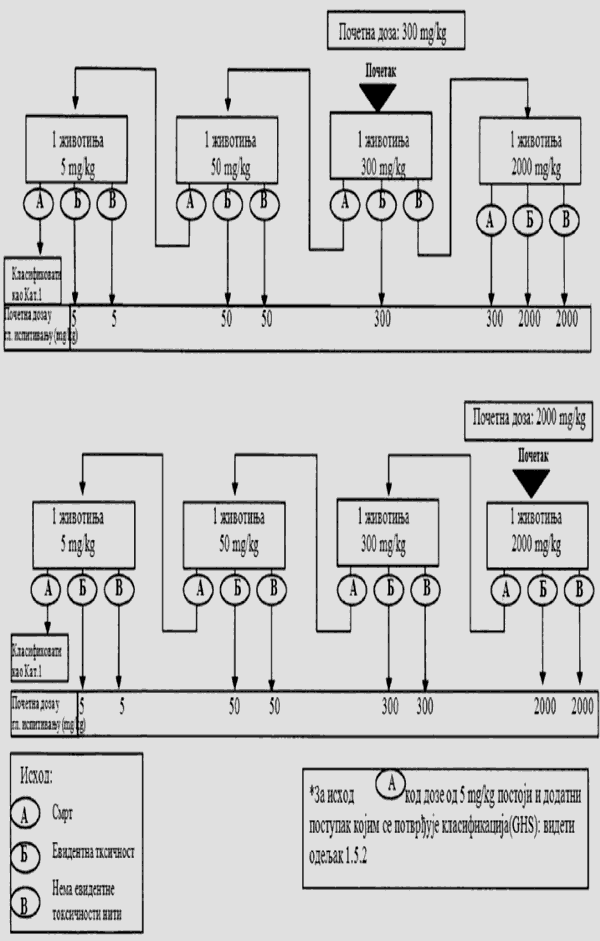
1.5.3. Glavno ispitivanje
1.5.3.1. Broj životinja i dozni nivoi
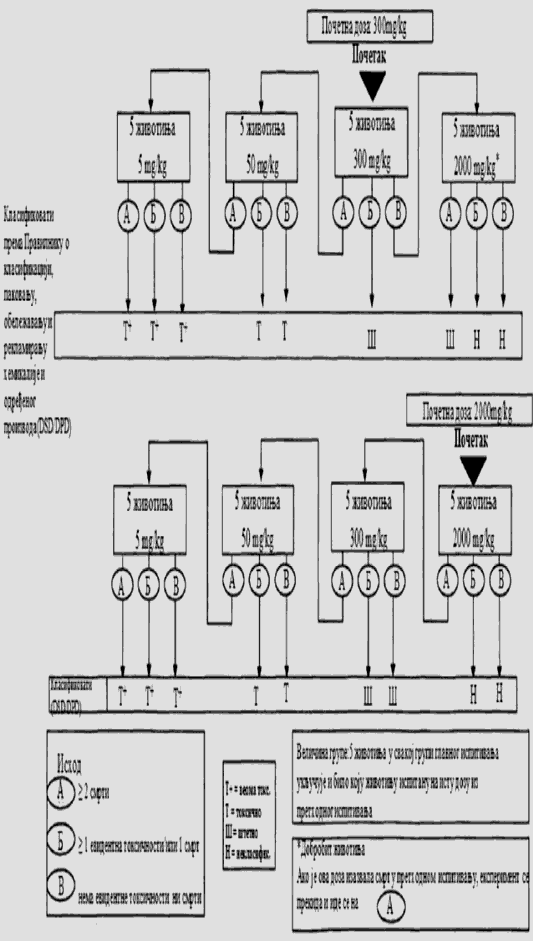
Na dijagramu toka u Delu trećem ove metode prikazani su postupci koji se preduzimaju u ispitivanju nakon primene početnog doznog nivoa. Preduzima se jedan od tri koraka: prekid ispitivanja i klasifikacija u odgovarajuću klasu opasnosti ili ispitivanje većom fiksnom dozom ili ispitivanje manjom fiksnom dozom. Da bi se zaštitile životinje, dozni nivo koji je u prethodnom ispitivanju doveo do smrti životinje ne primenjuje se u glavnom ispitivanju (videti Deo treći ove metode). Iskustvo je pokazalo da je pri početnom doznom nivou najverovatniji ishod glavnog ispitivanja klasifikacija ispitivane supstance, tako da dalja ispitivanja nisu neophodna.
Za ispitivanje pri svakom doznom nivou koristi se ukupno pet životinja istog pola. Grupu od pet životinja čine jedna životinja iz prethodnog ispitivanja (kojoj je primenjena odabrana fiksna doza) i dodatne četiri životinje (osim u posebnim slučajevima kada se dozni nivo iz glavnog ispitivanja nije koristio u prethodnom ispitivanju).
Vremenski razmak između primene ispitivane supstance pri svakom doznom nivou određen je početkom, trajanjem i ozbiljnošću znakova toksičnosti. Tretman životinja sledećom dozom se odlaže sve dok se ne uverimo u preživljavanje prethodno tretiranih životinja. Pravi se vremenski razmak od 3 do 4 dana između primene ispitivane supstance pri svakom doznom nivou, kako bi se omogućio dovoljno dug period za posmatranje eventualnih odloženih toksičnih reakcija. Ovaj vremenski interval može po potrebi da se menja, npr. u slučajevima u kojima su posmatranja nejasna. Kada se razmatra korišćenje fiksne doze od 5.000 mg/kg, potrebno je pratiti postupak koji je opisan u Delu četvrtom ove metode (videti odeljak 1.6.2. ove metode).
1.5.3.2. Ispitivanje granične doze
Ispitivanje granične doze primarno se koristi u situacijama u kojima istraživač ima podatke koji ukazuju da je ispitivana hemikalija verovatno netoksična, tj. da postaje toksična samo iznad propisanih graničnih doza. Podaci o toksičnosti ispitivane hemikalije mogu se preuzeti iz završenih ispitivanja sa sličnim supstancama ili smešama, ako se uzme u obzir identitet i koncentracija komponenata izražena u procentima, za koje se pouzdano zna da su toksikološki značajne. U slučajevima gde nema podataka o toksičnosti ili ih nema dovoljno, ili kada se očekuje da će ispitivana hemikalija biti toksična, potrebno je isplanirati i obaviti glavno ispitivanje.
Za ispitivanje granične doze koristi se već ustanovljen postupak, sa početnom dozom definisanom u prethodnom ispitivanju od 2.000 mg/kg (ili izuzetno 5.000 mg/kg) i sa naknadnim uvođenjem dodatne četiri eksperimentne životinje na koje će se primeniti ista doza.
1.6. POSMATRANJA
Životinje se posmatraju pojedinačno nakon primene prve doze ispitivane supstance i to najmanje jednom tokom prvih 30 minuta i periodično tokom sledeća 24 sata, uz posebnu pažnju na prva 4 sata. Posmatranja se zatim obavljaju jedanput dnevno, u periodu od ukupno 14 dana, osim u slučajevima kada je životinju potrebno isključiti iz ispitivanja (ako je pronađena mrtva) ili je lišiti života na human način imajući u vidu dobrobit životinje. Trajanje posmatranja ne sme da bude strogo definisano, već ga određuju toksični efekti, početak i trajanje oporavka, a ukoliko postoji potreba može i da se produži. Važni su periodi u kojima se pojavljuju i nestaju prvi znaci toksičnosti, posebno ako se znaci toksičnosti javljaju odloženo11. Sva posmatranja sistematski se beleže, a za svaku životinju potrebno je voditi zasebni karton sa opažanjima.
Ako životinje neprekidno pokazuju znakove toksičnosti, potrebna su dodatna posmatranja. Potrebno je uključiti i promene na koži i krznu, očima i mukoznim membranama, kao i na respiratornom, cirkulatornom, autonomnom i centralnom nervnom sistemu, promene somatomotorne aktivnosti i promene ponašanja. Posebna pažnja se obraća na pojavu tremora, konvulzija, salivacije, proliva, letargije, pospanosti i kome. Za definisanje ovih stanja koriste se principi i kriterijumi koji su dati u literaturi8. Životinje pronađene na samrti ili one koje trpe jak bol ili stres, lišavaju se života na human način. Kada su životinje lišene života iz humanih razloga ili su pronađene mrtve, potrebno je što preciznije zabeležiti vreme smrti.
1.6.1. Telesna masa
Individualna telesna masa životinja određuje se neposredno pre primene ispitivane supstance i najmanje jednom nedeljno nakon tog perioda. Beleže se i izračunavaju promene u telesnoj masi. Na kraju ispitivanja, meri se telesna masa preživelih životinja, a potom se lišavaju života na human način.
1.6.2. Patološka ispitivanja
Sve ispitivane životinje (uključujući i one koje uginu u toku ispitivanja ili su isključene iz ispitivanja zbog dobrobiti životinje) potrebno je postmortalno pregledati. Za svaku životinju beleže se sve značajne patološke promene. Mikroskopskim pregledom organa mogu se dobiti korisni podaci, pa je potrebno obaviti pregled organa koji su postmortalnim pregledom pokazali značajne patološke promene i to kod životinja koje su preživele 24 ili više sati nakon prve doze.
2. PODACI
Potrebno je prikupiti podatke za svaku životinju. Svi podaci se tabelarno prikazuju, a za svaku ispitivanu grupu navodi se ukupan broj životinja u grupi, broj životinja koje su pokazale znakove toksičnosti, broj životinja koje su pronađene mrtve ili broj onih koje se lišavaju života na human način tokom ispitivanja, vreme smrti pojedinačnih životinja, opis i vremenski tok toksičnih efekata i njihovu reverzibilnost, kao i nalaze postmortalnog pregleda.
3. IZVEŠTAJ O ISPITIVANJU
PISANJE IZVEŠTAJA
Izveštaj o ispitivanju sadrži:
1. Podatke o ispitivanoj supstanci:
- fizička svojstva, čistoću, i, kada je značajno, fizička i hemijska svojstva (uključujući izomerizaciju);
- identifikacione podatke koji uključuju i CAS broj.
2. Podatke o vehikulumu (ako je značajno):
- obrazloženje za izbor vehikuluma, ukoliko nije voda.
3. Podatke o eksperimentnoj životinji:
- vrsta/soj;
- mikrobiološki status životinje, ako je poznat;
- broj, starost i pol životinja (uključujući, kada je značajno, obrazloženje ukoliko se koriste mužjaci umesto ženki);
- izvor, uslove smeštaja, ishrane, itd.
4. Podatke o uslovima ispitivanja:
- detalje o formulaciji ispitivane supstance, uključujući fizičko stanje u kome je primenjena formulacija;
- detalje o primeni ispitivane supstance uključujući zapremine doza i vreme primene doze ispitivane supstance;
- detalje o kvalitetu hrane i vode uključujući detalje o vrsti i izvoru hrane i izvoru vode;
- obrazloženje za izbor početne doze.
5. Rezultate:
- tabelarni prikaz rezultata i primenjene doze za svaku životinju (životinje koje pokazuju znakove toksičnosti uključujući smrtnost, prirodu, intenzitet i trajanje toksičnih efekata);
- tabelarni prikaz telesne mase i promena telesne mase;
- individualnu telesnu masu životinja na dan primene doze ispitivane supstance, zatim u nedeljnim intervalima, i u vreme uginuća ili lišavanja života na human način;
- datum i vreme smrti, ako do nje dođe pre predviđenog lišavanja života na human način;
- vremenski tok pojave znakova toksičnosti, i da li su znakovi bili reverzibilni za svaku životinju;
- nalaze postmortalnih pregleda i histopatološki nalazi za svaku životinju, ukoliko su dostupni.
6. Diskusiju i tumačenje rezultata.
7. Zaključke.
4. LITERATURA
1. British Toxicology Society Working Party on Toxicity (1984). Special report: a new approach to the classification of substances and preparations on the basis of their acute toxicity. Human Toxicol., 3, 85-92.
2. Van den Heuvel, M.J., Dayan, A.D. and Shillaker, R.O. (1987). Evaluation of the BTS approach to the testing of substances and preparations for their acute toxicity. Human Toxicol.‚ 6, 279-291.
3. Van den Heuvel, M.J., Clark, D.G., Fielder, R.J., Koundakjian, P.P., Oliver, G.J.A., Pelling, D., Tomlinson, N.J. and Walker, A.P. (1990). The international validation of a fixed-dose procedure as an alternative to the classical LD50 test. Fd. Chem. Toxicol. 28, 469-482.
4. Whitehead, A. and Curnow, R.N. (1992). Statistical evaluation of the fixed-dose procedure. Fd. Chem. Toxicol., 30, 313-324.
5. Stallard, N. and Whitehead, A. (1995). Reducing numbers in the fixed-dose procedure. Human Exptl. Toxicol. 14, 315-323. Human Exptl. Toxicol.
6. Stallard, N., Whitehead, A. and Ridgeway, P. (2002). Statistical evaluation of the revised fixed dose procedure. Hum. Exp. Toxicol., 21, 183 -196.
7. OECD (2001). Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris
8. OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assesment N. 19.
9. OECD (1998). Harmonised Integrated Hazard Classification for Human Health and Environmental Effects of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p.11 [http://webnet1.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no-0,FF.html].
10. Lipnick, R.L., Cotruvo, J.A., Hill, R.N., Bruce, R.D., Stitzel, K.A., Walker, A.P., Chu, I., Goddard, M., Segal, L., Springer, J.A. and Myers, R.C. (1995). Comparison of the Up-and-Down, Conventional LD50, and Fixed-Dose Acute Toxicity Procedures. Fd. Chem. Toxicol. 33, 223-231.
11. Chan P.K and A.W. Hayes (1994) Chapter 16 Acute Toxicity and Eye Irritation. In: Principles and Methods of Toxicology. 3 rd Edition. A.W. Hayes, Editor. Raven Press, Ltd. New York, USA.
Deo drugi
DIJAGRAM TOKA ZA PRETHODNO ISPITIVANJE

Deo treći
DIJAGRAM TOKA ZA GLAVNO ISPITIVANJE
Deo četvrti
KRITERIJUMI ZA KLASIFIKACIJU ISPITIVANIH SUPSTANCI SA OČEKIVANIM VREDNOSTIMA LD50 IZNAD 2.000 mg/kg ZA KOJE NIJE POTREBNO DODATNO ISPITIVANJE
Kriterijum za klasifikaciju u klasu opasnosti akutna toksičnost Kategorija 5 (po GHS-u) omogućava identifikovanje ispitivanih supstanci koje pokazuju nisku akutnu toksičnost, ali koje pod određenim okolnostima mogu da predstavljaju opasnost za osetljive populacije. Ove supstance imaju vrednosti LD50 (peroralno) i LD50 (dermalno) u opsegu doza od 2.000 mg/kg do 5.000 mg/kg ili potpuno odgovarajućih doza primenjenih drugim putevima unosa. Ispitivane supstance klasifikuju se u odgovarajuću kategoriju opasnosti (Kategorija 5 po GHS-u) ako je: 2.000 mg/kg < LD50 < 5.000 mg/kg, u sledećim slučajevima:
a) ako bilo koja od shema ispitivanja datih u Delu trećem ove metode upućuje na ovu kategoriju zbog učestalosti smrtnih slučajeva,
b) ako postoje pouzdani dokazi da je vrednost LD50 u opsegu vrednosti koji odgovara Kategoriji 5; ili ako druge studije toksičnosti sprovedene na životinjama ili ljudima ukazuju na potencijalne akutne toksične efekte na zdravlje ljudi,
v) ako se ekstrapolacijom, procenom ili merenjem podataka ne ustanovi pripadnost nekoj višoj klasi opasnosti, a:
- postoje pouzdani podaci koji ukazuju na značajne toksične efekte kod ljudi ili
- uoči se smrt pri ispitivanjima koja se vrše radi klasifikacije zaključno u Kategoriju 4, peroralnom primenom odgovarajuće doze ili
- stručnom procenom se potvrde značajni klinički znakovi toksičnosti, pri ispitivanjima koja se vrše radi klasifikacije zaključno u Kategoriju 4, pri čemu klinički znakovi ne uključuju proliv, piloerekciju ili zapušteni izgled ili
- se stručnom procenom potvrdi postojanje značajnih akutnih toksičnih efekata iz drugih ispitivanja sprovedenih na životinjama.
ISPITIVANJE DOZA IZNAD 2.000 mg/kg
Izuzetno, u slučajevima kad to opravdavaju specifične potrebe, dodatno može da se razmotri primena fiksne doze od 5.000 mg/kg. Zbog zaštite životinja i njihove dobrobiti ne preporučuje se ispitivanje doze od 5.000 mg/kg. Primena ove doze razmatra se samo u slučajevima kad postoji velika verovatnoća da će rezultati ispitivanja imati značajan doprinos zaštiti zdravlja ljudi ili životinja9.
Prethodno ispitivanje
Pravila za primenu postupka koji se sastoji iz niza koraka koji je dat u Delu drugom ove metode, proširuju se na primenu doze od 5.000 mg/kg. Kada se u prethodnom ispitivanju koristi početna doza od 5.000 mg/kg, ishod A (smrt) zahteva ispitivanje i druge životinje na primenu doze od 2.000 mg/kg; ishodi B i V (evidentna toksičnost ili nema toksičnosti) dozvoljavaju primenu doze od 5.000 mg/kg kao početne doze u glavnom ispitivanju. Ako se ne koristi početna doza od 5.000 mg/kg, ispitivanje se nastavlja do primene doze od 5.000 mg/kg u slučaju ishoda pod B ili V pri dozi od 2.000 mg/kg; ako kod primenjene doze od 5.000 mg/kg dođe do ishoda A tada se u glavnom ispitivanju koristi početna doza od 2.000 mg/kg, a ishodi pod B i V nalažu početnu dozu od 5.000 mg/kg u glavnom ispitivanju.
Glavno ispitivanje
Pravila za primenu postupka iz niza koraka koji je dat u Delu trećem ove metode, proširuju se na primenu doze od 5.000 mg/kg. Kada se u glavnom ispitivanju koristi početna doza od 5.000 mg/kg, ishod A (dve ili više smrti) uslovljava ispitivanje druge grupe životinja primenom doze od 2.000 mg/kg; dok ishod B (evidentna toksičnost i/ili jedna ili manje smrti) ili ishod V (nema toksičnosti) dovode do klasifikacije supstance prema GHS-u. Ako se ne koristi početna doza od 5.000 mg/kg, u slučaju ishoda V, pri dozi od 2.000 mg/kg, ispitivanje se nastavlja do primene doze od 5.000 mg/kg. Ishod A kod primenjene doze od 5.000 mg/kg dovodi do klasifikacije supstance u Kategoriju 5 (prema GHS). Ishodi B ili V dovode do nemogućnosti klasifikacije supstance.
Deo peti
METODA ISPITIVANJA B.1 BIS-SMERNICE ZA KLASIFIKACIJU (PREUZETO IZ LITERATURE8)
B.1 tris AKUTNA ORALNA TOKSIČNOST - METODA ODREĐIVANJA KLASE AKUTNE TOKSIČNOSTI
Deo prvi
1. METODA ISPITIVANJA
Ova metoda ispitivanja zasniva se na Uputstvu za ispitivanje OECD 423 (2001).
1.1. UVOD
Metoda određivanja klase akutne toksičnosti1 koja je data u ovom ispitivanju jeste postupak (korak po korak) u kome se u svakom koraku koriste po tri životinje istog pola. U zavisnosti od smrtnosti odnosno stanja na samrti kod životinja, potrebno je da se prođe prosečno dva do četiri koraka da bi se doneo zaključak o akutnoj toksičnosti ispitivane supstance. Ovaj postupak je reproduktivan (ponovljiv), koristi veoma mali broj životinja i daje mogućnost klasifikacije supstanci na sličan način kao i ostale metode ispitivanja akutne toksičnosti. Metoda određivanja klase akutne toksičnosti zasnovana je na biometrijskim evaluacijama2,3,4,5 sa fiksnim dozama koje su razdvojene na odgovarajući način kako bi se omogućilo rangiranje supstance za potrebe klasifikacije i procenu opasnosti. Kada je ova metoda ispitivanja usvojena, 1996. godine, bila je u velikoj meri validirana u in vivo ispitivanjima u odnosu na podatke o vrednosti LD50 koji su dobijeni iz domaće6 i međunarodne7 literature.
Uputstvo za izbor najpogodnije metode ispitivanja za određenu svrhu može se pronaći u literaturi8. Ovaj dokument sadrži i dodatne informacije o izvođenju i tumačenju rezultata dobijenih metodom ispitivanja B.1tris.
Ispitivane supstance se ne primenjuju na životinje u dozama za koje je poznato da izazivaju vidljiv bol i iscrpljenost usled korozivnog ili jakog iritativnog efekta. Životinje koje su na samrti, koje očito trpe jake bolove ili pokazuju znakove trajne iscrpljenosti lišavaju se života na human način, i pri tumačenju rezultata ispitivanja uzimaju se u obzir kao i životinje koje su uginule tokom ispitivanja. Kriterijum za donošenje odluke o lišavanju života bolesne ili životinje na samrti, kao i uputstva za prepoznavanje predstojeće i predvidljive smrti dati su u literaturi9.
U ovoj metodi ispitivanja koriste se unapred određene doze, a rezultati ispitivanja omogućavaju da se supstanca rangira i klasifikuje prema Pravilniku o klasifikaciji, pakovanju, obeležavanju i oglašavanju hemikalije i određenog proizvoda u skladu sa globalno harmonizovanim sistemom za klasifikaciju i obeležavanje UN odnosno GHS10.
Metoda ispitivanja nije namenjena izračunavanju precizne vrednosti LD50, ali omogućava utvrđivanje definisanih opsega doza gde je letalitet očekivan, jer se i u ovoj metodi kao ciljni pokazatelj ispitivanja još uvek koristi smrt određenog procenta životinja. Metoda ispitivanja omogućava određivanje vrednosti LD50 samo u slučaju kada najmanje dve primenjene doze dovode do letaliteta koji je viši od 0% a manji od 100%. Korišćenje unapred određenih doza koje su izabrane nezavisno od ispitivane supstance, zajedno sa klasifikacijom koja je jasno povezana sa brojem životinja posmatranih u različitim okolnostima, povećava mogućnost konzistentnih izveštaja i ponovljivost.
Pre početka studije uzimaju se u obzir svi dostupni podaci o ispitivanoj supstanci. Podaci uključuju identitet i hemijsku strukturu supstance, njena fizička i hemijska svojstva, rezultate drugih in vivo ili in vitro ispitivanja toksičnosti, toksikološke podatke strukturno sličnih supstanci, kao i predviđene načine korišćenja supstance. Ovi podaci su neophodni da bi se ukazalo na važnost izvođenja studije za zaštitu zdravlja ljudi, a pomažu i pri izboru odgovarajuće početne doze.
1.2. DEFINICIJE
Akutna oralna toksičnost jeste svojstvo hemikalije da izazove štetne efekte nakon primene pojedinačne peroralne doze ili nekoliko peroralnih doza u periodu od 24 sata.
Odložena smrt jeste uginuće životinja koje ne uginu ili nisu životno ugrožene tokom prvih 48 sati, već do uginuća dolazi u periodu posmatranja od 14 dana.
Doza jeste količina primenjene ispitivane supstance. Izražava se kao masa ispitivane supstance po jedinici telesne mase eksperimentalne životinje (mg/kg).
Evidentna toksičnost jeste toksični efekat kod koga se javljaju jasni znakovi toksičnosti nakon primene ispitivane supstance (za primere videti literaturu3), koji su toliko intenzivni da bi izlaganje sledećoj većoj fiksnoj dozi kod životinja verovatno dovelo do jakog bola, stresa, iscrpljenosti, stanja na samrti (kriterijumi su dati u literaturi8) ili smrtnog ishoda.
GHS jeste skraćenica za Globalno harmonizovan sistem za klasifikaciju i obeležavanje hemikalija UN. Razvoj ovog sistema je zajednički napor OECD (zdravlje ljudi i životna sredina), UN Komiteta stručnjaka za transport opasnog tereta (fizička i hemijska svojstva) i Međunarodne organizacije rada (ILO) (saopštavanje opasnosti), a koordinira ga Međuorganizacijski program za upravljanje hemikalijama (IOMC).
Neminovna smrt jeste očekivana smrt životinje koja je na samrti ili se njena smrt očekuje pre planiranog narednog vremena posmatranja. Simptomi koji ukazuju na ovo stanje kod glodara su konvulzije, lateralni položaj, ležeći položaj ili tremor (za detalje videti literaturu8).
LD50 (srednja smrtna doza) jeste statistički određena pojedinačna doza supstance za koju se očekuje da izaziva smrtnost kod 50 posto ispitivanih životinja kada se primeni peroralnim putem. Vrednost LD50 izražava se u jedinici mase ispitivane supstance po jedinici telesne mase eksperimentalne životinje (mg/kg).
Granična doza jeste gornja granična doza koja se koristi u ispitivanju (2.000 mg/kg ili 5.000 mg/kg).
Stanje na samrti jeste stanje definisano kao nemogućnost preživljavanja ili neminovna smrt životinje, čak i nakon eventualnog tretmana (za detalje videti literaturu8).
Predvidljiva smrt jeste stanje koje karakteriše prisutnost kliničkih znakova koji ukazuju na neminovnu smrt životinje pre završetka eksperimenta, na primer nemogućnost uzimanja vode ili hrane (za detalje videti literaturu8).
1.3. PRINCIP METODE
Princip ispitivanja koje je zasnovano na postupku (korak po korak) uz korišćenje minimalnog broja životinja po koraku, jeste da se prikupi dovoljno podataka o akutnoj toksičnosti ispitivane supstance kako bi se omogućila njena klasifikacija. Supstanca se daje grupi eksperimentnih životinja peroralno u jednoj od određenih doza. Supstanca se ispituje primenom postupka (korak po korak), pri čemu se u svakom koraku koriste tri životinje istog pola (uglavnom ženke). Izostanak ili prisustvo znakova koji upućuju na smrt kod životinja kojima se primenjuje doza u jednom od koraka određuje sledeći korak postupka, odnosno:
- da dalja ispitivanja nisu potrebna,
- potrebu primene iste doze na dodatne tri životinje,
- potrebu primene sledeće više ili niže doze na dodatne tri životinje.
Detalji postupka ispitivanja dati su u Delu drugom ove metode. Ova metoda ispitivanja omogućava da se donese zaključak o klasifikaciji, pri čemu se u obzir uzima klasifikacija ispitivane supstance u jednu od niza klasa toksičnosti koje su definisane po fiksnim LD50 graničnim vrednostima.
1.4. OPIS METODE ISPITIVANJA
1.4.1. Izbor životinjske vrste
Preporučena vrsta glodara je pacov, iako se za ispitivanja koriste i druge životinjske vrste. Najčešće se koriste ženke9 jer je na osnovu literature koja se odnosi na ispitivanje LD50 uočeno da je mala razlika u osetljivosti polova pri primeni ove metode. U slučajevima u kojima je uočena razlika, ženke su pokazale nešto veću osetljivost11. Ako se u literaturi nađu toksikološki ili toksikokinetički podaci za strukturno slične hemikalije koji ukazuju na to da su mužjaci osetljiviji na određenu ispitivanu supstancu, koriste se mužjaci za ispitivanje. Kad se ispitivanje izvodi na mužjacima, navodi se opravdanost za njihovu primenu.
Ispitivanje se izvodi na zdravim mladim jedinkama onih laboratorijskih sojeva koji se uobičajeno koriste u ovakvim ispitivanjima. Ispitivanje se vrši na ženkama koje nisu ranije rađale i koje nisu gravidne. Svaka životinja na početku eksperimenta i primene prvih doza ispitivane supstance treba da bude stara između 8 i 12 nedelja, a njena telesna masa da bude u opsegu ± 20% od srednje vrednosti mase prethodno doziranih životinja.
1.4.2. Uslovi smeštaja i ishrana
Temperatura prostorije u kojima se drže životinje je 22° C (± 3° C). Relativna vlažnost vazduha iznosi najmanje 30%, ali ne više od 70% (osim kad se prostorije čiste), a idealno je vlažnost vazduha održavati između 50% i 60%. Osvetljenje je veštačko, i to u intervalima od 12 sati svetla i 12 sati mraka. Za ishranu se može primenjivati uobičajena hrana za laboratorijske životinje, sa slobodnim pristupom vodi za piće. Životinje se prema primenjenoj dozi ispitivane supstance mogu grupisati u kaveze. Broj životinja po kavezu ne sme ni na koji način da ometa proces praćenja i posmatranja svake životinje.
1.4.3. Priprema životinja
Životinje se biraju nasumce, obeležavaju radi lakšeg razlikovanja, a da bi se prilagodile na laboratorijske uslove drže se u kavezima najmanje pet dana pre početka eksperimenta i primene prve doze ispitivane supstance.
1.4.4. Priprema doza
Ispitivane supstance primenjuju se u konstantnim zapreminama, pa je neophodno prilagođavanje koncentracije za pripremanje različitih doza. Pri ispitivanju hemikalije u tečnom stanju, primena nerazblažene ispitivane supstance, odnosno supstance koja je u smeši u konstantnoj koncentraciji, može da bude značajna kasniju procenu rizika od te supstance. Maksimalna pojedinačna zapremina doze ne sme da se prekorači. Maksimalna zapremina tečnosti koja sme da se primeni zavisi i od veličine eksperimentne životinje. Zapremina ispitivane supstance koja se primenjuje kod glodara ne sme da prelazi 1 ml/100g TM životinje, a ukoliko se primenjuje vodeni rastvor može se razmotriti i doza od 2 ml/100g TM životinje. Kad je reč o formulaciji i pripremi doze, prvenstveno se preporučuje primena vodenog rastvora/suspenzije/emulzije, a zatim rastvora/suspenzije/emulzije u ulju (npr. kukuruznom ulju) ili rastvor u nekom drugom vehikulumu. Za sve vehikulume osim vode, neophodno je znati njihove toksikološke karakteristike. Doze se pripremaju neposredno pre primene, osim ako se radi o supstanci za koju je poznato da je stabilna u rastvoru tokom dužeg vremenskog perioda.
1.5. POSTUPAK
1.5.1. Primena doza
Ispitivana supstanca primenjuje se u jednoj dozi sondom direktno u želudac ili intubiranjem kanilom. U posebnim okolnostima, kada jednokratna doza nije moguća, ispitivana supstanca može se primeniti u nekoliko manjih porcija tokom vremenskog perioda koji nije duži od 24 sata.
Pre početka primene doza ispitivane supstance potrebno je izgladneti životinje (npr. pacovima je potrebno uskratiti hranu ali ne i vodu preko noći; miševima je potrebno uskratiti hranu ali ne i vodu na 3 do 4 sata). Nakon perioda gladovanja, potrebno je izmeriti telesnu masu životinja i primeniti ispitivanu supstancu. Nakon prve doze, hrana može ponovno da se uskrati, i to: kod pacova narednih 3 do 4 sata, a kod miševa naredna 1 do 2 sata. Kada se doza ispitivane supstance primeni u nekoliko manjih porcija u određenom vremenskom intervalu, može da se ukaže potreba za hranom i vodom ukoliko se radi o produženom vremenskom periodu.
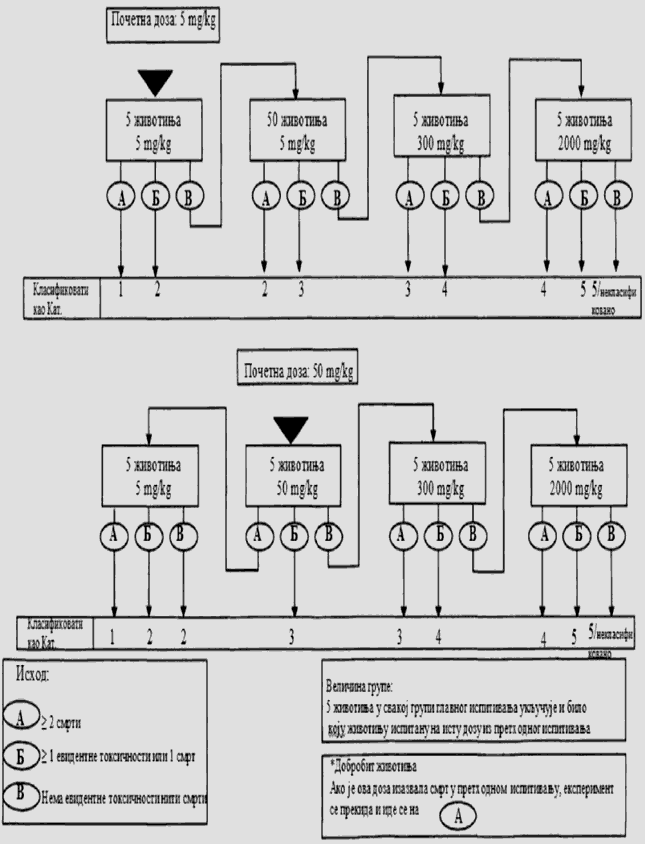
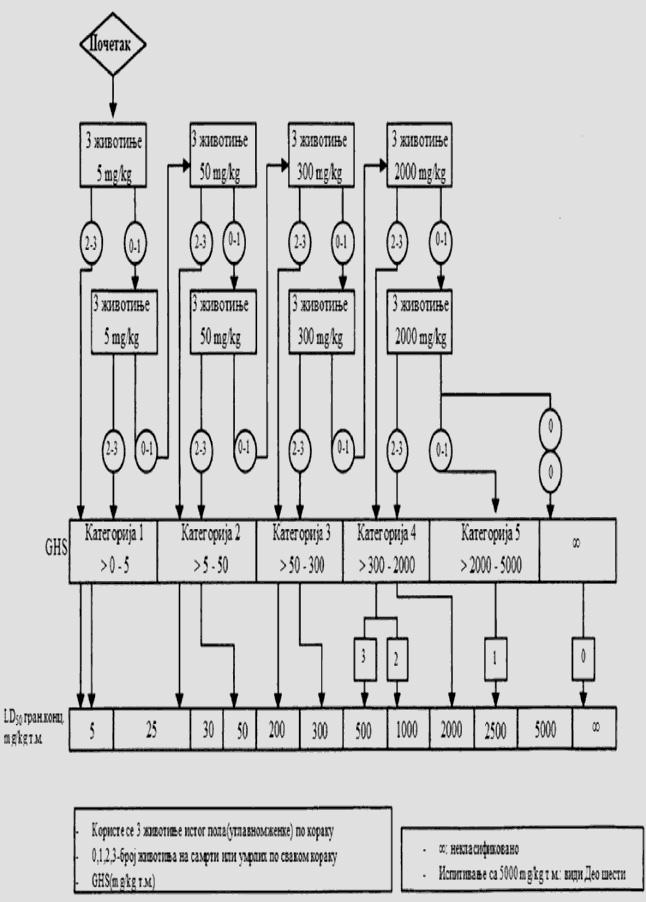
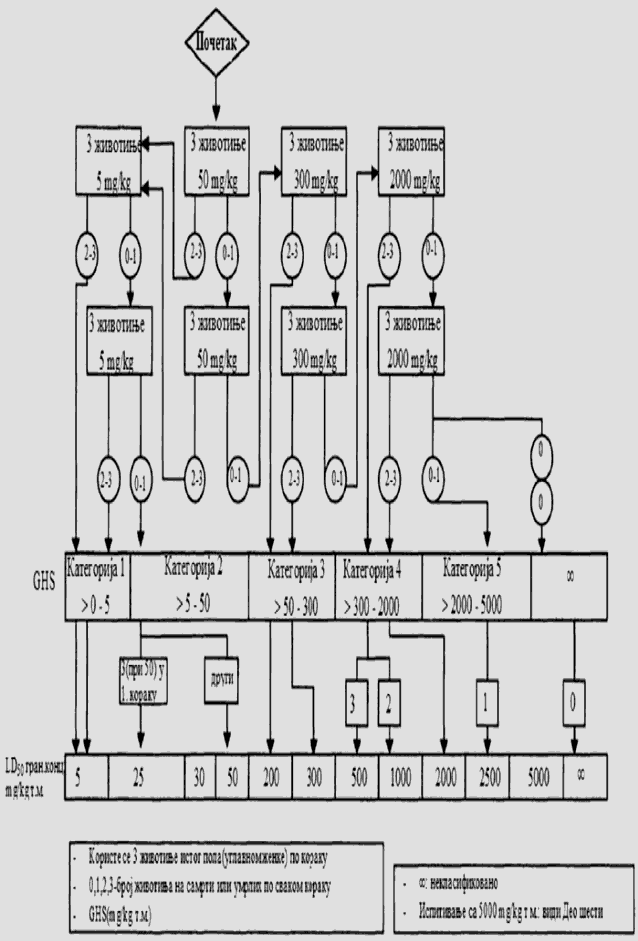
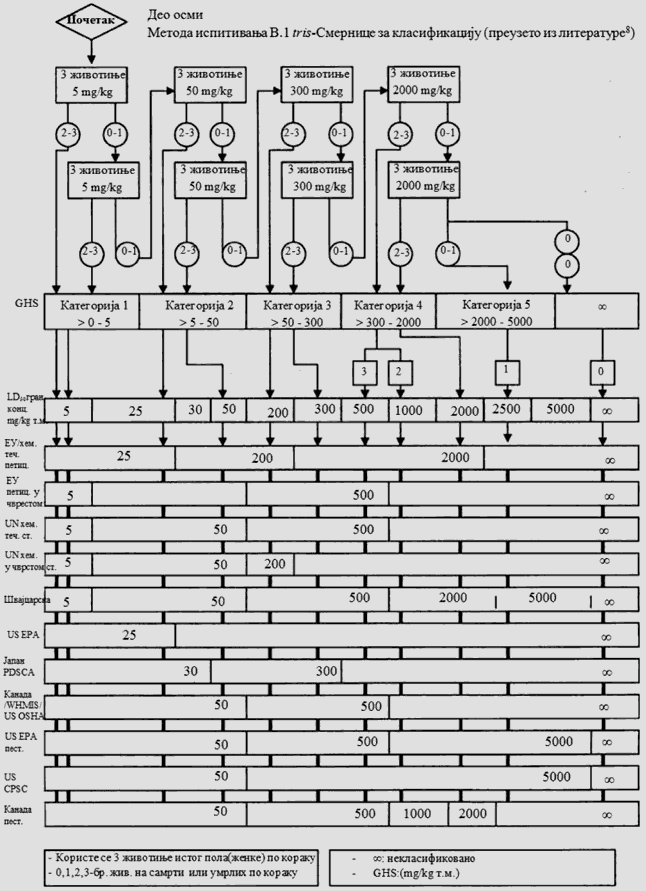
1.5.2. Broj životinja i dozni nivoi
U svakom koraku koriste se po tri životinje. Dozni nivo koji će se koristiti kao početna doza jeste jedna od fiksnih doza od 5 mg/kg, 50 mg/kg, 300 mg/kg i 2.000 mg/kg TM. Početni dozni nivo jeste doza koja sa najvećom verovatnoćom izaziva smrt kod nekih od uključenih životinja. Dijagrami toka ispitivanja koji su dati u Delu drugom ove metode, opisuju postupak koji se prati pri primeni svake početne doze. U Delu osmom ove metode date su smernice za klasifikaciju prema Pravilniku o klasifikaciji, pakovanju, obeležavanju i oglašavanju hemikalije i određenog proizvoda ("Službeni glasnik RS", br. 59/10, 25/11 i 5/12), dok ne počne sa primenom Pravilnika o klasifikaciji, pakovanju, obeležavanju i oglašavanju hemikalije i određenog proizvoda u skladu sa Globalno harmonizovanim sistemom za klasifikaciju i obeležavanje UN ("Službeni glasnik RS", br. 64/10 i 26/11).
Ukoliko dostupni podaci ukazuju da pri primeni najviše početne doze (2.000 mg/kg TM) verovatno neće doći do smrti životinja, obavlja se ispitivanje granične doze. Kad nema podataka o ispitivanoj supstanci, preporučeno je, zbog dobrobiti životinja, da početna doza bude od 300 mg/kg TM.
Vremenski razmak između primene ispitivane supstance pri svakom doznom nivou određen je početkom, trajanjem i ozbiljnošću znakova toksičnosti. Tretman životinja sledećom dozom odlaže se sve dok se ne uverimo u preživljavanje prethodno tretiranih životinja.
Izuzetno, i samo u slučajevima kada to opravdavaju specifične potrebe, može da se razmotri primena dodatnog doznog nivoa od 5.000 mg/kg TM (videti Deo sedmi ove metode). Zbog dobrobiti životinja, ne preporučuje se ispitivanje na životinjama radi klasifikacije ispitivane supstance u Kategoriju 5 (prema GHS-u) u opsegu doza od 2.000 mg/kg do 5000 mg/kg, i razmatra se samo u slučajevima kada postoji velika verovatnoća da će rezultati ispitivanja imati neposredan značaj za zaštitu zdravlja ljudi, životinja i životne sredine.
1.5.3. Ispitivanje granične doze
Ispitivanje granične doze primarno se koristi u situacijama kada istraživač ima pouzdane podatke da je ispitivana hemikalija netoksična, tj. da postaje toksična samo iznad propisanih graničnih doza. Podaci o toksičnosti ispitivanih hemikalija mogu se preuzeti iz završenih ispitivanja na sličnim hemikalijama, ako se uzme u obzir identitet i procenat komponenata za koje se pouzdano zna da su toksikološki značajne. U slučajevima gde nema podataka o toksičnosti ili ih nema dovoljno, ili kada se očekuje da će ispitivana hemikalija biti toksična, potrebno je isplanirati i obaviti glavno ispitivanje.
Ispitivanje granične doze, pri doznom nivou od 2.000 mg/kg TM, može se sprovesti na šest životinja (tri životinje po koraku) ili, izuzetno, pri doznom nivou od 5.000 mg/kg TM uvođenjem tri životinje po koraku (videti Deo sedmi ove metode). Ukoliko se pokaže da je smrt životinja povezana sa primenom ispitivane supstance potrebno je da se sprovede dalje ispitivanje i pri nižem doznom nivou.
1.6. POSMATRANJA
Životinje se posmatraju pojedinačno nakon primene prve doze ispitivane supstance i to najmanje jednom tokom prvih 30 minuta i periodično tokom sledeća 24 sata, uz posebnu pažnju i naglasak na prva 4 sata. Posmatranja se zatim obavljaju jednom dnevno, u periodu od ukupno 14 dana, osim u slučajevima kada je životinju potrebno isključiti iz ispitivanja (ako je pronađena mrtva) ili je lišiti života na human način imajući u vidu dobrobit životinje. Trajanje posmatranja ne sme da bude strogo definisano, već ga određuju toksični efekti, početak i trajanje oporavka, a ukoliko postoji potreba može i da se produži. Važni su periodi u kojima se pojavljuju i nestaju prvi znaci toksičnosti, posebno ako se znaci toksičnosti javljaju odloženo12. Sva posmatranja sistematski se beleže, a za svaku životinju potrebno je voditi zasebni karton sa opažanjima.
Ako životinje neprekidno pokazuju znakove toksičnosti, potrebna su dodatna posmatranja. Potrebno je uključiti i promene na koži i krznu, očima i mukoznim membranama, kao i na respiratornom, cirkulatornom, autononomnom i centralnom nervnom sistemu, promene somatomotorne aktivnosti i promene ponašanja. Posebna pažnja se obraća na pojavu tremora, konvulzija, salivacije, proliva, letargije, pospanosti i kome. Za definisanje ovih stanja koriste se principi i kriterijumi koji su dati u literaturi9. Životinje pronađene na samrti ili one koje trpe jak bol ili stres, lišavaju se života na human način. Kada su životinje lišene života iz humanih razloga ili pronađene mrtve, potrebno je što preciznije zabeležiti vreme smrti.
1.6.1. Telesna masa
Individualna telesna masa životinja određuje se neposredno pre primene ispitivane supstance i najmanje jednom nedeljno nakon tog perioda. Beleže se i izračunavaju i promene u telesnoj masi. Na kraju ispitivanja meri se telesna masa preživelih životinja, a potom se lišavaju života na human način.
1.6.2. Patološka ispitivanja
Sve ispitivane životinje (uključujući i one koje uginu za vreme ispitivanja ili su isključene iz ispitivanja zbog dobrobiti životinje) potrebno je postmortalno pregledati. Sve značajne patološke promene beleže se za svaku životinju. Mikroskopskim pregledom organa mogu se dobiti korisni podaci, pa je potrebno obaviti pregled organa koji su postmortalnim pregledom pokazali značajne patološke promene i to kod onih životinja koje su preživele 24 ili više sati nakon prve doze.
2. PODACI
Potrebno je prikupiti podatke za svaku životinju. Svi podaci se tabelarno prikazuju, a za svaku ispitivanu grupu navodi se ukupan broj životinja u grupi, broj životinja koje su pokazale znakove toksičnosti, broj životinja koje su pronađene mrtve ili broj onih koje se lišavaju života na human način tokom ispitivanja, vreme smrti pojedinačnih životinja, opis i vremenski tok toksičnih efekata i njihovu reverzibilnost, kao i nalaze postmortalnog pregleda.
3. IZVEŠTAJ O ISPITIVANJU
PISANJE IZVEŠTAJA
Izveštaj sadrži:
1. Podatke o ispitivanoj supstanci:
- fizička svojstva, čistoća, i kada je značajno, fizička i hemijska svojstva (uključujući izomerizaciju);
- identifikacione podatke, koji uključuju i CAS broj.
2. Podatke o vehikulumu (ako je značajno):
- obrazloženje za izbor vehikuluma, ukoliko nije voda.
3. Podatke o eksperimentalnoj životinji:
- vrsta/soj;
- mikrobiološki status životinje, ako je poznat;
- broj, starost i pol životinja (uključujući, kada je značajno, obrazloženje ukoliko se koriste mužjaci umesto ženki);
- izvor, uslove smeštaja, ishrane, itd.
4. Podatke o uslovima ispitivanja:
- detalje o formulaciji ispitivane supstance, uključujući fizičko stanje u kome je primenjena formulacija;
- detalje o primeni ispitivane supstance koji uključuju zapremine doza i vreme primene doze ispitivane supstance;
- detalje o kvalitetu hrane i vode (uključujući detalje o vrsti i izvoru hrane i izvoru vode);
- obrazloženje za izbor početne doze.
5. Rezultate:
- tabelarni prikaz rezultata i primenjene doze za svaku životinju (životinje koje pokazuju znakove toksičnosti uključujući smrtnost, prirodu, intenzitet i trajanje toksičnih efekata);
- tabelarni prikaz telesne mase i promena telesne mase;
- individualnu telesnu masu životinja na dan primene doze ispitivane supstance, zatim u nedeljnim intervalima, i u vreme uginuća ili lišavanja života na human način;
- datum i vreme smrti, ako do nje dođe pre predviđenog lišavanja života na human način;
- vremenski dijagram pojave znakova toksičnosti, kao i da li su znakovi bili reverzibilni za svaku životinju;
- nalaze postmortalnih pregleda i histopatološke nalaze za svaku životinju, ukoliko su dostupni.
6. Diskusiju i tumačenje rezultata.
7. Zaključke.
4. LITERATURA
1. Roll R., Höfer-Bosse Th. And Kayser D. (1986). New Perspectives in Acute Toxicity Testing of Chemicals. Toxicol. Lett., Suppl. 31, 86.
2. Roll R., Riebschläger M., Mischke U. and Kayser D. (1989). Neue Wege zur Bestimmung der akuten Toxizität von Chemikalien. Bundesgesundheitsblatt 32, 336-341.
3. Diener W., Sichha L., Mischke U., Kayser D. and Schlede E. (1994). The Biometric Evaluation of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 68, 559-610.
4. Diener W., Mischke U., Kayser D. and Schlede E. (1995). The Biometric Evaluation of the OECD Modified Version of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, 729-734.
5. Diener W., and Schlede E. (1999) Acute Toxicity Class Methods: Alterations to LD/LC50 Tests. ALTEX 16, 129-134.
6. Schlede E., Mischke U., Roll R. and Kayser D. (1992). A National Validation Study of the Acute-Toxic- Class Method - An Alternative to the LD50 Test. Arch. Toxicol. 66, 455-470.
7. Schlede E., Mischke U., Diener W. and Kayser D. (1994). The International Validation Study of the Acute-Toxic-Class Method (Oral). Arch. Toxicol. 69, 659-670.
8. OECD (2001) Guidance Document on Acute Oral Toxicity Testing. Environmental Health and Safety Monograph Series on Testing and Assessment N. 24. Paris.
9. OECD (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. Environmental Health and Safety Monograph Series on Testing and Assessment N 19.
10. OECD (1998) Harmonized Integrated Hazard Classification System For Human Health And Environmental Effects Of Chemical Substances as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals in November 1998, Part 2, p. 11, [http://webnet1.oecd.org/oecd/pages/home/displaygeneral/0,3380,EN-documents-521-14-no-24-no-0,FF.html].
11. Lipnick R L, Cotruvo, J A, Hill R N, Bruce R D, Stitzel K A, Walker A P, Chu I; Goddard M, Segal L, Springer J A and Myers R C (1995) Comparison of the Up and Down, Conventional LD50, and Fixed Dose Acute Toxicity Procedures. Fd. Chem. Toxicol 33, 223-231.
12. Chan P.K. and A.W. Hayes. (1994). Chap. 16. Acute Toxicity and Eye Irritancy. Principles and Methods of Toxicology. Third Edition. A.W. Hayes, Editor. Raven Press, Ltd., New York, USA.
Deo drugi
POSTUPCI ZA POČETNE DOZE
OPŠTE NAPOMENE
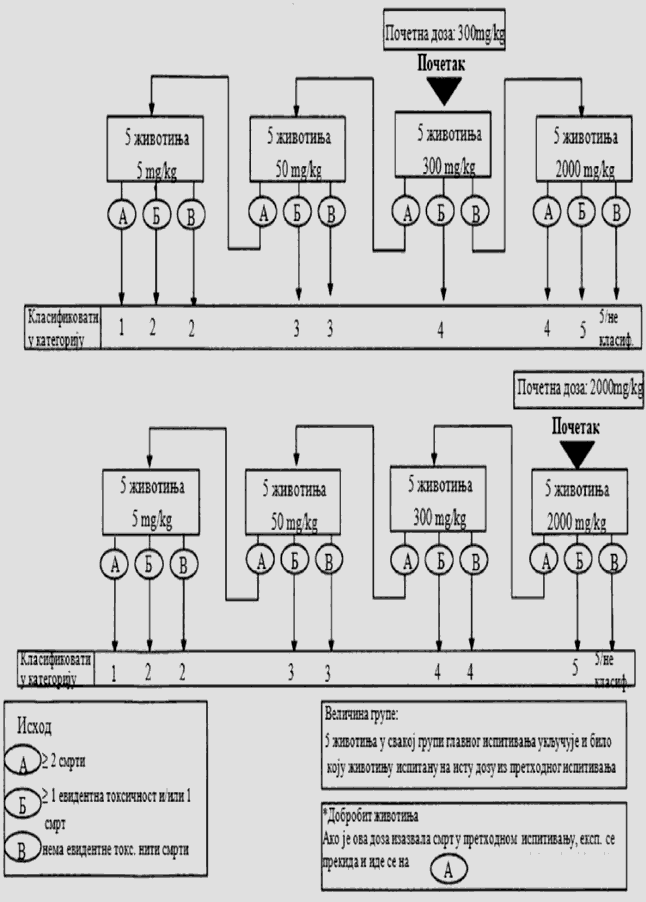
U ovom delu date su sheme ispitivanja za svaku početnu dozu:
- Deo treći: Početna doza je 5 mg/kg TM
- Deo četvrti: Početna doza je 50 mg/kg TM
- Deo peti: Početna doza je 300 mg/kg TM
- Deo šesti: Početna doza je 2000 mg/kg TM
U zavisnosti od broja životinja koje su lišene života na human način postupak ispitivanja označen je strelicama.
Deo treći
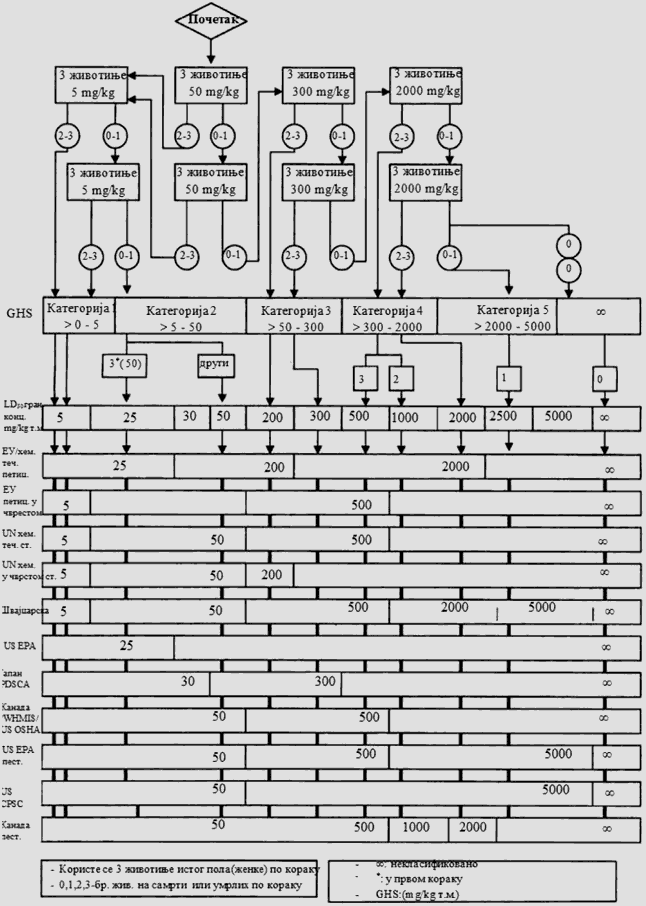
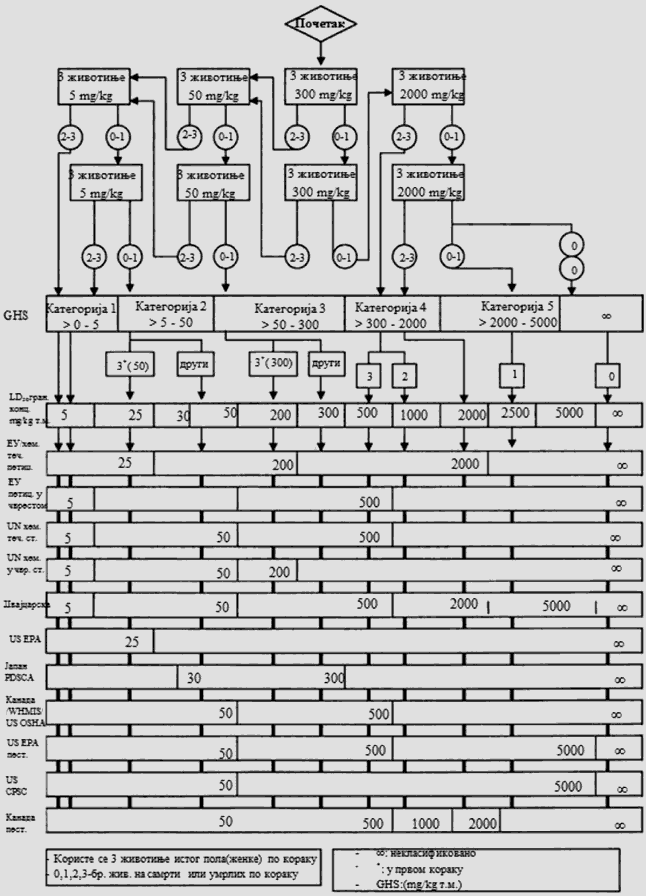
POSTUPAK ISPITIVANJA SA POČETNOM DOZOM OD 5 MG/KG TELESNE MASE
Deo četvrti
POSTUPAK ISPITIVANJA SA POČETNOM DOZOM OD 50 MG/KG TELESNE MASE
Deo sedmi
KRITERIJUMI ZA KLASIFIKACIJU ISPITIVANIH SUPSTANCI SA OČEKIVANIM VREDNOSTIMA LD50 IZNAD 2.000 mg/kg ZA KOJE NIJE POTREBNO DODATNO ISPITIVANJE
Kriterijum za klasifikaciju u klasu opasnosti akutna toksičnost Kategorija 5 (po GHS-u) omogućava identifikovanje ispitivanih supstanci koje pokazuju nisku akutnu toksičnost, ali koje pod određenim okolnostima mogu da predstavljaju opasnost za osetljive populacije. Ove supstance imaju vrednosti LD50 (peroralno) i LD50 (dermalno) u opsegu doza od 2.000 mg/kg do 5.000 mg/kg ili potpuno odgovarajućih doza primenjenih drugim putevima unosa. Ispitivane supstance klasifikuju se u odgovarajuću kategoriju opasnosti (Kategorija 5 po) ako je: 2.000 mg/kg < LD50 < 5.000 mg/kg, u sledećim slučajevima:
a) ako bilo koja od shema ispitivanja datih u Delovima trećem, četvrtom, petom i šestom ove metode upućuje na ovu kategoriju zbog učestalosti smrtnih slučajeva,
b) ako postoje pouzdani dokazi da je vrednost LD50 u opsegu vrednosti koji odgovara kategoriji 5; ili ako druge studije toksičnosti sprovedene na životinjama ili ljudima ukazuju na potencijalne akutne toksične efekte na zdravlje ljudi,
v) ako se ekstrapolacijom, procenom ili merenjem podataka ne ustanovi pripadnost nekoj višoj klasi opasnosti, a:
- postoje pouzdani podaci koji ukazuju na značajne toksične efekte kod ljudi ili
- se uoči smrt pri ispitivanjima koja se vrše radi klasifikacije zaključno u Kategoriju 4, peroralnom primenom odgovarajuće doze ili
- se stručnom procenom potvrde značajni klinički znakovi toksičnosti, pri ispitivanjima koja se vrše radi klasifikacije zaključno u Kategoriju 4, pri čemu klinički znakovi ne uključuju proliv, piloerekciju ili zapušteni izgled ili
- se stručnom procenom potvrdi postojanje značajnih akutnih toksičnih efekata iz drugih ispitivanja sprovedenih na životinjama.
ISPITIVANJE DOZA IZNAD 2.000 mg/kg
Zbog zaštite životinja i njihove dobrobiti ne preporučuje se ispitivanje doze od 5.000 mg/ kg za klasifikaciju u klasu opasnosti akutna toksičnost Kategorija 5 (po GHS-u). Primena ove doze razmatra se samo u slučajevima kad postoji velika verovatnoća da će rezultati ispitivanja imati značajan doprinos zaštiti zdravlja ljudi ili životinja10. Dalja ispitivanja sa primenom visokih doza se ne izvode.
Kada se ispituje doza od 5.000 mg/kg dovoljan je samo jedan korak (npr. tri životinje). Ako ugine prva životinja kojoj se primenjuje ispitivana supstanca, doza se spušta na 2.000 mg/kg prema pravilima datim u shemi iz Dela drugog ove metode. Ako prva životinja preživi, u ispitivanje se uključuju dodatne dve životinje. Ako ugine samo jedna od tri životinje, pretpostavlja se da je vrednost LD50 iznad 5.000 mg/kg. Ako uginu dve životinje, nastavlja se primena ispitivane supstance u dozi od 2.000 mg/kg.
B.2. AKUTNA INHALACIONA TOKSIČNOST
1. METODA ISPITIVANJA
1.1. UVOD
Korisno je imati prethodne podatke o svojstvima supstance kao što su: raspodela, veličina čestica, pritisak pare, tačka topljenja, tačka ključanja, tačka paljenja i eksplozivnost (ako se radi o eksplozivnoj supstanci).
Videti Opšti uvod, Deo A.
1.2. DEFINICIJE
Videti Opšti uvod, Deo B.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Nekoliko grupa eksperimentalnih životinja izlaže se ispitivanoj supstanci koja se primenjuje u rastućim koncentracijama kroz definisani vremenski period, tako da se na jednu grupu životinja primenjuje jedna koncentracija. Beleže se zapažanja o efektima primenjenih koncentracija i smrtnost kod životinja. One životinje koje uginu za vreme ispitivanja post-mortalno se pregledaju. Po završetku ispitivanja i preživele životinje se lišavaju života na human način i post-mortalno pregledaju.
One životinje koje pokazuju teške i trajne znake toksičnosti i bola lišavaju se života na human način. Izbegava se primena ispitivane supstance u koncentracijama za koje se pouzdano zna da će kod životinja usled korozivnog ili jakog iritativnog svojstva izazvati značajan bol i patnju.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE
1.6.1. Priprema
Životinje se čuvaju u odgovarajućim uslovima smeštaja i ishrane prema definisanom režimu najmanje pet dana pre početka eksperimenta. Zdrave mlade životinje nasumce se razvrstavaju u prethodno definisani broj grupa. Nije potrebno da se životinje podvrgnu simuliranom izlaganju, osim ako to nije posebno navedeno u uputstvu za aparaturu za inhalaciono izlaganje.
Čvrste ispitivane supstance usitnjavaju se do čestica odgovarajuće veličine.
Kada je neophodno, dodaje se vehikulum kojim se postiže odgovarajuća koncentracija ispitivane supstance u atmosferi. Za dodati vehikulum postavlja se i kontrolna grupa. Odabrani vehikulum i drugi aditivi koji se koriste da olakšaju primenu ispitivane supstance ne smeju da izazivaju toksične efekte. Ako je potrebno mogu se koristiti podaci iz literature.
1.6.2. Uslovi ispitivanja
1.6.2.1. Eksperimentalne životinje
Ako ne postoje kontraindikacije, preporučena vrsta je pacov i to sojevi koji se najčešće koriste u laboratorijskim ispitivanjima. Za oba pola, na početku ispitivanja, opseg u kome se kreće telesna masa životinja ne sme da prelazi ± 20% od srednje vrednosti.
1.6.2.2. Broj i pol
Najmanje 10 glodara (pet ženki i pet mužjaka) koristi se za svaku ispitivanu koncentraciju. Ispitivanje se vrši na ženkama koje nisu ranije rađale i koje nisu gravidne.
Napomena: U ispitivanjima akutne toksičnosti na životinjama višeg reda od glodara, može se razmotriti i korišćenje manjeg broja jedinki. Doze se pažljivo biraju, uz nastojanje da se izbegnu doze koje su veće od srednjih toksičnih doza. U ovakvim ispitivanjima se ne primenjuju letalne doze ispitivane supstance.
1.6.2.3. Koncentracije izlaganja
Koristi se najmanje tri koncentracije ispitivane supstance, a njihov izbor pokriva opseg toksičnih efekata i stope smrtnosti. Podaci omogućavaju konstruisanje krive zavisnosti koncentracije i smrtnosti, i gde je moguće, određivanje vrednosti LC50.
1.6.2.4. Ispitivanje granične doze
Ako se pet mužjaka i pet ženki izlože koncentraciji od 20 mg/L gasa ili 5 mg/L aerosola ili čestica u trajanju od četiri sata (ili se izlože maksimalnoj mogućoj koncentraciji, kada nije moguće postići ovu koncentraciju zbog fizičkih i hemijskih svojstava uključujući eksplozivna svojstva ispitivane supstance) i pri tome tokom 14 dana ne dođe do smrtnih slučajeva, dalja ispitivanja se obustavljaju.
1.6.2.5. Vreme izlaganja
Vreme izlaganja je četiri sata.
1.6.2.6. Oprema
Životinje se podvrgavaju ispitivanju pomoću opreme koja je dizajnirana tako da omogući dinamički protok vazduha sa najmanje 12 potpunih izmena u jednom satu, kako bi se omogućila odgovarajuća koncentracija kiseonika i ravnomeran raspored u atmosferi. Kada se koristi komora, ona je dovoljno prostrana za životinje i da omogući maksimalnu izloženost ispitivanoj supstanci udisanjem. Opšte pravilo koje obezbeđuje stabilnost atmosfere u komori, jeste da ukupna "zapremina" životinja na koje se primenjuje ispitivana supstanca nije bude veća od 5% ukupne zapremine komore. Koriste se različiti tipovi komora koji omogućavaju izloženost čitavog tela, samo glave ili samo oro-nazalnih otvora životinje. Poslednje dve komore minimiziraju izloženost ispitivanoj supstanci pri drugim putevima unosa.
1.6.2.7. Vreme posmatranja
Posmatranja se obavljaju u trajanju od najmanje 14 dana. Ovaj vremenski interval nije fiksno određen. Njega određuju, između ostalog, toksični efekti, njihova učestalost, kao i vreme trajanja oporavka. Vreme posmatranja se, po potrebi, može i produžiti. Važno je zabeležiti vreme kod kojeg se jave ili nestanu prvi znaci toksičnosti, kao i vreme smrti, pogotovo ako postoji tendencija da vreme smrti bude odloženo.
1.6.3. Postupak
Neposredno pre nego što se eksperimentalna životinja izloži ispitivanoj supstanci meri se njena telesna masa. Životinje se u periodu od četiri sata izlažu ispitivanim koncentracijama u komorama koje su prethodno uravnotežene. Vreme potrebno za uravnoteženje koncentracija u komori je kratko. Temperatura na kojoj se obavlja ispitivanje održava se na 22° C ± 3° C, a relativna vlažnost između 30% i 70%. U nekim slučajevima (npr. kod ispitivanja aerosola) ovo nije izvodljivo. Održavanjem negativnog pritiska unutar komore (≥ 5 mm vode) sprečiće se curenje isparavane supstance u okolnu zonu. Za vreme izlaganja ispitivanoj supstanci životinjama ne sme da se daje hrana i voda. U toku eksperimenta se koriste odgovarajući sistemi za održavanje i praćenje uslova unutar komore. Sistem omogućava stabilne uslove i njihovo uspostavljanje u što kraćem vremenskom roku. Komora mora da bude dizajnirana na takav način da omogućava homogenu distribuciju atmosfere za vreme ispitivanja.
Mere se i prate sledeći parametri:
a) brzina protoka vazduha (neprekidno);
b) koncentracije ispitivane supstance u inhalacionoj zoni najmanje tri puta tokom izlaganja životinja (aerosoli na visokim temperaturama zahtevaju i češće praćenje). Tokom perioda izlaganja ispitivanoj supstanci, koncentracije ne smeju da variraju više od ± 15% od srednje vrednosti. Kod aerosola teško se postiže ovaj nivo kontrole, pa se u tom slučaju tolerišu veće razlike u vrednostima. Za aerosole je potrebno obaviti i analizu veličine čestica (najmanje jedanput u svakoj grupi životinja);
v) temperatura i vlažnost (neprekidno, ako je moguće).
Zapažanja se beleže sistematično za vreme i nakon izlaganja ispitivanoj supstanci, i za svaku životinju vodi se zaseban karton. Prvog dana zapažanja se češće beleže. Pažljivi klinički pregled životinje potrebno je uraditi najmanje jedanput svakog radnog dana, a preostala posmatranja beleže se svakodnevno uz preduzimanje odgovarajućih aktivnosti kojima se na najmanju meru svodi gubitak životinja iz studije. Na uginulim životinjama radi se post-mortalni pregled ili se one odlažu na hlađenje, a životinje koje su izrazito slabe ili na samrti izdvajaju se iz grupe ili se lišavaju života na human način.
Beleže se promene na koži i krznu, očima, mukoznim membranama, respiratornom, cirkulatornom, autononomnom i centralnom nervnom sistemu, kao i somatomotorna aktivnost i način ponašanja. Posebna pažnja se posvećuje načinu disanja, tremoru, konvulzijama, salivaciji, prolivu, letargiji, pospanosti i komi kod životinja. Vreme smrti beleži se što preciznije. Telesna masa svake pojedinačne životinje određuje se jednom nedeljno nakon prvobitnog izlaganja ispitivanoj supstanci, kao i u vreme smrti (lišavanja života na human način). Životinje koje uginu za vreme ispitivanja i one koje prežive do samog kraja post-mortalno se pregledaju sa posebnom pažnjom na promene u gornjem i donjem respiratornom traktu. Sve značajnije patološke promene se beleže. Kada je neophodno, uzimaju se i uzorci tkiva za histopatološka ispitivanja.
2. PODACI
Podaci se navode tabelarno. Za svaku ispitivanu grupu životinja navodi se: broj životinja na početku ispitivanja, vreme smrti za svaku životinju, broj onih koje su pokazale znakove toksičnosti, opis toksičnih efekata i nalazi post-mortalnog pregleda. Kada životinje prežive duže od jednog dana izračunavaju se i beleže promene u njihovoj telesnoj masi. Životinje koje se lišavaju života na human način, zbog intenziteta izazvanog efekta ili bola, navode se kao uginuća izazvana delovanjem supstance. Vrednost LC50 određuje se primenom jedne od standardnih metoda ispitivanja.
Procena podatka uključuje i potencijalnu povezanost između izloženosti životinje ispitivanoj supstanci i učestalosti pojave i težine uočenih abnormalnosti. Navode se i promene u ponašanju, kliničke promene, pojava većih oštećenja, promene telesne mase, smrtnost, kao i drugi toksični efekti.
3. IZVEŠTAJ O ISPITIVANJU
3.1. PISANJE IZVEŠTAJA
Izveštaj o ispitivanju, ako je moguće, sadrži podatke o:
1) Eksperimentalnoj životinji:
- vrsta, soj, izvor, uslovi smeštaja, ishrana itd.
2) Uslovima ispitivanja:
- opis aparature za inhalaciono izlaganje koja podrazumeva: dizajn, tip, dimenzije, izvor vazduha, sistem za stvaranje aerosola, metodu za kondicioniranje vazduha i način smeštaja životinja u komori kada se koristi. Opisuje se i aparatura za merenje temperature, vlažnosti, koncentracije aerosola i određivanje raspodele veličine čestica.
3) Izlaganju ispitivanoj supstanci:
Ovi podaci navode se tabelarno zajedno sa srednjim vrednostima i merama odstupanja (standardna devijacija), a, ako je moguće, uključuju i podatke o:
a) brzini protoka vazduha, opremi za inhalaciju;
b) temperaturi i vlažnosti vazduha;
v) nominalnoj koncentraciji (ukupnom sadržaju ispitivane supstance u opremi za inhalaciju, podeljenom sa zapreminom vazduha);
g) prirodi vehikuluma, ako je korišćen;
d) tačnoj koncentraciji supstance u zoni udisanja;
đ) prosečnom aerodinamičkom prečniku (The mass median aerodynamic diameter, MMAD) i geometrijskoj standardnoj devijaciji (The geometric standard deviation, GSD);
e) vremenu predviđenom za postizanje ravnoteže u komori;
ž) vremenu izlaganja;
4) Rezultatima:
- tabelarni prikaz podataka podeljenih prema polu i nivou izloženosti (broj mrtvih životinja ili životinja lišenih života na human način tokom trajanja ispitivanja; broj životinja koje su pokazale znake toksičnosti; broj izloženih životinja, itd);
- vreme smrti za vreme ili nakon izlaganja, razlozi i kriterijumi za usmrćivanje životinja na human način;
- sva opažanja;
- LC50 vrednosti za svaki pol određene na kraju perioda posmatranja (sa propisanom metodom izračunavanja);
- 95% interval pouzdanosti za LC50 vrednosti (gde je moguće);
- kriva zavisnosti doza/smrtnost i nagib (ukoliko to omogućava metoda određivanja);
- nalazi post-mortalnih pregleda;
- svi histopatološki nalazi;
- obrazloženje rezultata (posebna pažnja se posvećuje uticaju koje može imati lišavanje života životinja iz humanih razloga za vreme ispitivanja na izračunatu vrednost LC50);
- tumačenje rezultata.
3.2. PROCENA PODATAKA I TUMAČENJE REZULTATA
Videti Opšti uvod, Deo G.
4. LITERATURA
Videti opšti uvod, Deo D.
B.3. AKUTNA DERMALNA TOKSIČNOST
1. METODA ISPITIVANJA
1.1. UVOD
Videti opšti uvod, Deo A.
1.2. DEFINICIJE
Videti opšti uvod, Deo B.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Ispitivana supstanca primenjuje se na kožu kod više grupa životinja, u rastućim dozama, tako da se jednoj grupi životinja primenjuje jedna doza. Nakon toga posmatraju se efekti primenjenih doza i beleži broj uginulih životinja. Životinje koje uginu tokom ispitivanja post-mortalno se pregledaju. Na kraju ispitivanja i preživele životinje se lišavaju života na human način i post-mortalno pregledaju.
Životinje koje pokazuju izrazite znakove patnje i bola, lišavaju se života na human način. Izbegava se primena ispitivane supstance u koncentracijama za koje se pouzdano zna da će kod životinja izazvati znatan bol i patnju usled iritacije ili korozivnog efekta.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE
1.6.1. Priprema
Životinje se drže u eksperimentalnim kavezima i hrane se po definisanom eksperimentalnom režimu najmanje pet dana pre početka ispitivanja. Zdrave mlade životinje nasumce se dele u prethodno definisani broj grupa. Približno 24 sata pre početka ispitivanja životinjama se uklanja krzno brijanjem dorzalnog dela tela. Kod šišanja ili brijanja krzna potrebno je obratiti pažnju da se ne ozledi koža jer bi to moglo da utiče na njenu permeabilnost (propustljivost). Za primenu ispitivane supstance potrebno je da se pripremi najmanje 10% od ukupne površine kože životinje. Ako se ispituje čvrsta supstanca, koja se po potrebi može usitniti do praha, dobijeni prašak potrebno je dobro ovlažiti vodom ili nekim drugim vehikulomom kako bi se omogućio dobar kontakt sa kožom. Ako se koristi određeni vehikulum, uzima se u obzir i njegov uticaj na penetraciju (prodiranje) ispitivane supstance kroz kožu. Ispitivane supstance koje se već nalaze u tečnom obliku najčešće se koriste nerazblažene.
1.6.2. Uslovi ispitivanja
1.6.2.1. Eksperimentalne životinje
Za ispitivanje najčešće se koriste kunići ili pacovi. I druge vrste životinja mogu da se koriste ali to zahteva dodatno obrazloženje, budući da se preporučuju već ustaljene životinjske vrste. Na početku ispitivanja, opseg telesne mase životinja za svaki pol ne sme da prelazi ± 20% od odgovarajuće srednje vrednosti.
1.6.2.2. Broj i pol
Najmanje pet životinja koristi se za svaki dozni nivo. Sve životinje su istog pola. Ako se koriste ženke, ispitivanje se vrši na ženkama koje nisu ranije rađale i koje nisu gravidne. Ako postoje podaci na osnovu kojih je pokazano da je određeni pol osetljiviji kod ovakvih ispitivanja, koristi se taj pol.
Napomena: U ispitivanjima akutne toksičnosti na životinjama višeg reda od glodara, može da se razmotri i korišćenje manjeg broja životinja. Doze se pažljivo biraju, i ne koriste se doze veće od srednje toksičnih doza. U ovakvim ispitivanjima izbegavaju se letalne doze ispitivane supstance.
1.6.2.3. Dozni nivoi
Koristi se najmanje tri doze ispitivane supstance, a njihov izbor je takav da kod ispitivane grupe životinja izazove čitav opseg toksičnih efekata i smrtnost. Kod određivanja primenjenih doza, uzimaju se u obzir potencijalni iritativni i korozivni efekti. Vodi se računa i o količini dobijenih podataka kako bi se mogla konstruisati kriva doza/odgovor, a gde je to moguće, određuje se i vrednost LD50.
1.6.2.4. Ispitivanje granične doze
Ispitivanje granične doze pri jednom doznom nivou može da se izvodi primenom ispitivane supstance od 2.000 mg/kg TM na grupi od pet mužjaka i pet ženki, prema postupku koji je opisan u Metodi ispitivanja B.1bis., Deo prvi odeljak 1.5.3. Ako dođe do smrti usled primene navedene doze ispitivane supstance, razmatra se cela studija.
1.6.2.5. Period posmatranja
Period posmatranja traje najmanje 14 dana. Ovaj vremenski period nije strogo određen. Njega određuju, između ostalog, toksične reakcije, njihova učestalost, kao i vreme trajanja oporavka. Vreme posmatranja može da se produži. Važno je da se zabeleži vreme pojave ili nestanka prvih znakovi toksičnosti, kao i vreme smrti, pogotovo ako se primeti da je vreme smrti odloženo.
1.6.3. Postupak
Životinje se drže u kavezima za pojedinačno i odvojeno držanje. Ispitivana supstanca primenjuje se ravnomerno preko površine koja iznosi otprilike 10% od ukupne površine kože. Za primenu veoma toksičnih supstanci, izložena površina može da bude i manja, ali je u tom slučaju potrebno voditi računa da se primenjeni sloj ravnomerno rasporedi u što tanjem sloju.
Ispitivana supstanca drži se u kontaktu sa kožom tokom 24 sata pomoću porozne gaze na koju se nanosi, pri čemu se gaza ljepljivom trakom-flasterom prilepi na kožu životinje. Mesto primene dodatno se može prekriti kako bi se osiguralo da ispitivana supstanca ne dođe u kontakt sa ustima životinje. Ako je neophodno, na životinju se mogu staviti i dodatni štitnici kojima se sprečava peororalno unošenje ispitivane supstance. Ne preporučuje se potpuna imobilizacija životinje.
Nakon propisanog vremena izlaganja ispitivanoj supstanci, uklanja se višak ispitivane supstance ili vodom gde je to moguće ili nekim drugim odgovarajućim načinom za čišćenje kože.
Zapažanja se beleže sistematično. Za svaku životinju vodi se zasebni karton. Prvog dana zapažanja se češće beleže. Pažljivi klinički pregled životinje potrebno je uraditi najmanje jedanput svakog radnog dana, a preostala posmatranja beleže se svakodnevno uz preduzimanje odgovarajućih aktivnosti kojima se na najmanju meru svodi gubitak životinja iz studije. Na uginulim životinjama potrebno je uraditi pos-mortalni pregled ili se one odlažu na hlađenje, a životinje koje su izrazito slabe ili na samrti izdvajaju se iz grupe ili se lišavaju života na human način.
Beleže se promene na koži i krznu, očima, mukoznim membranama, respiratornom, cirkulatornom, autonomnom i centralnom nervnom sistemu, kao i somatomotorna aktivnost i način ponašanja. Posebna pažnja se posvećuje načinu disanja, tremoru, konvulzijama, salivaciji, prolivu, letargiji, pospanosti i komi kod životinja. Vreme smrti beleži se što preciznije. Životinje koje uginu za vreme ispitivanja i one koje ostanu žive do samog kraja post-mortalno se pregledaju. Sve značajnije patološke promene beleže. Kada postoje indikacije, uzimaju se i uzorci tkiva za histopatološka ispitivanja.
Procena toksičnosti kod suprotnog pola:
Po završetku studije u kojoj se koriste životinje samo jednog pola, ista doza ispitivane supstance primenjuje se na najmanje jednu grupu od pet životinja suprotnog pola da bi se utvrdilo da li suprotni pol pokazuje veću osetljivost pri primeni ispitivane supstance Može se razmotriti i korišćenje manjeg broja životinja, zavisno od okolnosti. Kada su dostupni odgovarajući podaci na osnovu kojih je pokazano da je pol životinja koje su odabrane u prvobitnom ispitivanju značajno osetljiviji na ispitivanu supstancu, izostavlja se ispitivanje na životinjama suprotnog pola.
2. PODACI
Podaci se navode tabelarno. Za svaku ispitivanu grupu životinja navodi se: broj životinja na početku ispitivanja, vreme smrti za svaku životinju, broj onih koje su pokazale znakove toksičnosti, opis toksičnih efekata i nalaze post-mortalnog pregleda. Individualna telesna masa životinja meri se i beleži neposredno pre primene ispitivane supstance, zatim jednom nedeljno, i u vreme smrti. Kada životinje prežive duže od jednog dana izračunavaju se i beleže promene u njihovoj telesnoj masi. Životinje koje se lišavaju života na human način, zbog intenziteta patnje ili bola, navode se kao uginuća izazvana delovanjem supstance. Vrednost LD50 određuje se jednom od standardnih metoda ispitivanja.
Procena podatka uključuje i potencijalnu povezanost između izloženosti životinje ispitivanoj supstanci i učestalosti pojave i težine uočene abnormalnosti. Navode se promene u ponašanju, kliničke promene, pojava većih oštećenja, promene telesne mase, smrtnost kao i drugi toksični efekti.
3. IZVEŠTAJ O ISPITIVANJU
3.1. PISANJE IZVEŠTAJA
Izveštaj o ispitivanju, ako je moguće, sadrži podatke o:
1) Eksperimentalnoj životinji:
- vrsta, soj, izvor, uslovi smeštaja, ishrana itd.
2) Uslovima ispitivanja:
- način korišćen za čišćenje kože i tip obloga; okluzivni ili ne-okluzivni;
- dozni nivoi (koncentracija vehikuluma, ako je korišćen);
- pol eksperimentalnih životinja;
3) Rezultatima:
- tabelarni prikaz podataka koji su podeljeni prema polu i doznim nivoima (broj uginulih ili životinja lišenih života na human način tokom trajanja ispitivanja; broj životinja koje su pokazale znakove toksičnosti; broj izloženih životinja, itd.);
- vreme smrti nakon izlaganja, uzroci i kriterijumi za lišavanje života na human način;
- sva posmatranja;
- vrednost LD50 za onaj pol životinja koji je korišćen u ispitivanju, određen nakon 14 dana primenom propisane metode ispitivanja;
- 95% interval pouzdanosti za LD50 vrednosti (kada je moguće);
- kriva zavisnosti doza/smrtnost i nagib (kada metoda omogućava njeno konstruisanje);
- nalazi post-mortalnog pregleda;
- histopatološki nalazi;
- obrazloženje rezultata (posebna pažnja se posvećuje uticaju koje lišavanje života na human način za vreme ispitivanja može da ima na izračunatu vrednost LD50);
- tumačenje rezultata.
3.2. PROCENA PODATAKA I TUMAČENJE REZULTATA
Videti Opšti uvod, Deo G.
4. LITERATURA
Videti Opšti uvod, Deo D.
B.4. AKUTNA TOKSIČNOST: IRITACIJA/KOROZIVNO OŠTEĆENJE KOŽE
Deo prvi
1. METODA ISPITIVANJA
Ova metoda zasniva se na Uputstvu za ispitivanje OECD 404 (2002).
1.1. UVOD
U pripremi ažurirane verzije ove metode ispitivanja, posebna pažnja posvećena je mogućim poboljšanjima u odnosu na dobrobit životinja, kao i proceni svih postojećih podataka o ispitivanoj supstanci, sa ciljem da se izbegnu nepotrebna ispitivanja na životinjama. Metoda ispitivanja zasniva se na preporuci da se pre in vivo ispitivanja iritativnog ili korozivnog efekta supstance obavi analiza kvaliteta postojećih podataka. Kada nema dovoljno podataka, moguće ih je dobiti primenom ispitivanja korak po korak1. Strategija ispitivanja uključuje i izvođenje validiranih i prihvaćenih in vitro ili ex vivo ispitivanja koja su opisana u Delu trećem ove metode. Kada je prihvatljivo u inicijalnom in vivo ispitivanju, preporučuje se sukcesivna (jedan za drugim), a ne istovremena, primena tri "patch" testa na životinju.
U interesu naučne zasnovanosti i dobrobiti životinja jeste da se in vivo ispitivanja započinju tek nakon analize kvaliteta svih dostupnih podataka koji su relevantni za procenu potencijala supstance da izazove iritaciju/korozivno oštećenje. Takvi podaci obuhvataju: dokaze na osnovu nalaza kod ljudi odnosno iz prethodno sprovedenih studija na laboratorijskim životinjama, dokaze o efektima iritacije/korozivnog oštećenja za jednu ili više strukturno sličnih supstanci ili smeša takvih supstanci, podatke koji ukazuju na jaku kiselost ili baznost ispitivane supstance2, 3, ili podatke iz prethodno validiranih i prihvaćenih in vitro ili ex vivo ispitivanja4, 5, 5a. Ovakva analiza smanjiće potrebu za in vivo ispitivanjima iritacije/korozivnog oštećenja kože za one supstance za koje postoji dovoljno indirektnih dokaza na tom polju.
U Delu trećem ove metode opisana je strategija ispitivanja korak po korak koja uključuje i obavljanje validiranih i prihvaćenih in vitro ili ex vivo ispitivanja iritacije/korozivnog oštećenja kože. Strategiju su razvili, kao jedinstveno prihvaćenu i preporučenu, članovi radne grupe OECD6, a prihvaćena je i uvršćena u preporučene strategije ispitivanja od strane Globalno harmonizovanog sistema za klasifikaciju i obeležavanje (u daljem tekstu: GHS)7. Preporučuje se praćenje ove strategije pre preduzimanja bilo kakvih in vivo ispitivanja. Za nove supstance koje još nisu bile ispitivane za prikupljanje podataka o njihovim iritativnim/korozivnim efektima za kožu preporučen je pristup ispitivanja "korak po korak". Za supstance koje su već uključene u ispitivanja, ista strategija se primenjuje za upotpunjavanje podataka o iritativnim/korozivnim efektima za kožu. Ukoliko se primeni drugačija strategija ispitivanja ili postupka, ili se odluči da se ne primeni ova metoda ispitivanja, potrebno je objasniti i obrazložiti razloge ovakve odluke.
Ako se određivanje iritativnih/korozivnih efekata ispitivane supstance na koži ne može utvrditi na osnovu analize kvaliteta postojećih podataka, u skladu sa strategijom ispitivanja korak po korak, potrebno je razmotriti obavljanje in vivo ispitivanja (videti Deo treći ove metode).
1.2. DEFINICIJE
Iritacija kože jeste nastanak reverzibilnih oštećenja kože koja prate primenu ispitivane supstance nakon izlaganja u trajanju od 4 sata.
Korozivno oštećenje kože jeste nastanak ireverzibilnih oštećenja kože odnosno vidljive nekroze u epidermisu i dermisu nakon četvoročasovne primene ispitivane supstance. Korozivno oštećenje kože karakteriše se prema tipu izazvanog oštećenja kao: ulkus, krvarenje ili krvave kraste i na kraju perioda posmatranja od 14 dana prema promeni boje kože uslovljene perutanjem i pojavi površina sa alopecijom i ožiljnog tkiva. U cilju procene nejasnih oštećenja obavljaju se histopatološka ispitivanja.
1.3. PRINCIP METODE
Ispitivana supstanca primenjuje se u jednoj dozi na kožu eksperimentalne životinje, a netretirani delovi kože služe kao kontrola. Stepen iritativnih/korozivnih efekta na koži očitava se i ocenjuje u prethodno utvrđenim vremenskim intervalima, pri čemu se dodatno svaki efekat pojedinačno opisuje kako bi se dobila kompletna procena štetnih efekata. Studija traje dovoljno dugo, da bi mogli da se donesu zaključci o reverzibilnosti ili ireverzibilnosti zabeleženih štetnih efekata.
Životinje koje u bilo kom delu ispitivanja pokazuju stalne znakove patnje ili bola, lišavaju se života na human način, a supstanca se procenjuje u skladu sa tim. Kriterijumi za donošenje odluke o lišavanju života na human način onih životinja koje su na samrti i pokazuju znake izrazite patnje, opisani su u literaturi8.
1.4. OPIS METODE
1.4.1. Priprema za in vivo ispitivanje
1.4.1.1. Izbor životinjske vrste
Preporučuje se korišćenje zdravih mladih jedinki albino kunića. Ukoliko se koristi druga životinjska vrsta, navode se razlozi za ovo korišćenje.
1.4.1.2. Priprema životinja
Približno 24 sata pre početka ispitivanja životinjama se uklanja krzno brijanjem dorzalnog dela tela. Kod brijanja krzna, potrebno je obratiti pažnju da se ne povredi koža jer se za ispitivanje koristite isključivo one životinje čija je koža neoštećena (intaktna).
Neke vrste kunića imaju gusto krzno na pojedinim delovima kože, zavisno od godišnjeg doba. Ispitivanje se ne vrši na ovim površinama kože.
1.4.1.3. Uslovi smeštaja životinja i ishrana
Životinje se smeštaju u odgovarajući smeštaj za pojedinačno i odvojeno držanje. Temperatura smeštajnog prostora u kome se drže kunići održava se na 20° C (± 3° C). Relativna vlažnost vazduha je najmanje 30% i da ne prelazi 70% (osim u slučajevima kada se prostorija sa životinjama čisti). Idealna vlažnost je između 50% i 60%. Osvetljenje je veštačko i to u intervalima od 12 sati svetla i 12 sati mraka. Životinje se hrane uobičajenom hranom za laboratorijske životinje, sa slobodnim pristupom vodi za piće.
1.4.2. Postupak
1.4.2.1. Primena ispitivane supstance
Ispitivana supstanca nanosi se na malu površinu kože (otprilike 6 cm2) i prekriva gazom koja se fiksira pomoću flastera. U slučajevima kad direktno nanošenje nije moguće (npr. kod tečnosti ili nekih pasta), ispitivana supstanca se prvo nanosi na gazu, a zatim se gaza postavlja na kožu. Obloga od gaze je u laganom kontaktu s kožom, tako da bude polu zatvorena (semi-okluzivna) tokom perioda izlaganja. Ako se ispitivana supstanca nanosi na oblogu, a ne direktno na kožu, obloga se fiksira na kožu tako da se ostvari dobar kontakt i da se supstanca ravnomerno raspodeli po površini kože. Potrebno je onemogućiti pristup životinje oblozi, kao i inhalaciju ili dovođenje u kontakt sa ustima životinje (ingestiju) ispitivane supstance.
Ispitivane supstance koje se nalaze u tečnom stanju, najčešće se koriste nerazblažene. Ako se ispituje čvrsta supstanca, koja se po potrebi može usitniti do praha, dobijeni prašak potrebno je dobro ovlažiti u što manjoj zapremini vode ili nekom drugom vehikulumu kako bi se omogućio dobar kontakt sa kožom. Ako se koristi vehikulum koje nije voda, mogući uticaj tog vehikuluma na iritaciju kože svodi se na najmanju meru.
Nakon izlaganja, koje uobičajeno traje četiri sata, višak ispitivane supstance ispira se vodom ili se uklanja pomoću odgovarajućeg sredstva, bez promene efekata na koži i integriteta epidermisa.
1.4.2.2. Dozni nivo
Na pripremljeni deo kože nanosi se 0,5 mL tečne supstance ili 0,5 g čvrste supstance ili supstance u obliku paste.
1.4.2.3. Inicijalno ispitivanje
(in vivo ispitivanje iritacije/korozivnog oštećenja kože na jednoj životinji)
Stroga je preporuka da se in vivo ispitivanje inicijalno izvodi samo na jednoj životinji, naročito ako se sumnja da bi ispitivana supstanca mogla da izazove korozivno oštećenje kože. Ova preporuka je u skladu sa strategijom ispitivanja korak po korak iz Dela trećeg ove metode. Kada je na osnovu analize kvaliteta podataka doneta stručna procena da je ispitivana supstanca korozivna, nisu neophodna dalja ispitivanja na životinjama. Za većinu supstanci za koje se sumnja da izazivaju korozivno oštećenje kože ne smatraju se neophodnim dalja in vivo ispitivanja. U slučajevima kada nema dovoljno dokaza, potrebni su dodatni podaci, pri čemu se obavljaju ispitivanja granične doze korišćenjem sledećeg pristupa: najviše tri obloge se jedna za drugom (uzastopno) nanose na kožu životinje. Prva obloga se uklanja nakon tri minuta i ako se pri tome ne uoči jaka reakcija na koži, nanosi se i druga obloga koja se uklanja nakon jednog sata. Ako uočene promene u ovoj fazi ukazuju da se izlaganje ispitivanoj supstanci može proširiti na četiri sata, nanosi se i treća obloga koja se uklanja nakon četiri sata, a dobijeni nalaz se ocenjuje.
Ako se uoči korozivno oštećenje kože nakon bilo kog od tri uzastopna izlaganja ispitivanoj supstanci, ispitivanje se nakon tog izlaganja prekida. Ako ne dođe do pojave oštećenja na koži nakon što se ukloni i zadnja obloga, životinju je potrebno posmatrati još 14 dana, osim ukoliko ranije dođe do pojave korozivnog oštećenja.
U slučajevima kada se ne očekuje da će ispitivana supstanca dovesti do korozivnog oštećenja kože, ali se pretpostavlja da će izazvati iritaciju, dovoljno je primeniti oblogu na jednu životinju u trajanju od četiri sata.
1.4.2.4. Ispitivanje kojim se potvrđuje
(in vivo ispitivanje iritacije kože na dodatnim životinjama)
Ako se u inicijalnom ispitivanju ne uoči korozivno oštećenje, iritacija ili negativni nalaz kože potrebno je, radi potvrde, sprovesti ispitivanje na još dve dodatne životinje. Na svaku dodatnu životinju primenjuje se jedna obloga tokom perioda izlaganja u trajanju od četiri sata. Ako se u inicijalnom ispitivanju uoči iritacija kože, ispitivanje kojim se potvrđuje izvodi se po fazama ili istovremenim izlaganjem još dve dodatne životinje. U izuzetnom slučaju u kome se inicijalno ispitivanje ne izvodi, dve ili tri životinje mogu se tretirati po jednom oblogom koja se uklanja nakon četiri sata. Ako se koriste dve životinje i kod njih dođe do identičnih nalaza, nije neophodno dalje ispitivanje. U suprotnom, potrebno je i treću životinju uključiti u ispitivanje. Sumnjive (dvosmislene) nalaze ponekad je potrebno potvrditi ispitivanjima na dodatnim životinjama.
1.4.2.5. Period posmatranja
Period posmatranja mora da bude dovoljno dug kako bi se u potpunosti odredila reverzibilnost uočenih efekata. Eksperiment se prekida u bilo kom trenutku ako životinja pokazuje neprekidne znakove jakog bola ili patnje. Da bi se odredila reverzibilnost efekata, potrebno je posmatrati životinje nakon uklanjanja obloge i to do 14 dana. Ako se reverzibilnost uoči pre 14 dana, eksperiment se prekida.
1.4.2.6. Klinička posmatranja i ocenjivanje reakcija na koži
Kod svih životinje potrebno je ispitati znakove eritema ili edema na koži i oceniti nalaz i to nakon 60 minuta, i kasnije: 24 sata, 48 sati i 72 sata nakon uklanjanja obloge. Kod inicijalnog ispitivanja na jednoj životinji, samo mesto ispitivanja na koži potrebno je pregledati neposredno nakon uklanjanja obloge. Reakcije na koži ocenjuju se i opisuju prema ocenama navedenim u Tabeli. Ako na koži postoji oštećenje koje ne može da se definiše kao iritacija ili korozivno oštećenje nakon 72 sata, posmatranje se produžava do 14 dana kako bi se odredila reverzibilnost efekata. Osim posmatranja iritacije kože, beleže se i opisuju i svi lokalni toksični efekti, poput sušenja kože kao i sistemski štetni efekti (npr. klinički znakovi toksičnosti ili promene u telesnoj masi). U slučaju nejasnih nalaza obavljaju se histopatološka ispitivanja.
Ocenjivanje nalaza kože po svojoj prirodi je subjektivno. Kako bi se podstaklo da ocenjivanje bude usklađeno među različitim laboratorijama, potrebno je osoblje laboratorija adekvatno obučiti za ocenjivanje (videti Tabelu). Dostupan je i ilustrovani vodič za ocenjivanje iritacije kože i drugih lezija9.
2. PODACI
2.1. NAVOĐENJE REZULTATA
Rezultati ispitivanja navode se tabelarno u završnom izveštaju. Rezultati sadrže sve podatke navedene u odeljku 3.1. ove metode.
2.2. TUMAČENJE REZULTATA
Ocena iritacije kože sprovodi se u saglasnosti sa prirodom i težinom oštećenja/lezija na koži, kao i sa njihovom reverzibilnošću ili ireverzibilnošću. Pojedinačne ocene same za sebe ne ukazuju na iritativno svojstvo ispitivane hemikalije, budući da se procenjuju i ostali efekti. Pojedinačne ocene se imaju u vidu kao preporuka, i značajne su samo ukoliko su podržane potpunim opisom i procenom svih uočenih efekata.
Kod procene iritativnog odgovora potrebno je razmotriti reverzibilnost oštećenja na koži. Ispitivana supstanca može se smatrati iritativnom kada su nalazi poput alopecije (na ograničenoj površini), hiperkeratoze, hiperplazije ili deskvamacije prisutni sve do kraja perioda posmatranja od 14 dana.
3. IZVEŠTAJ O ISPITIVANJU
PISANJE IZVEŠTAJA
Izveštaj o ispitivanju sadrži podatke o:
1) Razlozima za izvođenje in vivo ispitivanja:
- analizu kvaliteta postojećih podataka, uključujući rezultate dobijene strategijom ispitivanja korak po korak;
- opis relevantnih podataka dobijenih iz prethodnih ispitivanja;
- podatke iz svakog pojedinačnog koraka strategije ispitivanja;
- opis izvedenih in vitro ispitivanja, koji uključuju detalje o postupku i rezultate dobijene za ispitivanu/referentnu supstancu;
- analizu kvaliteta podataka za izvođenje in vivo studije.
2) Ispitivanoj supstanci:
- identifikacioni podaci (npr. CAS broj; poreklo, stepen čistoće, poznate nečistoće, broj serije);
- fizičko stanje i fizička i hemijska svojstva (npr. pH, isparljivost, rastvorljivost, stabilnost);
- kod smeše: sastav i relativni procenti sastojaka.
3) Vehikulumu:
- identifikacija, koncentracija (po potrebi), zapremina koja se koristi;
- opravdanost izbora vehikuluma.
4) Eksperimentalnim životinjama:
- vrsta/soj, razlog korišćenja druge vrste, a ne albino kunića;
- broj životinja svakog pola;
- telesna masa pojedinačnih životinja na početku i kraju ispitivanja;
- starost na početku ispitivanja;
- izvor životinja, uslovi smeštaja, ishrana itd.
5) Uslovima ispitivanja:
- način pripreme kože na mestu gde se stavlja obloga;
- detalji o korišćenim materijalima za oblogu, kao i način nanošenja obloge;
- detalji o pripremi ispitivane supstance, primeni i uklanjanju.
6) Rezultatima:
- tabelarni prikaz ocene nalaza iritacije/korozivnog oštećenja kože za svaku životinju pri svakom vremenu posmatranja;
- opisi svih uočenih lezija;
- detaljan opis prirode i stepena iritacije ili korozivnog oštećenja kože, kao i histopatološki nalazi;
- opis svih drugih lokalnih štetnih efekata (npr. obezmašćivanje kože/sušenje) kao i sistemskih efekata.
- tumačenje rezultata.
4. LITERATURA
1. Barratt, M.D., Castell, J.V., Chamberlain, M., Combes, R.D., Dearden, J.C., Fentem, J.H., Gerner, I., Giuliani, A., Gray, T.J.B., Livingston, D.J., Provan, W.M., Rutten, F.A.J.J.L., Verhaar, H.J.M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, 410 - 429.
2. Young, J.R., How, M.J., Walker, A.P., Worth W.M.H. (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicol. In vitro, 2, 19 - 26.
3. Worth, A.P., Fentem, J.H., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Liebsch, M. (1998) Evaluation of the proposed OECD Testing Strategy for skin corrosion. ATLA 26, 709-720.
4. ECETOC (1990) Monograph No. 15, "Skin Irritation", European Chemical Industry, Ecology and Toxicology Centre, Brussels.
5. Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsail, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology in vitro 12, pp.483 - 524.
5a. Testing Method B.40 Skin Corrosion.
6. OECD (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22 - 24 January 1996 (http://www.oecd1.org/ehs/test/background.htm).
7. OECD (1998) Harmonized Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd1.org/ehs/Class/HCL6.htm).
8. OECD (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 19 (http://www.oecd1.org/ehs/test/monos.htm).
9. EPA (1990) Atlas of Dermal Lesions, (20T-2004). United States Environmental Protection Agency, Office of Pesticides and Toxic Substances, Washington, DC, August 1990 (Dostupno na zahtev od sekreterijata OECD)
Deo drugi
OCENJIVANJE REAKCIJA NA KOŽI
Nastanak eritema i eshare
Nema eritema |
0 |
Veoma slab eritem (jedva vidljiv) |
1 |
Dobro definisan eritem |
2 |
Srednje izražen do jak eritem |
3 |
Jak eritem (crvenilo) uz nastanak eshare |
|
koja sprečava ocenu eritema |
4 |
Maksimalna ocena: |
4 |
Nastanak edema |
|
Nema edema |
0 |
Veoma slab edem (jedva vidljiv) |
1 |
Slab edem (jasno ograničen) |
2 |
Srednje izražen edem (uzdignut približno 1 mm) |
3 |
Jak edem (uzdignut iznad 1 mm i proširen |
|
i na površinu koja nije bila izložena supstanci) |
4 |
Maksimalna ocena: |
4 |
U slučaju nejasnih nalaza potrebno je obaviti histopatološka ispitivanja.
Deo treći
STRATEGIJA ISPITIVANJA IRITACIJE I KOROZIVNOG OŠTEĆENJA KOŽE KORAK PO KORAK
1. OPŠTA RAZMATRANJA
U interesu naučne zasnovanosti i zbog dobrobiti životinja važno je izbegavati nepotrebno korišćenje životinja ili ispitivanja koja će kod životinja verovatno izazvati jak odgovor. Pre in vivo ispitivanja iritacije/korozivnog oštećenja potrebno je proceniti sve postojeće podatke koji se odnose na potencijal ispitivane supstance da izazove iritaciju /korozivno oštećenje. Ispitivanje na laboratorijskim životinjama može da se izbegne ako postoji dovoljno podataka i dokaza za klasifikaciju određene supstance u odnosu na potencijal da izazove iritaciju/korozivno oštećenje. Na osnovu analize kvaliteta podataka i strategije ispitivanja korak po korak smanjiće se potreba za in vivo ispitivanjima, naročito ako se sumnja na mogućnost da će ispitivana supstanca izazvati intenzivne reakcije na koži.
Analiza kvaliteta podataka koristi se za procenu postojećih podataka o iritaciji/korozivnom oštećenju kože koje izaziva ispitivana supstanca i da bi se utvrdilo da li se osim in vivo studija na koži, izvode i dodatna ispitivanja koja bi doprinela da se bolje opiše ovaj potencijal ispitivane supstance. Kada se pokaže potreba za dodatnim ispitivanjima, za prikupljanje novih, relevantnih eksperimentalnih podatka preporučuje se primena strategije ispitivanja korak po korak. Za supstance koje prethodno nisu ispitivane, takođe je potrebno primeniti strategiju ispitivanja korak po korak za određivanje njenih efekata na koži. Strategiju ispitivanja opisanu u ovom Delu razvili su članovi radne grupe OECD1, a ista je kasnija potvrđena i proširena u sklopu Globalno harmonizovanog sistema za klasifikaciju i obeležavanje u odnosu na efekte po zdravlje ljudi i na životnu sredinu, na 28-om zajedničkom Simpozijumu hemijske komisije i radne grupe za hemiju, u novembru 1998. godine2.
Iako strategija ispitivanja korak po korak nije sastavni deo metode ispitivanja B.4. koja je data u ovom Delu, ona odražava preporučeni pristup za određivanje svojstava supstanci na osnovu iritativnih/korozivnih efekata na koži. Ova metoda ispitivanja predstavlja, sa aspekta etike i prakse, najbolji pristup za in vivo ispitivanja iritacije/korozivnog oštećenja na koži. Metoda ispitivanja služi kao uputstvo za izvođenje in vivo ispitivanja i zbraja faktore koje je potrebno sagledati pre početka ispitivanja na životinjama. Strategija takođe daje preporuku za procenu postojećih podataka o ispitivanoj supstanci, kao i način na koji je potrebno prikupiti nove podatke za supstance za koje su potrebna dodatna ispitivanja ili za supstance za koje nikakva ispitivanja nisu prethodno sprovedena. Pod određenim okolnostima, preporučuje se i izvođenje validiranih i prihvaćenih in vitro ili ex vivo ispitivanja iritativnih/korozivnih efekata na koži.
2. OPIS STRATEGIJE ISPITIVANJA I PROCENE
Pre početka ispitivanja, kao deo strategije ispitivanja korak po korak (videti Sliku), procenjuju se svi dostupni podaci kako bi se odredila potreba za in vivo ispitivanjima na koži. Iako je značajne podatke moguće dobiti procenom jednog parametara (npr. visoki pH), za donošenje konačne odluke o ispitivanjima razmatraju se i svi drugi dostupni podaci, kao što su štetni efekti ispitivane supstance ili njenih analoga. Na kraju je potrebno izneti i objašnjenje za donetu odluku. Akcenat je na postojećim podacima o ispitivanoj supstanci dobijenim iz nalaza kod ljudi i ispitivanja na životinjama, i na ishodu in vitro ili ex vivo ispitivanja. Gde god je moguće izbegava se in vivo studije korozivnih supstanci za koje se unapred zna da su štetne. Faktori koji se uzimaju u obzir u strategiji ispitivanja uključuju:
Procenu postojećih podataka studija dobijenih na osnovu nalaza kod ljudi i podataka iz ispitivanja na životinjama (korak 1). Prvo se razmatraju postojeći podaci na osnovu nalaza kod ljudi npr. kliničke studije, studije nakon profesionalne izloženosti, prikazi slučaja; odnosno iz studija na životinjama npr. podaci iz ispitivanja sa jednom ili ponovljenim dozama, budući da se dobijaju podaci koji su direktno povezani sa efektima na koži. Nije potrebno ispitivati in vivo supstance za koje se pouzdano zna da izazivaju iritaciju/korozivno oštećenje kože, kao i one za koje postoje dokazi da nemaju takve efekte.
Analizu odnosa strukture i aktivnosti (u daljem tekstu: SAR) (korak 2). Razmatraju se rezultati ispitivanja strukturno sličnih supstanci, ako takve postoje. Kada dovoljno dostupnih podataka o strukturno sličnim supstancama/smešama tih supstanci ukazuju na njihov potencijal za iritaciju/korozivni efekat, može se pretpostaviti da će ispitivana supstanca u sličnim studijama dati slične nalaze. U takvim slučajevima, supstancu nije potrebno dodatno ispitivati. Negativni rezultati, odnosno podaci koji ukazuju na izostanak ovakvih efekata, iz studije na strukturno sličnim supstancama ili smešama takvih supstanci, ne predstavljaju dovoljno čvrst dokaz o neškodljivosti supstance koja je u postupku analize. Validirani i prihvaćeni SAR pristup koristi se kako bi se identifikovao potencijal za iritativni i korozivni efekat ispitivane supstance.
Fizička i hemijska svojstva i hemijsku reaktivnost (korak 3). Supstance koje imaju ekstremne pH vrednosti kao ≤ 2,0 i ≥ 11,5 mogu imati izražene lokalne efekte. Ako je ekstremni pH osnova za ocenjivanje potencijala supstance da izazove korozivno oštećenje kože, razmatra se i njena kiselo-bazna rezerva (ili puferski kapacitet)3, 4. Ako puferski kapacitet ukazuje na to da supstanca ne izaziva korozivno oštećenje kože, neophodno je obaviti dodatna ispitivanja kako bi se potvrdila ova pretpostavka, i to po mogućstvu primenom validiranih i prihvaćenih in vitro ili ex vivo ispitivanja (videti korake 5 i 6).
Dermalnu toksičnost (korak 4). Ako se pokazalo da je hemikalija veoma toksična nakon dermalne primene, ne preporučuje se in vivo ispitivanje iritacije/korozivnog oštećenja, budući da će količina ispitivane supstance koja se uobičajeno primenjuje premašiti onu veoma toksičnu dozu, i dovesti do uginuća ili izrazite patnje životinja. Nisu potrebna dodatna ispitivanja ako prethodno izvedena ispitivanja na albino kunićima primenom doze od 2.000 mg/kg TM ili veće nisu pokazala nikakve štetne efekte na koži. Kod procene akutne dermalne toksičnosti potrebno je imati na umu nekoliko stvari: na primer, beleške o lezijama na koži mogu biti nepotpune. Ispitivanja i opažanja mogu biti obavljena na drugoj vrsti, a ne na kunićima, a druge životinjske vrste mogu bitno da se razlikuju po osetljivosti odgovora. Oblik u kojem je ispitivana supstanca primenjena na kožu možda nije odgovarajući za određivanje iritacije/korozivnog oštećenja kože (npr. razblaživanje supstance kod ispitivanja dermalne toksičnosti5). U slučajevima kada su obavljena dobro osmišljena ispitivanja dermalne toksičnosti na koži kunića, negativni nalazi mogu da se smatraju dovoljno čvrstim dokazom da ispitivana supstanca ne izaziva iritaciju/korozivno oštećenje kože.
Rezultate in vitro ili ex vivo ispitivanja (koraci 5 i 6). Ispitivanje na životinjama nije potrebno vršiti za supstance koje su pokazale korozivno ili jako iritativno svojstvo u in vitro ili ex vivo ispitivanjima6, 7 koja su validirana i prihvaćena upravo za procenu ovih specifičnih efekata, već se može pretpostaviti da će ove supstance dovesti do sličnih efekata i in vivo.
In vivo ispitivanja na kunićima (koraci 7 i 8). Ako se nakon procene kvaliteta postojećih podataka ipak donese odluka da se izvodi in vivo ispitivanje, inicijalno ispitivanje se započinje samo na jednoj životinji. Ako na toj životinji supstanca izazove korozivno oštećenje kože, obustavljaju se dalja ispitivanja. Ako ne dođe do korozivnog oštećenja kože u inicijalnom ispitivanju, potrebno je da se iritativni ili negativni nalaz dodatno potvrdi na još dve eksperimentalne životinje i to za vreme izlaganja u trajanju od četiri sata. Ako se uoči efekat iritacije u inicijalnom ispitivanju, može da se obavi ispitivanje kojim se potvrđuje i to korak po korak, ili istovremenim izlaganjem dve dodatne životinje.
3. LITERATURA
1. OECD, (1996) Test Guidelines Programme: Final Report on the OECDWorkshop on Harmonisation of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held on Solna, Sweden, 22-24 January 1996 (http://www1.oecd.org/ehs/test/background.htm).
2. OECD, (1998) Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www1.oecd.org/ehs/Class/HCL6.htm).
3. Worth, A.P., Fentem J.H., Balls M., Botham P.A., Curren R.D., Earl L.K., Esdaile D.J., Liebsch M., (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26, p. 709-720.
4. Young, J.R., How, M.J., Walker, A.P., Worth, W.M.H., (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substances, Without Testing on Animals. Toxicology In vitro, 2(1), p. 19-26.
5. Patil, S.M., Patrick, E., Maibach, H.I. (1996) Animal, Human, and In vitro Test Methods for Predicting Skin Irritation, in: Francis N. Marzulli and Howard I. Maibach (editors): Dermatotoxicology. Fifth Edition ISBN 1-56032-356-6, Chapter 31, p. 411-436.
6. Testing Method B.40.
7. Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology In vitro 12, p. 483-524.
Deo četvrti
ISPITIVANJE I STRATEGIJA PROCENE ZA IRITACIJU/KOROZIVNO OŠTEĆENJE KOŽE
|
Aktivnost |
Nalaz |
Zaključak |
|
1 |
Postojeći podaci dobijeni na osnovu ispitivanja kod ljudi/životinja koji pokazuju efekte na koži ili sluzokoži |
Korozija |
Supstanca je korozivna. |
|
Iritatacija |
Supstanca je iritativna. |
|||
Nema korozije/iritacije |
Suptanca nije iritativna/korozivna. |
|||
|
¯ |
|
|
|
|
Nema dostupnih podataka, ili su dostupni podaci neadekvatni |
|
|
|
|
¯ |
|
|
|
2 |
Izvršiti SAR procenu za iritaciju/korozivno oštećenja koža |
Predviđa se teško oštećenje kože |
Supstanca je korozivna: |
|
Predviđa se iritacija kože |
Supstanca je iritativna. |
|||
|
¯ |
|
|
|
|
Nije moguće predvideti ili su predviđanja negativna i nejasna |
|
|
|
|
¯ |
|
|
|
3 |
Odrediti pH (po potrebi, razmotriti puferski kapacitet) |
pH³2 ili ³ 11,5 (sa visokim puferskim kapacitetom, po potrebi) |
Pretpostavlja se da je supstanca korozivna. Dalja ispitivanja nisu potrebna |
|
|
¯ |
|
|
|
|
2 <pH < 11,5, ili pH £ 2.0 ili ³ 11.5 sa malim / bez puferskog kapaciteta, po potrebi |
|
|
|
|
¯ |
|
|
|
4 |
Proceniti podatke koje se odnose na sistemsku toksičnost putem primene na kožu (1) |
Veoma toskično |
Dalja ispitivanja nisu potrebna |
|
Nema korozivnog oštećenja/iritacije pri ispitivanju granične doze od 2000 mg/kg TM ili veće, kod kunića |
Smatra se da supstanca nije iritativna/korozivna. |
|||
|
¯ |
|
|
|
|
Podaci nisu dostupni ili se smatraju neadekvatnim za izvođenje zaključaka |
|
|
|
|
¯ |
|
|
|
5 |
Izvršiti validirana i prihvaćena in vitro ili ex vivo ispitivanja korozivnog oštećenja kože |
Korozivno za kožu |
Pretpostavlja se korozivno oštećenje in vivo ispitivanjima. |
|
|
Dalja ispitivanja nisu potrebna. |
|||
|
¯ |
|
|
|
|
Supstanca ne dovodi do korozivnog oštećenja |
|
|
|
|
¯ |
|
|
|
6 |
Izvršiti validirana i prihvaćena in vitro ili ex vivo ispitivanja iritacije kože. |
Iritativno za kožu |
Pretpostavlja se iritacija in vivo ispitivanjima. Pretpostavlja se korozivno oštećenje in vivo ispitivanjima |
|
|
¯ |
|
|
|
|
Validirane in vitro ili ex vivo metode ispitivanja iritacije kože još nisu razvijene ili supstanca nema iritativni efekat |
|
|
|
|
¯ |
|
|
|
7 |
Izvršiti inicijalno in vivo ispitivanje na jednom kuniću |
Teško oštećenje kože |
Supstanca je korozivna. |
|
|
¯ |
|
|
|
|
Nema teških oštećenja |
|
|
|
|
¯ |
|
|
|
8 |
Obaviti na jednoj ili dve dodatne životinje |
Korozivno ili iritativno |
Supstanca je korozivna ili iritativna. |
|
Nije korozivno ili iritantno |
Supstanca nije korozivna ili iritativna. |
|||
|
Dalja ispitivanja nisu potrebna |
|||
__________ |
||||
B.5. AKUTNA TOKSIČNOST:
IRITACIJA/TEŠKO OŠTEĆENJE OKA
Deo prvi
1. METODA ISPITIVANJA
Ova metoda zasniva se na Uputstvu za ispitivanje OECD 405 (2002).
1.1. UVOD
U pripremi ažurirane verzije ove metode ispitivanja posebna pažnja posvećena je mogućim poboljšanjima u odnosu na dobrobit životinja, kao i na procenu svih postojećih podataka o ispitivanoj supstanci, sa ciljem da se izbegnu nepotrebna ispitivanja na životinjama. Metoda ispitivanja zasniva se na preporuci da se pre in vivo ispitivanja akutnog iritativnog/korozivnog oštećenje oka obavi analiza kvaliteta postojećih podataka1. Kada nema dovoljno podataka, moguće je dobiti ih primenom ispitivanja korak po korak2, 3. Strategija ispitivanja uključuje i obavljanje validiranih i prihvaćenih in vitro ili ex vivo ispitivanja koja su opisana u Delu trećem ove metode. Pre izvođenja in vivo ispitivanja oka preporučuje se korišćenje in vivo ispitivanja iritacije/korozivnog oštećenja kože koja mogu da predvide iritaciju oka.
U interesu naučne zasnovanosti i dobrobiti životinja jeste da se in vivo studije započinju nakon procene svih dostupnih podataka koji su relevantni za procenu potencijala supstance da izazove iritaciju/teško oštećenje oka. Takvi podaci proizlaze iz prethodno dobijenih nalaza kod ljudi odnosno sprovedenih ispitivanja na laboratorijskim životinjama, iz dokaza o iritaciji /korozivnom oštećenju jedne ili više strukturno sličnih supstanci ili smeša takvih supstanci, ali i iz podataka koji ukazuju na jaku kiselost ili baznost ispitivane supstance4, 5, ili iz prethodno već validiranih i prihvaćenih in vitro ili ex vivo ispitivanja iritacije/korozivnog oštećenja kože6, 6a. Studije mogu da budu sprovedene ranije ili da nastanu kao rezultat analize kvaliteta postojećih podataka.
Za neke supstance analiza može da ukaže na potrebu za in vivo ispitivanjima potencijala supstance za iritaciju/teškog oštećenja oka. U svim takvim slučajevima, pre in vivo ispitivanja efekata na oku, preporučuje se in vivo ispitivanje efekata na koži u skladu sa metodom ispitivanja B.4. koja je data u ovom Delu7. Primena analize kvaliteta postojećih podataka i studije ispitivanja korak po korak smanjuje potrebu za in vivo ispitivanjima iritacije/teškog oštećenja oka za supstance za koje postoje dovoljno podataka iz drugih studija. Ako potencijal supstance da izazove iritaciju/teško oštećenje oka ne može da se odredi korišćenjem metode ispitivanja korak po korak čak ni nakon ispitivanja iritacije/korozivnog oštećenja kože, pristupa se in vivo ispitivanju iritacije/teškog oštećenja oka.
U Delu trećem ove metode opisana je strategija ispitivanja korak po korak koja uključuje i obavljanje validiranih i prihvaćenih in vitro ili ex vivo ispitivanja iritacije/korozivnog oštećenja. Strategiju su razvili, kao jedinstveno prihvaćenu i preporučenu, članovi radne grupe OECD8, a ista je prihvaćena i uvrštena u preporučene strategije ispitivanja od strane Globalno harmonizovanog sistema za klasifikaciju i obeležavanje (u daljem tekstu: GHS)9. Ova strategija se preporučuje pre bilo kakvih in vivo ispitivanja. Za nove supstance, ispitivanje korak po korak je preporučeni pristup za dobijanje naučno zasnovanih podataka o njihovim iritativnim/korozivnim efektima. Za supstance koje su već obuhvaćene ispitivanjima, ista strategija se primenjuje za upotpunjavanje podataka o iritativnim/korozivnim efektima na oko i kožu. Primenu drugačije strategije ispitivanja ili postupka, ili odluku da se ne primeni ova usvojeno ispitivanje korak po korak, potrebno je objasniti i obrazložiti.
1.2. DEFINICIJE
Iritacija oka jeste nastanak promena u oku do kojih dolazi nakon primene ispitivane supstance na spoljašnju površinu oka, koje su potpuno reverzibilne u periodu od 21 dana nakon primene.
Teško oštećenje oka jeste oštećenje tkiva oka ili ozbiljno pogoršanje vida nakon primene ispitivane supstance na spoljašnju površinu oka, koje nije potpuno reverzibilno u periodu od 21 dana nakon primene.
1.3. PRINCIP METODE
Supstanca koja se ispituje primenjuje se u jednoj dozi u jedno oko eksperimentalne životinje. Netretirano oko služi kao kontrola. Stepen iritacije/teškog oštećenja oka procenjuje se ocenjivanjem lezija konjuktive, rožnjače i dužice, u prethodno određenim vremenskim intervalima. Da bi se obezbedila kompletna procena efekata opisuju se i druge promene na oku i sistemski štetni efekti. Ispitivanje traje dovoljno dugo da se proceni reverzibilnost ili ireverzivbilnost efekata.
Životinje koje u bilo kom delu ispitivanja pokazuju stalne znakove patnje odnosno bola lišavaju se života na human način, a supstanca se procenjuje u skladu sa tim. Kriterijumi za donošenje odluke o lišavanju života na human način životinja koje su na samrti i pokazuju znake izrazite patnje, opisani su u literaturi10.
1.4. OPIS METODE
1.4.1. Priprema za in vivo ispitivanje
1.4.1.1. Izbor životinja
Preporučuje se korišćenje zdravih mladih jedinki albino kunića. Ukoliko se koristi druga životinjska vrsta, navode se razlozi za to korišćenje.
1.4.1.2. Priprema životinja
Kod svake eksperimentalne životinje koja je prethodno odabrana za ispitivanje pregledaju se oba oka 24 sata pre početka ispitivanja. Životinje kod kojih je uočena iritacija oka, nedostatak ili već postojeća povreda rožnjače ne koriste se za ispitivanje.
1.4.1.3. Uslovi smeštaja i ishrana
Životinje se smeštaju u odgovarajući smeštaj za pojedinačno i odvojeno držanje. Temperatura smeštajnog prostora u kome se drže kunići održava se na 20° C (± 3° C). Relativna vlažnost vazduha je najmanje 30% i da ne prelazi 70% (osim u slučajevima kada se prostorija sa životinjama čisti). Idealna vlažnost je između 50% i 60%. Osvetljenje je veštačko i to u intervalima od 12 sati svetla i 12 sati mraka. Životinje se hrane uobičajenom hranom za laboratorijske životinje, sa slobodnim pristupom vodi za piće.
1.4.2. Postupak ispitivanja
1.4.2.1. Primena ispitivane supstance
Ispitivana supstanca primenjuje se u konjuktivalnu kesu jednog oka svake životinje nakon što se lagano povuče donji kapak očne jabučice. Kapci se zatim nežno spoje na otprilike jednu sekundu da bi se sprečio gubitak supstance. Drugo oko, koje nije tretirano supstancom, služi za kontrolu.
1.4.2.2. Ispiranje
Oči životinja najmanje 24 sata od primene ne smeju da se ispiraju, osim ako se primenjuje čvrsta supstanca (videti odeljak 1.4.2.3.2. ove metode) i u slučaju neposrednog korozivnog ili iritativnog efekta. Nakon 24 sata od primene, ukoliko se proceni da je potrebno, oko može da se ispere.
Ne preporučuje se korišćenje propratne grupe životinja za istraživanje uticaja koji se javljaju nakon ispiranja, osim ukoliko je naučno opravdano. Ako je potrebno koristiti propratnu grupu životinja, uzimaju se dva kunića. Uslovi ispiranja pažljivo se dokumentuju, npr. vreme ispiranja, sastav i temperatura tečnosti za ispiranje; trajanje, intenzitet i brzina primene.
1.4.2.3. Dozni nivoi
1.4.2.3.1. Ispitivanje tečnosti
Za ispitivanje tečnosti koristi se doza ispitivane supstance u zapremini od 0,1 mL. Za ukapavanje supstance direktno u oko ne smeju se koristiti sprejevi sa pumpicom. Tečni sprej se istiskuje i sakuplja u bočice pre ukapavanja 0,1 mL u oko.
1.4.2.3.2. Ispitivanje čvrstih supstanci
Kada se ispituje čvrsta supstanca, pasta, supstance u obliku čestica zapremina koja se koristi je 0,1 mL ili je to masa koja nije veća od 100 mg. Ispitivana supstanca se usitnjava u fini prah. Količina čvrste supstance meri se nakon što je pažljivo sabijena i stavljena u posudu za merenje. Ako se kod prvog posmatranja koje je se obavlja jedan sat nakon nanošenja čvrste ispitivane supstance uoči da ona nije odstranjena iz oka životinje pomoću fizioloških mehanizama, oko može se ispere fiziološkim rastvorom ili destilovanom vodom.
1.4.2.3.3. Ispitivanje aerosola
Preporučuje se prikupljanje svih sprejeva sa pumpicom i aerosola pre nanošenja (ukapavanja) u oko. Izuzetak su supstance u aerosol bočicama pod pritiskom, koje se zbog isparavanja ne prikupljaju unapred. U tim slučajevima oko se drži otvoreno i ispitivana supstanca se nanosi u jednom potezu direktno u oko u trajanju oko jedne sekunde, sa udaljenosti od 10 cm. Ova udaljenost može da varira, u zavisnosti od pritiska spreja i njegovog sastava. Vodi se računa da pritisak u spreju ne ošteti oko. U nekim slučajevima, postoji potreba za procenom mogućnosti za "mehaničko" oštećenje oka koje su izazvale sile spreja.
Procena doze ispitivane supstance spreja može se utvrditi simuliranjem ispitivanja na sledeći način: supstanca se naprska po papiru za merenje kroz otvor veličine oka kunića. Povećanje mase papira približno je dozi koja je naprskana u oko. Kod isparljivih supstanci, doza se može utvrditi merenjem bočice pre i posle prskanja ispitivane supstance.
1.4.2.4. Inicijalno ispitivanje
(In vivo ispitivanje iritacije/teškog oštećenja oka na jednoj životinji)
Preporučuje se in vivo ispitivanje na jednoj životinji kao što je opisano u strategiji ispitivanja korak po korak (videti Deo treći ove metode).
Ako rezultati pokažu da supstanca izaziva teško oštećenje ili jaku iritaciju oka pri korišćenju propisane metode, ne sprovode se dalja ispitivanja na oku.
1.4.2.5. Lokalni anestetici
Lokalni anestetici mogu da se koriste zavisno od slučaja. Ako analize kvaliteta postojećih podataka ukazuju da supstanca može da izazove bol ili inicijalno ispitivanje pokaže prisustvo bolnih reakcija, pre nanošenja ispitivane supstance može da se upotrebi lokalni anestetik. Vrsta, koncentracija i doza lokalnog anestetika bira se pažljivo, da se spreče odstupanja u reakciji na ispitivanu supstancu zbog njegovog korišćenja. Kontrolno oko je takođe pod lokalnom anestezijom.
1.4.2.6. Ispitivanje kojim se potvrđuje
(In vivo ispitivanje iritacije oka na dodatnim životinjama)
Ako u inicijalnom ispitivanju nije uočeno teško oštećenje oka, iritacija ili negativan rezultat, ono se potvrđuje korišćenjem najviše dve dodatne životinje. Ukoliko se u inicijalnom ispitivanju uoči značajna iritacija koja ukazuje da može da se ponovi jak (ireverzibilan) efekat i u ispitivanju kojim se potvrđuje, preporučeno je da se ispitivanje kojim se potvrđuje izvodi postepeno, prvo na jednoj pa na drugoj životinji, pre nego da se ispitivanje izvodi na obe životinje istovremeno. Ako druga životinja pokaže znakove iritacije ili teškog oštećenja oka, ispitivanje se ne nastavlja. Dodatne životinje mogu da budu potrebne kada se utvrđuju znakovi slabe ili srednje teške iritacije.
1.4.2.7. Period posmatranja
Posmatranje traje dovoljno dugo da bi se u potpunosti utvrdio značaj i reverzibilnost uočenih efekata. Eksperiment se obustavlja uvek kada životinja pokazuje neprekidne znakove bola ili patnje9. Da bi se utvrdila reverzibilnost efekata, životinje se posmatraju 21 dan nakon primene supstance. Ako se pre isteka 21-og dana uoči da su efekti reverzibilni, eksperiment se prekida.
1.4.2.7.1. Klinička posmatranja i ocenjivanje reakcija na oku
Pregled očiju obavlja se nakon 1 sata, 24 sata, 48 sati i 72 sata od primene supstance. Životinje se ne drže u ispitivanju nakon što se dobiju definitivni podaci. Životinje koje pokazuju neprekidne znakove jakog bola ili patnje lišavaju se života na human način bez odlaganja, a supstanca se procenjuje u skladu sa tim. Životinje koje se nakon primene ispitivane supstance lišavaju života na human način mogu imati sledeća oštećenja oka: perforirana rožnjača ili jaka ulceracija rožnjače koja obuhvata stafilom, krv u prednjoj komori oka, četvrti stepen zamućenja rožnjače koji traje 48 sati, nedostatak refleksa na svetlost (ocena 2 reakcije irisa koji traje 72 sat, ulceracija membrane konjuktive, nekroza konjuktive ili membrane sa trepavicama ili deskvamacija. Razlog za lišavanje života na human način jeste što su ove lezije (oštećenja) uglavnom trajne.
Životinje kod kojih se lezije oka ne razviju, mogu da se tretiraju tek nakon trećeg dana od primene. Životinje sa slabim do srednje teškim oštećenjima posmatraju se do uočavanja jasne lezije ili tokom 21 dan, nakon čega se ispitivanje prekida. Posmatranja se obavljaju 7 dana, 14 dana i 21 dan da bi se utvrdio obim oštećenja i njihova reverzibilnost ili ireverzibilnost.
Ocenjivanje reakcije na oku (konjuktiva, rožnjača i dužica) se beleži kod svakog ispitivanja (videti Deo drugi ove metode). Navode se sva druga oštećenja oka (panus, prebojenost) i druge promene.
Ispitivanje reakcija vrši se uz korišćenje binokularne lupe, ručne slit-lampe, biomikroskopa ili drugog odgovarajućeg pribora. Nakon beleženja rezultata posmatranja nakon 24 sata, oči dodatno mogu da budu pregledane flourescentnom lampom.
Ocenjivanje nalaza na oku po svojoj prirodi je subjektivno. Kako bi se podstaklo da ocenjivanje nalaza oka bude usklađeno među različitim laboratorijama, potrebno je da se osoblje laboratorija adekvatno obuči za ocenjivanje i tumačenje rezultata.
2. PODACI
2.1. PROCENA REZULTATA
Ocena iritacije oka procenjuje se u skladu sa prirodom i težinom lezija i njihovom reverzibilnošću ili ireverzibilnošću. Pojedinačne ocene same za sebe ne ukazuju na iritativna svojstva hemikalije, budući da se procenjuju i ostali efekti. Pojedinačne ocene se imaju u vidu kao preporuka i značajne su samo ukoliko su podržane potpunim opisom i procenom svih uočenih efekata.
3. IZVEŠTAJ O ISPITIVANJU
3.1. PISANJE IZVEŠTAJA
Izveštaj o ispitivanju sadrži podatke o:
1) Razlozima za in vivo ispitivanje:
- analiza procene kvaliteta postojećih podataka, uključujući i rezultate strategije ispitivanja korak po korak
- opis relevantnih podataka dobijenih iz prethodnih ispitivanja;
- podaci dobijeni iz svakog koraka strategije ispitivanja;
- opis in vitro izvedenih ispitivanja uključujući detalje o postupku i rezultate dobijene za ispitivanu/referentnu supstancu;
- opis in vivo izvedene studije iritacije/teškog oštećenja oka, uključujući dobijene rezultate;
- analiza kvaliteta podataka za izvođenje in vivo studije.
2) Ispitivanoj supstanci:
- identifikacioni podaci (npr. CAS broj, poreklo, čistoća, poznate nečistoće, broj serije);
- fizičko stanje i fizička i hemijska svojstva (npr. pH, isparljivost, rastvorljivost, stabilnost, hemijska reakcija sa vodom);
- kod smeša: sastav i relativni procenti sastojaka;
- ako se koristi lokalni anestetik: identifikacija, čistoća, tip, doza, eventualna interakcija sa supstancom.
3) Vehikulumu:
- identifikacija, koncentracija (po potrebi), zapremina koja se koristi;
- opravdanost za izbor vehikuluma.
4) Eksperimentalnim životinjama:
- vrsta/soj, razlog za korišćenje druge vrste a ne albino kunića;
- starost svake životinje na početku studije;
- broj životinja oba pola u ispitivanju i kontrolnim grupama (po potrebi);
- telesna masa pojedinačnih životinja na početku i kraju ispitivanja;
- izvor životinja, uslovi smeštaja, ishrana itd.
5) Rezultatima:
- opis metode koja je korišćena za ocenjivanje reakcije pri svakom vremenu posmatranja (npr. ručna slit-lampa, biomikroskop, fluorescentno svetlo);
- tabelarni prikaz nalaza iritacije/teškog oštećenja za svaku životinju pri svakom vremenu posmatranja do uklanjanja životinje iz ispitivanja;
- opis stepena i prirode uočene iritacije ili teškog oštećenja;
- opis drugih uočenih lezija na oku (npr. vaskularizacija, formiranje panusa, prebojenost, adhezija);
- opis svih lokalnih efekata koji nisu na oku i sistematskih štetnih efekata, i histopatološki nalazi ukoliko ih ima;
- tumačenje rezultata.
3.2. TUMAČENJE REZULTATA
Rezultati studije iritacije oka na laboratorijskim životinjama mogu se ekstrapolirati na ljude, i validni su u ograničenom stepenu. U mnogim slučajevima albino kunić pokazuje veću osetljivost na iritanse ili korozive oka od čoveka.
Precizno se tumače rezultati da bi se isključila iritacija koja je rezultat sekundarne infekcije.
4. LITERATURA
1. Barratt, M.D., Castell, J.V., Chamberlain, M., Combes, R.D., Dearden, J.C., Fentem, J.H., Gerner, I., Giuliani, A., Gray, T.J.B., Livingston, D.J., Provan, W.M., Rutten, F.A.J.J.L., Verhaar, H.J.M., Zbinden, P. (1995) The Integrated Use of Alternative Approaches for Predicting Toxic Hazard. ECVAM Workshop Report 8. ATLA 23, p. 410-429.
2. de Silva, O., Cottin, M., Dami, N., Roguet, R., Catroux, P., Toufic, A., Sicard, C., Dossou, K.G., Gerner, I., Schlede, E., Spielmann, H., Gupta, K.C., Hill, R.N., (1997) Evaluation of Eye Irritation Potential: Statistical Analysis and Tier Testing Strategies. Food Chem. Toxicol 35, p. 159-164.
3. Worth A.P. and Fentem J.H., (1999) A general approach for evaluating stepwise testing strategies ATLA 27, p. 161-177
4. Young, J.R., How, M.J., Walker, A.P., Worth W.M.H., (1988) Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substance Without Testing on Animals. Toxicollogy In vitro, 2, p. 19-26.
5. Neun, D.J. (1993) Effects of Alkalinity on the Eye Irritation Potential of Solutions Prepared at a Single pH. J. Toxicol. Cut. Ocular Toxicol. 12, p. 227-231.
6. Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Edsaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology In vitro 12, p. 483-524.
6a. Testing Method B.40 Skin Corrosion.
7. Testing method B.4. Acute toxicity: dermal irritation/corrosion.
8. OECD, (1996) OECD Test Guidelines Programme: Final Report of the OECD Workshop on Harmonisation of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held in Solna, Sweden, 22-24 January 1996 (http://www.oecd.org/ehs/test/background.htm).
9. OECD, (1998) Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www.oecd.org/ehs/Class/HCL6.htm).
10. OECD, (2000) Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications. Series on Testing and Assessment No 19 (http://www.oecd.org/ehs/test/monos.htm).
Deo drugi
OCENJIVANJE OŠTEĆENJA OKA
Rožnjača |
|
Zamućenost: stepen zamućenosti (očitava se nalaz sa mesta najveće gustine)* |
|
Nema ulceracija ni zamućenja |
0 |
Rasute ili difuzne površine zamućenja |
|
(osim neznatnog gubitka normalnog sjaja); |
|
dužica jasno vidljiva |
1 |
Lako raspoznatljiva providna površina; |
|
dužica blago zamućena |
2 |
Nekrotična površina; detalji dužice nisu vidljivi; |
|
veličina zenica se jedva raspoznaje |
3 |
Zamućenje rožnjače; dužica se ne raspoznaje |
|
kroz zamućenje |
4 |
Mogući maksimum: |
4 |
* Beleži se veličina površine zamućenja rožnjače. |
|
Dužica |
|
Normalna |
0 |
Izrazito duboka bora, kongestija, oticanje, |
|
umerena hiperemija oko rožnjače; ili nadraženost; |
|
dužica reaguje na svetlost (spora reakcija se smatra |
|
efektom) |
1 |
Krvarenje, obimna destrukcija, izostanak reakcije |
|
na svetlost |
2 |
Mogući maksimum: |
2 |
Konjuktiva |
|
Crvenilo (odnosi se na palpebralni i bulbarni deo konjuktive; izuzev rožnjače i dužice) |
|
Normalna |
0 |
Hiperemija nekih kapilara |
1 |
Difuzno crvenilo (tamno crvena) |
|
pojedinačni kapilari nisu jasno vidljivi |
2 |
Difuzno crvenilo boje mesa |
3 |
Mogući maksimum: |
3 |
Hemoza |
|
Oticanje (odnosi se na kapke odnosno treći kapak) |
|
Normalno |
0 |
Oticanje iznad normale |
1 |
Jasno oticanje, sa parcijalnim uvrtanjem kapaka |
2 |
Oticanje, sa kapcima zatvorenim na pola |
3 |
Oticanje, sa kapcima zatvorenim više od pola |
4 |
Mogući maksimum: |
4 |
Deo treći
STRATEGIJA ISPITIVANJA IRITACIJE I TEŠKOG OŠTEĆENJA OKA KORAK PO KORAK
1. OPŠTA RAZMATRANJA
U interesu naučne zasnovanosti i zbog dobrobiti životinja, važno je izbegavati nepotrebno korišćenje životinja ili ispitivanja koja će kod životinja verovatno izazvati jak odgovor. Pre in vivo ispitivanja iritatacije/teškog oštećenja oka, potrebno je proceniti sve postojeće podatke koji se odnose na potencijal ispitivane supstance da izazove iritaciju/teško oštećenje oka. Ako postoji dovoljno podataka i dokaza za klasifikaciju određene supstance u odnosu na potencijal da izazove iritaciju/teško oštećenje oka, može da se izbegne ispitivanje na laboratorijskim životinjama. Na osnovu analize kvaliteta podataka i strategije ispitivanja korak po korak smanjiće se potreba za in vivo ispitivanjima, naročito ako se sumnja na mogućnost da će ispitivana supstanca izazvati intenzivne reakcije.
Analiza kvaliteta postojećih podatka koristi se za procenu postojećih podataka o iritaciji/teškom oštećenju oka koje izaziva ispitivana supstanca kako bi se utvrdilo da li je osim in vivo ispitivanja na koži neophodno obaviti i dodatna ispitivanja koja doprinose da se bolje opiše ovaj potencijal ispitivane supstance. Kada se pokaže potreba za dodatnim ispitivanjima, za prikupljanje novih relevantnih eksperimentalnih podatka preporučuje se primena strategije ispitivanja korak po korak. Za supstance koje prethodno nisu ispitivane, takođe je potrebno primeniti strategiju ispitivanja korak po korak za određivanje njenih efekata na oku. Strategiju ispitivanja opisanu u ovom delu razvili su članovi radne grupe OECD1, a ista je kasnije potvrđena i proširena u sklopu Globalno harmonizovanog sistema za klasifikaciju hemijskih supstanci u odnosu na efekte po zdravlje ljudi i na životnu sredinu, na 28-om zajedničkom Simpozijumu hemijske komisije i radne grupe za hemiju, u novembru 1998. godine2.
Iako ova strategija ispitivanja korak po korak nije sastavni deo metode ispitivanja B.5. koja je data u ovom prilogu, ona odražava preporučeni pristup za određivanje svojstava supstanci na osnovu iritativnih/korozivnih efekata na oku. Sa aspekta etike i prakse metoda ispitivanja predstavlja najbolji pristup za in vivo ispitivanja iritacije/teškog oštećenja na oku. Metoda ispitivanja služi i kao uputstvo za izvođenje in vivo ispitivanja i zbraja faktore koje je potrebno sagledati pre početka ispitivanja na životinjama. Strategija takođe daje preporuku za procenu postojećih podataka o ispitivanoj supstanci kao i način na koji je potrebno prikupiti nove podatke za supstance za koje su potrebna dodatna ispitivanja ili za supstance za koje nisu prethodno sprovedena nikakva ispitivanja. Strategija kao prvo uključuje izvođenje validiranog i prihvaćenog in vitro ili ex vivo ispitivanja, a zatim metodu ispitivanja B.4. koja je data u ovom prilogu iritativnih/korozivnih efekata na koži pod specifičnim uslovima3, 4.
2. OPIS STRATEGIJE ISPITIVANJA KORAK PO KORAK
Pre početka ispitivanja u sklopu metode ispitivanja korak po korak (videti Sliku), potrebno je proceniti postojeće podatke kako bi se odredila potreba za in vivo ispitivanjima na oku. Iako je značajne podatke moguće dobiti procenom jednog parametara (npr. visoki pH), za donošenje konačne odluke o ispitivanjima razmatraju se i svi drugi dostupni podaci, kao što su štetni efekti ispitivane supstance ili njenih analoga. Na kraju je potrebno izneti i objašnjenje za donetu odluku. Akcenat je na postojećim podacima o ispitivanoj supstanci dobijenim iz podataka na osnovu nalaza kod ljudi i ispitivanja na životinjama, i na ishodu in vitro ili ex vivo ispitivanja. In vivo studije korozivnih supstanci za koje se unapred zna da su štetne i izbegavaju se gde god je to moguće. Faktori koji se uzimaju u obzir u strategiji ispitivanja uključuju:
Procenu postojećih podataka dobijenih na osnovu nalaza kod ljudi i na ispitivanja kod životinja. (korak 1). Prvo se razmatraju postojeći podaci na osnovu nalaza kod ljudi, npr. kliničke studije, studije nakon profesionalne izloženosti, prikazi slučaja, odnosno podaci iz studija na oku životinja, budući da se dobijaju podaci koji su direktno vezani za efekte na oko. Procenjuju se dostupni podaci iz studija u kojima su vršena istraživanja iritacije/korozivnog oštećenja na osnovu nalaza kod ljudi odnosno ispitivanja kod životinja. Supstance za koje je poznato da izazivaju jaku iritaciju/ korozivno oštećenje oka ne smeju se unositi u oko životinja, kao ni supstance sa istim efektom na koži, jer je to siguran pokazatelj da su iritativni/korozivni i za oko. Supstance za koje ima dovoljno dokaza da ne izazivaju iritaciju/teško oštećenje oka u prethodno izvedenim ispitivanjima, ne ispituju se u in vivo studijama oka.
Analizu odnosa strukture i aktivnosti (u daljem tekstu: SAR) (korak 2). Razmatraju se rezultati ispitivanja strukturno sličnih supstanci, ako su dostupni. Kada dovoljno dostupnih podataka o strukturno sličnim supstancama/smešama tih supstanci ukazuju na njihov potencijal za iritaciju/korozivni efekat na oku, može se pretpostaviti da će ispitivana supstanaca dati slične nalaze. U takvim slučajevima supstancu nije potrebno dodatno ispitivati. Negativni rezultati, odnosno podaci koji ukazuju na izostanak ovakvih efekata iz studije na strukturno sličnim supstancama ili smešama takvih supstanci, ne predstavljaju dovoljno čvrst dokaz o neškodljivosti supstance koja je u postupku ispitivanja. Validirani i prihvaćeni SAR pristup koristi se za identifikaciju potencijala za iritativni i korozivni efekat ispitivane supstance na oku i koži.
Fizička i hemijska svojstva i hemijsku reaktivnost (korak 3). Supstance koje imaju ekstremne pH vrednosti kao ≤ 2,0 ili ≥ 11,5 mogu imati izražene lokalne efekte. Ako je ekstremni pH osnova za ocenjivanje potencijala supstance da izazove teško oštećenje oka, razmatra se i njena kiselo-bazna rezerva (ili puferski kapacitet)5, 6. Ako puferski kapacitet ukazuje na to da supstanca ne izaziva teško oštećenje oka, neophodno je obaviti dodatna ispitivanja kako bi se potvrdila ova pretpostavka, i to ako je moguće primenom validiranih i prihvaćenih in vitro ili ex vivo ispitivanja (videti korake 5 i 6).
Razmatranje ostalih postojećih podataka (korak 4). U ovom koraku procenjuju se svi dostupni podaci o sistemskoj toksičnosti kod dermalnog puta primene. Akutna dermalna toksičnost ispitivane supstance takođe se razmatra. Ako se pokaže da je ispitivana supstanca veoma toksična ako se primeni na kožu, ne postoji potreba za ispitivanjem na oku, jer ako je veoma toksična nakon dermalnog puta primene, može se pretpostaviti da će izazvati jaku reakciju ako se nanese u oko. Taj podatak takođe može da bude razmotren u koraku 2 i 3.
Rezultate in vitro ili ex vivo ispitivanja (korak 5 i 6). Ispitivanje na životinjama nije potrebno vršiti za supstance koje su pokazale korozivno ili jako iritativno svojstvo u in vitro ili ex vivo ispitivanjima7, 8 koja su validirana i prihvaćena upravo za procenu iritacije/teškog oštećenja oka ili kože. Može se pretpostaviti da takve supstance pokazuju slične efekte in vivo. Ako ne postoje validirana i prihvaćena in vitro/ex vivo ispitivanja, korak 5 i 6 se preskaču i direktno se pristupa koraku 7.
In vivo procenu iritacije ili korozivnog oštećenja kože (korak 7). Kada nema dovoljno dokaza za izvođenje zaključne analize kvaliteta podataka o potencijalu supstance da izazove iritaciju/teško oštećenje oka na osnovu pomenutih studija, prvo se procenjuje in vivo potencijal iritacije/korozivnog oštećenja kože korišćenjem metode ispitivanja B.4. koja je data u ovom Prilogu4 i Delu trećem datom uz tu metodu ispitivanja9. Ako se pokaže da supstanca izaziva korozivno oštećenje ili tešku iritaciju kože, a ne postoje drugi podaci koji dokazuju suprotno, pretpostavlja se da je supstanca korozivna/iritativna i za oko. U tom slučaju nema potrebe za izvođenjem in vivo ispitivanja na oku. Ako supstanca nije korozivna/iritativna za kožu, izvodi se in vivo ispitivanje na oku.
In vivo ispitivanje na kunićima (korak 8 i 9). In vivo ispitivanje na oku započinje inicijalnim ispitivanjem korišćenjem jedne životinje. Nije potrebno izvoditi dalje ispitivanje ako rezultati ispitivanja ukažu da je supstanca jak iritans ili koroziv za oko. Ako ispitivanje ne pokaže nikakve značajne reakcije, potrebno je, sa dve dodatne životinje, izvesti ispitivanje kojim se potvrđuje (confoirmatory test).
3. LITERATURA
1. OECD, (1996) Test Guidelines Programme: Final Report on the OECD Workshop on Harmonisation of Validation and Acceptance Criteria for Alternative Toxicological Test Methods. Held on Solna, Sweden, 22-24 January 1996 (http://www1.oecd.org/ehs/test/background.htm).
2. OECD, (1998) Harmonised Integrated Hazard Classification System for Human Health and Environmental Effects of Chemical Substances, as endorsed by the 28th Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, November 1998 (http://www1.oecd.org/ehs/Class/HCL6.htm).
3. Worth, A.P., Fentem J.H., Balls M., Botham P.A., Curren R.D., Earl L.K., Esdaile D.J., Liebsch M., (1998). An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26, p. 709-720.
4. Young, J.R., How, M.J., Walker, A.P., Worth, W.M.H., (1988). Classification as Corrosive or Irritant to Skin of Preparations Containing Acidic or Alkaline Substances, Without Testing on Animals. Toxicology In vitro, 2(1), p. 19-26.
5. Patil, S.M., Patrick, E., Maibach, H.I. (1996) Animal, Human, and In vitro Test Methods for Predicting Skin Irritation, in: Francis N. Marzulli and Howard I. Maibach (editors): Dermatotoxicology. Fifth Edition ISBN 1-56032-356-6, Chapter 31, p. 411-436.
6. Testing Method B.40.
7. Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G. and Liebsch, M. (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology In vitro 12, p. 483-524.
Deo četvrti
ISPITIVANJE I STRATEGIJA PROCENE ZA IRITACIJU/TEŠKO OŠTEĆENJE OKA
|
Aktivnost |
Nalaz |
Zaključak |
|
1 |
Postojeći podaci dobijeni na osnovu ispitivanja kod ljudi/životinja koji pokazuju efekte na očima |
Teško oštećenje oka |
Supstanca je korozivna za oko |
|
Iritacija oka |
Supstanca je iritativna za oko. |
|||
Nema teškog oštećenja/iritacije oka |
Supstanca nije iritativna/korozivna za oko. Dalja ispitivanja nisu potrebna |
|||
Postojeći podaci dobijeni na osnovu ispitivanja kod ljudi/životinja koji pokazuju korozivne efekte na koži |
Korozivno oštećenje kože |
Pretpostavlja se da je korozivna za oko. |
||
Postojeći podaci dobijeni na osnovu ispitivanja kod ljudi/životinja koji pokazuju jake iritativne efekte na koži |
Jaka iritacija kože |
Pretpostavlja se da je iritativna za oko. Dalja ispitivanja nisu potrebna. |
||
|
¯ |
|
|
|
|
Nema dostupnih podataka, ili su dostupni podaci neadekvatni |
|
|
|
|
¯ |
|
|
|
2 |
Izvršiti SAR procenu za iritaciju/teško oštećenje oka |
Predviđa se teško oštećenje oka |
Pretpostavlja se da je supstanca korozivna za oko. Dalja ispitivanja nisu potrebna |
|
Predviđa se iritacija oka |
Pretpostavlja se da je supstanca iritativna za oko. Dalja ispitivanja nisu potrebna. |
|||
Izvršiti SAR procenu za korozivno oštećenje kože |
Predviđa se korozivno oštećenje kože |
Pretpostavlja se da je supstanca korozivna za oko. Dalja ispitivanja nisu potrebna |
||
|
¯ |
|
|
|
|
Nije moguće predvideti, ili su predviđanja negativna i nejasna |
|
|
|
|
¯ |
|
|
|
3 |
Odrediti pH (po potrebi, razmotriti puferski) |
pH £ 2 ili ³ 11,5 (sa visokim puferskim kapacitetom, po potrebi) |
Pretpostavlja se da je supstanca korozivna za oko. Dalja ispitivanja nisu potrebna |
|
|
¯ |
|
|
|
|
2 < pH < 11,5 pH £ 2.0 ili ³ 11.5 sa malim / bez puferskog kapaciteta, po potrebi |
|
|
|
|
¯ |
|
|
|
4 |
Procenti podataka koje se odnose na sistemsku toksičnost putem primene na kožu |
Veoma toksično pri konsentracijama u kojima se ispituje na oku |
Supstanca bi bila previše toksična za ispitivanje. Dalja ispitivanja nisu potrebna |
|
|
¯ |
|
|
|
|
Takvi podaci nisu dostupni ili supstanca nije veoma toksična |
|
|
|
|
¯ |
|
|
|
5 |
Izvršiti validirana i prihvaćena in vitro ili ex vivo ispitivanja teškog oštećenja oka |
Korozivna reakcija |
Pretpostavlja se da je supstanca korozivna za oko. Dalja ispitivanja nisu potrebna. |
|
|
¯ |
|
|
|
|
Validirane in vitro ili ex vivo metode ispitivanja teškog oštećenja oka još nisu razvijene ili supstanca nema korozivni efekat |
|
|
|
|
¯ |
|
|
|
6 |
Izvršiti validirana i prihvaćena in vitro ili ex vivo ispitivanja iritacije oka |
Iritativna reakcija |
Pretpostavlja se da je supstanca korozivna za oko. Dalja ispitivanja nisu potrebna. |
|
|
¯ |
|
|
|
|
Validirane in vitro ili ex vivo metode ispitivanja iritacije oka još nisu razvijene ili supstanca nema iritativni efekat |
|
|
|
|
¯ |
|
|
|
7 |
Eksperimentalno proceni potencijal in vitro iritacije/korozivnog oštećenja kože vidi metodu ispitivanja B.4 uključujući Deo treći |
Korozivna ili jaka iritativna reakcija |
Pretpostavlja se da je supstanca korozivna za oko. Dalja ispitivanja nisu potrebna. |
|
|
¯ |
|
|
|
|
Supstanca ne dovodi do korozivnog oštećenja ili jake iritacije kože |
|
|
|
|
¯ |
|
|
|
8 |
Izvršiti inicijalno in vivo ispitivanje oka na jednom kuniću |
Teško oštećenje oka |
Supstanca je korozivna za oko. |
|
|
¯ |
|
|
|
|
Nema teških oštećenja ili nema reakcije |
|
|
|
|
¯ |
|
|
|
9 |
Obaviti na jednoj ili dve dodatne životinje ispitivanje kojim se potvrđuje |
Korozivno ili iritativno |
Supstanca je korozivna ili iritativna za oko. |
|
Nije korozivno ili iritativno |
Supstanca nije korozivna ili iritativna za oko. |
B.6. SENZIBILIZACIJA KOŽE
Deo prvi
1. METODA ISPITIVANJA
1.1. UVOD
Napomene: Osetljivost i mogućnost ispitivanja kojim se određuje potencijal supstanci koje izazivaju senzibilizaciju kože kod ljudi, smatraju se važnim u sistemu klasifikacije na osnovu toksičnosti i važni su za javno zdravlje.
Ne postoji metoda ispitivanja koja na odgovarajući način identifikuje sve supstance koje izazivaju preosetljivost kože ljudi i koja je relevantna za sve supstance.
Činioci kao što su fizička svojstva supstance, uključujući njihovu sposobnost prodiranja u kožu, uzimaju se u obzir pri izboru odgovarajuće metode ispitivanja.
Razvijene su dve vrste metoda ispitivanja u kojima se koriste zamorci: metode ispitivanja sa adjuvansom u kojima se alergijska reakcija izaziva rastvaranjem ili suspendovanjem ispitivane supstance "Frojndovom kompletnom adjuvansu" (u daljem tekstu: FCA), i metode ispitivanja bez adjuvansa.
Metode ispitivanja sa adjuvansom su verovatno tačnije u predviđanju da supstanca kod ljudi izaziva senzibilizaciju kože, za razliku od metoda ispitivanja koje ne koriste FCA. Zbog ovoga se preporučuju metode ispitivanja sa adjuvansom.
Test maksimizacije na zamorcima (The Guinea-Pig Maximisation Test, u daljem tekstu: GMPT) je opšte prihvaćen test sa adjuvansom. Za otkrivanje potencijala izazivanja preosetljivosti neke supstance može se koristiti nekoliko različitih metoda ispitivanja, ali se preporučuje GMPT metoda ispitivanja sa adjuvansom.
U slučaju većine klasa hemikalija, eksperimentalne metode ispitivanja bez adjuvansa (prednost se daje Buehler testu) smatraju se manje osetljivim.
U određenim slučajevima postoji opravdan razlog za primenu Buehler testa u kome se ispitivana supstanca primenjuje topikalno, a ne u obliku intradermalne injekcije, kao što je slučaj u GMPT. Za korišćenje Buehler testa, potrebno je dati i naučno zasnovano obrazloženje.
GMPT i Buehler test dati su u ovoj metodi ispitivanja. Ostale metode ispitivanja koriste se ako su prethodno potvrđene i ako je njihovo korišćenje naučno opravdano.
Ako se u skrining testu dobije pozitivan rezultat, ispitivana supstanca se označava kao potencijalni uzročnik senzibilizacije. U tom slučaju ne nastavljaju se dalja ispitivanja na zamorcima. Ako se u skrining testu dobije negativan rezultat, ispitivanje na zamorcima se sprovodi koristeći postupke date u ovoj metodi.
Videti Opšti uvod.
1.2. DEFINICIJE
Senzibilizacija kože (Alergijski kontaktni dermatitis) jeste imunološki posredovana, kožna reakcija na određenu supstancu. Kod ljudi odgovor može biti okarakterisan svrabom, crvenilom, otokom, papulama (bubuljicama), vezikulama (mehurićima), bulama (plikovima) ili njihovom kombinacijom. Kod drugih vrsta reakcije se mogu razlikovati, i mogu se javiti samo eritem ili edem.
Indukcija jeste eksperimentalno izlaganje jedinke ispitivanoj supstanci sa namerom izazivanja reakcije preosetljivosti.
Faza indukcije jeste vremenski period u trajanju od najmanje nedelju dana nakon indukcije tokom kojeg dolazi do razvoja reakcije preosetljivosti.
Provokacije jesu ponovljeno izlaganje ispitivanoj supstanci prethodno tretirane životinje nakon faze indukcije kako bi se odredilo da li jedinka razvija preosetljivost.
1.3. REFERENTNE SUPSTANCE
Osetljivost i pouzdanost eksperimentalne metode ispitivanja koja se koristi proverava se svakih šest meseci primenom supstanci za koje je poznato da imaju svojstvo blage do srednje senzibilizacije kože.
U dobro obavljenom ispitivanju, pozitivan odgovor od najmanje 30% kod metode ispitivanja sa adjuvansom ili 15% kod metode ispitivanja bez adjuvansa očekuje se za supstance koje izazivaju slabu do umerenu senzibilizaciju.
Preporučuju se sledeće supstance:
Tabela 1.
CAS broj |
EINECS broj |
EINECS nazivi |
Uobičajeni nazivi |
101 -86 -0 |
202 -983-3 |
α-heksilcinamaldehid |
α-heksilcinamaldehid |
149 -30 -4 |
205 -736-8 |
benzotiazol-2-tiol |
kaptaks |
94-09-7 |
202 -303-5 |
benzokain |
norkain |
Postoje okolnosti u kojima se mogu koristiti druge kontrolne supstance koje zadovoljavaju navedene kriterijume, ako se navede adekvatno opravdanje za njihovu upotrebu.
1.4. PRINCIP METODE ISPITIVANJA
Ispitivane životinje početno se izlažu ispitivanoj supstanci putem intradermalnih injekcija odnosno epidermalnom primenom (indukcija). Nakon perioda pauze u trajanju od 10 do 14 dana (nakon faze indukcije), tokom koga može doći do razvoja imunološkog odgovora, životinje se izlažu drugoj, ponovljenoj dozi. Stepen prouzrokovane reakcije na koži nakon provokacije kod eksperimentalnih životinja poredi se sa onom reakcijom kod životinja iz kontrolne grupe koje su bile podvrgnute lažnom tretmanu indukcije, i koje su bile podvrgnute provokaciji.
1.5. OPIS METODE ISPITIVANJA
Ako je potrebno uklanjanje ispitivane supstance, ona se uklanja pomoću vode ili odgovarajućeg rastvarača tako da se ne utiče na nalaz na koži ili da se ne naruši integritet epidermisa.
1.5.1. Test maksimizacije na zamorcima (GMPT)
1.5.1.1. Priprema
Zdravi, mladi albino zamorci drže se radi privikavanja najmanje pet dana pre početka ispitivanja u eksperimentalnim uslovima. Pre ispitivanja, slučajnim izborom životinja, formiraju se grupe za tretman. Uklanjanje dlake sa kože životinja vrši se šišanjem, brijanjem ili hemijskom depilacijom, u zavisnosti od primenjene metode ispitivanja. Pazi se da u proceduri ne dođe do oštećenja kože. Telesna masa životinja meri se pre početka ispitivanja i na kraju ispitivanja.
1.5.1.2. Uslovi ispitivanja
1.5.1.2.1. Eksperimentalne životinje
Koriste se uobičajene vrste albino zamoraca.
1.5.1.2.2. Broj i pol
Koriste se mužjaci ili ženke. Ako se koriste ženke, ispitivanje se vrši na ženkama koje nisu ranije rađale i koje nisu gravidne.
Minimum 10 životinja koristi se u tretiranoj grupi i najmanje 5 životinja u kontrolnoj grupi. Kada se koristi manje od 20 tretiranih i 10 kontrolnih zamoraca, i kada nije moguće zaključiti da li ispitivana supstanca dovodi do senzibilizacije, preporučuje se ispitivanje na dodatnim životinjama kako bi se dostigao ukupan broj od najmanje 20 tretiranih i 10 kontrolnih životinja.
1.5.1.2.3. Dozni nivoi
Koncentraciju ispitivane supstance koja se koristi za indukciju životinje treba dobro da podnose u smislu sistemskih efekata, i treba da bude najveća moguća doza koje će dovesti do slabe ili srednje izražene iritacije kože. Koncentracija koja se koristi za provokaciju treba da bude najveća moguća koja ne dovodi do iritacije kože. Odgovarajuće koncentracije najbolje je odrediti u pilot ispitivanju na dve ili tri životinje, ako drugi podaci nisu dostupni. U ovu svrhu, može se razmotriti i korišćenje FCA-tretiranih životinja.
1.5.1.3. Postupak
1.5.1.3.1. Indukcija
Dan 0 - tretirana grupa:
Tri para intradermalnih injekcija zapremine 0,1 mL daju se u području ramenog regiona koje je prethodno obrijano tako da se po jedna injekcija primeni sa svake strane tela.
Injekcija 1: 1:1 smeša (v/v) FCA/voda ili fiziološki rastvor.
Injekcija 2: ispitivana supstanca u određenoj koncentraciji u odgovarajućem vehikulumu.
Injekcija 3: ispitivana supstanca u određenoj koncentraciji pripremljena kao 1:1 smeša (v/v) FCA/voda ili fiziološki rastvor.
U injekciji 3 supstance rastvorljive u vodi rastvaraju se u vodenoj fazi pre mešanja sa FCA. Supstance rastvorljive u lipidnoj fazi ili potpuno nerastvorne suspenduju se u FCA pre mešanja sa vodenom fazom. Završna koncentracija ispitivane supstance mora biti jednaka onoj korišćenoj u injekciji 2.
Injekcije 1 i 2 daju se jedna pored druge blizu glave, dok se injekcija 3 daje u ivični deo ispitivane površine.
Dan 0 - kontrolna grupa:
Tri para intradermalnih injekcija zapremine 0,1mL daju se u isto područje kao kod tretiranih životinja.
Injekcija 1: 1:1 smeša (v/v) FCA/voda ili fiziološki rastvor.
Injekcija 2: nerazređeno pomoćno sredstvo.
Injekcija 3: 50% m/v formulacija vehikuluma u 1:1 smeši (v/v) FCA/voda ili fiziološki rastvor.
Dan 5-7 - tretirane i kontrolne grupe:
Ako ispitivana supstanca nije iritans, nakon šišanja odnosno brijanja i to otprilike 24 sata pre topikalne primene, na površinu kože nanosi se 0,5 mL 10% natrijum lauril sulfata u vazelinu, kako bi se izazvala lokalna iritacija kože.
Dan 6-8 - tretirana grupa:
Sa tretiranog dela kože ponovo se uklanja dlaka. Na filter papir veličine 2 cm x 4 cm nanese se u debelom sloju ispitivana supstanca rastvorena u odgovarajućem vehikulumu i drži u kontaktu sa kožom uz pomoć okluzivnog zavoja narednih 48 sati. Izbor vehikuluma potrebno je obrazložiti. Čvrste supstance se pre primene usitne do praha i suspenduju u odgovarajućem vehikulumu. Tečnosti se mogu primeniti i nerazblažene.
Dan 6-8 - kontrolna grupa:
Sa površine kože koja se ponovno tretira uklanja se dlaka. Zatim se samo vehikulum, bez ispitivane supstance, nanosi na kožu uz pomoć okluzivnog zavoja i drži u kontaktu sa kožom narednih 48 sati.
1.5.1.3.2. Provokacija
Dan 20-22 - tretirane i kontrolne grupe:
Sa bokova životinja iz tretiranih i kontrolnih grupa uklanja se dlaka. Na jedan bok svake životinje nanosi se obloga dobro natopljena ispitivanom supstancom, a na drugi bok obloga natopljena vehikulumom. Obloge se drže u kontaktu sa kožom naredna 24 sata pomoću okluzivnog zavoja.
1.5.1.3.3. Posmatranja i ocenjivanje: tretirane i kontrolne grupe
Približno 21 sat nakon uklanjanja obloga sa mesta provokacije, koža na tom mestu se, po potrebi, čisti i ponovo brija ili depilira.
Približno 3 sata kasnije (48 sati od početka provokacije) posmatraju se reakcije na koži i ocenjuju prema kriterijumima i ocenama datim u Delu drugom ove metode.
Približno 24 sata nakon prve ocene (nakon ukupno 72 sata) obavlja se i drugo posmatranje reakcija na koži i beleži se ocena.
Preporučuje se nasumično ocenjivanje životinja iz tretiranih i kontrolnih grupa.
Ako je potrebno pojasniti rezultate dobijene nakon prve provokacije, može se obaviti i druga provokacija, i to nakon približno nedelju dana, sa odgovarajućom novom kontrolnom grupom. Druga provokacija može se obaviti i na životinjama iz originalne kontrolne grupe. Sve reakcije na koži kao i neuobičajeni nalazi, uključujući sistemske reakcije, koji su posledica indukcije ili provokacije ispitivanom supstancom beleže se i ocenjuju prema Magnusson/Kligman skali (videti Deo drugi ove metode). Drugi postupci, kao što su histopatološka ispitivanja, merenja debljine kože i sl., mogu se obaviti kako bi se razjasnile nedovoljno jasne reakcije.
1.5.2. Buehler test
1.5.2.1. Priprema
Zdravi, mladi albino zamorci drže se radi privikavanja najmanje pet dana pre početka ispitivanja u eksperimentalnim uslovima. Pre ispitivanja, nasumičnim izborom, životinje se razvrstavaju u grupe za tretman. Uklanjanje dlake sa kože životinja vrši se šišanjem, brijanjem ili hemijskom depilacijom, u zavisnosti od primenjene metode ispitivanja. Pazi se da ne dođe do oštećenja kože. Telesna masa životinja meri se pre početka ispitivanja i na kraju ispitivanja.
1.5.2.2. Uslovi ispitivanja
1.5.2.2.1. Eksperimentalne životinje
Koriste se već uobičajene vrste albino zamoraca.
1.5.2.2.2. Broj i pol
Koriste se mužjaci ili ženke. Ako se koriste ženke, ispitivanje se vrši na ženkama koje nisu ranije rađale i koje nisu gravidne.
Minimum 20 životinja koristi se u tretiranoj grupi i najmanje 10 životinja u kontrolnoj grupi.
1.5.2.2.3. Dozni nivoi
Koncentracija ispitivane supstance koja se koristi pri indukciji mora biti najveća moguća koja će prouzrokovati blagu, ali ne prekomernu iritaciju kože. Koncentracija koja se koristi za provokaciju mora biti najveća koncentracija koja ne izaziva iritaciju kože. Ako je potrebno, odgovarajuća koncentracija može se odrediti iz probnog ispitivanja na dve ili tri životinje.
U slučaju ispitivanih supstanci koje su rastvorljive u vodi, najbolje je koristiti vodu ili razblaženi nenadražujući surfaktant kao vehikulum. U slučaju drugih ispitivanih supstanci za indukciju preporučuje se korišćenje smeše 80% etanol/voda, a za provokaciju aceton.
1.5.2.3. Postupak
1.5.2.3.1. Indukcija
Dan 0 - tretirana grupa:
Sa jednog boka životinje šišanjem se uklanja dlaka. Sistem "patch" testa se priprema sa ispitivanom supstancom rastvorenom u odgovarajućem vehikuklumu (izbor vehikuluma potrebno je obrazložiti; ispitivane supstance u tečnom stanju mogu se primeniti i nerazblažene).
"Patch" sistem sa ispitivanom supstancom primenjuje se na površinu kože uz pomoć okluzivnog zavoja i drži u kontaktu s kožom narednih 6 sati.
U ovoj vrsti ispitivanja koristi se okluzivni zavoj, a kao obloga može poslužiti okrugao ili kvadratni komadić pamučne gaze, površine 4 cm2-6 cm2. Kako bi se sprečilo da životinja skine oblogu, može se na mesto primene staviti odgovarajuća prepreka ili dodatni zavoj. U slučaju korišćenja dodatnog zavoja, možda će biti potrebno ponoviti tretman.
Dan 0 - kontrolna grupa:
Sa jednog boka životinje brija se koža. Na oblogu se nanosi samo vehikulum koje se potom pomoću zavoja drži u kontaktu sa kožom narednih 6 sati, kao i u slučaju životinja iz ispitivane grupe.
Dani 6-8 i 13-15 - tretirane i kontrolne grupe:
Na dane 6-8 i 13-15 primena ispitivane supstance obavlja se na istom mestu na boku životinje kao i na dan 0 (po potrebi, dlaka se ponovno uklanja).
1.5.2.3.2. Provokacija
Dani 27-29 - tretirane i kontrolne grupe:
Sa netretiranog boka životinja iz ispitivane i kontrolne grupe brijanjem se uklanja dlaka. Na tako pripremljen deo kože stavlja se okluzivni zavoj sa oblogom na koji je prethodno naneta odgovarajuća količina ispitivane supstance u najvećoj mogućoj koncentraciji koja neće izazvati iritaciju kože.
Kada je neophodno, okluzivni zavoj koji sadrži samo vehikulum takođe se nanosi na kožu netretiranog boka životinja iz ispitivane i kontrolne grupe. Obloge se drže u kontaktu s kožom narednih 6 sati.
1.5.2.3.3. Posmatranje i stepenovanje
Približno 21 sat nakon uklanjanja obloge sa mesta provokacije uklanja se dlaka sa kože na tom mestu.
Približno 3 sata kasnije (tj. približno 30 sati nakon provokacije) posmatraju se reakcije na koži i ocenjuju prema kriterijumima i ocenama datim u Delu drugom ove metode.
Otprilike 24 sata nakon prve ocene (približno 54 sata nakon provokacije) obavlja se i drugo posmatranje reakcija na koži, i beleže ocene.
Preporučuje se nasumično ocenjivanje životinja iz tretiranih i kontrolnih grupa.
Ako je potrebno dodatno pojasniti rezultate dobijene nakon prve provokacije, obavlja se i druga provokacija, i to nakon približno nedelju dana, sa odgovarajućom novom kontrolnom grupom.
Druga provokacija može se obaviti i na životinjama iz originalne kontrolne grupe
Sve reakcije na koži kao i neuobičajeni nalazi, uključujući sistemske reakcije koje su posledica indukcije ili provokacije ispitivanom supstancom beleže se i ocenjuju prema Magnusson/Kligman skali (videti Deo drugi ove metode). Drugi postupci, kao što su histopatološka ispitivanja, merenja debljine kože i sl., mogu se obaviti kako bi se objasnile nedovoljno jasne reakcije.
2. PODACI (GPMT i Buehler test)
Podaci se prikazuju tabelarno. Za svaku životinju navode se uočene reakcije na koži pri svakom posmatranju.
3. IZVEŠTAJ O ISPITIVANJU (GPMT i Buehler test)
Ako se skrining ispitivanje obavlja pre ispitivanja na zamorcima, daje se opis obavljenog ispitivanja ili se poziva na preporuku (Mouse Ear Swelling Test, MEST) i iznose se detalji postupka zajedno sa rezultatima dobijenim u sklopu ispitivanja obavljenih sa ispitivanom i referentnom supstancom.
Pisanje izveštaja (GPMT i Buehler test)
Izveštaj o ispitivanju sadrži:
1. Podatke o eksperimentalnim životinjama:
- soj zamoraca;
- broj, starost i pol životinja;
- poreklo, uslove smeštaja, ishrane, itd.;
- telesnu masu pojedinačnih životinja na početku ispitivanja.
2. Podatke o uslovima ispitivanja:
- način pripreme kože;
- detaljan opis pripreme flastera i obloga;
- rezultate probnog ispitivanja sa zaključkom o koncentracijama koje će se koristiti za indukciju i provokaciju;
- detalje pripreme ispitivane supstance, njene primene na kožu i uklanjanja;
- obrazloženje za izbor vehikuluma;
- koncentracije ispitivane supstance i vehikuluma za indukciju i provokaciju, kao i ukupnu količinu primenjene ispitivane supstance u indukciji i provokaciji.
3. Rezultate:
- kratak pregled rezultata posljednjeg ispitivanja senzibilizacije i pouzdanosti (videti odeljak 1.3. ove metode) uključujući podatke o ispitivanoj supstanci, koncentraciji i vehikulumu;
- pojedinačno prikazane za svaku životinju uključujući i sistem ocenjivanja;
- opis vrste i stepena ozbiljnosti uočenih efekata na koži;
- sve histopatološke nalaze.
4. Tumačenje rezultata.
5. Zaključke.
4. LITERATURA
Ova metoda ispitivanja zasniva se na Uputstvu za ispitivanje OECD TG 406.
Deo drugi
MAGNUSSON/KLIGMAN SKALA ZA OCENU REAKCIJA USLED PROVOKACIJE ISPITIVANOM SUPSTANCOM "PATCH" TESTOM
0 nema vidljivih promena
1 diskretan ili mestimičan (nehomogen) eritem
2 srednje izražen i raširen eritem
3 izražen eritem i otok
B.7. AKUTNA (ORALNA) TOKSIČNOST (28 DANA)
- PONOVLJENE DOZE
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod.
1.2. DEFINICIJE
Videti Opšti uvod.
1.3. PRINCIP METODE ISPITIVANJA
Ispitivana supstanca primenjuje se peroralno u rastućim dozama na nekoliko različitih grupa eksperimentalnih životinja. Na jednu grupu životinja primenjuje se jedna doza tokom 28 dana. Tokom primene ispitivane supstance životinje se posmatraju svakodnevno kako bi se zabeležili znakovi toksičnosti. Životinje koje uginu tokom ispitivanja podvrgavaju se postmortalnom pregledu, a na kraju eksperimenta i preživele životinje se lišavaju života na human način i podvrgavaju postmortalnom pregledu.
Ova metoda ispitivanja stavlja veći naglasak na neurološke efekte i potrebu za pažljivim kliničkim posmatranjem životinja kako bi se prikupilo što više podataka. Metoda ispitivanja je razvijena kako bi omogućila identifikaciju hemikalija s neurotoksičnim potencijalom, koje zahtevaju dodatna ispitivanja ovog aspekta. Pored toga, metoda ispitivanja može ukazivati i na imunološke efekte ispitivane supstance kao i na toksičnost po reprodukciju.
1.4. OPIS METODE ISPITIVANJA
1.4.1. Priprema
Zdrave mlade odrasle jedinke nasumično se grupišu u ispitivane i kontrolnu grupu. Kavezi su takvi da se mogući efekti smeštaja svedu na minimum. Životinje se obeležavaju i drže u kavezima najmanje pet dana pre početka ispitivanja kako bi se prilagodile na laboratorijske uslove.
Ispitivana supstanca dozira se ili putem hrane ili putem vode za piće ili direktno, sondom u želudac. Metoda oralne primene zavisi od cilja studije i od fizičko-hemijskih svojstava supstance.
Kada je potrebno ispitivana supstanca se rastvara ili suspenduje u odgovarajućem vehikulumu. Preporučuje se, kad god je moguće, primena vodenog rastvora/suspenzije, a tek zatim rastvora ili emulzije u ulju (npr. kukuruznom ulju) ili nekom drugom sredstvu. Ako se koristi vehikulum koje nije voda, kod tumačenja rezultata uzimaju se u obzir i potencijalni toksični efekti tog vehikuluma. Potrebno je odrediti i stabilnost ispitivane supstance u vehikulumu.
1.4.2. Uslovi ispitivanja
1.4.2.1. Eksperimentalne životinje
Preporučuje se korišćenje mladih, zdravih pacova i to sojeva koji se najčešće koriste u laboratorijskim eksperimentima. Moguće je koristiti i druge glodare. Ispitivanje se vrši na ženkama koje nisu ranije rađale i koje nisu gravidne. Doziranje je najbolje započeti odmah nakon prestanka sisanja, a u svakom slučaju pre nego što životinje navrše devet nedelja.
Na početku ispitivanja raspon telesnih masa pojedinačnih životinja ne treba da prelazi ± 20% od srednje vrednosti za svaki pol.
Kada se ispitivanje sa ponovljenim oralnim dozama obavlja kao prethodno za dugoročne studije, životinje istog soja i iz istog izvora koriste se u oba ispitivanja.
1.4.2.2. Broj i pol
Najmanje 10 životinja (pet ženki i pet mužjaka) koristi se za svaki dozni nivo. Ako se u toku eksperimenta planiraju privremena lišavanja života na human način, broj životinja u eksperimentu povećava se za broj koji se planira da se liši života u toku ispitivanja.
Dodatno, prateća grupa od 10 životinja (po pet svakog pola) može se izlagati visokim dozama ispitivane supstance u periodu od 28 dana, kako bi se 14 dana nakon tretmana zabeležila reverzibilnost, postojanost ili odložena pojava toksičnih efekata. Potrebno je uključiti i grupu od 10 kontrolnih životinja (ponovo po pet životinja svakog pola).
1.4.2.3. Dozni nivoi
Koristite se najmanje tri tretirane grupe, zajedno sa istovremenom kontrolnom grupom. Osim što se životinjama u kontrolnim grupama ne daje ispitivana supstanca, sa životinjama se postupa identično kao sa životinjama iz tretiranih grupa. Ako je korišćen vehikulum, kontrolna grupa dobija vehikulum u najvećoj korišćenoj zapremini.
Ako se procenom postojećih podataka, za ispitivanu supstancu u koncentraciji od 1.000 mg/kg TM/dan, ne očekuju nikakvi efekti, preporučuje se obavljanje ispitivanja granične doze. Ako ne postoje odgovarajući podaci za takvu procenu, može se sprovesti ispitivanje sa ciljem određivanja doza koje će se primeniti.
Doze ispitivane supstance biraju se uzimajući u obzir toksikološke ili toksikokinetičke podatke koji već postoje za ispitivanu supstancu ili strukturno slične supstance. Najveća doza bira se tako da izazove toksični efekat, ali ne i smrt ili tešku patnju životinja. Potom se redom biraju opadajuće koncentracije sa ciljem demonstriranja efekata vezanih za primenjenu dozu sve dok se ne dođe do doze bez štetnog efekta, tj. "no-observed-adverse-effects-level" (NOAEL). Doze se smanjuju progresivno za faktor dva do četiri puta, a dodatak četvrte ispitivane doze preporučuje se umesto korišćenja veoma velikih intervala (npr. većih od faktora 10) između doza.
Za supstance koje se doziraju putem hrane ili vode za piće, važno je prethodno proveriti da količina ispitivane supstance dodata u obrok ne utiče štetno na ishranu ili ravnotežu vode. Kada se ispitivana supstanca dodaje hrani, ona se primenjuje ili u konstantnoj koncentraciji (ppm) ili u konstantnoj dozi izraženoj u jedinicama po telesnoj masi životinje. U svakom slučaju potrebno je propisati odabrani način doziranja. Ako se supstanca primenjuje putem sonde u želudac, doziranje se obavlja približno u isto vreme svaki dan, i podešava se po potrebi kako bi se održao konstantan dozni nivo u odnosu na telesnu masu životinje.
Kada se ispitivanje sa ponovljenom dozom obavlja kao prethodno za dugotrajne studije, potrebno je u oba ispitivanja koristiti sličnu ishranu.
1.4.2.4. Ispitivanje granične doze
Ako ispitivanje doze od 1.000 mg/kg TM/dan, ili ekvivalentne doze u slučaju primene putem vode za piće ili hrane (preračunato iz vrednosti za telesnu masu) ne dovodi ni do kakvih toksičnih efekata, i ako se toksični efekti ne očekuju iz podataka za strukturno slične supstance, nije potrebno obaviti kompletno ispitivanje sa sve tri doze. Ispitivanje granične doze primenjuje se u svim slučajevima, osim u onim gde predviđena izloženost ispitivanoj supstanci kod ljudi ne zahteva primenu veće doze.
1.4.2.5. Vreme posmatranja
Vreme posmatranja je 28 dana. Životinje iz prateće grupe koje su predviđene za naknadna posmatranja zadržavaju se još najmanje dodatnih 14 dana bez tretmana kako bi se uočila postojanost toksičnih efekata, odložena pojava efekata ili oporavak od istih.
1.4.3. Postupak
Životinje se doziraju sa ispitivanom supstancom svaki dan, sedam dana u nedelji, tokom perioda od 28 dana, a primena petodnevnog režima doziranja dodatno se obrazlaže. U slučaju doziranja putem sonde, ispitivana supstanca se primenjuje u jednoj dozi direktno u želudac, nakon intubiranja. Maksimalna zapremina tečnosti koji se može u jednom doziranju primeniti zavisi od veličine eksperimentalne životinje. Zapremina ne sme da pređe 1 mL/100 g TM životinje, izuzev u slučajevima kad se koriste vodeni rastvori i kada je dozvoljeno primeniti 2 mL/100 g TM životinje. Variranje zapremine ispitivane supstance potrebno je minimizirati prilagođavanjem koncentracije za svaku dozu, kako bi se obezbedila primena istih zapremina pri svim doznim nivoima.
1.4.3.1. Opšta posmatranja
Klinička posmatranja životinja obavljaju se najmanje jednom dnevno, ako je moguće u isto vreme svakog dana uzimajući u obzir očekivano vreme maksimalnog efekta nakon doziranja. Beleži se i zdravstveno stanje životinja. Najmanje dva puta dnevno vodi se beleška o smrtnosti ili životinjama na samrti. Životinje na samrti ili životinje koje trpe izrazitu patnju i bol uklanjaju se iz daljeg ispitivanja lišavanjem života na human način, i podvrgavaju se postmortalnom pregledu.
Jedanput pre inicijalnog izlaganja ispitivanoj supstanci (kako bi se omogućilo poređenje unutar grupe životinja), i najmanje jednom nedeljno nakon toga, obavljaju se detaljna klinička posmatranja svih životinja. Ova posmatranja najbolje je obaviti izvan kaveza u kome se životinja inače nalazi, i, ako je moguće, svaki put u isto vreme. Nalazi se pažljivo beleže i pomoću sistema ocenjivanja koji je definisala laboratorija koja vrši ispitivanja. Promene u uslovima ispitivanja treba da budu minimalne, a nalaze da beleže objektivni posmatrači koji nisu upućeni u detalje ispitivanja na životinjama. Beleže se promene na koži, krznu, očima, sluznici, kao i pojava sekreta/izlučevina i obeležja autonomne aktivnosti (npr. suzenje, piloerekcija, veličina zenice, neuobičajen način disanja). Potrebno je posmatrati i promene u hodu, držanju ili promene uzrokovane rukovanjem životinjama, kao i prisutnost toničko-kloničnih pokreta i stereotipnog ponašanja (npr. preterano čišćenje, hodanje u krug) ili bizarnog ponašanja (npr. samopovređivanje, hodanje unazad).
U četvrtoj nedelji izlaganja ispitivanoj supstanci utvrđuje se reagovanje životinja na spoljne nadražaje različite prirode (npr. auditorne, vizuelne, proprioceptivne), procenu jačine stiska, i motornu aktivnost. Detalji o preporučenim postupcima dati su u literaturi (videti Opšti uvod).
Funkcionalna posmatranja obavljena u četvrtoj nedelji izlaganja mogu se izbeći kad se ispitivanje obavlja kao prethodna studija subhroničnom (90-dnevnom) ispitivanju. U tom slučaju, funkcionalna posmatranja mogu biti deo ovog dugotrajnijeg ispitivanja. S druge strane, dostupnost podataka o funkcionalnim posmatranjima izvedenih iz ispitivanja sa ponavljanim dozama omogućava lakši izbor doza za naknadno subhronično ispitivanje.
Izuzetno, funkcionalna posmatranja se mogu izbeći kod onih grupa životinja koje pokazuju znakove toksičnosti u meri koja značajno ometa obavljanje funkcionalnog ispitivanja.
1.4.3.2. Telesna masa i potrošnja hrane/vode
Telesna masa svih životinja meri se najmanje jednom nedeljno. Potrošnja hrane i vode beleži se najmanje jednom nedeljno. Ako se ispitivana supstanca daje putem vode za piće, vodi se evidencija o potrošnji vode i to najmanje jedanput nedeljno.
1.4.3.3. Hematološka ispitivanja
Na kraju ispitivanja potrebno je uraditi sledeća hematološka ispitivanja: odrediti hematokrit, koncentraciju hemoglobina, broj eritrocita, broj ukupnih i diferenciranih leukocita, broj trombocita, kao i koagulabilnost.
Uzorci krvi uzimaju se sa određenog mesta neposredno pre ili za vreme lišavanja života na human način, i čuvaju pod odgovarajućim uslovima.
1.4.3.4. Kliničko-biohemijska ispitivanja
Kliničko-biohemijska ispitivanja krvi obavljaju se sa ciljem ispitivanja toksičnih efekata u tkivima, posebno u jetri i bubrezima, i to na uzorcima krvi svih eksperimentalnih životinja neposredno pre ili za vreme lišavanja života na human način (osim onih koje su već pronađene mrtve ili koje su lišene života na human način u međuvremenu). Pre uzimanja uzoraka krviI preporučuje se uskraćivanje hrane životinjama preko noći. Ispitivanja u plazmi ili serumu uključuju i određivanje natrijuma, kalijuma, glukoze, ukupnog holesterola, uree, kreatinina, ukupnih proteina i albumina, i aktivnosti najmanje dva enzima kao indikatora hepatocelularnih efekata (kao što su: alanin aminotransferaza, aspartat aminotransferaza, alkalna fosfataza, gama glutamil transpeptidaza i sorbitol dehidrogenaza). Mogu se obaviti i merenja aktivnosti drugih enzima (enzimi jetre ili nekog drugog porekla) kao i žučnih kiselina što može pod određenim okolnostima obezbediti korisne informacije.
Neobavezno, tokom poslednje nedelje ispitivanja, mogu se obaviti i sledeći pregledi urina sakupljenog u određenom vremenu: odrediti izgled, zapreminu, osmolalnost ili specifičnu gustinu, pH, proteine, glukozu i prisutnost krvi/krvnih ćelija u urinu.
Razmatra se mogućnost određivanja serumskih markera koji ukazuju na opšte oštećenje tkiva. Ako se sumnja da ispitivana supstanca deluje na metaboličke procese, obavljaju se i druga određivanja, kao što su određivanje koncentracije kalcijuma, fosfora, triglicerida, nivoa specifičnih hormona, methemoglobina, i aktivnost holinesteraze. Svi ovi parametri određuju se pri ispitivanju hemikalija iz određenih klasa, tj. u određenim slučajevima.
Preporučuje se fleksibilan pristup koji zavisi od vrste ispitivane životinje odnosno očekivanog efekta date supstance.
Ako ne postoje adekvatni podaci o kontrolnim vrednostima parametara iz prethodnih ispitivanja, razmatra se potreba za određivanjem hematoloških i kliničko-biohemijskih parametara i pre nego što se započne sa doziranjem ispitivane supstance.
______________
I Za određivanje brojnih parametara iz seruma i plazme, a najviše za određivanje glukoze, preporučuje se gladovanje preko noći. Glavni razlog tome je značajno veća varijacija vrednosti kao posledica uzimanja hrane koja bi mogla da maskira suptilne efekte i oteža tumačenje rezultata. S druge strane, gladovanje preko noći može uticati na opšti metabolizam životinja i, posebno u slučaju davanja ispitivane supstance putem hrane, poremetiti dnevnu izloženost ispitivanoj supstanci. Ako se usvoji gladovanje preko noći, kliničko-biohemijska ispitivanja potrebno je obaviti nakon izvođenja funkcionalnih posmatranja u četvrtoj nedelji ispitivanja.
1.4.3.5. Postmortalni pregled
Sve životinje koje se koriste u ispitivanju podvrgavaju se detaljnom postmortalnom pregledu, koja uključuje pažljiv pregled spoljašnje površine tela, uključujući sve otvore, lobanju, grudnu i trbušnu duplju. Jetru, bubrege, nadbubrežne žlezde, testise, semenike, timus, slezenu, mozak i srce svih životinja potrebno je odvojiti od okolnog tkiva, i što je pre moguće, vlažne izmeriti odmah nakon sekcije kako bi se izbeglo sušenje.
Sledeće vrste tkiva čuvaju se u medijumu za fiksiranje radi naknadnog izvođenja histopatoloških pregleda: sva vidljivo oštećena tkiva, mozak (reprezentativne regije, uključujući veliki mozak, mali mozak i produženu moždinu), kičmena moždina, želudac, tanko i debelo crevo (uključujući Pajerove ploče), jetra, bubrezi, nadbubrežne žlezde, slezina, srce, timus, štitna žlezda, dušnik, pluća (ubrizgavanjem fiksatora pa potom uranjanjem u isti medijum), polne žlezde, pomoćni polni organi (npr. materica, prostata), mokraćna bešika, limfni čvorovi (po mogućnosti, jedan uzet sa puta unosa ispitivane supstance u organizam, i drugi, udaljen od njega kako bi se proučili sistemski efekti), periferni nerv (n. ischiadicus ili n. tibialis), po mogućstvu smešten uz sam mišić, i isečak kostne srži (ili svež aspirat kostne srži). Klinički i drugi nalazi mogu uputiti na potrebu za ispitivanjem i drugih tkiva. Čuvaju se i svi organi koji se na osnovu saznanja o svojstvima ispitivane supstance smatraju ciljnim.
1.4.3.6. Histopatološka ispitivanja
Kompletna histopatološka ispitivanja obavljaju se na sačuvanim organima i tkivima svih životinja iz kontrolne grupe, i grupe izložene visokoj dozi ispitivane supstance. Ako se primete promene kod životinja na koje je primenjena visoka doza ispitivane supstance, histopatološka ispitivanja se obavljaju i na životinjama iz svih ostalih grupa.
Ispituju se sve veće (makroskopski vidljive) lezije.
Ako je korišćena pomoćna grupa, histopatološkoj obradi se podvrgavaju tkiva i organi na kojima su se kod tretiranih životinja primetile neke promene.
2. PODACI
Za svaku životinju vode se posebni podaci. Podaci se prikazuju tabelarno gde se za svaku ispitivanu grupu životinja navodi broj životinja na početku ispitivanja, broj životinja koje su uginule ili su lišene života na human način za vreme ispitivanja (zajedno sa vremenom lišavanja života), kao i broj životinja kod kojih su pronađeni znakovi toksičnosti. Daje se i detaljan opis uočenih znakova toksičnosti, vreme kada su primećeni, njihovo vreme trajanja i stepen izraženosti, kao i broj životinja kod kojih su primećene lezije zajedno sa opisom tipa lezija i procentom životinja kod kojih su pronađene.
Kada je moguće, svi rezultati se analiziraju pomoću odgovarajuće statističke metode, koju je najbolje odabrati još u vreme planiranja ispitivanja.
3. IZVEŠTAJ O ISPITIVANJU
PISANJE IZVEŠTAJA
Izveštaj o ispitivanju sadrži:
1. Podatke o eksperimentalnim životinjama:
- vrstu/soj;
- broj, starost i pol životinja;
- poreklo životinja, uslove smeštaja, ishrane itd.;
- individualne telesne mase životinja na početku ispitivanja, kasnije u nedeljnim intervalima i na kraju ispitivanja.
2. Podatke o uslovima ispitivanja:
- obrazloženje za izbor pomoćnog sredstva, ako se ne radi o vodi;
- razloge za izbor doze/koncentracije ispitivane supstance;
- detalje o formulaciji ispitivane supstance, ishrani, postignutoj koncentraciji ispitivane supstance, stabilnosti i homogenosti pripremljene formulacije;
- detalje o načinu primene ispitivane supstance;
- ukoliko je primenljivo, preračunavanja koncentracije ispitivane supstance primenjene hranom ili putem vode (ppm) na dozu (mg/kg TM/dan);
- detalje o kvalitetu hrane i vode.
3. Rezultate:
- telesnu masu/promene u telesnoj masi;
- konzumiranje hrane i vode;
- podatke o zabeleženim toksičnim efektima prikazane po polu i primenjenoj dozi ispitivane supstance;
- podatke o prirodi, težini i trajanju kliničkih promena (da li su reverzibilne ili nisu);
- procenu senzorne aktivnosti, jačina stiska i motorne aktivnosti;
- rezultate hematoloških ispitivanja, sa relevantnim kontrolnim vrednostima;
- rezultate kliničko-biohemijskih ispitivanja sa relevantnim kontrolnim vrednostima;
- telesnu masu pre lišavanja života na human način i masu pojedinačnih organa;
- nalaze postmortalnog pregleda;
- detaljan opis svih histopatoloških nalaza;
- podatke o apsorpciji;
- statističku obradu rezultata, tamo gde je odgovarajuće.
4. Tumačenje rezultata.
5. Zaključke.
4. LITERATURA
Ova metoda ispitivanja oralne toksičnosti zasniva se na Uputstvu za ispitivanje OECD TG 407.
B.8. AKUTNA (INHALACIONA) TOKSIČNOST (28 DANA) - PONOVLJENE DOZE
1. METODA ISPITIVANJA
1.1. UVOD
Korisno je imati prethodne podatke o svojstvima ispitivane supstance kao što su: raspodela veličine čestica, pritisak pare, tačka topljenja, tačka ključanja, tačka paljenja i eksplozivnost (ako se radi o eksplozivnoj supstanci).
Videti Opšti uvod, Deo A.
1.2. DEFINICIJE
Videti Opšti uvod, Deo B.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE ISPITIVANJA
Grupe eksperimentalnih životinja dnevno se izlažu rastućim koncentracijama ispitivane supstance tokom vremenskog perioda od 28 dana. Svaka grupa životinja izlaže se jednoj koncentraciji. Kada je neophodno, koristi se i vehikulum koji omogućava postizanje odgovarajuće koncentracije ispitivane supstance u atmosferi. Za vehikulum se određuje i dodatna kontrolna grupa. Životinje se posmatraju svaki dan tokom vremena izlaganja ispitivanoj supstanci kako bi se uočili znakovi toksičnosti. Životinje koje uginu za vreme eksperimenta podvrgavaju se postmortalnom pregledu, a po završetku eksperimenta i preživele životinje se lišavaju života na human način i postmortalno pregledaju.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE ISPITIVANJA
1.6.1. Priprema
Životinje se drže u eksperimentalnim uslovima i hrane po definisanom eksperimentalnom režimu najmanje pet dana pre početka ispitivanja. Pre ispitivanja zdrave mlade jedinke nasumce se grupišu u prethodno definisan broj eksperimentalnih grupa. Kada je neophodno, dodaje se vehikulum koji omogućava postizanje odgovarajuće koncentracije ispitivane supstance u atmosferi. Odabrani vehikulum ne sme biti toksičan, što može da se potvrdi navodima postojeće literature.
1.6.2. Uslovi ispitivanja
1.6.2.1. Eksperimentalne životinje
Ako ne postoje kontraindikacije, preporučuje se korišćenje pacova i to sojeva koji se najčešće koriste u laboratorijskim ispitivanjima.
Na početku ispitivanja, raspon telesnih masa pojedinačnih životinja ne sme da pređe ± 20% od srednje vrednosti.
1.6.2.2. Broj i pol
Najmanje 10 glodara (pet ženki i pet mužjaka) koristi se za svaku ispitivanu koncentraciju. Ženke moraju biti takve da nisu ranije rađale i da nisu gravidne. Ako se u toku ispitivanja planiraju prevremena lišavanja života na human način, broj životinja u ispitivanju povećava se za broj koji je planiran za lišavanje života u toku ispitivanja. Prateća grupa od deset životinja (po pet životinja svakog pola) može se izlagati visokim koncentracijama ispitivane supstance u periodu od 28 dana, kako bi se 14 dana nakon tretmana zabeležile reverzibilnost, postojanost ili vremenski odložena pojava toksičnih efekata. Ukoliko se obavlja ovo posmatranje, uključuje se pomoćna grupa od 10 kontrolnih životinja (po pet svakog pola).
1.6.2.3. Koncentracije
Koriste se najmanje tri koncentracije ispitivane supstance, zajedno sa odgovarajućim kontrolama (ako se koristi vehikulum, druga kontrola sadrži vehikulum u najvećoj datoj koncentraciji). Osim primene ispitivane supstance, sa životinjama u kontrolnim grupama postupa se na isti način kao sa životinjama iz ispitivanih grupa. Najveća koncentracija ispitivane supstance treba da izazove toksične efekte, ali bez ili sa minimalnim brojem uginulih životinja. Najniža koncentracija ne treba da izazove toksične efekte. Kada je moguće predvideti izloženost ispitivanoj supstanci kod ljudi, najniža koncentracija primenjena na životinje treba da bude malo viša od ove vrednosti. Idealno, srednja koncentracija ispitivane supstance izaziva minimalne toksične efekte. Ako se koristi nekoliko srednjih koncentracija, tada su njihove vrednosti pravilno razmaknute kako bi se postigla gradacija toksičnih efekata. U grupama kod kojih su primenjene niske ili srednje koncentracije ispitivane supstance, kao i u kontrolnim grupama, učestalost smrtnih slučajeva kod životinja treba da bude niska kako bi interpretacija rezultata imala smisla.
1.6.2.4. Dužina izlaganja
Trajanje izlaganja tokom jednog dana je šest sati. Drugi vremenski intervali mogu se definisati po potrebi.
1.6.2.5. Oprema
Životinje se podvrgavaju ispitivanju pomoću opreme kojom se može održavati konstantni protok vazduha sa najmanje 12 potpunih izmena u jednom satu, kako bi se obezbedila odgovarajuća koncentracija kiseonika i ravnomerno raspoređena atmosfera. Kada se koristi komora, njen dizajn mora da bude dovoljno prostran da minimizira skučenost životinja i omogući maksimalnu izloženost ispitivanoj supstanci udisanjem. Kao opšte pravilo koje obezbeđuje stabilnost atmosfere u komori koristi se mera prema kojoj "zapremina" životinja ne sme da bude veća od 5% ukupne zapremine komore. Koriste se različiti tipovi komora koji omogućavaju izloženost čitavog tela, samo glave ili samo oro-nazalnih otvora životinje, a ove posljednje dve komore minimiziraju izloženost ispitivanoj supstanci nekim drugim putem unosa.
1.6.2.6. Vreme posmatranja
Eksperimentalne životinje posmatraju se svaki dan kako bi se uočili znakovi toksičnosti i to tokom trajanja čitavog eksperimenta kao i za vreme oporavka. Važno je zabeležiti vreme pojave ili nestanka prvih znakova trovanja, kao i vreme uginuća.
1.6.3. Postupak
Životinje se svakodnevno izlažu ispitivanoj supstanci, ili pet do sedam dana u nedelji, u vremenskom periodu od 28 dana. Životinje iz pratećih grupa koje su predviđene za naknadna praćenja zadržavaju se dodatnih 14 dana bez tretmana kako bi se zabeležila postojanost toksičnih efekata ili oporavak.
Temperatura na kojoj se obavlja ispitivanje održava se na 22° C ± 3° C. Relativna vlažnost je između 30% i 70%, ali u nekim slučajevima (npr. kod ispitivanja aerosola) ovo nije izvodljivo. Održavanjem negativnog pritiska unutar komore (± 5 mm vode) sprečava se izlazak ispitivane supstance u okolinu. Za vreme izlaganja ispitivanoj supstanci životinjama se ne daje hrana i voda.
U toku ispitivanja koristi se odgovarajući dinamični sistem sa mogućnošću kontrole koncentracije ispitivane supstance. Za uspostavljanje odgovarajuće koncentracije ispitivane supstance, preporučuje se obavljanje probnog ispitivanja. Komora je dizajnirana na takav način da omogućava homogenu distribuciju vazduha za vreme trajanja eksperimenta. Sistem mora da omogući stabilne uslove i njihovo uspostavljanje u što kraćem vremenskom periodu.
Sprovode se merenja i prate sledeći parametri:
a) brzina protoka vazduha (kontinuirano);
b) koncentracije ispitivane supstance u zoni udisanja. Tokom dnevnih izlaganja, koncentracija ispitivane supstance ne sme da varira više od ± 15% od srednje vrednosti. Kod aerosola se teško postiže ovakva kontrola doziranja, pa se u tom slučaju tolerišu veće razlike u vrednostima. Za vreme trajanja kompletnog ispitivanja, dnevne koncentracije su što je moguće stabilnije. Za aerosole se obavlja i analiza veličine čestica (najmanje jedanput nedeljno u svakoj grupi životinja);
v) temperatura i vlažnost (kontinuirano, ako je moguće).
Opažanja se beleže sistematično za vreme i nakon izlaganja. Svaka životinja ima poseban karton. Životinje se prate svaki dan, a znakovi trovanja beleže se redovno, uključujući vreme pojave, ozbiljnost i trajanje. Beleže se promene na koži i krznu, očima, sluznici, respiratornom, kardiovaskularnom, autonomnom i centralnom nervnom sistemu, kao i somatomotorna aktivnost i način ponašanja. Jednom nedeljno određuje se telesna masa životinja i prati potrošnja hrane. Životinje se redovno prate kako bi se izbegao gubitak zbog kanibalizma ili autolize tkiva. Na kraju ispitivanja obavlja se postmortalni pregled svih preživelih životinja iz osnovnih (ne pratećih) ispitivanih grupa. Životinje koje su izrazito slabe ili na samrti izdvajaju se iz grupe i lišavaju života na human način, a potom se postmortalno pregledaju.
Sledeća ispitivanja sprovode se na kraju eksperimenta na svim životinjama, uključujući i one iz kontrolne grupe:
1) hematološka ispitivanja, uključujući hematokrit, koncentraciju hemoglobina, broj eritrocita, broj ukupnih i pojedinih loza leukocita, kao i koagulabilnost krvi;
2) kliničko-biohemijska ispitivanja krvi uključujući najmanje jedan parametar koji ukazuje na funkciju jetre i bubrega: alanin aminotransferaza (poznata i pod nazivom: glutamat piruvat transaminaza), aspartat aminotransferaza (poznata i pod nazivom: glutamat oksaloacetat transaminaza), azot uree, albumin, kreatinin, ukupni bilirubin i proteini u serumu.
Druga ispitivanja koja mogu biti potrebna za adekvatnu evaluaciju toksičnosti uključuju određivanje kalcijuma, fosfora, hlorida, natrijuma, kalijuma, glukoze (u uslovima gladovanja), lipida, hormona, acido-baznu ravnotežu methemoglobin i aktivnost holinesteraze.
Dodatne biohemijske analize obavljaju se po potrebi, kako bi se detaljnije proučili toksični efekti.
1.6.3.1. Postmortalni pregled
Sve eksperimentalne životinje detaljno se postmortalno pregledaju. Odmah nakon sekcije mere se, još vlažni, sledeći organi: jetra, bubrezi, nadbubrežne žlezde, pluća i testisi. Organi i tkiva (respiratorni trakt, jetra, bubrezi, slezina, testisi, nadbubrežne žlezde i srce, kao i drugi organi na kojima se primete promene u veličini) čuvaju se u odgovarajućem medijumu za dalja histopatološka ispitivanja. Pluća se vade netaknuta, mere i stavljaju u odgovarajući fiksator kako bi sačuvala sve strukture.
1.6.3.2. Histopatološka ispitivanja
U kontrolnim grupama i grupama izloženim visokim koncentracijama ispitivane supstance obavljaju se histološka ispitivanja izolovanih organa i tkiva. Organi i tkiva koji pokažu oštećenja koja se mogu pripisati visokim koncentracijama ispitivane supstance detaljno se ispituju i kod životinja koje su bile izložene nižim koncentracijama. Životinje iz pratećih grupa takođe je potrebno histološki obraditi sa posebnom pažnjom na organima i tkivima koja su pokazala promene i kod životinja iz drugih ispitivanih grupa.
2. PODACI
Podaci se prikazuju tabelarno gde se za svaku ispitivanu grupu životinja navodi broj životinja na početku eksperimenta, kao i broj životinja kod kojih su pronađene promene.
Svi dobijeni rezultati analiziraju se pomoću odgovarajuće statističke metode. Koristi se bilo koja prihvaćena statistička metoda.
3. IZVEŠTAJ O REZULTATIMA
3.1. PISANJE IZVEŠTAJA
Izveštaj o ispitivanju sadrži:
1. Podatke o eksperimentalnim životinjama:
- vrstu, soj, poreklo, uslove čuvanja, ishrane, itd.
2. Podatke o uslovima ispitivanja:
- opis komore ili aparature uključujući dizajn, tip, dimenzije, izvor vazduha, sistem za raspršivanje aerosola, metode za kondicioniranje vazduha i način čuvanja životinja u komori. Opisuje se i aparaturu za merenje temperature, vlažnosti, koncentracije aerosola i određivanje raspodele veličine čestica.
3. Podatke o izlaganju ispitivanoj supstanci:
- ovi podaci prikazuju se tabelarno u vidu srednjih vrednosti sa odstupanjima (standardna devijacija), a ako je moguće sadrže i podatke o:
a) brzini protoka vazduha kroz otvore u aparaturi;
b) temperaturi i vlažnosti vazduha;
v) nominalnoj koncentraciji (ukupnom sadržaju ispitivane supstance koja se uvodi kroz otvore u aparaturi, podeljenom sa zapreminom vazduha);
g) prirodi vehikuluma, ako je korišćen;
d) tačnoj koncentraciji supstance u zoni udisanja;
đ) srednjem masenom aerodinamičkom dijametru (MMAD) i geometrijskoj standardnoj devijaciji (GSD).
4. Podatke o nalazima o toksičnim efektima predstavljenim u odnosu na pol životinja i koncentraciju ispitivane supstance.
5. Vreme uginuća u toku eksperimenta, tj. da li su životinje preživele eksperiment.
6. Opis toksičnih i ostalih efekata; koncentraciju bez efekta.
7. Vreme pojave abnormalnosti i njihov kasniji tok.
8. Podatke o ishrani i telesnoj masi.
9. Podatke o hematološkim ispitivanjima i nalazima.
10. Rezultate kliničko-biohemijskih ispitivanja.
11. Nalaze postmortalnog pregleda.
12. Detaljan opis svih histopatoloških nalaza.
13. Statističku obradu rezultata gde je moguće.
14. Raspravu o rezultatima.
15. Tumačenje rezultata.
3.2. PROCENA I TUMAČENJE
Videti Opšti uvod, Deo G.
4. LITERATURA
Videti Opšti uvod, Deo D.
B.9. AKUTNA (DERMALNA) TOKSIČNOST(28 DANA)
- PONOVLJENE DOZE
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod, Deo A.
1.2. DEFINICIJA
Videti Opšti uvod, Deo B.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE ISPITIVANJA
Ispitivana supstanca primenjuje se svakodnevno na kožu životinja podeljenih u grupe u rastućim dozama. Na jednu grupu životinja primenjuje se jedna doza tokom perioda od 28 dana. Tokom primene ispitivane supstance životinje se svakodnevno posmatraju kako bi se beležili znakovi toksičnosti. Životinje koje uginu tokom ispitivanja postmortalno pregledaju se, a na kraju eksperimenta i preživele životinje se lišavaju života na human način i postmortalno pregledaju.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE ISPITIVANJA
1.6.1. Priprema
Životinje se drže u eksperimentalnim uslovima i hrane po definisanom eksperimentalnom režimu najmanje pet dana pre početka ispitivanja. Pre ispitivanja, zdrave mlade životinje nasumce se dele u ispitivane i kontrolne grupe. Neposredno pre početka ispitivanja, životinjama se uklanja krzno sa dorzalnog dela tela. Krzno se može ukloniti i brijanjem, ali je u tom slučaju brijanje potrebno uraditi 24 sata pre ispitivanja. Šišanje i brijanje se ponavljaju jednom nedeljno. Kod uklanjanja krzna, pazi se da ne dođe do oštećenja kože. Za primenu ispitivane supstance čisti se najmanje 10% ukupne površine kože životinje. Kod procene površine i dimenzija kože koja se čisti uzima se u obzir i telesna masa životinje. Ako se ispituje čvrsta supstanca, koja se po potrebi može usitniti do praha, dobijeni prašak potrebno je dobro ovlažiti vodom ili nekim drugim vehikulumom kako bi se omogućio dobar kontakt sa kožom. Ako se koristi neki vehikulum, uzima se u obzir i njegov uticaj na prodiranje ispitivane supstance kroz kožu. Ispitivane supstance koje se već nalaze u tečnom obliku, najčešće se koriste nerazblažene. Ispitivana supstanca se primenjuje na kožu između pet do sedam dana nedeljno.
1.6.2. Uslovi ispitivanja
1.6.2.1. Eksperimentalne životinje
Za ovakav tip ispitivanja najčešće se koriste odrasli pacovi, kunići ili zamorci. Ako se koriste druge vrste laboratorijskih životinja, daje se obrazloženje za ovo korišćenje.
Na početku eksperimenta raspon telesnih masa životinja ne sme da prelazi ± 20% od odgovarajuće srednje vrednosti.
1.6.2.2. Broj i pol
Najmanje 10 životinja (5 mužjaka i 5 ženki) sa zdravom kožom koriste se za svaku ispitivanu dozu. Ispitivanje se vrši na ženkama koje nisu ranije rađale i koje nisu gravidne. Ako se u toku eksperimenta planiraju prevremena lišavanja života na human način, broj životinja u eksperimentu povećava se za broj koji se planira lišiti života u toku ispitivanja. Prateća grupa od 10 životinja (po pet svakog pola) može da se izloži visokim koncentracijama ispitivane supstance u periodu od 28 dana, kako bi se 14 dana nakon tretmana zabeležile reverzibilnost, postojanost ili odložena pojava toksičnih efekata. Ukoliko se obavlja ovo posmatranje, uključuje se pomoćna grupa od 10 kontrolnih životinja (po pet svakog pola).
1.6.2.3. Dozni nivoi
Koriste se najmanje tri doze ispitivane supstance, zajedno sa odgovarajućim kontrolama (ako se koristi vehikulum, druga kontrola se izlaže vehikulumu). Vreme izlaganja je najmanje šest sati dnevno. Ispitivana supstanca nanosi se na kožu u približno isto vreme svakog dana, a naneta doza se prilagođava (jedanput ili dva puta nedeljno) promenama telesne mase životinje. Osim primene ispitivane supstance, sa životinjama u kontrolnim grupama postupa se identično kao sa životinjama iz ispitivanih grupa. Ako se koristi vehikulum, kontrolna grupa životinja dozira se vehikulumom na isti način kao i ispitivana grupa kojoj je primenjena najveća doza. Najveća doza ispitivane supstance treba da izazove toksične efekte kod životinja, ali bez ili sa minimalnim brojem uginulih životinja. Najniža koncentracija ne treba da izazove toksične efekte.
Kada je moguće predvideti izloženost ispitivanoj supstanci kod ljudi, najniža koncentracija primenjena na životinje treba da bude malo viša od ove vrednosti. Idealno, srednja koncentracija ispitivane supstance izaziva minimalne toksične efekte. Ako se koristi nekoliko srednjih koncentracija, njihove vrednosti su pravilno raspoređene kako bi se postigla gradacija toksičnih efekata. U grupama kod kojih su primenjene niske ili srednje koncentracije ispitivane supstance, kao i u kontrolnim grupama, učestalost smrtnih slučajeva kod životinja treba da bude niska kako bi tumačenje rezultata imalo smisla.
Ako primena ispitivane supstance izaziva tešku iritaciju kože, doze se smanjuju, što može uticati na smanjenje ili potpuni nestanak drugih toksičnih efekata kod visokih doza. Ako dođe do izrazitih oštećenja kože, preporučuje se okončavanje ispitivanja i početak novog ispitivanja sa nižim koncentracijama ispitivane supstance.
1.6.2.4. Ispitivanje granične doze
Ako prethodno ispitivanje sa dozom od 1.000 mg/kg ili većom dozom u slučajevima kada se predviđa izloženost ljudi većoj dozi ne rezultira toksičnim efektima, nastavak ispitivanja smatra se nepotrebnim.
1.6.2.5. Vreme posmatranja
Eksperimentalne životinje posmatraju se svakog dana kako bi se uočili znakovi toksičnosti. Beleži se vreme pojave ili nestanka prvih znakova toksičnosti, kao i vreme uginuća.
1.6.3. Postupak
Životinje se drže u zasebnim kavezima. U idealnim uslovima, životinje se tretiraju sedam dana u nedelji, tokom perioda od 28 dana. Životinje iz pratećih grupa koje su predviđene za naknadna praćenja zadržavaju se dodatnih 14 dana bez tretmana kako bi se zabeležila postojanost toksičnih efekata ili oporavak. Vreme izlaganja je najmanje šest sati dnevno.
Ispitivana supstanca primenjuje se ravnomerno preko čitave površine koja iznosi otprilike 10% od ukupne površine kože. U slučaju veoma toksičnih supstanci, izložena površina može biti i manja, ali je potrebno primenjeni sloj ravnomerno rasporediti u što je moguće tanjem sloju.
Tokom ispitivanja ispitivana supstanca se drži u kontaktu sa kožom pomoću porozne gaze i flastera koji ne izaziva iritaciju kože. Mesto primene dodatno se može prekriti kako bi se onemogućila ingestija ispitivane supstance. Ako je neophodno, životinji se stavljaju i dodatni štitnici kojima se sprečava direktan kontakt sa tretiranom kožom, ali se ne preporučuje kompletna imobilizacija životinje. Kao alternativa koristi se zaštitni okovratnik.
Nakon propisanog vremena izlaganja, višak ispitivane supstance uklanja se ispiranjem vodom ili pomoću nekog drugog sredstva za čišćenje kože.
Posmatranja se svakodnevno sistematično beleže. Beleže se znakovi toksičnosti, vreme njihove pojave, stepen i trajanje; promene na koži i krznu, očima, sluzokoži, respiratornom, kardiovaskularnom, autonomnom i centralnom nervnom sistemu, kao i somatomotorna aktivnost i način ponašanja. Jednom nedeljno određuje se telesna masa životinja i beleže opažanja vezana za potrošnju hrane. Redovno se prate životinje kako bi se izbegao njihov gubitak zbog kanibalizma ili autolize tkiva. Na kraju eksperimenta, postmortalno pregledaju se sve preživele životinje iz osnovnih (ne pratećih) ispitivanih gupa. Životinje koje su izrazito slabe ili na samrti izdvajaju se iz grupe i lišavaju života na human način, a potom se postmortalno pregledaju.
Sprovode se sledeća ispitivanja na kraju eksperimenta na svim životinjama uključujući one iz kontrolne grupe:
1. hematološka ispitivanja, uključujući hematokrit, koncentraciju hemoglobina, broj eritrocita, broj ukupnih i pojedinih loza leukocita, kao i brzinu zgrušavanja krvi;
2. kliničko-biohemijska ispitivanja krvi, uključujući najmanje jedan parametar koji ukazuje na funkciju jetre i bubrega: alanin aminotransferaza (poznata i pod nazivom: glutamat piruvat transaminaza), aspartat aminotransferaza (poznata i pod nazivom: glutamat oksaloacetat transaminaza), azot uree, albumin, kreatinin, ukupni bilirubin i proteini u serumu;
3. druga ispitivanja koja mogu biti potrebna za adekvatnu evaluaciju toksičnosti uključujući određivanje kalcijuma, fosfora, hlorida, natrijuma, kalijuma, glukoze (u uslovima gladovanja), lipida, hormona, acido-baznu ravnotežu, methemoglobin i aktivnost holinesteraze;
4. dodatne biohemijske analize obavljaju se po potrebi, kako bi se detaljnije proučili toksični efekti.
1.6.4. Postmortalni pregled
Sve eksperimentalne životinje detaljno se postmortalno pregledaju. Sledeći organi mere se odmah nakon sekcije, još vlažni: jetra, bubrezi, nadbubrežne žlezde, pluća i testisi. Organi i tkiva (respiratorni trakt, jetra, bubrezi, slezina, testisi, nadbubrežne žlezde i srce, kao i drugi organi na kojima se primete promene u veličini) čuvaju se u odgovarajućem medijumu za dalja histopatološka ispitivanja. Pluća se vade netaknuta, mere i stavljaju u odgovarajući fiksator kako bi se sačuvale sve strukture.
1.6.5. Histopatološka ispitivanja
U kontrolnim grupama i grupama izloženim visokim koncentracijama ispitivane supstance prave se histološka ispitivanja izolovanih organa i tkiva. Organi i tkiva koji pokažu oštećenja koja se mogu pripisati visokim koncentracijama ispitivane supstance detaljno se ispituju i kod životinja koje su bile izložene nižim koncentracijama. Životinje iz pratećih grupa takođe je potrebno histološki obraditi sa posebnim pažnjom na organe i tkiva koja su pokazala promene i kod životinja iz drugih ispitivanih grupa.
2. PODACI
Podaci se prikazuju tabelarno gde se za svaku ispitivanu grupu životinja navodi broj životinja na početku eksperimenta, kao i broj životinja kod kojih su pronađene promene.
Svi dobijeni rezultati analiziraju se odgovarajućom statističkom metodom. Koristi se bilo koja prihvaćena statistička metoda.
3. IZVEŠTAJ O ISPITIVANJU
3.1. PISANJE IZVEŠTAJA
Izveštaj o ispitivanju sadrži:
1. Podatke o eksperimentalnim životinjama:
- vrstu, soj, poreklo, uslovi smeštaja, ishrana itd.
2. Podatke o uslovima ispitivanja (uključujući način primene, okluzivni ili ne-okluzivni).
3. Koncentracije ispitivane supstance u dozama (koncentracija vehikuluma, ako je korišćen).
4. Podatke o dozi bez štetnog efekta.
5. Podatke o toksičnim efektima, sortirane prema polu životinja i primenjenoj dozi ispitivane supstance.
6. Vreme smrti u toku eksperimenta, tj. da li su životinje preživele celi eksperiment.
7. Opis toksičnih ili drugih efekata.
8. Vreme opažanja bilo kakvih abnormalnosti, i njihov kasniji tok
9. Podatke o ishrani i telesnoj masi.
10. Podatke o hematološkim ispitivanjima i nalazima.
11. Rezultate kliničko-biohemijskih ispitivanja.
12. Nalaze postmortalnog pregleda.
13. Detaljan opis svih histopatoloških nalaza.
14. Statističku obradu rezultata kada je moguće.
15. Raspravu o rezultatima.
16. Tumačenje rezultata.
3.2. PROCENA I TUMAČENJE
Videti Opšti uvod, Deo G.
4. LITERATURA
Videti Opšti uvod, Deo D.
B.10. MUTAGENOST - IN VITRO ISPITIVANJE HROMOZOMSKIH ABERACIJA KOD SISARA
1. METODA ISPITIVANJA
Ova metoda ispitivanja zasniva se na Uputstvu za ispitivanje OECD 473, In vitro ispitivanje hromozomskih aberacija (1997).
1.1. UVOD
Svrha in vitro ispitivanja hromozomskih aberacija je utvrđivanje agenasa koji uzrokuju strukturnu hromozomsku aberaciju u kulturi ćelija sisara1, 2, 3. Postoje dve vrste strukturnih aberacija: hromozomska i hromatidna. Sa većinom hemijskih mutagena izazvane aberacije su na hromatidama, ali može doći i do aberacija na hromozomima. Povećanje polipoidnosti može da ukaže na to da hemikalija ima potencijal za izazivanje numeričkih aberacija. Ova metoda nije namenjena za merenje numeričkih aberacija i ne koristi se rutinski u te svrhe. Hromozomske mutacije i s njima povezani efekti uzrok su mnogih genetskih oboljenja kod ljudi. Postoje dokazi da hromozomske mutacije i s njima povezani efekti koji izazivaju promene u onkogenima i tumor-supresorskim genima somatskih ćelija imaju ulogu u izazivanju kancera kod ljudi i eksperimentalnih životinja.
In vitro ispitivanje hromozomskih aberacija može da koristi: kulture utvrđenih ćelijskih linija, ćelijskih vrsta ili u prvom redu ćelijskih kultura. Ćelije se biraju na osnovu sposobnosti rasta u kulturi, stabilnosti kariotipa, hromozomskog broja, hromozomske h raznolikosti i spontane frekvencije hromozomskih aberacija.
Ispitivanja koja se obavljaju in vitro zahtevaju upotrebu egzogenog izvora metaboličke aktivacije. Ovaj sistem metaboličke aktivacije ne može u celini da oponaša in vivo uslove sisara. Vodi se računa da se izbegavaju uslovi koji dovode do pozitivnih rezultata, a koji ne odražavaju suštinsku mutagenost i koji mogu da nastanu usled promena u pH, osmolalnosti ili usled visokog nivoa citotoksičnosti4, 5.
Ovo ispitivanje koristi se za traženje mogućih mutagena i karcinogena za sisare. Mnoge supstance koje su pozitivne u ovom ispitivanju, karcinogene su za sisare. Uzajamna zavisnost između ovog ispitivanja i karcinogenosti nije besprekorna. Uzajamna zavisnost zavisi od hemijske klase. Sve je više dokaza da postoje karcinogeni koji se ne otkrivaju ovim ispitivanjem jer deluju mehanizmima koji su drugačiji od neposrednog oštećenja DNK.
Videti Opšti uvod.
1.2. DEFINICIJE
Aberacija tipa hromatida jeste strukturno oštećenje hromozoma izraženo kao prekidanje pojedinih hromatida ili prekidanje i ponovno spajanje između hromatida.
Aberacija tipa hromozoma jeste strukturno oštećenje hromozoma izraženo kao prekidanje pojedinih hromatida ili prekidanje i ponovno spajanje hromatida na identičnom mestu.
Endoreduplikacija jeste proces kod kojeg nakon S faze DNK replikacije jezgro ne ulazi u mitozu, već započinje druga S faza. Rezultat procesa su hromozomi sa 4, 8, 16 i više hromatida.
"Gap" (prekid) jeste ahromatska lezija manja od širine jedne hromatide i sa minimalnom iskrivljenošću hromatida.
Mitotski indeks jeste odnos broja ćelija u metafazi i ukupnog broja ćelija koje su posmatrane u populaciji ćelija; odnosno mitotski indeks jeste mera stepena proliferacije te ćelijske populacije.
Numerička aberacija jeste promena u broju hromozoma u odnosu na normalan broj karakterističan za korišćene ćelije.
Poliploidija jeste pojava kada ćelija sadrži više od haploidnog broja hromozoma (n), osim kada sadrži diploidni broj hromozoma (tj. 3n, 4n, itd.).
Strukturna aberacija jeste promena u strukturi hromozoma koja se može otkriti mikroskopskim pregledom u metafazi ćelijske deobe, a koja se zapaža u vidu delecija i fragmentacija, translokacija ili inverzija.
1.3. PRINCIP METODE
Ćelijske kulture izlažu se ispitivanoj supstanci uz metaboličku aktivaciju i bez nje. Nakon izlaganja ćelijskih kultura ispitivanoj supstanci, u prethodno određenim intervalima, ćelijske kulture se tretiraju supstancama koje prekidaju metafazu (npr. Colcemid® ili kolhicin); zatim se uzimaju, boje i mikroskopski se analiziraju ćelije u metafazi, odnosno ispituju se na prisutnost hromozomskih aberacija.
1.4. OPIS METODE
1.4.1. Preparati
1.4.1.1. Ćelije
Mogu se koristiti različite ćelijske linije, sojevi ili primarne ćelijske kulture, uključujući humane ćelije (npr. fibroblasti kineskog hrčka, humani ili drugi limfociti periferne krvi sisara).
1.4.1.2. Medijum (hranljive podloge) i uslovi kultivisanja
Za održavanje kultura koriste se odgovarajuće hranljive podloge i uslovi inkubacije (posude, CO2 koncentracija, temperatura i vlažnost). Postojećim ćelijskim linijama i sojevima rutinski se proverava stabilnost u modalnom broju hromozoma i odsustvo kontaminacije mikoplazmom pri čemu se ćelijske linije i sojevi ne koriste ako su kontaminirani. Treba da budu poznati uobičajeno vreme ćelijskog ciklusa ćelije i uslovi kultivisanja koji se koriste.
1.4.1.3. Priprema kultura
Utvrđene ćelijske linije i sojevi: ćelije se umnožavaju od "stock" kultura, zasejavaju se u podlozi pri gustini koja je takva da se u kulturama ne dostigne konfluentnost pre vremena sakupljanja i inkubiraju se na temperaturi od 37° C.
Limfociti: puna krv tretirana sa antikoagulansom (npr. heparinom) ili izdvojeni limfociti dobijeni od zdrave životinje dodaju se podlozi koji sadrži mitogen (npr. fitohemaglutinin) i inkubiraju se na temperaturi od 37° C.
1.4.1.4. Metabolička aktivacija
Ćelije se izlažu ispitivanoj supstanci u prisustvu i u odsustvu odgovarajućeg sistema metaboličke aktivacije. Najčešće korišćeni sistem je post-mitohodrijalna frakcija sa kofaktorom (S9) pripremljena od jetre glodara tretiranih agensima koji indukuju enzime kao što su: Aroclor 12546, 7, 8, 9 ili smeša fenobarbitona i ß-naftoflavona10, 11, 12.
Post-mitohondrijalne frakcije obično se koriste u koncentracijama u opsegu od 1% v/v do 10% v/v u konačnoj podlozi. Uslovi metaboličke aktivacije mogu da zavise od klase hemikalije koja se ispituje. U nekim slučajevima prikladno je da se koristi više od jedne koncentracije post-mitohondrijalne frakcije.
Pojedina dostignuća, uključujući ćelijske linije dobijene genetskim inženjeringom kod kojih se javlja ekspresija specifičnih aktivirajućih enzima, mogu da omoguće potencijal za endogenu aktivaciju. Izbor korišćenih ćelijskih linija mora da bude naučno opravdan (npr. relevantnost izoenzima citohroma P450 za metabolizam ispitivane supstance).
1.4.1.5. Ispitivana hemikalija
Ispitivane supstance u čvrstom stanju, pre tretmana ćelija, rastvaraju se ili suspenduju u odgovarajućem rastvaraču ili vehikulumu i, ako je potrebno, razblažuju. Ispitivane supstance u tečnom stanju mogu da se dodaju neposredno u ispitivani sistem, odnosno mogu da se razblaže pre tretmana. Koriste se sveži preparati ispitivane supstance, osim ako podaci o stabilnosti pokazuju da se preparati mogu čuvati.
1.4.2. Uslovi ispitivanja
1.4.2.1. Vehikulum
Vehikulum je takav da hemijski ne reaguje sa ispitivanom supstancom i da bude kompatibilan sa preživljavanjem ćelija i S9 aktivnošću. Ako se koristi vehikulum koji nije opštepoznat, njegova primena mora da bude obrazložena podacima koji potvrđuju njegovu kompatibilnost. Preporučuje se, kad god je moguće, da se u prvom redu koriste vodeni vehikulumi. Ako su ispitivane supstance nestabilne u vodi, organski rastvarači koja se koriste ne smeju da sadrže vodu. Voda može da se ukloni dodavanjem molekularnog sita.
1.4.2.2. Koncentracije izlaganja
Kriterijumi koji se razmatraju kod određivanja najviših koncentracija su: citotoksičnost, rastvorljivost u ispitivanom sistemu i promene pH ili osmolalnost.
Citotoksičnost se određuje sa i bez metaboličke aktivacije u glavnom eksperimentu uz korišćenje odgovarajuće indikacije za ćelijski integritet i rast, kao što je stepen združivanja, broj živih ćelija ili mitotski indeks. Korisno je da se u prethodnom eksperimentu odredi citotoksičnost i rastvorljivost.
Analizira se najmanje tri koncentracije. Koncentracije koje izazivaju citotoksičnost pokrivaju opseg od maksimalne do male toksičnosti ili bez toksičnosti; što obično znači da se koncentracije međusobno razlikuju najviše za faktor između √2 i √10. U vreme zrelosti najviša koncentracija mora da pokaže znatno smanjenje stepena združivanja, broja ćelija ili mitotskog indeksa (sve veće od 50%). Mitotski indeks je posredna mera citotoksičnih/citostatskih efekata i zavisi od vremena nakon tretmana. Mitotski indeks prihvatljiv je za suspenzije kultura kod kojih bi druge mere toksičnosti mogle da budu komplikovane i nepraktične. Podatak o kinetici ciklusa ćelije kao što je prosečno vreme generisanja (u daljem tekstu: AGT) može da se koristi kao dodatni podatak. AGT je srednja vrednost koja ne otkriva uvek postojanje subpopulacija, i čak i mali porasti prosečnog vremena generacije mogu da budu povezani sa vrlo bitnim kašnjenjem u vremenu optimalne produkcije aberacija.
Za supstance koje su relativno necitotoksične, najviša ispitivana koncentracija je 5 µL/mL, 5 mg/mL ili 0,01 M, zavisno od toga koja koncentracija je niža.
Za relativno nerastvorne supstance koje nisu toksične pri proizvodu koncentracija njenih jona nižem od proizvoda rastvorljivosti, najviša doza koja se koristi je iznad granice rastvorljivosti u konačnoj podlozi na kraju tretmana. U nekim slučajevima (npr. kad se toksičnost supstance pojavljuje samo pri proizvodu koncentracija jona višim od proizvoda rastvorljivosti), preporučuje se da se ispitivanje obavi sa više od jedne doze sa talogom. Procena rastvorljivosti na početku i na kraju tretmana može da bude od koristi, jer se rastvorljivost može menjati tokom izlaganja u sistemu ispitivanja usled prisutnosti ćelija, S9, seruma, itd. Talog može da se otkrije golim okom. Talog ne sme da utiče na ocenjivanje.
1.4.2.3. Pozitivne i negativne kontrole
Istovremene pozitivne i negativne (vehikulum) kontrole, sa i bez metaboličke aktivacije, uključene su u svaki eksperiment. Ako se koristi metabolička aktivacija, pozitivne kontrolne hemikalije su one koje zahtevaju aktivaciju, kako bi dale mutageni odgovor.
Kod pozitivnih kontrola koristi se poznati klastogen i nivoi izloženosti kod kojih se očekuje dobijanje reproduktivnog povećanja u odnosu na kontrolu, što ukazuje na osetljivost ispitivanog sistema.
Koncentracije pozitivne kontrole treba da pokažu jasne efekte, ali da licu koje obavlja tumačenje rezultata ne bude odmah poznat identitet kodiranih slajdova.
Primeri supstanci za pozitivnu kontrolu:
Tabela 1.
Uslovi metaboličke aktivacije |
Supstanca |
CAS br. |
EINEC br. |
Odsustvo egzogene metaboličke aktivacije |
Metil metansulfonat |
66-27-3 |
200-625-0 |
Etil metansulfonat |
62-50-0 |
200-536-7 |
|
Etil nitrozourea |
759-73-9 |
212-072-2 |
|
Mitomicin S |
50-07-7 |
200-008-6 |
|
4-Nitrohinolin-N-oksid |
56-57-5 |
200-281-1 |
|
Prisustvo egzogene metaboličke aktivacije |
Benzo[a]piren |
50-32-8 |
200-028-5 |
Ciklofosfamid |
50-18-0 |
200-015-4 |
Za pozitivnu kontrolu mogu da se koriste i druge supstance. Kada je moguće, razmatra se upotreba pozitivne kontrole koja je srodne klase ispitivanoj hemikaliji.
Negativne kontrole koje se sastoje samo od vehikuluma u podlozi za tretiranje i sa kojima se postupa na isti način kao i sa tretiranim kulturama, uključene su za svako vreme sakupljanja. Koriste se i netretirane kontrole, osim ako postoje podaci kontrole iz ranijih studija koji pokazuju da odabrani rastvarač ne izaziva nikakve štetne niti mutagene efekte.
1.4.3. Postupak
1.4.3.1. Tretman ispitivanom supstancom
Ćelije se tokom proliferacije tretiraju ispitivanom supstancom u prisustvu ili odsustvu sistema metaboličke aktivacije. Obrada limfocita počinje oko 48 sati nakon stimulacije mitoze.
1.4.3.2.
Za svaku koncentraciju obično se koriste kulture u duplikatu, a strogo se preporučuju za negativne kontrolne kulture odnosno kontrolne kulture vehikuluma. Kada na osnovu postojećih podataka mogu da se pokažu minimalne promene između kultura u duplikatu13, 14 prihvatljivo je korišćenje jedne kulture za svaku koncentraciju.
Gasovite ili isparljive supstance se ispituju odgovarajućim metodama, npr. korišćenjem hermetički zatvorenih posuda za kultivisanje15, 16.
1.4.3.3. Vreme sakupljanja kulture
U prvom eksperimentu ćelije se izlažu ispitivanoj supstanci 3 do 6 sati sa i bez metaboličke aktivacije, a uzorci se uzimaju posle približno 1,5 dužine normalnog ćelijskog ciklusa nakon početka tretmana12. Ako ovaj protokol da negativne rezultate i sa i bez aktivacije, obavlja se dodatni eksperiment bez aktivacije, sa neprekidnim tretmanom do uzorkovanja posle približno 1,5 dužine normalnog ćelijskog ciklusa. Određene hemikalije mogu se lakše otkriti kod vremena tretmana/uzorkovanja koje je duže od 1,5 dužine ciklusa. Negativni rezultati sa metaboličkom aktivacijom moraju da se potvrde u zavisnosti od slučaja. U slučajevima kada se potvrda negativnih rezultata ne smatra potrebnom, daje se obrazloženje.
1.4.3.4. Priprema hromozoma
Ćelijske kulture tretiraju se Colcemid®-om ili kolhicinom obično jedan do tri sata pre sakupljanja. Svaka ćelijska kultura sakuplja se i obrađuje posebno za pripremu hromozoma. Priprema hromozoma obuhvata: tretiranje ćelija hipotoničnim rastvorom, fiksaciju i bojenje.
1.4.3.5. Analiza
Svi slajdovi, uključujući one pozitivnih i negativnih kontrola, nezavisno se kodiraju pre mikroskopske analize. Postupci fiksacije često dovode do prekida proporcije metafaznih ćelija sa gubitkom hromozoma, pa procenjivane ćelije sadrže broj centromera koji je jednak modalnom broju ± 2 za sve vrste ćelija. Najmanje 200 dobro raspoređenih metafaza, podjednako podeljenih između duplikata, mora da se uoči po koncentraciji i kontroli. Taj broj može da bude i manji ako se uoči veliki broj aberacija.
Iako je svrha ispitivanja otkrivanje hromozomskih aberacija, važno je zabeležiti i poliploidiju i endoreduplikaciju, ukoliko se uoče.
2. PODACI
2.1. OBRADA REZULTATA
Eksperimentalna jedinica je ćelija. Zbog ovoga se procenjuje procenat ćelija sa strukturnim hromozomskim aberacijama. Strukturno različite vrste hromozomskih aberacija upisuju se sa svojim brojevima i učestalostima za eksperimentalne i kontrolne kulture. Oštećenja se upisuju odvojeno i navode u izveštaju, ali generalno nisu uključena u ukupnu učestalost aberacija.
Istovremene mere citotoksičnosti za sve tretirane i negativne kontrolne kulture u glavnim ispitivanjima aberacija, takođe se beleže.
Navode se podaci o svakoj pojedinačnoj kulturi. Svi podaci se navode sažeto u tabeli.
Ne postoje zahtevi za potvrdu jasnog pozitivnog odgovora. Dvosmisleni rezultati se razjašnjavaju daljim ispitivanjem, ako je moguće modifikacijama eksperimentalnih uslova. Potreba za potvrđivanjem negativnih rezultata razmotrena je odeljku 1.4.3.3. ove metode. Za izvođenje daljih razmatra se modifikacija parametara ispitivanja za proširenje opsega procenjenih uslova. Parametri ispitivanja se mogu modifikovati obuhvataju opseg koncentracije i uslove metaboličke aktivacije.
2.2. PROCENA I TUMAČENJE REZULTATA
Postoji nekoliko kriterijuma za određivanje pozitivnog rezultata, kao što je povećanje zavisno od koncentracije ili reproducibilno povećanje broja ćelija sa hromozomskim aberacijama. Prvo se razmatra biološka relevantnost rezultata. Statističke metode mogu da se koriste kao pomoć u proceni rezultata ispitivanja3, 13. Statistički značaj ne može da bude jedini faktor koji određuje pozitivni odgovor.
Povećanje broja poliploidnih ćelija može da ukaže na to da ispitivana supstanca ima potencijal da inhibira procese mitoze i izazove numeričke hromozomske aberacije. Povećanje broja ćelija sa endoreduplikovanim hromozomima može da ukaže na to da ispitivana supstanca ima potencijal da inhibira progresiju ćelijskog ciklusa17, 18.
Ispitivana supstanca za koju rezultati ispitivanja ne zadovoljavaju gore navedene kriterijume smatra se nemutagenom u ovom sistemu.
Iako većina eksperimenata daje jasne pozitivne ili negativne rezultate, u retkim slučajevima dobijeni podaci ne omogućavaju donošenje konačne procene aktivnosti ispitivane supstance. Rezultati mogu da ostanu dvosmisleni ili nejasni bez obzira na to koliko puta je eksperiment ponovljen.
Pozitivni rezultati iz in vitro ispitivanja aberacije hromozoma ukazuju da ispitivana supstanca izaziva strukturne aberacije hromozoma u kulturi somatskih ćelija sisara. Negativni rezultati ukazuju da, pod ispitivanim uslovima, ispitivana supstanca ne izaziva aberaciju hromozoma u kulturi somatskih ćelija sisara.
3. IZVEŠTAJ
Izveštaj o ispitivanju sadrži podatke o:
1) Vehikulumu:
- obrazloženje za izbor vehikuluma;
- rastvorljivost i stabilnost ispitivane supstance u vehikulumu, ako su poznati.
2) Ćelijama:
- vrsta i poreklo ćelija;
- kariotipne karakteristike i podesnost korišćene vrste ćelija;
- odsustvo mikoplazme, ako je primenljivo;
- podatak o dužini ćelijskog ciklusa;
- pol davaoca krvi, puna krv ili korišćeni odvojeni limfociti, mitogen;
- broj prolaza, ako je primenljivo;
- metode za održavanje kulture ćelije, ako je primenljivo;
- modalni broj hromozoma.
3) Uslovima ispitivanja:
- identitet supstance koja je korišćena za zaustavljanje metafaze, njena koncentracija i trajanje izloženosti ćelije;
- argumentacija za izbor koncentracija i broj kultura, uključujući npr. podatke o citotoksičnosti, ograničenju rastvorljivosti, ako su dostupni;
- sastav podloge, koncentracija CO2, ako je primenljivo;
- koncentracija ispitivane supstance;
- zapremina vehikuluma i dodate ispitivane supstance;
- temperatura inkubacije;
- vreme inkubacije;
- trajanje tretmana;
- gustina ćelija kod zasejavanja, ako je primenljivo;
- vrsta i sastav sistema metaboličke aktivacije, uključujući kriterijume prihvatljivosti;
- pozitivne i negativne kontrole;
- metode pripreme slajdova;
- kriterijumi za procenu aberacije;
- broj analiziranih metafaza;
- metode za merenje toksičnosti;
- kriterijumi za smatranje studija pozitivnim, negativnim ili dvosmislenim.
4) Rezultatima:
- znakovi toksičnosti, tj. stepen konfluencije, podaci o ćelijskom ciklusu, broj izbrojanih ćelija, mitotski indeks;
- znakovi taloženja;
- podaci o pH i osmolalnosti podloge za tretiranje, ako je određeno;
- definicija za aberacije, uključujući oštećenja;
- broj ćelija sa hromozomskim aberacijama i vrsta aberacija hromozoma, za svaku tretiranu i kontrolnu kulturu posebno;
- promene u ploidiji, ako se vide;
- odnos doza - odgovor, kada je moguće;
- eventualne statističke analize;
- podaci o istovremenoj negativnoj (vehikulum) i pozitivnoj kontroli;
- podaci iz literature o negativnoj (vehikulum) i pozitivnoj kontroli sa opsezima, srednjim vrednostima i standardnim devijacijama.
5) Obrazloženju rezultata.
6) Zaključcima.
4. LITERATURA
1. Evans, H. J., (1976) Cytological Methods for Detecting Chemical Mutagens. In: Chemical mutagens, Principles and Methods for their Detection, Vol. 4, Hollaender, A. (ed) Plenum Press, New York and London, p. 1-29.
2. Ishidate, M. Jr. and Sofuni, T., (1985). The In vitro Chromosomal Aberration Test Using Chinese Hamster Lung (CHL) Fibroblast Cells in Culture. In: Progress in Mutation Research, Vol. 5, Ashby, J. et al., (Eds) Elsevier Science Publishers, Amsterdam-New York-Oxford, p. 427-432.
3. Galloway, S.M., Armstrong, M.J., Reuben, C., Colman, S., Brown, B., Cannon, C., Bloom, A.D., Nakamura, F., Ahmed, M., Duk, S., Rimpo, J., Margolin, G.H., Resnick, MA, Anderson, G. and Zeiger, E., (1978). Chromosome aberration and sister chromatic exchanges in Chinese hamster ovary cells: Evaluation of 108 chemicals. Environs. Molec. Mutagen 10 (suppl. 10), p. 1-175.
4. Scott, D., Galloway, S.M., Marshall, R.R., Ishidate, M.Jr., Brusick, D., Ashby, J. and Myhr, B.C., (1991) Genotoxicity under Extreme Culture Conditions. A report from ICPEMC Task Group 9. Mutation Res, 257, p. 147-204.
5. Morita, T., Nagaki, T., Fukuda, I. and Okumura, K., (1992). Clastogenicity of low pH to Various Cultured Mammalian Cells. Mutation Res., 268, p. 297-305.
6. Ames, B.N., McCann, J. and Yamasaki, E., (1975). Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian Microsome Mutagenicity Test. Mutation Res., 31, p. 347-364.
7. Maron, D.M. and Ames, B.N., (1983) Revised Methods for the Salmonella Mutagenicity Test. Mutation Res., 113, p. 173-215.
8. Natarajan, A.T., Tates, A.D., van Buul, P.P.W., Meijers, M. and de Vogel, N., (1976) Cytogenetic Effects of Mutagen/Carcinogens after Activation in a Microsomal System in vitro, I. Induction of Chromosome Aberrations and Sister Chromatid Exchange by Diethylnitrosamine (DEN) and Dimethylnitrosamine (DMN) in CHO Cells in the Presence of Rat-Liver Microsomes. Mutation Res., 37, p. 83-90.
9. Matsuoka, A., Hayashi, M. and Ishidate, M. Jr., (1979) Chromosomal Aberration Tests on 29 Chemicals Combined with S9 Mix In vitro. Mutation Res., 66, p. 277-290.
10. Elliot, B.M., Combes, R.D., Elcombe, C.R., Gatehouse, D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C., (1992). Report of UK Environmental Mutagen Society Working Party. Alternatives to Aroclor 1254-induced S9 in In vitro Genotoxicity Assays. Mutagenesis, 7, p. 175-177.
11. Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T., (1976) A Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems. In: de Serres, F.J., Fouts, J.R., Bend, J.R. and Philpot, R.M. (eds) In vitro Metabolic Activation in Mutagenesis Testing, Elsevier, North-Holland, p. 85-88.
12. Galloway, S.M., Aardema, M.J., Ishidate, M.Jr., Ivett, J.L., Kirkland, D.J., Morita, T., Mosesso, P., Sofuni, T., (1994) Report from Working Group on in In vitro Tests for Chromosomal Aberrations. Mutation Res., 312, p. 241-261.
13. Richardson, C., Williams, D.A., Allen, J.A., Amphlett, G., Chanter, D.O. and Phillips, B., (1989) Analysis of Data from In vitro Cytogenetic Assays. In: Statistical Evaluation of Mutagenicity Test Data. Kirkland, D.J., (ed) Cambridge University Press, Cambridge, p. 141-154.
14. Soper, K.A. and Galloway, S.M., (1994) Replicate Flasks are not Necessary for In vitro Chromosome Aberration Assays in CHO Cells. Mutation Res., 312, p. 139-149.
15. Krahn, D.F., Barsky, F.C. and McCooey, K.T., (1982) CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids. In: Tice, R.R., Costa, D.L., Schaich, K.M. (eds). Genotoxic Effects of Airborne Agents. New York, Plenum, p. 91-103.
16. Zamora, P.O., Benson, J.M., Li, A.P. and Brooks, A.L., (1983) Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay. Environmental Mutagenesis, 5, p. 795-801.
17. Locke-Huhle, C., (1983) Endoreduplication in Chinese hamster cells during alpha-radiation induced G2 arrest. Mutation Res., 119, p. 403-413.
18. Huang, Y., Change, C. and Trosko, J.E., (1983) Aphidicolin-induced endoreduplication in Chinese hamster cells. Cancer Res., 43, p. 1362-1364.
B.11. MUTAGENOST - IN VIVO ISPITIVANJE HROMOZOMSKIH ABERACIJA NA KOSTNOJ SRŽI SISARA
1. METODA ISPITIVANJA
Metoda ispitivanja zasniva se na Uputstvu za ispitivanje OECD 475, Ispitivanje hromozomskih aberacija u kostnoj srži sisara (1997).
1.1. UVOD
Ispitivanje hromozomskih aberacija in vivo kod sisara koristi se za otkrivanje strukturnih hromozomskih aberacija koje je ispitivana supstanca izazvala u ćelijama kostne srži životinja, obično glodara1, 2, 3, 4. Strukturne hromozomske aberacije mogu biti dvojake: hromozomske i hromatidne. Povećanje poliploidnosti može da ukaže na to da hemikalija ima potencijal da izazove numeričke aberacije. Većina hemijskih mutagena izaziva aberacije hromatidnog tipa, ali dolazi i do aberacija hromozomskog tipa. Hromozomske mutacije i sa njima povezane pojave uzrok su mnogih genetskih bolesti kod ljudi i postoje značajni dokazi da su hromozomske mutacije i sa njima povezane pojave, koje izazivaju promene onkogena i tumor-supresorskih gena, povezane sa rakom kod ljudi i u eksperimentalnim sistemima.
U ovoj metodi ispitivanja obično se koriste glodari. Kostna srž predstavlja ciljno tkivo ovog ispitivanja, s obzirom da je reč o visoko prokrvljenom tkivu koje sadrži populaciju ćelija koje brzo prolaze kroz cikluse, a koje je moguće lako izolovati i obraditi. Druge životinjske vrste i ciljna tkiva nisu predmet ove metode ispitivanja.
Navedeno ispitivanje hromozomskih aberacija posebno je relevantno za procenu opasnosti od mutagenog dejstva jer omogućava da se uzme u obzir metabolizam in vivo, farmakokinetičke i procese reparacije DNK, iako se isti mogu razlikovati kod različitih vrsta i tkiva. In vivo ispitivanje korisno je i za dalje istraživanje mutagenih efekata otkrivenih prilikom in vitro ispitivanja.
Ovaj oblik ispitivanja ne odgovara ukoliko se pojave dokazi da ispitivana supstanca ili reaktivni metabolit neće dospeti do ciljnog tkiva.
Videti Opšti uvod.
1.2. DEFINICIJE
Aberacija tipa hromatida jeste strukturno oštećenje hromozoma izraženo kao prekidanje pojedinih hromatida ili prekidanje i ponovno spajanje između hromatida.
Aberacija tipa hromozoma jeste strukturno oštećenje hromozoma izraženo kao prekidanje pojedinih hromatida ili prekidanje i ponovno spajanje hromatida na identičnom mestu.
Endoreduplikacija jeste proces kod koga nakon S faze replikacije DNK jedro ne ulazi u mitozu nego započinje druga S faza. Rezultat su hromozomi sa 4, 8, 16 i više hromatida.
"Gap" (prekid) jeste ahromatska lezija manja od širine jedne hromatide i sa minimalnom iskrivljenosti hromatida.
Numerička aberacija jeste promena u broju hromozoma u odnosu na normalan broj karakterističan za ćelije koje se koriste.
Poliploidija jeste pojava kada ćelija sadrži više od haploidnog broja hromozoma (n), osim kada sadrži diploidni broj (tj. 3n, 4n, itd).
Strukturna aberacija jeste promena u strukturi hromozoma koja se može otkriti mikroskopskim pregledom u metafazi ćelijske deobe, a koja se zapaža u vidu delecija i fragmentacija, translokacija ili inverzija.
1.3. PRINCIP METODE
Životinje se odgovarajućim putem izlažu ispitivanoj supstanci i lišavaju života na human način u određeno vreme nakon tretiranja. Pre lišavanja života na human način, životinje se tretiraju agensom za zaustavljanje metafaze (npr. kolhicinom ili Colcemid®-om). Nakon toga, pripreme se preparati hromozoma ćelija kostne srži i analiziraju se ćelije u metafazi sa ciljem utvrđivanja hromozomskih aberacija.
1.4. OPIS METODE
1.4.1. Pripreme
1.4.1.1. Izbor životinjske vrste
Obično se koriste pacovi, miševi i kineski hrčci. Mogu se koristiti i druge odgovarajuće vrste sisara. Koriste se mlade, zdrave, odrasle životinje sojeva koji se uobičajeno upotrebljavaju. Prilikom započinjanja istraživanja odstupanje u telesnoj masi životinja treba da bude minimalno i da ne prelazi ± 20% prosečne telesne mase za svaki pol.
1.4.1.2. Uslovi smeštaja i ishrane
Primenjuju se opšti uslovi koji su navedeni u Opštem uvodu, iako se nastoji da se vlažnost održi na nivou od 50% do 60%.
1.4.1.3. Priprema životinja
Zdrave odrasle životinje nasumično se grupišu u kontrolnu i tretirane grupe. Kavezi su takvi da mogući efekti na ispitivanje budu minimalni. Životinje se pojedinačno označavaju. Životinje se aklimatizuju na laboratorijske uslove najmanje pet dana pre početka ispitivanja.
1.4.1.4. Priprema doza
Pre tretiranja životinja ispitivanom supstancom čvrste ispitivane supstance se rastvaraju ili suspenduju u odgovarajućim vehikulumima i, ukoliko je potrebno, razblažuju. Tečne ispitivane supstance mogu direktno da se primene ili da se razblaže pre primene. Sveži preparati ispitivane supstance se odmah upotrebljavaju, osim ukoliko podaci o stabilnosti ne pokazuju da je čuvanje prihvatljivo.
1.4.2. Uslovi ispitivanja
1.4.2.1. Vehikulum
Vehikulum ne sme da izaziva toksične efekte pri doznim nivoima koji se primenjuju i ne sme da postoji sumnja da će hemijski da reaguje sa ispitivanom supstancom. Ukoliko se primenjuju manje poznati vehikulumi, njihovo uključivanje u ispitivanje se obrazlaže podacima koji ukazuju na njihovu kompatibilnost. Kad god je moguće, preporučuje se primena vodenog rastvora.
1.4.2.2. Kontrole
Istovremene pozitivne i negativne (vehikulum) kontrole se uključuju u svako ispitivanje i za svaki pol. Osim primene ispitivane supstance, sa životinjama u kontrolnim grupama se postupa na isti način kao i sa životinjama u tretiranim grupama.
Pozitivne kontrole proizvode strukturne aberacije in vivo pri nivoima izloženosti za koje se očekuje da će dati povećanje u odnosu na pozadinu koja može da se detektuje. Pozitivne kontrolne doze biraju se tako da efekti budu jasni, ali da licu koje očitava rezultate odmah ne otkriju identitet šifriranih mikroskopskih preparata (slajdova). Dozvoljeno je da se supstanca koja je pozitivna kontrola primeni putem koji je različit od puta primene ispitivane supstance, i da se uzorkuje samo jednom. Može se uzeti u obzir primena pozitivnih kontrola koje pripadaju istoj hemijskoj klasi kao i ispitivana hemikalija. Primeri supstanci koje se koriste kao pozitivne kontrole:
Tabela 1.
Supstanca |
CAS br. |
EINECS br. |
etil metansulfonat |
62-50-0 |
200-536-7 |
etil nitrozourea |
759-73-9 |
212-072-2 |
mitomicin C |
50-07-7 |
200-008-6 |
ciklofosfamid |
50-18-0 |
200-015-4 |
trietilenmelamin |
51-18-3 |
200-083-5 |
Negativne kontrole, tretirane samo vehikulumom, sa kojima se inače postupa na isti način kao sa grupama obuhvaćenim tretmanom, su obuhvaćene svakim uzorkovanjem, osim ukoliko su dostupni podaci o varijabilnosti u okviru vrste i u frekvenciji ćelija sa hromozomskim aberacijama. Ukoliko se na negativne kontrole primenjuje jedno uzorkovanje, najprimerenije je vreme prvog uzorkovanja. Istovremeno se koriste i netretirane kontrole (kontrolni uzroci), osim ukoliko postoje podaci o kontrolama iz ranijih studija ili objavljeni kontrolni podaci koji dokazuju da odabran vehikulum ne izaziva štetne ili mutagene efekte.
1.5. POSTUPAK
1.5.1. Broj i pol životinja
Svaka tretirana i kontrolna grupa obuhvata najmanje pet životinja istog pola na kojima je moguće obaviti analizu. Ukoliko postoje podaci istraživanja obavljenog na istoj vrsti i istim putem izlaganja koji dokazuju da ne postoje značajnije razlike u toksičnosti među polovima, dovoljno je obaviti ispitivanje kod samo jednog pola. U slučajevima u kojima izlaganje ljudi hemikalijama može da bude specifično za određeni pol, kao na primer kod nekih farmaceutskih agensa, ispitivanje se obavlja na životinjama odgovarajućeg pola.
1.5.2. Plan tretmana
Preporučuje se primena ispitivane supstance u okviru jednog tretmana. Ispitivane supstance je moguće davati u obliku podeljene doze, tj. dva tretmana tokom istog dana u razmaku od najviše nekoliko sati, kako bi se olakšalo davanje velike zapremine ispitivane supstance. Ostali režimi tretiranja naučno se opravdavaju.
Uzorci se uzimaju u dva navrata nakon tretmana tokom jednog dana. Kod glodara prvo vreme uzorkovanja je 1,5 dužina redovnog ćelijskog ciklusa (koji iznosi 12 do 18 sati) nakon tretmana. S obzirom da vreme koje je potrebno za unos i metabolizam ispitivane supstance, kao i za njen efekat na dinamiku ćelijskog ciklusa, može da utiče na optimalno vreme potrebno za otkrivanje hromozomske aberacije, preporučuje se i kasnije uzimanje uzorka: 24 sata nakon prvog uzorkovanja. Ukoliko se primenjuju režimi tretiranja ispitivanom supstancom duži od jednog dana, nakon poslednjeg tretmana obavlja se jedno uzorkovanje od oko 1,5 dužine normalnog ćelijskog ciklusa.
Pre lišavanja života na human način životinjama se intraperitonealno ubrizgava odgovarajuća doza agensa za zaustavljanje metafaze (npr. Colcemid® ili kolhicin). Životinjama se nakon toga uzimaju uzorci u odgovarajućim intervalima. Za miševe navedeni interval iznosi otprilike 3 do 5 sati, a za kineske hrčke interval je približno 4 do 5 sati. Ćelije se izoluju iz kostne srži i analiziraju radi otkrivanja hromozomskih aberacija.
1.5.3. Dozni nivoi
Ukoliko se ispitivanje obavlja sa ciljem utvrđivanja opsega doza zbog toga što nema dostupnih podataka, navedeno ispitivanje se obavlja u istoj laboratoriji, uz korišćenje iste vrste, soja, pola i režima tretiranja kao i u glavnom ispitivanju5. Ukoliko postoji toksičnost, za prvo uzorkovanje koriste se tri dozna nivoa. Navedene doze obuhvataju opseg od maksimalne do niske toksičnosti ili nivo bez toksičnosti. Prilikom narednog uzorkovanja potrebno je koristiti samo najvišu dozu. Najviša doza se definiše kao doza usled koje nastaju takvi znakovi toksičnosti da bi viša doza prouzrokovala uginjavanje životinja. Supstance specifične biološke aktivnosti u malim netoksičnim dozama (poput hormona i mitogena) mogu biti izuzetak za primenu kriterijuma za izbor doza i tada se doze procenjuju u zavisnosti od slučaja. Najviša doza se definiše i kao doza koja dovodi do nekih indikacija toksičnosti u kostnoj srži (npr. smanjenje mitotskog indeksa veće od 50%).
1.5.4. Ispitivanje granične doze
Ukoliko u ispitivanju sa jednom dozom od najmanje 2.000 mg/kg TM u jednokratnom tretmanu ili u dva tretmana tokom istog dana ne nastanu nikakvi primetni toksični efekti i ukoliko se na osnovu podataka o strukturno srodnim supstancama ne očekuje genotoksičnost, nije potrebno primeniti kompletno ispitivanje primenom tri dozna nivoa. Za ispitivanja u trajanju do 14 dana granična doza iznosi 2.000 mg/kg TM/dan, a za tretmane koji traju duže od 14 dana 1.000 mg/kg TM/dan. Očekivana izloženost ljudi može da ukaže na potrebu za primenom više doze u ispitivanju granične doze.
1.5.5. Primena doza
Ispitivana supstanca obično se primenjuje intubacijom i to korišćenjem želudačne sonde ili odgovarajuće intubacione kanile ili intraperitonealnom injekcijom. Mogu se primeniti i drugi putevi izlaganja uz navođenje obrazloženja za tu primenu. Maksimalna zapremina tečnosti koju je moguće dati putem sonde ili injekcijom u jednom navratu zavisi od veličine eksperimentalne životinje. Zapremina ne prelazi 2 mL/100 g TM. Upotrebu većih zapremina potrebno je obrazložiti. Izuzev u slučaju iritativnih i korozivnih supstanci kod kojih će se normalno ispoljiti pogoršani efekti pri višim koncentracijama, odstupanja u zapremini treba da budu minimalna podešavanjem koncentracije, kako bi se obezbedila konstantna zapremina pri svim nivoima doza.
1.5.6. Hromozomski preparat
Odmah nakon što se životinja liši života na human način, uzima se kostna srž koja se izlaže hipotoničnom rastvoru i fiksira. Ćelije se nanesu na mikroskopske pločice i oboje.
1.5.7. Analiza
Kao mera citotoksičnosti određuje se mitotski indeks u najmanje 1.000 ćelija po životinji za sve tretirane životinje (uključujući pozitivne kontrole) i netretirane životinje negativne kontrolne grupe.
Analizi se podvrgava najmanje 100 ćelija svake životinje. Navedeni broj se može smanjiti ukoliko se uoči veliki broj aberacija. Sve preparate (slajdove), uključujući one pozitivne i negativne kontrole, potrebno je šifrovati pre mikroskopske analize. S obzirom da postupci izrade preparata često imaju za posledicu promenu proporcije metafaza uz gubitak hromozoma, ćelije koje se broje sadrže broj centromera jednak broju 2n ± 2.
2. PODACI
2.1. OBRADA REZULTATA
Podaci koji se odnose na pojedine životinje navode se tabelarno. Životinja predstavlja eksperimentalnu jedinicu. Za svaku životinju potrebno je odrediti broj ćelija koje se procenjuju, broj aberacija po ćeliji i procenat ćelija sa strukturnim hromozomskim aberacijama. Navode se različite vrste strukturnih hromozomskih aberacija zajedno sa svojim brojevima i frekvencijama, a u odnosu na tretirane i kontrolne grupe. Hromozomski prekidi navode se odvojeno, ali se generalno ne uključuju u ukupnu učestalost aberacija. Ukoliko ne postoje dokazi o razlikama među polovima, podatke dobijene ispitivanjem oba pola moguće je sjediniti radi statističke analize.
2.2. PROCENA I TUMAČENJE REZULTATA
Postoji nekoliko kriterijuma za utvrđivanje pozitivnog rezultata, kao što je dozno zavisno povećanje relativnog broja ćelija sa hromozomskim aberacijama ili jasno povećanje broja ćelija sa aberacijama u grupi koja je primila jednu dozu, prilikom jedinog vremena uzorkovanja. Prvenstveno se uzima u obzir biološki značaj rezultata. Statističke metode se mogu primeniti kao pomoćno sredstvo prilikom vrednovanja rezultata ispitivanja6. Statistički značaj ne treba da bude jedini faktor za utvrđivanje pozitivne reakcije. Dvosmisleni rezultati se pojašnjavaju daljim ispitivanjem, najbolje modifikovanjem eksperimentalnih uslova.
Povećanje poliploidnosti može da ukaže na to da ispitivana supstanca ima potencijal da izazove numeričke hromozomske aberacije. Povećanje endoreduplikacije (endomitoze) može da ukaže na to da ispitivana supstanca ima potencijal da inhibira progresiju ćelijskog ciklusa7, 8.
Ispitivana supstanca za koju dobijeni rezultati ne zadovoljavaju gore navedene kriterijume, smatra se nemutagenom u ovom ispitivanju.
Iako većina eksperimenata daje jasno pozitivne ili negativne rezultate, u retkim slučajevima utvrđeni podaci ne omogućavaju donošenje konačne odluke o delovanju ispitivane supstance. Rezultati mogu ostati dvosmisleni ili pod znakom pitanja, bez obzira na broj obavljenih eksperimenata.
Pozitivni rezultati ispitivanja hromozomskih aberacija in vivo ukazuju na to da supstanca uzrokuje hromozomske aberacije u kostnoj srži ispitivane životinjske vrste. Negativni rezultati ukazuju na to da, pod navedenim eksperimentalnim uslovima, ispitivana supstanca ne izaziva aberacije u kostnoj srži ispitivane vrste.
Potrebno je razmotriti verovatnoću da ispitivana supstanca ili njeni metaboliti dospeju u krvotok ili, konkretno, do ciljnog tkiva (npr. sistemska toksičnost).
3. IZVEŠTAJ
Izveštaj o ispitivanju sadrži podatke o:
1) Vehikulumu:
- opravdanost izbora vehikuluma;
- rastvorljivost i stabilnost ispitivane supstance u vehikulumu, ukoliko su poznati.
2) Eksperimentalnim životinjama:
- vrsta/soj;
- broj, starost i pol životinja;
- izvor/poreklo, smeštaj, ishrana, itd.;
- pojedinačna telesna masa životinja na početku ispitivanja, uključujući raspon telesne mase, srednju vrednost i standardnu devijaciju za svaku grupu.
3) Uslovima ispitivanja:
- pozitivna i negativna (vehikulum) kontrola;
- rezultati ispitivanja za utvrđivanje raspona doza, ukoliko je obavljeno;
- obrazloženje za izbor doznih nivoa;
- detalji pripreme ispitivane supstance;
- detalji primene ispitivane supstance;
- obrazloženje puta primene;
- metode za potvrdu činjenice da je ispitivana supstanca dospela u sistemski krvotok ili do ciljnog tkiva, ukoliko je primenljivo;
- način preračunavanja koncentracije ispitivane supstance u hrani/vodi za piće (ppm) u dozu (mg/kg TM/dan), ukoliko je primenljivo;
- detalji o kvalitetu hrane i vode;
- detaljan opis rasporeda tretmana i uzorkovanja;
- metode za merenje toksičnosti;
- identitet supstance koja zaustavlja metafazu, njena koncentracija i trajanje tretmana;
- metode pripremanja mikroskopskih preparata;
- kriterijumi za prebrojavanje aberacija;
- broj analiziranih ćelija po životinji;
- kriterijumi za proglašavanje ispitivanja pozitivnim, negativnim ili dvosmislenim.
4) Rezultatima:
- znakovi toksičnosti;
- mitotski indeks;
- vrsta i broj aberacija, pojedinačno navedenih za svaku životinju;
- ukupan broj aberacija po grupi, srednja vrednost i standardna devijacija;
- broj ćelija sa aberacijama po grupi, srednja vrednost i standardna devijacija;
- promene u ploidiji, ukoliko su uočene;
- odnos doza - odgovor, gde je moguće;
- statističke analize, ukoliko postoje;
- podaci istovremene negativne kontrole;
- negativni kontrolni podaci iz literature sa opsezima, srednjim vrednostima i standardnim devijacijama;
- istovremeni pozitivni kontrolni podaci.
5) Obrazloženju rezultata.
6) Zaključcima.
4. LITERATURA
1. Adler, I.D., (1984) Cytogenetic Tests in Mammals. In: Mutagenicity Testing: a Practical Approach. S. Venitt and J.M. Parry (Eds). IRL Press, Oxford, Washington D.C., p. 275-306.
2. Preston, R.J., Dean, B.J., Galloway, S., Holden, H., McFee, A.F. and Shelby, M. (1987). Mammalian In vivo Cytogenetic Assays: Analysis of Chromosome Aberrations in Bone Marrow Cells. Mutation Res., 189, p. 157-165.
3. Richold, M., Chandley, A., Ashby, J., Gatehouse, D.G., Bootman, J. and Henderson, L., (1990) In vivo Cytogenetic Assays. In: D.J. Kirkland (Ed.) Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report. Part I revised. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, p. 115-141.
4. Tice, R.R., Hayashi, M., MacGregor, J.T., Anderson, D., Blakey, D.H., Holden, H.E., Kirsch-Volders, M., Oleson Jr., F.B., Pacchierotti, F., Preston, R.J., Romagna, F., Shimada, H., Sutou, S. and Vannier, B., (1994) Report from the Working Group on the In vivo Mammalian Bone Marrow Chromosomal Aberration Test. Mutation Res., 312, p. 305-312.
5. Fielder, R.J., Allen, J.A., Boobis, A.R., Botham, P.A., Doe, J., Esdaile, D.J., Gatehouse, D.G., Hodson-Walker, G., Morton, D.B., Kirkland, D.J. and Richold, M. (1992). Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose setting in In vivo Mutagenicity Assays. Mutagenesis, 7, p. 313-319.
6. Lovell, D.P., Anderson, D., Albanese, R., Amphlett, G.E., Clare, G., Ferguson, R., Richold, M., Papworth, D.G. and Savage, J.R.K. (1989). Statistical Analysis of In vivo Cytogenetic Assays. In: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report Part III. Statistical Evaluation of Mutagenicity Test Data. D.J. Kirkland, (Ed.) Cambridge University Press, Cambridge. p. 184-232.
7. Locke-Huhle, C., (1983) Endoreduplication in Chinese hamster cells during alpha-radiation induced G2 arrest. Mutation Res. 119, p. 403-413.
8. Huang, Y., Change, C. and Trosko, J.E., (1983) Aphidicolin-induced endoreduplication in Chinese hamster cells. Cancer Res., 43, p. 1362-1364.
B.12. MUTAGENOST - MIKRONUKLEUS TEST IN VIVO NA ERITROCITIMA SISARA
1. METODA ISPITIVANJA
Metoda ispitivanja zasniva se na Uputstvu za ispitivanje OECD 474, Mikronukleus test na eritrocitima sisara (1997).
1.1. UVOD
Mikronukleus test in vivo kod sisara koristi se za otkrivanje oštećenja izazvanih ispitivanom supstancom na hromozomima ili mitotskom sistemu eritroblasta, na osnovu analize eritrocita iz kostne srži i/ili ćelija periferne krvi životinja, obično glodara.
Svrha mikronukleus testa jeste identifikacija supstanci koje izazivaju citogenetska oštećenja koja za posledicu imaju formiranje mikronukleusa koji sadrži zaostale fragmente hromozoma ili čitave hromozome.
Kada se eritroblast kostne srži razvije u polihromatski eritrocit, glavni nukleus biva istisnut; svaki nastali mikronukleus može da zaostane u citoplazmi koja inače nema jezgro. Vidljivost mikronukleusa u ovim ćelijama olakšana je s obzirom da im nedostaje glavno jezgro. Povećanje učestalosti polihromatskih eritrocita sa mikronukleusima kod tretiranih životinja pokazatelj je izazvanih hromozomskih oštećenja.
Za navedeno ispitivanje obično se koristi kostna srž glodara, jer se proizvodnja polihromatskih eritrocita odvija u tom tkivu. Mera mikronukleusnih nezrelih (polihromatskih) eritrocita u perifernoj krvi jednako je prihvatljiva kod bilo koje vrste kod koje je dokazana nesposobnost slezine da ukloni mikronukleusne eritrocite ili koja je pokazala odgovarajuću osetljivost na otkrivanje agensa koji izazivaju strukturne ili numeričke hromozomske aberacije. Mikronukleuse je moguće razlikovati na osnovu većeg broja kriterijuma. Navedeni kriterijumi obuhvataju identifikaciju prisustva ili odsustva kinetohore ili centromere DNK u mikronukleusima. Učestalost mikronukleusnih nezrelih (polihromatskih) eritrocita predstavlja ciljni pokazatelj ispitivanja. U slučajevima kada se životinje neprekidno tretiraju tokom četiri nedelje ili duže, kao krajnja tačka ispitivanja može se koristiti broj zrelih (normohromatskih) eritrocita u perifernoj krvi koji sadrže mikronukleuse u datom broju zrelih eritrocita.
In vivo mikronukleus test kod sisara posebno je važan za procenu mutagenosti jer uzima u obzir faktore metabolizma in vivo, farmakokinetku i procese reparacije DNK, iako isti mogu da se razlikuju između različitih vrsta i tkiva, kao i između različitih genetskih pokazatelja ispitivanja. In vivo ispitivanje korisno je i za dalje istraživanje mutagenih efekata otkrivenih u in vitro sistemu.
Ovo ispitivanje ne odgovara ukoliko se pojave dokazi da ispitivana supstanca ili reaktivni metabolit neće stići do ciljnog tkiva.
Videti Opšti uvod.
1.2. DEFINICIJE
Centromera (Kinetohora) jeste područje(a) hromozoma sa kojima su tokom ćelijske deobe povezane niti deobnog vretena, a čime je omogućeno uredno kretanje kćerki hromozoma prema polovima kćerki ćelija.
Mikronukleusi jesu zasebni mali nukleusi, odvojeni od glavnog jedra ćelije, nastali tokom telofaze mitoze (mejoze) zaostajanjem fragmenata hromozoma ili čitavih hromozoma.
Normohromatski eritrociti jesu zreli eritrociti kojima nedostaju ribozomi. Mogu se razlikovati od nezrelih polihromatskih eritrocita na osnovu crta karakterističnih za prisustvo ribozoma.
Polihromatski eritrociti jesu nezreli eritrociti u prelaznoj fazi razvoja koji još uvek sadrže ribozome. Mogu se razlikovati od zrelih, normohromatskih eritrocita na osnovu crta karakterističnih za prisustvo ribozoma.
1.3. PRINCIP METODE
Životinje se odgovarajućim putem izlažu ispitivanoj supstanci. Ukoliko se koristi kostna srž, životinje se lišavaju života na human način u odgovarajuće vreme nakon tretmana, nakon čega se uzima kostna srž i izrađuju i boje preparati1, 2, 3, 4, 5, 6, 7. Prilikom korišćenja periferne krvi, krv se uzima u odgovarajuće vreme nakon tretmana i izrađuju se preparati razmaza krvi koji se boje4, 8, 9, 10. Kod istraživanja sa perifernom krvlju vreme proteklo od poslednjeg izlaganja i ubiranja ćelija je što kraće. Preparati se analiziraju kako bi se utvrdilo postojanje mikronukleusa.
1.4. OPIS METODE
1.4.1. Pripreme
1.4.1.1. Izbor životinjske vrste
U slučaju korišćenja kostne srži preporučuje se primena miševa i pacova, iako se mogu koristiti i druge odgovarajuće vrste sisara. U slučaju korišćenja periferne krvi preporučuju se miševi. Mogu se koristiti i druge odgovarajuće vrste sisara ako slezina te vrste ne uklanja eritrocite sa mikronukleusima ili da je vrsta pokazala odgovarajuću osetljivost za otkrivanje agensa koji izazivaju strukturne ili numeričke hromozomske aberacije. Koriste se mlade, zdrave životinje laboratorijskih sojeva koji se generalno upotrebljavaju. Prilikom započinjanja istraživanja odstupanje u telesnoj masi životinja treba da bude minimalno i ne veće od ± 20% prosečne telesne mase svakog pola.
1.4.1.2. Uslovi čuvanja i ishrane
Primenjuju se opšti uslovi dati u Opštem uvodu, iako se nastoji da se vlažnost održava na nivou od 50% do 60%.
1.4.1.3. Priprema životinja
Zdrave, odrasle životinje nasumično se grupišu u kontrolnu i tretirane grupe. Životinje se pojedinačno označavaju. Životinje se aklimatizuju na laboratorijske uslove najmanje pet dana. Kavezi su takvi da se mogući uticaji svedu na minimum.
1.4.1.4. Priprema doza
Pre primene, čvrste ispitivane supstance se rastvaraju ili suspenduju u odgovarajućim vehikulumima i, ukoliko je potrebno, razblažuju. Tečne ispitivane supstance mogu direktno da se primene ili da se pre primene razblaže. Sveži preparati ispitivane supstance se odmah upotrebljavaju, osim ukoliko podaci o stabilnosti pokazuju da je čuvanje prihvatljivo.
1.4.2. Uslovi ispitivanja
1.4.2.1. Vehikulum
Vehikulum ne sme da izaziva toksične efekte pri doznim nivoima u kojima se primenjuje i ne sme da postoji sumnja da će hemijski da reaguje sa ispitivanom supstancom. Ukoliko se primenjuju manje poznati vehikulumi, njihovo uključivanje u ispitivanje se obrazlaže podacima koji ukazuju na njihovu kompatibilnost. Kad god je moguće, preporučuje se primena vodenog vehikuluma.
1.4.2.2. Kontrole
Istovremene pozitivne i negativne (vehikulum) kontrole uključene su u svako ispitivanje i za svaki pol. Osim tretiranja ispitivanom supstancom, sa životinjama u kontrolnim grupama postupa se na isti način kao i sa životinjama u tretiranim grupama.
Pozitivne kontrole treba da izazovu stvaranje mikronukleusa in vivo pri doznim nivoima za koje se očekuje da će dovesti do uočljivog povećanja u odnosu na negativnu kontrolu. Doze pozitivne kontrole biraju se tako da efekti budu jasni, ali da licu koja očitava rezultate odmah ne otkriju identitet šifriranih mikroskopskih preparata (slajdova). Dozvoljeno je da se pozitivna kontrola primeni putem koji je različit od puta primene ispitivane supstance, i uzorak se uzima samo jednom. Može se uzeti u obzir primena pozitivnih kontrola koje pripadaju istoj hemijskoj klasi kao i ispitivana hemikalija. Primeri supstanci koje se koriste kao pozitivne kontrole:
Tabela 1.
Supstanca |
CAS br. |
EINECS br |
Etil metansulfonat |
62-50-0 |
200-536-7 |
N-etil-N-nitrozourea |
759-73-9 |
212-072-2 |
Mitomicin C |
50-07-7 |
200-008-6 |
Ciklofosfamid |
50-18-0 |
200-015-4 |
Trietilenmelamin |
51-18-3 |
200-083-5 |
Negativne kontrole, tretirane samo vehikulumom, sa kojima se postupa na isti način kao sa grupama obuhvaćenim tretmanom, obuhvaćene su svakim uzorkovanjem, osim ukoliko su dostupni podaci kontrole iz ranijih studija o varijabilnosti u okviru vrste i frekvenciji ćelija sa mikronukleusima. Ukoliko se na negativne kontrole primenjuje jedno uzorkovanje, najprimerenije je vreme prvog uzorkovanja. Istovremeno se koriste i netretirane kontrole (kontrolni uzroci), osim ukoliko postoje kontrolni podaci iz prethodnih ispitivanja ili objavljeni kontrolni podaci koji dokazuju da odabran vehikulum ne izaziva štetne ili mutagene efekte.
Kada se koristi periferna krv može biti prihvatljiv i uzorak uzet pre tretmana u svojstvu negativne kontrole (negativnog kontrolnog uzorka), ali samo kod kratkotrajnih istraživanja periferne krvi (npr. 1 do 3 tretmana), a kada se dobijeni podaci nalaze unutar očekivanog opsega s obzirom na raniju kontrolu.
1.5. POSTUPAK
1.5.1. Broj i pol životinja
Svaka tretirana i kontrolna grupa obuhvata najmanje pet životinja istog pola na kojima je moguće obaviti analizu11. Ukoliko postoje podaci istraživanja obavljenog na istoj vrsti i istim putem izlaganja koji dokazuju da ne postoje značajnije razlike među polovima u toksičnosti, dovoljno je da se ispitivanje obavi kod samo jednog pola. U slučajevima u kojima izlaganje ljudi hemikalijama može da bude specifično za pol, kao na primer kod nekih farmaceutskih agenasa, ispitivanje se obavlja sa životinjama odgovarajućeg pola.
1.5.2. Plan tretmana
Nije moguće preporučiti nikakav standardni plan tretmana (tj. jedan, dva ili više tretmana u intervalima od 24 sata). Uzorci dobijeni iz produženih režima tretmana prihvatljivi su ako je dokazan pozitivan efekat ili, kada je u pitanju negativno ispitivanje, ako je dokazana toksičnost ili upotrebljena granična doza i da je tretiranje nastavljeno sve do vremena uzorkovanja. Ispitivane supstance se mogu davati u obliku podeljenih doza, tj. u obliku dva tretmana tokom istog dana u razmaku od najviše nekoliko sati, kako bi se olakšalo davanje velike zapremine materijala.
Ispitivanje se može obaviti na dva načina:
a) Životinje se jednom tretiraju ispitivanom supstancom. Uzorci kostne srži uzimaju se najmanje dva puta, počevši najranije 24 sata nakon tretmana, ali najkasnije 48 sati nakon tretmana, uz primenu odgovarajućih intervala između uzimanja uzoraka. Uzorkovanje pre isteka perioda od 24 sata nakon tretmana potrebno je obrazložiti. Uzorci periferne krvi uzimaju se najmanje dva puta, počevši najranije 36 sati nakon tretmana, uz primenu odgovarajućih intervala nakon uzimanja prvog uzorka, ali ne duže od 72 sata nakon tretmana. Ukoliko se potvrdi pozitivna reakcija prilikom jednog intervala uzorkovanja, nije potrebno dalje uzorkovanje.
b) Ukoliko se primenjuje dva ili više tretmana dnevno (npr. dva ili više tretmana u intervalima od 24 sata), uzorci se uzimaju jednom, između 18 sati i 24 sata nakon konačnog tretmana kada je u pitanju kostna srž, i jednom između 36 sati i 48 sati nakon konačnog tretmana u slučaju periferne krvi12.
Mogu se dodatno primeniti drugi intervali uzorkovanja, kada je to značajno.
1.5.3. Dozni nivoi
Ukoliko se zbog nedostatka dostupnih podataka obavlja istraživanje sa ciljem utvrđivanja opsega doza, navedeno istraživanje se obavlja u istoj laboratoriji, uz korišćenje iste vrste, soja, pola i režima ispitivanja kao i u glavnom istraživanju13. Ukoliko postoji toksičnost, prilikom prvog uzorkovanja koriste se tri dozna nivoa. Navedene doze obuhvataju raspon od maksimalne do niske toksičnosti ili nivo bez toksičnosti. Prilikom drugog uzorkovanja potrebno je upotrebiti samo najvišu dozu. Najviša doza toksičnosti definiše se kao doza usled koje nastaju takvi znakovi toksičnosti da bi viša doza prouzrokovala uginjavanje životinja. Supstance specifične biološke aktivnosti u malim netoksičnim dozama (poput hormona i mitogena) mogu biti izuzetak od kriterijuma za izbor doza i tada se doze procenjuju u zavisnosti od slučaja. Najviša doza se može definisati i kao dozu koja dovodi do nekih indikacija toksičnosti u kostnoj srži (npr. smanjenje udela nezrelih eritrocita u ukupnom broju eritrocita u kostnoj srži ili perifernoj krvi).
1.5.4. Ispitivanje granične doze
Ukoliko u ispitivanju sa jednom dozom od najmanje 2.000 mg/kg TM u jednokratnom tretmanu ili u obliku dva tretmana tokom istog dana ne nastanu nikakvi primetni toksični efekti i ukoliko se na osnovu podataka o strukturno sličnim supstancama ne očekuje genotoksičnost, nije potrebno primeniti kompletno ispitivanje primenom tri dozna nivoa. Za ispitivanja koja traju do 14 dana granična doza iznosi 2.000 mg/kg TM/dan, a za ispitivanja koja traju duže od 14 dana iznosi 1.000 mg/kg TM/dan. Očekivana izloženost ljudi može da ukaže na potrebu za primenom više doze u ispitivanju granične doze.
1.5.5. Primena doza
Ispitivana supstanca obično se primenjuje intubacijom, i to korišćenjem želučane sonde ili odgovarajuće intubacione kanile ili intraperitonealnom injekcijom. Mogu se primeniti i ostali putevi izlaganja uz obrazloženje. Maksimalna zapremina tečnosti koja se može dati putem sonde ili injekcijom u jednom navratu zavisi od veličine eksperimentalne životinje. Zapremina ne prelazi 2 mL/100 g TM. Upotrebu većih zapremina potrebno je obrazložiti. Izuzev u slučaju iritanasa i koroziva kod kojih se efekti ispoljavaju pri višim koncentracijama, odstupanja u zapremini treba da budu minimalna podešavanjem koncentracije, a kako bi se obezbedila konstantna zapremina pri svim doznim nivoima.
1.5.6. Pripremanje uzoraka koštane srži/krvi
Ćelije kostne srži obično se dobijaju iz butne ili goleničnih kostiju odmah nakon lišavanja života na human način. Ćelije se izoluju iz butne kosti i golenice, pripremljene i obojene primenom potvrđenih metoda ispitivanja. Periferna krv se uzima iz repne vene ili drugog odgovarajućeg krvnog suda. Krvne ćelije se odmah supravitalno oboje8, 9, 10 ili se izrade preparati u obliku razmaza koji se zatim oboje. Primenom boje koja je specifična za DNK (npr. akridin oranž14 ili Hoechst 33258 plus pironin-Y15) mogu se otkloniti neki od nedostataka vezanih za primenu DNK-nespecifičnih boja. Navedena prednost ne isključuje primenu uobičajenih boja (npr. Giemsa). Mogu da se primene i dodatni sistemi (npr. celulozne ploče za otklanjanje nukleusnih ćelija16), ako je dokazano kako navedeni sistemi na odgovarajući način funkcionišu prilikom izrade mikronukleusnih preparata u laboratoriji.
1.5.7. Analiza
Udeo nezrelih eritrocita u ukupnom broju eritrocita (nezreli plus zreli) utvrđuje se za svaku životinju prebrojavanjem ukupnog broja od najmanje 200 eritrocita za kostnu srž i 1.000 eritrocita za perifernu krv17. Sve preparate, uključujući one pozitivne i negativne kontrole, potrebno je šifrirati pre mikroskopske analize. Za svaku životinju najmanje 2.000 nezrelih eritrocita podvrgava se analizi radi utvrđivanja pojave mikronukleusnih nezrelih eritrocita. Dodatni podaci mogu se dobiti prebrojavanjem zrelih eritrocita sa mikronukleusima. Prilikom analiziranja mikroskopskih preparata, udeo nezrelih eritrocita prema ukupnom broju eritrocita nije manji od 20% kontrolne vrednosti. Kada se životinje neprekidno tretiraju tokom četiri nedelje ili duže, na pojavu mikronukleusa može se ispitati najmanje 2.000 zrelih eritrocita po životinji. Sistemi za automatizovanu analizu (analiza krvne slike i protočna citometrija suspenzije ćelija) predstavljaju prihvatljive alternative manuelnom ocenjivanju ukoliko su opravdani i validirani.
2. PODACI
2.1. OBRADA REZULTATA
Podaci koji se odnose na pojedinačne životinje navode se tabelarno. Životinja predstavlja eksperimentalnu jedinicu. Za svaku analiziranu životinju zasebno se navodi: broj nezrelih vrednovanih eritrocita, broj mikronukleusnih nezrelih eritrocita i ukupan broj nezrelih eritrocita. Kada se životinje neprekidno tretiraju tokom četiri nedelje ili duže, potrebno je navesti i podatke o zrelim eritrocitima ukoliko se isti prikupljaju. Za svaku životinju se navodi odnos između broja nezrelih i ukupnog broja eritrocita i, ukoliko je potrebno, procenat mikronukleusnih eritrocita. Ukoliko ne postoje dokazi o razlikama među polovima, podaci dobijeni ispitivanjem oba pola mogu se sjediniti radi statističke analize.
2.2. PROCENA I TUMAČENJE REZULTATA
Postoji nekoliko kriterijuma za utvrđivanje pozitivnog rezultata, kao što je dozno zavisno povećanje broja mikronukleusnih ćelija ili jasno povećanje broja mikronukleusnih ćelija u grupi koja je primala jednu dozu, prilikom jednog intervala uzorkovanja. Prvenstveno se uzima u obzir biološka relevantnost rezultata. Mogu se primeniti statističke metode kao pomoćno sredstvo prilikom procene rezultata ispitivanja18, 19. Statistički značaj ne treba da bude jedini faktor za utvrđivanje pozitivne reakcije. Dvosmisleni rezultati se pojašnjavaju daljim ispitivanjem, najbolje modifikovanjem eksperimentalnih uslova.
Ispitivana supstanca za koju rezultati ne zadovoljavaju gore navedene kriterijume, u ovom ispitivanju smatra se nemutagenom.
Iako većina eksperimenata daje jasno pozitivne ili negativne rezultate, u retkim slučajevima utvrđeni podaci ne omogućavaju donošenje konačne odluke o delovanju ispitivane supstance. Rezultati mogu ostati dvosmisleni ili pod znakom pitanja, bez obzira na broj obavljenih eksperimenata.
Pozitivni rezultati mikronukleus testa ukazuju na to da supstanca izaziva nastajanje mikronukleusa koji su posledica hromozomskih oštećenja ili oštećenja mitotskog sistema u eritroblastima eksperimentalne vrste životinja. Negativni rezultati ukazuju na to da, pod eksperimentalnim uslovima, ispitivana supstanca ne izaziva nastanak mikronukleusa u nezrelim eritrocitima eksperimentalne vrste životinja.
Potrebno je razmotriti verovatnoću da ispitivana supstanca ili njeni metaboliti dospeju u krvotok ili, konkretno, do ciljnog tkiva (npr. sistemska toksičnost).
3. IZVEŠTAJ
Izveštaj o ispitivanju sadrži podatke o:
1) Vehikulumu:
- opravdanost izbora vehikuluma;
- rastvorljivost i stabilnost ispitivane supstance u vehikulumu, ukoliko su poznati.
2) Eksperimentalnim životinjama:
- vrsta/soj;
- broj, starost i pol životinja;
- izvor, smeštaj, ishrana, itd.;
- pojedinačna telesna masa životinja na početku ispitivanja, uključujući raspon telesne mase, srednju vrednost i standardnu devijaciju za svaku grupu.
3) Uslovima ispitivanja:
- pozitivna i negativna (vehikulum) kontrola;
- podaci ispitivanja za utvrđivanje raspona doza, ukoliko je obavljeno;
- obrazloženje za izbor doznih nivoa;
- detalji pripreme ispitivane supstance
- detalji primene ispitivane supstance;
- obrazloženje puta primene;
- metode za potvrdu činjenice da je ispitivana supstanca dospela u sistemski krvotok ili do ciljnog tkiva, ukoliko je primenljivo;
- način preračunavanja koncentracije ispitivane supstance u hrani/vodi za piće (ppm) u dozu (mg/kg TM/dan), ukoliko je primenljivo;
- detalji o kvalitetu hrane i vode;
- detaljan opis rasporeda tretmana i uzorkovanja;
- metode pripreme mikroskopskih pločica (slajdova);
- metode merenja toksičnosti;
- kriterijum za vrednovanje mikronukleusnih nezrelih eritrocita;
- broj analiziranih ćelija po životinji;
- kriterijum za smatranje ispitivanja kao pozitivnog, negativnog ili dvosmislenog.
4) Rezultatima:
- znakovi toksičnosti;
- udeo nezrelih eritrocita prema ukupnom broju eritrocita;
- broj mikronukleusnih nezrelih eritrocita, zasebno dat za svaku životinju;
- srednja vrednost ± standardna devijacija broja mikronukleusnih nezrelih eritrocita po grupama;
- odnos doza - odgovor, gde je moguće;
- primenjene statističke analize i metode;
- podaci negativne kontrole iz konkurentne studije i ranije studije;
- podaci pozitivne kontrolne iz konkurentne studije.
5) Obrazloženju rezultata.
6) Zaključcima.
4. LITERATURA
1. Heddle, J.A., (1973) A Rapid In vivo Test for Chromosomal Damage, Mutation Res., 18, p. 187-190.
2. Schmid, W., (1975) The Micronucleus Test, Mutation Res., 31, p. 9-15.
3. Heddle, J.A., Salamone, M.F., Hite, M., Kirkhart, B., Mavournin, K., MacGregor, J.G. and Newell, G.W. (1983). The Induction of Micronuclei as a Measure of Genotoxicity. Mutation Res., 123, p. 61-118.
4. Mavournin, K.H., Blakey, D.H., Cimino, M.C., Salamone, M.F. and Heddle, J.A., (1990) The In vivo Micronucleus Assay in Mammalian Bone Marrow and Peripheral Blood. A report of the U.S. Environmental Protection Agency Gene-Tox Program, Mutation Res., 239, p. 29-80.
5. MacGregor, J.T., Schlegel, R. Choy, W.N., and Wehr, C.M., (1983) Micronuclei in Circulating Erythrocytes: A Rapid Screen for Chromosomal Damage During Routine Toxicity Testing in Mice. Iin: "Developments in Science and Practice of Toxicology", Ed. A.W. Hayes, R.C. Schnell and T.S. Miya, Elsevier, Amsterdam, p. 555-558.
6. MacGregor, J.T., Heddle, J.A. Hite, M., Margolin, G.H., Ramel, C., Salamone, M.F., Tice, R.R., and Wild, D., (1987) Guidelines for the Conduct of Micronucleus Assays in Mammalian Bone Marrow Erytrocytes. Mutation Res., 189, p. 103-112.
7. MacGregor, J.T., Wehr, C.M., Henika, P.R., and Shelby, M.E., (1990) The in vivo Erythrocyte Micronucleus Test: Measurement at Steady State Increases Assay Efficiency and Permits Integration with Toxicity Studies. Fund. Appl. Toxicol., 14, p. 513-522.
8. Hayashi, M., Morita, T., Kodama, Y., Sofuni, T. and Ishidate, M. Jr., (1990) The Micronucleus Assay with Mouse Peripheral Blood Reticulocytes Using Acridine Orange-Coated Slides. Mutation Res., 245, p. 245-249.
9. The Collaborative Study Group for the Micronucleus Test, (1992) Micronucleus Test with Mouse Peripheral Blood Erythrocytes by Acridine Orange Supravital Staining: The Summary Report of the 5th Collaborative Study by CSGMT/JEMMS. MMS. Mutation Res., p. 278, 83-98.
10. The Collaborative Study Group for the Micronucleus Test (CSGMT/JEMMS. MMS: The Mammalian Mutagenesis Study Group of the Environmental Mutagen Society of Japan), (1995) Protocol recommended for the short-term mouse peripheral blood micronucleus test. Mutagenesis, 10, p. 153-159.
11. Hayashi, M., Tice, R.R., MacGregor, J.T., Anderson, D., Blackey, D.H., Kirsch-Volders, M., Oleson, Jr. F. B., Pacchierotti, F., Romagna, F., Shimada, H., Sutou, S. and Vannier, B., (1994) In vivo Rodent Erythrocyte Micronucleus Assay. Mutation Res., 312, p. 293-304.
12. Higashikuni, N. and Sutou, S., (1995) An optimal, generalised sampling time of 30 ± 6 h after double dosing in the mouse peripheral blood micronucleus test. Mutagenesis, 10, p. 313-319.
13. Fielder, R.J., Allen, J.A., Boobis, A.R., Botham, P.A., Doe, J., Esdaile, D.J., Gatehouse, D.G., Hodson-Walker, G., Morton, D.B., Kirkland, D.J. and Rochold, M., (1992) Report of British Toxicology Society/UK Environmental Mutagen Society Working Group: Dose Setting in In vivo Mutagenicity Assays. Mutagenesis, 7, p. 313-319.
14. Hayashi, M., Sofuni, T. and Ishidate, M. Jr., (1983) An Application of Acridine Orange Fluorescent Staining to the Micronucleus Test. Mutation Res., 120, p. 241-247.
15. MacGregor, J.T., Wehr, C.M. and Langlois, R.G., (1983) A Simple Fluorescent Staining Procedure for Micronuclei and RNA in Erythrocytes Using Hoechst 33258 and Pyronin Y. Mutation Res., 120, p. 269-275.
16. Romagna, F. and Staniforth, C.D., (1989) The automated bone marrow micronucleus test. Mutation Res., 213, p. 91-104.
17. Gollapudi, B. and McFadden, L.G., (1995) Sample size for the estimation of polychromatic to normochromatic erythrocyte ratio in the bone marrow micronucleus test. Mutation Res., 347, p. 97-99.
18. Richold, M., Ashby, J., Bootman, J., Chandley, A., Gatehouse, D.G. and Henderson, L., (1990) In vivo Cytogenetics Assay. In: D.J. Kirkland (Ed.) Basic Mutagenicity tests. UKEMS Recommended Procedures. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report, Part I, revised. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, p. 115-141.
19. Lovell, D.P., Anderson, D., Albanese, R., Amphlett, G.E., Clare, G., Ferguson, R., Richold, M., Papworth, D.G. and Savage, J.R.K., (1989) Statistical Analysis of In vivo Cytogenetic Assays. In: D.J. Kirkland (Ed.) Statistical Evaluation of Mutagenicity Test Data. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Report, Part III. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, p. 184-232.
B. 13/14. MUTAGENOST: ISPITIVANJE REVERZNIH MUTACIJA NA BAKTERIJAMA
1. METODA ISPITIVANJA
Metoda ispitivanja zasniva se na Uputstvu za ispitivanje OECD 471, Ispitivanje Bakterijskih Reverznih Mutacija (1997).
1.1. UVOD
Za ispitivanje bakterijskih reverznih mutacija koriste se sojevi Salmonella-e typhimurium i Escherichia-e coli kojima su neophodne aminokiseline, sa ciljem otkrivanja tačkastih mutacija koje obuhvataju supstituciju, adiciju i deleciju jednog ili nekoliko parova baza DNK1, 2, 3. Princip ispitivanja bakterijskih reverznih mutacija je da detektuje mutacije koje dovode do reverzije mutacija prisutnih u ispitivanim sojevima i tako obnavljaju funkcionalnu sposobnost bakterija da sintetišu esencijalne aminokiseline. Reverzno mutirane bakterije mogu se otkriti na osnovu njihove sposobnosti rasta u odsustvu aminokiseline koja je potrebna roditeljskom ispitivanom soju.
Tačkaste mutacije su uzrok mnogih genetskih oboljenja kod ljudi i postoje znatni dokazi da tačkaste mutacije u onkogenima i tumor-supresorskim genima somatskih ćelija učestvuju u nastanku tumora kod ljudi i eksperimentalnih životinja. Ispitivanje bakterijskih reverznih mutacija je brzo, jeftino i relativno jednostavno za izvođenje. Mnogi eksperimentalni sojevi imaju nekoliko svojstava koje ih čine osetljivijim na otkrivanje mutacija, uključujući osetljive sekvence DNK na mestima reverzije, povećanu propustljivost ćelija za veće molekule i eliminaciju sistema reparacije DNK ili pojačavanja procesa reparacije DNK molekula sklonih greškama. Specifičnost eksperimentalnih sojeva može da pruži korisne podatke o tipu mutacija koje izazivaju genotoksični agensi. Dostupna je velika baza rezultata ispitivanja bakterijskih reverznih mutacija za veliki broj različitih struktura i razvijene su dobro utemeljene metodologije za ispitivanje hemikalija sa različitim fizičkim i hemijskim svojstvima, uključujući isparljiva jedinjenja.
Videti Opšti uvod.
1.2. DEFINICIJE
Ispitivanje reverzne mutacije na Salmonella typhimurium ili na Escherichia coli otkriva mutaciju u soju kome je neophodna aminokiselina (histidin odnosno triptofan, redom) koja proizvodi soj koji ne zavisi od spoljašnjeg izvora aminokiseline.
Mutageni koji dovode do supstitucije baznog para (mutageni supstitucije baznog para) jesu agensi koji izazivaju promene baza u DNK. U ispitivanju reverznih mutacija do ove promene može doći na mestu izvorne mutacije ili na drugom mestu u bakterijskom genomu.
Mutageni koji dovode do pomeranja okvira čitanja (mutageni pomaka okvira) jesu agensi koji izazivaju adiciju ili deleciju jednog ili više parova baza u DNK, menjajući time okvir očitavanja RNK.
1.3. POLAZNA RAZMATRANJA
Za ispitivanje bakterijskih reverznih mutacija koriste se prokariotske ćelije koje se od ćelija sisara razlikuju u karakteristikama kao što su: unošenje, metabolizam, hromozomska struktura i procesi reparacije DNK. Ispitivanja koja se obavljaju in vitro obično zahtevaju upotrebu egzogenog izvora metaboličke aktivacije. Sistemi za in vitro metaboličku aktivaciju ne mogu potpuno da oponašaju in vivo uslove kod sisara. Ispitivanje ne pruža direktne podatke o mutagenom i karcinogenom potencijalu supstance kod sisara.
Ispitivanje bakterijskih reverznih mutacija obično se primenjuje kao inicijalni skrining za genotoksičnu aktivnost i, posebno, kao aktivnost koja izaziva pojavu tačkastih mutacija. Opsežna baza podataka pokazala je da mnoge hemikalije koje su u ovom ispitivanju dale pozitivan rezultat pokazuju mutageno delovanje i u drugim ispitivanjima. Postoje primeri mutagenih agensa koji se ne mogu otkriti ovim ispitivanjem. Razlozi za ove nedostatke mogu se pripisati specifičnoj prirodi efekta koji se detektuje, razlikama u metaboličkoj aktivaciji ili u bioraspoloživosti. Faktori koji povećavaju osetljivost ispitivanja bakterijskih reverznih mutacija mogu da dovedu do precenjivanja mutagene aktivnosti.
Ispitivanje bakterijskih reverznih mutacija možda neće biti prikladno za procenu određenih klasa hemikalija, npr. visoko baktericidnih jedinjenja (npr. određeni antibiotici), kao i onih za koje se smatra (ili je poznato) da specifično interferiraju sa sistemom replikacije ćelija sisara (npr. neki inhibitori topoizomeraze i neki analozi nukleotida). U tim slučajevima mogu da budu primerenija ispitivanja mutacija na ćelijama sisara.
Iako je mnoštvo jedinjenja, koja daju pozitivan rezultat u ovom ispitivanju, karcinogeno za sisare, povezanost nije apsolutna. Ona zavisi od klase hemikalije, a postoje i karcinogeni koji se ne mogu otkriti ovim ispitivanjem zbog toga što deluju posredstvom drugih mehanizama koji nisu genotoksični ili putem mehanizama koji ne postoje u ćelijama bakterija.
1.4. PRINCIP METODE
Suspenzije bakterijskih ćelija izlažu se ispitivanoj supstanci u prisustvu i odsustvu egzogenog sistema metaboličke aktivacije. U okviru metode inkorporacije u podlogu, navedene suspenzije mešaju se sa nadslojem agara i odmah se nanose na minimalnu količinu podloge. U metodi preinkubacije smeša za tretman se inkubira, a zatim meša sa nadslojem agara pre nanošenja na minimalnu količinu podloge. Kod obe tehnike, nakon dva ili tri dana inkubacije, broje se revertantne kolonije i upoređuju sa brojem spontanih revertantnih kolonija na kontrolnim podlogama sa vehikulumom.
Opisano je nekoliko postupaka za izvođenje ispitivanja bakterijskih reverznih mutacija. Među navedenim obično se koristi metoda inkorporacije u podlogu 1, 2, 3, 4, metoda preinkubacije2, 3, 5, 6, 7, 8, metoda fluktuacije9, 10 i metoda suspenzije11. Opisane su i modifikacije namenjene ispitivanju gasova ili para12.
Postupci opisani u metodi ispitivanja prvenstveno se odnose na metodu inkorporacije u podlogu i metodu preinkubacije. Obe metode prikladne su za izvođenje eksperimenta sa i bez metaboličke aktivacije. Neke supstance se mogu efikasnije otkriti primenom metode preinkubacije. Navedene supstance pripadaju hemijskim klasama koje uključuju alifatične nitrozamine kratkog lanca, dvovalentne metale, aldehide, azo-boje i diazo jedinjenja, pirolizidinske alkaloide, alil jedinjenja i nitro jedinjenja3. Određene klase mutagena ne mogu se uvek detektovati korišćenjem standardnih postupaka, poput metode inkorporacije u podlogu ili metode preinkubacije. Navedene klase mutagena smatraju se "posebnim slučajevima" i za njihovo otkrivanje preporučuje se korišćenje alternativnih postupaka. Mogu se identifikovati sledeći "posebni slučajevi" (zajedno s primerima postupaka koji se mogu upotrebiti za njihovo otkrivanje): azo-boje i diazo jedinjenja3, 5, 6, 13, gasovi i isparljive hemikalije12, 14, 15, 16 i glikozidi17, 18. Odstupanje od standardnog postupka naučno se opravdava.
1.5. OPIS METODE
1.5.1. Pripreme
1.5.1.1. Bakterije
Sveže kulture bakterija se uzgajaju do kasne eksponencijalne ili rane stacionarne faze rasta (približno 109 ćelija po mL). Kulture u kasnoj stacionarnoj fazi se ne upotrebljavaju. Potrebno je da kulture koje se koriste tokom eksperimenta sadrže visok titar vijabilnih bakterija. Titar se može pokazati ili iz krivih rasta na osnovu podataka kontrole iz ranijih studija ili u svakom ispitivanju utvrđivanjem broja vijabilnih ćelija eksperimentom na podlozi.
Preporučena temperatura inkubacije iznosi 37° C.
Potrebno je upotrebiti najmanje pet sojeva bakterija. Sojevi obuhvataju četiri soja S. typhimurium (TA1535; TA1537 ili TA97a ili TA97; TA98; i TA100) koji su se pokazali kao pouzdani i reproducibilni između laboratorija. Navedena četiri soja S. typhimurium imaju GC parove baza na primarnom mestu reverzne mutacije i poznato je da oni možda neće otkriti određene oksidujuće mutagene, agense koji dovode do unakrsnog povezivanja i hidrazine. Ovakve supstance mogu se otkriti pomoću sojeva E. coli WP2 ili S. typhimurium TA10219 koji imaju AT bazni par na primarnom mestu reverzne mutacije. Preporučena kombinacija sojeva je:
- S. typhimurium TA1535 i
- S. typhimurium TA1537 ili TA97 ili TA97a i
- S. typhimurium TA98 i
- S. typhimurium TA100 i
- E. coli WP2 uvrA ili E. coli WP2 uvrA (pKM101) ili S. typhimurium TA102.
Kako bi se otkrili mutageni koji dovode do unakrsnog povezivanja, može biti potrebno da se uključi TA102 ili dodati soj E. coli koji je vičan u popravci DNK (npr. E. coli WP2 ili E. coli WP2 (PKM101)).
Potrebno je primeniti prihvaćene postupke za pripremanje "stock" kulture, verifikaciju markera i čuvanje. Potreba za aminokiselinama za rast demonstrira se za svaki preparat zamrznute "stock" kulture (za histidinom za sojeve S. typhimurium i triptofanom za sojeve E. coli). Na sličan način potrebno je proveriti ostale fenotipske karakteristike, odnosno prisustvo ili odsustvo plazmida R-faktora ako je potrebno (tj. rezistencija na ampicilin kod sojeva TA98, TA100 i TA97a ili TA97, WP2 uvrA i WP2 uvrA (pKM101) i rezistencija na ampicilin + tetraciklin kod soja TA102); postojanje svojstvenih mutacija (tj. rfa mutacija kod S. typhimurium putem osetljivosti na kristal-violet i uvrA mutacija kod E. Coli ili uvrB mutacija kod S. typhimurium, putem osetljivosti na ultraljubičastu svetlost)2, 3. Sojevi daju takav broj spontanih revertantnih kolonija na podlogama koji se nalazi u okviru raspona učestalosti koji se očekuje na osnovu podataka iz ranije kontrole laboratorije i koji se po mogućstvu nalazi unutar raspona koji se navodi u literaturi.
1.5.1.2. Podloga
Primenjuje se odgovarajući minimalni agar (npr. koji sadrži Vogel-Bonner-ovu minimalnu podlogu "E" i glukozu) i nadsloj agara koji sadrži histidin i biotin ili triptofan koji omogućava nekoliko deoba ćelija1, 2, 9.
1.5.1.3. Metabolička aktivacija
Bakterije se izlažu ispitivanoj supstanci i u prisustvu i u odsustvu sistema metaboličke aktivacije. Najčešće korišćen sistem je postmitohondrijalna frakcija sa kofaktorom (S9) pripremljena od jetre glodara tretiranih agensima enzimske indukcije poput Aroclor-a 12541, 2 ili kombinacije fenobarbitona i ß-naftoflavona18, 20, 21. Postmitohondrijalna frakcija obično se koristi u koncentracijama u rasponu od 5% v/v do 30% v/v u obliku S9-mešavine. Izbor i uslovi sistema metaboličke aktivacije mogu da zavise od klase hemikalije koja se ispituje. U nekim slučajevima može da bude prikladno da se iskoristi više od jedne koncentracije postmitohondrijalne frakcije. Za azo-boje i diazo-jedinjenja može da se pokaže primerenijom primena sistema reduktivne metaboličke aktivacije6, 13.
1.5.1.4. Ispitivana supstanca/Preparat
Pre tretiranja bakterija, čvrste ispitivane supstance se rastvaraju ili suspenduju u odgovarajućim vehikulumima i, ukoliko je potrebno, da se razblaže. Tečne ispitivane supstance mogu se direktno dodati ispitivanim sistemima i/ili se razblažiti pre tretiranja. Sveži preparati ispitivane supstance upotrebljavaju se odmah, osim ukoliko podaci o stabilnosti pokazuju da je čuvanje prihvatljivo.
Ne sme da postoji sumnja da vehikulum hemijski reaguje sa ispitivanom supstancom. Vehikulum je kompatibilan sa preživljenjem bakterija i S9 aktivnošću22. Ukoliko se primenjuju manje poznati vehikulumi, njihovo uključivanje u ispitivanje se potkrepljuje podacima koji ukazuju na njihovu kompatibilnost. Kad god je moguće, preporučuje se vodeni vehikulum. Prilikom ispitivanja supstanci koje su nestabilne u vodi, organski rastvarači koji se koriste ne smeju sadržati vodu.
1.5.2. Uslovi ispitivanja
1.5.2.1. Eksperimentalni sojevi
Videti odeljak 1.5.1.1. ove metode.
1.5.2.2. Koncentracija kojoj se izlažu bakterije
Među kriterijima koji se uzimaju u obzir prilikom utvrđivanja najveće količine ispitivane supstance koja će se primeniti je citotoksičnost i rastvorljivost u konačnoj smeši namenjenoj za primenu.
Može da bude korisno da se utvrdi toksičnost i rastvorljivost u preliminarnom eksperimentu. Citotoksičnost se može otkriti preko redukcije broja revertantnih kolonija, bistrenjem ili smanjivanjem pozadine ili stepena preživljavanja tretiranih kultura. Citotoksičnost neke supstance može se promeniti usled prisustva sistema metaboličke aktivacije. Nerastvorljivost je potrebno oceniti kao precipitaciju (taloženje) u konačnoj mešavini pod stvarnim eksperimentalnim uslovima, a koja je vidljiva golim okom.
Preporučena maksimalna ispitivana koncentracija za rastvorne supstance koje nisu citotoksične iznosi 5 mg/podloga ili 5 µL/podloga. Za supstance koje nisu citotoksične i koje se ne rastvaraju pri 5 mg/podloga ili 5 µL/podloga, jedna ili više ispitivanih koncentracija treba da bude nerastvorna u konačnoj smeši namenjenoj za tretman. Ispitivane supstance koje su ciotoksične već pri nivoima nižim od 5 mg/podloga ili 5 µL/podloga ispituju se sve do citotoksične koncentracije. Precipitat ne sme da utiče na ocenjivanje (prebrojavanje).
Potrebno je upotrebiti najmanje pet različitih koncentracija ispitivane supstance (koje je moguće analizirati) u intervalima od otprilike polovine log (tj. √10) između tačaka ispitivanja u inicijalnom eksperimentu. Manji intervali mogu se pokazati prikladnim prilikom ispitivanja veze između koncentracije i odgovora. Ispitivanje koncentracija iznad 5 mg/podloga ili 5 µL/podloga može da se uzme u obzir prilikom vrednovanja supstance koje sadrže značajne količine potencijalno mutagenih nečistoća.
1.5.2.3. Pozitivne i negativne kontrole
Svako ispitivanje uključuje istovremene pozitivne i negativne kontrole (vehikuklum) specifične za soj, sa i bez metaboličke aktivacije. Potrebno je odabrati koncentracije pozitivne kontrole koje će pokazati efikasno obavljanje svakog eseja.
Za eseje sa sistemom metaboličke aktivacije, referentna supstanca pozitivne kontrole se bira na osnovu vrste bakterijskih sojeva koji se koriste.
Primeri supstanci odgovarajućih pozitivnih kontrola za eseje sa metaboličkom aktivacijom:
Tabela 1.
CAS br. |
EINECS br. |
Nazivi |
781-43-1 |
212-308-4 |
9,10-dimetilantracen |
57-97-6 |
200-359-5 |
7,12-dimetilbenzo[a]antracen |
50-32-8 |
200-028-5 |
benzo[a]piren |
613-13-8 |
210-330-9 |
2-aminoantracen |
50-18-0 |
|
ciklofosfamid |
6055-19-2 |
200-015-4 |
ciklofosfamid monohidrat |
Supstanca koja predstavlja odgovarajuću pozitivnu kontrolu za metodu reduktivne metaboličke aktivacije:
Tabela 2.
CAS br. |
EINECS br |
Nazivi |
573-58-0 |
209-358-4 |
Kongo crveno |
2-aminoantracen se ne upotrebljava kao jedini indikator efikasnosti S9-smeše. Ukoliko se koristi 2-aminoantracen, svaki lot S9 takođe nosi obeležje mutagena koji zahteva metaboličku aktivaciju mikrozomalnim enzimima, npr. benz[a]piren, dimetilbenzantracen.
Supstance date u Tabeli 3 primeri su pozitivnih kontrola specifičnih za soj za eseje koji se sprovode bez egzogenog sistema metaboličke aktivacije:
Tabela 3.
CAS br. |
EINECS br. |
Nazivi |
Soj |
26628-22-8 |
247-852-1 |
Natrijum-azid |
TA 1535 i TA 100 |
607-57-8 |
210-138-5 |
2-nitrofluoren |
TA 98 |
90-45-9 |
201-995-6 |
9-aminoakridin |
TA 1537, TA 97 i TA 97a |
17070-45-0 |
241-129-4 |
ICR 191 |
TA 1537, TA 97 i TA 97a |
80-15-9 |
201-254-7 |
Kumen hidroperoksid |
TA 102 |
50-07-7 |
200-008-6 |
mitomicin C |
WP2 uvrA i TA102 |
70-25-7 |
200-730-1 |
N-etil-N-nitro-N-nitrozogvanidin |
WP2, WP2uvrA i |
56-57-5 |
200-281-1 |
4-nitrohinolin-1-oksid |
WP2, WP2uvrA i |
3688-53-7 |
|
Furilfuramid (AF2) |
sojevi koji sadrže plazmid |
Mogu se koristiti i druge referentne supstance kao pozitivne kontrole. Uzima se u obzir upotreba hemikalije srodne klase kao pozitivna kontrola, kada je dostupna.
Potrebno je uključiti negativne kontrole koje se sastoje samo od vehikuluma, bez ispitivane supstance i sa kojima se postupa na isti način kao i sa tretiranim grupama. Potrebno je koristiti netretirane kontrole, osim ukoliko postoje kontrolni podaci iz ranijih studija koji pokazuju da izabrani vehikulum ne dovodi do štetnih ili mutagenih efekata.
1.5.3. Postupak
Kod metode inkorporacije u podlogu1, 2, 3, 4 bez metaboličke aktivacije, obično se 0,05 mL ili 0,1 mL ispitivanih rastvora, 0,1 mL sveže bakterijske kulture (koja sadrži otprilike 108 vijabilnih ćelija) i 0,5 mL sterilnog pufera pomeša sa 2,0 mL nadsloja agara. Za esej sa metaboličkom aktivacijom, obično se 0,5 mL smeše za metaboličku aktivaciju, koja sadrži odgovarajuću količinu postmitohondrijalne frakcije (u rasponu od 5% v/v do 30% v/v u smeši za metaboličku aktivaciju) meša s nadslojem agara (2,0 mL) zajedno s bakterijama i ispitivanom supstancom/ispitivanim rastvorom. Sadržaj svake epruvete izmeša se i prelije preko površine minimalne agar hranjive podloge. Nadsloj agara ostavlja se kako bi se stvrdnuo pre inkubacije.
Kod metode preinkubacije2, 3, 5, 6 ispitivana supstanca/ispitivan rastvor se preinkubira zajedno s ispitivanim sojem (koji sadrži otprilike 108 vijabilnih ćelija) i sterilnim puferom ili sistemom metaboličke aktivacije (0,5 mL), obično u trajanju od 20 minuta ili duže, pri temperaturi od 30° C do 37° C, a pre mešanja s nadslojem agara i prelivanja preko površine minimalne agar podloge. Obično se 0,05 mL ili 0,1 mL ispitivane supstance/ispitivanog rastvora, 0,1 mL bakterija i 0,5 mL S9-smeše ili sterilnog pufera pomeša sa 2,0 mL nadsloja agara. Epruvete se tokom preinkubacionog perioda snabdevaju vazduhom, primenom uređaja za mućkanje.
Potrebno je da se primene po tri podloge za svaki dozni nivo u cilju odgovarajuće procene varijabilnosti. Prihvatljivo je da se primene po dve podloge u slučajevima kada je to naučno opravdano. Povremeni gubitak podloge ne čini nužno esej nevažećim.
Gasovite i isparljive supstance potrebno je ispitivati pomoću odgovarajućih metoda, npr. u zapečaćenim sudovima12, 14, 15, 16.
1.5.4. Inkubacija
Sve podloge u određenom ispitivanju se inkubiraju na temperaturi od 37 °C tokom 48 do 72 sata. Nakon perioda inkubacije prebrojava se broj revertantnih kolonija po podlozi.
2. PODACI
2.1. OBRADA REZULTATA
Podaci se navode u obliku broja revertantnih kolonija po podlozi. Navodi se broj revertantnih kolonija na podlogama negativne (kontrola sa vehikulumom i netretirana kontrola, ukoliko su primenjene) i pozitivne kontrole. Potrebno je navesti broj i srednju vrednost revetrantnih kolonija po podlozi i standardnu devijaciju za ispitivanu supstancu i pozitivne i negativne (netretirane i/ili vehikulum) kontrole.
Ne postoji potreba za verifikovanjem jasno pozitivne reakcije. Ako se dobiju dvosmisleni rezultati, razjašnjavaju se u daljim ispitivanjima, najbolje modifikovanjem eksperimentalnih uslova. Negativne rezultate potrebno je potvrditi u zavisnosti od slučaja. U slučajevima u kojima se potvrda negativnih rezultata ne smatra neophodnom, daje se obrazloženje. U narednim eksperimentima potrebno je razmotriti modifikaciju parametara ispitivanja s ciljem proširenja opsega ocenjivanih uslova. Parametri ispitivanja koje je moguće modifikovati obuhvataju razmak između koncentracija, metodu tretmana (inkorporacija u podlogu ili tečna preinkubacija) i uslove metaboličke aktivacije.
2.2. PROCENA I TUMAČENJE REZULTATA
Postoji nekoliko kriterijuma za utvrđivanje pozitivnog rezultata, kao što je povećanje u zavisnosti od koncentracije u okviru ispitivanog opsega i/ili reproducibilnog povećanja broja revertantnih kolonija po podlozi pri jednoj ili više koncentracija, kod najmanje jednog soja, sa ili bez sistema metaboličke aktivacije23. Prvenstveno se uzima u obzir biološki značaj rezultata. Mogu da se primene statističke metode kao pomoć prilikom ocenjivanja rezultata ispitivanja24. Statistički značaj ne treba da bude jedini činilac pomoću koga se utvrđuje pozitivni odgovor.
Ispitivana supstanca za koju rezultati ne zadovoljavaju gore navedene kriterijume smatra se nemutagenom u ovom ispitivanju.
Iako većina eksperimenata daje jasne pozitivne ili negativne rezultate, u retkim slučajevima utvrđeni podaci ne omogućavaju donošenje konačnog suda o delovanju ispitivane supstance. Rezultati mogu da ostanu dvosmisleni ili pod znakom pitanja, bez obzira koliko se puta eksperiment ponovi.
Pozitivni rezultati ispitivanja bakterijskih reverznih mutacija ukazuju na to da supstanca uzrokuje tačkaste mutacije supstitucijom baze ili pomeranjem okvira čitanja u genomu kod Salmonella typhimurium odnosno Escherichia coli. Negativni rezultati ukazuju na to da, pod eksperimentalnim uslovima, ispitivana supstanca ne izaziva mutagene promene kod eksperimentne vrste.
3. IZVEŠTAJ
Izveštaj o ispitivanju sadrži podatke o:
1) Vehikulumu:
- obrazloženje izbora vehikuluma;
- rastvorljivost i stabilnost ispitivane supstanca u vehikulumu, ukoliko su poznati.
2) Sojevima:
- upotrebljeni sojevi;
- broj ćelija po kulturi;
- karakteristike soja.
3) Uslovima ispitivanja:
- količina ispitivane supstance po podlozi (mg/podloga ili µL/podloga) s obrazloženjem za izbor doze i broj podloga po koncentraciji;
- upotrebljena podloga;
- tip i sastav sistema metaboličke aktivacije, uključujući kriterijume prihvatljivosti;
- postupci tretmana.
4) Rezultatima:
- znakovi toksičnosti;
- znakovi precipitacije;
- broj za pojedinačne podloge;
- prosečan broj revertantnih kolonija po podlozi i standardna devijacija;
- odnos doza - odgovor, ako je moguće;
- statističke analize, ukoliko postoje;
- podaci negativne (vehikulum) i pozitivne kontrole iz konkurentne studije, sa opsezima, srednjim vrednostima i standardnim devijacijama;
- podaci negativne (vehikulum) i pozitivne kontrole iz ranije studije, sa opsezima srednjim vrednostima i standardnim devijacijama;
5) Obrazloženju rezultata.
6) Zaključcima.
4. LITERATURA
1. Ames, B.N., McCann, J. and Yamasaki E., (1975) Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test. Mutation Res., 31, p. 347-364.
2. Maron, D.M. and Ames, B.N., (1983) Revised Methods for the Salmonella Mutagenicity Test. Mutation Res., 113, p. 173-215.
3. Gatehouse, D., Haworth, S., Cebula, T., Gocke, E., Kier, L., Matsushima, T., Melcion, C., Nohmi, T., Venitt, S. and Zeiger, E., (1994) Recommendations for the Performance of Bacterial Mutation Assays. Mutation Res., 312, p. 217-233.
4. Kier, L.D., Brusick D.J., Auletta, A.E., Von Halle, E.S., Brown, M.M., Simmon, V.F., Dunkel, V., McCann, J., Mortelmans, K., Prival, M., Rao, T.K. and Ray V., (1986) The Salmonella typhimurium/Mammalian Microsomal Assay: A Report of the U.S. Environmental Protection Agency Gene-Tox Program. Mutation Res., 168, p. 69-240.
5. Yahagi, T., Degawa, M., Seino, Y.Y., Matsushima, T., Nagao, M., Sugimura, T. and Hashimoto, Y., (1975) Mutagenicity of Carcinogen Azo Dyes and their Derivatives, Cancer Letters, 1, p. 91-96.
6. Matsushima, M., Sugimura, T., Nagao, M., Yahagi, T., Shirai, A. and Sawamura, M., (1980) Factors Modulating Mutagenicity Microbial Tests. In: Short-term Test Systems for Detecting Carcinogens. Ed. Norpoth K.H. and Garner, R.C., Springer, Berlin-Heidelberg-New York. p. 273-285.
7. Gatehouse, D.G., Rowland, I.R., Wilcox, P., Callender, R.D. and Foster, R., (1980) Bacterial Mutation Assays. In: Basic Mutagenicity Tests: UKEMS Part 1 Revised. Ed. D.J. Kirkland, Cambridge University Press,p. 13-61.
8. Aeschacher, H.U., Wolleb, U. and Porchet, L., (1987) Liquid Preincubation Mutagenicity Test for Foods. J. Food Safety, 8, p. 167-177.
9. Green, M.H.L., Muriel, W.J. and Bridges, B.A., (1976) Use of a simplified fluctuation test to detect low levels of mutagens. Mutation Res., 38, p. 33-42.
10. Hubbard, S.A., Green, M.H.L., Gatehouse, D. and J.W. Bridges (1984) The Fluctuation Test in Bacteria. In: Handbook of Mutagenicity Test Procedures. 2nd Edition. Ed. Kilbey, B.J., Legator, M., Nichols, W. And Ramel, C., Elsevier, Amsterdam-New York-Oxford, p. 141-161.
11. Thompson, E.D. and Melampy, P.J., (1981) An Examination of the Quantitative Suspension Assay for Mutagenesis with Strains of Salmonella typhimurium. Environmental Mutagenesis, 3, p. 453-465.
12. Araki, A., Noguchi, T., Kato, F. and T. Matsushima (1994) Improved Method for Mutagenicity Testing of Gaseous Compounds by Using a Gas Sampling Bag. Mutation Res., 307, p. 335-344.
13. Prival, M.J., Bell, S.J., Mitchell, V.D., Reipert, M.D. and Vaughn, V.L., (1984) Mutagenicity of Benzidine and Benzidine-Congener Dyes and Selected Monoazo Dyes in a Modified Salmonella Assay. Mutation Res., 136, p. 33-47.
14. Zeiger, E., Anderson, B.E., Haworth, S., Lawlor, T. and Mortelmans, K., (1992) Salmonella Mutagenicity Tests. V. Results from the Testing of 311 Chemicals. Environ. Mol. Mutagen., 19, p. 2-141.
15. Simmon, V., Kauhanen, K. and Tardiff, R.G., (1977) Mutagenic Activity of Chemicals Identified in Drinking Water. In Progress in Genetic Toxicology, D. Scott, B. Bridges and F. Sobels (Eds.) Elsevier, Amsterdam, p. 249-258.
16. Hughes, T.J., Simmons, D.M., Monteith, I.G. and Claxton, L.D., (1987) Vaporisation Technique to Measure Mutagenic Activity of Volatile Organic Chemicals in the Ames/Salmonella Assay. Environmental Mutagenesis, 9, p. 421-441.
17. Matsushima, T., Matsumoto, A., Shirai, M., Sawamura, M., and Sugimura, T., (1979) Mutagenicity of the Naturally Occurring Carcinogen Cycasin and Synthetic Methylazoxy Methane Conjugates in Salmonella typhimurium. Cancer Res., 39, p. 3780-3782.
18. Tamura, G., Gold, C., Ferro-Luzzi, A. and Ames, B.N., (1980) Fecalase: A Model for Activation of Dietary Glycosides to Mutagens by Intestinal Flora. Proc. Natl. Acad. Sci. USA, 77, p. 4961-4965.
19. Wilcox, P., Naidoo, A., Wedd, D.J. and Gatehouse, D.G., (1990) Comparison of Salmonella typhimurium TA 102 with Escherichia coli WP2 Tester strains. Mutagenesis, 5, p. 285-291.
20. Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T., (1976) A Safe Substitute for Polychlorinated Biphenyls as an Inducer or Metabolic Activation Systems. In: "In vitro metabolic Activation in Mutagenesis Testing" Eds. F.J. de Serres et al. Elsevier, North Holland, p. 85-88.
21. Elliot, B.M., Combes, R.D., Elcombe, C.R., Gatehouse, D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C., (1992) Alternatives to Aroclor 1254-induced S9 in in vitro Genotoxicity Assays. Mutagenesis, 7, p. 175-177.
22. Maron, D., Katzenellenbogen, J. and Ames, B.N., (1981) Compatibility of Organic Solvents with the Salmonella/Microsome Test. Mutation Res., p. 88343-350.
23. Claxton, L.D., Allen, J., Auletta, A., Mortelmans, K., Nestmann, E. and Zeiger, E., (1987) Guide for the Salmonella typhimurium/Mammalian Microsome Tests for Bacterial Mutagenicity. Mutation Res. 189, p. 83-91.
24. Mahon, G.A.T., Green, M.H.L., Middleton, B., Mitchell, I., Robinson, W.D. and Tweats, D.J., (1989) Analysis of Data from Microbial Colony Assays. In: UKEMS Sub-Committee on Guidelines for Mutagenicity Testing. Part II. Statistical Evaluation of Mutagenicity Test Data. Ed. Kirkland, D.J., Cambridge University Press, p. 28-65.
B.15. ISPITIVANJE MUTAGENOSTI I SKRINING ZA GENSKE MUTACIJE KARCINOGENOSTI-SACCAHAROMYCES CEREVISIAE
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod.
1.2. DEFINICIJE
Videti Opšti uvod.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Merenje produkcije genskih mutacija izazvanih hemijskim agensima sa i bez metaboličke aktivacije može da se izvodi na više haploidnih i diploidnih sojeva kvasca Saccharomyces cerevisiae.
Koriste se rani sistemi mutacije kod haploidnih sojeva, poput merenja mutacije od crvenih mutanata zavisnih od adenina (ade-1, ade-2) do belih mutanata dvostruko zavisnih od adenina i selektivni sistemi poput indukcije rezistencije na kanavnain i cikloheksimid.
Najobimnije validiran sistem reverznih mutacija uključuje primenu haploidnog soja HV 185-14C koji nosi oker nonsense mutacije ade 2-1, arg 4-17, lys 1-1 i trp 5-48, koje su reverzibilne mutageninima supstitucije baza koji izazivaju mutacije specifičnih lokacija ili mutacije oker supresora. HV 185-14C takođe nosi marker his 1-7, missense mutaciju koja se reverzno mutira uglavnom kroz mutacije na drugoj lokaciji, kao i marker hom 3-10 koga reverzno mutiraju mutageni pomaka okvira čitanja.
U diploidnim sojevima S. cerevisiae jedini soj koji ima široku primenu je D7 koji je homozigotan za ilv 1-92.
1.5. KRITERIJUMI KAVALITETA
Nisu propisani.
1.6. OPIS METODE
1.6.1. Pripreme
Rastvori ispitivanih hemikalija i kontrola pripremaju se neposredno pre ispitivanja, uz primenu odgovarajućeg vehikuluma. Kada su u pitanju organska jedinjenja koja nisu rastvorna u vodi, ne upotrebljava se rastvor jači od 2% v/v za organske rastvarače kao što su etanol, aceton ili dimetilsulfoksid (DMSO). Konačna koncentracija vehikuluma ne treba u značajnoj meri da utiče na ćelijsku vijabilnost i svojstva rasta.
1.6.1.1. Metabolička aktivacija
Ćelije se izlažu ispitivanim hemikalijama i u prisustvu i u odsustvu odgovarajućeg egzogenog sistema metaboličke aktivacije.
Najčešće korišćen sistem jeste postmitohondrijalna frakcija sa kofaktorom pripremljena od jetre glodara prethodno tretiranih agensima enzimske indukcije. Za metaboličku aktivaciju može biti prihvatljiva primena i drugih vrsta, tkiva, postmitohondrijalnih frakcija ili postupaka.
1.6.2. Uslovi ispitivanja
1.6.2.1. Eksperimentalni sojevi
Haploidni soj HV 185-14C i diploidni soj D7 su sojevi koji se najčešće primenjuju u ispitivanjima genskih mutacija. Mogu da odgovaraju i drugi sojevi.
1.6.2.2. Podloge
Radi utvrđivanja preživljavanja i broja mutanata koriste se odgovarajuće podloge za kultivisanje.
1.6.2.3. Primena pozitivnih i negativnih kontrola
Potrebno je istovremeno izvesti pozitivne, netretirane i kontrole vehikuluma. Za svaki posmatrani specifični efekat mutacije primenjuju se odgovarajuće hemikalije pozitivne kontrole.
1.6.2.4. Koncentracija izlaganja
Potrebno je upotrebiti najmanje pet odgovarajuće raspoređenih koncentracija ispitivane supstance. Najviša ispitivana koncentracija toksičnih supstanci ne sme da smanji preživljenje ispod 5% do 10%. Supstance koje su relativno nerastvorne u vodi ispituju se do granice rastvorljivosti, uz primenu odgovarajućih postupaka. Za netoksične supstance koje se lako rastvaraju u vodi gornja granica koncentracije se određuje u zavisnosti od slučaja.
1.6.2.5. Uslovi inkubacije
Podloge se inkubiraju od četiri do sedam dana na temperaturi od 28° C do 30° C na tamnom mestu.
1.6.2.6. Frekvencija spontanih mutacija
Potrebno je da se koriste subkulture kod kojih je frekvenca spontanih mutacija u okviru prihvaćenog normalnog opsega.
1.6.2.7. Broj replikata
Neophodno je da se primene najmanje tri podloge po koncentraciji za esej prototrofa nastalih usled genske mutacije i za vijabilnost ćelija. U slučaju eksperimenta koji koriste markere kao što je hom 3-10 sa niskim stopom mutacija, broj hranljivih podloga se povećava kako bi se dobili statistički relevantni podaci.
1.6.3. Postupak
Tretiranje sojeva S. cerevisiae obično se obavlja u postupku ispitivanja u tečnoj podlozi koji obuhvata ćelije u fazi mirovanja ili ćelije u rastu. Inicijalni eksperimenti se izvode na ćelijama u rastu: 1-5 x 107 ćelija/mL izlaže se ispitivanoj hemikaliji do 18 sati na temperaturi od 28° C do 37° C uz mešanje. Tokom tretmana dodaje se odgovarajuća količina sistema metaboličke aktivacije kada je prikladno. Na kraju tretmana ćelije se centrifugiraju, ispiraju i zasejavaju na odgovarajuću podlogu. Nakon inkubacije, podloge se ocenjuju na preživljavanje i indukciju genskih mutacija.
Ukoliko je prvi eksperiment negativan, drugi eksperiment se izvodi uz primenu ćelija u fazi mirovanja. Ukoliko je prvi eksperiment pozitivan, potvrđuje se obavljanjem odgovarajućeg nezavisnog eksperimenta.
2. PODACI
Podaci se navode tabelarno. Navodi se: broj izbrojanih kolonija, broj mutanata, preživljavanje i učestalost mutacija. Sve rezultate potrebno je potvrditi u nezavisnom eksperimentu. Podaci se procenjuju primenom odgovarajućih statističkih metoda.
3. IZVEŠTAJ
3.1. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju, ukoliko je moguće, sadrži podatke o:
- upotrebljenom soju;
- uslovima ispitivanja: faza mirovanja ili ćelije u rastu, sastav podloge, temperatura inkubacije i trajanje, sistem metaboličke aktivacije;
- uslovima tretiranja: nivoi izlaganja, postupak i trajanje tretmana, temperatura na kojoj se izvodi, pozitivne i negativne kontrole;
- broju izbrojanih kolonija, broj mutanata, preživljavanje i učestalost mutanata, odnos doza - odgovor, ukoliko je moguće, statističku procenu podataka;
- obrazloženju rezultata,
- tumačenju rezultata.
3.2. PROCENA I TUMAČENJE REZULTATA
Videti Opšti uvod.
4. LITERATURA
Videti Opšti uvod.
B.16. MITOTSKA REKOMBINACIJA - SACCAROMYCES CEREVISIAE
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod.
1.2. DEFINICIJE
Videti Opšti uvod.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Mitotska rekombinacija kod Saccaromyces cerevisiae može se otkriti između gena (ili obično između gena i njegove centromere), kao i unutar gena. Prvi navedeni događaj naziva se mitotskim krosingoverom (crossing-over) i stvara recipročne proizvode, dok drugi događaj najčešće nije recipročan i naziva se konverzijom gena. Krosingover se obično ispituje na osnovu stvaranja recesivnih homozigotnih kolonija ili sektora stvorenih u heterozigotnom soju, dok se konverzija gena ispituje na osnovu stvaranja prototrofnih revertanata koji nastaju u auksotrofnom heteroalelnom soju koji nosi dva različita defektna alela istog gena. Najčešće korišćeni sojevi namenjeni otkrivanju mitotske konverzije gena su: D4 (heteroalel na ade 2 i trp 5), D7 (heteroalel na trp 5), BZ34 (heteroalel na arg 4) i JDl (heteroalel na his 4 i trp 5). Mitotski krosingover koji stvara crvene i ružičaste homozigotne sektore može da se analizira kod D5 ili D7 (čime se ujedno meri mitotska konverzija gena i reverzna mutacija na ilv 1-92), pri čemu su oba soja heteroalelna za komplementarne alele ade 2.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE
1.6.1. Priprema
Rastvori ispitivanih hemikalija i kontrolnih ili referentnih jedinjenja pripremaju se neposredno pre ispitivanja, uz primenu odgovarajućeg vehikuluma. Kada su u pitanju organska jedinjenja koji nisu rastvorljiva u vodi, ne upotrebljava se rastvor jači od 2% v/v organskih rastvarača kao što su etanol, aceton ili dimetilsulfoksid (DMSO). Konačna koncentracija vehikuluma ne sme u značajnoj meri da utiče na ćelijsku vijabilnost i svojstva rasta ćelija.
1.6.1.1. Metabolička aktivacija
Ćelije se izlažu ispitivanim hemikalijama i u prisustvu i u odsustvu odgovarajućeg egzogenog sistema metaboličke aktivacije. Najčešće korišćen sistem je postmitohondrijalna frakcija sa kofaktorom, pripremljena od jetre glodara prethodno tretiranih agensima koji indukuju enzime. Za metaboličku aktivaciju mogu da se primene i druge vrste, tkiva, postmitohondrijalne frakcije ili postupci.
1.6.2. Uslovi ispitivanja
1.6.2.1. Eksperimentalni sojevi
Najčešće se primenjuju sojevi diploidi D4, D5, D7 i JD1. Mogu da se koriste i drugi sojevi.
1.6.2.2. Podloga
Za određivanje preživljavanja i učestalosti mitotske rekombinacije koriste se odgovarajuće podloge.
1.6.2.3. Upotreba pozitivnih i negativnih kontrola
Istovremeno je potrebno izvoditi pozitivne, netretirane i kontrole vehikuluma. Primenjuju se odgovarajuće hemikalije pozitivne kontrole za svaki specifični pokazatelj ispitivanja rekombinacije.
1.6.2.4. Koncentracije izlaganja
Potrebno je upotrebiti najmanje pet odgovarajuće raspoređenih koncentracija ispitivane supstance. Među faktorima koji se uzimaju u obzir nalaze se citotoksičnost i rastvorljivost. Najniža koncentracija ne sme da ima efekat na vijabilnost ćelija. Najviša ispitivana koncentracija toksičnih hemikalija ne sme da smanji preživljenje ispod 5% do 10%. Hemikalije koje su relativno nerastvorne u vodi ispituju se do njihove granice rastvorljivosti uz primenu odgovarajućih postupaka. Za netoksične supstance koje se lako rastvaraju u vodi gornja granica koncentracije određuje se u zavisnosti od slučaja.
Ćelije mogu da se izlože ispitivanim hemikalijama u fazi mirovanja ili tokom rasta u trajanju do 18 sati. Za dugotrajne tretmane kulture se mikroskopski pregledaju na formiranje spora, čije postojanje čini ispitivanje nevažećim.
1.6.2.5. Uslovi inkubacije
Podloge se inkubiraju na tamnom mestu, od četiri do sedam dana, na temperaturi od 28° C do 30° C. Podloge koje se koriste za ispitivanje crvenih i ružičastih homozigotnih sektora koji su nastali mitotskim krosingoverom drže se u frižideru (na temperaturi oko 4° C) tokom jednog do dva dana pre ocenjivanja, a kako bi se omogućio razvoj odgovarajućih pigmentovanih kolonija.
1.6.2.6. Učestalosti spontane mitotske rekombinacije
Koriste se subkulture sa učestalošću spontanih mutacija mitotske rekombinacije u okviru prihvaćenog normalnog opsega.
1.6.2.7. Broj replikata
Za ispitivanje prototrofa nastalih usled mitotske konverzije gena i za vijabilnost ćelija neophodno je primeniti najmanje tri podloge po koncentraciji. U slučaju ispitivanja recesivnih homozigota koje nastaju mitotskim krosingoverom, potrebno je povećati broj podloga kako bi se obezbedio odgovarajući broj kolonija.
1.6.3. Postupak
Tretiranje sojeva S. Cerevisiae obično se obavlja postupkom u tečnoj podlozi koji uključuje ćelije u fazi mirovanja ili ćelije u rastu. Prethodni eksperimenti se obavljaju na ćelijama u rastu: 1-5 x 107 ćelija/mL izlaže se ispitivanoj hemikaliji do 18 sati na temperaturi od 28° C do 37° C uz mešanje. Tokom tretmana dodaje se odgovarajuća količina sistema za metaboličku aktivaciju, kada je prikladno.
Na kraju tretmana ćelije se centrifugiraju, ispiraju i zasejavaju na odgovarajuće podloge za kultivisanje. Nakon inkubacije, hranljive podloge se ocenjuju na preživljenje i indukciju mitotske rekombinacije.
Ukoliko je prvi eksperiment negativan, obavlja se drugi eksperiment uz primenu ćelija u fazi mirovanja. Ukoliko je prvi eksperiment pozitivan, ovaj rezultat se potvrđuje u nezavisnom eksperimentu.
2. PODACI
Podaci se navode tabelarno. Navodi se: broj izbrojanih kolonija, broj rekombinanata, preživljenje i frekvenca rekombinanata.
Potrebno je potvrditi rezultate u nezavisnom eksperimentu.
Podaci se procenjuju primenom odgovarajućih statističkih metoda.
3. IZVEŠTAJ
3.1. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju, ukoliko je moguće, sadrži podatke o:
- upotrebljenom soju;
- uslovima ispitivanja: stacionarna faza ili ćelije u rastu, sastav podloge, temperatura inkubacije i trajanje, sistem metaboličke aktivacije;
- uslovima tretiranja: koncentracija kojoj su ćelije izložene, postupak i trajanje tretmana, temperatura, pozitivne i negativne kontrole;
- broju izbrojanih kolonija, broj rekombinanata, preživljenje i učestalost rekombinacije, odnos doza-odgovor, ukoliko je moguće, statistička procena podataka;
- obrazloženju rezultata;
- tumačenju rezultata.
3.2. PROCENA I TUMAČENJE REZULTATA
Videti Opšti uvod.
4. LITERATURA
Videti Opšti uvod.
B.17. MUTAGENOST - IN VITRO ISPITIVANJE GENSKE MUTACIJE NA ĆELIJAMA SISARA
1. METODA ISPITIVANJA
Ova metoda zasniva se na Uputstvu za ispitivanje OECD 476, In vitro ispitivanje genskih mutacija na ćelijama sisara (Mammalian Cell Gene Mutation Test) (1997).
1.1. UVOD
Za otkrivanje genskih mutacija izazvanih hemijskim supstancama može se koristiti ispitivanje genskih mutacija na ćelijama sisara in vitro. Odgovarajuće ćelijske linije obuhvataju L5178Y ćelije mišjeg limfoma, CHO, CHO-AS52 i V79 linije ćelija kineskog hrčka i TK6 ćelije humanog limfoblasta1. U ovim ćelijskim linijama najčešće posmatrani genski pokazatelji mere mutaciju na timidin kinazi (u daljem tekstu: TK) i hipoksantin-gvanin fosforibozil transferazi (u daljem tekstu: HPRT) i transgenu za ksantin-gvanin fosforibozil transferazu (u daljem tekstu: XPRT). Ispitivanja mutacija na TK, HPRT i XPRT otkrivaju različite spektre genetskih pojava. Autozomalna lokacija TK i XPRT može da omogući otkrivanje genetskih pojava (npr. velikih delecija), a koje nisu otkrivene na HPRT lokusu na X-hromozomima2, 3, 4, 5, 6.
In vitro ispitivanje genske mutacije na ćelijama sisara mogu da se izvode na kulturama definisanih ćelijskih linija ili ćelijskih sojeva. Ćelije koje se upotrebljavaju biraju se na osnovu sposobnosti rasta u kulturi i stabilnosti učestalosti spontanih mutacija.
Ispitivanja koja se obavljaju in vitro generalno zahtevaju primenu egzogenog izvora metaboličke aktivacije. Ovaj sistem metaboličke aktivacije ne može u potpunosti da oponaša in vivo uslove kod sisara. Potrebno je da se izbegavaju uslovi koji dovode do rezultata koji ne oslikavaju intrinzičnu mutagenost. Usled promena pH, osmolalnosti ili visokih nivoa citotoksičnosti mogu da nastanu pozitivni rezultati koji ne oslikavaju intrinzičnu mutagenost7.
Navedeno ispitivanje koristi se za otkrivanje mogućih mutagena i karcinogena za sisare. Mnoga jedinjenja koja daju pozitivan rezultat u ovom ispitivanju karcinogeni su za sisare; međutim, međusobna zavisnost između ovog ispitivanja i karcinogenosti nije besprekorna. Korelacija zavisi od klase hemikalije i ima sve više dokaza da postoje karcinogeni koji se ne mogu otkriti ovim ispitivanjem zbog toga što deluju putem drugih, negenotoksičnih mehanizama ili mehanizama koji ne postoje u bakterijskim ćelijama6.
Videti Opšti uvod.
1.2. DEFINICIJE
Napredna direktna mutacija jeste genska mutacija iz roditeljskog tipa u mutirani oblik koja dovodi do izmene ili gubitka enzimske aktivnosti ili funkcije kodiranog proteina.
Mutageni supstitucije baznog para jesu supstance koje dovode do supstitucije jednog ili nekoliko parova baza u DNK.
Mutageni pomaka okvira jesu supstance koje dovode do adicije ili delecije jednog ili više parova baza u molekulu DNK.
Vreme ekspresije fenotipa jeste vremenski period tokom koga nepromenjeni genski proizvodi bivaju odstranjeni iz novomutiranih ćelija.
Frekvenca mutanata jeste broj primećenih mutiranih ćelija podeljen brojem vijabilnih ćelija.
Relativni ukupni rast jeste povećanje broja ćelija tokom vremena u poređenju s kontrolnom populacijom ćelija. Izračunava se kao proizvod rasta u suspenziji u odnosu na vreme efikasnosti kloniranja negativne kontrole i u odnosu na negativnu kontrolu.
Relativni rast u suspenziji jeste povećanje broja ćelija tokom perioda ekspresije u odnosu na negativnu kontrolu.
Vijabilnost jeste efikasnost kloniranja tretiranih ćelija u vreme zasejavanja u selektivnim uslovima nakon perioda ekspresije.
Preživljavanje jeste efikasnost kloniranja tretiranih ćelija nakon što se iste zaseju na podlogu na kraju perioda tretmana. Preživljavanje se obično izražava u odnosu na preživljenje kontrolne populacije ćelija.
1.3. PRINCIP METODE
Ćelije bez timidin kinaze (u daljem tekstu: TK) su zbog mutacije TK+/- > TK-/- otporne na citotoksične efekte analoga pirimidina trifluorotimidina (u daljem tekstu: TFT). Ćelije s timidin kinazom osetljive su na TFT koji inhibira ćelijski metabolizam i zaustavlja dalju deobu ćelija. Zbog toga mutirane ćelije mogu da se razmnožavaju u prisustvu TFT-a, dok normalne ćelije, koje sadrže timidin kinazu, ne mogu. Slično se ćelije bez HPRT-a ili XPRT-a selektuju po otpornosti na 6-tiogvanin (u daljem tekstu: TG) ili 8-azagvanin (u daljem tekstu: AG). Svojstva ispitivane supstance pažljivo se razmatraju ukoliko se u bilo kojem ispitivanju genske mutacije u ćelijama sisara ispituje analog baze ili jedinjenje srodno selektivnom agensu. Na primer, potrebno je istražiti svaku selektivnu toksičnost na koju se sumnja da postoji kod ispitivane supstance, a u odnosu na mutirane i nemutirane ćelije. Potrebno je potvrditi efikasnost selekcijskog sistema/agensa, a kada se ispituju hemikalije koje su strukturno srodne selektivnom agensu8.
Ćelije u suspenziji ili jednoslojnoj kulturi izlažu se ispitivanoj supstanci sa i bez metaboličke aktivacije, tokom odgovarajućeg vremenskog perioda i subkultivišu se kako bi se utvrdila citotoksičnost i kako bi se omogućila fenotipska ekspresija pre selekcije mutanata9, 10, 11, 12, 13. Citotoksičnost se obično utvrđuje merenjem relativne efikasnosti kloniranja (preživljenje) ili relativnog ukupnog rasta kultura nakon perioda tretiranja. Tretirane kulture održavaju se u podlozi za rast tokom dovoljnog vremenskog perioda, koje je karakteristično za svaki izabrani lokus i vrstu ćelija, a kako bi se omogućila skoro optimalna fenotipska ekspresija indukovanih mutacija. Frekvenca mutanata utvrđuje se zasejavanjem poznatog broja ćelija u podlozi koja sadrži selektivni agens, kako bi se detektovale mutirane ćelije, kao i u podlozi bez selektivnog agensa kako bi se utvrdila efikasnost kloniranja (vijabilnost). Nakon odgovarajućeg vremena inkubacije kolonije se prebroje. Frekvenca mutacija izračunava se iz broja mutiranih kolonija u selektivnoj podlozi i broja kolonija u neselektivnoj podlozi.
1.4. OPIS METODE
1.4.1. Pripreme
1.4.1.1. Ćelije
Za primenu u ovom ispitivanju na raspolaganju je više vrsta ćelija, uključujući i suklonove ćelija L5178Y, CHO, CHO-AS52, V79 ili TK6. Za vrstu ćelija koje se koriste u ovom ispitivanju treba da je dokazana osetljivost na hemijske mutagene, visoka efikasnost kloniranja i stabilna učestalost pojave spontanih mutanata. Potrebno je proveriti da ćelije nisu kontaminirane mikoplazmom i ukoliko su kontaminirane ne smeju se upotrebiti.
Ispitivanje je dizajnirano tako da ima unapred određenu osetljivost i potencijal. Broj upotrebljenih ćelija, kultura i koncentracija ispitivane supstance oslikava navedene definisane parametre14. Najmanji broj vijabilnih ćelija koje prežive tretman i broj onih koje se upotrebljavaju u svakoj fazi eksperimenta zasniva se na učestalosti spontanih mutacija. Preporuka je da se upotrebi onoliki broj ćelija koji je najmanje jednak deseterostrukoj recipročnoj vrednosti učestalosti spontanih mutacija. Preporučuje se primena najmanje 106 ćelija. Treba da su dostupni odgovarajući podaci o ćelijskom sistemu iz ranije studije kako bi ukazali na konzistentnost ispitivanja.
1.4.1.2. Podloge i uslovi kultivisanja
Upotrebljavaju se odgovarajuće podloge i uslovi inkubacije (posude za kulture, temperatura, koncentracija CO2 i vlažnost). Podloge se biraju u zavisnosti od selektivnog sistema i vrste ćelija koje se upotrebljavaju u ispitivanju. Posebno je važno izabrati uslove kultivisanja koji obezbeđuju optimalan rast ćelija tokom razdoblja ekspresije i sposobnost formiranja kolonija mutiranih i nemutiranih ćelija.
1.4.1.3. Pripremanje kultura
Ćelije se razmnože iz početnih kultura, zaseju na podlogu i inkubiraju na temperaturi od 37 °C. Pre upotrebe u ovom ispitivanju možda će iz kultura biti potrebno odstraniti već postojeće mutirane ćelije.
1.4.1.4. Metabolička aktivacija
Ćelije je potrebno izložiti ispitivanoj supstanci i u prisustvu i u odsustvu odgovarajućeg sistema metaboličke aktivacije. Najčešće korišćen sistem je postmitohondrijalna frakcija sa kofaktorom (S9), pripremljena od jetre glodara tretiranih agensima koji indukuju enzime poput Aroclora 125415, 16, 17, 18 ili kombinacije fenobarbitona i ß-naftoflavona19, 20.
Postmitohondrijalna frakcija obično se koristi u koncentracijama u rasponu od 1% v/v do 10% v/v u konačnoj podlozi za ispitivanje. Izbor i stanje sistema metaboličke aktivacije mogu da zavisi od klase hemikalije koja se ispituje. U nekim slučajevima može biti prikladno da se koristi više od jedne koncentracije postmitohondrijalne frakcije.
Niz razvojnih promena, uključujući konstruisanje genetskim inžinjeringom ćelijskih linija sa ekspresijom specifičnih aktivišućih enzima, mogu da obezbede mogućnost za endogenu aktivaciju. Izbor upotrebljenih ćelijskih linija treba da bude naučno utemeljen (npr. na osnovu značaja izoenzima citohroma P450 za metabolizam ispitivane supstance).
1.4.1.5. Ispitivana supstanca/Preparat
Čvrste ispitivane supstance se rastvaraju ili suspenduju u odgovarajućim rastvaračima ili vehikulumima i, ukoliko je potrebno, razblažuju pre tretiranja ćelija. Tečne ispitivane supstance mogu direktno da se dodaju eksperimentnim sistemima odnosno da se razblaže pre tretiranja. Sveži preparati ispitivane supstance odmah se upotrebljavaju, osim ukoliko podaci o stabilnosti pokazuju da je čuvanje prihvatljivo.
1.4.2. Uslovi ispitivanja
1.4.2.1. Behikulum
Ne sme da postoji sumnja da će rastvarač/vehikulum hemijski da reaguje sa ispitivanom supstancom. Rastvarač/vehikulum je kompatibilan sa preživljenjem ćelija i aktivnošću S9. Ukoliko se primenjuju rastvarači/vehikulumi koja nisu poznati, njihovo uključivanje u ispitivanje se potkrepljuje podacima koji ukazuju na njihovu kompatibilnost. Kad god je moguće, preporučuje se da se prvo uzme u obzir primena vodenog rastvarača/vehikuluma. Prilikom ispitivanja supstance koje su nestabilne u vodi, organski rastvarači koji se koriste ne smeju da sadrže vodu. Voda se može odstraniti dodavanjem molekularnog sita.
1.4.2.2. Koncentracije izlaganja
Među kriterijumima koje je potrebno uzeti u obzir prilikom utvrđivanja najviše koncentracije su: citotoksičnost, rastvorljivost u ispitivanome sistemu i promene u pH i osmolalnosti.
Citotoksičnost je potrebno utvrditi sa i bez metaboličke aktivacije u glavnom eksperimentu uz primenu odgovarajućeg pokazatelja ćelijskog integriteta i rasta, kao što je relativna efikasnosti kloniranja (preživljavanje) ili relativni ukupni rast. Može da bude korisno da se odredi citotoksičnost i rastvorljivost u preliminarnom eksperimentu.
Upotrebljava se najmanje četiri koncentracije koje se mogu analizirati. Kada postoji citotoksičnost, navedene koncentracije obuhvataju raspon od maksimalne do niske ili bez toksičnosti. Ovo najčešće znači da razlika među nivoima koncentracija ne treba da bude veća od faktora između √2 i √10. Ukoliko se najviša koncentracija temelji na citotoksičnosti, tada za posledicu ima relativno preživljenje (relativnu efikasnost kloniranja) ili relativni ukupni rast od oko 10% do 20% (ali ne manje od 10%). Za relativno necitotoksične supstance najviša ispitivana koncentracija je 5 mg/mL 5 µL/mL, ili 0,01 M, u zavisnosti od toga koja koncentracija je niža.
Relativno nerastvorne supstance se ispituju do ili iznad njihove granice rastvorljivosti u uslovima kultivisanja. Dokaze nerastvorljivosti potrebno je utvrditi u konačnoj podlozi za tretiranje kome su izložene ćelije. Može da bude korisno da se rastvorljivost proceni na početku i na kraju tretmana, s obzirom da rastvorljivost može da se promeni tokom izlaganja u ispitivanom sistemu, usled prisutnosti ćelija, S9, seruma, itd. Nerastvorljivost se može otkriti golim okom. Precipitat ne sme da utiče na prebrojavanje.
1.4.2.3. Kontrole
U svaki eksperiment se uključuju istovremene pozitivne i negativne (rastvarač ili vehikulum) kontrole, sa i bez metaboličke aktivacije. Kada se koristi metabolička aktivacija, hemikalija pozitivne kontrole je ona kojoj je za mutageni odgovor potrebna aktivacija.
Primeri supstanci pozitivne kontrole:
Tabela 1.
Stanje |
Lokus |
Supstanca |
CAS br. |
EINECS br. |
Nema egzogene metaboličke aktivacije |
HPRT |
etil metansulfonat |
62-50-0 |
200-536-7 |
etil nitrozourja |
759-73-9 |
212-072-2 |
||
TK (male i velike kolonije) |
metil |
66-27-3 |
200-625-0 |
|
XPRT |
etil metansulfonat |
62-50-0 |
200-536-7 |
|
|
etil nitrozourea |
759-73-9 |
212-072-2 |
|
Postoji egzogena metabolička aktivacija |
HPRT |
3-metilholantren |
56-49-5 |
200-276-4 |
N-nitrozo-dimetilamin |
62-75-9 |
200-549-8 |
||
7,12- dimetil |
57-97-6 |
200-359-5 |
||
TK (male i velike |
ciklofosfamid |
50-18-0 |
200-015-4 |
|
ciklofosfamid monohidrat |
6055-19-2 |
|
||
benzo[a]piren |
50-32-8 |
200-028-5 |
||
3-metilholantren |
56-49-5 |
200-276-5 |
||
XPRT |
N-nitrozodimetil amin (pri visokim koncentracijama S-9) |
62-75-9 |
200-549-8 |
|
benzo[a]piren |
50-32-8 |
200-028-5 |
Mogu da se primene i druge odgovarajuće referentne supstance kao pozitivne kontrole, npr. ukoliko laboratorija raspolaže bazom podataka iz ranijih studija o 5-brom 2'-dezoksiuridinu (CAS br. 59-14-3, EINECS br. 200-415-9) tada mogu da se primene ove referentne supstance. Kada su dostupne klase hemikalija koje su vezi sa pozitivnom kontrolom, razmatra se njihovo korišćenje.
Potrebno je uključiti negativne kontrole koje se sastoje samo od rastvarača ili vehikuluma u podlozi za tretiranje i sa kojima je postupano na isti način kao i sa grupama obuhvaćenim tretmanom. Koriste se i netretirane kontrole, osim ukoliko postoje kontrolni podaci iz prethodnih ispitivanja koji dokazuju da odabran rastvarač ne izaziva štetne ili mutagene efekte.
1.4.3. Postupak
1.4.3.1. Tretiranje ispitivanom supstancom
Ćelije u proliferaciji izlažu se ispitivanoj supstanci sa i bez metaboličke aktivacije. Trajanje izloženosti je odgovarajuće (obično se postiže efekat sa tri do šest sati). Vreme izlaganja može da se produži na jedan ili više ćelijskih ciklusa.
Pri ispitivanju svake koncentracije mogu da se tretiraju jedna ili dve kulture. Kada se upotrebljava jedna kultura, potrebno je povećati broj koncentracija kako bi se obezbedio odgovarajući broj kultura za analizu (npr. najmanje osam koncentracija koje se mogu analizirati). Potrebno je upotrebiti duplikat kulture negativne kontrole (rastvarača).
Gasovite ili isparljive supstance ispituju se primenom odgovarajućih metoda, npr. u zatvorenim posudama za kulture21, 22.
1.4.3.2. Merenje preživljavanja, vijabilnosti i učestalosti mutacija
Na kraju ekspozicije ćelije se ispiraju i kultivišu kako bi se odredio nivo preživljenja i kako bi se omogućila ekspresija mutiranog fenotipa. Merenje citotoksičnosti, na osnovu utvrđivanja relativne efikasnosti kloniranja (preživljenje) ili relativnog ukupnog rasta kultura, obično se počinje nakon tretmana.
Svakom lokusu je potrebno određeno minimalno vreme za skoro optimalnu ekspresiju fenotipa novoindukovanih mutacija (HPRT i XPRT zahtevaju najmanje 6-8 dana, dok su TK-u potrebna najmanje dva dana). Ćelije se uzgajaju u podlozi sa i bez selektivnih agenasa radi utvrđivanja broja mutanata i efikasnosti kloniranja, redom. Merenje vijabilnosti (koja se koristi za izračunavanje učestalosti mutacija) započinje na kraju vremena ekspresije zasejavanjem u neselektivnu podlogu.
Ukoliko ispitivana supstanca prilikom ispitivanja L5178Y TK+/- da pozitivan rezultat, kolonije se razvrstavaju po veličini (izmeriti veličinu) kod najmanje jedne od ispitivanih kultura (najviša pozitivna koncentracija) i kod negativnih i pozitivnih kontrola. Ukoliko ispitivana supstanca prilikom ispitivanja L5178Y TK+/- da negativan rezultat, kolonije je potrebno razvrstati po veličini kod negativnih i pozitivnih kontrola. Razvrstavanje kolonija po veličini može da se obavi i kod ispitivanja u kojima se primenjuje TK6TK+/-.
2. PODACI
2.1. OBRADA REZULTATA
Podaci obuhvataju citotoksičnost i vijabilnost, broj kolonija i učestalost mutacija za tretirane i kontrolne kulture. U slučaju pozitivne reakcije u eksperimentu L5178Y TK+/-, kolonije se prebrojavaju prema kriterijumu velikih i malih kolonija kod najmanje jedne koncentracije ispitivane supstance (najviše pozitivne koncentracije) i kod negativne i pozitivne kontrole. Molekularna i citogenetska priroda velikih i malih kolonija mutanata detaljno je istražena23, 24. U eksperimentu TK+/-, kolonije se prebrojavaju prema kriterijumu kolonija normalnog rasta (velike) i kolonija usporenog rasta (male)25. Mutirane ćelije koje su pretrpele najopsežnija genetska oštećenja imaju produženo vreme udvostručavanja i zbog toga formiraju male kolonije. Opseg navedenih oštećenja obično se kreće od gubitka čitavog gena do hromozomskih aberacija koje su vidljive u kariotipu. Indukcija mutanata s malim kolonijama dovodi se u vezu sa hemikalijama koje uzrokuju velike hromozomske aberacije26. Mutirane ćelije koje su manje pogođene rastu brzinom koja je slična roditeljskim ćelijama i formiraju velike kolonije.
Navodi se i preživljavanje (relativne efikasnosti kloniranja) ili relativni ukupni rast. Učestalost mutacija se izražava u obliku broja mutiranih ćelija u odnosu na broj preživelih ćelija.
Tabelarno se navode podaci o pojedinačnim kulturama.
Ne postoji potreba za verifikovanjem jasno pozitivne reakcije. Dvosmisleni rezultati se pojašnjavaju daljim ispitivanjem, tj. najbolje modifikovanjem eksperimentalnih uslova. Negativne rezultate potrebno je potvrditi u zavisnosti od slučaja. U slučajevima u kojima se potvrda negativnih rezultata ne smatra neophodnom, potrebno je navesti obrazloženje. Za dvosmislene ili negativne rezultate kod daljih eksperimenata koji se nadovezuju na prethodne potrebno je razmotriti modifikaciju parametara ispitivanja s ciljem proširenja opsega vrednovanih uslova. Parametri ispitivanja koje je moguće modifikovati obuhvataju razmak izeđu koncentracija i uslove metaboličke aktivacije.
2.2. PROCENA I TUMAČENJE REZULTATA
Postoji nekoliko kriterijuma za utvrđivanje pozitivnog rezultata, kao što je povećanje učestalosti mutacija u zavisnosti od koncentracije ili reproducibilno. Prvenstveno je potrebno uzeti u obzir biološki značaj rezultata. Mogu da se primene statističke metode kao pomoć prilikom vrednovanja rezultata ispitivanja. Statistički značaj ne treba da bude jedini kriterijum za pozitivnu reakciju.
Ispitivana supstanca za koju rezultati ne zadovoljavaju gore navedene kriterijume smatra se nemutagenom u ovom ispitivanju. Iako većina eksperimenta daje jasno pozitivne ili negativne rezultate, u retkim slučajevima utvrđeni podaci onemogućavaju donošenje konačne odluke o delovanju ispitivane supstance. Rezultati mogu da ostanu dvosmisleni ili pod znakom pitanja, bez obzira koliko se puta eksperiment ponovi.
Pozitivni rezultati in vitro ispitivanja genskih mutacija u ćelijama sisara ukazuju na to da ispitivana supstanca uzrokuje genske mutacije u upotrebljenim kultivisanim ćelijama sisara. Od najvećeg značaja je postojanje reproducibilnog pozitivnog odgovora zavisnog od koncentracije. Negativni rezultati pokazuju da, pod eksperimentalnim uslovima, ispitivana supstanca ne uzrokuje genske mutacije u upotrebljenim kultivisanim ćelijama sisara.
3. IZVEŠTAJ
Izveštaj o ispitivanju sadrži podatke o:
1) Rastvaraču/vehikulumu:
- obrazloženje izbora rastvarača/vehikuluma;
- rastvorljivost i stabilnost ispitivane supstance u rastvaraču/vehikulumu, ukoliko su poznati.
2) Ćelijama:
- vrsta i poreklo ćelija;
- broj ćelijskih kultura;
- broj prolaza ćelija, ukoliko je primenljivo;
- metode za održavanje ćelijske kulture, ukoliko je primenljivo;
- odsustvo mikoplazme.
3) Uslovima ispitivanja:
- logička osnova za izbor koncentracija i broj kultura, uključujući, podatke o citotoksičnosti i ograničenja zbog rastvorljivosti, ukoliko postoje;
- sastav podloge, koncentracija CO2;
- koncentracija ispitivane supstance;
- zapremina vehikuluma i dodate ispitivane supstance;
- temperatura inkubacije;
- vreme inkubacije;
- trajanje tretmana;
- gustina ćelija tokom tretmana;
- tip i sastav sistema metaboličke aktivacije, uključujući kriterijume prihvatljivosti;
- pozitivne i negativne kontrole;
- dužina perioda ekspresije (uključujući broj zasejanih ćelija i supkultura i raspored prehranjivanja, ukoliko odgovara);
- selektivni agensi;
- kriterijum za smatranje ispitivanja pozitivnim, negativnim ili dvosmislenim;
- metode primenjene za prebrojavanje vijabilnih ćelija i mutiranih ćelija;
- definicija kolonija čija se veličina i vrsta uzimaju u obzir (uključujući kriterijume za "male" i "velike" kolonije, ako odgovara).
4) Rezultatima:
- znakovi toksičnosti;
- znakovi precipitacije;
- podaci o pH i osmolalnosti tokom izlaganja ispitivanoj supstanci, ukoliko su utvrđeni;
- veličina kolonija ukoliko je ista utvrđena barem za negativne i pozitivne kontrole;
- adekvatnost laboratorije da otkrije mutante malih kolonija primenom sistema L5178Y TK+/-, kada je potrebno;
- odnos doza - odgovor, gde je moguće;
- statističke analize, ukoliko postoje;
- podaci negativne (rastvarač/vehikulum) i pozitivne kontrole iz konkurentne studije;
- podaci negativne (rastvarač/vehikulum) i pozitivne kontrole iz ranije studije, sa opsezima, srednjom vrednosti i standardnom devijacijom;
- učestalost mutanata.
5) Obrazloženju rezultata.
6) Zaključcima.
4. LITERATURA
1. Moore, M.M., DeMarini, D.M., DeSerres, F.J. and Tindall, K.R. (Eds.) (1987). Banbury Report 28: Mammalian Cell Mutagenesis, CoLD Spring Harbor Laboratory, New York.
2. Chu, E.H.Y. and Malling, H.V. (1968). Mammalian Cell Genetics. II. Chemical Induction of Specific Locus Mutations in Chinese Hamster Cells In vitro, Proc. Natl. Acad. Sci., USA, 61, 1306-1312.
3. Liber, H.L. and Thilly, W.G. (1982). Mutation Assay at the Thymidine Kinase Locus in Diploid Human Lymphoblasts. Mutation Res., 94, 467-485.
4. Moore, M.M., Harington-Brock, K., Doerr, C.L. and DearfieLD, K.L. (1989). Differential Mutant Quantitation at the Mouse Lymphoma TK and CHO HGPRT Loci. Mutagenesis, 4, 394-403.
5. Aaron, C.S. and Stankowski, Jr.L.F. (1989). Comparison of the AS52/XPRT and the CHO/HPRT Assays: Evaluation of Six Drug Candidates. Mutation Res., 223, 121-128.
6. Aaron, C.S., BolcsfoLDi, G.,Glatt, H.R., Moore, M., Nishi, Y., Stankowski, Jr.L.F., Theiss, J. And Thompson, E. (1994). Mammalian Cell Gene Mutation Assays Working Group Report. Report of the International Workshop on Standardisation of Genotoxicity Test Procedures. Mutation Res., 312, 235-239.
7. Scott, D., Galloway, S.M., Marshall, R.R., Ishidate, M., Brusick, D., Ashby, J. and Myhr, B.C. (1991). Genotoxicfity Under Extreme Culture Conditions. A report from ICPEMC Task Group 9. Mutation Res., 257, 147-204.
8. Clive, D., McCuen, R., Spestor, J.F.S., Piper, C. and Mavournin, K.H. (1983). Specific Gene Mutations in L5178Y Cells in Culture. A Report of the U.S. Environmental Protection Agency Gene-Tox Program. Mutation Res., 115, 225-251.
9. Li, A.P., Gupta, R.S., Heflich, R.H. and Wasson, J.S. (1988). A Review and Analysis of the Chinese Hamster Ovary/Hypoxanthine Guanine Phosphoribosyl Transferase System to Determine the Mutagenicity of Chemical Agents: A Report of Phase III of the U.S. Environmental Protection Agency Gene-Tox Program. Mutation Res., 196, 17-36.
10. Li, A.P., Carver, J.H., Choy, W.N., Hsie, A.W., Gupta, R.S., Loveday, K.S., O’Neill, J.P., Riddle, J.C., Stankowski, L.F. Jr. and Yang, L.L. (1987). A Guide for the Performance of the Chinese Hamster Ovary Cell/Hypoxanthine-Guanine Phosphoribosyl Transferase Gene Mutation Assay. Mutation Res., 189, 135-141.
11. Liber, H.L., Yandell, D.W and Little, J.B. (1989). A Comparison of Mutation Induction at the TK and HPRT Loci in Human Lymphoblastoid Cells: Quantitative Differences are Due to an Additional Class of Mutations at the Autosomal TK Locus. Mutation Res., 216, 9-17.
12. Stankowski, L.F. Jr., Tindall, K.R. and Hsie, A.W. (1986). Quantitative and Molecular Analyses of Ethyl Methanosulphonate -and ICR 191- Induced Molecular Analyses of Ethyl Methanosulphonate -and ICR 191- Induced Mutation in AS52 Cells. Mutation Res., 160, 133-147.
13. Turner, N.T., Batson, A.G. and Clive, D. (1984). Procedures for the L5178Y/TK+/- -TK+/- Mouse Lymphoma Cell Mutagenicity Assay. In: Kilbey, B.J. et al (eds.) Handbook of Mutagenisity Test Procedures, Elsevier Science Publishers, New York, pp. 239-268.
14. Arlett, C.F., Smith, D.M., Clarke, G.M., Green, M.H.L., Cole, J., McGregor, D.B. and Asquith, J.C. (1989). Mammalian Cell Gene Mutation Assays Based upon Colony Formation. In: Statistical Evaluation of Mutagenicity Test Data, Kirkland, D.J., Ed., Cambridge University Press, pp. 66-101.
15. Abbondandolo, A., Bonatti, S., Corti, G., Fiorio, R., Loprieno, N. and Mazzaccaro, A. (1977). Induction of 6-Thioguanine-Resistant Mutants in V79 Chinese Hamster Cells by Mouse-Liver Microsome-Activated Dimethylnitrosamine. Mutation Res., 46, 365-373.
16. Ames, B.N., McCann, J. and Yamasaki, E. (1975). Methods for Detecting Carcinogens and Mutagens with the Salmonella/Mammalian-Microsome Mutagenicity Test. Mutation Res., 31, 347-364.
17. Clive, D., Johnson, K.O., Spector, J.F.S., Batson, A.G. and Brown M.M.M. (1979). Validation and Characterization of the L5178Y/TK+/- Mouse Lymphoma Mutagen Assay System. Mutat. Res., 59, 61-108.
18. Maron, D.M. and Ames, B.N. (1983). Revised Methods for the Salmonella Mutagenicity Test. Mutation Res., 113, 173-215.
19. Elliott, B.M., Combes, R.D., Elcombe, C.R., Gatehouse, D.G., Gibson, G.G., Mackay, J.M. and Wolf, R.C. (1992). Alternatives to Aroclor 1254-Induced S9 in In vitro Genotoxicity Assays. Mutagenesis, 7, 175-177.
20. Matsushima, T., Sawamura, M., Hara, K. and Sugimura, T. (1976). A Safe Substitute for Polychlorinated Biphenyls as an Inducer of Metabolic Activation Systems. In: In vitro Metabolic Activation in Mutagenesis Testing, de Serres, F.J., Fouts, J.R., Bend, J.R. and Philpot, R.M. (eds), Elsevier, North-Holland, pp. 85-88.
21. Krahn, D.F., Barsky, F.C. and McCooey, K.T. (1982). CHO/HGPRT Mutation Assay: Evaluation of Gases and Volatile Liquids. In: Tice, R.R., Costa, D.L., Schaich, K.M. (eds). Genotoxic Effects of Airborne Agents. New York, Plenum, pp. 91-103.
22. Zamora, P.O., Benson, J.M., Li, A.P. and Brooks, A.L. (1983). Evaluation of an Exposure System Using Cells Grown on Collagen Gels for Detecting Highly Volatile Mutagens in the CHO/HGPRT Mutation Assay. Environmental Mutagenesis, 5, 795-801.
23. Applegate, M.L., Moore, M.M., Broder, C.B., Burrell, A. and Hozier, J.C. (1990). Molecular Dissection of Mutations at the Heterozygous Thymidine Kinase Locus in Mouse Lymphoma Cells. Proc. Natl. Acad. Sci. USA, 87, 51-55.
24. Moore, M.M., Clive, D., Hozier, J.C., Howard, B.E., Batson, A.G., Turner, N.T. and Sawyer, J. (1985). Analysis of Trifluorothymidine-Resistant (TFTr) Mutants of L5178Y/TK+/- Mouse Lymphoma Cells. Mutation Res., 151, 161-174.
25. Yandell, D.W., Dryja, T.P. and Little, J.B. (1990). Molecular Genetic Analysis of Recessive Mutations at a Heterozygous Autosomal Locus in Human Cells. Mutation Res., 229, 89-102.
26. Moore, M.M. and Doerr, C.L. (1990). Comparison of Chromosome Aberration Frequency and Small- Colony TK-Deficient Mutant Frequency in L5178Y/TK+/- -3.7.2C Mouse Lymphoma Cells. Mutagenesis, 5, 609-614.
B.18. OŠTEĆENJE I REPARACIJA DNK - VANREDNA SINTEZA DNK - ĆELIJE SISARA IN VITRO
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod.
1.2. DEFINICIJE
Videti Opšti uvod.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Ispitivanje vanredne sinteze DNK (u daljem tekstu: UDS) meri sintezu DNK za reparaciju nakon isecanja i otklanjanja odsečka DNK koji sadrži region oštećenja koji je izazvan hemijskim i fizičkim agensima. Ispitivanje se zasniva na ugrađivanju timidina obeleženog tricijumom (u daljem tekstu: 3H-TdR) u DNK ćelije sisara koje se ne nalaze u S fazi ćelijskog ciklusa. Aktivno preuzimanje 3H-TdR može da se odredi autoradiografijom ili tečnim scintilacionim brojanjem (u daljem tekstu: LSC) DNK iz tretiranih ćelija. Ćelije sisara u kulturi, osim ukoliko se ne koriste primarni hepatociti pacova, tretiraju se ispitivanim agensom sa i bez egzogenog sistema metaboličke aktivacije. UDS može da se meri i u in vivo sistemima.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE
1.6.1. Preparati
Ispitivane hemikalije i kontrolne ili referentne supstance pripremaju se u podlozi za rast ili se rastvaraju ili suspenduju u odgovarajućim vehikulumima i zatim se dodatno razblažuju u podlozi za rast za upotrebu u eksperimentu. Konačna koncentracija vehikuluma ne sme da utiče na vijabilitet ćelija.
U eseju mogu da se koriste primarne kulture hepatocita pacova, ljudskih limfocita ili utvrđenih ćelijskih linija (npr. ljudski diploidni fibroblasti).
Ćelije se izlažu ispitivanoj hemikaliji i u prisustvu i u odsustvu odgovarajućeg sistema metaboličke aktivacije.
1.6.2. Uslovi ispitivanja
1.6.2.1. Broj kultura
Potrebno je najmanje dve kulture ćelija za autoradiografiju i šest kultura (ili manje ukoliko je to naučno opravdano) za određivanje LSC UDS za svaku eksperimentalnu tačku.
1.6.2.2. Upotreba negativnih i pozitivnih kontrola
U svako ispitivanje se uključuju istovremene pozitivne i negativne (netretirane i/ili vehikulum) kontrole, sa i bez metaboličke aktivacije.
Primeri pozitivnih kontrola za eksperiment sa hepatocitima pacova obuhvataju 7,12-dimetil benzantracen (7,12-DMBA) ili 2-acetil aminofluoren (2-AAF). U slučaju utvrđenih ćelijskih linija, 4-nitrokvinolin-N-oksid (4-NQO) predstavlja primer pozitivne kontrole i za autoradiografske i za LSC eseje koji se izvode bez metaboličke aktivacije. N-dimetil nitrozamin je primer jedinjenja pozitivne kontrole kada se koriste sistemi metaboličke aktivacije.
1.6.2.3. Koncentracije izlaganja
Primenjuju se višestruke koncentracije ispitivane supstance u rasponu koji odgovara za definisanje odgovora. Najviša koncentracija izaziva određene citotoksične efekte. Jedinjenja koji su relativno nerastvorna u vodi ispituju se do granice rastvorljivosti. U slučaju hemikalija koje su netoksične i dobro rastvorne u vodi, gornja ispitivana koncentracija hemikalije utvrđuje se u zavisnosti od slučaja.
1.6.2.4. Ćelije
Prilikom održavanja kultura potrebno je primeniti odgovarajući podlogu za rast, koncentraciju CO2, temperaturu i vlažnost. Utvrđene ćelijske linije periodično se proveravaju na kontaminaciju mikoplazmom.
1.6.2.5. Metabolička aktivacija
Sistem metaboličke aktivacije ne koristi se sa primarnim kulturama hepatocita. Određene ćelijske linije i limfociti izlažu se ispitivanoj supstanci i u prisustvu i u odsustvu odgovarajućeg sistema metaboličke aktivacije.
1.6.3. Postupak
1.6.3.1. Priprema kultura
Utvrđene ćelijske linije dobijaju se iz "stock", kultura (npr. tripsinizacijom ili otresanjem), zasađuju se u posude za kultivisanje pri odgovarajućoj gustini i inkubiraju na temperaturi od 37° C.
Kratkotrajne kulture hepatocita pacova utvrđuju se omogućavanjem sveže izdvojenim hepatocitima da se u odgovarajućoj podlozi pričvrste za površinu za rast.
Kulture ljudskih limfocita uspostavljaju se korišćenjem odgovarajućih metoda.
1.6.3.2. Tretiranje kultura ispitivanom supstancom
1.6.3.2.1. Primarni hepatociti pacova
Sveže izolovani hepatociti pacova tretiraju se ispitivanom supstancom u podlozi koja sadrži 3H-TdR tokom odgovarajućeg vremenskog perioda. Na kraju perioda tretiranja, podloga se odstranjuje sa ćelija, koje se nakon toga ispiraju, fiksiraju i suše. Slajdovi se zatim umoče u autoradiografsku emulziju (može se koristiti alternativni tanki film), izlože, razviju, oboje i prebroje.
1.6.3.2.2. Utvrđene ćelijske linije i limfociti
Autoradiografske tehnike: ćelijske kulture se izlažu ispitivanoj supstanci tokom odgovarajućih vremenskih perioda, nakon čega se tretiraju sa 3H-TdR. Vremenski periodi se određuju u skladu sa prirodom supstance, aktivnosti metaboličkih sistema i vrstom ćelija. Kako bi se otkrio maksimum UDS-a, potrebno je dodati 3H-TdR, istovremeno s ispitivanom supstancom ili tokom nekoliko minuta nakon izlaganja ispitivanoj supstanci. Na izbor jednog od ova dva postupka utiču moguće interakcije ispitivane supstance i 3H-TdR. Kako bi se napravila razlika između UDS i semi-konzervativne replikacije DNK, ova druga se može sprečiti, npr. primenom podloge bez arginina, niskog sadržaja seruma ili hidroksiureom u podlozi za kultivisanje.
LSC merenja UDS-a: pre tretiranja ispitivanom supstancom potrebno je blokirati ulazak ćelija u S-fazu na način kako je gore opisano. Ćelije se zatim izlažu ispitivanoj hemikaliji na način kako je opisano za autoradiografiju. Na kraju perioda inkubacije, DNK se ekstrahuje iz ćelija i određuje se ukupni sadržaj DNK i stepen inkorporacije 3H-TdR.
U slučajevima kada se koriste ljudski limfociti u gore navedenim tehnikama, kod nestimulisanih kultura nije potrebna supresija semi-konzervativne replikacije DNK.
1.6.3.3. Analize
1.6.3.3.1. Autoradiografska određivanja
Prilikom određivanja UDS-a u ćelijama u kulturi ne prebrojavaju se jedra u S-fazi. Potrebno je prebrojati najmanje 50 ćelija po koncentraciji. Slajdovi se pre prebrojavanja šifruju. Na svakom slajdu se prebroji nekoliko široko razdvojenih nasumičnih polja. Količina inkorporacije 3H-TdR u citoplazmi određuje se prebrojavanjem tri područja veličine nukleusa u citoplazmi svake prebrojane ćelije.
1.6.3.3.2. LSC određivanja
Za LSC UDS određivanja, za svaku koncentraciju, primenjuje se odgovarajući broj kultura, kao i za kontrolu.
Svi rezultati se potvrđuju u nezavisnom eksperimentu.
2. PODACI
Podaci se navode tabelarno.
2.1. AUTORADIOGRAFSKA ODREĐIVANJA
Stepen inkorporacije 3H-TdR u citoplazmi i broj zrna pronađenih u jedru ćelije odvojeno se navode.
Za opisivanje raspodele stepena inkorporacije 3H-TdR u citoplazmi i broja zrna po nukleusu mogu da se koriste srednje vrednosti, medijana i modus.
2.2. LSC ODREĐIVANJA
Za određivanja koja se odnose na LSC, inkorporaciju 3H-TdR potrebno je izraziti kao dpm/μg DNK. Može se primeniti srednja vrednost dpm/μg DNK sa standardnom devijacijom, a kako bi se opisala raspodela inkorporacije. Podaci se procenjuju odgovarajućim statističkim metodama.
3. IZVEŠTAJ
3.1. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju, ukoliko je moguće, sadrži podatke o:
- upotrebljenim ćelijama, gustini i broju prolaza u vreme tretiranja, broju kultura ćelija;
- metodi primenjenoj u održavanju ćelijskih kultura, uključujući podlogu, temperaturu i koncentraciju CO2;
- ispitivanoj supstanci, vehikulumu, koncentraciji i logičkoj osnovi za izbor koncentracija primenjenih u ispitivanju;
- detaljima o sistemima metaboličke aktivacije;
- rasporedu tretmana;
- pozitivnim i negativnim kontrolama;
- primenjenoj autoradiografskoj tehnici;
- postupcima korišćenim za blokiranje ulaska ćelija u S-fazu;
- postupcima korišćenim za ekstrakciju DNK i utvrđivanje ukupnog sadržaja DNK u LSC određivanju;
- odnosu doza/odgovor, kada je moguće;
- statističkoj proceni;
- obrazloženju rezultata;
- tumačenju rezultata.
3.2. PROCENA I TUMAČENJE REZULTATA
Videti Opšti uvod.
4. LITERATURA
Videti Opšti uvod.
B.19. IN VITRO ISPITIVANJE IZMENE SESTRINSKIH HROMATIDA
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod.
1.2. DEFINICIJE
Videti Opšti uvod.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Ispitivanje izmene sestrinskih hromatida (u daljem tekstu: SCE) jeste kratkotrajno ispitivanje namenjeno otkrivanju međusobnih izmena DNK dve sestrinske hromatide hromozoma koji se udvostručava. SCE predstavlja izmenu proizvoda replikacije DNK na naizgled homologim mestima. Postupak razmene verovatno obuhvata prekidanje i ponovno sjedinjavanje DNK, iako se malo zna o njegovoj molekulskoj osnovi. Detekcija SCE-a zahteva ulaganje određenog napora u diferencijalno obeležavanje sestrinskih hromatida, što se može postići inkorporacijom bromdeoksiuridina (u daljem tekstu: BrdU) u hromozomsku DNK kroz dva ćelijska ciklusa.
Ćelije sisara in vitro izlažu se ispitivanoj hemikaliji sa i bez sisarskog egzogenog sistema metaboličke aktivacije, ukoliko je svrsishodno i kultivišu se tokom dva kruga replikacije u medijumu koji sadrži BrdU. Posle obrade inhibitorom deobnog vretena (npr. kolhicinom) da bi se akumulirale ćelije u stadijumu mitoze koji je sličan metafazi (c-metafaza) ćelije se skupljaju i pripremaju se hromozomski preparati.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE
1.6.1. Preparati
U ispitivanju mogu da se koriste primarne kulture (ljudski limfociti) ili određene ćelijske linije (npr. ćelije ovarijuma kineskog hrčka). Ćelijske linije se proveravaju na kontaminaciju mikoplazmom,
Neophodno je da se primeni odgovarajući medijum za kulture i uslovi inkubacije (npr. temperatura, posude za kulture, koncentracija CO2 i vlažnost).
Ispitivane supstance mogu da se pripreme u medijumu kulture ili da se rastvore ili suspenduju u odgovarajućim vehikulumima pre tretiranja ćelija. Konačna koncentracija vehikuluma u sistemu kulture ne sme u znatnoj meri da utiče na vijabilitet ćelija ili stepen rasta. Uticaj na učestalost SCE-a se prati putem kontrole rastvarača.
Ćelije se izlažu ispitivanoj supstanci u prisustvu i u odsustvu sisarskog egzogenog sistema metaboličke aktivacije. Alternativno, u slučajevima kada se koriste tipovi ćelija s intrinzičnom metaboličkom aktivnošću, obim i priroda aktivnosti odgovaraju klasi hemikalije koja se ispituje.
1.6.2. Uslovi ispitivanja
1.6.2.1. Broj kultura
Za svaku tačku ispitivanja primenjuje se najmanje dve kulture.
1.6.2.2. Primena pozitivnih i negativnih kontrola
U svaki eksperiment se uključuju pozitivne kontrole i to primenom jedinjenja direktnog dejstva, kao i jedinjenja koje zahteva metaboličku aktivaciju. Potrebna je i primena kontrole vehikuluma.
Supstance koje se mogu primeniti kao pozitivne kontrole:
- jedinjenje direktnog delovanja;
- etil-metansulfonat;
- jedinjenje indirektnog delovanja;
- ciklofosfamid.
Kada je primereno, u ispitivanje može da se uključi dodatna pozitivna kontrola iste hemijske klase kojoj pripada i hemikalija koja se ispituje.
1.6.2.3. Koncentracije izlaganja
Potrebno je da se primeni najmanje tri odgovarajuće raspoređene koncentracije ispitivane supstance. Najviša koncentracija izaziva značajan toksični efekt, ali pri tome omogućava odgovarajuću replikaciju ćelija. Supstance koje su relativno nerastvorljive u vodi ispituju se do granice rastvorljivosti uz primenu odgovarajućih postupaka. U slučaju supstanci koje su slobodno rastvorljive u vodi i nisu toksične, gornja koncentracija ispitivane supstance utvrđuje se od slučaja do slučaja.
1.6.3. Postupak
1.6.3.1. Priprema kultura
Utvrđene ćelijske linije dobijaju se iz postojećih ("stock") kultura (npr. tripsinizacijom ili otresanjem), zasejavaju se u posude za kulture na odgovarajućoj gustini i inkubiraju na temperaturi od 37° C. Za jednoslojne kulture potrebno je prilagoditi broj ćelija po posudi, tako da kulture u vreme skupljanja ne budu konfluentne mnogo više od 50%. Alternativno, mogu da se primene ćelije u kulturi u obliku suspenzije. Kulture ljudskih limfocita dobijaju se iz heparinizirane krvi odgovarajućim tehnikama i inkubiraju se na temperaturi od 37° C.
1.6.3.2. Tretiranje
Ćelije koje se nalaze u eksponencijalnom stadijumu rasta izlažu se ispitivanoj supstanci u odgovarajućem vremenskom periodu. U većini slučajeva jedan do dva sata može da bude delotvorno, ali je u određenim situacijama moguće produžiti vreme tretiranja do dva cela ćelijska ciklusa. Ćelije bez dovoljne intrinzične (sopstvene) metaboličke aktivnosti izlažu se ispitivanoj hemikaliji u prisustvu i odsustvu odgovarajućeg sistema metaboličke aktivacije. Po završetku perioda izlaganja sa ćelija se ispiraju ostaci ispitivane supstance pa se iste kultivišu tokom dva kruga replikacije u prisustvu BrdU. Kao alternativa može se primeniti postupak tokom kog se ćelije istovremeno izlažu ispitivanoj hemikaliji i BrdU tokom čitavog vremena kultivisanja od dva ćelijska ciklusa.
Kulture ljudskih limfocita tretiraju se dok se nalaze u polusinhronom stanju.
Analiza ćelija obavlja se tokom njihove druge deobe posle tretmana, kako bi se obezbedilo da najosetljiviji stadijumi ćelijskog ciklusa budu izloženi hemikaliji. Sa svim kulturama kojima se dodaje BrdU rukuje se u mraku ili uz prigušenu svetlost inkandescentnih lampi, sve do skupljanja ćelija, kako bi se fotoliza DNK koji sadrži BrdU svela na najmanju meru.
1.6.3.3. Skupljanje ćelija
Ćelijske kulture tretiraju se inhibitorom deobnog vretena (npr. kolhicinom) jedan do četiri sata pre skupljanja. Ćelije svake kulture ubiraju se i obrađuju odvojeno za preparate hromozoma.
1.6.3.4. Preparati i bojenje hromozoma
Hromozomski preparati pripremaju se primenom standardnih citogenetskih tehnika. Bojenje slajdova, kako bi se prikazali SCE, može da se izvede pomoću nekoliko tehnika (npr. fluorescencija plus Giemsa metoda).
1.6.4. Analiza
Broj analiziranih ćelija zasniva se na spontanoj kontrolnoj učestalosti SCE. Obično se za SCE analizira najmanje 25 dobro rasprostranjenih metafaza po kulturi. Slajdovi se pre analize šifriraju. Kod ljudskih limfocita analiziraju se samo metafaze koje sadrže 46 centromera. Kod utvrđenih ćelijskih linija analiziraju se samo metafaze koje sadrže ± 2 centromere modalnog broja. Navodi se da li se centromerna zamena oznake vrednuje kao SCE. Rezultati se potvrđuju u nezavisnom ispitivanju.
2. PODACI
Podaci se navode tabelarno. Broj SCE za svaku metafazu i broj SCE po hromozomu za svaku metafazu navode se odvojeno za sve tretirane i kontrolne kulture.
Podaci se procenjuju korišćenjem odgovarajućih statističkih metoda.
3. IZVEŠTAJ
3.1. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju, ukoliko je moguće, sadrži podatke o:
- upotrebljenim ćelijama, metodama održavanja ćelijske kulture;
- uslovima ispitivanja: sastav medijuma, koncentracija CO2, koncentracija ispitivane supstance, korišćeni vehikulum, temperatura inkubacije, vreme tretiranja, korišćeni inhibitor deobnog vretena, njegova koncentracija i trajanje tretmana istim, vrsta korišćenog sisarskog sistema aktivacije, pozitivne i negativne kontrole;
- broju ćelijskih kultura po tački ispitivanja;
- detaljima tehnike korišćene za pripremu slajdova;
- broju analiziranih metafaza (podaci se navode odvojeno za svaku kulturu);
- prosečnom broju SCE po ćeliji i po hromozomu (podaci se navode odvojeno za svaku kulturu);
- kriterijumima za vrednovanje SCE;
- logičkoj osnovi za izbor doze;
- odnosu doza/odgovor, ako je primenljivo;
- statističkoj proceni;
- obrazloženju rezultata;
- tumačenju rezultata.
3.2. PROCENA I TUMAČENJE REZULTATA
Videti Opšti uvod.
4. LITERATURA
Videti Opšti uvod.
B.20. ISPITIVANJE RECESIVNE LETALNOSTI VEZANE ZA POL NA DROSOPHILA-e MELANOGASTER
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod.
1.2. DEFINICIJE
Videti Opšti uvod.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Ispitivanjem recesivne letalnosti vezane za pol (u daljem tekstu: SLRL) kod Drosophila-e melanogaster otkriva se pojava mutacija, uključujući i tačkaste mutacije i male delecije, u zametnoj lozi insekta. Navedeno ispitivanje je analiza napredne mutacije, koja je sposobna za skrining mutacija na oko 800 lokusa (genskih mesta) na hromozomu X; što čini oko 80% svih lokusa hromozoma X. Hromozom X predstavlja približno jednu petinu čitavog haploidnog genoma.
Mutacije u hromozomu X Drosophila-e melanogaster fenotipski su izražene kod mužjaka koji nose mutirani gen. Kad je mutacija letalna u hemizigotnim uslovima, o njenom postojanju se zaključuje na osnovu izostanka jedne kategorije muških potomaka od dve kategorije koje normalno iznese heterozigotna ženka. SLRL ispitivanje koristi navedene činjenice pomoću posebno označenih i raspoređenih hromozoma.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE
1.6.1. Pripreme
1.6.1.1. Kulture soja
Mogu se primeniti mužjaci kvalitetno definisane kulture soja divljeg tipa i ženki kulture soja Myller-5. Mogu se upotrebiti i ostale, dobro označene, ženske kulture soja s višestrukim invertiranim hromozomima X.
1.6.1.2. Ispitivana supstanca
Ispitivane supstance se rastvaraju u vodi. Supstance koje su nerastvorljive u vodi mogu da se rastvore ili suspenduju u odgovarajućem vehikulumu (npr. smeši etanola i Tween-a 60 ili 80), a zatim pre primene da se razblaže u vodi ili rastvoru soli. Dimetilsulfoksid (u daljem tekstu: DMSO) se izbegava kao medijum.
1.6.1.3. Broj životinja
Ispitivanje je osmišljeno tako da ima unapred određenu osetljivost i snagu. Učestalost spontanih mutacija, koja bude primećena u odgovarajućem kontrolnom uzorku, u značajnoj meri utiče na broj tretiranih hromozoma koji se analiziraju.
1.6.1.4. Put primene
Izlaganje može biti: oralnim putem, putem injekcije ili izlaganje gasovima ili parama. Ispitivana supstanca može se dati i u rastvoru šećera. Kada je neophodno, materija može da se rastvori u 0,7% rastvoru NaCl i da se ubrizga u grudni koš ili abdomen.
1.6.1.5. Primena pozitivnih i negativnih kontrola
Neophodno je uključiti negativne (vehikulum) i pozitivne kontrole. Ukoliko postoje odgovarajući laboratorijski podaci iz prethodnih ispitivanja, nisu potrebne istovremene kontrole.
1.6.1.6. Nivoi izlaganja
Primenjuju se tri nivoa izlaganja. Za preliminarnu procenu može da se primeni jedan nivo izlaganja ispitivanoj supstanci, s tim da navedeni nivo izlaganja treba da bude ili maksimalna tolerisana koncentracija ili ona koncentracija pri kojoj nastaju neki znaci toksičnosti. Za netoksične materije potrebno je izlaganje maksimalno mogućoj koncentraciji.
1.6.2. Postupak
Mužjaci divljeg tipa (stari tri do pet dana) tretiraju se ispitivanom supstancom i pojedinačno pare s velikim brojem nevinih ženki kulture soja Myller-5 ili druge kulture soja, označenim (višestrukim invertiranim hromozomima X) na odgovarajući način. Ženke se zamenjuju novim nevinim ženkama svaka dva do tri dana kako bi se obuhvatio čitav ciklus polne ćelije. Potomci navedenih ženki proveravaju se na postojanje letalnih efekta koji odgovaraju efektima na zrelom spermatozoidu, spermatidima u srednjoj ili kasnoj fazi, spermatidima u ranoj fazi, spermatocitima i spermatogonijima u vreme tretiranja ispitivanom supstancom.
Heterozigotnim F1 ženkama, dobijenima navedenim ukrštanjem, dopušteno je da se pojedinačno pare (tj. jedna ženka po bočici) sa svojom braćom. U F2 generaciji svaka se kultura proverava na odsustvo mužjaka divljeg tipa. Ukoliko se dogodi da kultura potiče od F1 ženke koja je nosilac smrtnosti u roditeljskom hromozomu X (tj. nije primećen nijedan mužjak s tretiranim hromozomom), kćeri ženke s istim genotipom obavezno se ispituju kako bi se utvrdilo da li se smrtnost ponavlja u narednoj generaciji.
2. PODACI
Podaci se navode u tabelarnom obliku kako bi se prikazao broj ispitanih hromozoma X, broj neplodnih mužjaka i broj letalnih hromozoma pri svakoj koncentraciji izlaganja i za svaki period parenja za svakog tretiranog mužjaka. Neophodno je navesti i brojeve grupa (klastera) različitih veličina po svakom mužjaku. Potrebno je da se dobijeni rezultati potvrde u posebnom ispitivanju.
Prilikom procene ispitivanja recesivne letalnosti vezane za pol primenjuju se odgovarajuće statističke metode. Grupisanje recesivnih smrtnih ishoda koji potiču od jednoga mužjaka razmatra se i procenjuje odgovarajućom statističkom metodom.