3. IZVEŠTAJ
3.1. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju, ukoliko je moguće, sadrži podatke o:
- kulturi soja: korišćene kulture soja ili sojevi Drosophila-e, starost insekata, broj tretiranih mužjaka, broj sterilnih mužjaka, broj utvrđenih F2 kultura, broj F2 kultura bez potomstva, broj hromozoma nosilaca letala koji su primećeni pri svakome stadijumu polne ćelije;
- kriterijumima za utvrđivanje veličine tretiranih grupa;
- uslovima ispitivanja, detaljan opis plana tretiranja i uzorkovanja, nivoe izlaganja, podatke o toksičnosti, negativne (rastvarač) i pozitivne kontrole, zavisno od konkretnog slučaja;
- kriterijumima za beleženje letalnih mutacija;
- odnosu izloženost/efekat, gde je moguće;
- proceni podataka;
- obrazloženju rezultata;
- tumačenju rezultata.
3.2. PROCENA I TUMAČENJE REZULTATA
Videti Opšti uvod.
4. LITERATURA
Videti Opšti uvod.
B.21. IN VITRO ISPITIVANJA TRANSFORMACIJE ĆELIJA SISARA
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod.
1.2. DEFINICIJE
Videti Opšti uvod.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Kulture ćelija sisara mogu da se koriste za otkrivanje fenotipskih promena in vitro izazvanih hemijskim supstancama koje su povezane s malignom transformacijom in vivo. Među ćelije koje se najviše primenjuju spadaju: C3H10T1/2, 3T3, SHE i ćelije pacova Fischer soja, dok se ispitivanja oslanjaju na promene u morfologiji ćelije, formiranju fokusa ili promene u zavisnosti od pričvršćivanja u polučvrstom agaru. Postoje i kulture ćelija koje se ređe koriste, a koje otkrivaju druge fiziološke ili morfološke promene u ćelijama posle izlaganja karcinogenim hemikalijama. Nijedna od in vitro krajnjih tačaka ispitivanja nema utvrđenu mehanističku vezu s rakom. Neke od kultura ćelija mogu da detektuju promotore tumora. Citotoksičnost može da se utvrdi merenjem efekta ispitivanog materijala na sposobnosti formiranja kolonija (efikasnost kloniranja) ili stepene rasta kultura. Merenje citotoksičnosti služi da se utvrdi da je izlaganje ispitivanoj hemikaliji bilo toksikološki relevantno, ali ne može da se upotrebi za izračunavanje transformacije: učestalosti kod svih analiza s obzirom da neke od njih mogu da uključuju produženu inkubaciju i/ili subkultivisanje.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE
1.6.1. Pripreme
1.6.1.1. Ćelije
U zavisnosti od vrste ispitivanja transformacije koja se koristi, dostupne su različite ćelijske linije ili primarne ćelije. Ispitivač se stara da se kod ćelija koje se koriste u ispitivanju posle izlaganja poznatim karcinogenima pokaže odgovarajuća promena u fenotipu, kao i da se pobrine za to da je ispitivanje, u laboratoriji ispitivača, dokazanog i dokumentovanog kvaliteta i pouzdanosti.
1.6.1.2. Medijum
Neophodno je da se koristi medijum i eksperimentalni uslovi koji odgovaraju obliku ispitivanja transformacije koji se koristi.
1.6.1.3. Ispitivana supstanca
Ispitivane supstance mogu da se pripreme u medijumu kulture ili da se rastvore ili suspenduju u odgovarajućim vehikulumima pre tretiranja ćelija. Konačna koncentracija vehikuluma u sistemu kulture ne sme da utiče na vijabilitet ćelija, stepen rasta ili učestalost transformacija.
1.6.1.4. Metabolička aktivacija
Ćelije se izlažu ispitivanoj supstanci u prisustvu i u odsustvu odgovarajućeg sistema metaboličke aktivacije. Alternativno, kada se koriste tipovi ćelija sa intrinzičnom (sopstvenom) metaboličkom aktivnošću, priroda aktivnosti odgovara kategoriji (klasi) hemikalije koja se ispituje.
1.6.2. Uslovi ispitivanja
1.6.2.1. Primena pozitivnih i negativnih kontrola
U svako ispitivanje se uključuju pozitivne kontrole i to primenom jedinjenja direktnog delovanja, kao i jedinjenja koje zahteva metaboličku aktivaciju. Neophodno je primeniti i negativne kontrole (vehikuluma).
Supstance koje se mogu primeniti kao pozitivne kontrole su:
a) Hemikalije direktnog delovanja:
- etil metansulfonat;
- b propiolakton.
b) Jedinjenja koji zahtevaju metaboličku aktivaciju:
- 2- acetil aminofluoren;
- 4-dimetilaminoazobenze;,
- 7,12-dimetilbenz[a]antracen.
Kad je primereno, u ispitivanje se uključuje dodatna pozitivna kontrola iste hemijske kategorije kojoj pripada i jedinjenje koji se ispituje.
1.6.2.2. Koncentracije izlaganja
Neophodno je da se primeni nekoliko koncentracija ispitivane supstance. Navedene koncentracije treba da izazovu toksične efekte zavisne od koncentracije, pri čemu najviša koncentracija uzrokuje nizak stepen preživljenja, dok je preživljenje kod najniže koncentracije slično onome kod negativne kontrole. Supstance koje su relativno nerastvorljive u vodi ispituju se do granice rastvorljivosti, uz primenu odgovarajućih postupaka. U slučaju supstanci koje su netoksične i dobro rastvorljive u vodi, gornja koncentracija ispitivane supstance utvrđuje se posebno za svaki pojedinačni slučaj.
1.6.3. Postupak
Ćelije se izlažu ispitivanoj supstanci tokom odgovarajućeg vremenskog perioda, u zavisnosti od sistema koji se koristi u ispitivanju. U slučaju produženog izlaganja, može se uključiti ponovljeno doziranje praćeno promenom medijuma (i ukoliko je potrebno, svežom smešom za metaboličku aktivaciju). Ćelije bez dovoljne intrinzične (sopstvene) metaboličke aktivnosti izlažu se ispitivanoj supstanci u prisustvu i odsustvu odgovarajućeg sistema metaboličke aktivacije. Po završetku perioda izlaganja sa ćelija se ispiraju ostaci ispitivane supstance i iste ćelije se kultivišu pod uslovima koji su primereni za pojavu transformisanog fenotipa koji se posmatra, a posle čega se utvrđuje incidenca transformacije. Svi rezultati potvrđuju se u okviru nezavisnog ispitivanja.
2. PODACI
Podaci se navode tabelarno i mogu biti različito formulisani zavisno od oblika ispitivanja koji se koristi, na primer: broj podloga, pozitivne podloge ili broj transformisanih ćelija. Kad odgovara, stepen preživljavanja se izražava u obliku procenta od kontrolnih nivoa. Učestalost transformacija izražava se kao broj transformanata prema broju preživelih. Podaci se procenjuju primenom odgovarajućih statističkih metoda.
3. IZVEŠTAJ
3.1. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju, ukoliko je moguće, sadrži podatke o:
- korišćenom tipu ćelija, broju ćelijskih kultura, metodama održavanja ćelijskih kultura;
- uslovima ispitivanja: koncentracija ispitivane supstance, korišćeni medijum, vreme inkubacije, trajanje i učestalost tretiranja, gustina ćelija tokom tretmana, vrsta korišćenog egzogenog sistema metaboličke aktivacije, pozitivne i negativne kontrole, detaljan opis fenotipa koji se posmatra, korišćeni selektivni sistem (zavisno od slučaja), logička osnova za izbor doze;
- metodi korišćenoj za prebrojavanje vijabilnih i transformisanih ćelija;
- statističkoj proceni;
- obrazloženju rezultata;
- tumačenju rezultata.
3.2. PROCENA I TUMAČENJE REZULTATA
Videti Opšti uvod.
4. LITERATURA
Videti Opšti uvod.
B.22. ISPITIVANJE DOMINANTNE LETALNOSTI NA GLODARIMA
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod.
1.2. DEFINICIJE
Videti Opšti uvod.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Efekti dominantne letalnosti za posledicu imaju embrionalnu ili fetalnu smrt. Indukcija dominantnih letala izlaganjem hemijskoj supstanci ukazuje na činjenicu da je supstanca delovala na germinativno tkivo ispitivane životinjske vrste. Opšteprihvaćeno mišljenje je da su dominantni letali posledica hromozomskih oštećenja (strukturnih i numeričkih anomalija). U slučaju tretiranja ženki ispitivanom supstancom, embrionalna smrt može da bude i posledica toksičnih dejstava.
Obično se mužjaci izlažu delovanju ispitivanog jedinjenja i potom se pare s netretiranim nevinim ženkama. Primenom sekvencijalnih intervala parenja moguće je odvojeno ispitati različite stadijume polnih ćelija. Povećanje broja mrtvih implanta po svakoj ženki u tretiranoj grupi u odnosu na broj mrtvih implanta po svakoj ženki u kontrolnoj grupi odražava postimplantacioni gubitak. Predimplantacioni gubitak može da se proceni na osnovu broja žutih tela ili poređenjem ukupnoga broja implanta po svakoj ženki u kontrolnoj i tretiranoj grupi. Ukupan efekt dominantne letalnosti predstavlja zbir pred- i post-implantacionog gubitka. Procena ukupnoga efekta dominantne letalnosti zasniva se na poređenju živih implanta po svakoj ženki u ispitivanoj grupi i živih implanta po svakoj ženki u kontrolnoj grupi. Smanjenje broja implanta u određenim vremenskim razmacima može biti posledica ubijanja ćelija (tj. spermatocita i/ili spermatogonija).
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE
1.6.1. Pripreme
Kada je moguće, ispitivane supstance se rastvaraju ili suspenduju u izotoničnom rastvoru. Hemikalije nerastvorljive u vodi mogu da se rastvore ili suspenduju u odgovarajućim medijumima. Medijum koji se koristi ne sme da interferira sa ispitivanom hemikalijom, niti za posledicu da ima toksične efekte. Neophodna je upotreba svežih rastvora/suspenzija ispitivane hemikalije.
1.6.2. Uslovi ispitivanja
1.6.2.1. Put primene
Ispitivano jedinjenje uglavnom se primenjuje samo jednom. Na osnovu toksikoloških podataka može se primeniti plan ponovljenog tretiranja. Uobičajeni putevi primene su oralna intubacija ili intraperitonealna injekcija. Mogu da odgovaraju i drugi putevi primene.
1.6.2.2. Eksperimentalne životinje
Kao odgovarajuće vrste za ispitivanje preporučuju se pacovi i miševi. Zdrave i potpuno polno zrele životinje nasumično se biraju i dodeljuju grupama koje se tretiraju i kontrolnim grupama.
1.6.2.3. Broj i pol
Koristi se odgovarajući broj tretiranih mužjaka, uzimajući u obzir spontano variranje bioloških svojstava koja se vrednuju. Izabrani broj se zasniva na unapred određenoj osetljivosti detekcije i stepena značaja. Na primer, u tipičnom ispitivanju, broj mužjaka u svakoj grupi koja prima određenu dozu je dovoljan da se obezbedi između 30 i 50 gravidnih ženki po svakom intervalu parenja.
1.6.2.4. Primena pozitivnih i negativnih kontrola
U svaki eksperiment se uključuju istovremene pozitivne i negativne (medijum) kontrole. Kad postoje prihvatljivi rezultati pozitivne kontrole iz eksperimenata koji su nedavno obavljeni u istoj laboratoriji, oni se mogu koristiti umesto istovremene pozitivne kontrole. Supstance pozitivne kontrole koriste se u prikladnoj niskoj dozi (npr. MMS, intraperitonealno pri 10 mg/kg), a kako bi se pokazala osetljivost ispitivanja.
1.6.2.5. Dozni nivoi
Obično se koriste tri nivoa doza. Visoka doza prouzrokuje znakove toksičnosti ili smanjene plodnosti tretiranih životinja. U određenim slučajevima jedna visoka doza može da bude dovoljna.
1.6.2.6. Ispitivanje granične doze
Netoksične supstance traba ispitati pri dozi od 5 g/kg u obliku jedne doze, ili pri dozi od 1 g/kg/dnevno prilikom ponovljenog doziranja.
1.6.3. Postupak
Postoji nekoliko planova za izvođenje postupka. Najviše se primenjuje doziranje ispitivane supstance u obliku jednokratne primene. Mogu se primeniti i drugi planovi tretiranja.
Pojedini mužjaci se sekvencijalno pare s jednom ili dve netretirane nevine ženke u odgovarajućim vremenskim intervalima posle tretiranja ispitivanom supstancom. Ženke je potrebno ostaviti zajedno s mužjacima tokom najmanje jednog estrusnog ciklusa ili dok ne dođe do parenja koje se utvrđuje prema prisutnosti sperme u vagini ili prema postojanju vaginalnog "čepa".
Broj parenja posle tretiranja rukovodi se planom tretiranja i obezbeđuje uzorkovanje svih stadijuma polnih ćelije posle tretiranja.
Ženke se lišavaju života na human način u drugoj polovini graviditeta i pregleda se sadržaj materice kako bi se utvrdio broj živih i mrtvih implanta. Mogu se pregledati i jajnici kako bi se utvrdio broj žutih tela.
2. PODACI
Podaci se navode tabelarno kako bi se prikazao broj mužjaka, broj gravidnih ženki i broj negravidnih ženki. Rezultati svakoga parenja, uključujući identitet svakog mužjaka i ženke, navode se pojedinačno. Potrebno je zabeležiti nedelju parenja za svaku ženku, veličinu doze koju su primili mužjaci, kao i učestalosti pojave živih i mrtvih implanta.
Izračunavanje ukupnog efekta dominantne letalnosti zasniva se na poređenju živih implanta po svakoj ženki u ispitivanoj grupi sa živim implantima po svakoj ženki u kontrolnoj grupi. Odnos mrtvih i živih implanta iz tretirane grupe u poređenju sa odnosom u kontrolnoj grupi analizira se kako bi se pokazao postimplantacioni gubitak.
Ukoliko se podaci navode u obliku ranih i kasnih smrti, u tabelama se to jasno naznačava. Navodi se i predimplantacioni gubitak, ukoliko je procenjen. Predimplantacioni gubitak može se izračunati kao razlika između broja žutih tela i broja implanta ili kao smanjenje prosečnog broja implanta po materici, a u poređenju sa kontrolnim parenjima.
Podaci se procenjuju primenom odgovarajućih statističkih metoda.
3. IZVEŠTAJ
3.1. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju, ukoliko je moguće, sadrži podatke o:
- životinjskoj vrsti, soju, starosti i telesnoj masi korišćenih životinja, broju životinja svakoga pola u eksperimentalnim i kontrolnim grupama;
- ispitivanoj supstanci, medijumu, ispitanim nivoima doza i logičkoj osnovi za izbor doza, negativnoj i pozitivnoj kontroli, toksičnosti;
- putu i planu primene;
- rasporedu parenja;
- metodama koje su korišćene da bi se utvrdilo da je došlo do parenja;
- vremenu lišavanja života na human način;
- kriterijumima beleženja dominantnih letala;
- odnosu doza/efekat, ako je primenljivo;
- statističkoj proceni;
- obrazloženju rezultata;
- tumačenju rezultata.
3.2. PROCENA I TUMAČENJE REZULTATA
Videti Opšti uvod.
4. LITERATURA
Videti Opšti uvod.
B.23. ISPITIVANJE HROMOZOMSKIH ABERACIJA NA SPERMATOGONIJIMA SISARA
1. METODA ISPITIVANJA
Metoda se zasniva na Uputstvu za ispitivanje OECD 483, Mammalian Spermatogonial Chromosome Aberration Test (1997).
1.1. UVOD
Svrha ispitivanja hromozomskih aberacija u spermatogonijima sisara in vivo jeste identifikacija supstanci koje uzrokuju strukturalne hromozomske aberacije u ćelijama spermatogonija sisara1, 2, 3, 4, 5. Strukturalne aberacije mogu biti dvojake: hromozomskog ili hromatidnog tipa. Većina hemijskih mutagena uzrokuje aberacije hromatidnog tipa, ali ponekad se pojavljuju i aberacije hromozomskog tipa. Ova metoda nije namenjena merenju numeričkih aberacija i obično se ne upotrebljava u tu svrhu. Hromozomske mutacije i sa njima povezane pojave uzrok su mnoštva genetskih oboljenja kod ljudi.
Ovo ispitivanje meri hromozomske pojave u zametnim ćelijama spermatogonija i od njega se očekuje da bude uspešno u predviđanju indukovanja naslednih mutacija u polnim ćelijama.
U ovom ispitivanju obično se upotrebljavaju glodari. Navedeno citogenetsko ispitivanje in vivo otkriva hromozomske aberacije prilikom mitoze spermatogonija. Ostale ciljne ćelije nisu predmet ove metode.
Da bi se otkrile aberacije hromatidnog tipa u ćelijama spermatogonija potrebno je ispitati prvu mitotsku deobu ćelija posle tretmana, a pre nego što navedene lezije nestanu u narednim ćelijskim deobama. Dodatni podaci o tretiranim matičnim ćelijama spermatogonija mogu se dobiti analizom aberacija hromozomskoga tipa kod mejotskih hromozoma prilikom dijakineze-metafaze 1 kada tretirane ćelije postaju spermatociti.
Svrha ovoga ispitivanja in vivo jeste ispitati da li su mutageni somatskih ćelija aktivni i u polnim ćelijama. Uz to, ovo ispitivanje na spermatogonijima odgovara i za ocenjivanje mutagenosti, zbog toga što omogućava uzimanje u obzir faktor metabolizma in vivo, farmakokinetike i procesa popravka DNK.
U testisu se nalaze brojne generacije spermatogonija koje imaju različite nivoe osetljivosti na hemijski tretman. Otkrivene aberacije predstavljaju zbirnu reakciju tretiranih ćelijskih populacija spermatogonija, pri čemu preovlađuju diferencirane ćelije spermatogonija koje su brojnije. Zbog fizičke i fiziološke barijere Sertolijevih ćelija i barijere između krvi i testisa, različite generacije spermatogonija mogu ili ne moraju biti izložene krvotoku, zavisno od njihovog položaja u testisima.
Ovaj oblik ispitivanja ne odgovara ukoliko se pojave dokazi da ispitivana supstanca ili reaktivni metabolit neće dospeti do ciljnog tkiva.
Videti Opšti uvod.
1.2. DEFINICIJE
Aberacija hromatidnog tipa jeste strukturalno oštećenje hromozoma koje se izražava kao cepanje pojedinih hromatida ili cepanje i ponovno sjedinjavanje između hromatida.
Aberacija hromozomskog tipa jeste strukturno oštećenje hromozoma koje se izražava kao cepanje ili cepanje i ponovno sjedinjavanje obe hromatide na identičnom mestu.
Hromozomski prekid jeste ahromatska lezija manja od širine jedne hromatide s minimumom neporavnatošću hromatida.
Numerička aberacija jeste promena u broju hromozoma koja odstupa od redovnog broja karakterističnog za životinje koje se koriste.
Poliploidnost jeste umnožak haploidnog broja hromozoma (n) različit od diploidnog broja (tj. 3n, 4n, itd).
Strukturna aberacija jeste promena u strukturi hromozoma koja se može otkriti mikroskopskim pregledom metafaznog stadijuma deobe ćelija, a koja se zapaža u obliku delecija, transpozicija ili recipročnih translokacija.
1.3. PRINCIP METODE
Životinje se odgovarajućim putem ekspozicije izlažu ispitivanoj supstanci i lišavaju života u odgovarajuće vreme posle tretiranja. Pre lišavanja života na human način, životinje se tretiraju supstancom za zaustavljanje metafaze (npr. kolhicinom ili Colcemid-om®). Posle toga, pripreme se i oboje hromozomski preparati od polnih ćelija i analiziraju ćelije u metafazi s ciljem utvrđivanja hromozomskih aberacija.
1.4. OPIS METODE
1.4.1. Pripreme
1.4.1.1. Izbor životinjske vrste
Obično se koriste kineski hrčci i miševi muškoga pola. Mogu se primeniti i mužjaci druge odgovarajuće vrste sisara. Koriste se laboratorijski sojevi mladih zdravih odraslih životinja koji se obično koriste. Na početku istraživanja odstupanje u telesnoj masi životinja treba da bude minimalno i da ne premašuje ± 20% prosečne telesne mase.
1.4.1.2. Uslovi smeštaja i ishrane
Primenjuju se opšti uslovi koji su navedeni u Opštem uvodu, iako se vlažnost održava na nivou od 50% do 60%.
1.4.1.3. Priprema životinja
Zdravi odrasli mužjaci se, po metodi slučajnog izbora, svrstavaju u kontrolne i eksperimentalne grupe. Kavezi su raspoređeni na način kojim će efekti koji su posledica položaja kaveza biti svedeni na najmanju moguću meru. Životinje se označavaju na jedinstven način. Životinje se aklimatizuju na laboratorijske uslove najmanje pet dana pre početka ispitivanja.
1.4.1.4. Priprema doza
Čvrste ispitivane supstance rastvaraju se ili suspenduju u odgovarajućim rastvaračima ili vehikulumima i, ukoliko je potrebno, razređuju pre doziranja životinja. Tečne ispitivane supstance mogu direktno da se doziraju ili razrede pre doziranja. Koriste se sveže pripremljeni preparati ispitivane supstance, osim ako podaci o stabilnosti ukazuju da je čuvanje prihvatljivo.
1.4.2. Uslovi ispitivanja
1.4.2.1. Rastvarač/vehikulum
Rastvarač/vehikulum ne sme da ima toksične efekte pri nivou doza koje se primenjuju i ne sme da postoji sumnja da će hemijski da reaguje sa ispitivanom supstancom. Ukoliko se primenjuju manje poznati rastvarači/vehikulumi, njihovo uključivanje u ispitivanje se opravdava podacima o njihovoj kompatibilnosti. Kad god je moguće, preporučuje se da se prvo razmotri primena vodenog rastvarača/vehikuluma.
1.4.2.2. Kontrole
Istovremene pozitivne i negativne (rastvarač/vehikulum) kontrole uključuju se u svako ispitivanje. Osim tretiranja ispitivanom supstancom, sa životinjama u kontrolnim grupama se postupa na isti način kao sa životinjama u tretiranim grupama.
Pozitivne kontrole izazivaju strukturne hromozomske aberacije u ćelijama spermatogonija in vivo pri istim nivoima izloženosti za koje se očekuje da će izazvati primetno povećanje u odnosu na podlogu.
Pozitivne kontrolne doze se biraju tako da efekti budu jasni, ali da licu koje čita eksperiment odmah ne otkriju identitet šifriranih mikroskopskih preparata (slajdova). Prihvatljivo je da se pozitivne kontrole primene putem koji je različit od onoga kod ispitivane supstance i da se uzorak uzme samo jednom. Kada je moguće uzima se u obzir primena hemikalija pozitivne kontrole koje pripadaju istoj hemijskoj kategoriji kao i ispitivana hemikalija. Primeri supstanci pozitivne kontrole:
Tabela 1.
Supstanca |
CAS br. |
EINECS br. |
ciklofosfamid |
50-18-0 |
200-015-4 |
cikloheksilamin |
108-91-8 |
203-629-0 |
mitomicin C |
50-07-7 |
200-008-6 |
monomerni akrilamid |
79-06-1 |
201-173-7 |
trietilenmelamin |
51-18-3 |
200-083-5 |
Negativne kontrole, tretirane samo rastvaračem ili vehikulumom, inače tretirane na isti način kao grupe obuhvaćene tretmanom, uključuju se u svako vreme uzorkovanja, osim ukoliko se, iz prošlih kontrolnih podataka, mogu ekstrapolirati prihvatljive među-životinjske varijabilnosti i frekventnost ćelija s hromozomskim aberacijama. Istovremeno se koriste i netretirane kontrole, osim ukoliko postoje kontrolni podaci iz prošlih ispitivanja ili objavljeni kontrolni podaci koji dokazuju da odabran rastvarač/vehikulum ne izaziva štetne ili mutagene efekte.
1.5. POSTUPAK
1.5.1. Broj životinja
Svaka tretirana i kontrolna grupa obuhvata najmanje pet mužjaka na kojima se može obaviti analiza.
1.5.2. Plan tretmana
Ispitivane supstance je najbolje davati jednom ili dvaput (tj. u okviru jednog ili dva tretmana). Ispitivane supstance mogu da se daju u obliku podeljene doze, tj. u obliku dva tretmana tokom istoga dana u razmaku od najviše nekoliko sati, a kako bi se olakšalo davanje velike količine materijala. Ostali režimi doziranja naučno se opravdavaju.
U najvišoj doznoj grupi uzorkovanje se vrši dva puta posle tretiranja. S obzirom da ispitivana supstance može da utiče na dinamiku ćelijskoga ciklusa, jedno uzorkovanje se obavlja ranije, oko 24 sata posle tretmana, a drugo kasnije, oko 48 sati posle tretmana. Kod ostalih doza, različitih od najviše doze, uzorke je potrebno uzeti 24 sata ili 1,5 dužinu ćelijskog ciklusa posle tretmana, osim ukoliko je poznato da bi drugo vreme uzorkovanja bilo prikladnije za otkrivanje efekata6.
Dodatni uzorci mogu da se uzimaju i u drugo vreme, npr. u slučaju hemikalija koje mogu da dovedu do zaostajanje hromozoma ili efekte nezavisne od S-faze, primerenije je da se uzorkovanje obavi ranije1.
Primerenost plana ponovljenog tretiranja utvrđuje se od slučaja do slučaja. Posle programa ponovljenog tretiranja, životinje se lišavaju života na human način 24 sata (1,5 dužina ćelijskog ciklusa) posle poslednjeg unosa ispitivane supstance. Kad je potrebno, mogu se uzeti i dodatni uzorci u drugo vreme.
Pre lišavanja života na human način životinjama se intraperitonealno injektuje odgovarajuća doza supstance za zaustavljanje metafaze (npr. Colcemid-a® ili kolhicina). Zatim se uzimaju životinjski uzorci u odgovarajućim intervalima. Za miševe ovaj interval iznosi oko 3 do 5 sati; za kineske hrčke interval iznosi oko 4 do 5 sati.
1.5.3. Dozni nivoi
Ukoliko se istraživanje obavlja sa ciljem utvrđivanja raspona zbog toga što ne postoje odgovarajući podaci, navedeno istraživanje se obavlja u istoj laboratoriji, uz korišćenje iste vrste, soja, pola i režima tretiranja koji će biti primenjeni u glavnom istraživanju7. Ukoliko postoji toksičnost, prilikom prvog intervala uzorkovanja koriste se tri nivoa doziranja. Ovi nivoi doziranja obuhvataju raspon od maksimalne do minimalne toksičnosti ili bez toksičnosti. Prilikom kasnijeg intervala uzorkovanja potrebno je upotrebiti samo najvišu dozu. Najviša doza se definiše kao doza usled koje nastaju simptomi toksičnosti takve prirode da se očekuje da bi veći nivoi doziranja, zasnovani na istom režimu doziranja, izazvali smrt.
Supstance specifičnog biološkog delovanja u malim netoksičnim dozama (kao što su hormoni i mitogena) izuzetak su od kriterijuma za postavljanje doza, pa se vrednuju od slučaju do slučaja. Najviša doza se može definisati i kao doza koja dovodi do nekih indikacija toksičnosti u ćelijama spermatogonija (npr. smanjenje odnosa između mitoza spermatogonija u prvoj i drugoj mejotskoj metafazi; navedeno smanjenje ne sme da bude veće od 50%).
1.5.4. Ispitivanje granične doze
Ukoliko prilikom ispitivanja jednom dozom, na nivou od najmanje 2.000 mg/kg TM/dnevno u okviru jednog tretmana ili dva tretmana tokom istoga dana, ne nastanu nikakvi primetni toksični efekti i ukoliko se genotoksičnost ne očekuje na osnovu podataka o strukturno sličnim supstancama, nije neophodno celokupno ispitivanje koje primenjuje tri nivoa doziranja. Očekivana izloženost ljudi može ukazati na potrebu za primenom veće doze tokom ispitivanja granične doze.
1.5.5. Primena doza
Ispitivana supstanca obično se primenjuje intubacijom (prisilno hranjenje), i to korišćenjem želudačne cevi ili odgovarajuće intubacijske kanile ili intraperitonealnom injekcijom. Ostali putevi izlaganja mogu da budu prihvatljivi u slučajevima u kojima se mogu opravdati. Maksimalna zapremina tečnosti koja može da se da odjednom putem cevi ili injekcijom zavisi od veličine eksperimentalne životinje. Zapremina ne sme da pređe 2 ml/100 g TM. Upotrebu većih zapremina potrebno je opravdati. Izuzev u slučaju iritabilnih i korozivnih supstanci koje normalno pokazuju pogoršane efekte pri višim koncentracijama, varijabilnost ekperimentalne zapremine svodi se na najmanju moguću meru prilagođavanjem koncentracije, a kako bi se osigurala konstantna zapremina pri svim nivoima doza.
1.5.6. Hromozomski preparat
Odmah posle lišavanja života na human način iz jednog ili oba testisa uzimaju se ćelijske suspenzije koje se izlažu hipotoničnom rastvoru i fiksiraju. Ćelije se zatim nanesu na mikroskopska stakla i oboje.
1.5.7. Analiza
Za svaku životinju se analizira najmanje 100 dobro vidljivih metafaza (tj. najmanje 500 metafaza po grupi). Navedeni broj se može smanjiti kada se uočava veliki broj aberacija. Sve preparate (slajdove), uključujući one pozitivne i negativne kontrole, potrebno je nezavisno šifrirati pre mikroskopske analize. S obzirom da postupci fiksiranja često za posledicu imaju oštećenje proporcija metafaza uz gubitak hromozoma, vrednovane ćelije zbog toga sadrže broj centromera jednak broju 2n ± 2.
2. PODACI
2.1. OBRADA REZULTATA
Podaci koji se odnose na pojedine životinje prikazuju se tabelarno. Životinja predstavlja eksperimentalnu jedinicu. Za svaku pojedinu životinju potrebno je utvrditi broj ćelija sa strukturnim hromozomskim aberacijama i broj hromozomskih aberacija po ćeliji. Navode se različite vrste strukturnih hromozomskih aberacija zajedno sa njihovim brojevima i frekvencama, a u odnosu na tretirane i kontrolne grupe. Hromozomski prekidi navode se odvojeno i o njima se izveštava, ali se uglavnom ne uključuju u ukupnu frekvencu aberacija.
Ukoliko se posmatraju i mitoza i mejoza, potrebno je utvrditi odnos između mitoza spermatogonija u prvoj i drugoj mejotskoj metafazi kao merilo citotoksičnosti za sve tretirane životinje i životinje negativne kontrole na čitavom uzorku od 100 ćelija u deobi po životinji, da bi se utvrdili mogući citotoksični efekti. Ukoliko se posmatra samo mitoza, potrebno je utvrditi mitotski indeks u najmanje 1.000 ćelija za svaku životinju.
2.2. PROCENA I TUMAČENJE REZULTATA
Postoji nekoliko kriterijuma za utvrđivanje pozitivnog rezultata, kao što je dozno zavisno povećanje relativnog broja ćelija s hromozomskim aberacijama ili jasno povećanje broja ćelija sa aberacijama u grupi koja je primala po jednu dozu prilikom pojedinog intervala uzorkovanja. Prvenstveno se uzima u obzir biološka relevantnost rezultata. Prilikom procene rezultata ispitivanja mogu da se primene statističke metode kao pomoćno sredstvo8. Statistički značaj ne treba da bude jedini faktor pomoću kojeg se utvrđuje pozitivan odgovor. Dvosmisleni rezultati se pojašnjavaju ispitivanjem, najbolje kroz modifikaciju eksperimentalnih uslova.
Ispitivana supstanca za koju rezultati ne zadovoljavaju navedene kriterijume, smatra se nemutagenom u ovom ispitivanju.
Iako većina eksperimenata daje jasno pozitivne ili negativne rezultate, u retkim slučajevima utvrđeni podaci onemogućavaju donošenje konačne odluke o delovanju ispitivane supstance. Rezultati mogu ostati dvosmisleni ili nejasni, bez obzira koliko je puta eksperiment ponovljen.
Pozitivni rezultati ispitivanja hromozomskih aberacija u spermatogonijima in vivo ukazuju na to da ispitivana supstanca uzrokuje strukturne hromozomske aberacije u polnim ćelijama ispitane vrste. Negativni rezultati ukazuju na to da, pod eksperimentalnim uslovima, ispitivana supstanca ne izaziva hromozomske aberacije u polnim ćelijama ispitane vrste.
Potrebno je razmotriti verovatnoću da će ispitivana supstanca ili njeni metaboliti dopreti do ciljnog tkiva.
3. IZVEŠTAJ
Izveštaj o ispitivanju sadrži podatke o:
1) Rastvaraču/vehikulumu:
- opravdanost izbora vehikuluma;
- rastvorljivost i stabilnost ispitivane supstance u rastvaraču/vehikulumu, ukoliko je poznato.
2) Eksperimentalnim životinjama:
- upotrebljena vrsta/soj;
- broj i starost životinja;
- poreklo, smeštajni uslovi, ishrana, itd.;
- pojedinačna težina životinja na početku ispitivanja, uključujući raspon telesne mase i srednju vrednost i standardnu devijaciju za svaku grupu.
3) Uslovima ispitivanja:
- podaci istraživanja za utvrđivanje raspona, ukoliko je obavljeno;
- logička osnova za izbor nivoa doziranja;
- logička osnova za izbor načina primene ispitivane supstance;
- detalji pripreme ispitivane supstance;
- detalji primene ispitivane supstance;
- logička osnova vremena lišavanja života na human način;
- način preračunavanja koncentracije ispitivane supstance u hrani/vodi za piće (ppm) u stvarnu dozu (mg/kg TM/dan), ukoliko je primenljivo na konkretan slučaj;
- detalji o kvalitetu hrane i vode;
- detaljan opis rasporeda tretmana i uzorkovanja;
- metode merenja toksičnosti;
- identitet supstance koja zaustavlja metafazu, njena koncentracija i trajanje tretmana;
- metode pripreme mikroskopskih preparata;
- kriterijumi za prebrojavanje aberacija;
- broj analiziranih ćelija po životinji;
- kriterijumi za proglašavanje ispitivanja pozitivnim, negativnim ili dvosmislenim.
4) Rezultatima:
- simptomi toksičnosti;
- mitotski indeks;
- odnos između mitoza spermatogonija u prvoj i drugoj mejotskoj metafazi;
- vrsta i broj aberacija, zasebno prikazanih za svaku životinju;
- ukupan broj aberacija po grupi;
- broj ćelija sa aberacijama po grupi;
- odnos doza/efekat, gde je moguće;
- statističke analize, ukoliko postoje;
- podaci istovremene negativne kontrole;
- negativni kontrolni podaci prošlih istraživanja s rasponima i srednjim vrednostima i standardnim devijacijama;
- podaci istovremene pozitivne kontrole;
- promene u ploidnosti (broju hromozomske strukture ćelije), ukoliko su primećene.
5) Obrazloženju rezultata.
6) Zaključcima.
4. LITERATURA
1. Adler, I.D. (1986). Clastogenic Potential in Mouse Spermatogonia of Chemical Mutagens Related to their Cell-Cycle Specifications. In: Genetic Toxicology of Environmental Chemicals, Part B: Genetic Effects and Applied Mutagenesis, Ramel, C., Lambert, B. and Magnusson, J. (Eds.) Liss, New York, pp. 477-484.
2. Adler, I.D., (1984). Cytogenetic tests in Mammals. In: Mutagenicity Testing: a Practical Approach. Ed. S. Venitt and J.M. Parry. IRL Press, Oxford, Washington DC, pp. 275-306.
3. Evans, E.P., Breckon, G. and Ford, C.E., (1964). An Air-Drying Method for Meiotic Preparations from Mammalian Testes. Cytogenetics and Cell Genetics, 3, 289-294.
4. Richold, M., Ashby, J., Chandley, A., Gatehouse, D.G. and Henderson, L. (1990). In vivo Cytogenetic Assays, In: D.J. Kirkland (Ed.) Basic Mutagenicity Tests, UKEMS Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing. Report. Part I revised. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 115-141.
5. Yamamoto, K. and Kikuchi, Y. (1978). A New Method for Preparation of Mammalian Spermatogonial Chromosomes. Mutation Res., 52, 207-209.
6. Adler, I.D., Shelby M.D., Bootman, J., Favor, J., Generoso, W., Pacchierotti, F., Shibuya, T. and Tanaka N.(1994). International Workshop on Standardisation of Genotoxicity Test Procedures. Summary Report of the Working Group on Mammalian Germ Cell Tests. Mutation Res., 312, 313-318.
7. Fielder, R.J., Allen, J.A., Boobis, A.R., Botham, P.A., Doe, J., Esdaile, D.J., Gatehouse, D.G., Hodson-Walker, G., Morton, D.B., Kirkland, D.J. and Richold, M. (1992). Report of British Toxicology Society/UK Environmental Mutagen Society Working group: Dose setting in In vivo Mutagenicity Assays. Mutagenesis, 7, 313-319.
8. Lovell, D.P., Anderson, D., Albanese, R., Amphlett, G.E., Clare, G., Ferguson, R., Richold, M., Papworth, D.G. and Savage, J.R.K. (1989). Statistical Analysis of In vivo Cytogenetic Assays In: D.J. Kirkland (Ed.) Statistical Evaluation of Mutagenicity Test Data. UKEMS Sub-Committee on Guidelines for Mutagenicity Testing, report, Part III. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 184-232.
B.24. SPOT TEST NA MIŠEVIMA
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod.
1.2. DEFINICIJE
Videti Opšti uvod.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Ovo je in vivo ispitivanje na miševima prilikom kog se hemikalijama izlažu embrioni u razvoju. Ciljne ćelije u embrionima u razvoju su melanoblasti, dok su ciljni geni oni koji kontrolišu pigmentaciju dlake krzna. Embrioni u razvoju su heterozigotni kod niza ovih gena koji uslovljavaju boju krzna. Mutacija ili gubitak (zbog niza genetskih pojava) dominantnih alela takvog gena u melanoblastu ima za posledicu ekspresiju recesivnog fenotipa u ćelijama koje potom nastaju, stvarajući mrlju drugačije boje na krznu dobijenog miša. Broj potomaka s mrljama, mutacijama, prebroji se i učestalost njihovog javljanja upoređuje se s onom koja se javlja među potomcima koji nastanu iz embriona tretiranih isključivo rastvaračem. Test mrlje u miša otkriva pretpostavljene somatske mutacije u fetalnim ćelijama.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE
1.6.1. Pripreme
Kada može, ispitivane supstance se rastvaraju ili suspenduju u izotoničnom rastvoru. Hemikalije koje su nerastvorljive u vodi rastvaraju se ili suspenduju u odgovarajućim vehikulumima. Vehikulum koji se koristi ne sme da interferira sa ispitivanom hemikalijom, niti da uzrokuje toksične efekte. Neophodna je primena svežih preparata ispitivane hemikalije.
1.6.1.1. Eksperimentalne životinje
Miševi T soja (jednobojni bez uzorka, a/a; činčila, ružičaste oči, cch p/cch p; smeđi, b/b; blage boje, kratke uši, d se/d se; šarene mrlje, s/s) pare se ili sa HT sojem (bleda boja, jednobojni bez uzorka, kratki udovi, pa a bp/pa a bp; nejasno olovnosivi, ln fz/ln fz; sedefasti pe/pe) ili sa C57BL (jednobojni bez uzorka, a/a). Mogu se koristiti i ostali odgovarajući oblici ukrštanja, kao što su NMRI (jednobojni bez uzroka, a/a; albino, c/c) i DBA (jednobojni bez uzorka, a/a; smeđi b/b; blage boje d/d) ako se dobiju jednobojni potomci.
1.6.1.2. Broj i pol
Tretira se dovoljan broj gravidnih ženki kako bi se osigurao odgovarajući broj preživelih potomaka za svaki dozni nivo koja se primenjuje. Odgovarajuća veličina uzorka reguliše se zavisno od broja mrlja zapaženih kod tretiranih miševa i raspona kontrolnih podataka. Negativan rezultat prihvatljiv je samo kada je procenjivanje sprovedeno na najmanje 300 potomaka ženki tretiranih najvišom dozom.
1.6.1.3. Primena pozitivnih i negativnih kontrola (kontrolnih uzoraka)
Neophodno je da postoje podaci o istovremenim kontrolama miševa koji su tretirani samo medijumom (negativne kontrole). Mogu se sjediniti kontrolni podaci iz prethodnih istraživanja iste laboratorije kako bi se povećala osetljivost ispitivanja, ako su navedena ispitivanja homogena. Podaci o pozitivnoj kontroli koji su nedavno dobijeni u istoj laboratoriji posle tretmana hemikalijom koja je pokazala mutagenost ovim testom, treba da budu dostupni ukoliko se ne primeti mutagenost ispitivane hemikalije.
1.6.1.4. Put primene
Uobičajeni putevi primene uključuju oralnu intubaciju ili intraperitonealno ubrizgavanje supstance gravidnim ženkama. Obavljanje tretmana inhalacijom ili drugim putevima primene koristi se kada to odgovara.
1.6.1.5. Dozni nivoi
Primenjuju se bar dva dozna nivoa, uključujući jednu kod koje se javljaju simptomi toksičnosti ili smanjenje veličine legla. Kod netoksičnih hemikalija potrebno je izlaganje maksimalnoj mogućoj dozi.
1.6.2. Postupak
Obavlja se jedan tretman tokom osmog, devetog ili desetog dana trudnoće, pri čemu se kao prvi dan broji onaj dan kada je prvi put primećen vaginalni "čep". Ovi dani odgovaraju vremenu od 7,25, 8,25 i 9,25 dana posle začeća. Mogu se primeniti i sukcesivni tretmani tokom navedenih dana.
1.6.2.1. Analiza
Potomci se šifriraju i posmatraju na postojanje mrlja između treće i četvrte nedelje posle rođenja. Razlikuju se tri kategorije mrlja:
a) bele mrlje unutar 5 mm od središnje ventralne (trbušne) linije za koje se pretpostavlja da su posledica ubijanja ćelija (u daljem tekstu:WMVS);
b) žute mrlje, nalik aguti boji, vezane uz područja grudi, genitalija, grla, područja pazuha i prepona i na sredini čela; za njih se pretpostavlja da su posledica pogrešne diferencijacije (u daljem tekstu: MDS);
v) pigmentne i bele mrlje slučajno raspoređene po krznu za koje se pretpostavlja da su posledica somatskih mutacija (u daljem tekstu: RS).
Vrednovanje se obavlja u sve tri kategorije, ali je samo poslednja, RS, od genetske važnosti. Poteškoće u razlikovanju MDS i RS mogu se rešiti fluorescentnom mikroskopijom uzoraka dlake.
Neophodno je zabeležiti očigledne makro morfološke abnormalnosti potomaka.
2. PODACI
Podaci se navode u obliku ukupnog broja vrednovanih potomaka i broja kod koga se pojavila jedna ili više mrlja za koje se pretpostavlja da su posledica somatske mutacije. Podaci o tretiranju upoređuju se sa podacima negativne kontrole primenom odgovarajućih metoda. Podaci se prikazuju na osnovi pojedinih legala.
3. IZVEŠTAJ
3.1. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju, ukoliko je moguće, sadrži podatke o:
- sojevima upotrebljenim za ukrštanje;
- broju gravidnih ženki u eksperimentalnim i kontrolnim grupama;
- prosečnoj veličini legla u eksperimentalnim i kontrolnim grupama prilikom okota i prestanka dojenja;
- nivoima doza ispitivane hemikalije;
- upotrebljenom rastvaraču;
- danu gravidnosti na koji je tretman primenjen;
- načinu primene tretmana;
- ukupnom broju vrednovanih potomaka i broju sa WMVS, MDS i RS u eksperimentalnim i kontrolnim grupama;
- uočljivim morfološke abnormalnostima;
- odnosu doze/efekat kod RS-a kada je moguće;
- statističkoj proceni;
- obrazloženju rezultata;
- tumačenju rezultata.
3.2. PROCENA I TUMAČENJE REZULTATA
Videti Opšti uvod.
4. LITERATURA
Videti Opšti uvod.
B.25. NASLEĐENA TRANSLOKACIJA KOD MIŠA
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod.
1.2. DEFINICIJE
Videti Opšti uvod.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Ispitivanje nasleđene translokacije kod miša otkriva strukturne i numeričke hromozomske promene u polnim ćelijama sisara koje se pojavljuju kod potomstva prve generacije. Vrste otkrivenih hromozomskih promena obuhvataju recipročne translokacije i, ukoliko je uključeno potomstvo ženskog pola, gubitak hromozoma X. Kod nosilaca translokacija i XO-ženki javlja se smanjena plodnost koja se koristi za izbor F1 potomstva u svrhu citogenetske analize. Potpunu sterilnost izazivaju određene vrste translokacija (autozomni gen X (autozom) i c-t tip). Translokacije se citogenetski posmatraju u mejotskim ćelijama tokom dijakineze - metafaze 1 kod jedinki mužjaka, bilo F1 mužjaka ili potomaka muškog pola F1 ženki. XO-ženke citogenetski se identifikuju na osnovu postojanja samo 39 hromozoma tokom mitoza koštane srži.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE
1.6.1. Pripreme
Hemikalije koje se ispituju rastvaraju se u izotoničnom rastvoru. Ukoliko su hemikalije nerastvorljive, suspenduju se u odgovarajućim vehikulumima. Koriste se sveže pripremljeni rastvori ispitivane supstance. Ukoliko se zbog lakšeg doziranja koristi vehikulum, on ne sme da interferira sa ispitivanim jedinjenjem, niti da uzrokuje toksične efekte.
1.6.1.1. Put primene
Putevi primene obično obuhvataju oralnu intubaciju ili intraperitonealne injekcije. Mogu da odgovaraju i drugi putevi primene.
1.6.1.2. Eksperimentalne životinje
Zbog lakšeg razmnožavanja i citološke verifikacije, eksperimenti se obavljaju na miševima. Nije potreban nikakav specifični mišji soj. Prosečna veličina legla soja je veća od osam i relativno je konstantna.
Koriste se zdrave i polno zrele životinje.
1.6.1.3. Broj životinja
Potreban broj životinja zavisi od učestalosti spontanih translokacija i najnižeg stepena indukcije potrebne za pozitivan rezultat.
Ispitivanje se obično obavlja analizom muškog F1 potomstva. Po svakoj doziranoj grupi potrebno je ispitati najmanje 500 muških F1 potomaka. Ukoliko je u ispitivanje uključeno i žensko F1 potomstvo, potrebno je 300 mužjaka i 300 ženki.
1.6.1.4. Primena pozitivnih i negativnih kontrola
Potrebni su odgovarajući kontrolni podaci dobijeni na osnovu istovremene kontrole i kontrole iz prošlih ispitivanja. Kad postoje prihvatljivi rezultati pozitivne kontrole iz nedavno izvedenih ispitivanja u istoj laboratoriji, mogu se upotrebiti ovi rezultati umesto istovremene pozitivne kontrole.
1.6.1.5. Dozni nivoi
Ispituje se jedna doza, obično najviša doza koja je u vezi sa izazivanjem minimalnih toksičnih efekata, ali bez uticaja na reproduktivno ponašanje ili preživljavanje. Kako bi se uspostavio odnos između doze i efekta, potrebne su i dve dodatne niže doze. Kod netoksičnih hemikalija potrebno je izlaganje maksimalnoj mogućoj dozi.
1.6.2. Postupak
1.6.2.1. Tretiranje i parenje
Postoje dva plana tretiranja. Najviše se koristi pojedinačna primena ispitivane supstance. Ispitivana supstanca se može primenjivati sedam dana nedeljno tokom perioda od 35 dana. Broj parenja koji sledi posle tretmana određen je planom tretmana. Obezbeđuje se obavljanje uzorkovanja u svim tretiranim stadijumima polnih ćelija. Na kraju perioda parenja ženke se pojedinačno stavljaju u kaveze. Kada se ženke okote, beleži se datum, veličina legla i pol potomstva. Svi muški potomci se odbijaju od sise, dok se svi ženski potomci odbacuju, osim ukoliko su obuhvaćeni ispitivanjem.
1.6.2.2. Ispitivanje heterozigotnosti kod translokacije
Koristi se jedna od dve moguće metode:
a) Ispitivanje plodnosti F1 potomstva i naknadna verifikacija mogućih nosilaca translokacije citogenetskom analizom;
b) Citogenetska analiza svih muških F1 potomaka bez prethodne selekcije na osnovu ispitivanja plodnosti.
a) Ispitivanje plodnosti
Smanjena plodnost F1 jedinki može se utvrditi praćenjem veličine legla i/ili analizom materičnog sadržaja ženskih ispitanika.
Neophodno je utvrditi kriterijume za određivanje normalne i smanjene plodnosti za soj miševa koji se koristi.
Praćenje veličine legla: F1 mužjaci, na kojima će biti izvedeno ispitivanje, pojedinačno se zatvaraju u kaveze zajedno sa ženkama iz istog eksperimenta ili iz kolonije. Kavezi se svakodnevno proveravaju, počevši 18 dana posle parenja. Prilikom okota beleži se veličina legla i pol F2 potomstva i legla se posle toga odbacuju. Ukoliko se ispituje žensko F1 potomstvo, F2 potomstvo iz malih legala zadržava se zbog daljih ispitivanja. Ženski nosioci translokacija proveravaju se citogenetskom analizom translokacije kod svakog od njihovih muških potomaka. XO-ženke prepoznaju se po promeni odnosa među polovima njihovog potomstva iz 1:1 u 1:2 u korist potomaka muškoga pola. U sekvencijalnom postupku normalne F1 životinje eliminišu se iz daljeg ispitivanja ukoliko prvo F2 leglo dostigne ili premaši unapred određenu normalnu vrednost. U suprotnom, obavlja se posmatranje drugog ili trećeg F2 legla.
F1 životinje koje se ne mogu klasifikovati kao normalne posle praćenja maksimalno tri F2 legla, ili se dalje ispituju analizom materičnog sadržaja ženskih ispitanika ili se direktno podvrgavaju citogenetskoj analizi.
Analiza materičnog sadržaja: do smanjenja veličine legla nosilaca translokacije dolazi zbog smrti embriona tako da visok broj mrtvih implantata upućuje na postojanje translokacije kod životinje koja se ispituje. Svaki F1 mužjak na kojem se obavlja ispitivanje pari se sa dve do tri ženke. Začeće se utvrđuje na osnovu svakodnevnih provera na postojanje vaginalnih "čepova" u jutarnjim satima. Ženke se lišavaju života na human način 14 do 16 dana kasnije i registruju se živi i mrtvi implantati u njihovim matericama.
b) Citogenetska analiza
Preparati sadržaja testisa pripremaju se tehnikom vazdušnog sušenja. Nosioci translokacija prepoznaju se po postojanju multivalentnih struktura pri dijakinezi - metafazi 1 u primarnim spermatocitima. Opažanje najmanje dve ćelije sa multivalentnom asocijacijom dovoljan je dokaz da je ispitana životinja nosilac translokacije.
Ukoliko nije obavljena ni jedna selekcija tokom uzgoja, svi F1 mužjaci se proveravaju citogenetski. Neophodno je mikroskopski otkriti postojanje najmanje 25 ćelija u metafazi 1 dijakineze po mužjaku. Neophodan je pregled mitotskih metafaza u spermatogonijima ili koštanoj srži F1 mužjaka s malim testisima i mejotskom razgradnjom pre dijakineze ili F1 ženki za koje se sumnja da su XO. Postojanje neobično dugog i/ili kratkog hromozoma u svakoj od deset ćelija dokaz je posebne translokacije kod mužjaka koja izaziva sterilnost (c-t tip). Neke translokacije autozoma X koje uzrokuju sterilnost mužjaka mogu se prepoznati samo analizom koja primenjuje pruganje mitotskih hromozoma.
Postojanje 39 hromozoma u svih 10 mitoza dokaz je postojanja XO stanja kod ženke.
2. PODACI
Podaci se navode tabelarno.
Za svaki period parenja, posle parenja roditelja, registruje se srednja veličina legla i odnos polova prilikom okota i prestanka dojenja.
Za procenu plodnosti F1 životinja navodi se srednja veličina legla svih normalnih parenja i pojedinačne veličine legla F1 nosilaca translokacija. Za analizu materičnog sadržaja izveštava se o prosečnom broju živih i mrtvih implantata posle normalnih parenja i o pojedinačnim brojevima živih i mrtvih implantata za svako parenje F1 nosilaca translokacije.
Za citogenetsku analizu dijakineze-metafaze 1 beleži se broj vrsta multivalentnih struktura i ukupan broj ćelija za svakog nosioca translokacije.
Za sterilne F1 jedinke beleži se ukupan broj parenja i trajanje perioda parenja. Navodi se masa testisa i detalji citogenetske analize.
Za XO ženke beleži se srednja veličina legla, odnos polova F1 potomstva i rezultati citogenetske analize.
Kad je moguće, F1 nosioci translokacije prethodno se biraju na osnovu ispitivanja plodnosti i tabele obuhvataju podatke o tome koliki broj njih su potvrđeni heterozigoti translokacije.
Navode se i podaci negativnih i pozitivnih kontrola ispitivanja.
3. IZVEŠTAJ
3.1. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju, ukoliko je moguće, sadrži podatke o:
- mišjem soju, starosti životinja, masi tretiranih životinja;
- broju životinja roditelja svakog pola u eksperimentalnim i kontrolnim grupama;
- uslovima ispitivanja, detaljan opis tretmana, nivoa doza, rastvarača, raspored parenja;
- broju i polu potomaka po svakoj ženki, broju i polu potomaka uzgojenih u svrhu analize translokacije;
- vremenu i kriterijumima analize translokacije;
- broju i detaljnom opisu nosilaca translokacije, uključujući podatke o parenju i podatke o materičnom sadržaju, u zavisnosti od konkretnog slučaja;
- citogenetskim postupcima i detaljima mikroskopske analize, po mogućstvu uz slike;
- statističkoj proceni;
- obrazloženju rezultata;
- tumačenje rezultata.
3.2. PROCENA I TUMAČENJE REZULTATA
Videti Opšti uvod.
4. LITERATURA
Videti Opšti uvod.
B.26. SUBHRONIČNA ORALNA TOKSIČNOST PONOVLJENIH DOZA - STUDIJA ORALNE TOKSIČNOSTI NA GLODARIMA, 90 DANA
1. METODA ISPITIVANJA
Metoda ispitivanja subhronične oralne toksičnosti zasniva se na Uputstvu za ispitivanje OECD 408 (1998).
1.1. UVOD
Prilikom vrednovanja i procene toksičnih svojstava hemikalije subhronična oralna toksičnost može da se odredi primenom ponovljenih doza, a nakon što su, na osnovu 28-dnevnih ispitivanja toksičnosti, primenom akutne ili ponovljenih doza, dobijeni početni podaci o toksičnosti. Devedesetodnevno ispitivanje daje podatke o mogućim opasnostima po zdravlje koje će verovatno proizaći iz ponavljane dugotrajne izloženosti tokom perioda sazrevanja posle prestanka dojenja i perioda rasta, poprilično zahvatajući odraslo doba. Ispitivanje daje podatke o značajnijim toksičnim efektima, naznačava ciljne organe i mogućnost kumulacije, i može da obezbedi procenu nivoa ekspozicije pri kojem nisu primećeni neželjeni efekti, a koji se može primeniti prilikom izbora nivoa doze za hronična ispitivanja, kao i za utvrđivanje kriterijuma sigurnosti kod izlaganja ljudi.
Metoda stavlja dodatni akcenat na neurološke krajnje tačke i ukazuje na imunološke i reproduktivne efekte. Naglašava se i potreba za pažljivim kliničkim praćenjem životinja, s ciljem prikupljanja što veće količine podataka. Ovo ispitivanje omogućava prepoznavanje hemikalija koje imaju potencijal uzrokovanja neurotoksičnih i imunoloških efekata, kao i efekata na reproduktivnim organima, što može opravdati dalja detaljna istraživanja.
Videti Opšti uvod.
1.2. DEFINICIJE
Doza jeste količina ispitivane supstance koja se primenjuje. Doza se izražava kao masa (g, mg) ili kao masa ispitivane supstance po jedinici telesne mase eksperimentalne životinje (npr. mg/kg) ili u obliku konstantnih koncentracija izlaganja putem ishrane (ppm).
Doziranje jeste opšti pojam koji obuhvata dozu, njenu učestalost i vremensko trajanje doziranja.
NOAEL jeste skraćenica za nivo pri kojem nisu primećeni neželjeni efekti i predstavlja najviši nivo doze pri kojoj nisu primećeni nikakvi štetni nalazi vezani za tretman.
1.3. PRINCIP METODE
Ispitivana supstanca primenjuje se svakodnevno oralnim putem u rastućim dozama kod nekoliko grupa eksperimentalnih životinja i to po jedan dozni nivo po grupi tokom 90 dana. Tokom perioda primene, životinje se pažljivo posmatraju zbog uočavanja simptoma toksičnosti. Na životinjama koje uginu ili budu lišene života na human način tokom ispitivanja obavlja se postmortalni pregled, dok se, po završetku ispitivanja, preživele životinje takođe lišavaju života na human način i postmortalno pregledaju.
1.4. OPIS METODE
1.4.1. Priprema životinja
Prilikom ispitivanja neophodno je koristiti zdrave životinje koje su se aklimatizovale na laboratorijske uslove najmanje pet dana i nisu bile predmet prethodnih eksperimentalnih postupaka. Eksperimentalne životinje potrebno je okarakterisati kao vrstu, soj, poreklo, pol, telesnu masu i/ili starost. Životinje se slučajnim izborom dodeljuju kontrolnim grupama i grupama koje se tretiraju. Kavezi su razmešteni na način kojim će mogući efekti koji proizlaze iz položaja kaveza biti svedeni na najmanju moguću meru. Svakoj životinji dodeljuje se jedinstveni identifikacioni broj.
1.4.2. Priprema doza
Ispitivana supstanca daje se putem intubacione cevi ili putem hrane ili vode za piće. Metoda oralne primene zavisi od svrhe ispitivanja, kao i od fizičkih i hemijskih svojstava ispitivanog materijala.
Kada je potrebno, ispitivana supstanca se rastvara ili suspenduje u odgovarajućem vehikulumu. Preporučuje se da se, kad god je moguće, uzme u obzir primena vodenog rastvora/suspenzije, posle čega se razmatra rastvor/emulzija u ulju (npr. kukuruzno ulje), a tek posle toga moguće je rastvaranje u ostalim vehikulumima. Za sve vehikulume, osim vode, moraju biti poznata toksična svojstva. Neophodno je utvrditi stabilnost ispitivane supstance u uslovima primene.
1.4.3. Uslovi ispitivanja
1.4.3.1. Eksperimentalne životinje
Najpogodnija životinjska vrsta je pacov, iako se mogu primeniti i ostale vrste glodara, na primer miševa. Koriste se mlade zdrave odrasle životinje laboratorijskih sojeva koji se obično upotrebljavaju. Biraju se ženke koje nisu ranije rađale i koje nisu gravidne. Sa doziranjem se započinje što je pre moguće posle prestanka dojenja, a pre nego što životinje navrše devet nedelja. Prilikom započinjanja ispitivanja, odstupanje u telesnoj masi životinja koje se koriste treba da bude minimalno i ne sme da odstupa više od ± 20% prosečne telesne mase svakog pola. Kada se istraživanje obavlja kao preliminarno, pre dugotrajnog ispitivanja hronične toksičnosti, u oba ispitivanja se upotrebljavaju životinje koje su istog soja i istog porekla.
1.4.3.2. Broj i pol
Prilikom ispitivanja svake doze upotrebljava se najmanje 20 životinja (deset ženki i deset mužjaka). Ukoliko se planira lišavanje života na human način u međuvremenu, broj je potrebno povećati za broj životinja čije se lišavanje života planira pre završetka ispitivanja. Na osnovu prethodnog znanja o hemikaliji ili bliskom analogu, potrebno je razmotriti uključivanje dodatne prateće grupe od deset životinja (pet po polu) u kontrolnu grupu i grupu koja prima najvišu dozu, zbog praćenja reverzibilnosti ili postojanosti bilo kog od toksičnih efekata po isteku perioda tretiranja. Trajanje ovog perioda posle tretiranja utvrđuje se u skladu sa zapaženim efektima.
1.4.3.3. Nivoi doziranja
Potrebno je koristiti najmanje tri nivoa doze i istovremenu kontrolu, osim u slučajevima u kojima se obavlja ispitivanje granične doze (videti odeljak 1.4.3.4. ove metode). Nivoi doze mogu da se temelje na rezultatima ispitivanja s ponovljenim doziranjem ili rezultatima ispitivanja namenjenog utvrđivanju raspona. Uzimaju se u obzir svi postojeći toksikološki i toksikokinetički podaci koji postoje za ispitivanu supstancu ili materijal s njom u vezi. Najviša doza bira se sa ciljem da izazove toksičnost, ali ne i smrt ili ozbiljne tegobe, osim ukoliko nije ograničena fizičkim i hemijskim karakteristikama ili biološkim efektima ispitivane supstance. Opadajući niz doza bira se s ciljem da se dokažu bilo kakve reakcije povezane s doziranjem, kao i najviši nivo na kome nisu primećeni neželjeni efekti (u daljem tekstu: NOAEL) pri najnižem nivou doze. Za uspostavljanje silaznih nivoa doza najčešće su optimalni dvostruki intervali, pa sve do četvorostrukih, dok je dodavanje četvrte eksperimentalne grupe preporučljivije od korišćenja vrlo velikih intervala između doziranja
Kontrolna grupa je ona koja se ne tretira ili kontrolna grupa koja se tretira samo vehikulumom ukoliko se isti koristi prilikom davanja ispitivane supstance. Izuzev tretiranja ispitivanom supstancom, sa životinjama u kontrolnoj grupi postupa se na isti način kao i sa eksperimentalnim grupama. Ukoliko se koristi vehikulum, kontrolna grupa prima vehikulum u najvišoj zapremini koja se primenjuje. Ukoliko se ispitivana supstanca daje zajedno sa hranom i uzrokuje smanjen unos hrane tada se, za razlikovanje smanjenog unosa uzrokovanog ukusom i onog usled toksikoloških promena kod eksperimentalnog modela, koristi paralelno hranjena kontrolna grupa.
U obzir se uzimaju sledeća svojstva vehikuluma i ostalih dodataka, u zavisnosti od slučaja: efekti na apsorpciju, raspodelu, metabolizam ili zadržavanje ispitivane supstance; efekta na hemijska svojstva ispitivane supstance koji mogu promeniti njena toksična svojstva i efekti na potrošnju hrane i vode ili stanje uhranjenosti životinja.
1.4.3.4. Ispitivanje granične doze
Ukoliko zbog eksperimenta s jednim nivoom doze, koja je najmanje jednaka 1.000 mg/kg TM/dnevno, a koji se koristi u postupcima opisanim za ovo ispitivanje, ne nastanu nikakvi primetni neželjeni efekti i ukoliko se toksičnost ne očekuje na osnovu podataka o strukturno sličnim supstancama, tada se ne smatra neophodnim celokupno ispitivanje koje primenjuje tri nivoa doziranja. Ispitivanje granične doze nije primenljiv u slučajevima kad izloženost ljudi ukazuje na potrebu za primenom višeg nivoa doze.
1.5. POSTUPAK
1.5.1. Primena doza
Životinjama se ispitivana supstanca daje svakodnevno, sedam dana nedeljno tokom perioda od 90 dana. Bilo koji drugi režim doziranja, na primer, pet dana nedeljno, potrebno je opravdati. Kada se ispitivana supstanca primenjuje putem intubacijske cevi (prisilno hranjenje), istu je potrebno dati u obliku jedne doze životinjama koje koriste želudačnu cev ili odgovarajuću intubacijsku kanilu. Maksimalna zapremina tečnosti koja es može dati odjednom zavisi od veličine eksperimentalne životinje. Zapremina ne sme da bude veća od 1ml/100g TM, osim u slučaju vodenih rastvora kada je moguće primeniti 2 ml/100g TM. Izuzev u slučaju iritativnih ili korozivnih supstanci kod kojih se nepovoljni efekti obično pokazuju pri višim koncentracijama, varijabilnost eksperimentalne zapremine je svedena na najmanju moguću meru prilagođavanjem koncentracije, a kako bi se osigurala konstantna zapremina pri svim nivoima doza.
Kod supstanci koje se primenjuju putem hrane ili vode za piće važno je osigurati da količine ispitivane supstance o kojoj je reč ne ometaju redovnu ishranu i ravnotežu vode. Kada se ispitivana supstanca daje putem hrane, može da se primeni konstantna prehrambena koncentracija (ppm) ili konstantni dozni nivo u odnosu na telesnu masu životinje. Alternativa koja se koristi se naznačava. U slučaju supstance koja se daje prisilnim hranjenjem (intubacijskom cevi), dozu je potrebno dati svaki dan u isto vreme i po potrebi prilagoditi kako bi se održala konstantna doza u odnosu na telesnu masu životinje. Kada se 90-dnevno ispitivanje koristi kao preliminarno ispitivanje dugotrajnog ispitivanja hronične toksičnosti, preporučljivo je u oba ispitivanja primeniti sličan način ishrane.
1.5.2. Posmatranja
Praćenje traje najmanje 90 dana. Životinje u pratećoj grupi za koje se planiraju dodatna posmatranja potrebno je, odgovarajuće vreme, držati bez tretmana, a kako bi se otkrila postojanost ili oporavak od toksičnih efekata.
Opšta klinička posmatranja obavljaju se najmanje jednom dnevno, najbolje u isto vreme svakog dana, uzimajući u obzir najznačajniji period očekivanih efekata posle doziranja. Neophodno je zabeležiti kliničko stanje životinja. Najmanje dvaput dnevno, obično početkom i krajem svakog dana, sve životinje se proveravaju na simptome morbiditeta i mortaliteta.
Najmanje jednom pre prvog izlaganja (kako bi se omogućilo poređenje kod istih ispitanika) i jednom nedeljno posle toga, potrebno je detaljno kliničko snimanje stanja svih životinja. Navedena posmatranja potrebno je obaviti izvan kaveza u kojem životinja inače boravi, najbolje u standardnom okruženju i svaki put u slično vreme. Posmatranja se pažljivo registruju, najbolje korišćenjem sistema vrednovanja, izričito definisanih od strane laboratorije koja obavlja ispitivanje. Neophodno je uložiti određeni napor kako bi se obezbedilo da su odstupanja u uslovima posmatranja minimalna. Simptomi koji se beleže obuhvataju, ali nisu ograničeni na, promene na koži, krznu, očima, mukoznim membranama, pojavi sekreta ili ekskreta i autonomnu aktivnost (npr. suzenje, piloerekcija, veličina zenica, neobična respiratorna struktura). Registruju se i promene u hodu, držanju i reakciji na manipulisanje, kao i postojanje kloničkih ili toničkih pokreta, šablone u ponašanju (npr. preterano negovanje spoljašnosti, ponovljeno kruženje) ili neobično ponašanje (npr. samoozleđivanje, hodanje unatrag)1.
Oftalmološki pregled, korišćenjem oftalmoskopa ili podjednako odgovarajuće opreme, potrebno je obaviti pre primene ispitivane supstance i po završetku ispitivanja, najbolje kod svih životinja, ali najmanje u grupama koje primaju visoku dozu i kontrolnim grupama. Ukoliko se primete promene na očima, neophodan je pregled svih životinja.
Pri kraju perioda izlaganja, a u svakom slučaju ne ranije od jedanaeste nedelje, obavlja se ocena senzorne reaktivnosti na podražaje različitih vrsta1 (npr. zvučne, vizuelne i proprioceptivne podražaje)2, 3, 4, ocenu jačine stiska5 i ocenu motorne aktivnosti6. Dalje pojedinosti o postupcima navedene su u literaturi. Mogu se primeniti i alternativni postupci različiti od onih iz literature.
Mogu se izostaviti funkcionalna posmatranja koja se obavljaju pri kraju ispitivanja kad postoje podaci o funkcionalnim posmatranjima iz drugih istraživanja, a dnevna klinička posmatranja nisu otkrila nikakve funkcionalne nedostatke.
Izuzetno, funkcionalna posmatranja mogu se izostaviti i kod grupa koje na drugi način pokazuju simptome toksičnosti do mere koja bi znatno ometala obavljanje funkcionalnog ispitivanja.
1.5.2.1. Telesna masa i potrošnja hrane/vode
Sve životinje se mere najmanje jednom nedeljno. Merenje potrošnje hrane potrebno je obavljati najmanje jednom nedeljno. Ukoliko se ispitivana supstanca daje putem vode za piće, meri se i potrošnja vode, i to najmanje na nedeljnom nivou. Potrošnja vode može se razmatrati i u ispitivanjima koja se odnose na ishranu ili prisilno hranjenje tokom kojih može doći do promene u aktivnosti uzimanja tečnosti.
1.5.2.2. Hematologija i medicinska biohemija
Uzorke krvi potrebno je uzeti s navedenog izvora i čuvati pod odgovarajućim uslovima, u zavisnosti od konkretnog slučaja. Na kraju perioda ispitivanja uzorci se prikupljaju neposredno pre ili u okviru postupka lišavanja životinja života na human način.
Na kraju perioda ispitivanja, i uvek kada su u međuvremenu prikupljeni bilo kakvi uzorci krvi, neophodno je obaviti sledeća hematološka ispitivanja: hematokrit, koncentracija hemoglobina, broj eritrocita, ukupni i diferencijalni broj leukocita, broj trombocita i određivanje vremena/potencijala zgrušavanja krvi.
Medicinsko-biohemijska određivanja koja se izvode u cilju istraživanja značajnijih toksičnih efekata u tkivima, odnosno u cilju istraživanja efekata na bubrege i jetru, potrebno je obaviti na uzorcima krvi svake životinje neposredno pre lišavanja života na human način ili u okviru postupka lišavanja života životinja (osim kod životinja koje su umirale i/ili su lišene života na human način). Slično hematološkim ispitivanjima, može se obaviti uzorkovanje u međuvremenu i u svrhu medicinsko-biohemijskih ispitivanja. Preporučuje se uskraćivanje hrane životinjama tokom noći pre uzimanja uzoraka krvi.II Određivanja u plazmi ili serumu obuhvataju: natrijum, kalijum, glukozu, ukupni holesterol, ureu, azot iz uree u krvi (u daljem tekstu: BUN), kreatinin, ukupne proteine i albumin i više od dva enzima indikatora hepatocelularnih efekata (poput alanin aminotransferaze, aspartat aminotransferaze, alkalne fosfataze, gama glutamil transpeptidaze i sorbitol dehidrogenaze). Mogu se obaviti i merenja dodatnih enzima (jetrenog ili drugog porekla) i žučnih kiselina, a koji, pod određenim okolnostima, mogu dati korisne podatke.
Opciono, tokom poslednje nedelje ispitivanja prikupljanjem zapremine urina u ograničenom vremenskom periodu mogu se obaviti sledeća određivanja u okviru analize urina: izgled, volumen, osmolalnost ili specifična težina, pH, proteini, glukoza i krv/krvne ćelije. Potrebno je razmotriti i ispitivanja serumskih markera opštih oštećenja tkiva. Ostala određivanja koja je potrebno obaviti, ukoliko su poznata svojstva ispitivane supstance ili postoji sumnja da utiču na srodne metaboličke profile, obuhvataju kalcijum, fosfor, vrednost triglicerida na prazan želudac, specifične hormone, methemoglobin i holinesteraze. Navedeno je potrebno identifikovati kod hemikalija koje pripadaju određenim kategorijama ili u zavisnosti od slučaja.
Potreban je fleksibilan pristup u zavisnosti od životinjske vrste i primećenih odnosno očekivanih efekata ispitivane supstance.
Ukoliko osnovni podaci ranijih studija ne odgovaraju, razmatra se potreba za utvrđivanjem hematoloških i kliničko biohemijskih parametara pre početka doziranja. Ne preporučuje se utvrđivanje ovih podataka pre tretmana7.
____________
II Kod niza merenja u serumu i plazmi, posebno u slučaju glukoze, preporučuje se uskraćivanje hrane tokom noći. Glavni razlog je činjenica da povećana varijabilnost, koja neizbežno nastaje kao posledica uzimanja hrane, može prikriti nešto suptilnije efekte i otežati tumačenje. S druge strane, gladovanje tokom noći može ometati opšti metabolizam životinja i, posebno u studijama koje se bave ishranom, narušiti dnevno izlaganje ispitivanoj supstanci. Ukoliko se usvoji gladovanje tokom noći, medicinsko-biohemijska ispitivanja izvode se posle obavljanja funkcionalnih ispitivanja.
1.5.2.3. Postmortalni pregled (postmortalni pregled)
Sve životinje obuhvaćene ispitivanjem podvrgavaju se detaljnom postmortalnom pregledu koji uključuje pažljiv pregled spoljne površine tela, svih telesnih otvora i kranijalne, torakalne i abdominalne šupljine i njihovih sadržaja. Sa jetre, bubrega, nadbubrežne žlezde, testisa, epididimisa, uterusa, ovarijuma, grudne žlezde, slezine, mozga i srca svake životinje (osim životinja koje su zatečene na samrti i/ili su interkurentno lišene života na human način) potrebno je odstraniti sva pripadajuća tkiva, zavisno od slučaja, i izmeriti njihovu masu u vlažnom stanju što je pre moguće posle disekcije kako bi se izbeglo isušivanje.
U medijumu za fiksaciju koji je najpogodniji s obzirom na vrstu tkiva i histopatološko ispitivanje koje sledi potrebno je sačuvati sledeća tkiva: sve makro lezije, mozak (reprezentativna područja, uključujući veliki mozak, mali mozak i medulu/most), kičmenu moždinu (na tri nivoa: cervikalnoj regiji, sredini torakalne regije i lumbalnoj regiji), hipofizu, štitnu žlezdu, paratiroidnu žlezdu, grudnu žlezdu, jednjak, pljuvačne žlezde, želudac, tanko i debelo crevo (uključujući Peyerove ploče), jetru, gušteraču, bubrege, nadbubrežne žlezde, slezinu, srce, dušnik i pluća (očuvana naduvavanjem fiksirom i zatim uranjanjem), aortu, polne žlezde, uterus, pomoćne polne organe, ženske mlečne žlezde, prostatu, mokraćnu bešiku, žučnu bešiku (miš), limfne žlezde (najbolje jedna limfna žlezda koja pokriva put kojim se supstanca primenjuje i druga koja je udaljena od puta kojim se supstanca primenjuje kako bi se obuhvatili sistemski efekti), periferne nerve (ishijatični ili tibijalni nerv) najbolje u blizini mišića, uzorak koštane srži (i/ili sveži aspirat koštane srži), kožu i oči (ukoliko su na njima primećene promene tokom oftalmoloških pregleda). Klinički i ostali nalazi mogu da ukažu na potrebu ispitivanja dodatnih tkiva. Potrebno je sačuvati i sve organe za koje postoji verovatnoća da su ciljni organi, a na osnovu poznatih svojstava ispitivane supstance.
1.5.2.4. Histopatologija
Potrebno je obaviti celovitu histopatologiju na sačuvanim organima i tkivima svih životinja u kontrolnim grupama i grupama koje su primale visoke doze. Navedenim ispitivanjima obuhvataju se životinje svih ostalih grupa doziranja, ukoliko su kod grupe koja je primala visoku dozu primećene promene vezane za tretman.
Neophodno je ispitati sve veće lezije.
Ako se koristi prateća grupa, histopatologija se obavlja na tkivima i organima na kojima je primećeno ispoljavanje efekata u tretiranim grupama.
2. PODACI
Podaci se navode pojedinačno, tabelarno, tako što se navode: broj životinja na početku ispitivanja u svakoj ispitivanoj grupi, broj životinja koje su pronađene mrtve tokom ispitivanja ili su lišene života iz humanih razloga, kao i vreme svake smrti ili lišavanja života na human način, broj životinja kod kojih su se pojavili simptomi toksičnosti, opis primećenih simptoma toksičnosti, uključujući vreme njihovog nastupanja, trajanje i ozbiljnost svakog toksičnog efekta, broj životinja kod kojih su se javile lezije, vrsta lezija i procent životinja kod kojih se pojavila svaka vrsta lezija.
Kada odgovara, numerički rezultati se procenjuju pomoću odgovarajuće i opšteprihvaćene statističke metode. Statističke metode i podaci koji se analiziraju biraju se tokom osmišljavanja ispitivanja.
3. IZVEŠTAJ
Izveštaj o ispitivanju sadrži podatke o:
1) Ispitivanoj supstanci:
- fizička svojstva, čistoća i fizička i hemijska svojstva;
- podaci za identifikaciju;
- vehikulum (ukoliko odgovara): razlozi za izbor vehikuluma, ukoliko nije reč o vodi.
2) Vrsti životinja koje se ispituju:
- upotrebljena vrsta i soj;
- broj, starost i pol životinja;
- poreklo, uslovi smeštaja, ishrana, itd.;
- pojedinačna telesna masa životinja na početku ispitivanja.
3) Uslovima ispitivanja:
- logička osnova za izbor nivoa doza;
- detalji o pripremanju ispitivane supstance/pripremanju hrane, postignuta koncentracija, stabilnost i homogenost preparata;
- detalji o načinu primene ispitivane supstance na životinjama;
- stvarne doze (mg/kg TM/dnevno) i faktor preračunavanja koncentracije ispitivane supstance u hrani/vodi za piće (ppm) u stvarnu dozu, ukoliko je primenljivo na konkretan slučaj;
- detalji o kvalitetu hrane i vode.
4) Rezultatima:
- telesna masa i promene u telesnoj masi;
- potrošnja hrane i vode, ako je merodavno;
- podaci o toksičnoj reakciji po polu i nivou doze, uključujući simptome toksičnosti;
- priroda, ozbiljnost i trajanje kliničkih zapažanja (bilo u slučaju prolaznih, bilo neprolaznih efekata);
- rezultati oftalmološkog pregleda;
- ocene senzorne aktivnosti, jačine stiska i motornih aktivnosti (kad je moguće);
- hematološka ispitivanja sa relevantnim osnovnim vrednostima;
- medicinsko biohemijska ispitivanja sa relevantnim osnovnim vrednostima;
- telesna masa po lišavanju života na human način, masa organa i odnos mase organa/TM;
- obdukcioni nalazi;
- detaljan opis svih histopatoloških nalaza;
- podaci o apsorpciji ukoliko postoje;
- statistička obrada rezultata, kada odgovara.
5) Obrazloženju rezultata.
6) Zaključcima.
4. LITERATURA
1. IPCS (1986). Principles and Methods for the Assessment of Neurotoxicity Associated with Exposure to Chemicals. Environmental Health Criteria Document No. 60.
2. Tupper, D.E., Wallace, R.B. (1980). Utility of the Neurologic Examination in Rats. Acta N eurobiol. Exp., 40, 999-1003.
3. Gad, S.C. (1982). A Neuromuscular Screen for Use in Industrial Toxicology. J.Toxicol. Environ. Health, 9, 691-704.
4. Moser, V.C., Mc Daniel, K.M., Phillips, P.M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of Amitraz. Toxicol. Appl. Pharmacol., 108, 267-283.
5. Meyer O.A., Tilson H.A., Byrd W.C., Riley M.T. (1979). A Method for the Routine Assesment of Fore- and Hind- limb grip Strength of Rats and Mice. Neurobehav. Toxivol., 1, 233-236.
6. Crofton K.M., Howard J.L., Moser V.C., Gill M.W., Reiter L.W., Tilson H.A., MacPhail R.C. (1991). Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, 59 9-609.
7. Weingand K., Brown G., Hall R. et al. (1996). "Harmonisation of Animal Clinic Pathology Testing in Toxicity and Safety Studies", Fundam. & Appl. Toxicol., 29, 198-201.
B.27. SUBHRONIČNA ORALNA TOKSIČNOST PONOVLJENIH DOZA - STUDIJA ORALNE TOKSIČNOSTI NA NE-GLODARIMA, 90 DANA
1. METODA ISPITIVANJA
Metoda ispitivanja subhronične oralne toksičnosti zasniva se na Uputstvu za ispitivanje OECD 409 (1998).
1.1. UVOD
Prilikom vrednovanja i ocene toksičnih svojstava hemikalije mogu se odrediti subhronične oralne toksičnosti primenom ponovljenih doza, a nakon što su, na osnovu 28-dnevnih ispitivanja toksičnosti, primenom akutne ili ponovljenih doza, dobijeni početni podaci o toksičnosti. Devedesetodnevno ispitivanje daje podatke o mogućim opasnostima po zdravlje koje verovatno proizilaze iz ponavljane izloženosti tokom perioda ubrzanog rasta i ulaska u mlađe odraslo doba. Ispitivanje daje podatke o značajnijim toksičnim efektima, naznačava ciljne organe i mogućnost kumulacije, i može da pruži procenu nivoa ekspozicije pri kome nisu opaženi neželjeni efekti, a koji se može primeniti prilikom izbora nivoa doze za ispitivanja u kojima se primenjuju hronične doze, kao i prilikom utvrđivanja kriterijuma bezbednosti kod izlaganja ljudi.
Eksperimentalna metoda omogućava prepoznavanje štetnih efekata koji se javljaju kod vrsta koje nisu glodari prilikom izlaganja hemikalijama. Potrebno je ovu metodu koristiti isključivo:
- kad efekti primećeni u drugim ispitivanjima ukazuju na potrebu za razjašnjenjem/ karakterizacijom kod druge vrste koja ne pripada rodu glodara ili
- kada toksikokinetička ispitivanja pokazuju da je korišćenje specifične vrste ne-glodara najrelevantniji izbor laboratorijske životinje ili
- u slučajevima kad ostali specifični razlozi opravdavaju upotrebu određene vrste ne-glodara.
Videti Opšti uvod.
1.2. DEFINICIJE
Doza jeste količina ispitivane supstance koja se primenjuje. Doza se izražava kao masa (g, mg) ili kao masa ispitivane supstance po jedinici telesne mase eksperimentalne životinje (npr. mg/kg) ili u obliku konstantnih prehrambenih koncentracija (ppm).
Doziranje jeste opšti pojam koji obuhvata dozu, njenu učestalost i vremensko trajanje doziranja.
NOAEL jeste skraćenica za nivo na kojem nisu opaženi neželjeni efekti i predstavlja najviši nivo doze pri kojoj ne postoje nikakvi štetni nalazi vezani za tretman.
1.3. PRINCIP METODE
Ispitivana supstanca primenjuje se dnevno oralnim putem i u progresivnim dozama kod nekoliko grupa eksperimentalnih životinja, i to jedan dozni nivo po grupi tokom 90 dana. Tokom perioda primene životinje se pažljivo posmatraju zbog uočavanja simptoma toksičnosti. Na životinjama koje uginu ili budu lišene života na human način tokom ispitivanja obavlja se postmortalni pregled, dok se, po zaključenju ispitivanja, preživele životinje takođe lišavaju života na human način i postmortalno pregledaju.
1.4. OPIS METODE
1.4.1. Izbor životinjske vrste
Najčešće korišćena vrsta ne-glodara je pas koji treba da bude određene pasmine. Često se koristi bigl (kratkonogi pas zečar). Ostale vrste, poput svinja i patuljastih svinja takođe se mogu koristiti. Korišćenje primata se ne preporučuje i njihova primena se opravdava. Neophodno je koristiti mlade zdrave životinje. U slučaju pasa s doziranjem je najbolje započeti pri starosti od 4 do 6 meseci i ne kasnije od 9 meseci starosti. Kad se istraživanje obavlja kao preliminarno, pre dugotrajnog ispitivanja hronične toksičnosti, u oba ispitivanja se upotrebljava ista vrsta/pasmina životinja.
1.4.2. Priprema životinja
Prilikom ispitivanja obavezno se koriste zdrave mlade životinje koje su se aklimatizovale na laboratorijske uslove i koje nisu bile predmet prethodnih eksperimentalnih postupaka. Trajanje aklimatizacije zavisi od odabrane eksperimentalne životinjske vrste i njenog porekla. Preporučuje se aklimatizacija u trajanju od najmanje pet dana za pse ili svinje uzgojene u tu svrhu, a koje pripadaju koloniji životinja trajno smeštenoj na lokaciji ispitivanja, i najmanje dve nedelje za iste životinje ukoliko potiču iz spoljašnjih izvora. Eksperimentalne životinje se označavaju s obzirom na njihovu vrstu, soj, poreklo, pol, težinu i/ili starost. Životinje se nasumično dodeljuju kontrolnim grupama i grupama koje se tretiraju. Kavezi su razmešteni na način kojim će mogući efekti koji proizlaze iz položaja kaveza biti svedeni na najmanju moguću meru. Svakoj životinji se dodeljuje jedinstveni identifikacioni broj.
1.4.3. Priprema doza
Ispitivana supstanca se daje putem hrane ili vode za piće, prisilnim hranjenjem (putem intubacijske cevi) ili u obliku kapsula. Metoda oralne primene zavisi od svrhe ispitivanja, kao i od fizičkih i hemijskih svojstava ispitivane supstance.
Kada je potrebno, ispitivana supstanca se rastvara ili suspenduje u odgovarajućem medijumu. Preporučuje se da se, kad god je moguće, uzme u obzir primena vodenog rastvora/suspenzije, posle čega se razmatraju rastvori/emulzije u ulju (npr. kukuruzno ulje), a tek posle toga moguće rastvaranje u ostalim vehikulumima. Za sve vehikulume, osim vode, moraju biti poznata toksična svojstva. Neophodno je utvrditi stabilnost ispitivane supstance u uslovima primene.
1.5. POSTUPAK
1.5.1. Broj i pol životinja
Prilikom ispitivanje svake doze upotrebljava se najmanje osam životinja (četiri ženke i četiri mužjaka). Ukoliko se u međuvremenu planira lišavanje života na human način, broj je potrebno povećati za broj životinja čije se lišavanje života planira pre zaključenja ispitivanja. Broj životinja na kraju ispitivanja odgovara za značajno vrednovanje toksičnih efekata. Na osnovu prethodnog znanja o supstanci ili njenom bliskom analogu, potrebno je uzeti u obzir uključivanje dodatne prateće grupe od osam životinja (četiri po polu) u kontrolnu grupu i grupu koja prima najvišu dozu, a zbog praćenja prolaznosti (reverzibilnosti) ili postojanosti bilo kog od toksičnih efekata po isteku perioda tretiranja. Trajanje ovoga perioda posle tretiranja utvrđuje se u skladu sa opaženim efektima.
1.5.2. Doziranje
Upotrebljava se najmanje tri nivoa doze i istovremena kontrola, osim u slučajevima kada se obavlja ispitivanje granične doze (videti odeljak 1.5.3. ove metode). Nivoi doze mogu se zasnivati na rezultatima ispitivanja s ponovljenom dozom ili na rezultatima ispitivanja namenjenog utvrđivanju raspona. Uzimaju se u obzir svi postojeći toksikološki i toksikokinetički podaci koji postoje za ispitivano jedinjenje ili srodne materije. Osim ukoliko nije ograničena fizičkom i hemijskom prirodom ili biološkim efektima ispitivane supstance, najviša doza se bira sa ciljem da izazove toksičnost, ali ne smrt ili ozbiljne tegobe. Opadajući niz doza bira se s namerom da se dokažu bilo kakve reakcije povezane sa doziranjem, kao i nivoa pri kome se ne opažaju neželjeni efekti (NOAEL) pri najnižoj dozi. Dvostruki intervali, pa sve do četvorostrukih, najčešće su optimalni za uspostavljanje silaznih doza, dok je dodavanje četvrte eksperimentalne grupe često preporučljivije od korišćenja vrlo velikih intervala između doziranja.
Kontrolna grupa je ona koja se ne tretira ili kontrolna grupa koja se tretira samo vehikulumom ukoliko se isti koristi prilikom davanja ispitivane supstance. Izuzev načina tretiranja ispitivanom supstancom, sa životinjama u kontrolnoj grupi potrebno je postupati na način kao i sa eksperimentalnim grupama. Ukoliko se koristi vehikulum, kontrolna grupa dobija vehikulum u najvišoj količini koja se primenjuje. Ukoliko se ispitivana supstanca daje zajedno s hranom i uzrokuje smanjen unos hrane tada, u razlikovanju smanjenog unosa uzrokovanog ukusom ili toksikološkim promenama kod eksperimentalnog modela, može biti od koristi paralelno hranjena kontrolna grupa.
Uzimaju se u obzir sledeća svojstva vehikuluma i ostalih dodataka, u zavisnosti od slučaja: delovanje na apsorpciju, raspodelu, metabolizam ili zadržavanje ispitivane supstance; dejstvo na hemijska svojstva ispitivane supstance koje može promeniti njena toksična svojstva i delovanje na potrošnju hrane i vode ili stanje uhranjenosti životinja.
1.5.3. Ispitivanje granične doze
Ukoliko prilikom ispitivanja sa jednim nivoom doze, koja je najmanje jednaka nivou od 1.000 mg/kg TM/dnevno, u eksperimentu u kome se koriste postupci opisani za ovo ispitivanje, ne nastanu nikakvi štetni efekti i ukoliko se toksičnost ne očekuje na osnovu podataka o strukturno srodnim supstancama, ne smatra se neophodnim celokupno ispitivanje koje primenjuje tri nivoa doziranja. Ispitivanje granične doze se ne primenjuje samo u slučajevima kada izloženost ljudi ukazuje na potrebu za primenom veće doze.
1.5.4. Primena doza
Ispitivana supstanca se životinjama daje svakodnevno, sedam dana nedeljno tokom perioda od 90 dana. Bilo koji drugi režim doziranja, na primer, pet dana nedeljno, potrebno je opravdati. Kada se ispitivana supstanca primenjuje putem intubacijske cevi (prisilno hranjenje), životinjama koje koriste želudačnu cev ili odgovarajuću intubacionu kanilu, potrebno je dati u obliku jedne doze. Maksimalna zapremina tečnosti koja se može dati odjednom zavisi od veličine eksperimentalne životinje. Neophodno je držati zapreminu na najnižem mogućem nivou. Izuzev u slučaju iritabilnih ili korozivnih supstanci kod kojih se obično lošiji efekti pokazuju pri višim koncentracijama, varijabilnost eksperimentalne zapremine se svodi na najmanju moguću meru prilagođavanjem koncentracije, a kako bi se osigurala konstantna zapremina pri svim nivoima doza.
Kod supstance koje se daju putem hrane ili vode za piće važno je obezbediti da količine ispitivane supstance o kojoj je reč ne ometaju redovnu ishranu i ravnotežu vode. Kad se ispitivana supstanca primenjuje hranom, može se primeniti konstantna prehrambena koncentracija (ppm) ili konstantna doza u odnosu na telesnu masu životinje. Alternativa koja se koristi se označava. U slučaju supstance koja se daje prisilnim hranjenjem (intubacijskom cevi) ili u obliku kapsula, dozu je potrebno dati svaki dan u isto vreme i po potrebi prilagoditi kako bi se održala konstantna doza u odnosu na telesnu masu životinje. Kad se 90-dnevno ispitivanje koristi kao preliminarno ispitivanje dugotrajnog ispitivanja hronične toksičnosti, preporučljivo je u oba ispitivanja primeniti sličan način ishrane.
1.5.5. Opažanja
Posmatranje traje najmanje 90 dana. Životinje u pratećoj grupi za koje se planiraju dodatna praćenja potrebno je, odgovarajuće vreme, držati bez tretmana, a kako bi se otkrila postojanost ili oporavak od toksičnih efekata.
Opšti klinički pregled se obavlja najmanje jednom dnevno, najbolje u isto vreme svakog dana, uzimajući u obzir najznačajniji period u kome se očekuje pojava efekata posle doziranja. Neophodno je zabeležiti kliničko stanje životinja. Najmanje dvaput dnevno, obično početkom i krajem svakog dana, sve životinje se proveravaju na simptome morbiditeta i mortaliteta.
Najmanje jednom pre prvog izlaganja (kako bi se omogućilo poređenje kod istih ispitanika) i jednom nedeljno posle toga, potrebno je detaljno kliničko praćenje stanja svih životinja. Navedena opažanja, kad je to praktično, potrebno je obaviti izvan kaveza u kojem životinja inače boravi, najbolje u standardnom okruženju i svaki put u slično vreme. Neophodno je uložiti određeni napor kako bi se garantovalo da su odstupanja u uslovima posmatranja minimalna. Simptomi toksičnosti pažljivo se registruju, uključujući vreme njihovog nastupanja, stepen i trajanje. Opažanja obuhvataju, ali nisu ograničena na: promene na koži, krznu, očima, mukoznim membranama, nastanak sekrecija i izlučevina i autonomnu aktivnost (npr. suzenje, piloerekcija - podizanje dlake, veličina zenica, neobična respiratorna struktura). Potrebno je registrovati i promene u hodu, držanju i reakciji na manipulisanje, kao i postojanje kloničkih ili toničkih pokreta i šablona u ponašanju (npr. preterano negovanje spoljašnosti, ponovljeno kruženje) ili neobično ponašanje.
Oftalmološki pregled, korišćenjem oftalmoskopa ili odgovarajuće opreme, obavlja se pre davanja ispitivane supstance i posle završetka ispitivanja, najbolje kod svih životinja ili bar u grupama koje primaju visoku dozu i u kontrolnim grupama. Ukoliko se primete promene na očima, neophodan je pregled svih životinja.
1.5.5.1. Telesna masa i potrošnja hrane/vode
Sve životinje se mere najmanje jednom nedeljno. Merenje potrošnje hrane obavlja se najmanje jednom nedeljno. Ukoliko se ispitivana supstanca daje zajedno sa vodom za piće, meri se i potrošnja vode, i to najmanje na nedeljnom nivou. Potrošnja vode može da se uzme u obzir i u ispitivanjima koja se odnose na ishranu ili prisilno hranjenje tokom kojih može doći do promene u aktivnosti uzimanja tečnosti.
1.5.5.2. Hematologija i medicinska biohemija
Uzorke krvi potrebno je uzeti sa navedenog mesta i čuvati u odgovarajućim uslovima, u zavisnosti od konkretnog slučaja. Na kraju perioda ispitivanja uzorci se prikupljaju neposredno pre ili prilikom postupka lišavanja životinja života na human način.
Na početku ispitivanja, zatim u mesečnim intervalima ili na sredini ispitivanja i na kraju ispitivanja, obavezno je hematološko ispitivanje, uključujući, hematokrit, koncentraciju hemoglobina, broj eritrocita, ukupni i diferencijalni broj leukocita, broj trombocita i merenje potencijala zgrušavanja, poput vremena zgrušavanja, protrombinskog vremena ili tromboplastinskog vremena.
Određivanja iz područja medicinske biohemije s ciljem istraživanja značajnijih toksičnih efekata u tkivima, odnosno efekta na bubrege i jetru, potrebno je obaviti na uzorcima krvi dobijenim od svake životinje na početku, zatim u mesečnim intervalima ili na sredini ispitivanja i na kraju ispitivanja. Područja ispitivanja koja je potrebno uzeti u obzir obuhvataju ravnotežu elektrolita, metabolizam ugljenih hidrata i funkciju jetre i bubrega. Na izbor specifičnih ispitivanja utiču zapažanja o načinu delovanja ispitivane supstance. Preporučuje se gladovanje kod životinja pre uzimanja uzoraka krvi tokom vremenskog perioda koje odgovara pojedinoj životinjskoj vrsti. Preporučena određivanja obuhvataju utvrđivanje: nivoa kalcijuma, fosfora, hlorida, natrijuma, kalijuma, vrednosti glukoze na prazan želudac, alanin aminotransferaze, aspartat aminotransferaze, ornitin dekarboksilaze, gama glutamil transpeptidaze, azota iz uree, albumina, kreatinina u krvi i merenje ukupnog bilirubina i ukupnih proteina u serumu.
Analize mokraće potrebno je izvesti najmanje na početku, zatim na sredini i na kraju ispitivanja, prikupljanjem zapremine mokraće u odgovarajućem vremenskom periodu. Analiza mokraće obuhvata izgled, volumen, osmolalnost i specifičnu težinu, pH, proteine, glukozu i krv/krvne ćelije. Mogu se primeniti i dodatni parametri u slučajevima kad je potrebno proširiti ispitivanje primećenih efekata.
Potrebno je razmotriti i ispitivanja namenjena istraživanju serumskih markera opštih tkivnih oštećenja. Ostala opažanja koja mogu biti potrebna zbog donošenja odgovarajuće toksikološke ocene obuhvataju: analizu lipida, hormona, acido-bazne ravnoteže, methemoglobina i inhibicije holinesteraze.
Dopušteno je dodatno koristiti analize medicinske biohemije kada je potrebno proširiti ispitivanje zapaženih efekata. Navedene efekte je potrebno identifikovati kod hemikalija koje pripadaju određenim kategorijama opasnosti ili u zavisnosti od konkretnog slučaja.
Potreban je fleksibilan pristup, u zavisnosti od životinjske vrste i zapaženih odnosno očekivanih efekata ispitivane supstance.
1.5.5.3. Postmortalni pregled (makro-nekropsija)
Sve životinje obuhvaćene ispitivanjem podvrgavaju se detaljnom postmortalnom pregledu koji uključuje pažljiv pregled spoljnje površine tela, svih telesnih otvora i kranijalne, torakalne i abdominalne šupljine i njihovih sadržaja. Sa jetre sa žučnom kesicom, bubrega, nadbubrežne žlezde, testisa, epididimisa, ovarijuma, uterusa, štitne žlezde (sa paratiroidnim žlezdama), grudne žlezde, slezine, mozga i srca svake životinje (osim životinja koje su zatečene na umiranju i/ili su lišene života na human način) potrebno je odstraniti sva pripadajuća tkiva, u zavisnosti od slučaja, izmeriti njihovu težinu u vlažnom stanju što je pre moguće posle disekcije kako bi se izbeglo isušivanje.
U medijumu fiksacije koji je najprikladniji s obzirom na vrstu tkiva i histopatološko ispitivanje koje sledi potrebno je sačuvati sledeća tkiva: sve makro lezije, mozak (reprezentativna područja, uključujući veliki mozak, mali mozak i medulu/most), kičmenu moždinu (na tri nivoa: cervikalnoj regiji, sredini torakalne regije i lumbalnoj regiji), hipofizu, oči, štitnu žlezdu, paratiroidnu žlezdu, grudnu žlezdu, jednjak, pljuvačne žlezde, želudac, tanko i debelo crevo (uključujući Peyerove ploče), jetru, žučnu kesu, pankreas, bubrege, nadbubrežne žlezde, slezinu, srce, dušnik i pluća, aortu, polne žlezde, uterus, pomoćne polne organe, ženske mlečne žlezde, prostatu, mokraćnu bešiku, limfne žlezde (najbolje jedna limfna žlezda koja pokriva put primene supstance i druga koja je udaljena od puta kojim se supstanca primenjuje kako bi se njome obuhvatili sistemski efekti), periferne živce (ishijatični ili tibijalni živac) najbolje u blizini mišića, uzorak koštane srži (i/ili sveži aspirat koštane srži) i kožu. Klinički i ostali nalazi mogu da ukažu na potrebu ispitivanja dodatnih tkiva. Potrebno je sačuvati i sve organe za koje postoji verovatnoća da su ciljni organi, a na osnovu poznatih svojstava ispitivane supstance.
1.5.5.4. Histopatologija
Potrebno je obaviti celovitu histopatologiju na sačuvanim organima i tkivima, bar svih životinja u kontrolnim grupama i grupama koje su primale visoke doze. Navedenim ispitivanjima obuhvataju se životinje svih ostalih grupa doziranja, a ukoliko kod grupe koja je primala visoku dozu budu primećene promene vezane za tretman.
Ispituju se sve makro-lezije.
Ako se koristi prateća grupa, histopatologija se obavlja na tkivima i organima za koja je zaključeno da se na njima pokazuju efekti u tretiranim grupama.
2. PODACI
Neophodno je navesti podatke koji se odnose na pojedinačne životinje. Podaci se navode tabelarno i prikazuju: broj životinja na početku ispitivanja u svakoj eksperimentalnoj grupi, broj životinja koje su pronađene mrtve tokom ispitivanja ili su lišene života iz humanih razloga, kao i vreme svake smrti ili lišavanja života na human način, broj životinja kod kojih su se pojavili simptomi toksičnosti, opis zapaženih simptoma toksičnosti, uključujući vreme njihovog nastupanja, trajanje i ozbiljnost svakog toksičnog efekta, broj životinja kod kojih su se javile lezije, vrsta lezija i procenat životinja kod kojih se pojavila svaka pojedina vrsta lezija.
Kada je moguće, numerički rezultati se procenjuju pomoću odgovarajuće i opšteprihvaćene statističke metode. Statističke metode i podaci koji se analiziraju biraju se tokom osmišljavanja ispitivanja.
3. IZVEŠTAJ
Izveštaj o ispitivanju sadrži podatke o:
1) Ispitivanoj supstanci:
- fizička svojstva, čistoća i fizička i hemijska svojstva;
- podaci za identifikaciju;
- vehikulum (ukoliko odgovara): razlozi za izbor vehikuluma, ukoliko nije reč o vodi.
2) Eksperimentalnoj životinjskoj vrsti:
- upotrebljena vrsta i soj;
- broj, starost i pol životinja;
- poreklo, uslovi smeštaja, ishrana, itd.;
- pojedinačna telesna masa životinja na početku ispitivanja.
3) Uslovima ispitivanja:
- logička osnova za izbor nivoa doze;
- detalji o pripremanju ispitivane supstance/pripremanju hrane, postignuta koncentracija, stabilnost i homogenost preparata;
- detalji o načinu primene ispitivane supstance na životinjama;
- stvarne doze (mg/kg TM/dnevno) i faktor preračunavanja koncentracije ispitivane supstance u hrani/vodi za piće (ppm) u stvarnu dozu, ukoliko je primenljivo na konkretan slučaj;
- detalji o kvalitetu hrane i vode.
4) Rezultatima:
- telesna masa i promene u telesnoj masi;
- potrošnja hrane i vode, ako je bitno;
- podaci o toksičnom efektu po polu i nivou doze, uključujući simptome toksičnosti;
- svojstva, tačnost i trajanje kliničkih posmatranja (bilo u slučaju reverzibilnih, bilo ireverzibilnih efekata);
- oftalmološki pregled;
- hematološka ispitivanja s relevantnim osnovnim vrednostima;
- medicinsko-biohemijska ispitivanja sa relevantnim osnovnim vrednostima;
- telesna masa po lišavanju života na human način, težine organa i odnosi težine organa/TM;
- obdukcioni nalazi;
- detaljan opis svih histopatoloških nalaza;
- podaci o apsorpciji ukoliko postoje;
- statistička obrada rezultata, kada odgovara.
5) Obrazloženju rezultata.
6) Zaključcima.
B.28. SUBHRONIČNA DERMALNA TOKSIČNOST - STUDIJA PONOVLJENIH DERMALNIH DOZA NA GLODARIMA, 90 DANA
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod.
1.2. DEFINICIJE
Videti Opšti uvod.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Ispitivana supstanca se svakodnevno i u progresivnim dozama nanosi na kožu nekoliko grupa eksperimentalnih životinja i to jedna doza po grupi tokom 90 dana. Tokom perioda primene životinje se svakodnevno posmatraju zbog uočavanja simptoma toksičnosti. Na životinjama koje uginu tokom ispitivanja obavlja se postmortalni pregled, dok se, po zaključenju ispitivanja, preživele životinje takođe lišavaju života na human način i postmortalno pregledaju.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE
1.6.1. Priprema
Životinje se drže u uslovima eksperimentalnog smeštaja i ishrane tokom najmanje pet dana pre ispitivanja. Pre ispitivanja, zdrave i mlade životinje se slučajnim izborom biraju i dodeljuju tretiranim i kontrolnim grupama. S leđnog dela trupa eksperimentalnih životinja neposredno pre ispitivanja ošiša se krzno. Moguće je brijanje, ali je potrebno obaviti ga oko 24 sata pre ispitivanja. Šišanje ili brijanje obično je potrebno ponoviti svake nedelje. Prilikom šišanja ili brijanja krzna ne treba oštetiti kožu. Za primenu supstance koja se ispituje potrebno je ukloniti krzno s najmanje 10% površine tela. Prilikom odlučivanja o veličini površine tela sa koje je potrebno ukloniti krzno i o dimenzijama prekrivanja supstancom koja se ispituje uzima se u obzir telesna masa životinje. Kad se ispituju čvrste supstance, koje se, ukoliko odgovara, mogu i pulverizovati, supstancu koja se ispituje potrebno je dovoljno navlažiti vodom ili, kada je neophodno, odgovarajućim vehikulumom, kako bi se obezbedio kvalitetan kontakt s kožom. Tečne supstance koje se ispituju obično se koriste nerazblažene. Primenjuje se režim svakodnevne primene tokom perioda od pet do sedam dana nedeljno.
1.6.2. Uslovi ispitivanja
1.6.2.1. Eksperimentalne životinje
Upotrebljavaju se odrasli pacovi, zečevi ili zamorci. Mogu se upotrebiti i ostale životinjske vrste, s tim da je potrebno da njihova primena bude opravdana. Prilikom započinjanja ispitivanja raspon odstupanja u telesnoj masi treba da bude ± 20% prosečne telesne mase. Kada se ispitivanje subhronične dermalne toksičnosti obavlja kao preliminarno, pre dugotrajnog ispitivanja, u oba ispitivanja se upotrebljavaju životinje iste vrste i istog soja.
1.6.2.2. Broj i pol
Prilikom ispitivanja svakog nivoa doze upotrebljava se najmanje 20 životinja (deset ženki i deset mužjaka) zdrave kože. Biraju se ženke koje nisu ranije rađale i koje nisu gravidne. Ukoliko se u međuvremenu planira lišavanje života na human način, broj je potrebno povećati za broj životinja čije se lišavanje života planira pre zaključenja ispitivanja. Može da se uključi i prateća grupa od 20 životinja (10 po polu) kod kojih se primenjuje visok dozni nivo tokom 90 dana i prati prolaznost (reverzibilnost), postojanost ili odložena pojava toksičnih efekata tokom perioda od 28 dana po isteku perioda tretiranja.
1.6.2.3. Dozni nivoi
Upotrebljava se najmanje tri nivoa doze na kontrolnom uzorku i uzorku namenjenom kontroli vehikuluma, ukoliko se primenjuje vehikulum. Vreme izlaganja je najmanje šest sati dnevno. Eksperimentalna supstanca se primenjuje u isto vreme svakog dana, a količina supstance koja se primenjuje periodično se prilagođava (nedeljno ili dvonedeljno) s ciljem održavanja konstantnog nivoa doze s obzirom na telesnu masu životinje. Izuzev tretiranja ispitivanom supstancom, sa životinjama u kontrolnoj grupi postupa se na isti način kao s ispitanicima u eksperimentalnim grupama. Kada se zbog lakšeg doziranja koristi vehikulum, kontrolna grupa namenjena kontroli vehikuluma dozira se na isti način kao i tretirane grupe i prima količinu vehikuluma jednaku onoj koju prima grupa s najvišim nivoom doze. Najviši dozni nivo treba da dovede do toksičnih efekata, dok smrtnih posledica ne treba da bude ili njihov broj treba da bude zanemarljiv. Najniži dozni nivo ne sme da proizvede bilo kakve dokaze toksičnosti. U situacijama kad postoji primenljiva procena nivoa izloženosti ljudi ispitivanoj supstanci, najniži dozni nivo treba da premašuje navedeni nivo. U idealnom slučaju, srednji dozni nivo treba da dovede do minimalnih vidljivih toksičnih efekata. Ukoliko se koristi više od jedne srednje doze, dozni nivoi treba da budu raspoređeni na način koji za posledicu ima gradaciju toksičnih efekata. U nižim srednjim grupama, kao i u kontrolnim grupama, incidenca smrtnih posledica treba da bude niska, kako bi se omogućila pravilna procena rezultata.
Ukoliko primena supstance koja se ispituje za posledicu ima ozbiljnu iritaciju kože, potrebno je smanjiti koncentraciju, što može dovesti do smanjenja ili nejavljanja ostalih toksičnih efekata pri najvišem nivou doze. Ukoliko je koža teško oštećena može da bude neophodno da se prekine ispitivanje i da se organizuje novo ispitivanje uz korišćenje nižih koncentracija.
1.6.2.4. Ispitivanje granične doze
Ukoliko prilikom preliminarnog ispitivanja sa nivoom doze od 1.000 mg/kg ili višom dozom koja je povezana s mogućom izloženosti ljudi kada je ista poznata, ne nastanu nikakvi toksični efekti, dalje ispitivanje se možda neće smatrati neophodnim.
1.6.2.5. Period posmatranja
Eksperimentalne životinje se svakodnevno posmatraju da bi se uočili simptomi toksičnosti. Neophodno je zabeležiti vreme smrti i vreme u koje su se pojavili ili nestali simptomi toksičnosti.
1.6.3. Postupak
Životinje se pojedinačno smeštaju u kaveze. U idealnom slučaju životinje se ispitivanom supstancom tretiraju sedam dana nedeljno, tokom perioda od 90 dana.
Životinje u bilo kojoj pratećoj grupi, za koje je planirano naknadno posmatranje posle završetka ispitivanja, drže se bez tretmana narednih 28 dana kako bi se otkrio oporavak od ili postojanost toksičnih efekata. Vreme izlaganja je šest sati dnevno.
Ispitivana supstanca se ravnomerno nanosi na područje čija veličina iznosi oko 10% ukupne površine tela. Kad su u pitanju visoko toksične supstance, površinsko područje koje se prekriva može biti manje, ali je potrebno što više navedenog područja prekriti što tanjim i ravnomernijim slojem.
Tokom izlaganja ispitivana supstanca se održava u kontaktu s kožom pomoću poroznog zavoja od gaze i samolepive trake koja ne nadražuje kožu. Područje kože na kojem se ispitivanje obavlja se, na odgovarajući način, dodatno prekriva, kako bi se sačuvao povoj i ispitivana supstanca i kako bi se obezbedilo da životinje ne mogu da progutaju ispitivanu supstancu. Dozvoljeno je delimično imobilisati životinje kako bi se sprečilo gutanje ispitivane supstance, ali se ne preporučuje potpuna imobilizacija.
Po isteku perioda izlaganja potrebno je, kad je moguće, ukloniti ostatke ispitivane supstance korišćenjem vode ili neke druge odgovarajuće metode čišćenja kože.
Sve životinje se svakodnevno prate i beleže se simptomi toksičnosti, uključujući vreme njihovog nastupanja, stepen i trajanje. Opažanja tokom boravka životinja u kavezima obuhvataju: promene na koži i krznu, očima, mukoznim membranama, kao i praćenje respiratornog, cirkulatornog, autonomnog i centralnog nervnog sistema i somatomotorne aktivnosti i obrazaca ponašanja. Potrebno je meriti konzumiranje hrane i telesnu masu životinja na nedeljnom nivou. Neophodno je redovno posmatranje životinja kako bi se obezbedilo da ne dođe do gubitka životinja zbog kanibalizma, autolize tkiva ili pogrešnog smeštanja. Po završetku ispitivanja na svim preživelim ispitanicima u ne-pratećim tretiranim grupama obavlja se postmortalni pregled. Životinje na samrti potrebno je ukloniti i obdukovati.
Na svim životinjama, uključujući kontrolne, obično se obavljaju sledeća ispitivanja:
a) Oftalmološki pregled, korišćenjem oftalmoskopa ili podjednako pogodne opreme potrebno je obaviti pre izlaganja ispitivanoj supstanci i po završetku ispitivanja, najbolje kod svih životinja, ali bar u grupama koje primaju visoku dozu i kontrolnim grupama. Ukoliko se zapaze promene na očima, neophodan je pregled svih životinja.
b) Hematološka ispitivanja, koja uključuju hematokrit, koncentraciju hemoglobina, broj eritrocita, ukupni i diferencijalni broj leukocita i procenu potencijala zgrušavanja, kao što je vreme zgrušavanja, protrombinsko vreme ili tromboplastinsko vreme ili broja trombocita potrebno je obaviti na kraju perioda ispitivanja.
v) Određivanja u oblasti medicinske biohemije potrebno je obaviti na kraju perioda ispitivanja. Oblasti koje se smatraju odgovarajućim za sva ispitivanja obuhvataju ravnotežu elektrolita, metabolizam ugljenih hidrata i funkciju jetre i bubrega. Na izbor specifičnih ispitivanja utiču opažanja o načinu delovanja supstance. Predlaže se utvrđivanje nivoa kalcijuma, fosfora, hlorida, natrijuma, kalijuma, glukoze na prazan želudac (uz primenu perioda gladovanja koje je odgovarajuće za određenu životinjsku vrstu), serumske glutamat piruvat transaminazeIII, serumske glutamat oksaloacetat transaminazeIV, ornitin dekarboksilaze, gama glutamil transpeptidaze, azota iz uree, albumina, kreatinina u krvi, ukupnog bilirubina i ukupnih proteina u serumu.
Ostali nalazi koji mogu biti potrebni zbog odgovarajuće toksikološke procene obuhvataju: analizu lipida, hormona, acidno-bazne ravnoteže, methemoglobina i aktivnosti holinesteraze. Može se primeniti dodatna medicinska biohemija kada je to potrebno zbog proširivanja istraživanja zapaženih efekata.
g) Pregled urina nije deo uobičajene prakse, nego se traži tek onda kada za to postoji indikacija na osnovu očekivane ili zapažene toksičnosti.
Ukoliko osnovni podaci prethodnih istraživanja ne odgovaraju, potrebno je razmotriti da li je neophodno da se pre početka doziranja utvrde parametri hematologije i kliničke biohemije.
___________
III Sada poznat kao serumska alanin aminotransferaza.
IV Sada poznat kao serumska aspartat aminotransferaza
1.6.3.1. Postmortalni pregled (makro-nekropsija)
Sve životinje obuhvaćene ispitivanjem podvrgavaju se detaljnom postmortalnom pregledu koji uključuje pregled spoljne površine tela, svih telesnih otvora i kranijalne, torakalne i abdominalne šupljine i njihovih sadržaja. Jetra, bubrezi, nadbubrežne žlezde i testisi se mere što je pre moguće posle disekcije kako bi se izbeglo isušivanje.
U odgovarajućem medijumu zbog mogućeg kasnijeg histopatološkog ispitivanja potrebno je sačuvati sledeće organe i tkiva: sve makro lezije, mozak - uključujući delove medule/ponsa, kore malog mozga i moždane kore, hipofizu, štitinu/štitastu žlezdu i tkivo grudne žlezde, (dušnik), pluća, srce, aortu, pljuvačne žlezde, jetru, slezinu, bubrege, nadbubrežne žlezde, pankreas, polne žlezde, uterus, pomoćne polne organe, žučnu kesu (ukoliko postoji), jednjak, želudac, duodenum, tanko crevo, slepo crevo, debelo crevo, mokraćnu bešiku, reprezentativni limfni čvor (ženska mlečna žlezda), (muskulaturu bedra), periferni živac, (oči), (grudnu kost s koštanom srži), (bedrenu kost - uključujući površinu zgloba), (kičmenu moždinu na tri nivoa-cervikalni, srednjetorakalni i lumbalni) i (eksorbitalne suzne žlezde). Tkiva navedena u zagradama pregledaju se samo ukoliko na to ukazuju simptomi toksičnosti ili ako su u pitanju ciljni organi.
1.6.3.2. Histopatološki pregled
a) Detaljnu histopatologiju neophodno je obaviti na normalnoj i tretiranoj koži i na organima i tkivima životinja u kontrolnim grupama i grupama koje su tretirane visokim dozama.
b) Neophodan je pregled svih makro-lezija.
v) Pregledaju se ciljni organi u grupama koje su primale ostale doze.
g) Kada se koriste pacovi, pluća životinja u grupama tretiranim niskim i srednjim dozama se podvrgavaju histopatološkom pregledu zbog pronalaženja dokaza o infekciji, s obzirom da se time dolazi do pravilne ocene zdravstvenog stanja životinja. Može se desiti da se dalji histopatološki pregledi ne obavljaju rutinski na životinjama u navedenim grupama, ali se uvek sprovode na organima na kojima postoje dokazi lezija u visoko doziranoj grupi.
d) Ako se koristi prateća grupa, histopatologija se obavlja na tkivima i organima za koje je utvrđeno da se na njima pokazuju efekti u ostalim tretiranim grupama.
2. PODACI
Podaci se navode tabelarno i prikazuju: broj životinja na početku ispitivanja u svakoj eksperimentalnoj grupi, broj životinja kod kojih su se pojavile lezije, vrstu lezija i procenat životinja kod kojih se pojavila svaka pojedina vrsta lezija.
Rezultati se procenjuju pomoću odgovarajuće statističke metode i može se primeniti bilo koja priznata statistička metoda.
3. IZVEŠTAJ
3.1. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju, ukoliko je moguće, sadrži podatke o:
- životinjskoj vrsti, soju, poreklu, uslovima okoline, ishrani;
- uslovima ispitivanja;
- nivoima doza (uključujući vehikulum ukoliko se koristi) i koncentracije;
- toksičnom efektu prema polu i dozi;
- nivou na kome nisu opaženi bilo kakvi efekti, kada je to moguće;
- vremenu smrti tokom ispitivanja ili podatke da li su životinje preživele do usmrćenja;
- opisu toksičnih i ostalih efekata;
- vremenu zapažanja svakog patološkog znaka i njegov kasniji tok;
- hrani i telesnoj masi;
- oftalmološkim nalazima;
- primenjenim hematološkim ispitivanjima i svim rezultatima;
- primenjenim ispitivanjima medicinske biohemije i svim rezultatima (uključujući rezultate svakog pregleda mokraće);
- nalazima obdukcije;
- detaljnom opisu svih histopatoloških nalaza;
- statističkoj obradi rezultata kada je moguće;
- obrazloženju rezultata;
- tumačenju rezultata.
3.2. PROCENA I TUMAČENJE REZULTATA
Videti Opšti uvod.
4. LITERATURA
Videti Opšti uvod.
B.29. SUBHRONIČNA INHALACIONA TOKSIČNOST - STUDIJA PONOVLJENIH INHALACIONIH DOZA NA GLODARIMA, 90 DANA
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod.
1.2. DEFINICIJE
Videti Opšti uvod.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Nekoliko grupa eksperimentalnih životinja izlaže se određeno vreme svakodnevno supstanci koja se ispituje u rastućim koncentracijama, pri čemu se na jednu grupu primenjuje jedna koncentracija u trajanju od 90 dana. Kada se koristi pomoćno sredstvo da bi se dobile odgovarajuće koncentracije ispitivane supstance u atmosferi, koristi se i kontrolna grupa. Za vreme primene, životinje se svakodnevno posmatraju zbog otkrivanja znakova toksičnosti. Životinje koje za vreme ispitivanja uginu postmortalno se pregledaju, a po završetku ispitivanja i preživele životinje se postmortalno pregledaju.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE
1.6.1. Pripreme
Životinje se drže i hrane pod eksperimentalnim uslovima najmanje pet dana pre ispitivanja. Pre ispitivanja, zdrave mlade životinje se nasumce izdvajaju i dodeljuju grupama koje se tretiraju i kontrolnim grupama. Gde je potrebno, ispitivanoj supstanci može se dodati pomoćno sredstvo da bi se pripremile odgovarajuće koncentracije supstance u atmosferi. Ako se pomoćno sredstvo ili drugi dodaci koriste za olakšavanje doziranja mora biti poznato da ne proizvode toksične efekte. Ukoliko odgovara, koriste se podaci iz ranije studije.
1.6.2. Uslovi ispitivanja
1.6.2.1. Eksperimentalne životinje
Ukoliko ne postoje kontraindikacije, koriste se pacovi. Uzimaju se laboratorijske vrste mladih zdravih životinja koje se uobičajeno koriste. Na početku studije, raspon promena u telesnoj masi korišćenih životinja ne sme da prelazi ± 20% odgovarajuće srednje vrednosti. Ako se vodi studija subhronične inhalacije kao uvod u dugoročnu studiju, u obe studije koriste se iste vrste.
1.6.2.2. Broj i pol
Za svaku koncentraciju izlaganja koristi se najmanje 20 životinja (10 ženki i 10 mužjaka). Uzimaju se ženke koje nisu ranije rađale i koje nisu gravidne. Ako se planiraju lišavanja života na human način u toku eksperimenta, broj se povećava za broj životinja koje su planirane za lišavanje života pre završetka studije. Prateća grupa od 20 životinja (10 životinja po polu) izlaže se u trajanju od deset dana visokoj koncentraciji i posmatra, kako bi se registrovala reverzibilnost, postojanost ili zakasnela pojava toksičnih efekata 28 dana po završetku tretmana.
1.6.2.3. Koncentracije
Ako se koristi pomoćno sredstvo, potrebne su najmanje tri koncentracije, s kontrolom ili kontrolom pomoćnog sredstva (koje odgovara koncentraciji pomoćnog sredstva na najvišem nivou). Osim tretmana eksperimentalnom supstancom, prema životinjama u kontrolnoj grupi se postupa na isti način kao s onima u eksperimentalnoj grupi. Najviše koncentracije pokazuju toksične efekte, ali ni jedan smrtni slučaj ili samo nekoliko smrtnih slučajeva. Ako postoji primenljiva procena izloženosti ljudi, najniži nivo primenjen na životinjama premašuje tu vrednost. U idealnom slučaju, srednja koncentracija proizvodi minimalno primetne toksične efekte. Ako se koristi više od jedne srednje koncentracije, njihove vrednosti su dovoljno različite da se postigne gradacija toksičnih efekata. U grupama kod kojih su primenjene niske ili srednje koncentracije, kao i kontrolnim grupama, učestalost smrtnih slučajeva kod životinja je niska, kako bi procena rezultata imala smisla.
1.6.2.4. Vreme izlaganja
Dnevno vreme izlaganja je šest sati posle izjednačavanja koncentracija u komorama, ali se mogu odrediti i drugi vremenski intervali kada postoje posebni zahtevi.
1.6.2.5. Oprema
Životinje se podvrgavaju ispitivanju u inhalacionoj opremi koja je dizajnirana tako da održava konstantni protok vazduha s najmanje 12 potpunih izmena u jednom satu, kako bi se obezbedila odgovarajuća koncentracija kiseonika i ravnomerno raspoređena atmosfera ekspozicije. Tamo gde se koristi komora, njen dizajn je dovoljno prostran da minimalizuje prenaseljenost životinja i maksimalizuje njihovu izloženost ispitivanoj supstanci udisanjem. Kao opšte pravilo koje obezbeđuje stabilnost atmosfere u komori, koristi se mera, prema kojoj ukupna zapremina eksperimentalnih životinja ne sme da prelazi 5% zapremine komore. Mogu se koristiti različiti tipovi komora koji omogućavaju izloženost samo oro-nazalnih otvora, glave ili čitavog tela, pri čemu prve dve smanjuju preuzimanje ispitivane supstance drugim putevima.
1.6.2.6. Vreme posmatranja
Eksperimentalne životinje posmatraju se svakog dana tokom perioda tretiranja kao i za vreme oporavka kako bi se uočili znakovi toksičnosti. Važno je registrovati vreme kad se jave ili nestanu prvi znakovi trovanja, kao i vreme smrti.
1.6.3. Postupak
Životinje se izlažu ispitivanoj supstanci svakog dana, pet do sedam dana nedeljno, u periodu od 90 dana. Životinje iz pratećih grupa koje su predviđene za kasnija posmatranja, drže se još 20 dana bez tretmana, kako bi se utvrdila postojanost toksičnih efekata ili oporavak od istih. Temperatura na kojoj se obavlja ispitivanje se održava na 22° C ± 3° C. U idealnim uslovima, relativna vlažnost je između 30% i 70%, ali u nekim slučajevima (npr. ispitivanja aerosola) to nije izvodljivo. Za vreme izlaganja, životinjama se ne daje voda i hrana.
Tokom eksperimenta koristi se dinamički inhalacioni sistem s odgovarajućim sistemom analitičke kontrole koncentracije. Kako bi se uspostavile odgovarajuće koncentracije preporučuje se obavljanje probnog ispitivanja. Protok vazduha se podešava tako da se obezbedi homogenost uslova u komori. Sistem omogućava da se stabilni uslovi izlaganja postižu što je moguće brže.
Obavljaju se merenja i prate sledeći parametri:
a) brzina protoka vazduha (neprekidno);
b) koncentracija ispitivane supstance merena u području udisanja. Za vreme izlaganja u toku jednog dana koncentracija ispitivane supstance ne sme da varira više od ± 15% od srednje vrednosti. Kod prašine i aerosola, možda nije moguće postići taj nivo kontrole pa se toleriše širi opseg vrednosti. Za vreme trajanja čitavog eksperimenta, koncentracije se iz dana u dan drže konstantnim koliko god je izvodljivo. Za vreme razvoja sistema vrše se analize veličina čestica da bi se utvrdila stabilnost koncentracija aerosola. Tokom izlaganja, analize se obavljaju u vremenskim intervalima u kojima je to neophodno za određivanje konzistencije raspodele veličina čestica;
v) temperatura i vlažnost;
g) za vreme i posle izlaganja, opažanja se sistematično registruju; za svaku životinju vodi se poseban zapisnik.
Životinje se posmatraju svakodnevno, a znakovi toksičnosti se evidentiraju, uključujući vreme njihovog prvog javljanja, stepen i trajanje. Registruju se promene na koži i krznu, očima, sluznicama, respiratornom, cirkulatornom, autonomnom i centralnom nervnom sistemu, kao i somatomotorna aktivnost i način ponašanja. Jednom nedeljno mere se telesna masa životinja i unos hrane. Potrebno je redovno pratiti životinje da bi se izbegao njihov gubitak zbog kanibalizma, autolize tkiva ili drugo. Na kraju perioda izlaganja obavlja se postmortalni pregled svih preživelih životinja. Životinje koje su na samrti izdvajaju se i postmortalno pregledaju, kad se primeti da su jako slabe.
Na svim životinjama, uključujući i one iz kontrolne grupe, obično se rade sledeća ispitivanja:
a) oftalmološki pregled uz korišćenje oftalmoskopa ili sličnog odgovarajućeg instrumenta vrši se pre izlaganja ispitivanoj supstanci i na kraju studije, obično na svim životinjama ili bar na onima koje su bile izložene visokoj dozi i životinjama u kontrolnim grupama. Ako se otkriju promene na očima, potrebno je pregledati sve životinje;
b) hematološke analize, uključujući hematokrit, koncentraciju hemoglobina, broj eritrocita, ukupan i diferencijalni broj leukocita i potencijal zgrušavanja krvi kao što je: vreme zgrušavanja, protrombinsko vreme, tromboplastinsko vreme ili broj trombocita, vrše se na kraju perioda ispitivanja;
v) medicinsko biohemijska određivanja u krvi obavljaju se na kraju perioda ispitivanja. Područja ispitivanja koja se smatraju važnim za sve studije su: ravnoteža elektrolita, metabolizam ugljenih hidrata, funkcija jetre i bubrega. Na izbor specifičnih ispitivanja utiču posmatranja mehanizma delovanja supstance. Predložena određivanja su: kalcijum, fosfor, hlorid, natrijum, kalijum, glukoza u uslovima gladovanja (s vremenom gladovanja koje je odgovarajuće za vrstu), serumska glutamat piruvat transaminazaV, serumska glutamat oksaloacetat transaminazaVI, ornitin deksarboksilaza, gama glutamil transpeptidaza, azot u ureji, albumin, kreatinin u krvi, ukupni bilirubin i merenja ukupnih proteina u serumu. Druga određivanja koja mogu da budu potrebna za adekvatnu toksikološku procenu obuhvataju: analize lipida, hormona, acidobaznu ravnotežu, methemoglobin i aktivnost holinesteraze. Dodatne biohemijske analize mogu se uključiti kada je potrebno proširiti ispitivanje posmatranih efekata;
g) analiza urina nije rutinski potrebna, samo ako postoji indikacija zasnovana na očekivanoj ili primećenoj toksičnosti.
Ako su osnovni podaci iz ranije studije nedovoljni, razmatra se određivanje hematoloških i medicinsko biohemijskih parametara pre početka doziranja.
____________
V Sada poznata kao serumska alanin aminotransferaza.
VI Sada poznata kao serumska aspartat aminotransferaza.
1.6.3.1. Postmortalni pregled
Sve životinje podvrgavaju se detaljnom postmortalnom pregledu koji obuhvata pregled spoljne površine tela, svih otvora, lobanjske, grudne i trbušne šupljine i njihovih sadržaja. Odmah posle sekcije, još mokri, mere se sledeći organi: jetra, bubrezi, žlezde i testisi. Merenje se sprovodi što pre posle sekcije, da se organi ne bi osušili. U prikladnom medijumu za eventualni budući histopatološki pregled čuvaju se sledeći organi i tkiva: sve velike lezije, pluća - koja se vade intaktna, mere se i tretiraju odgovarajućim fiksativom kako bi se očuvale sve strukture organa (perfuzija s fiksativom smatra se efikasnom procedurom), nazofaringealno tkivo, mozak - uključujući delove moždine/pons, kore malog mozga(cerebelarni korteks) i moždane kore (cerebralni korteks), hipofizno, tiroidno/paratiroidni i bilo koje timusno tkivo, dušnik, pluća, srce, aorta, pljuvačne žlezde, jetra, slezina, bubrezi, nadbubrežne žlezde, gušterača, gonade, materica (pripadajući genitalni organi), (koža), žučna kesica (ako postoji), jednjak, želudac, dvanaestopalačno crevo, tanko crevo, slepo crevo, debelo crevo, rektum, mokraćna bešika, limfni čvorovi (ženske mlečne žlezde), (bedrena muskulatura), periferni živci, (oči), grudna kost sa koštanom srži (femur, uključujući zglobne površine) i (kičmena moždina u tri nivoa - cervikalni, srednjetorakalni i lumbalni). Tkiva navedena u zagradama pregledaju se samo ako postoje znaci toksičnosti ili ako se radi o ciljnom organu.
1.6.3.2. Histopatološka ispitivanja
a) Kompletna histopatološka posmatranja obavljaju se na respiratornom traktu i drugim organima i tkivima svih životinja u kontrolnim grupama i grupama koje su bile izložene visokim koncentracijama.
b) Sve velike lezije se pregledaju.
v) Pregledaju se ciljni organi u grupama koje su podvrgnute drugim koncentracijama.
g) Histopatološki se pregledaju i pluća životinja koje su podvrgnute niskim i srednjim koncentracijama, jer se na taj način može objektivno utvrditi zdravstveno stanje životinja. Dalji histopatološki pregledi rutinski se ne obavljaju na životinjama u tim grupama, ali se uvek obavljaju na organima na kojima su vidljive lezije u grupi podvrgnutoj visokoj koncentraciji.
d) Kad se koristi prateća grupa, histopatološki se obrađuju tkiva i organi koji pokazuju iste efekte kao i kod životinja iz drugih ispitanih grupa.
2. PODACI
Podaci se navode tabelarno, gde se za svaku ispitivanu grupu životinja navodi broj životinja na početku eksperimenta, broj životinja s lezijama, vrste lezija i procenat životinja kod kojih su pronađene lezije. Rezultati se procenjuju odgovarajućom statističkom metodom. Može se koristiti bilo koja usvojena statistička metoda.
3. IZVEŠTAJ
3.1. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju, ako je moguće, sadrži podatke o:
- vrsti, varijetetu, izvoru, uslovima okoline, ishrane;
- eksperimentalnim uslovima: opis aparature za izlaganje, uključujući dizajn, tip, dimenzije, izvor vazduha, sistem za raspršivanje aerosola, metoda kondicioniranja vazduha, obrada iskorišćenog vazduha i način čuvanja životinja u komori. Potrebno je opisati i aparaturu za merenje temperature, vlažnosti i kada odgovara, stabilnost koncentracija aerosola ili veličina čestica;
- izlaganju ispitivanoj supstanci koji se prikazuju tabelarno zajedno sa srednjim vrednostima i merom odstupanja (npr. standardna devijacija) i obuhvataju:
a) brzinu protoka vazduha kroz inhalacionu opremu;
b) temperaturu i vlažnost vazduha;
v) nominalnu koncentraciju (ukupan sadržaj ispitivane supstance koja se uvodi kroz inhalacionu opremu, podeljena sa zapreminom vazduha);
g) prirodu pomoćnog sredstva, ako se koristilo;
d) tačne koncentracije supstance u zoni udisanja;
đ) srednje veličine čestica (kada je potrebno);
- toksičnim efektima po polu i koncentraciji;
- nivou bez efekta ako je moguće;
- vremenu smrti u toku eksperimenta ili da li su životinje preživele do kraja eksperimenta;
- opisu toksičnih ili drugih efekata;
- vremenu posmatranja bilo kakvih abnormalnosti i njihov kasniji tok;
- hranjenju i telesnoj masi;
- oftalmološkim nalazima;
- hematološkim ispitivanjima koja su primenjena i nalazima;
- medicinsko-biohemijskim ispitivanjima i nalazima (uključivši nalaze analize urina);
- nalazima obdukcije;
- detaljnom opisu svih histopatoloških nalaza;
- statističkoj obradi rezultata gde je moguće;
- obrazloženju rezultata;
- tumačenju rezultata.
3.2. PROCENA I TUMAČENJE REZULTATA
Videti Opšti uvod.
4. LITERATURA
Videti Opšti uvod.
B.30. ISPITIVANJE HRONIČNE TOKSIČNOSTI
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod.
1.2. DEFINICIJE
Videti Opšti uvod.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Ispitivana supstanca se obično primenjuje sedam dana nedeljno, odgovarajućim putem, kod nekoliko grupa eksperimentalnih životinja, jedna doza po grupi, kroz duži period njihovog životnog veka. Za vreme i posle izloženosti ispitivanoj supstanci, eksperimentalne životinje se posmatraju svakodnevno, kako bi se otkrili znaci toksičnosti.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE
1.6.1. Pripreme
Životinje se drže pod eksperimentalnim uslovima čuvanja i hranjenja najmanje pet dana pre ispitivanja. Pre ispitivanja slučajnim izborom zdrave mlade životinje se svrstavaju u tretirane i kontrolne grupe.
1.6.2. Uslovi ispitivanja
1.6.2.1. Eksperimentalne životinje
Preporučena vrsta je pacov. Mogu se koristiti i druge vrste (glodara ili drugih životinja), na osnovu rezultata prethodnih studija. Ispitivanju se podvrgavaju zdravi mladi primerci životinja onih laboratorijskih vrsta koje se najčešće koriste u ovakvim eksperimentima, a primena doze započinje u što kraćem vremenskom roku posle odbijanja od sise.
Na početku studije varijacije u telesnoj masi korišćenih životinja ne smeju prelaziti ± 20% srednje vrednosti. Ako se izvodi subhronična oralna studija kao uvod u dugoročnu studiju, u obe studije koriste se iste vrste i varijeteti.
1.6.2.2. Broj i pol
Za svaki dozni nivo i istovremenu kontrolnu grupu koristi se najmanje 40 životinja (20 ženki i 20 mužjaka). Uzimaju se ženke koje nikad nisu rađale i koje nisu gravidne. Ako se planiraju lišavanja života na human način u toku eksperimenta, broj se povećava za broj životinja koje su planirane za lišavanje života pre završetka studije.
Za vrste koje ne pripadaju glodarima prihvatljiv je manji broj životinja, ali najmanje četiri životinje po polu po grupi.
1.6.2.3. Dozni nivoi i učestalost izlaganja
Koriste se najmanje tri nivoa doze ispitivane supstance zajedno s istovremenom kontrolnom grupom. Najviša doza treba da pokaže toksične efekte, ali bez velikog broja smrtnih slučajeva. Najniža doza ne sme da izazove i pokaže toksičnost.
Srednja doza utvrđuje se u rasponu između visokih i niskih doza.
Kod izbora nivoa doza uzimaju se u obzir podaci iz prethodnih ispitivanja i studija toksičnosti.
Životinje se obično svakodnevno izlažu ispitivanoj supstanci. Ako se hemikalija daje u vodi za piće ili se umeša u hranu, uvek je na raspolaganju.
1.6.2.4. Kontrole
Istovremeno se koristi kontrolna grupa koje je u svakom pogledu identična eksperimentalnim grupama, osim izloženosti ispitivanoj supstanci.
U posebnim okolnostima, kao što su inhalacione studije koje obuhvataju aerosole ili korišćenje emulgatora čija biološka aktivnost nije okarakterisana u oralnim studijama, istovremeno se koristi i negativna kontrolna grupa. Negativna kontrolna grupa tretira se na isti način kao i eksperimentalne grupe, samo što se životinje ne izlažu ispitivanoj supstanci niti bilo kom pomoćnom sredstvu.
1.6.2.5. Put primene
Dva glavna puta primene su oralni i inhalacioni. Izbor puta primene zavisi od fizičkih i hemijskih karakteristika ispitivane supstance i od mogućeg puta unosa kod ljudi.
Korišćenje dermalnog puta predstavlja značajan praktični problem. O hroničnoj sistemskoj toksičnosti koja proizlazi iz perkutane apsorpcije može se izvesti zaključak iz rezultata drugog oralnog ispitivanja i znanja o stepenu perkutane apsorpcije dobijenom iz prethodnih ispitivanja perkutane toksičnosti.
1.6.2.6. Studije sa peroralnim putem primene
Kad se ispitivana supstanca apsorbuje iz gastrointestinalnog trakta i ako je to put unosa kojim mogu biti izloženi ljudi, predlaže se peroralni put primene, osim ako postoje kontraindikacije.
Životinje mogu da dobijaju ispitivanu supstancu u hrani, rastvorenu u vodi za piće ili im se može davati u kapsulama.
Idealno je dnevno doziranje tokom sedam dana nedeljno, jer primena određene doze na bazi pet dana nedeljno može da omogući oporavak ili povlačenje toksičnosti u periodu u kojem se ne primenjuje ispitivana supstanca i time da utiče na rezultat i kasniju procenu. Sa stanovišta prakse, doziranje na bazi pet dana nedeljno smatra se prihvatljivim.
1.6.2.7. Studije sa inhalacionim putem primene
Kako studije sa inhalacionim putem primene predstavljaju tehnički problem koji je složeniji od drugih puteva primene, ovde se detaljnije navodi taj način primene. Napominje se da intratrahealno ulivanje može biti dobra alternativa u specifičnim situacijama.
Dugoročno izlaganje obično se planira prema projektovanoj izloženosti ljudi. Životinje se dnevno izlažu šest sati posle izjednačenja koncentracija u komori, pet dana u nedelji (isprekidana izloženost) ili, pogodnoj ambijentalnoj izloženosti, 22 do 24 sata izloženosti dnevno tokom sedam dana nedeljno (neprekidna izloženost) sa jednim satom za hranjenje životinja u slično vreme svakog dana i za održavanje komore. U oba slučaja životinje se izlažu fiksnim koncentracijama ispitivane supstance. Najveća razlika između isprekidane i neprekidne izloženosti je što u prvom slučaju postoji period od 17 do 18 sati tokom koga se životinje mogu oporaviti od efekata svakodnevne izloženosti, sa čak i dužim vremenom oporavka tokom vikenda.
Izbor isprekidane ili neprekidne izloženosti zavisi od ciljeva studije i od izloženosti ljudi koja će se simulirati. Razmatraju se određene tehničke teškoće. Na primer, prednosti neprekidne izloženosti koja simulira uslove životne sredine mogu se poništiti potrebom davanja vode i hranjenja za vreme izloženosti i potrebom za složenijim (i pouzdanim) tehnikama za stvaranje i posmatranje aerosola i pare.
1.6.2.8. Komore za izlaganje
Životinje se podvrgavaju ispitivanju u inhalacionim komorama dizajniranim tako da održavaju dinamičan protok vazduha s najmanje 12 izmena vazduha u jednom satu, kako bi se osigurala odgovarajuća koncentracija kiseonika i ravnomerno raspoređena atmosfera. Kontrolne komore i komore za izlaganje su jednake u konstrukciji i dizajnirane tako da obezbeđuju uslove izlaganja koji su uporedivi u svim pogledima, izuzev izloženosti ispitivanoj supstanci. Slabi negativni pritisak u komori se uglavnom održava za sprečavanje ispuštanja ispitivane supstance u okolno područje. Komore minimizuju prenaseljenost eksperimentalnih životinja. Kao opšte pravilo koje obezbeđuje stabilnost atmosfere u komori, koristi se mera prema kojoj zapremina eksperimentalnih životinja ne sme prelaziti 5% zapremine komore.
Mere se i prate sledeći parametri:
a) Protok vazduha: preporučuje se da se brzina protoka vazduha prati neprekidno;
b) Koncentracija: u periodu dnevnog izlaganja koncentracija ispitivane supstance ne sme da varira više od ± 15% od srednje vrednosti;
v) Temperatura i vlaga: za glodare se temperatura održava na 22° C ± 2° C, a vlaga u komori na 30% do 70%, osim ako se koristi voda za suspendovanje ispitivane supstance u atmosferu komore. Preporučuje se da se temperatura i vlaga prate neprekidno;
g) Merenja veličine čestica: raspodela veličine čestica određuje se u atmosferi komore koje sadrže tečne ili čvrste aerosole. Čestice aerosola su takve veličine da ih eksperimentalne životinje mogu udisati. Uzorci vazduha komore uzimaju se u zoni disanja životinja. Uzorak vazduha mora biti tipičan predstavnik raspodele čestica kojima su životinje izložene i obuhvata, na gravimetrijskoj bazi, sav suspendovani aerosol, čak i ako se mnogo aerosola ne može udisati. Za vreme razvoja generišućeg sistema često se obavljaju analize veličine čestica da bi se obezbedila stabilnost aerosola, a posle toga se analize veličine čestice obavljaju onoliko često koliko zahteva vreme izlaganja, da bi se pravilno odredila konzistencija raspodele čestica kojima su životinje bile izložene.
1.6.2.9. Trajanje ispitivanja
Period davanja je najmanje 12 meseci.
1.6.3. Postupak
1.6.3.1. Posmatranja
Pažljivo kliničko ispitivanje obavlja se najmanje jednom dnevno. Dodatna posmatranja obavljaju se svakodnevno uz preduzimanje odgovarajućih mera kako bi se gubitak životinja za vreme izvođenja studije sveo na minimum, na primer postmortalni pregled ili zaleđavanje onih životinja koje se pronađu mrtve i izolacija ili lišavanje života na human način slabih životinja ili životinja na samrti. Obavljaju se pažljiva posmatranja da bi se otkrio početak i napredovanje toksičnih efekata, kao i da bi se sveo na minimum gubitak zbog bolesti, autolize ili kanibalizma.
Klinički znaci, uključujući neurološke promene i promene na očima, beleže se za sve životinje. Beleže se i vreme početka i napredovanje toksičnih efekata, uključujući sumnjive tumore.
Telesne mase beleže se pojedinačno za sve životinje jednom nedeljno u prvih 13 nedelja perioda ispitivanja, a posle toga najmanje jednom svake četiri nedelje. Uzimanje hrane određuje se nedeljno za vreme prvih 13 nedelja studije, a potom u intervalima od oko tri meseca, osim ako zdravstveno stanje ili promene u telesnoj masi ne diktiraju drugačije.
1.6.3.2. Hematološki pregled
Hematološki pregled (npr. sadržaj hemoglobina; ukupna zapremina krvnih ćelija; ukupan broj eritrocita, ukupan broj leukocita, trombocita ili merenja drugih parametara koagulacije) obavlja se posle tri meseca, posle šest meseci, a posle toga u intervalima od oko šest meseci i po završetku ispitivanja iz uzoraka krvi svih životinja koje nisu glodari i uzoraka krvi 10 pacova po polu svih grupa. Ako je moguće, uzorci su od istih pacova u svakom intervalu. Uzimaju se i uzorci od životinja koje nisu glodari.
Ako klinička posmatranja daju nagoveštaj pogoršanja zdravlja životinja za vreme studije, od životinja kod kojih se naslućuje pogoršanje zdravlja, uzimaju se uzorci krvi i radi se diferencijalna krvna slika.
Diferencijalna krvna slika radi se kod životinja iz grupe koja je podvrgnuta najvišoj dozi i kod kontrolne grupe. Diferencijalna krvna slika radi se kod životinja koje su podvrgnute nešto manjoj dozi samo ako postoji velika razlika između grupe sa najvišom dozom i kontrolne grupe ili ako je indikovana na osnovu patoloških nalaza.
1.6.3.3. Analiza mokraće
Za analizu se uzimaju uzorci mokraće od životinja koje nisu glodari i od 10 pacova po polu, ako je moguće od istih pacova u jednakim intervalima u kojima se obavljaju i hematološke analize. Kod pojedinačnih životinja ili na zbirnim ("pool") uzorcima po polu i po grupi za glodare određuju se:
- izgled: zapremina i gustina za pojedinačne životinje;
- proteini, glukoza, ketoni, skriveno krvarenje (semikvantitativno);
- mikroskopski pregled sedimenta (semikvantitativno);
- medicinska biohemija.
U intervalima od oko šest meseci i na kraju ispitivanja, uzimaju se uzorci krvi za medicinsko-biohemijska merenja od svih životinja koje nisu glodari i 10 pacova po polu svih grupa, po mogućnosti od istih pacova u svakom intervalu. Uzorci za preliminarna ispitivanja uzimaju se od životinja koje nisu glodari. U plazmi tih uzoraka određuju se:
- koncentracija ukupnih proteina;
- koncentracija albumina;
- ispitivanja funkcije jetre (kao što je aktivnost alkalne fosfataze, glutaminske piruvat transaminazeVII, aktivnost glutaminske oksaloacetatne transaminazeVIII), gama glutamil transpeptidaze, ornitin dekarboksilaze;
- metabolizam ugljenih hidrata, kao što je glukoza u krvi posle gladovanja;
- ispitivanja funkcije bubrega kao što je azot iz uree u krvi.
_____________
VII Sada poznata kao serumska alanin aminotransferaza.
VIII Sada poznata kao serumska aspartat amintransferaza.
1.6.3.4. Postmortalni pregled
Postmortalni pregled se obavlja na svim životinjama, uključujući one koje su uginule za vreme eksperimenta ili su lišene života na human način jer su bile na samrti. Pre lišavanja života na human način od svih životinja uzimaju se uzorci krvi za diferencijalnu krvnu sliku. Čuvaju se sve vidljive lezije, tumori ili lezije za koje se sumnja da su tumori. Pokušava se da se dovedu u vezu opažene promene s mikroskopskim nalazima.
Svi organi i tkiva čuvaju se za histopatološke preglede. Ovo se obično odnosi na sledeće organe i tkiva: mozakIX (medula i pons, cerebelarni korteks, cerebralni korteks), hipofiza, štitna žlezda (uključujući paratioroidnu žlezdu), timus, pluća (uključujući traheju), srce, aorta, pljuvačne žlezde, jetraIX, slezina, bubreziIX, nadbubrežne žlezdeIX, jednjak, želudac, duodenum, tanko crevo, slepo crevo, debelo crevo, rektum, materica, mokraćna bešika, limfni čvorovi, pankreas, polne žlezdeIX, ostali genitalni organi, kod ženki mlečne žlezde, koža, muskulatura, periferni živci, kičmena moždina (cervikalna, torakalna, lumbalna), grudna kost s koštanom srži (uključujući zglobove) i oči. Za odgovarajući histopatološki pregled važno je naduvavanje pluća i mokraćne bešike sa fiksativom na optimalan način da se sačuvaju ta tkiva, kao i naduvavanje pluća kod inhalacionih studija. U posebnim studijama, kao što su inhalacione studije, pregleda se celokupan respiratorni trakt, uključujući nos, ždrelo i grkljan.
Ako su obavljeni drugi klinički pregledi, dobijeni rezultati su na raspolaganju pre mikroskopskog pregleda, jer to može biti smernica za patologa.
____________
IX Mere se organi od deset životinja po polu po grupi za glodare i životinje koje nisu glodari, plus tiroidna žlezda (s paratiroidnim žlezdama) za životinje koje nisu glodari.
1.6.3.5. Histopatologija
Sve vidljive promene, naročito tumori i druge lezije nastale u bilo kom organu, mikroskopski se pregledaju. Preporučuju se sledeći postupci:
a) Mikroskopski pregled svih sačuvanih organa i tkiva s kompletnim opisom svih lezija nađenih:
1) kod svih životinja koje su uginule ili su lišene života na human način za vreme studije;
2) u svim grupama koje su dobijale visoku dozu i u kontrolnoj grupi;
b) Organi ili tkiva kod kojih su pronađene abnormalnosti uzrokovane ili verovatno uzrokovane ispitivanom supstancom ispituju se i kod životinja iz grupa sa nižom dozom;
v) Ako rezultat ispitivanja dokaže bitno skraćenje normalnog životnog veka životinje ili efekte koji mogu da utiču na toksičnu reakciju, naredni niži dozni nivo ispituje se na način koji je gore opisan;
g) Za ispravnu procenu značaja promena koje su primećene kod tretiranih životinja neophodni su podaci o nastanku lezija do kojih obično dolazi kod vrste životinja koje se koriste, pod istim laboratorijskim uslovima, tj. istorijski kontrolni podaci.
2. PODACI
Podaci se navode tabelarno, gde se za svaku ispitivanu grupu životinja navodi broj životinja na početku eksperimenta, broj životinja sa lezijama i procenat životinja sa svakom vrstom lezije. Svi dobijeni rezultati analiziraju se odgovarajućom statističkom metodom. Može se koristiti bilo koja usvojena statistička metoda.
3. IZVEŠTAJ
3.1. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju, ako je moguće, sadrži podatke o:
- vrsti, varijetetu, izvoru, uslovima sredine, ishrane;
- eksperimentalnim uslovima: aparaturi za izlaganje ispitivanoj supstanci uključujući dizajn, vrstu, dimenzije aparature, kao i izvor vazduha, sistem za proizvodnju čestica i aerosola, metoda za kondicioniranje vazduha, obrada iskorišćenog vazduha i metoda čuvanja životinja u komori. Opisuje se oprema za merenje temperature, vlage i, gde je moguće, stabilnost koncentracije aerosola ili veličinu čestice;
- izlaganju ispitivanoj supstanci: ovi podaci se prikazuju tabelarno sa srednjim vrednostima i merama varijabilnosti (npr. standardna devijacija) i obuhvataju podatke o:
a) brzini protoka vazduha kroz opremu za inhalaciju;
b) temperaturi i vlažnosti vazduha;
v) nominalnoj koncentraciji (ukupnom sadržaju ispitivane supstance koja se uvodi u opremu za inhalaciju, podeljenim sa zapreminom vazduha);
g) prirodi pomoćnog sredstva, ako je korišćen;
d) stvarnim koncentracijama supstance u zoni udisanja;
đ) srednjoj veličini čestica (gde je potrebno),
- visini doze (uključujući i pomoćno sredstvo, ako se koristilo) i koncentracije;
- toksičnoj reakciji po polu i dozi;
- nivou bez efekta;
- vremenu smrti za vreme studije ili da li su životinje preživele do kraja eksperimenta;
- opis toksičnih i drugih efekata;
- vremenu kada je primećen svaki znak abnormalnosti i njegov kasniji tok;
- hrani i telesnoj masi;
- oftalmološkim nalazima;
- hematološkim ispitivanja i svim rezultatima;
- medicinsko biohemijskim ispitivanjima i svim rezultatima (uključujući rezultate analize urina);
- nalazima obdukcije;
- detaljan opis svih histopatoloških nalaza;
- statističkoj proceni rezultata, gde je moguće;
- obrazloženju rezultata;
- tumačenju rezultata.
3.2. PROCENA I TUMAČENJE REZULTATA
Videti Opšti uvod.
4. LITERATURA
Videti Opšti uvod.
B.31. ISPITIVANJE TOKSIČNOSTI PO PRENATALNI RAST I RAZVOJ
1. METODA ISPITIVANJA
Ova metoda zasniva se na Uputstvu za ispitivanje OECD 414 (2001).
1.1. UVOD
Ova metoda za ispitivanje toksičnosti po rast i razvoj namenjena je za dobijanje opštih podataka o efektima prenatalnog izlaganja na gravidne eksperimentalne životinje i na organizam tokom rasta i razvoja u materici. Ovo može da obuhvati procenu efekata na majku, kao i smrt, strukturalne abnormalnosti ili izmenjen rast ploda. Funkcionalni nedostaci, iako čine važan deo rasta i razvoja, nisu sastavni deo ove metode ispitivanja. Oni se mogu ispitivati u posebnoj studiji ili kao dodatak ovaj studiji, korišćenjem metode ispitivanja neurotoksičnosti po rast i razvoj. Podaci o ispitivanju funkcionalnih nedostataka i drugih efekata posle rođenja, se traže u odgovarajućem ispitivanju reproduktivne toksičnosti na dve generacije i ispitivanju neurotoksičnosti po rast i razvoj.
Ova metoda ispitivanja može zahtevati specifično prilagođavanje u pojedinačnim slučajevima na osnovu specifičnog znanja o npr. fizičkim i hemijskim ili toksikološkim svojstvima ispitivane supstance. Takvo prilagođavanje je prihvatljivo ako uverljivi naučni dokazi pokazuju da će se prilagođavanjem dobiti bolji kvalitet podataka. U takvom slučaju, ovi naučni dokazi pažljivo se dokumentuju u izveštaju o ispitivanju.
1.2. DEFINICIJE
Toksikologija rasta i razvoja jeste studija o štetnim efektima na organizam tokom rasta i razvoja koji se mogu pojaviti kao posledica izlaganja pre začeća, tokom prenatalnog rasta i razvoja ili postnatalno do vremena polnog sazrevanja. Najveće manifestacije toksičnosti po rast i razvoj obuhvataju: 1) smrt organizma, 2) strukturalne abnormalnosti, 3) izmenjeni rast, 4) funkcionalne nedostatke. Toksikologija rasta i razvoja se ranije često nazivala teratologija.
Štetni efekat jeste svaka promena polaznog stanja povezana sa tretmanom koja umanjuje sposobnost organizma da preživi, reprodukuje se ili prilagodi životnoj sredini. U najširem smislu, toksikologija rasta i razvoja obuhvata svaki efekat koji remeti normalan razvoj zametka i pre i posle rođenja.
Izmenjen rast jeste promena mase ili veličine organa ili organizma potomaka.
Alteracije (anomalije) jesu strukturne promene u rastu i razvoju koje obuhvataju i malformacije i varijacije28.
Malformacija/veća abnormalnost jeste strukturna promena koja se smatra štetnom za životinju (može biti i smrtonosna) i obično je retka.
Varijacija/manja abnormalnost jeste strukturna promena za koju se smatra da ima mali ili nikakav štetan efekt na životinju; može biti prolazna i može se pojaviti relativno često u kontrolnoj populaciji.
Zametak jeste zbir derivata oplođenog jajašca u bilo kojoj fazi rasta i razvoja od oplodnje do rođenja, uključujući ekstraembrionalne membrane, kao i embrion ili plod.
Implantacija (nidacija) jeste pripajanje blastocista na epitelni sloj materice, uključujući njegovu penetraciju kroz epitel materice i usađivanje u endometrijum.
Embrion jeste rana ili razvojna faza bilo kog organizma, naročito proizvoda oplođenja jajašca koji se razvija posle pojave dugačke ose i do pojave svih većih struktura.
Embriotoksičnost jeste štetnost za normalnu strukturu, razvoj, rast i/ili sposobnost preživljavanja embriona.
Plod jeste nerođeni potomak u periodu posle embrionalnog.
Fetotoksičnost jeste štetnost za normalnu strukturu, razvoj, rast i/ili sposobnost preživljavanja ploda.
Pobačaj jeste prevremeno izbacivanje proizvoda začeća iz materice: embriona ili ploda koji nije sposoban za preživljavanje.
Resorpcija jeste zametak koji, posle implantacije u matericu, kasnije umre i resorbuje se ili je resorbovan.
Rana resorpcija jeste dokaz o implantaciji bez prepoznatljivog embriona/ploda.
Kasna resorpcija jeste mrtvi embrion ili plod sa spoljnjim degenerativnim promenama.
NOAEL jeste skraćenica za najviši nivo doze ili izlaganja, kod koga nisu primećeni štetni efekti povezani sa tretmanom.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Obično se ispitivana supstanca daje gravidnim životinjama najmanje od implantacije do jednog dana pre dana planiranog lišavanja života na human način, koji je što bliži normalnom danu porođaja bez opasnosti od gubitka podataka koji proizlaze iz preranog porođaja. Eksperimentalna metoda nije namenjena samo za ispitivanje perioda organogeneze (tj. 5 do 15 dana kod glodara i 6 do 18 dana kod kunića), nego i za ispitivanje efekata od preimplantacije, ako odgovara, tokom čitavog perioda gestacije do dana pre carskog reza. Malo pre carskog reza ženke se lišavaju života na human način, pregleda se sadržaj materice, a plodovi se procenjuju prema spoljnim vidljivim anomalijama, kao i prema promenama na mekim tkivima i kosturu.
1.5. OPIS METODE
1.5.1. Izbor životinjske vrste
Preporučuje se da se ispitivanje obavlja na najrelevantnijim vrstama i da se koriste laboratorijske vrste i varijeteti koji se obično koriste kod ispitivanja toksičnosti po prenatalni rast i razvoj. Preporučena vrsta glodara je pacov, a preporučena vrsta koja ne pripada glodarima je kunić. Kada se koriste životinje drugih vrsta navodi se razlog za ovo korišćenje.
1.5.2. Uslovi smeštaja i ishrana
Temperatura eksperimentalne sobe gde se drže životinje je 22° C (± 3° C) za glodare, a 18° C (± 3 °C) za kuniće. Relativna vlažnost vazduha iznosi najmanje 30% ali ne više od 70% osim kad se prostorije čiste. Najbolje je održavati vlažnost vazduha između 50% i 60%. Osvetljenje je veštačko i to u intervalima 12 sati svetla i 12 sati mraka. Za hranjenje se mogu primenjivati ustaljene laboratorijske dijete sa neograničenim količinama vode za piće. Postupak parenja se izvodi u kavezima koji su odgovarajući za tu svrhu. Parene životinje preporučljivo je držati pojedinačno u kavezu, ali je prihvatljivo i čuvanje u malim grupama.
1.5.3. Priprema životinja
Koriste se zdrave životinje koje su se tokom najmanje pet dana privikle na laboratorijske uslove i koje ranije nisu bile podvrgnute eksperimentalnim postupcima. Eksperimentalne životinje se označavaju prema vrsti, varijetetu, izvoru, polu, telesnoj masi i/ili starosti. Životinje svih eksperimentalnih grupa su jednake telesne mase i starosti, koliko god je izvodljivo. Za svaki dozni nivo koriste se mlade odrasle ženke koje nisu ranije rađale. Ženke se pare s mužjacima iste vrste i varijeteta, a parenje između brata i sestre se izbegava. Za glodare je nulti dan gestacije dan kad se opazi vaginalni čep i/ili sperma. Za kuniće je nulti dan obično dan koitusa ili veštačke oplodnje, ukoliko se koristi ova tehnika. Parene ženke dodeljuju se slučajnim izborom kontrolnim grupama ili grupama koje se tretiraju. Kavezi se postavljaju tako da se pojava mogućih efekata zbog položaja kaveza svede na minimum. Svakoj životinji se dodeljuje jedinstveni identifikacijoni broj. Parene ženke se slučajnim izborom dodeljuju kontrolnim grupama ili grupama koje se tretiraju, a ako su se ženke parile u gomili, životinje iz svake gomile podjednako se raspodeljuju po grupama. Ženke koje je oplodio isti mužjak se raspodeljuju po grupama.
1.6. POSTUPAK
1.6.1. Broj i pol životinja
Svaka tretirana i kontrolna grupa sadrži dovoljan broj ženki, tako da se na postmortalnom pregledu nađe oko 20 ženki sa implantima. Grupe sa manje od 16 životinja sa implantima mogu da budu neodgovarajuće. Studija se ne odbacuje obavezno zbog mortaliteta majki, ako se obezbedi da mortalitet ne prelazi približno 10%.
1.6.2. Priprema doza
Ako se za lakše doziranje koristi pomoćno sredstvo ili drugi aditiv, uzimaju se u obzir sledeće karakteristike: efekti na apsorpciju, raspodelu, metabolizam i zadržavanje ili izlučivanje ispitivane supstance; efekti na hemijska svojstva ispitivane supstance koja mogu izmeniti njene toksikološke karakteristike; efekti na potrošnju hrane ili vode ili ishranjenost životinja. Pomoćno sredstvo ne sme da bude toksično po rast i razvoj, niti sme da ima efekte na reprodukciju.
1.6.3. Doziranje
Obično se ispitivana supstanca daje svakodnevno od implantacije (npr. peti dan posle parenja) do dana pre planiranog carskog reza. Ako preliminarne studije, kada su dostupne, ne upućuju na visoku opasnost od preimplantacionog gubitka, tretman se može produžiti toliko da obuhvati čitav period gestacije, od parenja do dana pre planiranog lišavanja života na human način. Dobro je poznato da neodgovarajuća manipulacija ili stres tokom trudnoće mogu da uzrokuju prenatalni gubitak. Radi čuvanja od prenatalnog gubitka zbog faktora koji nisu u vezi sa tretmanom, izbegava se nepotrebna manipulacija skotnim životinjama, kao i stres zbog spoljašnjih faktora kao što je buka.
Koriste se najmanje tri nivoa doze i istovremena kontrola. Zdrave životinje dodeljuju se kontrolnim grupama i grupama koje se tretiraju slučajnim izborom. Dozni nivoi se dovoljno razlikuju kako bi proizvele gradaciju toksičnih efekta. Osim ako ne postoji ograničenje zbog fizičke/hemijske prirode ili bioloških svojstava ispitivane supstance, najviša doza se određuje s ciljem da izazove određenu toksičnost po rast i razvoj i/ili po majku (klinički znaci ili smanjenje telesne mase), ali ne smrt ili tešku patnju. Najmanje jedan srednji dozni nivo proizvodi minimalne primetne toksične efekte. Najniži dozni nivo ne sme da izazove nikakav dokaz toksičnosti niti po majku niti po rast i razvoj. Opadajući niz nivoa doza bira se u cilju dokazivanja neke reakcije koja je zavisna od doziranja i nivoa pri kome nije opažen štetni efekat (NOAEL). Za određivanje opadajućih nivoa doza obično su optimalni dvostruki do četvorostruki intervali, a često se preporučuje četvrta eksperimentalna grupa umesto primene vrlo velikih intervala između doza (npr. više od faktora 10). Iako je cilj utvrđivanje NOAEL-a majke, mogu se prihvatiti i studije koje ne utvrđuju ovaj nivo1.
Dozni nivoi biraju se uzimajući u obzir sve postojeće podatke o toksičnosti, kao i dodatne podatke o metabolizmu i toksikokinetici ispitivane supstance ili srodnih materijala. Ovi podaci pomažu i kod dokazivanja adekvatnosti režima doziranja.
Koristi se i istovremena kontrolna grupa. Ova grupa mora da bude prividno tretirana kontrolna grupa ili kontrolna grupa za pomoćno sredstvo, ako se ono koristi prilikom primene ispitivane supstance. Svim grupama daje se ista zapremina ili ispitivane supstance ili pomoćnog sredstva. Sa životinjama u kontrolnim grupama postupa se na isti način kao sa onima u eksperimentalnim grupama. Kontrolne grupe pomoćnog sredstva dobijaju pomoćnu materiju u najvećoj količini koja se koristi (kao kod grupa koje se tretiraju najnižim koncentracijama).
1.6.4. Ispitivanje granične doze
Ako ispitivanje na jednom nivou doze od najmanje 1.000 mg/kg TM/dan primenjene oralno uz korišćenje postupaka opisanih u ovoj studiji ne proizvede primetnu toksičnost kod gravidnih životinja ili kod njihovog potomstva i ako se efekat na osnovu postojećih podataka (npr. iz jedinjenja koja su strukturno i/ili metabolički slična) ne očekuje, nije potrebna potpuna studija uz korišćenje tri nivoa doze. Očekivana izloženost ljudi može da ukaže na potrebu da se u ispitivanju granične doze koristi viša oralna doza. Za druge vrste primene, kao što su inhalacija ili dermalna primena, fizička i hemijska svojstva ispitivane supstance često mogu indikovati i ograničiti nivo izlaganja koji se maksimalno može postići (na primer dermalna aplikacija ne sme da uzrokuje izraženu lokalnu toksičnost).
1.6.5. Primena doza
Ispitivana supstanca ili pomoćno sredstvo obično se daje oralno intubacijom. Ako se koristi drugi put primene, lice koja obavlja ispitivanje opravdava i obrazlaže svoj izbor i verovatno su neophodne odgovarajuće izmene2, 3, 4. Ispitivana supstanca se primenjuje u približno isto vreme svakog dana.
Doza za pojedinačne životinje zasniva se na poslednjoj određenoj individualnoj telesnoj masi. Potreban je oprez kod prilagođavanja doze tokom poslednjeg trimestra trudnoće. Prilikom izbora doze koriste se postojeći podaci kako bi se sprečila prekomerna toksičnost po majku. Ako se registruje prekomerna toksičnost kod tretiranih (gravidnih) ženki, te životinje se humano lišavaju života. Ako nekoliko gravidnih životinja pokaže znake prekomerne toksičnosti, razmatra se završetak (lišavanje života na human način) te dozne grupe. Ako se supstanca primenjuje oralnom sondom, preporučuje se da se životinjama daje u jednoj dozi upotrebom želudačne cevi ili odgovarajuće intubacione kanile. Maksimalna zapremina tečnosti koju je dozvoljeno dati odjednom zavisi od veličine eksperimentalne životinje. Zapremina ne sme biti veća od 1 ml/100 g TM, osim u slučaju vodenih rastvora gde se može koristiti 2 ml/100 g TM. Ako se kao pomoćno sredstvo koristi kukuruzno ulje zapremina ne sme da bude veća od 0,4 ml/100 g TM. Varijabilnost u zapremini koja se ispituje svodi se na minimum prilagođavanjem koncentracija kako bi se obezbedila stalna zapremina kod svih doznih nivoa.
1.6.6. Posmatranje (gravidnih) ženki
Klinička posmatranja obavljaju se i beleže najmanje jednom dnevno, ako je moguće u isto vreme svakog dana, uzimajući u obzir glavni period tokom koga se javljaju predviđeni efekti posle primene doze. Beleže se stanja životinja, uključujući smrtnost, stanje pred smrt, bitne promene ponašanja i svi znaci očigledne toksičnosti.
1.6.7. Telesna masa i potrošnja hrane
Životinje se mere: nultog dana gestacije i najkasnije trećeg dana gestacije ako je parene životinje nabavio spoljni uzgajivač; prvog dana doziranja; najmanje svaka tri dana tokom perioda doziranja i na dan planiranog lišavanja života na human način.
Potrošnja hrane se beleži svaka tri dana i podudara se sa danima određivanja telesne mase.
1.6.8. Postmortalni pregled
Ženke se lišavaju života na human način jedan dan pre očekivanog dana porođaja. Ženke koje pokazuju znake pobačaja ili prevremenog porođaja lišavaju se života i podvrgavaju detaljnom makroskopskom pregledu pre planiranog lišavanja života.
Za vreme lišavanja života na human način ili u slučaju smrti tokom studije, ženka se makroskopski pregleda u cilju otkrivanja bilo koje strukturalne abnormalnosti ili patološke promene. Procena ženki za vreme carskog reza i kasnija analiza ploda obavlja se obično bez poznavanja podataka o tretiranoj grupi kako bi se greške svele na minimum.
1.6.9. Pregled sadržaja materice
Odmah po lišavanju života na human način ili što pre nakon smrti, uzimaju se materice i proverava stanje trudnoće životinja. Materice koje nisu gravidne potrebno je dalje pregledati (npr. bojenjem amonijum sulfidom za glodare i Salewski bojenjem ili odgovarajućom alternativnom metodom za kuniće) kako bi se potvrdilo da ne postoji trudnoća5.
Meri se masa gravidne materice sa cerviksom. Kod životinja koje su nađene mrtve tokom studije ne mere se mase gravidnih materica.
Za gravidne životinje određuje se broj žutih tela.
Sadržaji materica pregledaju se kako bi se utvrdio broj smrti embriona ili ploda i plodova koji su sposobni za život. Opisuje se stepen resorpcije kako bi se procenilo relativno vreme smrti zametka (videti odeljak 1.2. ove metode).
1.6.10. Pregled ploda
Određuje se pol i telesna masa svakog ploda. Svaki plod se pregleda kako bi se utvrdile spoljašnje promene6.
Plodovi se pregledaju na izmene kostura i mekih tkiva (npr. varijacije i malformacije ili anomalije)7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24. Kategorizacija fetalnih promena se preporučuje, ali nije obavezna. Ako se obavi kategorizacija, jasno se navode kriterijumi za određivanje svake kategorije. Posebna pažnja se obraća na reproduktivni trakt koji se pregleda na znakove izmenjenog rasta i razvoja.
Za glodare, oko jedne polovine svakog okota priprema se i pregleda promene na kosturu. Preostale životinje iz okota pripremaju se i pregledaju na promene u mekim tkivima korišćenjem prihvaćenih ili odgovarajućih metoda serijske sekcije ili pažljive tehnike seciranja.
Kod životinja koje nisu glodari, npr. kunića, svi plodovi se pregledaju na promene u mekim tkivima i kosturu. Tela tih plodova procenjuju se pažljivim seciranjem i traženjem promena na mekim tkivima, što može da obuhvati postupke za dalju procenu interne kardijalne strukture25. Glave jedne polovine plodova pregledane na taj način uklanjaju se i obrađuju za procenu promena na mekim tkivima (uključujući oči, mozak, nazalne šupljine i jezik) korišćenjem standardnih metoda serijske sekcije26 ili neke podjednako osetljive metode. Tela tih plodova i preostali nedirnuti plodovi obrađuju se i pregledaju na promene na kosturu, koristeći iste metode kao što je opisano za glodare.
2. PODACI
2.1. OBRADA REZULTATA
Podaci se navode pojedinačno za ženke, kao i za njihove potomke i prikazuju tabelarno. Podaci se navode za svaku eksperimentalnu grupu i generaciju i to: broj životinja na početku ispitivanja, broj životinja koje su nađene mrtve za vreme ispitivanja ili su lišene života iz humanih razloga, vreme svake smrti ili humanog lišenja života, broj gravidnih ženki, broj životinja koje pokazuju znakove toksičnosti, opis znakova uočene toksičnosti, uključujući vreme pojave, trajanja i težine svakog toksičnog efekta, vrste primećenih pojava koje embriona/ploda i sve relevantne podatke o okotu.
Numerički podaci se procenjuju odgovarajućom statističkom metodom, uz uzimanje okota kao jedinice za analizu podataka. Koristi se opšteprihvaćena statistička metoda. Statističke metode se biraju prilikom planiranja ispitivanja i one se moraju opravdati. U izveštaju o ispitivanju navode se i podaci o životinjama koje nisu preživele do planiranog lišavanja života na human način. Ako je relevantno ovi podaci se mogu uključiti u srednje vrednosti za grupe. Relevantnost podataka dobijenih od takvih životinja, pa i uključivanje ili isključenje iz srednjih vrednosti grupe, opravdava se i procenjuje na individualnoj osnovi.
2.2. PROCENA REZULTATA
Nalazi ispitivanja toksičnosti po prenatalni rast i razvoj procenjuju se u smislu primećenih efekata. Procena obuhvata:
- rezultate ispitivanja majke i embriona/ploda, uključujući procenu odnosa ili njihovo odsustvo, između izlaganja životinja ispitivanoj supstanci i učestalosti i ozbiljnosti svih nalaza;
- kriterijume korišćene za kategorizaciju spoljnog izgleda ploda, promena mekog tkiva i kostura, ako je obavljena kategorizacija;
- kad odgovara, kontrolne podatke iz ranije studije kako bi se poboljšalo tumačenje rezultata ispitivanja;
- numeričke vrednosti korišćene za izračunavanje svih procenata ili indeksa;
- odgovarajuću statističku analizu nalaza ispitivanja, gde odgovara, koja obuhvata podatke o metodi analize, tako da nezavisni analitičar/statističar može da reevaluira i rekonstruiše analizu.
U svakoj studiji koja pokazuje odsustvo bilo kakvih toksičnih efekata razmatraju se dalja istraživanja kako bi se utvrdila apsorpcija i bioraspoloživost ispitivane supstance.
2.3. TUMAČENJE REZULTATA
Ispitivanje toksičnosti po prenatalni rast i razvoj daje podatke o efektima ponavljanog izlaganja supstanci tokom graviditeta na ženke i na intrauterini razvoj njihovih potomaka. Rezultati ispitivanja tumače se u vezi sa nalazima iz subhronične, reproduktivne, toksikokinetičke i drugih studija. Kako je naglasak stavljen i na opštu toksičnost u smislu toksičnosti po majku i na pokazatelje toksičnosti po rast i razvoj, rezultati ispitivanja dozvoljavaju u određenoj meri razlikovanje između efekata na rast i razvoj do kojih dolazi u odsustvu opšte toksičnosti i onih efekata koji su indukovani samo pri nivoima koji su toksični i za gravidne životinje27.
3. IZVEŠTAJ
Izveštaj o ispitivanju sadrži podatke o:
1) Ispitivanoj supstanci:
- fizička svojstva i, gde je neophodno, fizička i hemijska svojstva;
- identifikacija uključujući CAS broj ako je poznat/utvrđen;
- čistoću.
2) Pomoćnom sredstvu (ako se koristi):
- opravdanje za izbor pomoćnog sredstva, ako se ne radi o vodi.
3) Eksperimentalnim životinjama:
- korišćena vrsta i varijetet;
- broj i starost životinja;
- izvor, uslovi smeštaja, dijeta itd.;
- individualne telesne mase životinja na početku ispitivanja.
4) Eksperimentalnim uslovima:
- obrazloženje za izbor nivoa doze;
- pojedinosti o formulaciji ispitivane supstance/priprema hrane, postignuta koncentracija, stabilnost i homogenost preparata;
- pojedinosti o primeni ispitivane supstance;
- konverzija koncentracije ispitivane supstance u hrani/vodi za piće (ppm) do stvarne doze (mg/kg TM/dan), ako je primenljivo;
- uslovi životne sredine;
- podaci o kvalitetu hrane i vode.
5) Rezultatima:
- Podaci o toksičnoj reakciji kod majke, uključuju, ali nisu ograničeni na:
- broj životinja na početku ispitivanja, broj preživelih životinja, broj gravidnih ženki i broj pobačaja i broj životinja koje su se prevremeno okotile;
- datum smrti tokom studije ili da li su životinje preživele do lišavanja života na human način;
- podatke o životinjama koje nisu preživele do planiranog lišavanja života na human način, ali se ne uključuju u statističko poređenje između grupa;
- datum uočavanja svakog abnormalnog kliničkog znaka i kasniji tok;
- telesna masa, promene telesne mase i masa gravidne materice, uključujući, po izboru, promenu telesne mase korigovane za težinu gravidne materice;
- potrošnja hrane i, ako je merena, potrošnja vode;
- nalazi obdukcije, uključujući težinu materice;
- NOAEL vrednosti za efekte na majku i rast i razvoj.
6) Krajnjim pokazateljima efekta na rast i razvoj po dozi za okot sa implantima, uključujući:
- broj žutih tela;
- broj implantacija, broj i procenat živih i mrtvih plodova i resorpcija;
- broj i procenat pred- i postimplantaciionih gubitaka.
7) Krajnjim pokazateljima efekta na rast i razvoj po dozi za okote sa živim plodovima, uključujući:
- broj i procenat živih potomaka;
- odnos polova;
- telesna masa, najbolje po polu i sa kombinovanim polovima;
- malformacije spoljnog izgleda, mekih tkiva i kostura i druge relevantne promene;
- kriterijumi za kategorizaciju, ako odgovara;
- ukupan broj i procenat plodova i okota sa spoljašnjim promenama, promenama mekog tkiva ili kostura, kao i vrsta i incidenca individualnih anomalija i drugih relevantnih promena.
8) Obrazloženju rezultata.
9) Zaključcima.
4. LITERATURA
1. Kavlock R.J. et al. (1996) A Simulation Study of the Influence of Study Design on the Estimation of Benchmark Doses for Developmental Toxicity. Risk Analysis 16; 399-410.
2. Kimmel, C.A. and Francis, E.Z. (1990) Proceedings of the Workshop on the Acceptability and Interpretation of Dermal Developmental Toxicity Studies. Fundamental and Applied Toxicology 14; 386-398.
3. Wong, B.A., et al. (1997) Developing Specialized Inhalation Exposure Systems to Address Toxicological Problems. CIIT Activities 17; 1-8.
4. US Environmental Protection Agency (1985) Subpart E-Specific Organ/Tissue Toxicity, 40 CFR 798.4350: Inhalation Developmental Toxicity Study.
5. Salewski, E. (1964) Faerbermethode zum Makroskopischen Nachweis von Implantations Stellen am Uterusder Ratte. Naunyn-Schmeidebergs Archiv fur Pharmakologie und Experimentelle Pathologie 247:367.
6. Edwards, J.A. (1968) The external Development of the Rabbit and Rat Embryo. In Advances in Teratology. D.H.M. Woolam (ed.) Vol. 3. Academic Press, NY.
7. Inouye, M. (1976) Differential Staining of Cartilage and Bone in Fetal Mouse Skeleton by Alcian Blue and Alizarin Red S. Congenital Anomalies 16; 171-173.
8. Igarashi, E. et al. (1992) Frequency Of Spontaneous Axial Skeletal Variations Detected by the Double Staining Techniquefor Ossified and Cartilaginous Skeleton in Rat Foetuses. Congenital Anomalies 32; :381-391.
9. Kimmel, C.A. et al. (1993) Skeletal Development Following Heat Exposure in the Rat. Teratology 47:229-242.
10. Marr, M.C. et al. (1988) Comparison of Single and Double Staining for Evaluation of Skeletal Development: The Effects of Ethylene Glycol (EG) in CD Rats. Teratology 37; 476.
11.Barrow, M.V. and Taylor, W.J. (1969) A Rapid Method for Detecting Malformations in Rat Foetuses. Journal of Morphology 127:291-306.
12. Fritz, H. (1974) Prenatal Ossification in Rabbits ss Indicative of Foetal Maturity. Teratology 11; 313-320.
13. Gibson, J.P. et al. (1966) Use of the Rabbit in Teratogenicity Studies. Toxicology and Applied Pharmacology 9; :398-408.
14. Kimmel, C.A. and Wilson, J.G. (1973) Skeletal Deviation in Rats: Malformations or Variations Teratology 8; 309-316.
15. Marr, M.C. et al. (1992) Developmental Stages of the CD (Sprague-Dawley) Rat Skeleton after Maternal Exposure to Ethylene Glycol. Teratology 46; 169-181.
16. Monie, I.W. et al. (1965) Dissection Procedures for Rat Foetuses Permitting Alizarin Red Staining of Skeleton and Histological Study of Viscera. Supplement to Teratology Workshop Manual, pp. 163-173.
17. Spark, C. and Dawson, A.B. (1928) The Order and Time of appearance of Centers of Ossification in the Fore and Hind Limbs of the Albino Rat, with Special Reference to the Possible Influence of the Sex Factor. American Journal of Anatomy 41; 411-445.
18. Staples, R.E. and Schnell, V.L. (1964) Refinements in Rapid Clearing Technique in the KOH-Alizarin Red S Method for Fetal Bone. Stain Technology 39; 61-63.
19. Strong, R.M. (1928) The Order Time and Rate of Ossification of the Albino Rat (Mus Norvegicus Albinus) Skeleton. American Journal of Anatomy 36; 313-355.
20. Stuckhardt, J.L. and Poppe, S.M. (1984) Fresh Visceral Examination of Rat and Rabbit Foetuses Used in Teratogenicity Testing. Teratogenesis, Carcinogenesis, and Mutagenesis 4; 181-188.
21. Walker, D.G. and Wirtschafter, Z.T. (1957) The Genesis of the Rat Skeleton. Thomas, Springfield, IL.
22. Wilson, J.G. (1965) Embryological Considerations in Teratology. In Teratology: Principles and Techniques, Wilson J.G. and Warkany J. (eds). University of Chicago, Chicago, IL, pp 251-277.
23. Wilson, J.G. and Fraser, F.C. (eds). (1977) Handbook of Teratology, Vol. 4. Plenum, NY.
24. Varnagy, L. (1980) Use of Recent Fetal Bone Staining Techniques in the Evaluation of Pesticide Teratogenicity. Acta Vet. Acad. Sci. Hung. 28; 233-239.
25. Staples, R.E. (1974) Detection of visceral Alterations in Mammalian Foetuses. Teratology 9; 37-38.
26. Van Julsingha, E.B. and C.G. Bennett (1977) A Dissecting Procedure for the Detection of Anomalies in the Rabbit Foetal Head. In: Methods in Prenatal Toxicology Neubert, D., Merker, H.J. and Kwasigroch, T.E. (eds.). University of Chicago, Chicago, IL, pp. 126-144.
27. US Environmental Protection Agency (1991) Guidelines for Developmental Toxicity Risk Assessment. Federal Register 56; 63798-63826.
28. Wise, D.L. et al. (1997) Terminology of Developmental Abnormalities in Common Laboratory Mammals (Version 1) Teratology 55; 249-292.
B.32. ISPITIVANJE KARCINOGENOSTI
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod.
1.2. DEFINICIJE
Videti Opšti uvod.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Obično se ispitivana supstanca primenjuje odgovarajućim putem sedam dana nedeljno kod nekoliko grupa eksperimentalnih životinja, jedna doza po grupi, tokom većeg dela njihovog životnog veka. Za vreme i posle izlaganja ispitivanoj supstanci eksperimentalne životinje se svakodnevno posmatraju kako bi se otkrili znakovi toksičnosti, naročito razvoj tumora.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE
Eksperimentalne životinje drže se pod eksperimentalnim uslovima čuvanja i hranjenja najmanje pet dana pre ispitivanja. Zdrave mlade životinje pre ispitivanja se slučajnim izborom raspoređuju u tretirane i kontrolne grupe.
1.6.1. Pripreme
1.6.1.1. Eksperimentalne životinje
Na osnovu rezultata prethodnih studija mogu se koristiti različite vrste životinja (glodari ili drugi). Ispitivanju se podvrgavaju zdravi mladi primerci životinja laboratorijskih vrsta koje se najčešće koriste u ovakvim eksperimentima, a davanje doze započinje u što kraćem vremenskom roku posle odbijanja od sise.
Varijacije u telesnoj masi korišćenih životinja na početku studije ne smeju biti veće od ± 20% srednje vrednosti. Ako se izvodi subhronična oralna studija kao uvod u dugoročnu studiju u obe studije se koriste iste vrste i sojevi životinja.
1.6.1.2. Broj i pol
Za glodare koristi se najmanje 100 životinja (50 ženki i 50 mužjaka) za svaki dozni nivo i istovremenu kontrolnu grupu. Uzimaju se ženke koje nisu ranije rađale i koje nisu gravidne. Ako se planiraju lišavanja života na human način u toku eksperimenta broj životinja se povećava za broj životinja koje su planirane za lišavanje života pre završetka ispitivanja.
1.6.1.3. Dozni nivoi i učestalost izlaganja
Koriste se najmanje tri doze ispitivane supstance uz istovremenu kontrolu. Najviša doza pokazuje znake minimalne toksičnosti, kao što je blago smanjenje dobijanja na telesnoj masi (manje od 10%), bez bitne promene normalnog životnog veka zbog efekata, osim kad se radi o tumorima.
Najniža doza ne sme da utiče na normalni rast, razvoj i dužinu života životinja niti da da bilo kakvu naznaku toksičnosti. Najniža doza ne sme da bude niža od 10% od visoke doze.
Srednja doza utvrđuje se u sredini raspona između visokih i niskih doza.
Kod izbora visine doza uzimaju se u obzir podaci iz prethodnih ispitivanja toksičnosti i studija.
Životinje se obično svakodnevno izlažu ispitivanoj supstanci. Ako se hemikalija daje u vodi za piće ili se umeša u hranu, neprekidno je na raspolaganju.
1.6.1.4. Kontrole
Istovremeno se koristi kontrolna grupa koja je u svakom pogledu ista kao eksperimentalne grupe, osim izlaganja ispitivanoj supstanci.
U posebnim okolnostima kao što su inhalacione studije koje uključuju aerosole ili korišćenje emulgatora čija biološka aktivnost nije okarakterisana u oralnim studijama, istovremeno se koristi i dodatna kontrolna grupa koja se ne izlaže pomoćnom sredstvu.
1.6.1.5. Put primene
Tri glavna puta primene su: peroralni, dermalni i inhalacioni. Izbor puta primene zavisi od fizičkih i hemijskih karakteristika ispitivane supstance i mogućeg puta izlaganja kod ljudi.
1.6.1.6. Studije sa peroralnim putem primene
Kad se ispitivana supstanca apsorbuje iz gastrointestinalnog trakta i ako je to put kojim ljudi mogu biti izloženi, predlaže se peroralni način primene, osim ako postoje kontraindikacije. Životinje mogu da dobiju ispitivanu supstancu u hrani, rastvorenu u vodi za piće ili im se može davati u kapsulama.
Idealno je dnevno doziranje tokom sedam dana nedeljno, jer primena doze na bazi pet dana nedeljno može da omogući oporavak ili povlačenje toksičnosti u periodu u kome se ne primenjuje ispitivana supstanca i time da utiče na rezultat i kasniju procenu. Doziranje na bazi pet dana nedeljno smatra se prihvatljivim.
1.6.1.7. Studije sa dermalnim putem primene
Kutano izlaganje premazivanjem kože može se izabrati da simulira glavni put izlaganja ljudi i kao sistem - model za izazivanje lezija na koži.
1.6.1.8. Studije sa inhalacionim putem primene
Kako studije sa inhalacionim putem primene predstavljaju tehnički problem koji je složeniji od drugih načina primene, ovde se detaljnije navodi taj način davanja. Dobra alternativa u specifičnim slučajevima može biti intratrahealno ukapavanje.
Dugotrajna izlaganja se osmišljavaju po projektovanoj izloženosti ljudi, pa se životinje dnevno izlažu šest sati posle izjednačenja koncentracija u komori, pet dana u nedelji (isprekidana izloženost) ili, kod eventualne ambijentalne izloženosti, 22 do 24 sata izloženosti tokom sedam dana nedeljno (neprekidna izloženost) sa oko jednim satom dnevno za hranjenje životinja u slično vreme i za održavanje komore. U oba slučaja životinje se izlažu fiksnim koncentracijama ispitivane supstance.
Glavna razlika između isprekidane i neprekidne izloženosti je u tome što u prvom slučaju postoji period od 17 do 18 sati tokom koga se životinje mogu oporaviti od efekata pojedinačne dnevne izloženosti, sa čak i dužim vremenom oporavka tokom vikenda.
Izbor isprekidane ili neprekidne izloženosti zavisi od ciljeva ispitivanja i od simulirane izloženosti ljudi. Razmatraju se određeni tehnički problemi. Na primer, prednosti neprekidne izloženosti za simuliranje uslova životne sredine mogu da deluju suprotno zbog potrebe davanja vode i hranjenja za vreme izloženosti i potrebe za složenijim (i pouzdanim) tehnikama za stvaranje i praćenje aerosola i pare.
1.6.1.9. Komore za izlaganje
Životinje se podvrgavaju ispitivanju u inhalacionim komorama dizajniranim tako da održavaju dinamičan protok vazduha s najmanje 12 izmena vazduha u jednom satu kako bi se obezbedio odgovarajući sadržaj kiseonika i ravnomerno raspoređena atmosfera. Kontrolne komore i komore za izlaganje su jednake u konstrukciji i dizajnirane tako da obezbeđuju uslove izlaganja koji su uporedivi u svim pogledima, izuzev izloženosti ispitivanoj supstanci. U komori se održava blagi negativni pritisak zbog sprečavanja ispuštanja ispitivane supstance u okruženje. Komore smanjuju na minimum prenaseljenost eksperimentalnih životinja. Kako bi se obezbedila stabilnost atmosfere u komori, pravilo je da ukupna "zapremina" eksperimentalnih životinja ne prelazi 5% zapremine komore.
Mere se i prate sledeći parametri:
a) Protok vazduha: preporučuje se da se brzina protoka vazduha kroz komoru neprestano prati;
b) Koncentracija: u periodu dnevnog izlaganja koncentracija ispitivane supstance ne sme da varira za više od ± 15% od srednje vrednosti. Tokom celog ispitivanja koncentracije iz dana u dan održavaju se što je moguće stalnijim;
v) Temperatura i vlaga: za glodare se temperatura održava na 22° C ± 2° C, a vlaga u komori na 30% do 70%, osim ako se koristi voda za suspendovanje ispitivane supstance u atmosferu komore. Preporučuje se da se temperatura i vlažnost neprestano prate;
g) Merenja veličine čestica: raspodela veličine čestica određuje se u atmosferi komore koja sadrži tečne ili čvrste aerosole. Čestice aerosola su takve veličine da ih eksperimentalne životinje mogu udisati. Uzorci atmosfere komore uzimaju se u zoni disanja životinja. Uzorak vazduha je reprezentativan za raspodelu čestica kojima su životinje izložene i obuhvata, na gravimetrijskoj bazi, sav suspendovani aerosol, čak i ako se ne može udisati mnogo aerosola. Za vreme razvoja generišućeg sistema, često se obavljaju analize veličine čestica, kako bi se obezbedila stabilnost aerosola, a posle toga onoliko često koliko je potrebno tokom izlaganja, kako bi se pravilno odredila raspodela čestica kojima su životinje bile izložene.
1.6.1.10. Trajanje ispitivanja
Trajanje ispitivanja karcinogenosti obuhvata veći deo životnog veka eksperimentalnih životinja. Ispitivanje se završava posle 18 meseci za miševe i hrčke, a posle 24 meseca za pacove. Za određene vrste životinja s dužim životnim vekom i/ili niskom stopom spontane pojave tumora ispitivanje se završava posle 24 meseca za miševe i hrčke, a posle 30 meseci za pacove. Alternativno je prihvatljiv završetak takve produžene studije kada broj preživelih životinja s najnižom dozom ili kontrolna grupa dostigne 25%. Kod završetka ispitivanja u kome je vidljiva razlika između polova, svaki pol se posebno razmatra. Ako zbog vidljive toksičnosti prevremeno ugine samo grupa izložena visokoj dozi, to ne mora da bude razlog za završetak ispitivanja, ako toksične manifestacije ne uzrokuju probleme u ostalim grupama. Kako bi se prihvatio negativan rezultat, najviše 10% životinja od bilo koje grupe može da se izgubi zbog autolize, kanibalizma ili problema usled manipulacije, a preživljavanje u svim grupama treba da bude veće od 50% posle 18 meseci za miševe i hrčke, a posle 24 meseca za pacove.
1.6.2. Postupak
1.6.2.1. Posmatranja
Dnevna posmatranja životinja u kavezu obuhvataju promene na koži i krznu, očima i sluznicama, kao i respiratornom, cirkulatornom sistemu i autonomnom i centralnom nervnom sistemu, somatomotornu aktivnost i model ponašanja.
Neophodno je redovno posmatrati životinje kako bi se obezbedilo, koliko je moguće, da se životinje ne izgube iz studije zbog kanibalizma, aotolize tkiva ili stavljanja na pogrešno mesto. Kada se primete životinje na samrti, one se izoluju i obdukuju.
Klinički znaci i mortalitet se beleže za sve životinje. Posebna pažnja se obraća na razvoj tumora: potrebno je zabeležiti vreme pojave; lokaciju, dimenzije, izgled i rast svakog golim okom vidljivog tumora ili tumora koji se palpira.
Merenja potrošnje hrane (i vode, ako se ispitivana supstanca daje u vodi za piće) obavljaju se jednom nedeljno tokom prvih 13 nedelja ispitivanja, a potom u intervalima od oko tri meseca, osim ako zdravstveno stanje ili promene telesne mase ne zahtevaju drugačije.
Telesna masa se beleži pojedinačno za sve životinje jednom nedeljno tokom prvih 13 nedelja ispitivanja, a posle toga najmanje na svake četiri nedelje.
1.6.2.2. Klinička ispitivanja
1.6.2.2.1. Hematologija
Ako se posmatranjem životinja u kavezima primeti pogoršanje zdravlja tokom studije, za sve životinje kod kojih je primećeno pogoršanje radi se diferencijalna krvna slika.
Posle 12 meseci, 18 meseci i pre lišavanja života na human način, od životinja se uzima uzorak krvi. Diferencijalna krvna slika radi se u uzorcima životinja iz grupe kojoj je davana visoka doza i životinja u kontrolnim grupama. Ako ti podaci, naročito oni dobijeni pre lišavanja života na human način ili podaci patološkog pregleda, ukažu na potrebu izrade diferencijalne krvne slike, ista se radi i u grupi s narednom nižom dozom.
1.6.2.2.2. Postmortalni pregled
Postmortalni pregled se izvodi na svim životinjama, uključujući one koje su uginule za vreme eksperimenta ili su lišene života na human način jer su nađene na samrti. Čuvaju se sve vidljive lezije, tumori ili lezije za koje se sumnja da su tumori.
U odgovarajućem medijumu za eventualni kasniji histopatološki pregled čuvaju se sledeći organi i tkiva: mozak (uključujući delove produžene moždine/ponsa, kore malog mozga, kore velikog mozga), hipofiza, tiroidna/paratiroidna žlezda, timusna tkiva, dušnik i pluća, srce, aorta, pljuvačne žlezde, jetra, slezina, bubrezi, nadbubrežne žlezde, gušterača, polne žlezde, materica, ostali genitalni organi, koža, jednjak, želudac, dvanaestopalačno crevo, tanko crevo, slepo crevo, debelo crevo, rektum, mokraćna bešika, reprezentativan limfni čvor, ženske mlečne žlezde, muskulatura bedra, periferni živci, grudna kost sa kostnom srži, femur (uključujući zglob), kičmena moždina na tri nivoa (cervikalna, srednje-torakalna i lumbalna) i oči.
Inflacija (naduvavanje) pluća i mokraćne bešike s fiksativom je optimalan način da se sačuvaju ta tkiva. Inflacija pluća kod inhalacionih studija je suštinska za odgovarajući histopatološki pregled. Kod inhalacionih studija čuva se čitav respiratorni trakt, uključujući nosnu šupljinu, ždrelo i grkljan.
1.6.2.2.3. Histopatologija
a) Kompletna histopatološka ispitivanja se obavljaju na organima i tkivima svih životinja koje su uginule ili su lišene života na human način tokom ispitivanja i u kontrolnoj grupi i grupi kojoj je davana visoka doza.
b) U svim grupama mikroskopski se pregledaju svi tumori vidljivi golim okom ili lezije za koje se sumnja da bi mogli biti tumori.
v) Ako postoji značajna razlika u incidenci neoplastičkih lezija u grupi kojoj je davana visoka doza i u kontrolnoj grupi, histopatološki pregledi na tim organima ili tkivima izvode se i u drugim grupama.
g) Ako je preživljavanje u grupi kojoj je davana visoka doza bitno manje nego u kontrolnoj grupi, obavlja se kompletno ispitivanje grupe naredne niže doze.
d) Ako u grupi kojoj je davana visoka doza postoji dokaz o izazivanju toksičnih ili drugih efekata koji su mogli uticati na neoplastičnu reakciju, obavlja se kompletno ispitivanje životinja u grupi s narednom nižom dozom.
2. PODACI
Podaci se navode tabelarno, gde se za svaku ispitivanu grupu životinja navodi: broj životinja na početku eksperimenta, broj životinja s tumorima otkrivenim tokom eksperimenta, vreme otkrivanja i broj životinja kod kojih je nađen tumor posle lišavanja života na human način. Svi dobijeni rezultati analiziraju se odgovarajućom statističkom metodom. Može se koristiti bilo koja usvojena statistička metoda.
3. IZVEŠTAJ
3.1. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju, ako je moguće, sadrži podatke o:
1) Vrsti, soju, izvoru, uslovima sredine, ishrani;
2) Eksperimentalnim uslovima: opis aparature za izlaganje (uključujući dizajn, vrstu, dimenzije aparature, kao i izvor vazduha, sistem za generisanje partikulata i aerosola, metoda za kondicioniranje vazduha, obrada iskorišćenog vazduha i metoda čuvanja životinja u eksperimentalnoj komori, ako se koristi. Opisuje se oprema za merenje temperature, vlažnosti i, kada odgovara, stabilnost koncentracije aerosola ili veličinu čestica).
3) Izlaganju:
- ovi podaci se prikazuju tabelarno sa srednjim vrednostima i merom varijabilnosti (npr. standardna devijacija) i obuhvataju podatke o:
a) brzini protoka vazduha kroz opremu za inhalaciju;
b) temperaturi i vlažnosti vazduha;
v) nominalnoj koncentraciji (ukupnom sadržaju ispitivane supstance koja se uvodi kroz opremu za inhalaciju, podeljenom sa zapreminom vazduha);
g) prirodi pomoćnog sredstva, ako je korišćeno;
d) koncentraciji supstance u zoni udisanja;
đ) srednjoj veličini čestica (gde je potrebno),
- nivoima doze (uključujući pomoćno sredstvo, ako je korišćeno) i koncentracije;
- o incidencama tumora po polu, dozi i vrsti tumora;
- vremenu smrti tokom ispitivanja ili da li su životinje preživele do žrtvovanja;
- o toksičnom odgovoru po polu i dozi;
- opis toksičnih ili drugih efekata;
- vremenu kada je primećen svaki znak abnormalnosti i njenom kasnijem toku;
- hrani i telesnoj masi;
- izvedenim hematološkim ispitivanjima i svim rezultatima istih;
- nalazima obdukcije;
- detaljan opis svih histopatoloških nalaza;
- statističkoj obradi rezultata s opisom korišćene metode.
4) Obrazloženju rezultata.
5) Tumačenju rezultata.
3.2. PROCENA I TUMAČENJE REZULTATA
Videti Opšti uvod.
4. LITERATURA
Videti Opšti uvod.
B.33. KOMBINOVANO ISPITIVANJE HRONIČNE TOKSIČNOSTI/KARCINOGENOSTI
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod.
1.2. DEFINICIJE
Videti Opšti uvod.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Cilj kombinovanog ispitivanja hronične toksičnosti karcinogenosti jeste određivanje hroničnih i karcinogenih efekata supstance kod sisara posle produžene izloženosti.
U tu svrhu u ispitivanje karcinogenosti se dodatno uključuje najmanje jedna prateća grupa i kontrolna prateća grupa. Doza koja se koristi kod prateće grupe sa visokom dozom može da bude veća od one koja se koristi kod grupe sa visokom dozom u ispitivanju karcinogenosti. Životinje se u ispitivanju karcinogenosti pregledaju kako bi se uočila opšta toksičnost, kao i karcinogeni odgovor. Životinje iz tretirane prateće grupe pregledaju se na opštu toksičnost.
Ispitivanom supstancom više grupa eksperimentalnih životinja tretira se sedam dana nedeljno, odgovarajućim putem, jednom dozom po grupi i to tokom najvećeg dela njihovog života. Za vreme i posle izlaganja ispitivanoj supstanci, eksperimentalne životinje se svakodnevno posmatraju radi otkrivanja znakova toksičnosti i razvoja tumora.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE
Životinje se drže pod eksperimentalnim uslovima smeštaja i ishrane najmanje pet dana pre ispitivanja. Pre ispitivanja zdrave mlade životinje se slučajnim izborom dodeljuju grupama za tretiranje i kontrolnim grupama.
1.6.1. Pripreme
1.6.1.1. Eksperimentalne životinje
Najpogodnija vrsta je pacov. Na osnovu rezultata prethodnih ispitivanja mogu se koristiti i druge vrste (glodarske ili ne). Koriste se mlade i zdrave životinje uobičajeno korišćenih laboratorijskih linija. Sa doziranjem se počinje što je moguće pre nakon odbijanja od sise.
Na početku ispitivanja varijacija u telesnoj masi životinja ne treba da bude veća od ± 20% srednje vrednosti. Kada se pre dugoročnog ispitivanja izvodi ispitivanje subhronične oralne toksičnosti u oba ispitivanja se koriste iste vrste i sojevi/linije životinja.
1.6.1.2. Broj i pol
Za glodare je potrebno koristiti najmanje 100 životinja (50 ženki i 50 mužjaka) za svaki dozni nivo i istovremenu kontrolnu grupu. Koriste se ženke koje nisu ranije rađale i koje nisu gravidne. Ukoliko se planira lišavanje života na human način u toku ispitivanja, potrebno je povećati broj životinja za onoliko koliko će biti lišeno života pre završetka ispitivanja.
Tretirana prateća grupa ili grupe za određivanje patologije različite od tumora obuhvataju po 20 životinja svakog pola, dok kontrolna prateća grupa obuhvata po 10 životinja svakog pola.
1.6.1.3. Dozni nivoi i učestalost izlaganja
U svrhu ispitivanja karcinogenosti potrebno je koristiti najmanje tri nivoa doza pored istovremene kontrolne grupe. Najveći dozni nivo izaziva znake minimalne toksičnosti, kao što je malo usporenje dobijanja na telesnoj masi (manje od 10%), a da se pri tome normalni životni vek ne menja bitno usled uzroka koji su drugačiji od pojave tumora.
Najmanji dozni nivo ne remeti normalni rast, razvoj i životni vek životinje, niti stvara ikakve naznake toksičnosti. Ovaj nivo nije niži od 10% visoke doze.
Srednja doza se ustanovljava na oko polovine raspona između visoke i niske doze.
Dozni nivoi se biraju uzimajući u obzir podatke iz prethodnih ispitivanja i studija toksičnosti.
U svrhu ispitivanja hronične toksičnosti u ispitivanje se uključuju dodatne prateće grupe - tretirane i istovremena kontrolna grupa. Visoka doza kod tretiranih pratećih životinja izaziva definitivne znake toksičnosti.
Učestalost izlaganja je svakodnevno. Ako se hemikalija daje u vodi za piće ili je umešana u hranu, potrebno je da voda i hrana budu stalno dostupne životinjama.
1.6.1.4. Kontrole
Koristi se istovremena grupa koja je u svakom pogledu identična tretiranim grupama, osim po izlaganju ispitivanoj supstanci.
U posebnim okolnostima, kao što je ispitivanje inhalacione toksičnosti koja uključuje aerosole ili upotreba emulgatora bez okarakterisanog biološkog dejstva u studijama oralne toksičnosti potrebno je koristiti dodatnu kontrolnu grupu koja nije izložena rastvaraču.
1.6.1.5. Put primene
Tri glavna puta primene su: peroralni, dermalni i inhalacioni. Izbor puta primene zavisi od fizičkih i hemijskih karakteristika ispitivane supstance i od mogućeg puta izlaganja kod ljudi.
1.6.1.6. Ispitivanja peroralno
Kada se ispitivana supstanca apsorbuje iz gastrointestinalnog trakta, a to je i put unosa kojim mogu biti izloženi ljudi, ukoliko ne postoje kontraindikacije najbolje je primeniti peroralni put primene. Životinje ispitivanu supstancu mogu da dobijaju putem hrane, rastvorenu u vodi za piće ili u obliku kapsule. U idealnom slučaju se koristi dnevno doziranje sedam dana u nedelji, jer doziranje na bazi pet dana nedeljno može da omogući oporavak ili povlačenje toksičnosti u periodu bez doziranja, što može da utiče na rezultat i procenu. Na osnovu razmatranja praktičnosti, doziranje na bazi pet dana nedeljno smatra se prihvatljivim.
1.6.1.7. Ispitivanja dermalnim putem primene
Za simulaciju u slučaju kada je glavni put izloženosti ljudi preko kože i kao model za izazivanje povreda kože, može se izabrati izlaganje premazivanjem kože.
1.6.1.8. Ispitivanja inhalacionim putem primene
Ispitivanja inhalacionim putem primene predstavljaju složeniji tehnički problem od drugih puteva primene, te se iz tog razloga daju detaljnija uputstva o tom načinu. U posebnim slučajevima intratrahijalna instilacija može da predstavlja opravdanu alternativu.
Dugotrajna izlaganja se planiraju prema projektovanom izlaganju ljudi tako što se posle uravnoteženja koncentracija u komori životinje dnevno izlažu po šest sati, pet dana u nedelji (povremeno izlaganje) ili, u odnosu na moguće izlaganje u životnoj sredini, 22 do 24 sata dnevno sedam dana nedeljno (neprekidno izlaganje), sa jednim satom dnevno (u približno isto vreme) za hranjenje životinja i za održavanje komora. U oba slučaja životinje su izložene fiksnim koncentracijama ispitivane supstance. Glavna razlika između povremenog i neprekidnog izlaganja je da u prvom slučaju postoji period od 17 do 18 sati tokom kog se životinje mogu oporaviti od efekta dnevnog izlaganja, uz još duži period oporavka tokom vikenda.
Izbor povremenog ili neprekidnog izlaganja zavisi od ciljeva ispitivanja i od simuliranog izlaganja ljudi. U obzir se uzimaju određene tehničke poteškoće. Na primer, prednosti neprekidnog izlaganja za simulaciju uslova životne sredine mogu biti smanjene zbog potrebe pojenja i hranjenja za vreme izlaganja i zbog potrebe za komplikovanijim (i pouzdanijim) tehnikama produkcije aerosola i para, kao i zbog praćenja.
1.6.1.9. Komore za inhalaciono izlaganje
Životinje se ispituju u komorama za inhalaciono izlaganje koje su projektovane da podržavaju dinamički protok od najmanje 12 promena vazduha na sat kako bi se obezbedio adekvatan sadržaj kiseonika i ravnomerno raspoređena atmosfera izlaganja. Kontrolne komore i komore za izlaganje su identične konstrukcije i dizajna, kako bi se obezbedili uslovi izlaganja koji se u svim aspektima mogu uporediti, osim u pogledu izlaganja ispitivanim supstancama. U unutrašnjosti komore obično se održava negativni pritisak zbog sprečavanja ispuštanja ispitivane supstance u okolni prostor. Komore su takve da se gomilanje eksperimentalnih životinja svede na minimum. Opšte je pravilo da, zbog stabilnosti atmosfere u komori, ukupna zapremina životinja ne sme da prelazi 5% zapremine komore.
Mere se i prate sledeći parametri:
a) Protok vazduha: protok vazduha kroz komoru neprekidno se kontroliše;
b) Koncentracija: tokom dnevne izloženosti koncentracija ne sme da odstupa više od ± 15% od srednje vrednosti. Za vreme ukupnog trajanja ispitivanja, koncentracije se iz dana u dan održavaju što je moguće stabilnijim;
v) Temperatura i vlažnost: za glodare temperaturu se održava na 22° C ± 2° C, a vlažnost u komori na 30% do 70%, osim u slučaju kada se upotrebljava voda za suspendovanje ispitivane supstance u atmosferu komore. Preporučuje se neprekidno praćenje temperature i vlažnosti;
g) Merenja veličine čestica: raspodela veličine čestica određuje se u atmosferi komore kada ona uključuje tečne ili čvrste aerosole. Čestice aerosola su veličine koju eksperimentalna životinja može da udiše. Uzorci atmosfere iz komora uzimaju se u zoni udisanja. Uzorak vazduha je reprezentativan za raspodelu čestica kojima su životinje izložene i pruža gravimetrijski podatak o ukupnom aerosolu, čak i onda kada se veći deo aerosola ne udiše. Analize veličine čestica obavljaju se često tokom razvijanja generatorskog sistema kako bi se obezbedila stabilnost aerosola, a potom onoliko često koliko je potrebno da se adekvatno utvrdi konzistencija raspodele čestica kojima su životinje izložene.
1.6.1.10. Trajanje ispitivanja
Trajanje dela ispitivanja karcinogenosti podrazumeva najveći deo normalnog životnog veka eksperimentalnih životinja. Završetak ispitivanja u slučaju miševa i hrčaka je u 18 meseci starosti, a za pacove 24 meseca. Kod određenih sojeva životinja koje imaju duži životni vek i/ili nižu stopu spontane pojave tumora, završetak ispitivanja je 24 meseca za miševe i hrčke, a 30 meseci za pacove. Alternativno se može prihvatiti završetak takvog produženog ispitivanja kada broj preživelih u grupi sa najnižom dozom ili kontrolnoj grupi dostigne 25%. Ako se prilikom završetka ispitivanja uoče znatne razlike među polovima, svaki pol se odvojeno razmatra. Kad zbog očigledne toksičnosti pre vremena ugine samo grupa koja je primala visoku dozu, ispitivanje se ne prekida ukoliko toksičnost ne uzrokuje probleme u drugim grupama. Da bi se prihvatio negativni rezultat ispitivanja, ne sme biti izgubljeno više od 10% životinja u svakoj grupi zbog autolize, kanibalizma ili postupanja, a preživljavanje kod svih grupa ne sme da bude manje od 50% posle 18 meseci za miševe i hrčke, a posle 24 meseca za pacove.
Prateće grupe od 20 doziranih životinja po polu i 10 priključenih kontrolnih životinja po polu koje se koriste za ispitivanje hronične toksičnosti se na ispitivanju zadržavaju najmanje 12 meseci. Te životinje se lišavaju života na human način zbog ispitivanja patologije koja je u vezi sa ispitivanom supstancom, a koja nije dodatno zakomplikovana gerontološkim promenama.
1.6.2. Postupak
1.6.2.1. Posmatranja
Životinje u kavezima svakodnevno se posmatraju u pogledu promena na koži i krznu, očima i sluznicama, kao i disajnom, cirkulatornom, autonomnom i centralnom nervnom sistemu, promena somatomotornih aktivnosti i modela ponašanja.
Na životinjama u ispitivanim pratećim grupama u odgovarajućim intervalima se obavljaju klinički pregledi.
Redovno posmatranje životinja potrebno je zbog obezbeđivanja, koliko je moguće, da ne dođe do gubitka ispitivanih životinja zbog kanibalizma, autolize tkiva ili greškom. Životinje na samrti se odmah odvajaju i vrši se obdukcija.
Za sve životinje potrebno je zabeležiti kliničke znake, uključujući i neurološke i promene na oku i uginuća. Posebna pažnja se posvećuje razvoju tumora: vremenu nastanka, mestu, dimenzijama, izgledu i progresiji svakog vidljivog i opipljivog tumora. Potrebno je zabeležiti i vreme nastanka i progresiju toksičnih efekata.
Nedeljno se meri potrošnja hrane (i vode, kad se ispitivana supstanca daje putem vode za piće) tokom prvih 13 nedelja ispitivanja, a posle toga u intervalima od oko tri meseca, osim ako zdravstveno stanje ili promene telesne mase ne zahtevaju drugačije.
Telesna masa se beleži individualno za sve životinje, jednom nedeljno tokom prvih 13 nedelja perioda ispitivanja, a posle toga najmanje jednom u svake četiri nedelje.
1.6.2.2. Klinički pregledi
1.6.2.2.1. Hematologija
Hematološki pregled (tj. sadržaj hemoglobina, ukupna zapremina ćelija, ukupan broj crvenih krvnih ćelija, ukupan broj belih krvnih ćelija, krvnih pločica ili drugi parametri koagulabilnosti) se obavlja posle tri meseca, posle šest meseci, a posle toga u intervalima od oko šest meseci i na završetku ispitivanja na uzorcima krvi uzetih od 10 pacova po polu iz svih grupa. Ako je moguće, u svakom intervalu se uzimaju uzorci od istih pacova.
Ukoliko se tokom posmatranja utvrdi pogoršanje zdravstvenog stanja životinja, potrebno je uraditi diferencijalnu krvnu sliku odgovarajućih životinja.
Diferencijalna krvna slika vrši se na uzorcima životinja iz grupe s najvećom dozom i kontrolne grupe. Diferencijalna krvna slika vrši se na sledećoj nižoj grupi/grupama samo ako se utvrde značajne razlike između najviše grupe i kontrole ili ako je indikovano zbog patoloških nalaza.
1.6.2.2.2. Analiza mokraće
Za analizu se uzimaju uzorci mokraće od 10 pacova svakog pola iz svih grupa, ako je moguće od istih pacova, u istim intervalima kao i hematološki pregledi.
Za svaku pojedinu životinju ili na "pool" uzorku po polu po grupi glodara određuje se:
- izgled: zapremina i gustina po pojedinoj životinji;
- proteini, glukoza, keton, okultna krv (semi-kvantitativno);
- mikroskopski pregled sedimenata (semi-kvantitativno).
1.6.2.2.3. Medicinska biohemija
U intervalima od oko šest meseci i na završetku ispitivanja uzimaju se uzorci krvi od svih životinja koje nisu glodari za biohemijska merenja i 10 uzoraka od pacova po polu iz svih grupa, ako je moguće uvek od istih životinja. Potrebno je uzeti prethodne uzorke od životinja koje nisu glodari. U plazmi ovih uzoraka određuje se:
- koncentracija ukupnih proteina;
- koncentracija albumina;
- ispitivanja funkcije jetre (kao što su aktivnost alkalne fosfataze, aktivnost glutmat piruvat transaminazeX i aktivnost glutamat oksaloacetat transaminazeXI), gama glutamil transpeptidaza, ornitin dekarboksilaza;
- metabolizam ugljenih hidrata, kao što je glukoza u krvi posle gladovanja;
- ispitivanja funkcije bubrega kao što je azot u ureji u krvi (u daljem tekstu: BUN).
_____________
X poznata kao serumska alanin aminotransferaza
XI poznata kao serumska aspartat aminotransferaza
1.6.2.2.4. Postmortalni pregled
Kompletna obdukcija se izvodi na svim životinjama, uključujući i one koje su uginule tokom ispitivanja ili koje su lišene života na human način jer su nađene na samrti. Pre lišavanja života na human način potrebno je od svih životinja uzeti uzorke krvi za različite analize. Čuvaju se svi vidljivi tumori i ozlede za koje se sumnja da su tumori. Preduzimaju se sve mere za povezivanje uočenih promena s mikroskopskim nalazima.
Svi organi i tkiva se čuvaju za histopatološke preglede. To podrazumeva sledeće organe i tkiva: mozakXII (medula/pons, kora malog mozga, kora velikog mozga); hipofiza, tiroidea (uključujući paratiroideu), timus, pluća (uključujući traheju), srce, aortu, pljuvačne žlezde, jetruXII, slezinu, bubregeXII, nadbubrežne žlezdeXII, jednjak, želudac, duodenum, jejenum, ileum, slepo crevo, kolon, rektum, mokraćna bešika, limfni čvorovi, pankreas, pollne žlezdeXII, pomoćni genitalni organi; ženska mlečna žlezda, koža, muskulatura, periferni živci, kičma (cervikalna, torakalna, lumbalna), sternum sa koštanom srži i femur (sa zglobom) i oči.
Iako inflacija (naduvavanje) pluća i mokraćne bešike pomoću fiksativa predstavlja optimalni način za konzerviranje tih tkiva, u ispitivanjima inhalacione toksičnosti naduvavanje pluća je neophodno za odgovarajući histopatološki pregled. Kod specifičnih ispitivanja, kao što su ispitivanja inhalacione toksičnosti, potrebno je pregledati ceo respiratorni trakt, uključujući i nos, ždrelo i grkljan.
Ukoliko se obavljaju druga klinička ispitivanja, dobijeni podaci treba da budu dostupni pre mikroskopskog pregleda, jer patologu mogu dati značajne smernice.
______________
XII Meri se masa organima (uzetim od po 10 životinja po polu po grupi glodara)
1.6.2.2.5. Histopatologija
Za deo ispitivanja hronične toksičnosti:
Potrebno je detaljno pregledati sve sačuvane organe svih životinja iz prateće grupe visoke doze i iz kontrolne grupe. Ako se patološki nalaz uzorka iz prateće grupe visoke doze može povezati s ispitivanom supstancom, ciljni organi svih životinja iz ostalih tretiranih pratećih grupa se na kraju ispitivanja podvrgavaju potpunom i detaljnom histološkom pregledu, kao i oni iz pogođenih grupa iz dela ispitivanja karcinogenosti.
Za deo ispitivanja karcinogenosti:
a) Na organima i tkivima svih životinja koje su uginule ili bile lišene života na human način tokom ispitivanja, kao i svih životinja iz kontrolne grupe i grupe visoke doze obavlja se potpuni histopatološki pregled;
b) Svi tumori vidljivi golim okom ili promene za koje se sumnja da su tumori nađene kod svih grupa i na bilo kom organu pregledaju se mikroskopski;
v) Ukoliko postoji značajna razlika u učestalosti pojave neoplastičnih promena kod grupe visokog doznog nivoa i kontrolne grupe, potrebno je obaviti histopatološki pregled na određenom organu ili tkivu u drugim grupama;
g) Ako je preživljavanje kod grupe visokog doznog nivoa znatno manje nego u kontrolnoj grupi, potrebno je detaljno pregledati sledeću grupu sa nižim nivoom doze;
d) Ako kod grupe visokog doznog nivoa postoji dokaz o uzrokovanju toksičnosti ili o drugim efektima koji mogu da utiču na neoplastičnu reakciju, potrebno je detaljno pregledati grupu sledećeg nižeg doznog nivoa.
2. PODACI
Podaci se navode tabelarno i za svaku ispitivanu grupu navodi se: broj životinja na početku ispitivanja, broj životinja kod kojih su se pojavili tumori ili toksični efekti utvrđenih tokom ispitivanja, vreme otkrivanja i broj životinja kod kojih su tumori ustanovljeni po lišavanju života na human način. Rezultati se procenjuju odgovarajućom statističkom metodom. Može se primeniti bilo koja priznata statistička metoda.
3. IZVEŠTAJ
3.1. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju, ako je moguće, sadrži podatke o:
1) Vrsti, soju, izvoru, uslovima sredine, ishrani.
2) Uslovima ispitivanja: opis aparature za inhalaciono izlaganje (uključujući dizajn, tip, dimenzije, izvor vazduha, sistem generisanja čestica i aerosola, način klimatizovanja vazduha, tretman iskorišćenog vazduha i metoda smeštaja životinja u eksperimentalnim komorama, ako se primenjuju. Opisuje se uređaj za merenje temperature, vlažnosti i, kada odgovara, stabilnosti koncentracije aerosola i veličine čestica).
3) Izlaganju:
- ovi podaci se navode u obliku tabele u kojoj se prikazuju srednje vrednosti i mera odstupanja (tj. standardna devijacija) i uključuju:
a) podatke o protoku vazduha kroz opremu za inhalaciju;
b) temperaturu i vlažnost vazduha;
v) nominalne koncentracije (ukupna količine ispitivane supstance dodate u opremu za inhalaciju, podeljena sa zapreminom vazduha);
g) prirodu rastvarača, ako je korišćen;
d) koncentraciju u zoni udisanja;
đ) srednju veličina čestica (gde je primenljivo);
- doznim nivoima (uključujući rastvarač, ako se koristi) i koncentracije;
- učestalosti pojave tumora po polu, dozi i tipu tumora;
- vremenu smrti tokom ispitivanja ili da li su životinje preživele do kraja, uključujući prateću grupu;
- toksičnoj reakciji po polu i dozi;
- opis toksičnih ili drugih efekata;
- vremenu uočavanja svakog znaka abnormalnosti i njen dalji tok;
- oftalmološkim nalazima;
- hrani i telesnoj masi;
- primenjenim hematološkim ispitivanjima i svim rezultatima;
- primenjenim medicinsko-biohemijskim ispitivanjima i svim rezultatima (uključujući i analizu urina);
- obdukcionim nalazima;
- detaljan opis svih histopatoloških nalaza;
- statističkoj obradi rezultata sa opisom primenjenih metoda.
4) Obrazloženju rezultata.
5) Tumačenju rezultata.
3.2. PROCENA I TUMAČENJE REZULTATA
Videti Opšti uvod.
4. LITERATURA
Videti Opšti uvod.
B.34. ISPITIVANJE TOKSIČNOSTI PO REPRODUKCIJU NA JEDNOJ GENERACIJI
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod.
1.2. DEFINICIJE
Videti Opšti uvod.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Ispitivana supstanca primenjuje se u rastućim dozama u grupama mužjaka i ženki. Mužjacima se daje supstanca tokom rasta i tokom najmanje jednog spermatogenenog ciklusa (oko 56 dana kod miša, a 70 dana kod pacova) kako bi se izazvali štetni efekti supstance koja se ispituje na spermatogenezu.
Ženke roditeljske (P) generacije se doziraju tokom najmanje dva kompletna ciklusa "estrusa" kako bi se izazvali štetni efekti ispitivane supstance po "estrus". Posle toga se životinje pare. Ispitivana supstanca se primenjuje kod oba pola tokom perioda parenja, a posle toga samo ženkama tokom graviditeta i tokom perioda dojenja.
Za primenu inhalacionim putem metoda zahteva modifikaciju.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE
1.6.1. Pripreme
Pre ispitivanja zdrave mlade životinje se slučajnim izborom raspoređuju u tretirane i kontrolne grupe. Životinje se drže u uslovima eksperimentalnog smeštaja i ishrane najmanje pet dana pre ispitivanja.
Preporučuje se da se ispitivana supstanca daje u hrani ili vodi za piće. Prihvataju se i drugi putevi primene. Tokom odgovarajućeg eksperimentalnog perioda svim životinjama se daje supstancu na isti način. Ako se upotrebljava rastvarač ili aditivi da bi se olakšalo doziranje, oni ne smeju da izazivaju toksični efekat.
Doziranje je sedam dana nedeljno.
1.6.1.1. Eksperimentalne životinje
1.6.1.1.1. Izbor vrste
Preporučene vrste su pacovi ili miševi. Koriste se zdrave životinje koje ranije nisu bile podvrgnute ispitivanjima. Ne koriste se sojevi za koje se zna da su slabo plodni. Eksperimentalne životinje treba okarakterisati po vrsti, soju, polu, telesnoj masi i/ili starosti.
Za adekvatnu procenu plodnosti potrebno je posmatrati i mužjake i ženke. Kada ispitivanje započne nijedna eksperimentalna životinja, bilo iz tretirane ili iz kontrolne grupe, ne sme da bude u fazi sisanja.
1.6.1.2. Broj i pol
Svaka eksperimentalna i kontrolna grupa ima dovoljan broj životinja kako bi se dobilo oko 20 gravidnih ženki neposredno pre ili blizu okota.
Cilj je da se proizvede dovoljno trudnoća i potomstva kako bi se obezbedila svrsishodna procena potencijala supstance da utiče na plodnost, graviditet i majčinsko ponašanje u P generaciji životinja, i odojčad, rast i razvoj F1 potomaka od začeća do odbijanja od sise.
1.6.1.3. Uslovi ispitivanja
Obezbeđuje se slobodan pristup hrani i vodi. Uoči koćenja, gravidne ženke se smeštaju u posebne kaveze za koćenje ili uzgoj i daje im se materijal za gnežđenje.
1.6.1.4. Dozni nivoi
Koriste se najmanje tri tretirane grupe i kontrolna grupa. Ako se za primenu ispitivane supstance upotrebljava rastvarač, kontrolna grupa prima najveću korišćenu zapreminu rastvarača. Ukoliko ispitivana supstanca uzrokuje smanjeno uzimanje ili iskorišćenost hrane, neophodno je koristiti dodatnu kontrolnu grupu koja bi se hranila. U idealnom slučaju, osim ako postoji ograničenje fizičko/hemijske prirode ili biološki efekti ispitivane supstance, najviši dozni nivo izaziva toksičnost, ali ne smrtnost kod životinja roditelja (P). Srednja doza izaziva minimalne toksične efekte koji bi se mogli pripisati ispitivanoj supstanci, a niska doza ne izaziva nikakve primetne štetne efekte kod roditelja ili potomaka. Kada se daje prisilnim hranjenjem ili kao kapsula, doza koja se daje svakoj životinji određuje se prema njenoj telesnoj masi i podešavati svake nedelje prema promenama telesne mase. Doze za gravidne ženke mogu se određivati prema telesnoj masi nultog ili šestog dana graviditeta, ako je poželjno.
1.6.1.5. Ispitivanje granične doze
U slučaju supstance sa niskom toksičnošću, ako dozni nivo od najmanje 1.000 mg/kg ne proizvodi nikakav dokaz interferencije sa reprodukcijom, ispitivanja pri drugim doznim nivoima nisu neophodna. Ako preliminarno ispitivanje pri visokom doznom nivou sa jasnim dokazom toksičnosti po majku ne pokaže štetne efekte na plodnost, nisu neophodna ispitivanja drugih doznih nivoa.
1.6.2. Izvođenje ispitivanja
1.6.2.1. Eksperimentalni rasporedi
Dnevno doziranje roditeljskih (P) mužjaka se počinje kad su stari oko pet do devet nedelja, a nakon što su odbijeni od sise i aklimatizovani najmanje pet dana. Kod pacova doziranje se nastavlja 10 nedelja pre perioda parenja (kod miševa osam nedelja). Mužjaci se lišavaju života na human način i pregledaju ili na kraju perioda parenja ili se, alternativno, mužjaci mogu zadržati na eksperimentalnoj ishrani za moguću produkciju drugog legla i usmrtiti i pregledati negde pre kraja studije. Doziranje roditeljskih (P) ženki počinje se posle najmanje pet dana aklimatizacije i nastavlja najmanje dve nedelje pre parenja. Dnevno doziranje P ženki nastavlja se tokom perioda parenja od tri nedelje, graviditeta i do odbijanja od sisa F1 potomaka. Potrebno je razmotriti modifikaciju rasporeda doziranja na osnovu drugih podataka o ispitivanoj supstanci, kao što su podaci o indukciji metabolizma ili bioakumulaciji.
1.6.2.2. Postupak parenja
U ispitivanju reproduktivne toksičnosti primenjuje se parenje 1:1 (jedan mužjak s jednom ženkom) ili 1:2 (jedan mužjak s dve ženke).
Kod postupka parenja 1:1, jedna ženka se smešta s istim mužjakom do pojave graviditeta ili posle isteka perioda od tri nedelje. Svakog jutra ženka se pregleda na prisutnost sperme ili vaginalnog čepa. Nulti dan graviditeta definiše se kao dan kada je utvrđena prisutnost sperme ili vaginalnog čepa.
Parovi koji ne uspeju da se spare procenjuju se kako bi se utvrdio uzrok neplodnosti.
Taj postupak može da uključi procedure kao što su dodatna mogućnost parenja sa drugim plodnim mužjacima ili ženkama, mikroskopski pregled reproduktivnih organa i ispitivanja ciklusa "estrusa" ili spermatogeneze.
1.6.2.3. Veličine legla
Životinjama koje su primale supstancu tokom ispitivanja plodnosti dozvoljava se normalno koćenje i podizanje mladih do stadijuma odbijanja od sise, bez standardizacije legla.
Tamo gde se primenjuje standardizacija preporučuje se sledeća procedura: između prvog i četvrtog dana posle rođenja veličina legla se može podesiti odstranjivanjem prekobrojnih mladunaca selekcijom kako bi se postiglo, što je približnije moguće, veličina od četiri mužjaka i četiri ženke po leglu. Ako broj mužjaka ili ženki ne dopušta selekciju od četiri mladunca svakog pola po leglu, prihvatljivo je i delimično sastavljanje (npr. pet mužjaka i tri ženke). Prilagođavanje se ne obavlja u leglima s manje od osam mladih.
1.6.2.4. Posmatranja
Tokom perioda ispitivanja potrebno je bar jednom dnevno posmatrati svaku životinju. Beleže se promene ponašanja, znaci teškog ili produženog koćenja i svi znaci toksičnosti, uključujući i mortalitet. Za vreme perioda pred parenje i perioda parenja potrebno je dnevno obavljati merenje potrošnje hrane. Posle koćenja i za vreme dojenja merenje potrošnje hrane (i vode, ako se ispitivana supstanca daje u vodi za piće) se obavlja istog dana kad i merenje mase legla. Telesna masa P mužjaka i ženki meri se prvog dana doziranja, a posle toga jednom nedeljno. Ova zapažanja se navode za svaku odraslu životinju pojedinačno.
Trajanje gestacije računa se od nultog dana graviditeta. Svako leglo se pregleda što je moguće pre po porođaju, kako bi se utvrdio broj i pol mladih, mrtvorođenih, živih mladih i prisutnost većih anomalija.
Mrtvorođeni i mladunci koji su lišeni života na human način četvrtog dana čuvaju se i ispituju kako bi se utvrdili mogući defekti. Živi mladunci se prebrojavaju i meri se masa legla jutro posle rođenja i četvrtog i sedmog dana, a posle toga jednom nedeljno, sve do završetka studije, kada se životinje mere pojedinačno. Beleže se fizičke ili abnormalnosti u ponašanju kod ženki ili mladunaca.
1.6.2.5. Patologija
1.6.2.5.1. Postmortalni pregled
U vreme lišavanja života na human način ili smrti tokom ispitivanja životinje P generacije se makroskopski pregledaju kako bi se utvrdile strukturne abnormalnosti ili patološke promene, s posebno posvećenom pažnjom na pregled organa reproduktivnog sistema. Mrtvi ili umirući mladunci se pregledaju kako bi se uočili defekti.
1.6.2.5.2. Histopatologija
Jajnici, uterus, cerviks, vagina, testisi, epididimisi, semene kesice, prostata, koagulišuća žlezda, hipofiza i ciljni organ(i) svih P životinja se čuvaju za mikroskopski pregled. U slučaju da se ti organi ne pregledaju u ispitivanjima drugih doznih nivoa, potrebno ih je mikroskopski pregledati kod svih životinja izloženih visokim dozama i kod kontrolnih životinja i onih koje su uginule tokom studije kada je izvodljivo.
Organi koji pokazuju abnormalnosti kod tih životinja pregledaju se i kod svih drugih P životinja. Tom prilikom potrebno je izvršiti mikroskopski pregled svih tkiva koja pokazuju veće patološke promene. Kao što je preporučeno kod postupka parenja, reproduktivni organi životinja kod kojih postoji sumnja na neplodnost podvrgavaju se mikroskopskom pregledu.
2. PODACI
Podaci se navode tabelarno, tako da se za svaku ispitivanu grupu navodi: broj životinja na početku ispitivanja, broj plodnih mužjaka, broj gravidnih ženki, tipovi promena i procenat životinja koje pokazuju svaki tip promene.
Kada je moguće, numerički rezultati se ocenjuju pomoću odgovarajuće statističke metode. Može se primeniti bilo koja prihvaćena statistička metoda.
3. IZVEŠTAJ
3.1. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju, ako je moguće, sadrži podatke o:
- vrsti/soju;
- toksičnom odgovoru po polu i dozi, uključujući plodnost, gestaciju i viabilitet;
- vremenu smrti tokom studije ili da li su životinje preživele do trenutka predviđenog lišavanja života na human način ili završetka ispitivanja;
- tabeli sa podacima o telesnoj masi svakog legla, srednja vrednost: masa mladunaca i pojedinačna telesna masa mladunaca na kraju ispitivanja;
- toksičnim ili drugim efektima na reprodukciju, potomke ili postnatalni rast;
- danu utvrđivanja svakog abnormalnog znaka i njegovog daljeg toka;
- telesnoj masi P životinja;
- nalazima obdukcije;
- detaljan opis svih mikroskopskih nalaza;
- statističkoj obradi rezultata, gde je moguće;
- obrazloženju rezultata;
- tumačenju rezultata.
3.2. PROCENA I TUMAČENJE REZULTATA
Videti Opšti uvod.
4. LITERATURA
Videti Opšti uvod.
B.35. ISPITIVANJE TOKSIČNOSTI PO REPRODUKCIJU NA DVE GENERACIJE
1. METODA ISPITIVANJA
Ova metoda zasniva se na Uputstvu za ispitivanje OECD 416 (2001).
1.1. UVOD
Ova metoda ispitivanja reprodukcije na dve generacije namenjena je da obezbedi opšte podatke u vezi efekata ispitivane supstance na integritet i učinak muških i ženskih reproduktivnih sistema, uključujući funkciju polnih žlezda, estrus ciklus, parenje, začeće, gestaciju, porođaj, laktaciju i odbijanje od sise i rast i razvoj potomstva. Studija može da pruži i podatke o efektima ispitivane supstance na neonatalni morbiditet, mortalitet i preliminarne podatke o prenatalnoj i postnatalnoj toksičnosti po rast i razvoj i da usmeri buduća ispitivanja. Pored proučavanja rasta i razvoja F1 generacije, ova eksperimentalna metoda se predviđa i za procenu integriteta i sposobnosti muških i ženskih reproduktivnih sistema, kao i rasta i razvoja F2 generacije. Za dodatne podatke o toksičnosti po rast i razvoj i funkcionim nedostacima, u ovaj protokol mogu se uključiti dodatni segmenti ispitivanja, konsultujući metode za toksičnost po rast i razvoj i/ili neurotoksični efekti za rast i razvoj neurotoksičnost u periodu rasta i razvoja, ako odgovara, ili se ovi efekti mogu proučavati u posebnim studijama, koristeći odgovarajuće eksperimentalne metode.
1.2. PRINCIP METODE
Ispitivana supstanca se daje u rastućim dozama muškim i ženskim jedinkama u grupama. Mužjacima P generacije daju se doze za vreme rasta i tokom bar jednog celog ciklusa spermatogeneze (približno 56 dana kod miševa i 70 dana kod pacova) kako bi se izazvali svi štetni efekti na spermatogenezu. Efekti na spermu se određuju brojnim parametrima sperme (npr. morfologija i pokretljivost spermatozoida) i pripremom tkiva i detaljnom histopatologijom. Ukoliko postoje podaci o spermatogenezi iz prethodne studije koja je trajala dovoljno dugo i u kojoj je primenjeno ponovljeno doziranje, npr. 90-dnevna studija, mužjake P generacije nije potrebno uključiti u procenu. Preporučuje se da uzorci ili digitalni snimci sperme P generacije budu sačuvani kako bi se omogućila kasnija procena. Ženke P generacije se doziraju tokom rasta i tokom nekoliko estrus ciklusa kako bi se uočili bilo kakvi štetni efekti ispitivane supstance na normalnost estrus ciklusa. Ispitivana supstanca se daje roditeljskim (P) životinjama za vreme parenja, za vreme graviditeta koji su usledili i tokom odbijanja od sise njihovog F1 potomstva. Po odbijanju od sise nastavlja se sa davanjem supstance F1 potomstvu tokom njihovog rasta do odraslog doba, parenja i produkcije F2 generacije, sve dok F2 generacija ne bude odbijena od sise.
Obavljaju se klinička opažanja i patološki pregledi na svim životinjama kako bi se utvrdili znakovi toksičnosti sa posebnim naglaskom na efekte na integritet i sposobnost muških i ženskih reproduktivnih sistema i rast i razvoj potomstva.
1.3. OPIS METODE
1.3.1. Izbor životinjskih vrsta
Preporučena vrsta za ispitivanje je pacov. Ukoliko se koriste druge vrste, daje se opravdanje, a neophodne su i odgovarajuće izmene metode. Ne koriste se sojevi sa slabom plodnošću ili oni sa poznatom visokom učestalošću pojave nedostataka u rastu i razvoju. Na početku studije, varijacija u telesnoj masi životinja koje se koriste mora biti minimalna i ne sme da prelazi 20% srednje telesne mase za svaki pol.
1.3.2. Uslovi smeštaja i ishrane
Temperatura u eksperimentalnoj prostoriji za životinje je 22° C (± 3 °C). Relativna vlažnost je najmanje 30%, i po mogućnosti ne prelazi 70%, osim za vreme čišćenja prostorije. Idealna vlažnost je 50% do 60%. Osvetljenje je veštačko, uz izmenu 12 sati svetla i 12 sati mraka. Za hranjenje se koristi uobičajena laboratorijska ishrana uz neograničenu količinu vode za piće. Izbor ishrane je pod uticajem potrebe da se obezbedi odgovarajuća mešavina ispitivane supstance koja se primenjuje ovom metodom.
Životinje mogu biti smeštene pojedinačno ili u kavezima u malim grupama istog pola. Parenje se obavlja u odgovarajućim kavezima. Posle dokazane kopulacije, sparene ženke se smeštaju pojedinačno u kaveze za porođaj ili materinstvo. Spareni pacovi mogu se držati u malim grupama i odvojeni jedan ili dva dana pre koćenja. Sparenim životinjama se obezbeđuje određeni odgovarajući materijal za gnežđenje neposredno pre porođaja.
1.3.3. Priprema životinja
Koriste se zdrave mlade životinje koje su se aklimatizovale na laboratorijske uslove tokom najmanje pet dana i koje nisu bile podvrgnute prethodnim eksperimentalnim postupcima. Eksperimentalne životinje treba okarakterisati prema vrsti, soju, izvoru, polu, telesnoj masi i/ili starosti. Kako bi se izbeglo parenje srodnih životinja mora biti poznato bilo koje srodstvo među životinjama. Životinje se slučajnim izborom razvrstavaju u kontrolne ili tretirane grupe (preporučuje se stratifikacija po telesnoj masi). Kavezi se raspoređuju tako da se smanje mogući efekti rasporeda kaveza. Svakoj životinji se pripisuje jedinstveni identifikacioni broj. Za P generaciju ovo se radi pre početka doziranja. Za F1 generaciju ovo se radi prilikom odbijanja od sise za životinje koje su odabrane za parenje. Podaci o leglu iz kog potiče životinja čuvaju se za sve izabrane F1 životinje. Pojedinačna identifikacija mladunaca odmah posle rođenja preporučuje se prilikom individualnog merenja mladunaca ili prilikom razmatranja bilo kakvog funkcionalnog ispitivanja.
Roditeljske (P) životinje treba da budu stare oko pet do devet nedelja na početku doziranja. Životinje svih eksperimentalnih grupa su, koliko je izvodljivo, ujednačene telesne mase i starosti.
1.4. POSTUPAK
1.4.1. Broj i pol životinja
Svaka eksperimentalna i kontrolna grupa ima dovoljan broj životinja kako bi se dobilo ne manje od 20 gravidnih ženki na porođaju ili pred porođaj. Za supstance koje uzrokuju neželjene efekte tokom tretmana (npr. sterilnost, izražena toksičnost pri visokim dozama) ovo nije moguće. Cilj je da se dobije dovoljno trudnoća kako bi se obezbedila značajna ocena potencijala supstance da utiče na plodnost, trudnoću i materinsko ponašanje, sisanje, rast i razvoj F1 potomstva od začeća do zrelosti, kao i na rast i razvoj njihovog potomstva (F2) do odbijanja od sise. Ako se ne postigne željeni broj gravidnih životinja (odnosno 20) studija se ne smatra obavezno neodgovarajućom i procenjuje se od slučaja do slučaja.
1.4.2. Priprema doza
Preporučuje se da se ispitivana supstanca daje peroralno (putem hrane, vode za piće ili sondom), osim ukoliko se neki drugi put primene (npr. dermalno ili inhalaciono) ne smatra prikladnijim.
Kada je potrebno, ispitivana supstanca se rastvara ili suspenduje u odgovarajućem vehikulumu. Preporučuje se da se, kada god je moguće, koristi vodeni rastvor/suspenzija, a zatim da se razmotri rastvor/emulzija u ulju (npr. kukuruzno ulje) i zatim rastvor u nekom drugom vehikulumu. Za vehikulume koji nisu voda moraju biti poznate toksične karakteristike. Potrebno je odrediti stabilnost ispitivane supstance u vehikulumu.
1.4.3. Doziranje
Koristi se najmanje tri dozna nivoa i istovremena kontrola. Osim ukoliko nije ograničena fizičkom i hemijskom prirodom ili biološkim efektima ispitivane supstance, bira se najveći dozni nivo sa ciljem da se izazove toksičnost ali ne smrt ili teška patnja. U slučaju neočekivane smrtnosti, studija sa stopom smrtnosti od manje od 10% kod roditeljskih (P) životinja još uvek je prihvatljiva. Opadajući niz doznih nivoa bira se tako da se pokaže bilo kakav efekat povezan sa doziranjem i nivoom doza pri kojima se ne primećuju štetni efekti (NOAEL). Često su optimalni dvostruki do četvorostrukih intervala za postavljanje opadajućih doznih nivoa, a dodatak četvrte eksperimentalne grupe je često prihvatljiviji od korišćenja vrlo velikih intervala (npr. više od faktora 10) između doziranja. Za studije ishrane intervali doza ne smeju biti veći od trostrukih. Nivoi doza se biraju uzimajući u obzir bilo koje postojeće podatke o toksičnosti, posebno rezultate iz studija s ponovljenim doziranjem. Uzimaju se u obzir bilo koji raspoloživi podaci o metabolizmu i kinetici ispitivanog jedinjenja ili sličnih materijala. Ovi podaci pomažu u pokazivanju adekvatnosti režima doziranja.
Kontrolna grupa je netretirana grupa ili grupa sa vehikulumom ukoliko se on koristi za primenu ispitivane supstance. Osim tretmana sa ispitivanom supstancom, životinje u kontrolnim grupama se tretiraju na identičan način kao i jedinke iz tretiranih grupa ispitivanja. Ukoliko se koristi vehikulum, kontrolna grupa dobija vehikulum u najvećoj zapremini koja se koristi. Ukoliko se ispitivana supstanca daje putem hrane i uzrokuje smanjeno uzimanje ili iskoristljivost hrane, korišćenje kontrolne grupe za unos hrane može se smatrati neophodnim. Alternativno, podaci iz kontrolisanih studija namenjenih za ocenjivanje efekata smanjene potrošnje hrane na reproduktivne parametre koriste se umesto istovremene kontrolne grupe za unos hrane.
Uzimaju se u obzir sledeće karakteristike vehikuluma i drugih aditiva: efekti na apsorpciju, raspodelu, metabolizam ili zadržavanje ispitivane supstance; efekte na hemijska svojstva ispitivane supstance koja mogu izmeniti njena toksična svojstva i efekte na potrošnju hrane ili vode, ili na nutritivni status životinja.
1.4.4. Ispitivanje granične doze
Ukoliko se u oralnoj studiji pri jednom doznom nivou od najmanje 1.000 mg/kg TM/dan ili, za primenu putem hrane ili vode odgovarajući procenat koji se koristi u postupku opisanom u ovoj studiji, ne uzrokuje uočljive toksične efekte kod roditeljskih životinja ili njihovog potomstva, i ako se toksičnost ne može očekivati na osnovu podataka iz strukturno i/ili metabolički sličnih jedinjenja, nije neophodna cela studija uz korišćenje nekoliko doznih nivoa. Primenjuje se ispitivanje granične doze, osim u slučaju kad izloženost ljudi ukazuje na potrebu za korišćenjem viših nivoa oralne doze. Za druge načine primene kao što su inhalacija i dermalna primena, fizička i hemijska svojstva ispitivane supstance, kao što su rastvorljivost, često mogu ukazati na granicu najvećeg ostvarljivog nivoa izlaganja.
1.4.5. Primena doza
Životinje se doziraju ispitivanom supstancom sedam dana u nedelji. Preporučuje se oralna primena (hrana, piće ili sonda). Ukoliko se koristi neki drugi put primene, to se opravdava i vrše se potrebne izmene. Sve životinje se doziraju na isti način tokom odgovarajućeg perioda ispitivanja. Kad se ispitivana supstanca primenjuje sondom, primena se obavlja putem trbušne cevi. Zapremina primenjene tečnosti ne sme preći 1 ml/kg TM (0,4 ml/100 g TM najviše za kukuruzno ulje), osim u slučaju vodenih rastvora gde se može koristiti 2 ml/100 g TM. Osim kod iritabilnih i korozivnih supstanci koje pokazuju lošije efekte u većim koncentracijama, varijabilnost zapremine koja se primenjuje minimalizuje se prilagođavanjem koncentracije kako bi se obezbedila konstantna zapremina pri svim doznim nivoima. Kod prisilnog hranjenja mladunci primaju eksperimentalnu supstancu kroz mleko, sve dok se ne mogu direktno dozirati posle odbijanja od sise. Kada se supstanca primenjuje putem hrane ili vode za piće, mladunci dodatno primaju ispitivanu supstancu čim počnu samostalno da se hrane za vreme poslednje nedelje perioda laktacije.
Kod supstance koja se daje putem hrane ili vode za piće, važno je obezbediti da količina primenjene ispitivane supstance ne utiče na balans normalne ishrane ili vode. Kad se ispitivana supstanca daje putem hrane, može se koristiti stalna prehrambena koncentracija (ppm) ili stalni dozni nivo prema telesnoj masi životinje. Alternativne metode se obrazlažu. Ukoliko se supstanca daje prisilno, doza se primenjuje u slično vreme svakog dana i prilagođena najmanje nedeljno kako bi se održao konstantni dozni nivo u odnosu na telesnu masu životinje. Podaci o placentalnoj raspodeli uzimaju se u obzir prilikom prilagođavanja prisilne doze zasnovane na telesnoj masi.
1.4.6. Eksperimentalni rasporedi
Dnevno doziranje roditeljskih (P) mužjaka i ženki započinje se kad su stari pet do devet nedelja. Dnevno doziranje F1 mužjaka i ženki započinje po odbijanju od sise. U slučaju primene ispitivane supstance putem hrane ili vode za piće, direktno izlaganje F1 mladunaca ispitivanoj supstanci može započeti već za vreme perioda laktacije. Za oba pola (P i F1), doziranje se nastavlja najmanje 10 nedelja pre perioda parenja. Doziranje se nastavlja za oba pola za vreme dvonedeljnog perioda parenja. Muške jedinke se lišavaju života na human način i pregledaju kada više ne budu potrebne za ocenjivanje reproduktivnih efekata. Za roditeljske (P) ženke, doziranje se nastavlja tokom trudnoće i sve do odbijanja od sise F1 potomaka. Uzimaju se u obzir modifikacije u rasporedu doziranja na osnovu raspoloživih podataka o ispitivanoj supstanci, uključujući postojeće podatke o toksičnosti, indukciji metabolizma ili bioakumulaciji. Doza za svaku životinju je zasnovana na najskorijim merenjima telesne mase. Obratiti pažnju prilikom prilagođavanja doze tokom poslednjeg tromesečja trudnoće.
Tretiranje P i F1 mužjaka i ženki nastavlja se do lišavanja života na human način. Sve P i F1 odrasli mužjaci i ženke se lišavaju života na human način kada više nisu potrebni za procenu reproduktivnih efekata. F1 potomstvo koje nije odabrano za parenje i čitavo F2 potomstvo lišava se života na human način posle odbijanja od sise.
1.4.7. Postupak parenja
1.4.7.1. Roditeljsko (P) parenje
Za svako parenje svaka ženka se smešta sa jednim mužjakom iz istog doznog nivoa (1:1 parenje) sve dok ne dođe do kopulacije ili dok ne proteknu dve nedelje. Ženke se svaki dan pregledaju na prisutnost sperme ili vaginalnog čepa. Nulti dan trudnoće definiše se kao dan kad se pronađe sperma ili vaginalni čep. U slučaju da parenje nije uspešno, razmatra se ponovno parenje ženki sa dokazanim mužjacima iz iste grupe. Parovi se jasno označavaju u podacima. Parenje srodnih jedinki se izbegava.
1.4.7.2. F1 parenje
Za parenje F1 potomstva izabere se najmanje jedan mužjak i jedna ženka pri odbijanju od sise iz svakog legla za parenje sa drugim mladuncima iz istog doznog nivoa ali iz drugog legla, kako bi se proizvela F2 generacija. Izbor mladunaca iz svakog legla je slučajan ukoliko se ne uoče značajne razlike u telesnoj masi ili izgledu između jedinki u leglu. U slučaju da se takve razlike uoče, biraju se najbolji predstavnici svakog legla. Ovo se najbolje obavlja na osnovu telesne mase ali može biti pogodnije da se obavi na osnovu izgleda. F1 potomstvo se ne pari sve dok ne dostigne punu seksualnu zrelost.
Parovi bez potomaka pregledaju se kako bi se utvrdio uzrok neplodnosti. To može uključivati postupke kao što su: dodatne prilike za parenje sa drugim dokazanim jedinkama, mikroskopski pregled reproduktivnih organa i ispitivanje estrus ciklusa ili spermatogeneze.
1.4.7.3. Drugo parenje
U nekim slučajevima, kao što su promene u veličini legla povezane sa tretmanom ili uočavanje sumnjivog efekta za vreme prvog parenja, preporučuje se da se P ili F1 odrasle jedinke ponovo pare kako bi se proizvelo drugo leglo. Preporučuje se da se ponovno pare mužjaci ili ženke koje nisu proizvele potomstvo s dokazanim priplodnim životinjama suprotnog pola. Ukoliko se smatra da je drugo leglo neophodno u bilo kojoj generaciji, životinje se ponovno pare približno jednu nedelju posle odbijanja od sise prethodnog legla.
1.4.7.4. Veličina legla
Životinjama se omogućava da imaju normalna legla i da odgajaju svoje potomstvo do odbijanja od sise. Standardizacija veličine legla nije obavezna. Ako se izvodi standardizacija, korišćena metoda se detaljno opisuje.
1.5. POSMATRANJA
1.5.1. Klinička posmatranja
Svakog dana se obavlja opšta klinička posmatranja, a u slučaju prisilnog hranjenja njegov vremenski raspored uzima u obzir predviđeno vreme za pojavu maksimalnih efekata posle doziranja. Beleže se promene u ponašanju, znaci teškog ili dugotrajnog koćenja i svi znaci toksičnosti. Detaljniji pregled svake životinje obavlja se najmanje jednom nedeljno i najbolje ga je obavljati prilikom merenja telesne mase životinja. Dva puta dnevno, a tokom vikenda jednom dnevno, kad odgovara, sve životinje se pregledaju na morbiditet i smrtnost.
1.5.2. Telesna masa i konzumiranje, hrane/vode roditeljskih životinja
Telesna masa roditeljskih životinja (P i F1) meri se prvog dana doziranja i najmanje jednom nedeljno posle toga. Telesna masa roditeljskih ženki (P i F1) meri se najmanje nultog, sedmog, četrnaestog, dvadesetog ili dvadeset prvog dana gestacije, kao i za vreme laktacije u iste dane kada se meri masa legla i na dan kad se životinje lišavaju života na human način. Ova opažanja se navode pojedinačno za svaku odraslu životinju. Pre parenja i u periodu gestacije potrošnja hrane se meri najmanje jednom nedeljno. Unos vode meri se najmanje jednom nedeljno ukoliko se ispitivana supstanca primenjuje putem vode.
1.5.3. Estrus ciklus
Dužina i normalnost estrus ciklusa ocenjuju se za P i F1 ženke vaginalnim brisevima pre parenja i po izboru za vreme parenja, dok se ne pronađu dokazi parenja. Kod dobijanja vaginalnih/cervikalnih ćelija, pazi se kako bi se izbeglo nadraživanje (prekidanje, perturbacija, poremećaj) sluznice i potom izazivanje lažne trudnoće1.
1.5.4. Parametri sperme
Za sve P i F1 mužjake prilikom lišavanja života na human način beleži se masa testisa i epididimisa i po jedan od organa se čuva za histopatološki pregled (videti odeljke 1.5.7. i 1.5.8.1. ove metode). Od podskupa od najmanje deset mužjaka iz svake grupe P i F1 mužjaka preostali testisi i epididimisi se koriste za prebrojavanje spermatida otpornih na homogenizaciju i rezerve spermatozoida kaudalnog dela epididimisa. Iz iste podgrupe mužjaka spermatozoidi iz kaude epididimidisa ili vas deferens-a se prikupljaju zbog ocenjivanja njihove mobilnosti i morfologije. Ukoliko se uoče efekti u vezi sa tretmanom ili kada postoje dokazi o tome iz drugih studija o mogućim efektima na spermatogenezu, ocenjivanje spermatozoida se obavlja kod svih mužjaka u svakoj doznoj grupi. U protivnom se brojanje može ograničiti na P i F1 mužjake iz kontrolne i visokodozne grupe.
Broji se ukupni broj spermatida testisa otpornih na homogenizaciju i spermatozoida kaudalnog dela epididimisa2, 3. Kaudalne rezerve spermatozoida mogu se izvesti iz koncentracije i zapremine sperme u suspenziji korišćenoj za kompletiranje kvalitativnih ocenjivanja i broja spermatozoida dobijenog kasnijim mlevenjem i/ili homogenizaciom preostalog kaudalnog tkiva. Brojanje se obavlja na odabranoj podgrupi mužjaka iz svih doznih grupa odmah nakon lišavanja života na human način, osim ako se ne naprave video ili digitalni snimci ili ako se primerci ne zamrznu i analiziraju kasnije. U tim slučajevima kontrolne i grupe velikih doza prve se analiziraju. Ukoliko se ne uoče efekti u vezi sa tretmanom (npr. efekti na broj spermatozoida, pokretljivost ili morfologiju), preostale grupe se ne analiziraju. Kada se takvi efekti uoče u grupi visoke doze, onda se ocenjuju i grupe nižih doza.
Pokretljivost epididimalnih (ili ductus deferens) spermatozoida se ocenjuje ili snima odmah nakon lišavanja života na human način. Sperma se pribavlja uz minimalnu štetu i razblažuje za analizu pokretljivosti korišćenjem prihvatljivih metoda4. Procenat progresivno pokretljivih spermatozoida određuje se subjektivno ili objektivno. Kada se obavlja kompjuterska analiza pokretljivosti5, 6, 7, 8, 9, 10 izvođenje progresivne pokretljivosti se oslanja na korisnički definisane granične vrednosti za prosečnu brzinu i pravac putanje ili na linearni indeks. Ukoliko su uzorci snimljeni11 ili ukoliko postoje slike zabeležene na drugačiji način u trenutku obdukcije, može se obaviti kasnija analiza P i F1 mužjaka samo iz kontrolne i grupe s visokom dozom, osim ukoliko se ne uoče efekti vezani za tretman. U tom slučaju se analiziraju i grupe nižih doza. Ukoliko nema video ili digitalnog zapisa svi uzorci u svim tretiranim grupama se analiziraju pri postmortalnom pregledu.
Radi se morfološka analiza uzorka spermatozoida iz epididimidisa (ili vas deferens-a). Spermatozoidi (najmanje 200 po uzorku) se analiziraju kao fiksirani, mokri preparat12 i klasifikuju kao normalni ili abnormalni. Primeri morfološke abnormalnosti spermatozoida uključuju fuziju, izolovane glave i deformisane glave i/ili repove. Ocenjivanje se obavlja na odabranoj podgrupi mužjaka svih doznih grupa, bilo odmah nakon lišavanja života na human način ili kasnije na osnovu video ili digitalnih snimaka. Jednom fiksirani razmazi mogu se čitati i kasnije. U tim slučajevima mogu se prvo analizirati kontrolne i grupe visokih doza.
Ukoliko se ne uoče efekti u vezi sa tretmanom (npr. efekti na morfologiju spermatozoida), preostale grupe nije potrebno analizirati. Kada se takvi efekti uoče kod grupe visoke doze, onda se i grupe nižih doza ocenjuju.
Ukoliko je bilo koji od gore navedenih parametara za ocenjivanje sperme već ispitan kao deo studije sistemske toksičnosti koja traje najmanje 90 dana, takve analize nije neophodno ponavljati u studiji na dve generacije. Preporučuje se da se sačuvaju uzorci ili digitalni snimci sperme P generacije, kako bi se po potrebi omogućila kasnija analiza.
1.5.5. Potomstvo
Svako leglo se pregleda što je moguće pre nakon koćenja (dan laktacije 0) kako bi se ustanovio broj i pol mladunaca, mrtvorođeni, živorođeni i prisutnost većih anomalija. Mladunci koji su pronađeni mrtvi na dan 0, ukoliko nisu macerirani, pregledaju se kako bi se otkrili mogući defekti i uzrok smrti i čuvaju se. Živi mladunci se prebrojavaju i meri se telesna masa svakog pojedinačno, po rođenju (dan laktacije 0) ili na dan 1 i danima koji su redovno predviđeni za merenje telesne mase, npr. dani 4, 7, 14. i 21. dan laktacije. Beleže se fizičke ili anomalije u ponašanju uočene na majkama ili potomstvu.
Fizički razvoj potomstva beleži se pre svega prema dobijanju na telesnoj masi. Drugi fizički parametri (npr. otvaranje uha i oka, izbijanje zuba, rast dlake) mogu dati dodatne podatke, ali je ove podatke najbolje ocenjivati u kontekstu podataka o polnom sazrevanju (npr. starost i telesna masa prilikom otvaranja vagine ili balano-prepucijalne separacije)13. Funkcionalna ispitivanja (npr. motorike, senzorne funkcije, ontogenog refleksa) F1 potomstva pre i/ili posle odbijanja od sise, posebno ona vezana uz polno sazrevanje preporučuju se ukoliko nisu uključena u posebne studije. Starost prilikom sazrevanja vagine i prepucijalne separacije utvrđuje se za F1 mladunce koji se odbijaju od sise, a koji su odabrani za parenje. Anogenitalno rastojanje se meri nultog postnatalnog dana kod F2 mladunaca ukoliko je izazvano alteracijama u odnosu polova u F1 ili vremenu polnog sazrevanja.
Funkcionalna posmatranja mogu da se izostave kod grupa koje na drugi način pokazuju jasne znake štetnih efekata (npr. značajno smanjenje u dobijanju na telesnoj masi, itd). Ukoliko se rade funkcionalna istraživanja, ne izvode se na mladuncima koji su odabrani za parenje.
1.5.6. Postmortalni pregled
Prilikom zaključivanja ili smrti u toku studije, sve roditeljske životinje (P i F1), svi mladunci sa spoljnjim abnormalnostima ili kliničkim znacima, kao i jedno slučajno odabrano mladunče po polu po leglu iz F1 i F2 generacije makroskopski se pregleda kako bi se uočile bilo kakve strukturne abnormalnosti ili patološke promene. Posvećuje se posebna pažnja organima reproduktivnog sistema. Mladunci nađeni na samrti pa humano lišeni života i mrtva mladunčad, kada nisu macerirana, ispituju se na moguće defekte i/ili uzrok smrti i čuvaju.
Materice svih ženki koje su jednom rađale pregledaju se na prisustvo i broj implantacionih mesta na način koji ne kompromituje histopatološko ocenjivanje.
1.5.7. Merenje mase organa
Prilikom zaključivanja utvrđuje se telesna masa i masa sledećih organa za sve P i F1 roditeljske životinje (parni organi se mere individualno):
- materica, jajnici;
- testisi, epididimidis (ukupno i kauda);
- prostata;
- semene kesice sa koagulacionim žlezdama i njihove tečnosti i prostata (kao jedna jedinica);
- mozak, jetra, bubrezi, slezina, hipofiza, tiroidna i adrenalne žlezde i poznati ciljni organi.
Utvrđuje se terminalna telesna masa za F1 i F2 mladunce koji su odabrani za obdukciju. Mere se sledeći organi od jednog slučajno odabranog mladunca po polu po leglu (videti odeljak 1.5.6. ove metode): mozak, slezina i timus.
Rezultati obdukcije i merenja mase organa procenjuju se u kontekstu sa zapažanjima iz drugih studija sa ponovljenim dozama, kada je izvodljivo.
1.5.8. Histopatološka ispitivanja
1.5.8.1. Roditeljske životinje
Sledeći organi i tkiva roditeljskih (P i F1) životinja ili reprezentativni uzorci istih se fiksiraju i čuvaju u odgovarajućem medijumu za histopatološku analizu:
- vagina, materica sa cerviksom i jajnici (sačuvani u odgovarajućem fiksativu);
- jedan testis (sačuvan u Bouin-ovom ili sličnom fiksativu), jedan epididimis, semene kesice, prostata i koagulaciona žlezda;
- prethodno identifikovani ciljni organi od svih P i F1 životinja odabranih za parenje.
Potpuna histopatološka ispitivanja gore navedenih sačuvanih organa obavljaju se za sve jedinke iz grupe kojoj je davana visoka doza i kontrolne grupe P i F1 životinja izabranih za parenje. Ispitivanje jajnika P životinja je opcionalno. Organi koji pokazuju promene vezane za tretman ispituju se u grupama niske i srednje doze kako bi se pomoglo određivanje NOAEL. Reproduktivni organi životinja u grupama s niskim i srednje visokim dozama za koje se sumnja na smanjenu plodnost, npr. onih koje se nisu parile, koje nisu začele, iznele ili rodile zdravo potomstvo ili na čiji je estrus ciklus, broj spermatozoida, mobilnost ili morfologiju bilo uticaja, podvrgavaju se histopatološkom ocenjivanju. Ispituju se sva veća oštećenja kao što su atrofija ili tumori.
Obavlja se detaljan histopatološki pregled testisa (npr. korišćenjem Bouinovog fiksativa, učvršćivanjem parafinom i poprečnim presecima debljine 4 µm do 5 µm) kako bi se identifikovali efekti vezani za tretman kao što su zadržane spermatide, slojevi ili tipovi germinativnih ćelija koji nedostaju, divovske ćelije sa više jedara ili otpadanje spermatogenih ćelija u lumen14. Pregled intaktnog epididimisa uključuje pregled glave, tela i repa što se može postići analizom uzdužnih preseka. Epididimis se pregleda na infiltraciju leukocita, promene u preovlađujućim tipovima ćelija, nenormalne tipove ćelija i fagocitozu spermatozoida. Bojenje PAS-om i hematoksilinom se koristi za pregled muških reproduktivnih organa.
Postlaktacioni jajnik sadrži primordijalne i rastuće folikule kao i velika žuta tela laktacije. Histopatološki pregled otkriva kvalitativno smanjenje populacije primordijalnih folikula. Obavlja se kvantitativna analiza primordijalnih folikula za F1 ženke; broj životinja, izbor preseka jajnika i veličina uzorka preseka su statistički odgovarajući za postupak ocenjivanja koji se koristi. Pregled uključuje prebrojavanje primordijalnih folikula koji mogu biti kombinovani sa malim rastućim folikulama zbog poređenja tretiranih i kontrolnih jajnika15, 16, 17, 18, 19.
1.5.8.2. Mladunci odbijeni od sisanja
Izuzetno, nenormalno tkivo i ciljani organi svih mladunaca sa spoljnim abnormalnostima ili kliničkim znacima, kao i oni organi od slučajno odabranog mladunaca po polu po leglu iz obe F1 i F2 generacije, koji nisu odabrani za parenje biće fiksirani i čuvani u odgovarajućem medijumu za histopatološki pregled. Puna histopatološka karakterizacija sačuvanog tkiva obavlja se uz poseban naglasak na organe reproduktivnog sistema.
2. PODACI
2.1. OBRADA REZULTATA
Podaci se navode pojedinačno i tabelarno. Navode se podaci za svaku eksperimentalnu grupu i svaku generaciju i to: broj životinja na početku ispitivanja, broj životinja koje su pronađene mrtve za vreme ispitivanja ili lišene života na human način, vreme bilo koje smrti ili lišavanja života na human način, broj plodnih životinja, broj gravidnih ženki, broj životinja koje pokazuju znake toksičnosti, opis uočenih znakova toksičnosti, uključujući, vreme nastanka, trajanje i ozbiljnost toksičnih efekata, tipove zapažanja kod roditelja i potomstva, tipove histopatoloških promena i sve relevantne podatke o leglu.
Numerički rezultati se ocenjuju odgovarajućom opšteprihvaćenom statističkom metodom. Statističke metode se biraju prilikom koncipiranja studije i treba ih opravdati. Statistički modeli doza-odgovor mogu biti korisni za analizu podataka. Izveštaj uključuje dovoljno podataka o metodi analize i o primenjenom kompjuterskom programu kako bi nezavisni ocenjivač/statističar mogao ponovno da proceni i rekonstruiše analizu.
2.2. OCENJIVANJE REZULTATA
Nalazi ove studije toksičnosti po reprodukciju na dve generacije ocenjuju se u smislu uočenih efekata uključujući obdukcione i mikroskopske nalaze. Ocenjivanje uključuje vezu ili nepostojanje veze između doze ispitivane supstance i prisustva ili odsustva pojave i ozbiljnosti abnormalnosti, uključujući veća oštećenja, identifikovane ciljne organe, efekt na plodnost, kliničke abnormalnosti, efekt na reprodukciju i na legla, promene telesne mase, efekte na smrtnost i sve druge toksične efekte. Prilikom ocenjivanja rezultata ispitivanja uzimaju se u obzir fizička i hemijska svojstva ispitivane supstance i kada su dostupni toksikokinetičke podatke.
Pravilno izvedeno ispitivanje toksičnosti po reprodukciju obezbeđuje zadovoljavajuću procenu nivoa bez efekta i razumevanje štetnih efekata na reprodukciju, rađanje, laktaciju, postnatalni rast i razvoj, uključujući rast i polni razvoj.
2.3. TUMAČENJE REZULTATA
Ispitivanje toksičnosti po reprodukciju na dve generacije daje podatke o efektima ponovljenog izlaganja supstanci za vreme svih faza reproduktivnog ciklusa. Studija daje podatke o reproduktivnim parametrima i o razvoju, rastu, sazrevanju i preživljavanju potomstva. Rezultati studije tumače se zajedno sa nalazima subhroničkih studija, ispitivanja prenatalnog rasta i razvoja, toksikokinetičkih i drugih raspoloživih studija. Rezultati ove studije mogu se koristiti u proceni potrebe za daljim ispitivanjem hemikalije. Ekstrapolacija rezultata studije na čoveka je prihvatljiva do određenog stepena. Najbolje je da se koriste za obezbeđivanje podataka o nivou bez efekta i za dozvoljeno izlaganje ljudi20, 21, 22, 23.
3. IZVEŠTAJ
Izveštaj o ispitivanju, ukoliko je moguće, sadrži podatke o:
1) Ispitivanoj supstanci:
- fizička priroda i, ako je relevantno, fizička i hemijska svojstva;
- identifikacioni podaci;
- čistoća.
2) Vehikulumu (ako odgovara):
- opravdanje za izbor vehikuluma ako nije u pitanju voda.
3) Eksperimentalnim životinjama:
- korišćena vrsta/soj;
- broj, starost i pol životinja;
- izvor, uslovi smeštaja, ishrana, materijal za gnežđenje, itd.;
- individualna težina životinja na početku ispitivanja;
4) Uslovima ispitivanja:
- obrazloženje izbora nivoa doze;
- detalji o ispitivanoj supstanci formulacija/priprema hrane, postignute koncentracije;
- stabilnost i homogenost preparata;
- detalji o primeni ispitivane supstance;
- preračunavanje iz koncentracije ispitivane supstance u hrani/vodi za piće (ppm) do postignute doze (mg/kg telesna masa/dan), ako je primenljivo;
- podaci o kvalitetu hrane i vode.
5) Rezultatima:
- potrošnja hrane i vode, ako je dostupno, iskorišćenje hrane (dobijanje na telesnoj masi po gramu konzumirane hrane) i potrošnja ispitivanog materijala za P i F1 životinje, osim za period kohabitacije i za poslednju trećinu perioda laktacije;
- podaci o apsorpciji (ako su dostupni);
- podaci o telesnoj masi za P i F1 životinje koje su izabrane za parenje;
- podaci o masi legla i mladunaca;
- telesna masa pri lišavanju života na human način i apsolutna i relativna masa organa za roditeljske životinje;
- priroda, ozbiljnost i trajanje kliničkih zapažanja (bilo da su reverzibilni ili ne);
- vreme smrti tokom studije ili da li su životinje preživele do lišavanja života na human način;
- podaci o toksičkim reakcijama po polu i dozi, uključujući indekse parenja, plodnosti, gestacije, rođenja, održivosti i laktacije; u izveštaju se navode brojevi korišćeni za izračunavanje ovih indeksa;
- toksični i drugi efekti na reprodukciju, potomstvo, postnatalni rast, itd.;
- nalazi obdukcije;
- detaljan opis svih histopatoloških nalaza;
- broj P i F1 životinja sa normalnim ciklusom i trajanje ciklusa;
- ukupni broj spermatozoida kaude epididimis, procenat progresivno pokretljivih spermatozoida, procenat morfološki normalnih spermatozoida i procenat spermatozoida sa svakom identifikovanom abnormalnošću;
- vreme do parenja, uključujući broj dana do parenja;
- trajanje gestacije;
- broj implantacija, žutih tela, veličina legla;
- broj živorođenih i post-implantacioni gubitak;
- broj mladunaca sa većim vidljivim abnormalnostima, ukoliko je određen navodi se broj kržljavaca;
- podaci o fizičkim obeležjima kod mladunaca i drugi podaci o postnatalnom rastu i razvoju; proučena fizička obeležja se opravdavaju;
- podaci o funkcionalnim zapažanjima kod mladunaca i odraslih jedinki, ako je primenljivo;
- statistička analiza rezultata, kad odgovara.
6) Obrazloženju rezultata.
7) Zaključcima, uključujući NOAEL vrednosti za efekte na majku i potomstvo.
4. LITERATURA
1. Sadleir, R.M.F.S. (1979). Cycles and Seasons, In: Reproduction in Mammals: I. Germ Cells and Fertilization, C.R. Auston and R.V. Short (eds.), Cambridge, New York.
2. Gray, L.E. et al., (1989). A Dose-Response Analysis of Methoxychlor-Induced Alterations of Reproductive Development and Function in the Rat. Fundamental and Applied Toxicology 12:92-108.
3. Robb, G.W. et al., (1978). Daily Sperm Production and Epididymal Sperm Reserves of Pubertal and Adult Rats. Journal of Reproduction and Fertility 54:103-107.
4. Klinefelter, G.R. et al., (1991). The Method of Sperm Collection Significantly Influences Sperm Motion Parameters Following Ethane Dimethanesulfonate Administration in the Rat. Reproductive Toxicology 5:39 44
5. Seed, J. et al. (1996). Methods for Assessing Sperm Motility, Morphology, and Counts in the Rat, Rabbit, and Dog: a Consensus Report. Reproductive Toxicology 10(3):237- 244.
6. Chapin, R.E. et al., (1992).Methods for Assessing Rat Sperm Motility. Reproductive Toxicology 6:267- 273
7. Klinefelter, G.R. et al., (1992). Direct Effects of Ethane Dimethanesulphonate on Epididymal Function in Adult Rats: an In vitro Demonstration. Journal of Andrology 13:409-421.
8. Slott, V.L. et al., (1991). Rat Sperm Motility Analysis: Methodologic Considerations. Reproductive Toxicology 5:449-458.
9. Slott, V.L. and Perreault, S.D., (1993). Computer-Assisted Sperm Analysis of Rodent Epididymal Sperm Motility Using the Hamilton-Thorn Motility Analyzer. In: Methods in Toxicology, Part A., Academic, Orlando, Florida. pp. 319-333.
10. Toth, G.P. et al. (1989). The Automated Analysis of Rat Sperm Motility Following Subchronic Epichlorhydrin Administration: Methodologic and Statistical Considerations. Journal of Andrology 10: 401-415.
11. Working, P.K. and M. Hurtt, (1987). Computerized Videomicrographic Analysis of Rat Sperm Motility. Journal of Andrology 8:330-337.
12. Linder, R.E. et al., (1992). Endpoints of Spermatoxicity in the Rat After Short Duration Exposures to Fourteen Reproductive Toxicants. Reproductive Toxicology 6:491-505.
13. Korenbrot, C.C. et al., (1977). Preputial Separation as an External Sign of Pubertal Development in the Male Rat. Biological Reproduction 17:298303.
14. Russell, L.D. et al., (1990). Histological and Histopathological Evaluation of the Testis, Cache River Press, Clearwater, Florida.
15. Heindel, J.J. and R.E. Chapin, (eds.) (1993). Part B. Female Reproductive Systems, Methods in Toxicology, Academic, Orlando, Florida.
16. Heindel, J.J. et al., (1989) Histological Assessment of Ovarian Follicle Number in Mice As a Screen of Ovarian Toxicity. In: Growth Factors and the Ovary, A.N. Hirshfield (ed.), Plenum, New York, pp. 421-426.
17. Manson, J.M. and Y.J. Kang, (1989). Test Methods for Assessing Female Reproductive and Developmental Toxicology. In: Principles and Methods of Toxicology, A.W. Hayes (ed.), Raven, New York.
18. Smith, B.J. et al,. (1991). Comparison of Random and Serial Sections in Assessment of Ovarian Toxicity. Reproductive Toxicology 5:379-383.
19. Heindel, J.J. (1999). Oocyte Quantitation and Ovarian Histology. In: An Evaluation and Interpretation of Reproductive Endpoints for Human Health Risk Assessment, G. Daston,. and C.A. Kimmel, (eds.), ILSI Press, Washington, DC.
20. Thomas, J. A. (1991). Toxic Responses of the Reproductive System. In: Casarett and Doull’s Toxicology, M.O. Amdur, J. Doull, and C.D. Klaassen (eds.), Pergamon, New York.
21. Zenick, H. and E.D. Clegg, (1989). Assessment of Male Reproductive Toxicity: A Risk Assessment Approach. In: Principles and Methods of Toxicology, A.W. Hayes (ed.), Raven Press, New York.
22. Palmer, A.K. (1981). In: Developmental Toxicology, Kimmel, C.A. and J. Buelke-Sam (eds.), Raven Press, New York.
23. Palmer, A.K. (1978). In Handbook of Teratology, Vol. 4, J.G. Wilson and F.C. Fraser (eds.), Plenum Press, New York.
B.36. TOKSIKOKINETIKA
1. METODA ISPITIVANJA
1.1. UVOD
Videti Opšti uvod.
1.2. DEFINICIJE
Videti Opšti uvod.
1.3. REFERENTNE SUPSTANCE
Nisu propisane.
1.4. PRINCIP METODE
Supstanca koja se ispituje primenjuje se odgovarajućim putem. Zavisno od svrhe studije, supstanca može da se daje kao pojedinačna ili u ponovljenoj dozi tokom određenog perioda, jednoj ili više grupa eksperimentalnih životinja. Posle toga, zavisno od tipa ispitivanja određuje se supstanca i/ili metaboliti u telesnim tečnostima, tkivima i/ili ekskretima.
Studija može da se obavi sa "neobeleženim" ili "obeleženim" oblicima supstance koja se ispituje. Kad se koristi oznaka, ona se nalazi u supstanci na takvom mestu da se obezbedi što je moguće više podataka o sudbini jedinjenja.
1.5. KRITERIJUMI KVALITETA
Nisu propisani.
1.6. OPIS METODE
1.6.1. Pripreme
Zdrave mlade odrasle životinje aklimatizuju se na laboratorijske uslove najmanje pet dana pre obavljanja ispitivanja. Pre ispitivanja životinje se slučajnim izborom svrstavaju u grupe za tretiranje. U posebnim slučajevima mogu se koristiti i vrlo mlade, gravidne ili prethodno tretirane životinje.
1.6.2. Eksperimentalni uslovi
1.6.2.1. Eksperimentalne životinje
Toksikokinetička ispitivanja mogu da se izvode na jednoj ili više odgovarajućih životinjskih vrsta. Uzimaju se u obzir vrste koje su korišćene i koje će se koristiti u drugim studijama toksičnosti iste ispitivane supstance. Kad se u ispitivanju koriste glodari, varijacija telesne mase ne sme da prelazi ± 20% srednje telesne mase.
1.6.2.2. Broj i pol
Na početku, za ispitivanja apsorpcije i izlučivanja, koristi se četiri životinje u svakoj doznoj grupi. Nije obavezan izbor jednog određenog pola, ali pod određenim uslovima potrebno je ispitivanje oba pola. Ukoliko postoje razlike u odgovoru između polova, potrebno je ispitati po četiri životinje svakog pola. U slučaju ispitivanja sa vrstama koje nisu glodari, može da se koristi manji broj životinja. Kada se ispituje raspodela u tkivima, na početku, prilikom određivanja veličine grupe, uzima se u obzir broj životinja koje će se lišiti života na human način u svakoj vremenskoj instanci (tački) i broj vremenskih instanci koji se ispituje.
Kod ispitivanja metabolizma veličina grupe zavisi od potreba studije. Kod ispitivanja višestrukih doza ili višestrukih vremenskih instanci, veličina grupe zavisi od broja vremenskih tačaka i od planiranih lišavanja života na human način, ali ne sme da bude manja od dve životinje. Veličina grupe je dovoljna da obezbedi prihvatljivu karakterizaciju resorpcije, platoa i eliminacije (ako odgovara) supstance koja se ispituje i/ili metabolita.
1.6.2.3. Dozni nivoi
U slučaju primene pojedinačne doze koriste se najmanje dva nivoa doza: niska doza bez toksičnog efekta i visoka doza pri kojoj se mogu pojaviti promene u toksikokinetičkim parametrima ili pri kojoj se javljaju toksični efekti.
U slučaju primene ponovljenog doziranja obično je dovoljna niska doza, ali pod određenim uslovima visoka doza može da bude neophodna.
1.6.2.4. Put primene
U toksikokinetičkim studijama se koristi isti put i, kada odgovara, isti vehikulum kao što se koristi ili će biti korišćen u drugim studijama toksičnosti. Ispitivana supstanca se daje grupama eksperimentalnih životinja oralno prisilnim davanjem ili u hrani, nanosi se na kožu ili primenjuje inhalacijom tokom određenih vremenskih perioda. Intravenska primena ispitivane supstance može da bude korisna za utvrđenje relativne apsorpcije kada se supstanca primenjuje drugim putevima. Odmah nakon intravenskog davanja supstance dobijaju se korisni podaci o načinu raspodele.
Uzima se u obzir mogućnost interferencije vehikuluma sa ispitivanom supstancom. Potrebno je posvetiti pažnju razlikama u apsorpciji između primene ispitivane supstance prisilnim davanjem i u hrani i potrebe za tačnim (preciznim) određivanjem doze, posebno kad se supstanca daje putem hrane.
1.6.2.5. Period posmatranja
Sve životinje se svakodnevno posmatraju. Svakodnevno se beleže znaci toksičnosti i drugi relevantni klinički znaci, uključujući vreme njihovog nastupanja, stepen i trajanje.
1.6.3. Postupak
Posle merenja telesne mase, životinjama se odgovarajućim putem primenjuje supstanca koja se ispituje. Ako je relevantno, životinje se stavljaju na gladovanje pre primene supstance koja se ispituje.
1.6.3.1. Apsorpcija
Brzina i stepen apsorpcije primenjene supstance mogu se odrediti korišćenjem različitih metoda, sa i bez referentnih grupaXIII, na primer:
- određivanjem količine ispitivane supstance i/ili metabolita u ekskretima, kao što su urin, žuč, stolica, izdahnuti vazduh i u ostacima mrtvih životinja;
- poređenjem bioloških reakcija (tj. studije akutne toksičnosti) između tretiranih grupa i kontrolnih i/ili referentnih grupa;
- upoređenjem količine supstance koja je izlučena putem bubrega i/ili metabolita kod tretiranih i referentnih grupa;
- određivanjem površine ispod krive koncentracija u plazmi/vreme između supstance i/ili metabolita i poređenju sa podacima dobijenim od referentne grupe.
____________
XIII U ovoj metodi referentna grupa je ona kod koje je supstanca koja se ispituje primenjena drugim putem koji omogućuje potpunu bioraspoloživost doze.
1.6.3.2. Raspodela
Postoje dva pristupa, od kojih se jedan ili oba mogu koristiti za analizu oblika raspodele:
- korisni kvalitativni podaci dobijaju se korišćenjem autoradiografskih tehnika na celom telu;
- kvantitativni podaci dobijaju se lišavanja života na human način u različito vreme posle ekspozicije i određivanja koncentracije i količine ispitivane supstance i/ili metabolita u tkivima i organima.
1.6.3.3. Izlučivanje
Kod ispitivanja izlučivanja skupljaju se mokraća, stolica i izdahnuti vazduh, a u nekim slučajevima i žuč. Količina ispitivane supstance i/ili metabolita u tim izlučevinama meri se više puta posle izlaganja ili dok se oko 95% primenjene doze ne izluči ili tokom sedam dana (ukoliko izlučivanje 95% doze traje duže).
U posebnim slučajevima se uzima u obzir izlučivanje ispitivane supstance u mleku eksperimentalnih životinja koje doje.
1.6.3.4. Metabolizam
Pogodnim tehnikama analiziraju se biološki uzorci da bi se utvrdio stepen i tip metabolizma. Ukoliko je potrebno dati odgovore na pitanja koja su proizašla iz prethodnih toksikoloških studija, potrebno je razjasniti strukturu metabolita i predložiti odgovarajuće metaboličke puteve. Korisno je obaviti in vitro ispitivanje kako bi se dobili podaci o metaboličkim putevima.
Dodatni podaci o odnosu metabolizma i toksičnosti mogu se dobiti biohemijskim studijama, kao što je određivanje efekata na sisteme enzima koji učestvuju u metabolizmu, smanjenje endogenih neproteinskih sulfidrilnih jedinjenja i vezivanje supstance za makromolekule.
2. PODACI
Podaci se navode tabelarno, u skladu sa tipom izvedene studije, a gde je potrebno, daje se i grafička prezentacija. Za svaku eksperimentalnu grupu navodi se srednja vrednost i statističke varijacije merenja u odnosu na vreme, doziranje, tkiva i organe, kada odgovara. Potrebno je odrediti stepen apsorpcije i količinu i brzine izlučivanja odgovarajućim metodama. Kada se obavljaju ispitivanja metabolizma, navodi se struktura utvrđenih metabolita i mogući metabolički put.
3. IZVEŠTAJ
3.1. IZVEŠTAJ O ISPITIVANJU
U skladu sa tipom izvedenog ispitivanja, izveštaj o ispitivanju, ako je moguće, sadrži podatke o:
- vrsti, soju, izvoru, uslovima sredine, ishrani;
- karakterizaciji obeleženih materijala, ako su upotrebljeni;
- nivoima doza i intervalima davanja;
- putu primene i, ako je korišćen, o vehikulumu;
- toksičnim i drugim uočenim efektima;
- metodi određivanja ispitivane supstance i/ili metabolita u biološkim uzorcima, uključujući izdahnuti vazduh;
- tabele merenja po polu, dozi, režimu, vremenu, tkivima i organima;
- prikaz stepena apsorpcije i izlučivanja tokom vremena;
- metodi za karakterizaciju i identifikaciju metabolita u biološkim uzorcima;
- metodi bioloških merenja u vezi sa metabolizmom;
- predloženim putevima metabolizma;
- obrazloženju rezultata;
- tumačenju rezultata.
3.2. PROCENA I TUMAČENJE REZULTATA
Videti Opšti uvod.
4. LITERATURA
Videti Opšti uvod.
B.37. ODLOŽENA NEUROTOKSIČNOST ORGANOFOSFORNIH SUPSTANCI POSLE AKUTNOG IZLAGANJA
1. METODA ISPITIVANJA
1.1. UVOD
U proceni i evaluaciji toksičnih efekata supstanci važno je uzeti u obzir potencijal posebnih grupa supstanci da uzrokuju specifične vrste neurotoksičnosti koje ne moraju da budu otkrivene u drugim studijama toksičnosti. Uočeno je da određene organofosforne supstance uzrokuju odloženu neurotoksičnost i smatraju se kandidatima za ocenjivanje.
Za identifikaciju supstanci koje mogu da uzrokuju odloženu polineuropatiju mogu se primeniti in vitro skrining testovi. Negativni rezultati in vitro studija ne daju dokaze da ispitivana supstanca nije neurotoksična.
Videti Opšti uvod.
1.2. DEFINICIJE
Organofosforne supstance uključuju nejonizovane organofosforne estre, tioestere ili anhidride organofosforne, organofosforaste ili organofosfamidne kiseline ili slične tiofosfornoj, tiofosforastoj ili tiofosfamidnoj kiselini ili druge supstance koje mogu da uzrokuju odloženu neurotoksičnost koja se ponekad javlja kod ovih grupa supstanci.
Odložena neurotoksičnost jeste sindrom koji se povezuje sa produženim odloženim nastupanjem ataksije, distalne aksonopatije u kičmenoj moždini i perifernim živcima i inhibicijom i starenjem ciljne esteraze neuropatije (u daljem tekstu: NTE) u nervnom tkivu.
1.3. REFERENTNE SUPSTANCE
Referentne supstance mogu da se ispituju sa pozitivnom kontrolnom grupom kao sredstvo koje pokazuje da se pod laboratorijskim uslovima odgovor ispitivanih životinjskih vrsta nije značajno promenio.
Primer široko korišćene neurotoksične supstance je tri-o-tolil fosfat (CAS 78-30-8, EINECS 201-103-5, CAS nomenklatura: tris (2-metilfenil)estar fosforne kiseline, takođe poznat kao tris-o-krezilfosfat.
1.4. PRINCIP METODE
Ispitivana supstanca primenjuje se oralno u jednoj dozi domaćim kokoškama koje su zaštićene od akutnih holinergičkih efekata, kada odgovara. Životinje se posmatraju 21 dan kako bi se uočile abnormalnosti u ponašanju, ataksija i paraliza. Na kokoškama nasumično izabranim iz svake grupe izvode se biohemijska merenja, posebno NTE, obično 24 i 48 sata posle doziranja. Dvadeset i jedan dan posle izlaganja preostale kokoške se lišavaju života na human način i izvode se histopatološki pregled odabranih nervnih tkiva.
1.5. OPIS METODE
1.5.1. Pripreme
Zdrave mlade kokoške bez virusnih bolesti koje mogu da interferiraju, koje ne primaju lekove i bez abnormalnosti slučajnim izborom se uvršćuju u tretirane i kontrolne grupe i aklimatizuju na laboratorijske uslove najmanje pet dana pre početka studije.
Koriste se kavezi ili zatvoreni prostori koji su dovoljno veliki za slobodno kretanje i lako posmatranje hoda.
Doziranje ispitivane supstance obično je oralnim putem prisilnim hranjenjem, gel kapsulama ili sličnom metodom. Tečnosti se daju nerazblažene ili rastvorene u odgovarajućem vehikulumu kao što je kukuruzno ulje. Čvrste supstance se, ako je moguće, rastvaraju, jer velike doze čvrstih supstanci u gel kapsulama ne mogu efikasno da se apsorbuju. Za vehikulume različite od vode moraju biti poznate toksične karakteristike, a ukoliko nisu poznate, iste se određuju pre ispitivanja.
1.5.2. Uslovi ispitivanja
1.5.2.1. Eksperimentalne životinje
Preporučuje se mlada odrasla domaća kokoška (Gallus gallus domestícus), stara 8 do 12 meseci. Koriste se vrste i sojeve standardne veličine. Kokoške se gaje u uslovima koji im omogućavaju slobodno kretanje.
1.5.2.2. Broj i pol
Pored tretirane grupe koristi se kontrolna grupa vehikuluma i grupa pozitivne kontrole. Sa kontrolnom grupom vehikuluma postupa se isto kao i sa tretiranom grupom, osim što se izostavlja primena ispitivane supstance.
Koristi se dovoljan broj kokoški u svakoj grupi kako bi se omogućilo lišavanja života na human način najmanje šest ptica za biohemijska određivanja (po tri u svakoj od dve vremenske tačke) i da šest ptica može da preživi 21-dnevni period praćenja posle tretmana za patologiju.
Grupa pozitivne kontrole može da se vodi istovremeno ili to može da bude nedavna kontrolna grupa iz ranije studije. Ona sadrži najmanje šest kokoški tretiranih s poznatim neurotoksikantom sa odloženim dejstvom: tri kokoši za biohemiju i tri za patologiju. Preporučljivo je periodično ažuriranje podataka iz ranije studije. Novi podaci pozitivne kontrole razvijaju se kad laboratorija koja izvodi ispitivanje promeni neki osnovni element (npr. soj, hrana, uslovi smeštaja).
1.5.2.3. Dozni nivoi
Obavlja se preliminarna studija uz korišćenje odgovarajućeg broja kokoški i grupa doznih nivoa kako bi se utvrdio nivo koji će se koristiti u glavnoj studiji. Određena smrtnost je neophodna u ovoj preliminarnoj studiji kako bi se definisala adekvatna doza za glavnu studiju. Može se koristiti atropin ili drugi zaštitni agens za koji se zna da ne utiče na odložene neurotoksične efekte da bi se sprečila smrt zbog akutnih holinergičkih efekata. Mogu se koristiti različite eksperimentalne metode kako bi se procenila maksimalna doza ispitivanih supstanci koja ne izaziva smrt (videti metodu B.1bis koja je data u ovom prilogu). Raniji podaci o kokoški ili drugi toksikološki podaci takođe mogu biti korisni u izboru doze.
Dozni nivo ispitivane supstance u glavnoj studiji je najveći mogući uzimajući u obzir rezultate studije preliminarnog izbora doze i gornju granicu doze od 2.000 mg/kg TM. Bilo koja smrtnost do koje može doći ne ometa preživljavanje dovoljnog broja životinja za biohemijska (šest) i histološka (šest) ispitivanja posle 21 dana. Koriste se atropin ili drugi zaštitni agens za koji se zna da ne utiče na odložene neurotoksične efekte kako bi se sprečila smrt usled akutnih holinergičkih efekata.
1.5.2.4. Ispitivanje granične doze
Ukoliko ispitivanje pri doznom nivou od najmanje 2.000 mg/kg TM/dan, korišćenjem postupaka opisanih u ovoj studiji, ne pokaže nikakve toksične efekte i ukoliko se toksičnost ne očekuje na osnovu podataka o strukturno sličnim supstancama, nije neophodna studija koja koristi veće doze. Ispitivanje granične doze se ne primenjuje kada ljudsko izlaganje ukazuje na potrebu za korišćenjem višeg nivoa doze.
1.5.2.5. Period posmatranja
Period posmatranja je 21 dan.
1.5.3. Postupak
Posle primene zaštitnog agensa kako bi se sprečila smrt zbog akutnih holinergičkih efekata, ispitivana supstanca daje se u jednoj dozi.
1.5.3.1. Opšta posmatranja
Posmatranja se započinju odmah po izlaganju. Sve kokoške se pažljivo pregledaju nekoliko puta tokom prva dva dana, a posle toga najmanje jednom dnevno u periodu od 21 dan ili do predviđenog lišavanja života na human način. Beleže se sve znaci toksičnosti, uključujući vreme nastanka, vrstu, ozbiljnost i trajanje abnormalnosti ponašanja. Ataksija se meri ordinalnom skalom za ocenjivanje koja se sastoji od najmanje četiri nivoa, a paraliza se registruje. Najmanje dva puta nedeljno kokoške odabrane za patološka ispitivanja vade se iz kaveza i izlažu prisilnoj motoričkoj aktivnosti određeni period, kao što je penjanje po merdevinama, kako bi se zapazili minimalni toksični efekti. Životinje na samrti i životinje koje trpe ozbiljan stres ili bol uklanjaju se kada se ove pojave primete, lišavaju ih života na human način i postmortalno pregledaju.
1.5.3.2. Telesna masa
Pre primene ispitivane supstance meri se telesna masa svim kokoškama, a posle toga najmanje jednom nedeljno.
1.5.3.3. Biohemijska ispitivanja
Šest slučajno izabranih kokoški iz svake tretirane i kontrolne grupe vehikuluma i tri kokoške iz grupe pozitivne kontrole (kad se takva grupa istovremeno vodi) lišavaju se života na human način u nekoliko dana posle doziranja. Osim toga, priprema se i ispituje mozak i lumbalna kičmena moždina na inhibiciju aktivnosti ciljne esteraze neuropatije. Može da bude korisno da se pripremi i ispita tkivo išijadičnog nerva na inhibiciju aktivnosti ciljne esteraze neuropatije. Obično, tri ptice iz kontrolne i svake tretirane grupe lišavaju se života na human način se posle 24 sata i tri ptice posle 48 sati, pri čemu se tri kokoške iz grupe pozitivne kontrole lišavaju života posle 24 sata. Ukoliko opažanje kliničkih znakova intoksikacije (ovo često može biti procenjeno posmatranjem trenutka nastupa holinergičkih znakova) pokazuje da se toksični agens distribuira vrlo polako, može biti poželjno uzorkovati tkivo iz tri ptice u oba navrata između 24 sata i 72 sata posle doziranja.
Analiza acetilholinesteraze (u daljem tekstu: AChE) može da se obavi na tim uzorcima, ako se to smatra odgovarajućim. Može da se dogodi in vivo spontana reaktivacija AChE i da dovede do podcenjivanja potentnosti supstance kao AChE inhibitora.
1.5.3.4. Postmortalni pregled
Postmortalni pregled svih životinja (planirano lišenih života na human način ili lišenih života na samrti) uključuje posmatranje izgleda mozga i kičmene moždine.
1.5.3.5. Histopatološka ispitivanja
Nervno tkivo životinja koje prežive period posmatranja i koje se ne koristi za biohemijske studije podvrgava se mikroskopskom pregledu. Tkiva se fiksiraju in situ, korišćenjem tehnika perfuzije. Preseci uključuju mali mozak (srednji longitudinalni nivo), produženu moždinu, kičmenu moždinu i periferne živce. Preseci kičmene moždine se uzimaju iz gornjeg cervikalnog segmenta, srednje torakalone i lumbo-sakralne regije. Uzimaju se preseci distalne regije tibijalnog živca i njegovih grana do gastroknemijusnog mišića i skijatičnog živca. Preseci se boje odgovarajućim mijelin i akson-specifičnim bojama.
2. PODACI
Negativni rezultati efekata izabranih za posmatranje u ovoj metodi (biohemijska, histopatološka ispitivanja i posmatranje ponašanja) ne zahtevaju dalje ispitivanje odložene neurotoksičnosti. Dvosmisleni ili neuverljivi rezultati za ove efekte mogu zahtevati dalje ocenjivanje.
Navode se pojedinačni podaci. Svi podaci navode se tabelarno. Za svaku eksperimentalnu grupu navodi se: broj životinja na početku ispitivanja, broj životinja koje pokazuju oštećenja, bihevioralne ili biohemijske efekte, tipovi i ozbiljnost tih oštećenja ili efekata i procenat životinja koje pokazuju svaki tip i ozbiljnost oštećenja ili efekta.
Nalaze ove studije se ocenjuje u smislu incidence, ozbiljnosti i korelacije bihevioralnih, biohemijskih i histopatoloških efekata i drugih opaženih efekata u tretiranim i kontrolnim grupama.
Numeričke rezultate se ocenjuju odgovarajućim i prihvaćenim statističkim metodama. Statističke metode se biraju prilikom osmišljavanja studije.
3. IZVEŠTAJ
Izveštaj o ispitivanju, ukoliko je moguće, sadrži podatke o:
1) Eksperimentalnim životinjama:
- korišćeni soj;
- broj i starost životinja;
- izvor, uslovi smeštaja, itd.;
- individualne telesne mase životinja na početku ispitivanja.
2) Uslovima ispitivanja:
- detalji o preparatu ispitivane supstance, stabilnost i homogenost, kad odgovara;
- opravdanje izbora vehikuluma;
- detalji o primeni ispitivane supstance;
- detalji o kvalitetu hrane i vode;
- obrazloženje izbora doze;
- specifikacija primenjenih doza uključujući detalje o vehikulumu, zapremini i fizičkom obliku primenjenog materijala;
- identitet i detalji o primeni svakog zaštitnog agensa.
3) Rezultatima:
- podaci o telesnoj masi;
- podaci o toksičnom odgovoru po grupi, uključujući mortalitet;
- priroda, ozbiljnost i trajanje kliničkih zapažanja (bilo da su reverzibilni ili ne);
- detaljan opis biohemijskih metoda i nalaza;
- nalazi obdukcije;
- detaljan opis svih histopatoloških nalaza;
- statistička obrada rezultata, kada odgovara.
4) Obrazloženju rezultata.
5) Zaključcima.
B.38. ISPITIVANJE ODLOŽENE NEUROTOKSIČNOSTI ORGANOFOSFORNIH SUPSTANCI - PONOVLJENE DOZE, 28 DANA
1. METODA ISPITIVANJA
1.1. UVOD
U proceni i evaluaciji toksičnih efekata supstanci važno je uzeti u obzir potencijal posebnih grupa supstanci da uzrokuju specifične vrste neurotoksičnosti koje ne moraju da budu otkrivene u drugim studijama toksičnosti. Uočeno je da određene organofosforne supstance uzrokuju odloženu neurotoksičnost i smatraju se kandidatima za ocenjivanje.
Za identifikaciju supstanci koje mogu da uzrokuju odloženu polineuropatiju mogu se primeniti in vitro skrining testovi. Negativni rezultati in vitro studija ne daju dokaze da ispitivana supstanca nije neurotoksična.
Ovo 28-dnevno ispitivanje odložene neurotoksičnosti daje podatke o mogućim rizicima po zdravlje koji mogu proizaći iz ponovljenog izlaganja tokom ograničenog vremenskog perioda. Ispitivanje obezbeđuje podatke o dozi-efektu i može dati procenu doze bez efekta koja može da bude korisna pri utvrđivanju kriterijuma bezbednosti za ekspoziciju.
Videti Opšti uvod.
1.2. DEFINICIJE
Organofosforne supstance uključuju nejonizovane organofosforne estre, tioestere ili anhidride organofosforne, organofosforaste ili organofosfamidne kiseline ili slične tiofosfornoj, tiofosforastoj ili tiofosfamidnoj kiselini ili druge supstance koje mogu da uzrokuju odloženu neurotoksičnost koja se ponekad javlja kod ovih grupa supstanci.
Odložena neurotoksičnost jeste sindrom koji se povezuje sa produženim odloženim nastupanjem ataksije, distalne aksonopatije u kičmenoj moždini i perifernim živcima i inhibicijom i starenjem ciljne esteraze neuropatije (u daljem tekstu: NTE) u nervnom tkivu.
1.3. PRINCIP METODE
Dnevne doze ispitivane supstance primenjuju se oralno domaćim kokoškama tokom 28 dana. Životinje se najmanje jednom dnevno posmatraju zbog abnormalnosti u ponašanju, ataksije i paralize i to do 14 dana posle zadnje doze. Obavljaju se biohemijska merenja, posebno NTE na slučajno odabranim kokoškama iz svake grupe, obično 24 i 48 sata posle poslednje doze. Dve nedelje posle zadnje doze preostale kokoške se lišavaju života na human način i obavlja se histopatološki pregled odabranih nervnih tkiva.
1.4. OPIS METODE
1.4.1. Pripreme
Najmanje pet dana pre početka studije zdrave mlade kokoške bez virusnih bolesti koje mogu da interferiraju, koje ne primaju lekove i bez abnormalnosti slučajnim izborom se uvršćuju u tretirane i kontrolne grupe i aklimatizuju na laboratorijske uslove.
Koriste se kavezi ili zatvoreni prostori koji su dovoljno veliki za slobodno kretanje i lako posmatranje hoda.
Doziranje ispitivane supstance je oralnim putem sedam dana u nedelji prisilnim hranjenjem, gel kapsulama ili sličnom metodom. Tečnosti se daju nerazblažene ili rastvorene u odgovarajućem vehikulumu kao što je kukuruzno ulje. Čvrste supstance se, ako je moguće, rastvaraju, jer velike doze čvrstih supstanci u gel kapsulama ne mogu efikasno da se apsorbuju. Za vehikulume različite od vode moraju da budu poznate toksične karakteristike, a ukoliko nisu poznate, iste se određuju pre ispitivanja.
1.4.2. Uslovi ispitivanja
1.4.2.1. Eksperimentalne životinje
Preporučuje se mlada odrasla domaća kokoška (Gallus gallus domestícus), stara 8 do 12 meseci. Koriste se vrste i sojevi standardne veličine. Kokoške se gaje u uslovima koji im omogućavaju slobodno kretanje.
1.4.2.2. Broj i pol
Koriste se najmanje tri tretirane grupe i kontrolna grupa u vehikuluma. Sa kontrolnom grupom vehikuluma postupa se isto kao i sa tretiranom grupom, osim što se izostavlja primena ispitivane supstance.
Koristi se dovoljan broj kokoški u svakoj grupi kako bi se omogućilo lišavanje života na human način najmanje šest ptica za biohemijska određivanja (po tri u svakoj od dve vremenske tačke) i da šest ptica može da preživi 14-dnevni period praćenja posle tretmana za patološka ispitivanja.
1.4.2.3. Dozni nivoi
Dozni nivoi se biraju uzimajući u obzir rezultate akutnog ispitivanja odložene neurotoksičnosti i postojeće podatke o toksičnosti ili kinetici koji su dostupni za ispitivanu supstancu. Najviši dozni nivo određuje se sa ciljem izazivanja toksičnih efekata, najbolje odložene neurotoksičnosti, ali ne smrti niti očigledne patnje. Zatim se bira opadajući niz nivoa doza kako bi se pokazao bilo koji odgovor povezan sa doziranjem i nepostojanje štetnih efekata pri najnižem doznom nivou.
1.4.2.4. Ispitivanje granične doze
Ukoliko ispitivanje pri doznom nivou od najmanje 1.000 mg/kg TM/dan, korišćenjem postupaka opisanih u ovoj studiji, ne pokaže nikakve toksične efekte i ukoliko se toksičnost ne očekuje na osnovu podataka o strukturno sličnim supstancama, nije neophodna studija koja koristi veće doze. Ispitivanje granične doze se ne primenjuje kada izlaganje ljudi ukazuje na potrebu za korišćenjem višeg nivoa doze.
1.4.2.5. Period posmatranja
Sve životinje se posmatraju najmanje jednom dnevno tokom perioda izlaganja i 14 dana posle toga, sve do planiranog lišavanja života na human način.
1.4.3. Postupak
Životinje se doziraju ispitivanom supstancom sedam dana u nedelji kroz period od 28 dana.
1.4.3.1. Opšta posmatranja
Posmatranja se započinju odmah po izlaganju. Sve kokoške se pažljivo pregledaju najmanje jednom dnevno u periodu od 28 dana tretmana i 14 dana posle doziranja ili do planiranog lišavanja života na human način. Beleže se svi znakovi toksičnosti, uključujući vreme nastanka, vrstu, ozbiljnost i trajanje. Posmatranja uključuju, ali nisu ograničena na, abnormalnosti u ponašanju. Ataksija se meri ordinalnom skalom za ocenjivanje koja se sastoji od najmanje četiri nivoa. Registruje se paralizu. Najmanje dva puta nedeljno kokoške odabrane za patološka ispitivanja se vade iz kaveza i izlažu prisilnoj motoričkoj aktivnosti određeni period, kao što je penjanje po merdevinama, kako bi se zapazili minimalni toksični efekti. Životinje na samrti i životinje koje trpe ozbiljan stres ili bol uklanjaju se kada se primete ove pojave, lišavaju se života na human način i postmortalno pregledaju.
1.4.3.2. Telesna masa
Svim kokoškama se meri telesna masa pre primene ispitivane supstance i najmanje jednom nedeljno posle toga.
1.4.3.3. Biohemijska ispitivanja
Šest slučajno odabranih kokošaka iz svake tretirane i kontrolne grupe vehikuluma lišavaju se života na human način nekoliko dana nakon poslednje doze. Priprema se i ispituje mozak i lumbalna kičmena moždina na inhibiciju aktivnosti ciljne esteraze neuropatije. Može biti korisno pripremiti i ispitati tkivo išijadičnog nerva na inhibiciju aktivnosti ciljne esteraze neuropatije. Tri ptice iz kontrolne i svake tretirane grupe lišavaju se života na human način posle 24 sata i tri ptice 48 sati posle zadnjeg doziranja. Ukoliko podaci iz akutne studije ili drugih studija (npr. toksikokinetike) ukazuju da su druge vremenske tačke posle zadnjeg doziranja pogodnije, primenjuju se te tačke, a obrazloženje se dokumentuje.
Analiza acetilholinesteraze (u daljem tekstu: AChE) može se obaviti na tim uzorcima, ako se to smatra odgovarajućim. Može se dogoditi in vivo spontana reaktivacija AChE i dovesti do podcenjivanja potentnosti supstance kao AChE inhibitora.
1.4.3.4. Postmortalni pregled
Postmortalni pregled svih životinja (planirano lišenih života na human način ili lišenih života na samrti) uključuje posmatranje izgleda mozga i kičmene moždine.
1.4.3.5. Histopatološka ispitivanja
Nervno tkivo životinja koje prežive period posmatranja i koje se ne koristi za biohemijska ispitivanja podvrgava se mikroskopskom pregledu. Tkiva se fiksiraju in situ, korišćenjem tehnika perfuzije. Preseci uključuju mali mozak (srednji longitudinalni nivo), produženu moždinu, kičmenu moždinu i periferne živce. Preseci kičmene moždine se uzimaju iz gornjeg cervikalnog segmenta, srednje torakalone i lumbo-sakralne regije. Uzimaju se preseci distalne regije tibijalnog živca i njegovih grana do gastroknemijusnog mišića i skijatičnog živca. Preseci se boje odgovarajućim mijelin i akson-specifičnim bojama. Izvodi se mikroskopski pregled na očuvanim tkivima svih životinja u kontrolnoj i tretiranoj grupi kojoj je davana visoka doza. Kada postoje dokazi za efekte kod grupe visoke doze, obavlja se mikroskopski pregled kod kokoški iz grupa srednje i niže doze.
2. PODACI
Negativni rezultati efekata izabranih za posmatranje u ovoj metodi (biohemijska, histopatološka ispitivanja i posmatranje ponašanja) obično ne zahtevaju dalje ispitivanje odložene neurotoksičnosti. Dvosmisleni ili neuverljivi rezultati za ove efekte mogu zahtevati dalje ocenjivanje.
Podaci se navode pojedinačno i to tabelarno. Za svaku eksperimentalnu grupu navodi se: broj životinja na početku ispitivanja, broj životinja koje pokazuju oštećenja, bihevioralne ili biohemijske efekte, tipovi i ozbiljnost tih oštećenja ili efekata i procenat životinja koje pokazuju svaki tip i ozbiljnost oštećenja ili efekta.
Nalazi ove studije ocenjuju se u smislu incidence, ozbiljnosti i korelacije bihevioralnih, biohemijskih i histopatoloških efekata i drugih opaženih efekata u tretiranim i kontrolnim grupama.
Numerički rezultati ocenjuju se odgovarajućim i prihvaćenim statističkim metodama. Statističke metode se biraju prilikom osmišljavanja studije.
3. IZVEŠTAJ
Izveštaj o ispitivanju, ukoliko je moguće, sadrži podatke o:
1) Eksperimentalnim životinjama:
- korišćeni soj;
- broj i starost životinja;
- izvor, uslovi smeštaja, itd.;
- individualne telesne mase životinja na početku ispitivanja.
2) Uslovima ispitivanja:
- detalji o preparatu ispitivane supstance, stabilnost i homogenost, kad odgovara;
- opravdanje izbora vehikuluma;
- detalji o primeni ispitivane supstance;
- detalji o kvalitetu hrane i vode;
- obrazloženje izbora doze;
- specifikacija primenjenih doza uključujući detalje o vehikulumu, zapremini i fizičkom obliku primenjenog materijala;
- opravdanje izbora drugih vremenskih tačaka za biohemijska određivanja, ukoliko vreme nije 24 sata i 48 sati.
3) Rezultatima:
- podaci o telesnoj masi;
- podaci o toksičnom odgovoru po grupi, uključujući mortalitet;
- doza bez štetnog dejstva;
- priroda, ozbiljnost i trajanje kliničkih zapažanja (bilo da su reverzibilni ili ne);
- detaljan opis biohemijskih metoda i nalaza;
- nalazi obdukcije;
- detaljan opis svih histopatoloških nalaza;
- statistička obrada rezultata, kad odgovara.
4) Obrazloženju rezultata.
5) Zaključcima.
B.39. ISPITIVANJE VANREDNE SINTEZE DNK (UDS)
NA ĆELIJAMA JETRE SISARA IN VIVO
1. METODE ISPITIVANJA
Ova metoda zasniva se na Uputstvu za ispitivanje OECD 486, Unscheduled DNK Synthesis (UDS) Test with Mammalian Liver Cells In vivo (1997).
1.1. UVOD
Svrha ispitivanja vanredne sinteze DNK (u daljem tekstu: UDS) na ćelijama jetre sisara in vivo je identifikacija ispitivanih supstanci koje uzrokuju popravku DNK u ćelijama jetre tretiranih životinja 1,2,3,4.
Ovo in vivo ispitivanje daje metodu za istraživanje genotoksičnih efekata hemikalija u jetri. Krajnji efekat koji se meri je indikativan za oštećenje DNK i kasniju popravku u ćelijama jetre. Jetra je obično glavno mesto metabolizma apsorbovanih supstanci, pa je to odgovarajuće mesto za merenje oštećenja DNK in vivo.
Nije prikladno koristiti ovo ispitivanje ukoliko postoje dokazi da ispitivana supstanca neće dospeti u ciljno tkivo.
Krajnji efekat UDS meri se određivanjem preuzimanja označenih nukleozida u ćelije koje ne prolaze kroz redovnu (u s-fazi) DNK sintezu. Tehnika koja se najviše koristi je određivanje preuzimanja timidina označenog tricijumom (u daljem tekstu: 3H-TdR) autoradiografijom. Jetre pacova se najviše koriste za in vivo UDS ispitivanja. Mogu se koristiti i druga tkiva osim jetre, ali nisu predmet ove metode.
Detekcija UDS efekta zavisi od broja DNK baza koje su uklonjene i zamenjene na mestu oštećenja. UDS ispitivanje je posebno koristan za detektovanje "dugačke popravke" (20 do 30 baza) izazvanog supstancom. Obrnuto "kratka popravka" (1 do 3 baze) detektuje se s mnogo manjom osetljivošću. Mutageni događaji mogu nastati zbog nepopravljenih, pogrešno popravljenih ili pogrešno replikovanih oštećenja DNK. Obim UDS reakcije ne daje indikacije pouzdanosti procesa oporavka. Moguće je da mutagen reaguje sa DNK, ali da se oštećenje DNK ne popravi kroz proces popravke izrezivanjem. Nedostatak specifičnih podataka o mutagenoj aktivnosti koje daje UDS ispitivanje kompenzuje se potencijalnom osetljivošću ovog krajnjeg efekta od interesa, budući da se prati celokupni genom.
Videti Opšti uvod.
1.2. DEFINICIJE
Ćelije u popravci jesu viša neto nuklearna zrnca od podešene vrednosti koja se opravdava u laboratoriji koja vrši ispitivanje.
Neto nuklearna zrnca (net nuclear grains, u daljem tekstu: NNG) jeste kvantitativna mera za UDS aktivnost ćelija u autoradiografskim UDS ispitivanjima, obračunata oduzimanjem prosečnog broja citoplazmatskih zrnaca u delovima citoplazme ekvivalentnim nukleusu (u daljem tekstu: CG) od broja nuklearnih zrnaca (u daljem tekstu: NG), odnosno: NNG = NG - CG. NNG broj se dobija za pojedinačne ćelije, a zatim se zbraja za ćelije u kulturi, u paralelnim kulturama, itd.
Vanredna sinteza DNK (u daljem tekstu: UDS) jeste sinteza radi popravke DNK posle uklanjanja i odstranjivanja niza DNK koji sadrži područje oštećenja koje je uzrokovano hemijskom supstancom ili fizičkim agensom.
1.3. PRINCIP METODE
UDS ispitivanje na ćelijama jetre sisara in vivo ukazuje na sintezu radi popravke DNK posle uklanjanja i odstranjivanja niza DNK koji sadrži područje oštećenja koje je uzrokovano hemijskom supstancom ili fizičkim agensom. Ispitivanje se obično zasniva na ugrađivanju 3H-TdR u DNK ćelija jetre koje imaju nisku frekvenciju ćelija u S-fazi ćelijskog ciklusa. Preuzimanje 3H-TdR određuje se autoradioografijom, budući da ova tehnika nije osetljiva na interferencije iz ćelija u S-fazi kao što je to npr. upotreba tečnog scintilacijskog brojanja.
1.4. OPIS METODE
1.4.1. Pripreme
1.4.1.1. Izbor životinjske vrste
Obično se koriste pacovi, mada može da se koristi bilo koja vrsta sisara. Uobičajeno se koriste sojevi mladih zdravih odraslih životinja. Na početku studije varijacija u telesnoj masi životinja treba da bude minimalna i da ne prelazi ± 20% srednje telesne mase za svaki pol.
1.4.1.2. Uslovi smeštaja i ishrane
Primenjuju se opšti uslovi navedeni u Opštem uvodu, mada vlažnost vazduha treba da bude između 50% i 60%.
1.4.1.3. Priprema životinja
Zdrave mlade odrasle životinje raspoređuju se slučajnim izborom u kontrolnu i tretirane grupe. Kavezi se raspoređuju tako da se minimalizuju mogući efekti položaja kaveza. Životinje se identifikuju pojedinačno i drže u kavezima najmanje pet dana pre početka studije kako bi se omogućila aklimatizacija na laboratorijske uslove.
1.4.1.4. Ispitivana supstanca/Preparat
Pre doziranja životinja čvrste ispitivane supstance se rastvaraju ili suspenduju u odgovarajućim rastvaračima ili vehikulumima i, ukoliko je potrebno, razblažuju. Tečne ispitivane supstance mogu da se doziraju direktno ili razblažene pre doziranja. Primenjuju se sveži preparati ispitivane supstance osim ukoliko podaci o stabilnosti ne ukazuju na prihvatljivost čuvanja.
1.4.2. Uslovi ispitivanja
1.4.2.1. Rastvarač/vehikulum
Rastvarač/vehikulum ne sme da uzrokuje toksične efekte pri korišćenim doznim nivoima i ne sme da se sumnja na hemijske reakcije sa ispitivanom supstancom. Ukoliko se koriste rastvarači/vehikulumi koji nisu dobro poznati, njihovo uključivanje treba podupreti podacima o njihovoj kompatibilnosti. Preporučuje se da se, kad god je moguće, prvo razmotri primena vodenog rastvarača/vehikuluma.
1.4.2.2. Kontrole
Istovremene pozitivne i negativne kontrole (rastvarač/vehikulum) se uključuju u svaki deo eksperimenta koji se nezavisno izvodi. Osim tretmana ispitivanom supstancom, sa životinjama u kontrolnoj grupi se postupa isto kao i sa životinjama u tretiranim grupama.
Pozitivne kontrole su supstance za koje je poznato da proizvode UDS kada se primene pri nivoima izloženosti za koje se očekuje da daju uočljivo povećanje u odnosu na pozadinu. Pozitivne kontrole koje zahtevaju metaboličku aktivaciju se koriste u dozama koje izazivaju umereni efekat4. Doze se mogu odabrati tako da su efekti jasni ali ne otkrivaju trenutno identitet kodiranih slajdova onome koji čita. Primeri supstanci koje se mogu koristiti kao pozitivne kontrole:
Tabela 1.
Vreme uzorkovanja |
Supstanca |
CAS br. |
EINECS br |
Rano uzorkovanje |
N-nitrozodimetilamin |
62-75-9 |
200-249-8 |
Kasno |
N-2-fluorenilacetamid (2-AAF) |
53-96-3 |
200-188-6 |
Mogu se koristiti i druge odgovarajuće supstance kao pozitivne kontrolne. Prihvatljivo je da se pozitivna kontrola primeni drugačijim putem od ispitivane supstance.
1.5. POSTUPAK
1.5.1. Broj i pol životinja
Koristi se odgovarajući broj životinja kako bi se uzele u obzir prirodne biološke varijacije u efektu ispitivanja. Broj životinja je najmanje tri životinje po grupi koje se mogu analizirati. Tamo gde je akumulirana značajna istorijska baza podataka potrebne su samo jedna ili dve životinje za istovremene negativne i pozitivne kontrolne grupe.
Ukoliko u vreme studije postoje raspoloživi podaci iz studija za iste vrste i korišćenje istog puta izlaganja koje pokazuju da ne postoje bitne razlike u toksičnosti među polovima, dovoljno je ispitivanje na samo jednom polu, prevashodno na mužjacima. Ako je ljudsko izlaganje hemikalijama specifično za pol, kao što je to npr. s nekim farmaceutskim agensima, ispitivanje se obavlja na životinjama odgovarajućeg pola.
1.5.2. Raspored tretmana
Ispitivane supstance se obično primenjuju kao jedan tretman.
1.5.3. Dozni nivoi
Uobičajeno se koriste najmanje dva dozna nivoa. Najviša doza se definiše kao doza koja uzrokuje znakove toksičnosti koji su takvi da bi se za više nivoe doza, zasnovane na istom režimu doziranja, očekivalo da uzrokuju smrtnost. Niža doza treba da bude 50% do 25% više doze.
Supstance sa specifičnim biološkim aktivnostima pri niskim netoksičnim dozama (kao što su hormoni i mitogeni) mogu da budu izuzeci od kriterijuma za određivanje doza i ocenjuju se od slučaja do slučaja. Ukoliko se obavlja studija nalaženja raspona, jer nisu raspoloživi odgovarajući podaci, izvodi se u istoj laboratoriji uz korišćenje iste vrste, soja, pola i režima tretiranja kao i u glavnoj studiji.
Najviša doza se može definisati i kao doza koja proizvodi određene indikacije toksičnosti u jetri (npr. piknotički nukleusi).
1.5.4. Ispitivanje granične doze
Ukoliko ispitivanje korišćenjem doze od najmanje 2.000 mg/kg TM primenjene u jednom tretmanu ili u dva tretmana istog dana ne pokaže toksične efekte i ukoliko genotoksičnost nije očekivana na osnovu podataka iz strukturno sličnih supstanci, nije neophodna potpuna studija. Očekivano izlaganje ljudi može da ukaže na potrebu za korišćenjem višeg nivoa doze u ispitivanju granične doze.
1.5.5. Primena doza
Ispitivana supstanca se primenjuje pomoću gastrične cevi ili prikladnim instrumentom za intubaciju. Drugi putevi izlaganja mogu biti prihvatljivi ako se mogu opravdati. Ne preporučuje se intraperitonealni način, budući da jetra može da se izloži ispitivanoj supstanci direktno, a ne preko cirkulacionog sistema. Maksimalna zapremina tečnosti koja može prisilno da se primeni ili ubrizga odjednom zavisi od veličine eksperimentalne životinje. Ova zapremina ne sme da prelazi 2 ml/100g TM. Korišćenje većih zapremina mora biti opravdano. Osim kod iritabilnih ili korozivnih supstanci koje uobičajeno pokazuju lošije efekte pri višim koncentracijama, varijabilnost u ispitivanoj zapremini se minimalizuje prilagođavanjem koncentracije kako bi se obezbedila stalna zapremina pri svim nivoima doza.
1.5.6. Priprema ćelija jetre
Ćelije jetre pripremaju se od tretiranih životinja obično 12 do 16 sati posle doziranja. Uglavnom je neophodno dodatno ranije vreme uzorkovanja (obično 2 do 4 sata posle tretmana), osim ukoliko postoji jasan pozitivni efekat unutar 12 do 16 sati. Alternativno vreme uzorkovanja može se koristiti kad je to opravdano na osnovu toksikokintičkih podataka.
Kratkotrajne kulture ćelija jetre sisara obično se dobijaju perfuzijom jetre in situ kolagenazom i omogućavanjem sveže odvojenim ćelijama jetre da se pričvrste na prikladnu podlogu. Ćelije jetre životinja negativne kontrole imaju vijabilitet5 od najmanje 50%.
1.5.7. Određivanje UDS
Sveže izolovane ćelije jetre sisara inkubiraju se sa medijumom koji sadrži 3H-TdR tokom odgovarajućeg vremenskog perioda, npr. 3 do 8 sati. Na kraju perioda inkubacije medijum se uklanja od ćelija koje se tada mogu inkubirati sa medijmom koji sadrži višak neoznačenog timidina kako bi se izbegla neugrađena radiooaktivnost ("hladna potraga"). Ćelije se zatim ispiraju, fiksiraju i suše. Hladna potraga nije neophodna za produžena vremena inkubacije. Slajdovi se potapaju u autoradiografsku emulziju, izlažu u mraku (npr. u frižideru 7 do 14 dana), razvijaju, boje i izložena srebrna zrnca se prebrojavaju. Od svake životinje priprema se dva do tri slajda.
1.5.8. Analiza
Preparati slajdova sadrže dovoljno ćelija normalne morfologije kako bi se omogućilo značajno ocenjivanje UDS. Preparati se mikroskopski ispituju na znake očigledne citotoksičnosti (npr. piknoza, smanjen nivo radio označavanja).
Slajdovi se kodiraju pre prebrojavanja zrnaca. Obično se dobije 100 ćelija od svake životinje u najmanje dva slajda. Manje od 100 ćelija po životinji, se obrazlaže. Ne prebrojavaju za nukleusi S-faze, već se beleži razmera S-faze.
Količina ugrađenih 3H-TdR u jedru i citoplazmi morfološki normalnih ćelija, dokazana taloženjem (deposition) srebrnih zrnaca, utvrđuje se odgovarajućim metodama.
Broj zrnaca se određuje po jedru (nuklearna zrnca, u daljem tekstu: NG) i jedru - ekvivalentnim područjima po citoplazmi (citoplazmatska zrnca, u daljem tekstu: CG). Broj CG se meri uzimanjem najviše označenog područja citoplazme ili uzimanjem proseka dva ili tri broja citoplazmatskih zrnaca u poređenju sa jedrom. Druge metode prebrojavanja (npr. brojavanje celih ćelija) mogu se koristiti ako je to opravdano6.
2. PODACI
2.1. OBRADA REZULTATA
Navode se podaci o pojedinačnim slajdovima i životinjama. Svi podaci se navode tabelarno. Neto nuklearna zrnca (u daljem tekstu: NNG) se izračunavaju za svaku ćeliju, za svaku životinju i svaku dozu i vreme, i to oduzimanjem broja CG od broja NG. Ukoliko se broje "ćelije u oporavku", kriterijumi za definisanje "ćelija u oporavku" se obrazlažu i zasnivaju na podacima negativne kontrole ranije ili konkurentne studije. Numerički rezultati mogu biti ocenjeni statističkim metodama. Ukoliko se koriste statističke metode, biraju se i opravdavaju pre izvođenja studije.
2.2. PROCENA I TUMAČENJE REZULTATA
Kriterijumi za pozitivne odgovore uključuju:
a) NNG vrednosti iznad prethodno zadatog praga, a što je opravdano na osnovu laboratorijskih istorijskih podataka ili
b) NNG vrednosti koje su značajno veće nego istovremena kontrola.
Kriterijumi za negativne odgovore uključuju:
a) NNG vrednosti u okviru/ispod istorijskog praga kontrole ili
b) NNG vrednosti koje nisu značajno veće od istovremene kontrole.
Potrebno je razmotriti biološku relevantnost podataka, odnosno parametre kao što su međuživotinjska varijacija, odnos doza-odgovor, a uzima se u obzir i citotoksičnost. Pri ocenjivanju rezultata ispitivanja mogu se koristiti statističke metode. Statistički značaj ne treba da bude jedini određujući faktor za pozitivni odgovor.
Većina eksperimenata daje jasno pozitivne ili negativne rezultate, u retkim slučajevima podaci onemogućuju definitivnu ocenu o aktivnosti ispitivane supstance. Rezultati mogu ostati dvosmisleni ili sumnjivi bez obzira na broj ponavljanja eksperimenta.
Pozitivni rezultat UDS ispitivanja na ćelijama jetre sisara in vivo ukazuje da ispitivana supstanca uzrokuje oštećenje DNK u ćelijama jetre sisara in vivo koje se može popraviti vanrednom sintezom DNK in vitro. Negativni rezultat ukazuje da, pod uslovima ispitivanja, ispitivana supstanca ne uzrokuje oštećenja DNK koja su uočljiva ovim ispitivanjem.
Treba prodiskutovati verovatnoću da ispitivana supstanca dospe u sistemsku cirkulaciju ili specifično u ciljano tkivo (npr. sistemska toksičnost).
3. IZVEŠTAJ
Izveštaj o ispitivanju, ukoliko je moguće, sadrži podatke o:
1) Rastvaraču/vehikulumu:
- opravdanje za izbor vehikuluma;
- rastvorljivost i stabilnost ispitivane supstance u rastvaraču/vehikulumu, ukoliko je poznato.
2) Eksperimentalnim životinjama:
- korišćena vrsta/soj;
- broj, starost i pol životinja;
- izvor, uslovi smeštaja, ishrana, itd.;
- individualna telesna masa životinja na početku ispitivanja, uključujući raspon telesne mase, srednju vrednost i standardnu devijaciju za svaku grupu.
3) Uslovima ispitivanja:
- pozitivne i negativne kontrole vehikuluma/rastvarača;
- podaci iz studije traženja raspona, ukoliko je obavljena;
- obrazloženje izbora nivoa doza;
- detalji o preparatu ispitivane supstance;
- detalji o primeni ispitivane supstance;
- obrazloženje puta primene;
- metode provere da je ispitivani agens dospeo do sistemske cirkulacije ili ciljnog tkiva, ukoliko je primenjivo;
- konverzija iz koncentracije ispitivane supstance u hrani/vodi za piće (ppm) do stvarne doze (mg/kg telesna masa/dan), ukoliko je primenjivo;
- detalji o kvalitetu hrane i vode;
- detaljan opis tretmana i uzorkovanja;
- metode merenja toksičnosti;
- metode pripreme ćelija jetre i kultura;
- korišćena autoradiografska tehnika;
- broj pripremljenih slajdova i broj prebrojanih ćelija;
- kriterijumi ocenjivanja;
- kriterijumi da je ispitivanje pozitivno, negativno ili dvosmisleno.
4) Rezultatima:
- individualni slajd, srednje vrednosti po životinji i grupi za nuklearna zrnca, citoplazmatska zrnca, ineto nuklearna zrnca;
- odnos doza-efekat, ukoliko je dostupan;
- statistička ocena, ukoliko postoji;
- znaci toksičnosti;
- podaci o istovremenoj negativnoj (rastvarač/vehikulum) i pozitivnoj kontroli;
- istorijski podaci o negativnoj (rastvarač/vehikulum) i pozitivnoj kontroli s rasponom, srednjom vrednošću i standardnim devijacijama;
- broj "ćelija u popravci" ako je utvrđen;
- broj ćelija S-faze ako je utvrđen;
- vijabilitet ćelija.
5) Obrazloženju rezultata.
6) Zaključcima.
4. LITERATURA
1. Ashby, J., Lefevre, P.A., Burlinson, B. and Penman, M.G. (1985). An Assessment of the In vivo Rat Hepatocyte DNK Repair Assay. Mutation Res., 156, 1-18.
2. Butterworth, B.E., Ashby, J., Bermudez, E., Casciano, D., Mirsalis, J., Probst, G. and Williams, G. (1987). A Protocol and Guide for the In vivo Rat Hepatocyte DNA-Repair Assay. Mutation Res. 189, 123-133.
3. Kennelly, J.C., Waters, R., Ashby, J., Lefevre, P.A., Burlinson, B., Benford, D.J., Dean, S.W. and Mitchell, I. de G. (1993). In vivo Rat Liver UDS Assay. In: Kirkland D.J. and Fox M., (Eds) Supplementary Mutagenicity Tests: UKEM Recommended Procedures. UKEMS Subcommittee on Guidelines for Mutagenicity Testing. Report. Part II revised. Cambridge University Press, Cambridge, New York, Port Chester, Melbourne, Sydney, pp. 52-77.
4. Madle, S., Dean, S.W., Andrae, U., Brambilla, G., Burlinson, B., Doolittle, D.J., Furihata, C., Hertner, T., McQueen, C.A. and Mori, H. (1993). Recommendations for the Performance of UDS Tests In vitro and In vivo. Mutation Res., 312, 263-285.
5. Fautz, R., Hussain, B., Efstathiou, E. and Hechenberger-Freudl, C. (1993). Assessment of the Relation Between the Initial Viability and the Attachment of Freshly Isolated Rat Hepatocytes Used for the In vivo/In vitro DNK Repair Assay (UDS). Mutation Res., 291, 21-27.
6. Mirsalis, J.C., Tyson, C.K. and Butterworth, B.E. (1982). Detection of Genotoxic Carcinogens in the In vivo/In vitro Hepatocyte DNK Repair Assay. Environ. Mutagen, 4, 553-562.
B.40. IN VITRO ISPITIVANJE KOROZIVNOG OŠTEĆENJA KOŽE: ISPITIVANJE TRANSKUTANOG ELEKTRIČNOG OTPORA (TER)
1. METODA ISPITIVANJA
Ova metoda zasniva se na Uputstvu za ispitivanje OECD 430 (2004).
1.1. UVOD
Korozivno oštećenje kože odnosi se na stvaranje ireverzibilnog oštećenja tkiva u koži po nanošenju materijala koji se ispituje (kao što je definisano u GHS)1. Ova metoda obezbeđuje proceduru kojom se procena korozivnosti ne izvodi na živim životinjama.
Procena korozivnosti za kožu uključuje upotrebu laboratorijskih životinja2. Zabrinutost zbog bola i patnje životinja koje su uključene u ovaj postupak navodi se u reviziji metode V.4. koja je data u ovom prilogu, a koja dozvoljava određivanje korozivnog oštećenja kože upotrebom alternativnih, in vitro metoda, da bi se izbegli bol i patnja životinja.
Prvi korak ka definisanju alternativnih ispitivanja koji se mogu koristiti za ispitivanje korozivnosti za kožu u regulatorne svrhe bilo je izvođenje prevalidacionih studija3. Potom je izvedena6, 7, 8 formalna validacija studija in vitro metoda za procenu korozivnog oštećenja kože4, 5. Ishod ovih studija i druga objavljena literatura doveli su do preporuke da se sledeća ispitivanja mogu koristiti za procenu in vivo korozivnosti za kožu9, 10, 11: ispitivanje sa modelom humane kože (videti metodu V.40 bis koja je data u ovom prilogu) i ispitivanje transkutanog električnog otpora (ova metoda).
Studija validacije i druge objavljene studije potvrđuju da je ispitivanje transkutanog električnog otpora (TER) kože pacova12, 13 moguće pouzdano napraviti razliku između poznatih koroziva za kožu i nekoroziva5, 9.
Ispitivanje koje se opisuje u ovoj metodi omogućava identifikaciju korozivnih hemijskih supstanci i smeša. To dalje omogućava identifikaciju supstanci i smeša koje nisu korozivne kada je to potkrepljeno određivanjem težine dokaza korišćenjem (na osnovu) postojećih informacija (npr. pH, odnos struktura - aktivnost, humani ili životinjski podaci)1, 2, 11, 14. To ne daje podatak o iritaciji kože, niti dozvoljava subklasifikaciju korozivne supstance kao što je to dozvoljeno u GHS1.
Za potpunu procenu lokalnih efekata na koži posle jednokratnog izlaganja putem kože, preporučuje se da se prati sledeća strategija ispitivanja kao što je dodato u ispitivanju metodi V.4.2 koja je data u ovom prilogu i kao što je dato u GHS1. Ova strategija ispitivanja uključuje izvođenje in vitro ispitivanje za korozivno oštećenje kože (kao što je opisano u ovoj metodi) i iritacije kože pre razmatranja ispitivanja na živim životinjama.
1.2. DEFINICIJE
Korozivno oštećenje in vivo jeste nastanak ireverzibilnih oštećenja kože odnosno vidljive nekroze u epidermisu i dermisu nakon četvoročasovne primene ispitivane supstance. Korozivno oštećenje kože karakteriše se prema tipu izazvanog oštećenja kao:ulkus, krvarenje ili krvave kraste i na kraju perioda posmatranja od 14 dana prema promeni boje kože uslovljene perutanjem i pojavi površina sa alopecijom i ožiljnog tkiva. U cilju procene nejasnih oštećenja obavljaju se histopatološka ispitivanja.
Transkutani električni otpor (u daljem tekstu: TER) jeste mera električne impedance kože, kao vrednost otpora u kilo omima. Jednostavna i snažna metoda procene funkcije barijere snimanjem prolaska jona kroz kožu pomoću aparature Wheatstone bridge.
1.3. REFERENTNE SUPSTANCE
Tabela 1. Referentne hemikalije
Naziv |
EINECS broj |
CAS broj |
|
1,2-diaminopropan |
201-155-9 |
78-90-0 |
jako korozivno |
akrilna kiselina |
201-177-9 |
79-10-7 |
jako korozivno |
2-terc- butilfenol |
201-807-2 |
88-18-6 |
korozivno |
Kalijum-hidroksid (10%) |
215-181-3 |
1310-58-3 |
korozivno |
sumporna kiselina (10%) |
231-639-5 |
7664-93-9 |
korozivno |
oktanska kiselina (kaprilna kiselina) |
204-677-5 |
124-07-02 |
korozivno |
4-amino-1,2,4-triazol |
209-533-5 |
584-13-4 |
nije korozivno |
eugenol |
202-589-1 |
97-53-0 |
nije korozivno |
Fenetil-bromid |
203-130-8 |
103-63-9 |
nije korozivno |
tetrahloretilen |
204-825-9 |
27-18-4 |
nije korozivno |
izostearinska kiselina |
250-178-0 |
30399-84-9 |
nije korozivno |
4-(metiltio)-benzaldehid |
222-365-7 |
3446-89-7 |
nije korozivno |
Većina navedenih hemikalija preuzeta je sa spiska hemikalija izabranih za međunarodnu studiju validacije ECVAM4. Njihov izbor se bazira na sledećim kriterijumima:
a) jednak broj korozivnih i nekorozivnih supstanci;
b) komercijalno dostupne supstance koje pokrivaju većinu relevantnih hemijskih klasa;
v) obuhvatanje jako korozivnih kao i manje korozivnih supstanci kako bi se omogućilo razlikovanje na osnovu korozivnog potencijala;
g) izbor hemikalija kojima se može rukovati u laboratoriji bez postavljanja drugih ozbiljnih opasnosti osim korozivnosti.
1.4. PRINCIP METODE
Hemikalija koja se ispituje primenjuje se do 24 sata na epidermalne površine diskova kože u sistemu za ispitivanje koji se sastoji od dve komore u kome diskovi kože funkcionišu kao pregrada između komora. Diskovi kože su uzeti od humano usmrćenih pacova starosti 28 do 30 dana. Korozivni materijali se identifikuju prema njihovom svojstvu da produkuju gubitak integriteta i zaštitne funkcije stratum corneum-a, što se meri kao smanjenje TER ispod graničnog nivoa12. Za TER pacova, granična vrednost od 5 kΩ izabrana je na osnovu opsežnih podataka za širok opseg hemikalija gde je velika većina vrednosti bila ili jasno dosta iznad (često > 10 kΩ ili dosta ispod (često < 3 kΩ) ove vrednosti12. Materijali koji nisu korozivni kod životinja ali jesu ili nisu iritabilni ne snižavaju TER ispod ove granične vrednosti. Korićenje drugih preparata kože ili druge opreme može da izmeni graničnu vrednost i zahteva dalju validaciju. Korak vezivanja boje uključen je u postupak ispitivanja za potvrdu pozitivnih rezultata TER uključujući vrednosti približne 5kΩ.
Korak vezivanja boje određuje da li je povećanje u propustljivosti jona posledica fizičkog oštećenja stratum corneum-a. Metoda ispitivanja TER koja koristi kožu pacova ukazuje na in vivo korozivnost na kunićima koja se procenjuje u metodi ispitivanja V.4. koja je data u ovom prilogu2. In vivo ispitivanje na kunićima je visoko konzervativan u pogledu na korozivnost i iritabilnost za kožu u poređenju sa "patch" testom na humanoj koži15.
1.5. OPIS METODE
1.5.1. Životinje
Koriste se pacovi jer je osetljivost njihove kože na hemikalije u ovoj metodi prethodno prikazana10. Starost (u trenutku uzimanja kože) i soj pacova su veoma važni kako bi se obezbedilo da su folikuli dlake u fazi mirovanja pre nego što počne rast krzna odraslih.
Dlaka na leđima i boku mladih, približno 22 dana starih mužjaka ili ženki pacova (izvedenih od Wistar ili sličnog soja) pažljivo se ukloni pomoću malih makaza. Onda se životinje peru pažljivim brisanjem, dok se ograničeni deo potapa u rastvor antibiotika (koji sadrži, npr. streptomicin, penicilin, hloramfenikol i amfotericin, u koncentracijama koje imaju efekat inhibicije rasta bakterija). Životinje se peru antibioticima ponovo trećeg i četvrtog dana posle prvog pranja i koriste se tokom tri dana posle drugog pranja, kada se stratum corneum oporavio od odstranjivanja dlake.
1.5.2. Priprema diskova kože
Životinje se humano lišavaju života kada su 28 do 30 dana stari. Ovo doba je kritično. Dorzalno-lateralna koža svake životinje ukloni se i skine se prekomerna subkutana masnoća pažljivim guljenjem sa kože. Diskovi kože prečnika od oko 20 mm se uklone. Koža se može čuvati pre nego što se diskovi upotrebe kada je pokazano da su podaci pozitivne i negativne kontrole jednaki onima koji se dobiju sa svežom kožom.
Svaki disk kože se postavlja preko jednog od krajeva politetrafluoroetilenske (u daljem tekstu: PTFE) cevi, obezbeđujući da je epidermalna površina u kontaktu sa cevi. Gumeni "O" prsten stavlja se na kraj cevi kako bi držao kožu na mestu i višak tkiva se odstranjuje. Dimenzije cevi i "O" prstena prikazane su na Slici 2. Gumeni "O" prsten se tada pažljivo pečati za kraj PTFE cevi vazelinom. Cev se podupire opružnom podloškom unutar receptorske komore koja sadrži rastvor magnezijum sulfata (154 mM) (Slika 1). Disk kože je potpuno uronjen u rastvor MgSO4. Čak 10 do 15 diskova kože može se dobiti od jedne kože pacova.
Pre nego što počne ispitivanje, meri se električni otpor dva diska kože kao postupak kontrole kvaliteta za svaku kožu životinje. Oba diska daju vrednost otpora veću od 10 kΩ kako bi se preostali diskovi koristili u ispitivanju. Ukoliko je vrednost otpora manja od 10 kΩ, preostali diskovi te kože se odbacuju.
1.5.3. Primena ispitivanih i kontrolnih supstanci
Tečne ispitivane supstance (150 μL) ravnomerno se nanose na epidermalnu površinu unutar cevi. Prilikom ispitivanja čvrstih materijala, nanosi se dovoljna količina čvrste materije ujednačeno na disk tako da čitava površina epidermisa bude pokrivena. Preko čvrste materije dodaje se dejonizovana voda (150 μL) i cev se blago prodrma. Kako bi se postigao maksimalan kontakt s kožom, čvrste materije je možda potrebno zagrejati do temperature od 30° C da bi se otopile ili je potrebno omekšati ispitivanu supstancu ili je usitniti da se napravi zrnasti materijal ili prah.
Tri diska kože koriste se za svaku ispitivanu i kontrolnu supstancu. Ispitivane supstance se primenjuju 24 sata pri temperaturi od 20° C do 23° C. Ispitivana supstanca se uklanja pranjem pod mlazom vode temperature do 30° C sve dok se više supstance ne može odstraniti.
1.5.4. TER merenja
Impedanca kože se meri tako što se meri TER niskovoltažnim uređajem s naizmeničnom strujom Wheatstone databridge13. Opšte karakteristike mosta su radni napon 1-3 Volt-a, naizmenična struja od 50 Hz do 1.000 Hz sinusnog ili četvrtastog oblika i opseg merenja od najmanje 0,1 kΩ do 30 kΩ. "Databridge" koji je korišćen u studiji validacije gde je merio induktivnost, kapacitivnost i otpor do vrednosti od redom 2.000 H, 2.000 μF i 2 MΩ, pri frekvencijama od 100 Hz ili 1 kHz koristeći redne ili paralelne vrednosti. U svrhu TER korozivnosti, merenja u ispitivanju se snimaju u otporu, pri frekvenci od 100 Hz i korišćenjem rednih vrednosti. Pre merenja električnog otpora površinski napon kože se smanjuje dodavanjem dovoljne zapremine 70% etanola da pokrije epiderm. Posle nekoliko sekundi etanol se uklanja iz cevi i tkivo se tada hidrira dodavanjem rastvora 3 mL rastvora magnezijum sulfata (154 mM). "Databridge" elektrode se postavljaju na obe strane diskova kože kako bi se izmerio otpor u kΩ/disk kože (Slika 1). Dimenzije elektroda i dužina elektroda koja je izložena ispod štipaljki prikazane su na Slici 2. Štipaljka koja je zakačena na unutrašnju elektrodu otvorena je na vrhu PTFE cevi tokom merenja otpora kako bi se obezbedilo da je dužina elektrode koja je uronjena u rastvor MgSO4 stalna. Spoljna elektroda se nalazi unutar receptorske komore tako da naleže na dno komore. Razmak između opružne podloške i dna PTFE cevi održava se konstantnim (Slika 2), budući da ovaj razmak utiče na dobijene vrednosti otpora. Zbog toga, razmak između unutrašnje elektrode i diska kože treba da bude konstantan i minimalan (1 mm do 2 mm).
Ukoliko je izmerena vrednost otpora veća od 20kΩ, to može biti zbog toga što ostaci ispitivane supstance prekrivaju epidermalnu površinu diska kože. Može se pokušati sa daljim odstranjivanjem ovog sloja, npr. začepljivanjem PTFE cevi palcem u rukavici i protresanjem približno 10 sekundi. Rastvor magnezijum sulfata se odstranjuje i merenje otpora se ponavlja sa svežim magnezijum sulfatom.
Svojstva i dimenzije aparature za ispitivanje i postupka ispitivanja koji se koriste mogu da utiču na dobijene vrednosti TER. Granična vrednost od 5 kΩ je izvedena iz podataka dobijenih sa specifičnom aparaturom i postupkom koji su opisani u ovoj metodi. Drugačija granična vrednost i vrednosti kontrole mogu se primeniti ukoliko su uslovi ispitivanja izmenjeni ili se koristi drugačija aparatura. Zbog toga je neophodno kalibrisati ovu metodologiju i vrednosti graničnog otpora ispitivanjem serije referentnih standarda koji su izabrani od hemikalija korićenih u studiji validacije4, 5 ili od hemijskih klasa sličnih hemikaliji koja se ispituje. Grupa odgovarajućih referentnih hemikalija data je u Tabeli 1.
1.5.5. Metode vezivanja boje
Ekspozicija određenim materijalima koji nisu korozivni može da ima za posledicu smanjenje otpora ispod granice od 5 kΩ dozvoljavajući prolazak jona kroz stratum corneum tako smanjujući električni otpor5. Na primer, neutralne organske i hemikalije koje imaju površinski aktivna svojstva (uključujući detergente, emulgatore i druge surfaktante) mogu da uklone lipide kože čineći barijeru više propustljivom za jone. Ako su TER vrednosti ispitivane supstance manje od ili približno 5 kΩ u odsustvu vidljivog oštećenja, procena prodiranja boje izvodi se na kontrolnim i tretiranim tkivima da bi se odredilo da li su dobijene TER vrednosti rezultat povećane propustljivosti kože ili korozivno oštećenje kože3, 5. U drugom slučaju kada postoji prekid u stratum corneum-u, boja sulforodamin B, kada se nanese na površinu kože brzo prodire i boji potporno tkivo. Ova određena boja je stabilna prema širokom opsegu hemikalija i na rezultate ne utiče proces ekstrakcije koji je opisan ispod.
1.5.5.1. Nanošenje i uklanjanje sulforodamin B boje
Posle procene TER, magnezijum sulfat se odstranjuje iz cevi i koža se pažljivo pregleda kako bi se uočilo oštećenje. Ukoliko nema vidljivog većeg oštećenja, boja sulforodamin B (Acid Red 52; C.I. 45100; EINECS broj 222-529-8; CAS broj 3520-42-1), 150 µL 10% (w/v) rastvor u destilovanoj vodi nanosi se na epidermalnu površinu svakog diska kože na dva sata. Diskovi kože se tada ispiraju sa vodom sa česme pri najviše sobnoj temperaturi približno 10 sekundi kako bi se odstranila sva prekomerna/nevezana boja. Svaki disk kože pažljivo se ukloni sa PTFE cevi i stavlja u bočicu (npr. 20 mL staklena scintilaciona bočica) koja sadrži dejonizovanu vodu (8 mL). Bočice se lagano mešaju pet minuta kako bi se odstranila dodatna nevezana boja. Ovaj postupak ispiranja se zatim ponavlja, posle čega se diskovi kože uklanjaju i stavljaju u bočice koje sadrže 5mL 30% (w/v) natrijum dodecilsulfata (SDS) u destilovanoj vodi i inkubiraju se preko noći na 60° C.
Posle inkubacije svaki disk kože se odstranjuje i baca, a preostali rastvor se centrifugira osam minuta pri 21° C (relativna centrifugalna sila je oko 175xg). Uzorak od 1mL supernatanta se razblažuje 1 u 5 (v/v) (tj. 1mL + 4mL) sa 30% (w/v) SDS u destilovanoj vodi. Optička gustina (u daljem tekstu: OD) rastvora meri se na 565 nm.
1.5.5.2. Izračunavanje sadržaja boje
Sadržaj boje sulforodamin B po disku izračunava se iz OD vrednosti5 (koeficijent molarne estinkcije boje sulforodamin B pri 565 nm = 8,7 x 104; molekularna masa = 580). Sadržaj boje sulforodamin B određuje se za svaki disk kože korišćenjem odgovarajuće kalibracione krive i zatim se izračunava srednja vrednost sadržaja boje za replikate.
2. PODACI
Vrednosti otpora (kΩ) i srednje vrednosti sadržaja boje(μg/disk), kada to odgovara, za ispitivani materijal, kao i za pozitivne i negativne kontrole navode se tabelarno (pojedinačni podaci ispitivanja i srednje vrednosti ± S.D.), uključujući podatke za ponovljene eksperimente, srednje vrednosti i pojedinačne vrednosti.
2.1. TUMAČENJE REZULTATA
Srednje vrednosti TER prihvataju se ako su vrednosti istovremene pozitivne i negativne kontrole u prihvatljivim okvirima za metodu u laboratoriji koja vrši ispitivanje. Prihvatljivi opsezi otpora za metodologiju i aparaturu koje su opisane dati su u sledećoj tabeli:
Tabela 1.
kontrola |
supstanca |
opseg otpora (kΩ) |
pozitivna |
10M hlorovodonična kiselina |
0,5 - 1,0 |
negativna |
destilovana voda |
10 - 25 |
Rezultati srednje vrednosti sadržaja boje prihvataju se ako se vrednosti istovremene kontrole nalaze u okviru prihvatljivih opsega za metodu. Predloženi prihvatljivi opsezi sadržaja boje za kontrolne supstance za metodologiju i aparaturu koje su opisani su:
Tabela 2.
kontrola |
supstanca |
opseg sadržaja boje (μg/disk) |
pozitivna |
10M hlorovodonična kiselina |
40 - 100 |
negativna |
destilovana voda |
15 - 35 |
Supstanca koja se ispituje ne smatra se korozivnom za kožu:
a) ako je srednja vrednost TER dobijena za ispitivanu supstancu veća od 5 kΩ ili
b) ako je srednja vrednost TER manja ili jednaka 5 kΩ i
- disk kože ne pokazuje vidljivo oštećenje i
- srednja vrednost sadržaja boje diska je daleko ispod srednjeg sadržaja boje diska istovremene pozitivne kontrole, 10M HCl.
Ispitivana supstanca se smatra korozivnom za kožu:
a) ako je srednja vrednost TER manja ili jednaka 5 kΩ i disk kože je vidljivo oštećen ili
b) ako je srednja vrednost TER manja ili jednaka 5 kΩ i
- disk kože ne pokazuje vidljivo oštećenje, ali
- srednja vrednost sadržaja boje diska je veća ili jednaka srednjoj vrednosti sadržaja boje diska istovremene pozitivne kontrole, 10M HCl.
3. IZVEŠTAJ
Izveštaj o ispitivanju sadrži podatke o:
1) Ispitivanim i kontrolnim supstancama:
- hemijsko ime kao što je IUPAC ili CAS ime i CAS broj, ako je poznato;
- čistoća i sastav supstance ili smeše (u težinskim procentima) i fizička priroda;
- fizička i hemijska svojstva kao što su fizičko stanje, pH, stabilnost, rastvorljivost u vodi, ono što je relevantno za izvođenje studije;
- tretman ispitivane/kontrolne supstance pre ispitivanja, ako je primenljivo (npr. zagrevanje, usitnjavanje);
- stabilnost, ako je poznata.
2) Eksperimentalnim životinjama:
- korišćen soj i pol;
- starost životinja u trenutku kada se koriste kao donorske životinje;
- izvor, uslovi smeštaja, ishrana, itd.;
- detalji pripremanja kože.
3) Uslovima ispitivanja:
- kalibracione krive za aparaturu na kojoj se vrši ispitivanje;
- kalibracione krive za izvođenje ispitivanja vezivanja boje;
- detalji postupka ispitivanja koji se koristi za merenja TER;
- detalji postupka ispitivanja koji se koristi za procenu vezivanja boje, ako odgovara;
- opis svake izmene postupka ispitivanja;
- opis korišćenih kriterijuma za ocenjivanje.
4) Rezultatima:
- u tabeli dati podaci ispitivanja TER i vezivanja boje (ako je odgovarajuće) za svaku pojedinačnu životinju i uzorak kože;
- opis svakog primećenog efekta.
5) Obrazloženju rezultata.
6) Zaključcima.
4. LITERATURA
1. OECD, (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.oecd.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6.
2. Testing Method B.4. Acute Toxicity: Dermal Irritation/Corrosion.
3. Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, D.J., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., and Balls, M., (1995) A prevalidation study on in vitro skin corrosivity testing. The report and recommendations of ECVAM Workshop 6. ATLA 23, p. 219-255.
4. Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxicology. In vitro 12, p. 471-482.
5. Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhütter, H.- G., and Liebsch, M., (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology. In vitro 12, p. 483- 524.
6. OECD, (1996) Final Report of the OECD Workshop on Harmonisation of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, p. 62.
7. Balls, M., Blaauboer, B.J., Fentem. J.H., Bruner. L., Combes, R.D., Ekwall, B., Fielder. R.J., Guillouzo, A., Lewis, R.W., Lovell, D.P., Reinhardt, C.A., Repetto, G., Sladowski. D., Spielmann, H., and Zucco, F., (1995) Practical aspects of the validation of toxicity test procedures. The report and recommendations of ECVAM workshops. ATLA 23, p. 129-147.
8. ICCVAM, (Interagency Coordinating Committee on the Validation of Alternative Methods)., (1997) Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf.
9. ECVAM, (1998) ECVAM News & Views. ATLA 26, 275-280.
10. ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods)., (2002) ICCVAM evaluation of EpiDermTM, EPISKINTM (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf.
11. OECD (2002) Extended Expert Consultation Meeting on The In vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st-2nd November 2001, Secretariat‘s Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat.
12. Oliver, G.J.A., Pemberton, M.A., and Rhodes, C., (1986) An in vitro skin corrosivity test -modificationsand validation. Fd. Chem. Toxicol. 24, 507-512.
13. Botham, P.A., Hall, T.J., Dennett, R., McCall, J.C., Basketter, D.A., Whittle, E., Cheeseman, M., Esdaile, D.J., and Gardner, J., (1992) The skin corrosivity test in vitro: results of an interlaboratory trial. Toxic. In vitro 6, p. 191-194.
14. Worth A.P., Fentem J.H., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile D.J., Liebsch, M., (1998) An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26, p. 709-720
15. Basketter, D.A., Chamberlain, M., Griffiths, H.A., Rowson, M., Whittle, E., York, M., (1997) The classification of skin irritants by human patch test. Fd. Chem. Toxicol. 35, p. 845-852.
16. Oliver G.J.A, Pemberton M.A and Rhodes C., (1988) An In vitro model for identifying skin-corrosive chemicals. I. Initial Validation. Toxicology In vitro. 2, p. 7-17.
Slika 1
Aparatura za ispitivanje kože pacova TEP ogledom

Slika 2. Dimenzije politetrafluoroetilenske (PFTE) i receptorske cevi i elektroda koje se koriste
Kritični faktori aparature koja je prikazana:
- unutrašnji promer PTFE cevi;
- dužina elektrode u odnosu na PTFE cev i receptorsku cev, tako da elektroda ne dotiče disk kože i da je standardna dužina elektrode u kontaktu sa rastvorom magnezijum sulfata;
- količina rastvora magnezijum sulfata u receptorskoj cevi daje dubinu tečnosti, u odnosu na nivo u PTFE cev, kao što je prikazano na Slici 1;
- disk kože je dovoljno dobro pričvršćen za PTFE cev, tako da električni otpor bude prava mera svojstava kože.
B.40. BIS. IN VITRO KOROZIVNO OŠTEĆENJE KOŽE: ISPITIVANJE NA MODELU HUMANE KOŽE
1. METODA ISPITIVANJA
Ova metoda zasniva se na Uputstvu za ispitivanje OECD 431 (2004).
1.1. UVOD
Korozivno oštećenje kože odnosi se na stvaranje ireverzibilnog oštećenja tkiva u koži po nanošenju materijala koji se ispituje (kao što je definisano u GHS)1. Ova metoda ispitivanja ne zahteva upotrebu živih životinja ili životinjskog tkiva za procenu korozivnosti za kožu.
Procena korozivnosti za kožu uključuje upotrebu laboratorijskih životinja2. Zabrinutost zbog bola i patnje životinja koje su uključene u ovaj postupak pominje se u reviziji metode B.4. koja je data u ovom prilogu i koja dozvoljava određivanje korozivnog oštećenja kože upotrebom alternativnih, in vitro metoda, da bi se izbegli bol i patnja životinja.
Prvi korak ka definisanju alternativnih ispitivanja koji se mogu koristiti za ispitivanje korozivnosti za kožu u regulatorne svrhe bilo je izvođenje prevalidacionih studija3. Potom je izvedena6, 7, 8 formalna validacija studija in vitro metoda za procenu korozivnost oštećenja kože4, 5. Ishod ovih studija i druga objavljena literatura9 doveli su do preporuke da se sledeća ispitivanja mogu koristiti za procenu in vivo korozivnosti za kožu10, 11, 12, 13: ispitivanje sa modelom humane kože (ova metoda) i ispitivanje transkutanog električnog otpora (videti metodu B.40. koja je data u ovom prilogu).
Studije validacije potvrđuju da je ispitivanjima a koji uključuju modele humane kože3, 4, 5, 9 moguće pouzdano napraviti razliku između poznatih korozivnih i nekorozivnih supstanci za kožu. Postupak ispitivanja može da obezbedi naznaku razlike između jakih i manje jakih koroziva za kožu.
Ispitivanje koje se opisuje u ovoj metodi omogućava identifikaciju korozivnih hemijskih supstanci i smeša. To dalje omogućava identifikaciju supstanci i smeša koje nisu korozivne kada je to potkrepljeno određivanjem težine dokaza korišćenjem (na osnovu) postojećih podataka (npr. pH, odnos struktura - aktivnost, humani i/ili životinjski podaci)1, 2, 13, 14. To obično ne daje odgovarajuće podatke o iritaciji kože, niti dozvoljava subklasifikaciju korozivne supstance kao što je to dozvoljeno u GHS1.
Za potpunu procenu lokalnih efekata na koži posle jednokratnog izlaganja putem kože, preporučuje se da se prati sledeća strategija ispitivanja kao što je dato u metodi ispitivanja B.4. koja je data u ovom prilogu2 i kao što je dato u GHS1. Ova strategija ispitivanja uključuje izvođenje in vitro ispitivanja za korozivno oštećenje kože (kao što je opisano u ovoj metodi) i iritacije kože pre razmatranja ispitivanja na živim životinjama.
1.2. DEFINICIJE
Korozivno oštećenje in vivo jeste nastanak ireverzibilnih oštećenja kože odnosno vidljive nekroze u epidermisu i dermisu nakon četvoročasovne primene ispitivane supstance. Korozivno oštećenje kože karakteriše se prema tipu izazvanog oštećenja kao:ulkus, krvarenje ili krvave kraste i na kraju perioda posmatranja od 14 dana prema promeni boje kože uslovljene perutanjem i pojavi površina sa alopecijom i ožiljnog tkiva. U cilju procene nejasnih oštećenja obavljaju se histopatološka ispitivanja.
Vijabilnost ćelija jeste parametar koji meri ukupnu aktivnost ćelijske populacije (npr. sposobnost ćelijske mitohondrijalne dehidrogenaze da smanji vitalnu boju MTT), koja, u zavisnosti od ciljnog pokazatelja ispitivanja koji se meri i korišćenog dizajna ispitivanja korelira sa ukupnim brojem i/ili vitalnosti ćelija.
1.3. REFERENTNE SUPSTANCE
Tabela 1: Referentne hemikalije
Naziv |
EINECS broj |
CAS broj |
|
1,2-diaminopropan |
201-155-9 |
78-90-0 |
jako korozivno |
akrilna kiselina |
201-177-9 |
79-10-7 |
jako korozivno |
2-terc-butilfenol |
201-807-2 |
88-18-6 |
korozivno |
kalijum-hidroksid (10%) |
215-181-3 |
1310-58-3 |
korozivno |
sumporna kiselina (10%) |
231-639-5 |
7664-93-9 |
korozivno |
oktanska kiselina (kaprilna kiselina) |
204-677-5 |
124-07-02 |
korozivno |
4-amino-1,2,4-triazol |
209-533-5 |
584-13-4 |
nije korozivno |
eugenol |
202-589-1 |
97-53-0 |
nije korozivno |
fenetil-bromid |
203-130-8 |
103-63-9 |
nije korozivno |
tetrahloroetilen |
204-825-9 |
27-18-4 |
nije korozivno |
izostearinska kiselina |
250-178-0 |
30399-84-9 |
nije korozivno |
4-(metiltio)-benzaldehid |
222-365-7 |
3446-89-7 |
nije korozivno |
Većina navedenih hemikalija preuzeto je sa spiska hemikalija izabranih za međunarodnu studiju validacije ECVAM4. Njihov izbor se bazira na sledećim kriterijumima:
a) jednak broj korozivnih i nekorozivnih supstanci;
b) komercijalno dostupne supstance koje pokrivaju većinu relevantnih hemijskih klasa;
v) obuhvatanje jako korozivnih kao i manje korozivnih supstanci kako bi se omogućilo razlikovanje na osnovu korozivnog potencijala;
g) izbor hemikalija kojima se može rukovati u laboratoriji bez postavljanja drugih ozbiljnih opasnosti osim korozivnosti.
1.4. PRINCIP METODE
Ispitivani materijal nanosi se površinski na trodimenzionalni model ljudske kože, koji se sastoji najmanje od rekonstruisanog epidermisa sa funkcionalnim stratum corneum-om. Korozivni materijali se identifikuju po njihovoj sposobnosti da izazovu smanjenje vijabilnosti ćelija (kao što je određeno npr. korišćenjem eseja smanjenja MTT15) ispod definisanih granica pri određenim periodima izlaganja. Princip ispitivanja modela humane kože zasniva se na hipotezi da korozivne hemikalije mogu da prodru kroz stratum corneum difuzijom ili erozijom i dovoljno su citotoksične da uzrokuju odumiranje potpornih slojeva ćelija.
1.4.1. Postupak
1.4.1.1. Modeli ljudske kože
Modeli ljudske kože mogu biti sastavljeni ili dobijeni komercijalno (npr. modeli EpiDermTM and EPISKINTM)16, 17, 18, 19 ili mogu biti razvijeni ili sastavljeni u laboratoriji koja vrši ispitivanje20, 21. Upotreba humane kože je predmet domaćih i međunarodnih etičkih razmatranja i uslova. Svaki novi model se validira (najmanje u obimu koji je opisan u odeljku 1.4.1.1.2. ove metode). Modeli humane kože koji se koriste za ovo ispitivanje zadovoljavaju sledeće:
1.4.1.1.1. Opšti uslovi za model
Humani keratinociti se koriste za izradu epitelijuma. Ispod funkcionalnog stratum corneum-a prisutno je više slojeva vijabilnih epitelijalnih ćelija. Model kože može da ima sloj sa stromalnom komponentom. Stratum corneum je višeslojan sa neophodnim lipidnim profilom da stvara funkcionalnu barijeru sa snagom da pruži otpor brzom prodiranju citotoksičnih markera. Svojstva sastava modela sprečavaju prolazak materijala oko stratum corneum-a do vijabilnog tkiva. Prolazak ispitivanih hemikalija oko stratum corneum-a dovodi do lošeg modelovanja ekspozicije kože. Model kože je bez kontaminacije bakterijama (uključujući mikoplazmu) ili gljivicama.
1.4.1.1.2. Uslovi za funkcionalni model
Veličina vijabilnosti obično se kvantifikuje upotrebom MTT ili druge vitalne boje koja se metabolički transformiše. U ovim slučajevima optička gustina (u daljem tekstu: OD) ekstrahovane (rastvorene) boje iz negativnog kontrolnog tkiva je najmanje 20 puta veća od OD samog ekstrakcionog rastvarača (za opšti pregled videti literaturu22). Negativno kontrolno tkivo je stabilno u kulturi (obezbeđujući slična merenja vijabilnosti) u trajanju perioda ispitivanog izlaganja. Stratum corneum je dovoljno otporan da se odupre brzom prodiranju određenih hemikalija - citotoksičnih markera (tj. 1% Triton X-100). Ovo svojstvo može da bude procenjeno vremenom ekspozicije koje je potrebno da se smanji vijabilnost ćelija za 50% (ET50) (npr. za modele EpiDermTM and EPISKINTM ono je > 2 sata). Ovo tkivo prikazuje reproduktivnost tokom vremena i najbolje između laboratorija. Sem toga, ono treba da može da predvidi korozivni potencijal referentne hemikalije (videti Tabelu 1) kada se koristi u izabranom protokolu ispitivanja.
1.4.1.2. Primena ispitivanih i kontrolnih supstanci
Dva replikata (kopije) tkiva koriste se za svaki tretman (vreme izlaganja), uključujući kontrole. Za tečne materijale, dovoljno ispitivane supstance se nanosi tako da ujednačeno prekrije površinu kože: koristi se najmanje 25 μL/cm2. Za čvrste materijale, dovoljno ispitivane supstance se nanosi ujednačeno da pokrije kožu i navlaži se sa dejonizovanom ili destilovanom vodom kako bi se omogućio dobar kontakt sa kožom. Kada je prikladno, čvrste supstance se usitne u prah pre primene. Metoda primene treba da bude odgovarajuća za ispitivanu supstancu (videti literaturu5). Na kraju perioda izlaganja, ispitivani materijal se pažljivo pere sa površine kože sa odgovarajućom puferom ili 0,9% NaCl.
Istovremene pozitivne i negativne kontrole se koriste za svaku studiju kako bi se obezbedila adekvatna performansa eksperimentalnog modela. Predložene supstance za pozitivnu kontrolu su glacijalna sirćetna kiselina ili 8N KOH. Predložene negativne kontrole su 0,9% NaCl ili voda.
1.4.1.3. Merenja vijabilnosti ćelija
Samo kvantitativne, validovane metode mogu se koristiti za merenje vijabilnosti ćelija. Mera vijabilnosti mora da bude kompatibilna sa upotrebom trodimenzionalne konstrukcije tkiva. Nespecifično vezivanje boje ne sme da interferira sa merenjem vijabiliteta. Boje koje se vezuju za protein i one koje ne podležu metaboličkoj tranformaciji (npr. neutral red) zato nisu pogodne. Najčešće korišćeno ispitivanje je smanjenje MTT (3-(4,5-dimetiltiazol-2il)-2,5-difeniltetrazolijum bromid, Tiazol plavo: EINECS broj 206-069-5, CAS broj 298-93-1)), za koji je pokazano da daje tačne i reproduktivne rezultate5, ali mogu se koristiti i druga ispitivanja. Uzorak kože se stavlja u rastvor MTT odgovarajuće koncentracije (npr. 0,3 - 1mg/mL) na odgovarajućoj inkubacionoj temperaturi tokom tri sata. Istaloženi plavi proizvod formazan se zatim ekstrahuje upotrebom rastvarača (izopropanola) i meri se koncentracija formazana se meri određivanjem OD na talasnoj dužini između 540 nm i 595 nm.
Hemijsko dejstvo ispitivanog materijala na vitalnu boju može da liči na metabolizam ćelije vodeći do pogrešne procene vijabilnosti. Ovo se dešava kada takav ispitivani materijal nije potpuno uklonjen sa kože ispiranjem9. Ako ispitivani materijal direktno deluje na vitalnu boju, dodatne kontrole se koriste kako bi se detektovala i korigovala interferencija ispitivane supstance sa merenjem vijabiliteta9, 23.
2. PODACI
Za svako tkivo navode se OD vrednosti i izračunati procenti vijabilnosti ćelija za svaki ispitivani materijal, pozitivne i negativne kontrole, uključujući podatke od replikata ponovljenih eksperimenata kako odgovara, srednje i pojedinačne vrednosti.
2.1. TUMAČENJE REZULTATA
Dobijene OD vrednosti za svaki ispitivani uzorak mogu se koristiti za izračunavanje procenta vijabiliteta u odnosu na negativnu kontrolu, koja je 100%. Granična vrednost procenta vijabiliteta koja pravi razliku između korozivnih i nekorozivnih materijala (ili razliku između različitih klasa koroziva) ili statistička procedura koja se koristi da se ocene rezultati i identifikuju korozivni materijali, jasno se definišu, dokumentuju i prikazuju da su odgovarajući. Ove granične vrednosti utvrđuju se za vreme optimizacije ispitivanja, ispituju se tokom prevalidacione faze i potvrđuju u validacionoj studiji. Kao primer predviđanje korozivnosti koja je u vezi sa modelom EpiDermTM je9:
Ispitivana supstanca se smatra korozivnom za kožu:
a) ako je vijabilnost posle tri minuta izlaganja manja od 50% ili
b) ako je vijabilnost posle tri minuta izlaganja veća ili jednaka 50% i vijabilnost posle jednog sata izloženosti manja od 15%.
Ispitivana supstanca se ne smatra korozivnom za kožu:
a) ako je vijabilnost posle tri minuta izloženosti veća ili jednaka 50% i vijabilnost posle 1 sata izlaganja veća ili jednaka 15%.
3. IZVEŠTAJ
Izveštaj o ispitivanju, ukoliko je moguće, sadrži podatke o:
1) Ispitivanim i kontrolnim supstancama:
- hemijsko ime kao što je IUPAC ili CAS ime i CAS broj, ako je poznato;
- čistoća i sastav supstance ili smeše (u težinskim procentima);
- fizička i hemijska svojstva kao što su fizičko stanje, pH, stabilnost, rastvorljivost u vodi, ono što je relevantno za izvođenje studije;
- tretman ispitivane/kontrolne supstance pre ispitivanja, ako je primenljivo (npr. zagrevanje, usitnjavanje);
- stabilnost, ako je poznata.
2) Opravdanju modela kože i korišćenog postupka.
3) Uslovima ispitivanja:
- korišćen sistem ćelija;
- podatke o kalibraciji za uređaj za merenje koji se koristi za merenje vijabilnosti ćelija (npr. spektrofotometar);
- svi podaci na koje se oslanjalo za specifični model kože uključujući njegovu validaciju;
- detalji postupka ispitivanja;
- korišćene doze;
- opis modifikacije postupka ispitivanja;
- reference prema istorijskim podacima za model;
- opis korišćenih kriterijuma za ocenjivanje.
4) Rezultatima:
- podaci pojedinačnih ispitivanih uzoraka u tabeli;
- opis drugih primećenih efekata.
5) Obrazloženju rezultata.
6) Zaključcima.
4. LITERATURA
1. OECD (2001) Harmonised Integrated Classification System for Human Health and Environmental Hazards of Chemical Substances and Mixtures. OECD Series on Testing and Assessment Number 33. ENV/JM/MONO(2001)6, Paris. http://www.olis.oecd.org/olis/2001doc.nsf/LinkTo/env-jm-mono(2001)6.
2. Testing Method B.4. Acute Toxicity: Dermal Irritation/Corrosion.
3. Botham, P.A., Chamberlain, M., Barratt, M.D., Curren, R.D., Esdaile, D.J., Gardner, J.R., Gordon, V.C., Hildebrand, B., Lewis, R.W., Liebsch, M., Logemann, P., Osborne, R., Ponec, M., Regnier, J.F., Steiling, W., Walker, A.P., and Balls, M., (1995) A prevalidation study on in vitro skin corrosivity testing. The report recommendations of ECVAM Workshop 6 ATLA 23, p. 219-255.
4. Barratt, M.D., Brantom, P.G., Fentem, J.H., Gerner, I., Walker, A.P., and Worth, A.P. (1998). The ECVAM international validation study on in vitro tests for skin corrosivity. 1. Selection and distribution of the test chemicals. Toxicology In vitro 12, p. 471-482.
5. Fentem, J.H., Archer, G.E.B., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Holzhutter, H.G. and Liebsch, M., (1998) The ECVAM international validation study on in vitro tests for skin corrosivity. 2. Results and evaluation by the Management Team. Toxicology In vitro 12, p. 483-524.
6. OECD, (1996) Final Report of the OECD Workshop on Harmonisation of Validation and Acceptance Criteria for Alternative Toxicological Test Methods, p. 62.
7. Balls, M., Blaauboer, B.J., Fentem, J.H., Bruner, L., Combes, R.D., Ekwall, B., Fielder, R.J., Guillouzo, A., Lewis, R.W., Lovell, D.P., Reinhardt, C.A., Repetto, G., Sladowski, D., Spielmann, H., and Zucco, F., (1995) Practical aspects of the validation of toxicity test procedures. Test report and recommendations of ECVAM workshops. ATLA 23, p. 129-147.
8. ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods)., (1997) Validation and Regulatory Acceptance of Toxicological Test Methods. NIH Publication No 97-3981. National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/docs/guidelines/validate.pdf.
9. Liebsch, M., Traue, D., Barrabas, C., Spielmann, H., Uphill, P., Wilkins, S., McPherson, J.P., Wiemann, C., Kaufmann, T., Remmele, M. and Holzhutter, H.G., (2000) The ECVAM prevalidation study on the use of EpiDerm for skin Corrosivity testing. ATLA 28, p. 371-401.
10. ECVAM, (1998) ECVAM News & Views. ATLA 26, p. 275-280.
11. ECVAM, (2000) ECVAM News & Views. ATLA 28, p. 365-67.
12. ICCVAM (Interagency Coordinating Committee on the Validation of Alternative Methods)., (2002) ICCVAM evaluation of EpiDermTM, EPISKINTM (EPI-200), and the Rat Skin Transcutaneous Electrical Resistance (TER) assay: In vitro test methods for assessing dermal corrosivity potential of chemicals. NIH Publication No 02-4502. National Toxicology Program Interagency Center for the Evaluation of Alternative Toxicological Methods, National Institute of Environmental Health Sciences, Research Triangle Park, NC, USA. http://iccvam.niehs.nih.gov/methods/epiddocs/epis_brd.pdf.
13. OECD, (2002) Extended Expert Consultation Meeting on The In vitro Skin Corrosion Test Guideline Proposal, Berlin, 1st-2nd November 2001, Secretariat‘s Final Summary Report, 27th March 2002, OECD ENV/EHS, available upon request from the Secretariat
14. Worth, A.P., Fentem, J.H., Balls, M., Botham, P.A., Curren, R.D., Earl, L.K., Esdaile, D.J., Liebsch, M., (1998) An Evaluation of the Proposed OECD Testing Strategy for Skin Corrosion. ATLA 26, p. 709-720.
15. Mosmann, T., (1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity asssays. J.Immunol. Meth. 65, p. 55-63.
16. Cannon, C.L., Neal, P.J., Southee, J.A., Kubilus, J., and Klausner, M., 1994. New epidermal model for dermal irritancy testing. Toxicology In vitro 8, p. 889-891.
17. Ponec, M., Boelsma, E., Weerheim, A., Mulder, A., Boutwstra, J., and Mommaas, M., 2000. Lipid and ultrastructural characterisation of reconstructed skin models. International Journal of Pharmaceutics. 203, p. 211-225.
18. Tinois, E., Gaetani, Q., Gayraud, B., Dupont, D., Rougier, A., Pouradier, D.X., (1994) The Episkin model: Successful reconstruction of human epidermis in vitro. In In vitro Skin Toxicology. Edited by A Rougier, AM Goldberg and HI Maibach, p. 133-140
19. Tinois E, Tiollier J, Gaucherand M, Dumas H, Tardy M, Thivolet J (1991). In vitro and post-transplantation differentiation of human keratinocytes grown on the human type IV collagen film of a bilayered dermal substitute. Experimental Cell Research 193, p. 310-319
20. Parentau, N.L., Bilbo, P., Molte, C.J., Mason, V.S., and Rosenberg, H., (1992) The organotypic culture of human skin keratinocytes and fibroblasts to achieve form and function. Cytotechnology 9, p. 163-171.
21. Wilkins, L.M., Watson, S.R., Prosky, S.J., Meunier, S.F., Parentau, N.L., (1994) Development of a bilayered living skin construct for clinical applications. Biotechnology and Bioengineering 43/8, p. 747-756.
22. Marshall, N.J., Goodwin, C.J., Holt, S.J., (1995) A critical assessment of the use of microculture tetrazolium assays to measure cell growth and function. Growth Regulation 5, p. 69-84.
23. Fentem, J.H., Briggs, D., Chesne’, C., Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Rouget, R., and van de Sandt, J.J.M., and Botham, P.A., (2001) A prevalidation study on in vitro tests for acute skin irritation: results and evaluation by the Management Team. Toxicology In vitro 15, p. 57-93.
B.41. IN VITRO 3T3 NRU ISPITIVANJE FOTOTOKSIČNOSTI
Deo prvi
1. METODA ISPITIVANJA
Ova metoda zasniva se na Uputstvu za ispitivanje OECD 432 (2004).
1.1. UVOD
Fototoksičnost se definiše kao toksična reakcija na supstancu primenjenu na organizam koja je ili izazvana ili pojačana (jasna pri nižim doznim nivoima) posle naknadnog izlaganja svetlosti ili koja je uzrokovana zračenjem kože posle sistemske primene supstance.
In vitro 3T3 NRU ispitivanje fototoksičnosti se koristi za identifikovanje fototoksičnog potencijala ispitivane supstance koji je izazvan pobuđenom hemikalijom posle ekspozicije svetlu. Ispitivanje ocenjuje foto-citotoksičnost relativnim smanjenjem u vijabilnosti ćelija koje su izložene hemikaliji u prisustvu svetlosti u odnosu na odsustvo svetlosti. Supstance koje su identifikovane ovim ispitivanjem su verovatno fototoksične in vivo po sistemskoj primeni i distribuciji u kožu ili posle površinske primene (lokalne primene na kožu).
Mnoge vrste hemikalija su prijavljene da izazivaju fototoksične efekte1, 2, 3, 4. Njihovo zajedničko svojstvo je njihova sposobnost da apsorbuju svetlosnu energiju u opsegu sunčeve svetlosti. Prema prvom zakonu fotohemije (zakon Grotthaus-Draper), fotoreakcija zahteva dovoljnu apsorpciju kvantuma svetlosti. Zbog toga, pre razmatranja biološkog ispitivanja, određuje se UV/vis apsorpcioni spektar ispitivane supstanceXIV. Predloženo je da ako je molarni ekstinkcioni/apsorpcioni koeficijent manji od 10 litre x mol-1 x cm-1 onda supstanca verovatno nije fotoreaktivna. Takvu hemikaliju nije neophodno ispitivati in vitro 3T3 NRU ispitivanjem fototoksičnosti ili bilo kojim drugim ispitivanjem za štetne fotohemijske efekte1, 5. Videti Deo drugi ove metode.
Pouzdanost i relevantnost in vitro 3T3 NRU ispitivanja fototoksičnosti je nedavno evaluirana6, 7, 8, 9. In vitro 3T3 NRU test fototoksičnosti se pokazao predvidivim za akutne fototoksične efekte kod životinja i ljudi in vivo. Test nije dizajniran da predvidi druge štetne efekte koji bi se mogli pojaviti iz kombinovanog dejstva hemikalije i svetlosti, npr. ne odnosi se na fotogenotoksičnost, fotoalergiju ili fotokarcinogenost, niti dozvoljava procenu potencijala fototoksičnosti. Test nije dizajniran da se odnosi na indirektne mehanizme fototoksičnosti, efekte metabolita ispitivane supstance ili efekte smeša.
Kako je upotreba metabolišućih sistema opšti zahtev za sve in vitro testove za predviđanje genotoksičnosti i karcinogenog potencijala, do sada, u slučaju fototoksikologije, postoje samo retki primeri kada je potrebna metabolička transformacija za hemikaliju da bi se ponašala kao fotootrov in vivo ili in vitro. Zbog toga se ne smatra neophodnim niti naučno opravdanim za ovaj test da se izvodi sa sistemom metaboličke aktivacije.
_____________
XIV Prema OECD TG 101
1.2. DEFINICIJE
Zračenje jeste intenzitet upadnog ultravioletnog (u daljem tekstu: UV) ili vidljivog svetla na površini, meren u W/m2 ili mW/cm2.
Doza svetlosti jeste količina (koja je jednaka proizvodu intenziteta i vremena) UV ili vidljivog upadnog zračenja na površini, izražen u džulima (= W × s) po jedinci površine, npr. J/m2 ili J/cm2.
Talasne dužine UV svetlosti jesu oznake koje je preporučila CIE (Commission Internationale de L'Eclairage), i to su: UVA (315 nm do 400 nm), UVB (280 nm do 315 nm) i UVC (100 nm do 280 nm). Druge oznake su takođe u upotrebi: podela između UVB i UVA se često stavlja na 320 nm, a UVA može biti podeljena u UV-A1 i UV-A2 s podelom napravljenom na oko 340 nm
Viabilitet ćelija jeste parametar koji meri ukupnu aktivnost ćelijske populacije (npr. upijanje vitalne boje Neutral Red u ćelijske lizozome), koja u zavisnosti od ciljnog pokazatelja ispitivanja koji se meri i korišćenog dizajna ispitivanja korelira sa ukupnim brojem i/ili vitalnosti ćelija
Relativni viabilitet ćelija jeste ćelijski viabilitet izražen u odnosu na negativne (rastvarač) kontrole koje su prošle celi eksperimentalni postupak (+Irr ili -Irr), ali nisu tretirane sa ispitivanom hemikalijom.
Fotoiritaciioni faktor (u daljem tekstu: PIF) jeste faktor izveden upoređivanjem dve podjednako efikasne citotoksične koncentracije (IC50) ispitivane hemikalije dobijene u odsustvu (-Irr) i u prisustvu (+Irr) necitotoksičnog zračenja sa UVA/vis svetlošću.
IC50 jeste koncentracija ispitivane hemikalije koja smanjuje viabilnost ćelija za 50%.
Srednji fotoefekat (u daljem tekstu: MPE) jeste mera izvedena iz matematičke analize krivih koncentracija odgovor dobijenih u odsustvu (-Irr) i u prisustvu (+Irr) zračenja sa UVA/vis svetlošću koje nije cititiksično.
Fototoksičnost jeste akutna toksična reakcija koja je izazvana posle prvog izlaganja kože određenim hemikalijama i naknadnom izlaganju svetlu ili koja je slično izazvana zračenjem kože posle sistemske primene hemikalije.
1.3. PRINCIP METODE
In vitro 3T3 NRU test fototoksičnosti zasnovan je na poređenju citotoksičnosti hemikalije, kada se ispituje u prisustvu i odsustvu izlaganja necitotoksičnoj dozi simulirane sunčeve svetlosti. Citotoksičnost je u ovom testu izražena kao smanjenje preuzimanja vitalne boje, Neutral Red. Zavisno od koncentracije, kada se meri 24 sata posle tretmana ispitivanom hemikalijom i zračenja10. NR je slaba katjonska boja koja lako prodire kroz membrane ćelija ne-difuzijom, akumulirajući se intracelularno u lizosomima. Promene u površini osetljive lizosomalne membrane vodi do lizosomalne nepostojanosti i drugih promena koje postepeno postaju ireverzibilne. Takve promene koje su nastale dejstvom ksenobiotika imaju za posledicu smanjenje preuzimanja i vezivanja NR. Na ovaj način se može napraviti razlika između viabilnih, oštećenih ili mrtvih ćelija, što je osnova ovog ispitivanja.
Balb/c 3T3 ćelije se održavaju u kulturi 24 sata da bi se formirali monoslojevi. Dve posude sa 96 bazenčića po ispitivanoj hemikaliji se pre-inkubiraju sa osam različitih koncentracija ispitivane supstance u trajanju od 1 sata. Potom se jedna od dve posude izlaže najvišoj dozi ne-citotoksičnog zračenja dok se druga posuda drži u mraku. Zatim se u obe posude medijum tretmana zameni medijumom za kultivisanje i posle sledećih 24 sata inkubacije određuje se viabilitet ćelija preuzimanjem Neutral Red boje. Viabilitet ćelija se izražava kao procenat od netretiranih kontrola rastvarača i računa se za svaku ispitivanu koncentraciju. Kako bi se predvideo potencijal fototoksičnosti, porede se koncentracione reakcije dobijene u prisustvu i u odsustvu zračenja, obično pri nivou IC50, tj. pri koncentraciji koja smanjuje viabilitet ćelija do 50% u poređenju sa netretiranim kontrolama.
1.4. OPIS METODE
1.4.1. Pripreme
1.4.1.1. Ćelije
Permanentna ćelijska linija mišjih firoblasta, Balb/c 3T3, klon 31, bilo iz Kolekcije kultura američkog tipa (American Type Culture Collection, ATCC), Manassas, VA, USA ili iz Evropske Kolekcije ćelijskih kultura (The European Collection of Cell Cultures, ECACC, Salisbury, Wiltshire, UK) korišćena je u studiji validacije i zato se preporučuje da se nabave iz dobro kvalifikovanih depoa ćelija. Uz isti postupak ispitivanja mogu se koristiti druge ćelije ili ćelijske linije ako su uslovi kultivisanja prilagođeni specifičnim potrebama ćelija, ali se pokazuje ekvivalentnost.
Ćelije se redovno proveravaju na odsustvo kontaminacije mikoplazmom i koristiti jedino ako nijedna mikoplazma nije pronađena11.
Važno je da se redovno proverava osetljivost ćelija na UV prema postupcima kontrole kvaliteta koje su opisane u ovoj metodi. Zbog toga što se UVA osetljivost ćelija može povećati s brojem prolaza, koristi se Balb/c 3T3 ćelije najnižeg broja prolaza koji se može dobiti, najbolje manje od 100 (videti odeljak 1.4.2.2.2. ove metode i Deo treći ove metode).
1.4.1.2. Medijum i uslovi kultivisanja
Odgovarajući medijum za kultivisanje i uslovi kultivacije se koriste za rutinske prolaze ćelija i tokom postupka ispitivanja, npr. za ćelije Balb/c 3T3 oni su DMEM (Dulbecco's Modified Eagle's Medium) kome je dodato 10% seruma novorođenog govečeta, 4 mM glutamina, penicilin (100 IU) i streptomicin (100 μg/mL), i vlažna inkubacija na 37° C, 5%-7,5% CO2 u zavisnosti od pufera (videti odeljak 1.4.1.4. drugi pasus ove metode). Naročito je važno da uslovi kultivisanja ćelija obezbede da vreme ciklusa ćelija bude u okviru normalnog istorijskog opsega ćelija ili ćelijskih linija koje se koriste.
1.4.1.3. Pripremanje kultura
Ćelije iz zamrznutih "stock" kultura zaseju se u medijum za kultivisanje pri odgovarajućoj gustini i subkultivišu najmanje jednom pre upotrebe u in vitro 3T3 NRU testu fototoksičnosti.
Ćelije koje se koriste za test fototoksičnosti poseju se u medijum za kultivisanje pri odgovarajućoj gustini tako da kulture ne dostignu nagomilavanje do kraja testa, tj. kada je viabilitet ćelija određen 48 sati posle zasejavanja ćelija. Za ćelije Balb/c 3T3 koje rastu u posudama od 96 bazenčića, preporučena gustina zasejavanja ćelija je 1 × 104 ćelija po bazenčiću.
Za svaku ispitivanu supstancu ćelije se zaseju identično u dve odvojene posude sa 96 bazenčića, koji zatim istovremeno prolaze postupak ispitivanja pod identičnim uslovima kultivacije osim za vremenski period kada se jedna posuda izlaže zračenju (+Irr) a druga se drži u mraku (-Irr).
1.4.1.4. Priprema ispitivane supstance
Ispitivane supstance se pripremaju sveže, odmah pre upotrebe osim ukoliko podaci pokazuju njihovu stabilnost pri čuvanju. Preporučuje se da se celokupna priprema hemikalija i inicijalni tretman ćelija izvede pod svetlosnim uslovima koji bi izbegli fotoaktivaciju ili degradaciju ispitivane supstance ispitivane supstance pre zračenja.
Ispitivane hemikalije se rastvore u puferovanim rastvorima soli, npr. Earle's Balanced Salt Solution (EBSS) ili drugom fiziološki izbalansiranom puferskom rastvoru koji ne sadrži proteinske sastojke, sastojke koji apsorbuju svetlost (npr. pH-idikatorke boje ili vitamini) kako bi se izbegla interferencija tokom zračenja. Kako se tokom zračenja ćelije drže oko 50 minuta van CO2 inkubatora, vodi se računa da se izbegne alkalizacija. Ako se koriste slabi puferi kao EBSS, ovo se može postići inkubiranjem ćelija pri 7,5% CO2. Ako se ćelije inkubiraju pri samo 5% CO2, bira se jači pufer.
Ispitivane hemikalije ograničene rastvorljivosti u vodi rastvaraju se u odgovarajućem rastvaraču. Ako se koristi rastvarač, on je prisutan u konstantnoj zapremini u svim kulturama, tj. u negativnoj kontroli (kontroli rastvarača) kao i u svim koncentracijama ispitivane supstance i da ne bude toksičan pri tim koncentracijama. Koncentracije ispitivane supstance biraju se tako da se izbegne taloženje ili mutnoća rastvora.
Preporučeni rastvarači su dimetilsulfoksid (u daljem tekstu: DMSO) i etanol (u daljem tekstu: ETOH). Mogu odgovarati i drugi rastvori niske citotoksičnosti. Pre upotrebe procenjuju se svi rastvarači prema specifičnim svojstvima, npr. reakcija sa ispitivanom supstancom, gušenje fototoksičnog efekta, svojstva dejonizacije radikala i/ili hemijska stabilnost u rastvaraču.
Mešanje na vorteksu i/ili zagrevanje do odgovarajućih temperatura može da se koristi kako bi se pomoglo rastvaranje ukoliko ovo ne bi imalo uticaja na stabilnost ispitivane supstance.
1.4.1.5. Uslovi zračenja
1.4.1.5.1. Izvor svetlosti
Izbor odgovarajućeg izvora svetlosti i filtera je kritičan faktor u ispitivanju fototoksičnosti. Svetlost UVA i vidljive oblasti obično se dovodi u vezu sa fototoksičnim odgovorima in vivo3, 12, dok je generalno UVB od manjeg značaja ali je visoko citotoksična. Citotoksičnost se povećava 1.000 puta kako talasna dužina ide od 313 nm do 280 nm13. Kriterijumi za izbor odgovarajućeg izvora svetlosti uključuju zahtev da svetlosni izvor emituje talasne dužine koje apsorbuje ispitivana supstanca (apsorpsioni spektar) i da doza svetlosti (koja se može postići u razumnom vremenu izlaganja) bude dovoljna za detekciju poznatih fotocitotoksičnih hemikalija. Talasne dužine i doze koje se koriste ne treba da prekomerno štete ispitivanom sistemu, npr. oslobađanje toplote (infracrvena oblast).
Simulacija sunčeve svetlosti sa solarnim simulatorima smatra se optimalnim veštačkim izvorom svetlosti. Raspodela snage zračenja filtriranog solarnog simulatora je približna dnevnoj svetlosti spoljašnjeg prostora koja je data u literaturi14. Ksenonski luk i (dopirani) živa-metal halogeni luk se koriste kao solarni simulatori15. Druga ima prednost emitovanja manje toplote i što je jeftinija slaganje sa sunčevom svetlošću je manje idealna u poređenju sa ksenonskim lukovima. Zbog toga što svi solarni simulatori emituju značajne količine UVB one se odgovarajuće filtriraju da bi se prigušile UVB talasne dužine visoke citotoksičnosti. Zbog toga što plastični materijali za kultivisanje ćelija sadrže UV stabilizatore spektar se meri kroz isti tip poklopca posude sa 96 bazenčića kao onaj koji će se koristiti u testu. Nezavisno od mera preduzetih da bi se prigušili delovi spektra filtriranjem ili neizbežnim filterskim efektima opreme, spektar zabeležen ispod ovih filtera ne treba da odstupa od standardizovane spoljašnje dnevne svetlosti14. Primer distribucije spekralnog zračenja filtriranog solarnog simulatora korišćenog u studiji validacije in vitro 3T3 NRU testa fototoksičnosti je dat u literaturi8, 16. Videti Deo treći Slika 1. ove metode.
1.4.1.5.2. Doziranje
Intenzitet svetlosti (zračenja) se redovno proverava pre svakog testa fototoskičnosti koristeći odgovarajući UV-metar širokog opsega. Intenzitet se meri preko istog tipa poklopca posude sa 96 bazenčića kao što će se koristiti u testu. UV-metar je kalibrisan prema izvoru. Proveravaju se karakteristike UV-metra i u ovu svrhu preporučuje se upotreba drugog, referentnog UV-metra iste vrste i ista kalibracija. Idealno, pri većim intervalima koristi se spektroradiometar za merenje spektralnog zračenja filtriranog izvora svetlosti i proveriti kalibraciju UV-metra širokog opsega.
Doza od 5 J/cm2 (kao što je merena u UVA opsegu) je određena da ne bude citotoksična za ćelije Balb/c 3T3 i dovoljno jaka da pobudi hemikalije da izazovu fototoksičnu reakciju6, 7 npr. da postigne 5 J/cm2 tokom vremenskog perioda od 50 minuta zračenje je bilo podešeno na 1,7 mW/cm2. Videti Deo treći Slika 2. ove metode. Ukoliko se koristi druga ćelijska linija ili drugi svetlosni izvor, doza zračenja možda treba da se kalibriše tako da način doziranja može da bude izabran da nije štetan za ćelije ali da je dovoljan da pobudi standardne fotootrove. Vreme izlaganja svetlosti se računa na sledeći način:
t(min) = |
doza zračenja (J/cm2)x100 |
|
zračenje (mW / cm2)x60 |
(1 J = 1 Wsec)
1.4.2. Eksperimentalni uslovi
1.4.2.1. Koncentracije ispitivane supstance
Opsezi koncentracija ispitivane hemikalije u prisustvu (+Irr) ili u odsustvu (-Irr) svetlosti adekvatno se određuju u eksperimentima koji su osmišljeni za nalaženje opsega. Bilo bi korisno prvo proceniti rastvorljivost i na 60 minuta (ili koje vreme će se koristiti) jer rastvorljivost može da se promeni tokom vremena ili za vreme trajanja ekspozicije. Da bi se izbegla toksičnost koja je uzrokovana neodgovarajućim uslovima kultivisanja ili visokom kiselošću ili alkalnosti hemikalije, pH ćelijskih kultura sa dodatom ispitivanom supstancom je u opsegu 6,5 do 7,8.
Najviša koncentracija ispitivane supstance je u okviru fizioloških uslova ispitivanja, npr. izbegava se osmotski ili pH stres. U zavisnosti od ispitivane hemikalije, možda je neophodno razmotriti druga fizikohemijska svojstva kao ograničavajuće faktore za najvišu ispitivanu koncentraciju. Za relativno nerastvorne supstance koje nisu toksične pri koncentracijama do tačke zasićenja ispituje se najviša koncentracija koja se može postići.
Izbegava se taloženje ispitivane hemikalije pri bilo kojoj ispitivanoj koncentraciji. Maksimalna koncentracija ispitivane supstance ne prelazi 1.000 μg/mL; osmolalnost ne prelazi 10 mmolar. Koristi se serija geometrijskoh razblaženja osam koncentracija ispitivane supstance sa konstantnim faktorom razblaženja (videti odeljak 2.1. drugi pasus ove metode).
Ukoliko postoje podaci (iz eksperimenta nalaženja opsega) da ispitivana supstanca nije citotoksična do granice koncentracije u eksperimentu u mraku (-Irr), ali je visoko toksična kada je ozračena (+Irr), opseg koncentracija koji se bira za (+Irr) eksperiment može da se razlikuje od onog izabranog za (−Irr) eksperiment da bi ispunio zahtev adekvatnosti kvaliteta podataka.
1.4.2.2. Kontrole
1.4.2.2.1. Osetljivost ćelija na zračenje, uspostavljanje istorijskih podataka
Ćelije se redovno proveravaju (približno svakog petog prolaza) na osetljivost prema izvoru svetlosti procenom njihove viabilnosti po ekspoziciji rastućim dozama zračenja. U ovoj proceni se koristi nekoliko doza zračenja, uključujući nivoe značajno veće od onih koji se koriste u 3T3 NRU testu fototoksičnosti. Ove doze se najlakše kvantifikuju merenjima UV delova izvora svetlosti. Ćelije se zasade pri gustini koja se koristi u in vitro 3T3 NRU testu fototoksičnosti i zrače se sledećeg dana. Onda se određuje viabilitet ćelija dan kasnije korišćenjem preuzimanja Neutral Red boje. Pokazuje se da je nastala najveća necitotoksična doza (npr. u studiji validacije: 5 J/cm2 (UVA)) bila dovoljna da ispravno klasifikuje referentnu hemikaliju (Tabela 1).
1.4.2.2.2. Osetljivost na zračenje, provera tekućeg testa
Ispitivanje zadovoljava kriterijume kvaliteta ako ozračene negativne kontrole/kontrole rastvarača pokažu viabilitet veći od 80% u poređenju sa neozračenom negativnom kontrolom/kontrolom rastvarača.
1.4.2.2.3. Sposobnost rasta kontrola rastvarača
Apsolutna optička gustina (OD540 NRU) boje Neutral Red ekstrahovane iz kontrole rastvarača ukazuje na to da li je 1×104 ćelija koje su zasejane po bazenčiću pokazalo rast sa normalnim vremenom udvostručavanja tokom dva dana testa. Ispitivanje zadovoljava kriterijume prihvatanja ako je srednja vrednost OD540 NRU netretiranih kontrola ≥ 0,4 (tj. približno 20 puta veća od podloge apsorbancije rastvarača).
1.4.2.2.4. Pozitivna kontrola
Poznata fototoksična hemikalija se testira istovremeno sa svakim in vitro 3T3 NRU testom fototoksičnosti. Preporučuje se hlorpromazin (u daljem tekstu: CPZ). Za CPZ koji se testira sa standardnim postupkom u in vitro 3T3 NRU testu fototoksičnosti, određeni su kriterijumi za prihvatanje testa: ozračen CPZ (+Irr): IC50=0,1 do 2,0μg/ml, neozračen CPZ (-Irr): IC50 = 7,0 do 90,0 μg/mL. Foto iritacioni faktor (Photo Irritation Factor, PIF) je > 6. Prate se istorijske karakteristike pozitivne kontrole.
Mogu da se koriste druge fototoksične hemikalije, koje odgovaraju za hemijsku klasu ili karakteristike rastvorljivosti hemikalije koja se procenjuje, kao istovremena pozitivna kontrola umesto hlorpromazina.
1.4.3. Postupak ispitivanja6, 7, 8, 16, 17
1.4.3.1. Prvi dan
Razdeliti 100 μL medijuma za kultivisanje u periferne bazenčiće posude sa 96 bazenčića za mikrotitraciju tkivnih kultura (= slepe probe). U preostale bazenčiće, razdeliti 100 μL suspenzije ćelija od 1×105 ćelija/mL u medijumu za kultivisanje (= 1×104 ćelija/bazenčić). Dve posude se pripremaju za svaku seriju pojedinačnih koncentracija ispitivane supstance i za kontrolu rastvarača i konpozitivnu kontrolu.
Inkubirati ćelije 24 sata (videti odeljak 1.4.1.2. ove metode) dok ne formiraju polukonfluentan monosloj. Ovaj period inkubacije dozvoljava oporavak ćelija, adherenciju i eksponencijalni rast.
1.4.3.2. Drugi dan
Posle inkubacije dekantovati medijum kulture od ćelija i isprati pažljivo sa 150 μL puferovanog rastvora koji je korišćen za inkubaciju. Dodati 100 μL pufera koji sadrži odgovarajuću koncentraciju ispitivane supstance ili rastvarača (kontrola rastvarača). Primeniti osam različitih koncentracija ispitivane hemikalije. Inkubatori ćelije sa ispitivanom supstancom u mraku 60 minuta (videti odeljak 1.4.1.2. i odeljak 1.4.1.4. drugi pasus ove metode).
Od dve posude pripremljene za svaku seriju koncentracija ispitivane supstance i kontrola, jedna se izabere, obično nasumično, za određivanje citotoksičnosti (-Irr) (t.j. kontrolna posuda) i jedna (tretirana posuda) za određivanje fototoksičnosti (+Irr).
Za izvođenje +Irr ekspozicije, ozračiti ćelije na sobnoj temperaturi 50 minuta preko poklopca posudice sa 96 bazenčića sa najvišom dozom zračenja koja nije citotoksična (videti Deo treći ove metode). Držati neozračene posude (-Irr) na sobnoj temperaturi u mračnoj kutiji 50 minuta (= vreme izlaganja svetlosti).
Dekantovati ispitivani rastvor i pažljivo isprati dva puta sa 150 μL puferskog rastvora koji je korišćen za inkubaciju, ali koji ne sadrži ispitivani materijal. Zameniti pufer sa medijumom za kultivaciju i inkubirati (videti odeljak 1.4.1.2. ove metode) preko noći (18 sati do 22 sata).
1.4.3.3. Treći dan
1.4.3.3.1. Mikroskopska procena
Ćelije se pregledaju na rast, morfologiju i integritet monosloja koristeći fazno kontrasni mikroskop. Beleže se promene u morfologiji ćelija i efekti na ćelijski rast.
1.4.3.3.2. Test preuzimanja boje Neutral Red
Isprati ćelije sa 150 μL prethodno zagrejanog pufera. Ukloniti rastvor za ispiranje nežnim lupkanjem. Dodati 100 μL rastvora Neutral Red (u daljem tekstu: NR) (3-amino-7-dimetilamino-2-metilfenazin hidrohlorid, EINECS broj 209-035-8; CAS broj 553-24-2; C.I. 50040) koncentracije 50 μg/mL u medijum bez seruma16 i inkubirati kao što je opisano u odeljku 1.4.1.2. ove metode tokom tri sata. Posle inkubacije, ukloniti NR medijum i isprati ćelije sa 150 μL pufera. Dekantovati i ukloniti višak pufera upijanjem ili centrifugiranjem.
Dodati tačno 150 μL rastvora za odstranjivanje NR (sveže pripremljen 49 delova vode + 50 delova etanola + 1 deo sirćetne kiseline).
Mešati posudu za mikrotitraciju nežno na mešalici 10 minuta dok se NR ne ekstrahuje iz ćelija i formira homogeni rastvor.
Izmeriti optičku gustinu ekstrakta NR na 540 nm na spektrofotometru prema slepoj probi. Sačuvati podatke u dokumentu odgovarajućeg elektronskog formata za dalju analizu.
2. PODACI
2.1. KVALITET I KVANTITET PODATAKA
Podaci ispitivanja omogućavaju značajnu analizu koncentracije - odgovora dobijene u prisustvu i u odsustvu zračenja i, ako je moguće, koncentraciju ispitivane hemikalije pri kojoj je viabilnost ćelija smanjena na 50% (IC50). Ukoliko se pronađe citotoksičnost i opseg koncentracija i odsečak pojedinačnih koncentracija se postavljaju tako da omoguće podešavanje krive prema eksperimentalnim podacima.
Za jasno pozitivne i za jasno negativne rezultate (vedeti odeljak 2.3. prvi pasus ove metode), može da bude dovoljan primarni eksperiment koji je podržan jednim ili sa više preliminarnih ispitivanja nalaženja opsega.
Dvosmisleni, granični ili nejasni rezultati se razjašnjavaju daljim ispitivanjima (videti odeljak 2.4. drugi pasus ove metode). U takvim slučajevima razmatra se izmena eksperimentalnih uslova. Eksperimentalni uslovi koji se mogu izmeniti uključuju opseg koncentracija ili razmak između koncentracija, vreme pre-inkubacije i vreme izlaganja zračenju. Kraće vreme izlaganja može da bude pogodno za hemikalije nestabilne u vodi.
2.2. PROCENA REZULTATA
Da bi se omogućila ocena rezultata, može se računati foto-iritacioni faktor (Photo-Irritation-Factor, PIF) ili srednji foto-efekat (Mean Photo Effect, MPE).
Za izračunavanje mera fototoksičnosti (videti ispod) potrebno je aproksimovati skup pojedinačnih vrednosti koncentracija - odgovor pomoću odgovarajuće neprekidne (model) krive koncentracija - odgovor. Podešavanje krive prema podacima obično se izvodi ne-linearnom regresivnom metodom18. Da bi se procenio uticaj varijabilnosti podataka na podešavanje krive, preporučuje se postupak bootstrap.
Foto-iritacioni faktor (u daljem tekstu: PIF) izračunava se upotrebom formule:
PIF = |
IC50(-Irr) |
|
IC50(+Irr) |
Ako se IC50 u prisustvu i u odsustvu svetlosti ne može izračunati, PIF se ne može odrediti za ispitivani materijal. Srednji foto-efekat (u daljem tekstu: MPE) određuje se na osnovu upoređivanja završenih koncentracija - odgovor krivih.
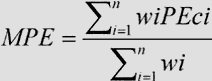
Foto-efekat PEc pri bilo kojoj koncentraciji C se definiše kao proizvod odgovora efekta REc i doze efekta DEc tj. PEc = REc × DEc. Odgovor efekta REc je razlika između odgovora primećenog u odsustvu i u prisustvu svetlosti, tj. REc = Rc (-Irr) − Rc (+Irr). Doza-efekat se daje kao:
DEc = |
C/C * - 1 |
|
C/C * +1 |
Pri čemu C* jeste ravnotežna koncentracija, odnosno koncentracija pri kojoj je +Irr odgovor jednak -Irr odgovoru pri koncentraciji C. Ako se C* ne može odrediti zato što su vrednosti odgovora +Irr krive sistematski više ili niže nego RC(-Irr), dozni efekat je 1. Faktori wi su dati po najvišoj vrednosti odgovora, tj. wi = MAX {Ri (+Irr), Ri (-Irr)}. Koncentracija Ci se bira tako da isti broj tačaka pripadne svakom koncentracionom intervalu koji su definisani sa vrednosti koncentracije pri kojoj najmanje jedna ili dve krive i dalje pokazuju vrednost odgovora od najmanje 10%. Ako je ova maksimalna koncentracija viša od najviše koncentracije koja je korišćena u +Irr eksperimentu, onda se rezidualni deo +Irr krive podešava da je vrednost odgovora "0". U zavisnosti od toga da li je MPE vrednost veća od određene cut-off vrednosti (MPEc = 0,15) ili nije, hemikalija se klasifikuje kao fototoksična.
Softverski paket za izračunavanje PIF i MPE je dostupan20.
2.3. TUMAČENJE REZULTATA
Na osnovu studije validacije8, ispitivana supstanca sa PIF < 2 ili sa MPE < 0,1 predviđa: "nije fototoksično". Ako je PIF > 2 i < 5 ili ako je MPE > 0,1 i < 0,15 predviđa: "verovatna fototoskičnost"; i ako je PIF > 5 ili MPE > 0,15 predviđa: "fototoksičnost".
Za laboratorije koje uvode ovaj test, ispituju se referentni materijali nabrojani u Tabeli 1. pre ispitivanja ispitivane supstance za procenu fototoksičnosti. Vrednosti PIF i MPE su približne vrednostima pomenutim u Tabeli 1.
Tabela 1.
Hemijski naziv |
EINECS broj |
CAS broj |
PIF |
MPE |
Apsorpcioni maksimum |
RastvaračXV (1) |
amiodaron HCL |
243-293-2 |
[19774-82-4] |
> 3,25 |
0,2-0,54 |
242 nm 300 nm |
etanol |
hlorpromazin HCL |
200-701-3 |
[69-09-0] |
> 14,4 |
0,33-0,63 |
309 nm |
etanol |
norfloksacin |
274-614-4 |
[70458-96-7] |
> 71,6 |
0,34-0,90 |
316 nm |
acetonitril |
antracen |
204-371-1 |
[120-12-7] |
> 18,5 |
0,19-0,81 |
356 nm |
acetonitril |
Protoporfirin IX, dinatrijum |
256-815-9 |
[50865-01-5] |
> 45,3 |
0,54-0,74 |
402 nm |
etanol |
L-histidin |
|
[7006-35-1] |
|
0,05-0,10 |
211 nm |
voda |
heksahlorofen |
200-733-8 |
[70-30-4] |
1,1-1,7 |
0,00-0,05 |
299 nm 317 nm |
etanol |
Natrijum-lauril sulfat |
205-788-1 |
[151-21-3] |
1,0-1,9 |
0,00-0,05 |
Nema apsorpcije |
voda |
____________
XV Rastvarač koji se koristi za merenje apsorbancije.
2.4. TUMAČENJE REZULTATA
Fototoksični efekti se uočavaju samo pri najvišim ispitivanim koncentracijama (naročito za ispitivane hemikalije koje su rastvorne u vodi). Dodatna razmatranja mogu biti neophodna za procenu hazarda. Ovo može uključiti podatke o apsorpciji kože i o akumulaciji hemikalije u koži i/ili podatke iz drugih testova, npr. ispitivanje hemikalije na in vitro životinjskoj ili ljudskoj koži ili modelima kože.
Ako nije pokazana toksičnost (+Irr i -Irr) i ako je slaba rastvorljivost bila ograničavajući faktor za koncentracije koje mogu biti ispitane, može se dovesti u pitanje kompatibilnost ispitivane supstance sa testom i razmatra se potvrdno testiranje upotrebom npr. drugog modela.
3. IZVEŠTAJ
Izveštaj o ispitivanju sadrži podatke o:
1) Ispitivanoj supstanci:
- podaci o identifikaciji, uobičajeni generički nazivi i IUPAC i CAS brojevi, ako su poznati;
- fizička priroda i čistoća;
- fizička i hemijska svojstva relevantna za izvođenje studije;
- UV/vis apsorpcioni spektar;
- stabilnost i fotostabilnost, ako je poznata.
2) Rastvaraču:
- opravdanje za izbor rastvarača;
- rastvorljivost ispitivane hemikalije u rastvaraču;
- procenat prisustva rastvarača u medijumu za tretman.
3) Ćelijama:
- vrsta i izvor ćelija;
- odsustvo mikoplazme;
- broj ćelijskih prolaza, ako je poznat;
- osetljivost ćelija na zračenje, određena opremom za zračenje koja se koristi u in vitro 3T3 NRU testu fototoksičnosti.
4) Uslovima ispitivanja1; inkubaciji pre i posle tretmana:
- vrsta i sastav medijuma za kultivisanje;
- uslovi inkubacije (koncentracija CO2; temperatura; vlažnost);
- trajanje inkubacije (predtretman, post-tretman).
5) Uslovima ispitivanja2; tretmanu hemikalijom:
- osnova za izbor koncentracija ispitivane hemikalije koje su korišćene u prisustvu i u odsustvu zračenja;
- u slučaju ograničene rastvorljivosti ispitivane hemikalije i odsustva citotoksičnosti: osnova za najvišu ispitivanu koncentraciju;
- vrsta sastava medijuma za tretiranje (puferovani rastvor soli);
- trajanje hemijskih tretmana.
6) Uslovima ispitivanja3; zračenju:
- osnova za izbor izvora svetlosti koji je korišćen;
- proizvođač i vrsta izvora svetlosti i radiometra;
- karakteristike spektralnog zračenja izvora svetlosti;
- transmisione i apsorpcione karakteristike korišćenih filtera;
- karakteristike radiometra i pojedinosti o kalibraciji;
- razmak svetlosnog izvora od ispitivanog sistema;
- UVA zračenje pri ovom razmaku, izraženo u mW/cm2;
- trajanje izlaganja UV/vis svetlosti;
- UVA doza (zračenje × vreme), izražena u J/cm2;
- temperatura ćelijskih kultura tokom zračenja i ćelijskih kultura koje se istovremeno drže u mraku.
7) Uslovima ispitivanja4; Neutral Red testu viabilnosti:
- sastav Neutral Red medijuma za tretiranje;
- trajanje inkubacije sa Neutral Red;
- uslovi inkubacije (koncentracija CO2; temperatura; vlažnost);
- uslovi ekstrakcije Neutral Red (ekstrakcija; trajanje);
- talasna dužina koja je korišćena za spektrofotometrijsko čitanje optičke gustine Neutral Red;
- druga talasna dužina (referentna), ako je korišćena;
- sadržaj slepe probe spektrofotometra, ako je korišćena.
8) Rezultatima:
- viabilnost ćelija dobijena iz svake koncentracije ispitivane hemikalije, izražena u procentu viabilnosti od srednje vrednosti istovremene kontrole rastvarača;
- krive koncentracija - odgovor (koncentracija ispitivane supstance prema relativnoj viabilnosti ćelija) dobijene u istovremenim +Irr i -Irr ispitivanjima;
- analiza krivih koncentracija - odgovor: ako je moguće, izračunavanje IC50 (+Irr) i IC50 (-Irr);
- upoređivanje dve krive koncentracija - odgovor dobijene u prisustvu i u odsustvu zračenja, bilo računanjem foto-iritacionog faktora (PIF), bilo računanjem srednjeg foto-efekta (MPE);
- kriterijumi za prihvatanje testa; istovremena kontrola rastvarača;
- apsolutna viabilnost (optička gustina ekstrakta Neutral Red) ozračenih i neozračenih ćelija;
- istorijski podaci negativne i kontrole rastvarača; srednje vrednosti i standardne devijacije;
- kriterijumi za prihvatanje testa; istovremena pozitivna kontrola;
- IC50(+Irr) i IC50(-Irr) i PIF/MPE hemikalije koja je korišćena kao pozitivna kontrola;
- istorijski podaci o hemikaliji koja je korišćena kao pozitivna kontrola: IC50(+Irr) i IC50(-Irr) i PIF/MPE; srednje vrednosti i standardne devijacije.
9) Obrazloženju rezultata.
10) Zaključcima.
4. LITERATURA
1. Lovell W.W., (1993) A scheme for in vitro screening of substances for photoallergenic potential. Toxicology In vitro 7, p. 95-102.
2. Santamaria, L. and Prino, G., (1972) List of the photodynamic substances. In ‘Research Progress in Organic, Biological and Medicinal Chemistry’ Vol. 3 part 1. North Holland Publishing Co. Amsterdam. p. XI-XXXV.
3. Spielmann, H., Lovell, W.W., Hölzle, E., Johnson, B.E., Maurer, T., Miranda, M.A., Pape, W.J.W., Sapora, O., and Sladowski, D., (1994) In vitro phototoxicity testing: The report and recommendations of ECVAM Workshop 2. ATLA, 22, p. 314-348.
4. Spikes, J.D., (1989) Photosensitisation. In 'The science of Photobiology' Edited by K.C. Smith. Plenum Press, New York. 2nd edition, p. 79-110.
5. OECD, (1997) Environmental Health and Safety Publications, Series on Testing and Assessment No 7 'Guidance Document On Direct Phototransformation Of Chemicals In Water' Environment Directorate, OECD, Paris.
6. Spielmann, H., Balls, M., Döring, B., Holzhütter, H.G., Kalweit, S., Klecak, G., L'Eplattenier, H., Liebsch, M., Lovell, W.W., Maurer, T., Moldenhauer. F. Moore. L., Pape, W., Pfannbecker, U., Potthast, J., De Silva, O., Steiling, W., and Willshaw, A., (1994) EEC/COLIPA project on in vitro phototoxicity testing: First results obtained with a Balb/c 3T3 cell phototoxicity assay. Toxic. In vitro 8, p. 793-796.
7. Anon, (1998) Statement on the scientific validity of the 3T3 NRU PT test (an in vitro test for phototoxicity), European Commission, Joint Research Centre: ECVAM and DGXI/E/2, 3 November 1997, ATLA, 26, p. 7-8.
8. Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., Pechovitch, G. De Silva, O., Holzhütter, H.G., Clothier, R., Desolle, P., Gerberick, F., Liebsch, M., Lovell, W.W., Maurer, T., Pfannenbecker, U., Potthast, J. M., Csato, M., Sladowski, D., Steiling, W., and Brantom, P., (1998) The international EU/COLIPA In vitro phototoxicity validation study: results of phase II (blind trial), part 1: the 3T3 NRU phototoxicity test. Toxicology In vitro 12, p. 305-327.
9. OECD, (2002) Extended Expert Consultation Meeting on The In vitro 3T3 NRU Phototoxicity Test Guideline Proposal, Berlin, 30th-31th October 2001, Secretariat‘s Final Summary Report, 15th March 2002, OECD ENV/EHS, available upon request from the Secretariat.
10. Borenfreund, E., and Puerner, J.A., (1985) Toxicity determination in vitro by morphological alterations and neutral red absorption. Toxicology Lett., 24, p. 119-124.
11. Hay, R.J., (1988) The seed stock concept and quality control for cell lines. Analytical Biochemistry 171, p. 225-237.
12. Lambert L.A, Warner W.G., and Kornhauser A., (1996) Animal models for phototoxicity testing. In ‘Dermatotoxicology’, edited by F.N. Marzulli and H.I. Maibach. Taylor & Francis, Washington DC. 5th Edition, p. 515-530.
13. Tyrrell R.M., Pidoux M., (1987) Action spectra for human skin cells: estimates of the relative cytotoxicity of the middle ultraviolet, near ultraviolet and violet regions of sunlight on epidermal keratinocytes. Cancer Res., 47, p. 1825-1829.
14. ISO 10977., (1993) Photography - Processed photographic colour films and paper prints - Methods for measuring image stability.
15. Sunscreen Testing (UV.B) TECHNICALREPORT, CIE, International Commission on Illumnation, Publication No 90, Vienna, 1993, ISBN 3 900 734 275
16. ZEBET/ECVAM/COLIPA - Standard Operating Procedure: In vitro 3T3 NRU Phototoxicity Test. Final Version, 7 September, 1998. p. 18.
17. Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., De Silva, O., Holzhütter, H.G., Gerberick, F., Liebsch, M., Lovell, W.W., and Pfannenbecker, U., (1998) A study on UV filter chemicals from Annex VII of the European Union Directive 76/768/EEC, in the in vitro 3T3 NRU phototoxicity test. ATLA 26, p. 679-708.
18. Holzhütter, H.G., and Quedenau, J., (1995) Mathematical modeling of cellular responses to external signals. J. Biol. Systems 3, p. 127-138.
19. Holzhütter, H.G., (1997) A general measure of in vitro phototoxicity derived from pairs of dose-response curves and its use for predicting the in vivo phototoxicity of chemicals. ATLA, 25, p. 445-462.
20. http://www.oecd.org/document/55/0,2340,en_2649_34377_2349687_1_1_1_1,00.html
Deo drugi
ULOGA 3T3 NRU PT U PRISTUPU KORAK PO KORAK ZA ISPITIVANJE FOTOTOKSIČNOSTI HEMIKALIJA
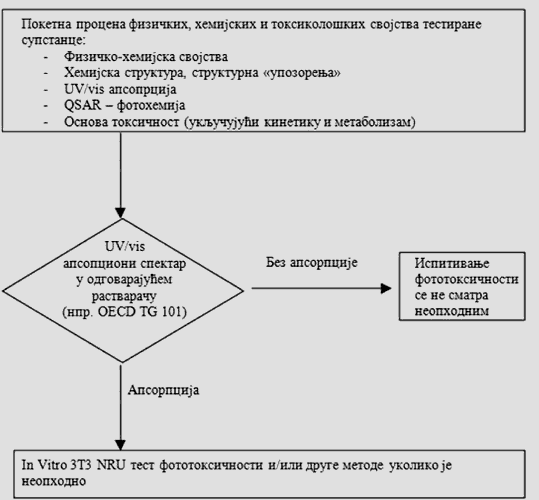
Deo treći
Slika 1: Raspodela spektralne moći filtriranog solarnog simulatora
Zračenje (mV/cm2)
(Videti odeljak 1.4.1.5. drugi pasus ove metode)
Slika 1. daje primer prihvatljive raspodele spektralnog zračenja filtriranog solarnog simulatora. On je od punjenog metal halofenog izvora koji je korišćen u probi validacije 3T3 NRU PT6, 8, 17. Prikazani su efekat dva različita filtera i dodatni efekat filtriranja poklopca posude sa 96 bazenčića. Filter H2 je korišćen samo sa test sistemima koji mogu da tolerišu veću količinu UVB (test modela kože i test foto-hemolize eritrocita). U 3T3 NRU PT korišćen je H1 filter. Slika pokazuje da je dodatni efekat filtriranja poklopca posude uglavnom uočen u opsegu UVB, ali i dalje ostavljajući dovoljno UVB spektar zračenja da se pobude hemikalije koje tipično apsorbuju UVB opseg, kao što je amjodaron (videti Tabelu 1).
Slika 2: Osetljivost na zračenje Balb/c 3T3 ćelija (izmereno u opsegu UVA)
Viabilnost ćelija (% preuzimanja Neutral Red od strane kontrola u mraku)
Vreme ozračivanja (minuti)
10 min= 1 joule UVA/cm2
(Videti odeljak 1.4.1.5.2. drugi pasus i odeljke 1.4.2.2.1. i 1.4.2.2.2. ove metode)
Osetljivost Balb/c 3T3 ćelija na zračenje sa solarnim simulatorom koji je korišćen u probi validacije 3T3 NRU testa fototoksičnosti, merena u UVA opsegu. Slika pokazuje rezultate dobijene u sedam različitih laboratorija u prevalidacionoj studiji1. Zbog toga što su obe krive sa otvorenim znakovima dobijene sa ostarelim ćelijama (veliki broj prolaza), one su morale da budu zamenjene novim sa zadebljanim oznakama koje pokazuju prihvatljivu toleranciju na zračenje, koje su dobijene na novim ćelijama. Iz ovih podataka izvedena je najviša doza zračenja koja nije toksična, od 5 J/cm2. Horizontalna isprekidana linija dodatno pokazuje maksimalno prihvatljiv efekat zračenja dat u odeljku 1.4.2.2. ove metode.
B.42. SENZIBILIZACIJA KOŽE: TEST LOKALNIH LIMFNIH ČVOROVA
1. METODA ISPITIVANJA
Ova eksperimentalna metoda zasniva se na Uputstvu za ispitivanje OECD 429 (2002).
1.1. UVOD
Test lokalnih limfnih čvorova (Local Lymph Node Assay, u daljem tekstu: LLNA) je u dovoljnoj meri proveren i prihvaćen da se opravda njegovo prihvatanje kao nove metode1, 2, 3. Ovo je druga metoda za ocenjivanje potencijala hemikalije da izazove senzibilizaciju kože kod životinja. Druga metoda (Metoda V.6. koja je data u ovom prilogu) koristi zamorce, pre svega test maksimizacije i Buehlerov test4.
LLNA daje alternativnu metodu za identifikaciju hemikalija koje izazivaju senzibilizaciju kože i za potvrđivanje da hemikalije nemaju značajan potencijal da uzrokuju senzibilizaciju kože. Ovo ne znači da se LLNA uvek koristi umesto ispitivanja na zamorcima, već pre da je ovaj test jednako dobar i da može biti primenjen kao alternativa u kojoj pozitivni i negativni rezultati uglavnom ne zahtevaju dalju potvrdu.
LLNA pruža određene prednosti u odnosu na naučni napredak i dobrobit životinja. Test proučava fazu indukcije senzibilizacije kože i daje kvantitativne podatke pogodne za procenu odnosa doza-odgovor. Detalji validacije LLNA i pregled rada u vezi s tim su objavljeni5, 6, 7, 8. Blagi/umereni senzibilizatori koji su preporučeni kao pogodne supstance za pozitivnu kontrolu za testove na zamorcima takođe su pogodni za korišćenje u LLNA6, 8, 9.
LLNA je in vivo metoda i ne eliminiše korišćenje životinja u ocenjivanju aktivnosti kontaktne senzibilizacije. Ona ima potencijal da smanji broj životinja koji je potreban za ovu svrhu. LLNA nudi značajno poboljšanje u načinu na koji se životinje koriste za testiranje kontaktne senzibilizacije. LLNA se zasniva na razmatranju imunoloških pojava koje su stimulisane hemikalijama za vreme indukcione faze senzibilizacije. Za razliku od ispitivanja na zamorcima, LLNA ne zahteva primenu osporavanih dermalnih reakcija preosetljivosti. Ova metoda ne zahteva korišćenje adjuvansa, kao što je slučaj kod testa maksimizacije na zamorcima. Zbog toga LLNA smanjuje stres kod životinja. Uprkos prednostima ove metode u odnosu na tradicionalne testove na zamorcima, postoje određena ograničenja koja mogu zahtevati tradicionalna ispitivanja na zamorcima (npr. lažno negativni rezultati LLNA sa nekim metalima, lažno pozitivni rezultati sa nekim iritansima kože)10.
Videti Opšti uvod.
1.2. PRINCIP METODE
Osnovni princip u LLNA je da senzibilišuće supstance dovode do primarne proliferacije limfocita u limfnom čvoru koji drenira mesto primene hemikalije. Ova proliferacija je proporcionalna primenjenoj dozi (i potenciji alergena) i predstavlja jednostavno sredstvo za dobijanje objektivne, kvantitativne mere senzibilizacije. LLNA procenjuje ovu proliferaciju kao odnos doza-odgovor u kojem se proliferacija u ispitivanim grupama upoređuje sa onom kod kontrola tretiranih rastvaračem. Odnos proliferacije u tretiranim grupama prema onima u kontrolama rastvarača, nazvana "indeks stimulacije", određuje se i mora da bude najmanje tri, pre nego što se ispitivana supstanca dalje ocenjuje kao potencijalno senzibilišuća za kožu. Ovde opisane metode zasnivaju se na korišćenju radioaktivnog obeležavanja kako bi se izmerila proliferacija ćelija. Drugi pokazatelji ispitivanja za ocenjivanje proliferacije mogu se primeniti ukoliko postoji opravdanje i odgovarajuća naučna podrška, uključujući potpune navode i opis metodologije.
1.3. OPIS METODE
1.3.1. Pripreme
1.3.1.1. Uslovi smeštaja i ishrane
Životinje se smeštaju pojedinačno. Temperatura prostorije za eksperimentalne životinje je 22° C (±3° C). Relativna vlažnost je najmanje 30% i ne prelazi 70% osim za vreme čišćenja prostorija. Ciljna vlažnost je 50% do 60%. Svetlo je veštačko sa sekvencama od 12 sati svetla i 12 sati mraka. Može da se koristi konvencionalna laboratorijska ishrana uz slobodan pristup vodi za piće.
1.3.1.2. Priprema životinja
Životinje se biraju nasumce i označavaju da bi se omogućila identifikacija jedinki (ali ne označavanjem ušiju na bilo koji način) i drže se u kavezima najmanje pet dana pre početka doziranja kako bi se aklimatizovale na laboratorijske uslove. Pre početka tretmana sve životinje se pregledaju da se utvrdi da nemaju vidljivih lezija na koži.
1.3.2. Uslovi ispitivanja
1.3.2.1. Eksperimentalne životinje
Za ovaj test koristi se miš. Ispitivanje se izvodi na mladim odraslim ženkama miševa soja CBA/Ca ili CBA/J, koje nisu ranije rađale i nisu gravidne. Na početku studije životinje treba da budu između 8 i 12 nedelja stare i varijacija u telesnoj masi životinja treba da bude minimalna i ne sme da prelazi 20% prosečne telesne mase. Drugi sojevi i mužjaci mogu se koristiti kada se prikupi dovoljno podataka da se pokaže da ne postoje značajne razlike u LLNA odgovoru između određenih sojeva i/ili polova.
1.3.2.2. Provera pouzdanosti
Pozitivne kontrole se koriste kako bi se pokazala odgovarajuća svojstva testa i kompetentnost laboratorije da uspešno obavi studiju. Pozitivna kontrola dovodi do pozitivnog LLNA odgovora pri nivou ekspozicije za koji se očekuje da povećanje indeksa stimulacije (SI) > 3 u odnosu na negativnu kontrolnu grupu. Doza pozitivne kontrole bira se tako da indukcija bude jasna ali ne prekomerna. Poželjno je primeniti supstance: heksil cinamin aldehid (CAS broj 101-86-0, EINECS broj 202-983-3) i merkaptobenzotiazol (CAS broj 149-30-4, EINECS broj 205-736-8). Mogu postojati okolnosti u kojima se, uz dovoljno opravdanje, mogu koristiti druge kontrolne supstance koje zadovoljavaju gore navedene kriterijume. Grupa pozitivne kontrole može biti potrebna u svakom testu, mogu postojati situacije u kojima će laboratorije imati istorijske podatke pozitivne kontrole koji pokazuju konzistentnost zadovoljavajućeg efekta tokom šestomesečnog ili dužeg perioda. U tim slučajevima može biti pogodno ređe testiranje s pozitivnim kontrolama u periodima kraćim od 6 meseci. Mada se pozitivna kontrolna supstanca ispituje u vehikulumu za koje je poznato da izaziva konzistentan odgovor (npr. aceton: maslinovo ulje), može doći do nekih propisanih situacija u kojima će biti potrebno testiranje nestandardnog vehikuluma (klinički/hemijski relevantna formulacija). U takvim situacijama se ispituje moguća interakcija pozitivne kontrole sa ovim nekonvencionalnim vehikulumom.
1.3.2.3. Broj životinja, dozni nivoi i izbor vehikuluma.
Ispitivanje se vrši na najmanje četiri životinje po doznoj grupi, sa najmanje tri koncentracije ispitivane supstance, plus grupa negativne kontrole koja se tretira samo vehikulumom za ispitivanu supstancu i, ako odgovara, pozitivna kontrola. U slučajevima u kojima se prikupljaju podaci o pojedinačnim životinjama, koristi se najmanje pet životinja po doznoj grupi. Osim u slučaju odsustva tretmana ispitivanom supstancom, sa životinjama u kontrolnoj grupi se postupa na isti način kao i sa životinjama u tretiranim grupama.
Izbor doze i vehikuluma je zasnovan na preporukama iz literature1. Doze se biraju iz niza koncentracija: 100%, 50%, 25%, 10%, 5%, 2,5%, 1%, 0,5%, itd. Kada su dostupni, razmatraju se postojeći podaci o akutnoj toksičnosti i iritaciji kože prilikom izbora tri uzastopne koncentracije tako da najveća koncentracija maksimizuje izlaganje uz izbegavanje sistemske toksičnosti i prekomerne lokalne iritacije kože2, 11.
Vehikulum se bira na osnovu maksimizacije ispitivanih koncentracija i rastvorljivosti uz pravljenje rastvora/suspenzije koja odgovara za primenu ispitivane supstance. Preporučeni vehikulumi (navedeni od više ka manje odgovarajućim) su aceton/maslinovo ulje (4:1 v/v), dimetilformamid, metil etil keton, propilen glikol i dimetil sulfoksid2, 10, ali se mogu koristiti i drugi uz zadovoljavajuće naučno obrazloženje. U određenim situacijama može da bude neophodno da se koristi klinički relevantni rastvarač ili komercijalna formulacija u kojoj se ispitivana supstanca stavlja na tržište kao dodatna kontrola. Posebna pažnja se posvećuje da se obezbedi da se hidrofilni materijali inkorporiraju u sistem vehikuluma, koji vlaži kožu i ne skida se trenutno. Izbegavaju se potpuno vodeni vehikulumi.
1.3.3. Postupak ispitivanja
1.3.3.1. Eksperimentalni raspored
Eksperimentalni raspored studije:
Dan 1:
Pojedinačno se identifikuju životinje i beleži se telesna masa svake životinje. Započinje se aplikaciju 25 µl odgovarajućeg rastvora ispitivane supstance, samog vehikuluma ili pozitivne kontrole (kako je odgovarajuće) na poleđinu svakog uha.
Dani 2 i 3:
Ponavlja se postupak aplikacije koji je primenjen dana 1.
Dani 4 i 5:
Bez tretmana.
Dan 6:
Beleži se telesna masa svake životinje. Ubrizgava se 250 µl rastvora soli sa fosfatnim puferom (u daljem tekstu: PBS) koja sadrži 20 µCi (7.4e + 8 Bq) 3H - metil timidina svim ispitivanim i kontrolnim miševima putem repne vene. Alternativno se ubrizgava 250 µl PBS koji sadrži 2 µCi (7.4e + 7 Bq) 125I jododeoksiuridina i 10-5 M fluorodeoksiuridina svim miševima putem repne vene.
Posle pet sati životinje se lišavaju života na human način. Iseku se ušni drenažni limfni čvorovi svakog uha i sakupljaju u PBS za svaku eksperimentalnu grupu (pristup zbirne tretirane grupe). Alternativno se mogu iseći parovi limfnih čvorova pojedinačnih životinja i staviti u PBS za svaku životinju (individualni pristup). Detalji i dijagrami identifikacije čvorova i disekcije dati su u literaturi10.
1.3.3.2. Priprema suspenzija ćelija
Jedna suspenzija ćelija limfnih čvorova (u daljem tekstu: LNC) od zbirnih tretiranih grupa ili obostrano od pojedinačnih životinja priprema se nežnim mehaničkim razdavanjem kroz gazu od nerđajućeg čelika mrežice 200 µm. Ćelije limfnog čvora dva puta se ispiraju s preostalim PBS i talože sa 5% trihlorsirćetnom kiselinom (u daljem tekstu: TCA) na 4° C tokom 18 sati2. Zrnca se ponovno suspenduju u 1 ml TCA i prenose u scintilacijske bočice koje sadrže 10 ml scintilacione tečnosti za 3H-brojanje ili se direktno prenose u epruvete za gama brojenje za 125I-prebrojavanje.
1.3.3.3. Određivanje proliferacije ćelija (inkorporirana radioaktivnost)
Inkorporiranje 3H-metil timidina se meri β-scintilacionim brojanjem kao raspadanje po minuti (u daljem tekstu: DPM). Inkorporiranje 125I-jododeoksiuridina se meri 125I-brojanjem i izražava kao DPM. Zavisno od pristupa, dodavanje se izražava kao DPM/tretirana grupa (pristup zbirne tretirane grupe) ili DPM/životinja (individualni pristup).
1.3.3.4. Zapažanja
1.3.3.4.1. Klinička zapažanja
Životinje se pažljivo pregledaju jednom dnevno zbog kliničkih znakova, bilo lokalne iritacije na mestu aplikacije ili zbog sistemske toksičnosti. Sva zapažanja se sistematično beleže u pojedinačnim dokumentima koji se vode za svaku životinju.
1.3.3.4.2. Telesna masa
Kako je navedeno u odeljku 1.3.3.1. ove metode individualne telesne mase životinja se mere na početku ispitivanja i prilikom planiranog lišavanja života na human način životinja.
1.3.4. Izračunavanje rezultata
Rezultati su izraženi kao indeks stimulacije (u daljem tekstu: SI). Kada se koristi pristup zbirne tretirane grupe, SI se dobija deljenjem zbirne radioaktivne inkorporacije za svaku tretiranu grupu sa inkorporacijom zbirne grupe kontrole vehikuluma. Na ovaj način se dobija srednji SI. Prilikom korišćenja individualnog pristupa, SI se dobija deljenjem srednje DPM/životinja unutar svake grupe ispitivane supstance i grupe pozitivne kontrole srednjom DPM/životinja za kontrolnu grupu rastvarača/vehikuluma. Srednji SI za kontrole tretirane vehikulumom je tada 1.
Korišćenje individualnog pristupa za izračunavanje SI omogućava statističku analizu podataka. Prilikom izbora odgovarajuće metode statističke analize istraživač vodi računa o mogućim nejednakostima varijansi i drugim relevantnim problemima koji mogu da zahtevaju transformaciju podataka ili neparametarske statističke analize. Adekvatni pristup za interpretaciju podataka je da se ocene svi individualni podaci tretiranih i kontrola vehikuluma i da se iz njih izvede najbolja kriva doza - odgovor, uzimajući u obzir granice pouzdanosti8, 12, 13. Istraživač vodi računa o mogućim "nepodobnim" reakcijama kod pojedinih životinja unutar grupe koje mogu zahtevati korišćenje alternativne mere odgovora (npr. mediana, a ne srednja vrednost) ili eliminaciju nepodobnih rezultata.
Proces donošenja odluka u pogledu pozitivnog odgovora uključuje indeks stimulacije ≥ 3 zajedno sa razmatranjem odnosa doza-odgovor i, kada odgovara, statistički značaj3, 6, 8, 12, 14.
Ukoliko je neophodno razjasniti dobijene rezultate, razmatraju se razna svojstva ispitivane supstance, uključujući i to da li ima strukturne sličnosti sa supstancama za koje je poznato da su senzibilišuće za kožu, da li uzrokuje prekomernu iritaciju kože i prirodu opaženog odnosa doze i odgovora. Ova i druga pitanja detaljno su razmatrana na drugom mestu7.
2. PODACI
Podaci se navode tabelarno. Navode se srednje i pojedinačne DPM vrednosti i indeksi stimulacije za svaku doznu grupu (uključujući kontrolu vehikuluma).
3. IZVEŠTAJ
Izveštaj o ispitivanju, ukoliko je moguće, sadrži podatke o:
1) Ispitivanoj supstanci:
- identifikacioni podaci (npr. CAS broj, ukoliko je dostupan; izvor; čistoću; poznate nečistoće; broj serije);
- fizičku prirodu i fizička i hemijska svojstva (npr. isparljivost, stabilnost, rastvorljivost);
- u slučaju smeše, sastav i relativna zastupljenost (procenat) sastojaka.
2) Vehikulumu:
- identifikacioni podaci (čistoća; koncentracija, gde odgovara; korišćena zapremina);
- opravdanje za izbor vehikuluma.
3) Eksperimentalnim životinjama:
- soj korišćenih miševa;
- mikrobiološki status životinja, kada je poznat;
- broj, starost i pol životinja;
- izvor životinja, uslovi smeštaja, ishrana, itd.
4) Uslovima ispitivanja:
- detalji o pripremi ispitivane supstance i primeni;
- opravdanje za izbor doze, uključujući rezultate studije raspona, ukoliko je obavljena; korišćen vehikulum i koncentracije ispitivane supstance i ukupna količina primenjene supstance;
- detalji o kvalitetu hrane i vode (uključujući vrstu ishrane/izvor, izvor vode).
5) Kontroli pouzdanosti:
- sažetak rezultata zadnje provere pouzdanosti uključujući podatke o supstanci, koncentraciji i korišćenom vehikulumu;
- podaci o istovremenoj i/ili istorijskoj pozitivnoj i negativnoj kontroli za laboratoriju koja vrši ispitivanje.
6) Rezultatima:
- pojedinačna telesna masa životinja na početku doziranja i u vreme planiranog lišavanja života na human način;
- tabela srednjih (pristup zbirne tretirane grupe) i individualnih (individualni pristup) DPM vrednosti kao i raspon vrednosti za oba pristupa i stimulacioni indeksi za svaku doznu grupu (uključujući kontrolu vehikuluma);
- statistička analiza, kad to odgovara;
- vreme pojave i znaci toksičnosti, uključujući iritaciju kože na mestu primene, ukoliko ih ima, za svaku životinju.
7) Obrazloženju rezultata:
- kratak komentar rezultata, analiza odnosa doza - odgovor i statističke analize, kada odgovara, sa zaključkom da li se ispitivana supstanca smatra senzibilišućom za kožu.
4. LITERATURA
1. Kimber, I. and Basketter, D.A. (1992). The murine local lymph node assay; collaborative studies and new directions: A commentary. Food and Chemical Toxicology 30, 165-169.
2. Kimber, I, Derman, R.J., Scholes E.W, and Basketter, D.A. (1994). The local lymph node assay: developments and applications. Toxicology, 93, 13-31.
3. Kimber, I., Hilton, J., Dearman, R.J., Gerberick, G.F., Ryan, C.A., Basketter, D.A., Lea, L., House, R.V., Ladies, G.S., Loveless, S.E., Hastings, K.L. (1998). Assessment of the skin sensitisation potential of topical medicaments using the local lymph node assay: An interlaboratory exercise. Journal of Toxicology and Environmental Health, 53, 563-79.
4. Testing Method B.6.
5. Chamberlain, M. and Basketter, D.A. (1996). The local lymph node assay: status of validation. Food and Chemical Toxicology, 34, 999-1002.
6. Basketter, D.A., Gerberick, G.F., Kimber, I. and Loveless, S.E (1996). The local lymph node assay- A viable alternative to currently accepted skin sensitisation tests. Food and Chemical Toxicology, 34, 985- 997.
7. Basketter, D.A., Gerberick, G.F. and Kimber, I. (1998). Strategies for identifying false positive responses in predictive sensitisation tests. Food and Chemical Toxicology. 36, 327-33.
8. Van Och, F.M.M, Slob, W., De Jong, W.H., Vandebriel, R.J., Van Loveren, H. (2000). A quantitative method for assessing the sensitising potency of low molecular weight chemicals using a local lymph node assay: employement of a regression method that includes determination of uncertainty margins. Toxicology, 146, 49-59.
9. Dearman, R.J., Hilton, J., Evans, P., Harvey, P., Basketter, D.A. and Kimber, I. (1998). Temporal stability of local lymph node assay responses to hexyl cinnamic aldehyde. Journal of Applied Toxicology, 18, 281-4.
10. National Institute of Environmental Health Sciences (1999). The Murine Local Lymph Node Assay: A Test Method for Assessing the Allergic Contact Dermatitis Potential of Chemicals/Compounds: The Results of an Independent Peer Review Evaluation Coordinated by the Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program Center for the Evaluation of Alternative Toxicological Methods (NICETAM). NIH Publication No: 99-4494, Research Triangle Park, N.C. (http://iccvam.niehs.nih.gov).
11. Testing method B.4.
12. Basketter, D.A., Selbie, E., Scholes, E.W. Lees, D. Kimber, I. and Botham, P.A. (1993) Results with OECD recommended positive control podraživačs in the maximisation, Buehler and local lymph node assays. Food and Chemical Toxicology, 31, 63-67.
13. Basketter D.A., Lea L.J., Dickens A., Briggs D., Pate I., Dearman R.J., Kimber I. (1999). A comparison of statistical approaches to the derivation of EC3 values from local lymph node assay dose responses. J. Appl. Toxicology, 19, 261-266.
14. Basketter DA, Blaikie L, Derman RJ, Kimber I, Ryan CA, Gerberick GF, Harvey P, Evans P, White IR and Rycroft RTG (2000). Use of local lymph node assay for the estimation of relative contact allergenic potency. Contact Dermatitis 42, 344-48.
B.43. STUDIJA NEUROTOKSIČNOSTI KOD GLODARA
1. METODA ISPITIVANJA
Ova metoda zasniva se na Uputstvu za ispitivanje OECD 424 (1997).
Metoda ispitivanja je osmišljena za dobijanje podataka potrebnih za potvrdu ili dalju karakterizaciju potencijalne neurotoksičnosti hemikalija kod odraslih životinja. Može se kombinovati sa postojećim metodama ispitivanja za studije toksičnosti ponovljene doze ili obavljati kao posebna studija. Preporučuje se konsultacija OECD vodiča1 oko pomoći pri osmišljavanju studije zasnovane na ovoj metodi ispitivanja. Navedeno je posebno važno kod razmatranja modifikacija opažanja i postupaka ispitivanja kao što se preporučuje za rutinsku primenu ove metode. Pripremljen je dokument sa smernicama kako bi omogućio izbor drugih postupaka ispitivanja za upotrebu u posebnim okolnostima.
Procena razvojne neurotoksičnosti nije predmet ove metode.
1.1. UVOD
U proceni i evaluaciji toksičnih karakteristika hemikalija važno je uzeti u obzir potencijal za neurotoksične efekte. Metoda za sistemsku toksičnost, ponovljena doza već uključuje posmatranja koja se odnose na potencijalnu neurotoksičnost. Ova metoda ispitivanja može se koristiti pri osmišljavanju studije za dobijanje daljih podataka o ili za potvrdu neurotoksičnih efekata opaženih u studijama za sistemske toksičnost, ponovljena doza. Razmatranje potencijalne neurotoksičnosti određenih grupa hemikalija može ukazati na to da se one mogu odgovarajuće oceniti ovom metodom bez prethodnih indikacija potencijalne neurotoksičnosti iz studija sistemske toksičnosti, ponovljena doza. Takva razmatranja npr. uključuju:
- posmatranje neuroloških znakova ili neuropatoloških lezija u studijama toksičnosti različitih od onih iz studija sistemsku toksičnost, ponovljena doza ili
- strukturnu vezu ili druge podatke koji ih povezuju sa poznatim neurotoksikantima.
Može da bude i drugih slučajeva u kojima je korišćenje ove metode ispitivanja prikladno (za detalje videti literaturu1).
Ova metoda je razvijena da se prilagodi da zadovolji posebne potrebe za potvrdom specifične histopatološke i bihevioralne neurotoksičnosti hemikalije, kao i da obezbedi karakterizaciju i kvantifikaciju neurotoksičnih reakcija.
U prošlosti se neurotoksičnost izjednačavala sa neuropatijom uključujući neuropatološke lezije ili neurološke disfunkcije kao što su napadi, paraliza ili tremor. Iako je neuropatija važna manifestacija neurotoksičnosti, jasno je da postoje mnogi drugi znaci toksičnosti za nervni sistem (npr. gubitak motorne koordinacije, deficiti čula, disfunkcije učenja i pamćenja) koji se ne moraju oslikavati u neuropatiji ili drugim vrstama studija.
Metoda ispitivanja neurotoksičnosti je osmišljena da detektuje glavne neurobihevioralne i neuropatološke efekte kod odraslih glodara. Bihevioralni efekti, čak i odsustvu morfoloških promena, mogu da održavaju štetni uticaj na organizam, ali nisu sve bihevioralne promene specifične za nervni sistem. Zbog toga, bilo koje promene koje su opažene ocenjuju se u vezi sa korelativnim histopatološkim, hematološkim ili biohemijskim podacima kao i sa podacima o drugim tipovima sistemske toksičnosti. Ispitivanje koje se obavlja u ovoj metodi je usmereno na davanje karakterizacije i kvantifikacije neurotoksičnih efekata što uključuje specifične histopatološke i bihevioralne postupke koji mogu biti nadalje podržani elektrofiziološkim i/ili biohemijskim istraživanjima1, 2, 3, 4.
Neurotoksikanti mogu da deluju na brojna ciljna mesta u okviru nervnog sistema i putem različitih mehanizama. Nijedan sistem ispitivanja ne može u potpunosti da proceni neurotoksični potencijal svih supstanci, pa može biti korisno iskoristiti druga in vivo ili in vitro ispitivanja koja su specifična za tip opažene ili predviđene neurotoksičnosti.
Ova metoda ispitivanja može da se koristi zajedno sa smernicama datim u OECD vodiču1 kako bi se osmislile studije čija je namera da dalje karakterišu ili povećaju osetljivost kvantifikacije odnosa doza-odgovor kako bi bolje ocenili dozu bez štetnog efekta ili potvrdili poznatu ili verovatnu opasnost od hemikalije. Mogu se osmisliti studije koje identifikuju i ocenjuju neurotoksični mehanizam (mehanizme) ili potkrepljuju već raspoložive podatke korišćenjem postupaka neurobihevioralne i neuropatološke opservacije. Takve studije ne kopiraju podatke koji bi bili generisani korišćenjem standardnih postupaka preporučenih u ovoj metodi. Podaci su već dostupni i nisu neophodni za tumačenje rezultata studije.
Metoda ispitivanja neurotoksičnosti, kad se primenjuje sama ili u kombinaciji, daje rezultate koji mogu:
- da identifikuju da li je nervni sistem trajno ili reverzibilno pod uticajem ispitivane hemikalije;
- da doprinesu karakterizaciji promena nervnog sistema koje se povezuju sa izlaganjem hemikaliji i razumevanju relevantnog mehanizma;
- da odrede odnose doza - odgovor i vreme - odgovor kako bi se procenila doza bez štetnog efekta (koja se može koristiti pri uspostavljanju bezbednosnih kriterijuma za hemikaliju).
Ova eksperimentalna metoda koristi oralnu primenu ispitivane supstance. Drugi putevi primene (npr. dermalni ili inhalacioni) mogu biti prikladniji i mogu zahtevati modifikaciju preporučenih postupaka. Razmatranja o izboru puta primene zavise od profila ljudskog izlaganja i raspoloživih toksikoloških ili kinetičkih informacija.
1.2. DEFINICIJE
Štetni efekat jeste bilo koja promena u odnosu na osnovno stanje koja je povezana sa tretmanom i koja umanjuje sposobnost organizma da preživi, razmnožava se ili se prilagodi životnoj sredini.
Doza jeste količina primenjene ispitivane supstance. Doza se izražava kao masa (g, mg) ili kao masa ispitivane supstance po jedinici mase eksperimentalne životinje (npr. mg/kg) ili kao konstantna koncentracija u hrani (ppm).
Doziranje jeste opšti pojam koji se sastoji od doze, njene frekvencije i trajanja doziranja.
Neurotoksičnost jeste štetna promena u strukturi ili funkciji nervnog sistema koja je posledica izlaganja hemijskom, biološkom ili fizičkom agensu.
Neurotoksikant jeste bilo koja hemikalija, biološki ili fizički agens koji ima potencijal da uzrokuje neurotoksičnost.
NOAEL jeste skraćenica za dozu bez štetnog efekta (no-observed-adverse effect level) i predstavlja najviši nivo doze pri kome nisu opaženi štetni efekti povezani sa tretmanom.
1.3. PRINCIP METODE
Ispitivana supstanca se primenjuje oralnim putem u rasponu doza na nekoliko grupa laboratorijskih glodara. Obično su potrebne ponovljene doze i režim doziranja može biti 28 dana, subhronično (90 dana) ili hronično (1 godina ili duže). Postupci opisani u ovoj eksperimentalnoj metodi mogu se koristiti i u studiji akutne neurotoksičnosti. Ispitivanje na životinjama vrši se kako bi se omogućila detekcija ili karakterizacija bihevioralnih i/ili neuroloških abnormalnosti. Raspon ponašanja na koje utiču neurotoksikanti procenjuje se tokom perioda posmatranja. Na kraju ispitivanja, podgrupa životinja oba pola iz svake grupe uzorkuje se in situ i pripremaju se i ispituju preseci mozga, kičmene moždine i perifernih nerava.
Tokom izvođenja studije kao samostalne studije za skrining neurotoksičnosti ili za karakterizaciju neurotoksičnih efekata, životinje u svakoj grupi koje se ne koriste za uzorkovanje i kasnija histopatološka ispitivanja (videti Tabelu 1.) mogu biti korišćene za specifične neurobihevioralne, neuropatološke, neurohemijske ili elektrofiziološke postupke koji mogu zameniti podatke dobijene standardnim ispitivanjima koje zahteva ova metoda1. Ovi dodatni postupci mogu biti posebno korisni kada empirijska posmatranja ili očekivani efekti ukazuju na specifičnu vrstu ili ciljno mesto neurotoksičnosti hemikalije. Preostale životinje se mogu koristiti za procene kao što su one koja zahtevaju metode ispitivanja za studije toksičnosti, ponovljena doza kod glodara.
Kad se postupci iz ove metode ispitivanja kombinuju sa onima iz drugih metoda, potreban je dovoljan broj životinja kako bi se zadovoljili zahtevi za posmatranja iz obe studije.
1.4. OPIS METODE
1.4.1. Izbor životinjske vrste
Preporučena vrsta glodara je pacov, mada se uz opravdanje mogu koristiti i druge vrste. Koriste se uobičajeni laboratorijski sojevi zdravih mladih odraslih životinje. Koriste se ženke koje nisu ranije rađale i koje nisu trudne. Doziranje se uobičajeno počinje što je ranije moguće posle odbijanja od sise, najbolje ne kasnije nego što životinje navrše šest nedelja i u svakom slučaju pre nego životinje navrše devet nedelja. Kada se ova studija kombinuje sa drugim studijama, ova starost se može prilagoditi. Na početku studije varijacija u telesnoj masi životinja ne sme da prelazi ± 20% srednje mase za svaki pol. Kada se obavlja kratkoročna studija ponovljene doze kao preliminarna dugoročnoj studiji, u obe studije se koriste životinje istog soja i iz istog izvora.
1.4.2. Uslovi smeštaja i ishrane
Temperatura prostorija za eksperimentalne životinje je 22° C (± 3 °C). Relativna vlažnost je najmanje 30% i da ne prelazi 70% osim za vreme čišćenja prostorija. Ciljna vlažnost je 50% do 60%. Svetlo je veštačko sa sekvencama od 12 sati svetla i 12 sati mraka. Buka se smanjuje na minimum. Može se koristiti konvencionalna laboratorijska ishrana uz neograničene količine vode za piće.
Izbor ishrane može biti uslovljen potrebom da se obezbedi odgovarajuća smeša ispitivane supstance koja se primenjuje ovom metodom. Životinje se smeštaju pojedinačno ili se drže u malim grupama istog pola.
1.4.3. Priprema životinja
Zdrave mlade životinje se slučajnim izborom raspoređuju u grupe. Kavezi se raspoređuju na način da se svedu na minimum mogući efekti zbog njihovog rasporeda. Životinje se jedinstveno identifikuju i drže u kavezima najmanje pet dana pre početka ispitivanja kako bi se aklimatizovale na laboratorijske uslove.
1.4.4. Put primene i priprema doza
Ova metoda ispitivanja posebno se odnosi na oralnu primenu ispitivane supstance. Oralna primena može biti putem prisilnog hranjenja, putem hrane, vode za piće ili kapsulama. Drugi putevi primene (npr. dermalni ili inhalacioni) mogu se koristiti ali zahtevaju modifikaciju preporučenih postupaka. Razmatranja o izboru puta primene zavise od profila izlaganja ljudi i raspoloživih toksikoloških ili kinetičkih podataka. Naznačava se objašnjenje za izbor puta primene kao i modifikacije postupaka ove metode ispitivanja.
Kad je neophodno, ispitivana supstanca se može rastvoriti ili suspendovati u odgovarajućem vehikulumu. Preporučuje se korišćenje vodenog rastvora/suspenzije kao prvi izbor, zatim razmatranje primene rastvora/suspenzije u ulju (npr. kukuruzno ulje) i zatim mogući rastvori/suspenzije u drugom vehikulumu. Toksične karakteristike vehikuluma moraju biti poznate. Razmatraju se i sledeće karakteristike vehikuluma: efekti vehikuluma na apsorpciju, raspodelu, metabolizam ili zadržavanje ispitivane supstance koji mogu izmeniti njene toksične karakteristike; kao i efekte unosa hrane ili vode ili nutritivni status životinja.
1.5. POSTUPCI
1.5.1. Broj i pol životinja
Kada se studija izvodi kao posebna studija, koristi se najmanje 20 životinja (10 ženki i 10 mužjaka) u svakoj doznoj i kontrolnoj grupi za ocenjivanja detaljnih kliničkih i funkcionalnih opažanja. Od najmanje pet mužjaka i pet ženki odabranih od tih 10 mužjaka i 10 ženki, uzimaju se uzorci in situ i isti se koriste za detaljnu neurohistopatologiju na kraju studije. U slučajevima kada se na znakove neurotoksičnih efekata posmatra samo ograničen broj životinja u datoj doznoj grupi, razmatra se da se te životinje uključe među one odabrane za uzorkovanje. Kada se studija obavlja u kombinaciji sa studijom toksičnosti sa ponovljenom dozom, koristi se odgovarajući broj životinja kako bi se zadovoljili ciljevi obe studije. Minimalni broj životinja po grupi za razne kombinacije ispitivanja je prikazan u Tabeli 1. Ukoliko se planiraju lišavanja života na human način tokom ispitivanja ili ukoliko se planiraju grupe za oporavak za posmatranje reverzibilnosti, perzistencije ili odložene pojave toksičnih efekata posle tretmana ili kada se razmatraju dodatna posmatranja, broj životinja se povećava kako bi se obezbedilo da bude dostupan dovoljan broj životinja potrebnih za posmatranje i histopatologiju.
1.5.2. Tretirana i kontrolna grupa
Koristi se najmanje tri dozne i jednu kontrolnu grupu, ali ukoliko se iz procene drugih podataka ne očekuju efekti pri ponovljenoj dozi od 1.000 mg/kg telesna masa/dan, može se obaviti ispitivanje granične doze. Ukoliko nema raspoloživih odgovarajućih podataka, može se izvesti studija traženja raspona kao pomoć pri određivanju doza koje bi se koristile. Osim tretiranja ispitivanom supstancom, sa životinjama u kontrolnoj grupi se postupa isto kao sa onima iz ispitivane grupe. Ukoliko se pri primeni ispitivane supstance koristi vehikulum, kontrolna grupa prima vehikulum u najvećoj zapremini koja se koristi.
1.5.3. Provera pouzdanosti
Laboratorija koja obavlja studiju navodi podatke kojima dokazuje svoju mogućnost da izvede ispitivanje i osetljivost korišćenih postupaka. Takvi podaci pružaju dokaze o mogućnosti detekcije i kvantifikacije, kako odgovara, promenama u različitim pokazateljima ispitivanja preporučenim za posmatranje, kao što su autonomni znaci, senzorska reaktivnost, snaga hvatanja i motorna aktivnost. Podaci o hemikalijama koji uzrokuju različite vrste neurotoksičnih efekata i koji se mogu koristiti kao supstance pozitivne kontrole nalaze se u literaturi2, 3, 4, 5, 6, 7, 8, 9. Istorijski podaci mogu se koristiti ukoliko ključni aspekti eksperimentalnih postupaka ostanu isti. Periodično ažuriranje istorijskih podataka se preporučuje. Novi podaci koji pokazuju neprekidnu osetljivost postupaka treba da budu razvijeni kada se promeni neki ključni element izvođenja ispitivanja ili postupka od strane laboratorije.
1.5.4. Izbor doza
Nivoi doza se biraju uzimajući u obzir bilo koju ranije uočenu toksičnost i raspoložive kinetičke podatke za ispitivano jedinjenje ili slične materijale. Najviša doza se bira sa ciljem izazivanja neurotoksičnih efekata ili jasnih sistemskih toksičnih efekata. Potom se bira opadajući niz doznih nivoa sa ciljem dokazivanja bilo kog odgovora koji je u vezi sa dozom i NOAEL pri najnižem doznom nivou. Doze se određuju tako da primarni toksični efekti na nervni sistem mogu da se razlikuju od efekata koji se povezuju sa sistemskom toksičnošću. Dva do tri intervala su često optimum i pored četvrte ispitivane grupe, često se preporučuje da se koriste vrlo veliki intervali (npr. više od faktora 10) između doza. Kada postoji dobra procena ljudske izloženosti, to se takođe uzima u obzir.
1.5.5. Ispitivanje granične doze
Ukoliko studija korišćenjem jedne doze od najmanje 1.000 mg/kg TM/dan, korišćenjem opisanih postupaka, ne pokaže nikakve neurotoksične efekte, i ako se toksičnost ne može očekivati na osnovu podataka o strukturno sličnim jedinjenjima, studija u kojoj bi se koristile tri doze ne smatra se neophodnom. Očekivana izloženost ljudi može indikovati potrebu za korišćenjem veće oralne doze u ispitivanju granične doze. Za druge puteve primene kao što su inhalacija ili dermalna primena, fizička i hemijska svojstva ispitivane supstance često mogu diktirati maksimalni nivo izlaganja. Za izvođenje studije akutne oralne toksičnosti, doza za ispitivanje granične doze je najmanje 2.000 mg/kg.
1.5.6. Primena doza
Životinje se svakodnevno doziraju ispitivanom supstancom, sedam dana nedeljno, tokom perioda od najmanje 28 dana. Korišćenje petodnevnog režima doziranja ili kraćeg izlaganja treba da bude opravdano. Kad se ispitivana supstanca primenjuje prisilnim hranjenjem, isto se čini u jednoj dozi korišćenjem trbušne cevi ili odgovarajućom intubacionom kanulom. Maksimalna zapremina tečnosti koji može biti primenjena zavisi od veličine eksperimentalne životinje. Zapremina ne sme da prelazi 1 ml/100 g TM. Ipak, u slučaju vodenih rastvora može se uzeti u obzir korišćenje do 2 ml/100 g TM. Osim kod iritativnih i korozivnih supstanci koje će uobičajeno pokazati intenzivnije efekte pri višim koncentracijama, varijabilnost u ispitivanoj zapremini se minimizuje podešavanjem koncentracije kako bi se osigurao konstantna zapremina pri svim nivoima doze.
Za supstance koje se primenjuju putem hrane ili vode za piće, važno je osigurati da količine ispitivane supstance ne ometaju normalnu prehranu ili ravnotežu vode. Kada se ispitivana supstanca primenjuje u hrani bilo kao konstantna prehrambena koncentracija (ppm) ili kada se koristi konstanti dozni nivo u smislu telesne mase životinja, alternativa se naznačava. Za supstance koje se primenjuju prisilnim hranjenjem, doza se primenjuje u slično vreme svakog dana i prilagođena je kako bi se zadržao konstantan dozni nivo u smislu telesne mase životinje. Kada se koristi ispitivanje sa ponovljenom dozom kao prethodno ispitivanje za dugoročnu studiju, onda se u obe studije koristi slična prehrana. Za studije akutne toksičnosti ako nije moguće dati jednu dozu, doza se može davati u manjim delovima tokom perioda koji ne prelaze 24 sata.
1.6. POSMATRANJA
1.6.1. Učestalost posmatranja i ispitivanja
Kod studija sa ponovljenom dozom, period posmatranja pokriva period doziranja. Kod studija akutne toksičnosti, posmatra se 14-dnevni period posle tretmana. Kod životinja u pratećim grupama koje se drže bez izlaganja za vreme posle tretmana, posmatranja pokriva i ovaj period.
Posmatranja se obavljaju dovoljno često kako bi se povećala verovatnost detekcije bilo kojih bihevioralnih i/ili neuroloških abnormalnosti. Posmatranja se obavljaju po mogućstvu u isto vreme svakog dana uzimajući u obzir period u kome se očekuje pojava efekata posle doziranja. Frekvencija kliničkih posmatranja i funkcionalnih testova je data u Tabeli 2. Ukoliko kinetički ili drugi podaci koji su dobijeni u prethodnim studijama ukazuju na potrebu posmatranja u drugačijim periodima, usvaja se alternativni raspored kako bi se prikupio maksimalan broj informacija. Daje se objašnjenje za promenu rasporeda.
1.6.1.1. Posmatranja opšteg zdravstvenog stanja i mortaliteta/morbiditeta
Zdravstveno stanje svih životinja pažljivo se posmatra najmanje jednom dnevno, a dva puta dnevno posmatraju se mortalitet i morbiditet.
1.6.1.2. Detaljna klinička posmatranja
Na životinjama koje su izabrane za tu svrhu obavljaju se detaljna klinička opažanja (videti Tabelu 1) jednom pre prvog izlaganja (kako bi se omogućila upoređivanja kod jedne jedinke) i u različitim intervalima u zavisnosti od trajanja studije (videti Tabelu 2). Detaljna klinička posmatranja na pratećim grupama obavljaju se na kraju perioda oporavka. Detaljna klinička opažanja se obavljaju izvan kaveza u standardnoj areni. Opažanja se pažljivo beleže korišćenjem sistema ocenjivanja koji uključuje kriterijume ili skale za svaku meru. Laboratorija jasno definiše kriterijume ili skale. Treba uložiti napor kako bi se obezbedilo da varijacije u uslovima ispitivanja budu minimalne (ne sistematično povezane sa tretmanom) i da posmatranja obavljaju obučeni posmatrači koji nisu upoznati sa tretmanom.
Preporučljivo je struktuirano obavljati posmatranja po dobro definisanim kriterijuma (uključujući definiciju "normalnog raspona") i sistematično ih primeniti na svaku životinju u svakom periodu posmatranja. "Normalni raspon" se adekvatno dokumentuje. Beleže se svi uočeni znakovi. Kad god je moguće beleži se i veličina uočenih znakova. Klinička opažanja uključuju, ali nisu ograničena na, promene na koži, krznu, očima, sluznicama, pojava sekreta i ekskreta i autonomne aktivnosti (npr. lakrimacija, piloerekcija, veličina zenice, neobičan način disanja i/ili disanje na usta, bilo koje neobične znakove uriniranja ili defekacije i bezbojni urin).
Beleže se i bilo koji neuobičajeni efekti u pogledu položaja tela, nivoa aktivnosti (npr. povećano ili smanjeno istraživanje standardne arene) i koordinacije pokreta. Promene u držanju (npr. klaćenje, ataksija), stavu (npr. pogrbljenost) i reakciji na postupanje, smeštanje ili drugi stimulusi okoline kao i prisustvo kloničnih ili toničnih pokreta, konvulzija ili tremora, stereotipa (npr. preterano timarenje, neobični pokreti glave, ponavljajuće kretnje u krug) ili čudno ponašanje (npr. griženje ili preterano lizanje, samosakaćenje, hod unazad, vokalizacija) ili agresija takođe se beleže.
1.6.1.3. Funkcionalna ispitivanja
Slično detaljnim kliničkim posmatranjima, funkcionalna ispitivanja se takođe obavljaju pre izlaganja, kao i često posle toga, na svim životinjama koje su izabrane za tu svrhu (videti Tabelu 1). Učestalost funkcionalnih ispitivanja takođe zavisi od trajanja studije (videti Tabelu 2). Pored perioda posmatranja iz Tabele 2, obavljaju se funkcionalna ispitivanja na pratećim grupama sve do usmrćenja. Funkcionalna ispitivanja uključuju senzornu reaktivnost na stimuluse raznih vrsta (npr. zvučni, vizuelni i proprioceptivni stimulusi5, 6, 7 ocenjivanje snage stiska8 i ocenjivanje motorne aktivnosti9). Motorna aktivnost se meri automatskom spravom kojom je moguće detektovati smanjenu i povećanu aktivnost. Ukoliko se koristi drugi definisani sistem, on je kvantitativan i njegovu osetljivost i pouzdanost treba pokazati. Svaki uređaj se testira kako bi se osigurala pouzdanost tokom vremena i konzistentnost između uređaja. Više detalja o postupcima koji se prate nalazi se u literaturi. Ukoliko nema podataka (npr. struktura - aktivnost, epidemiološki podaci, druge studije toksičnosti) koji bi ukazivali na potencijalne neurotoksične efekte, razmatra se uključivanje specijalizovanijih testova senzorne ili motorne funkcije ili učenja i pamćenja kako bi se detaljnije proučili ti mogući efekti. Više podataka o specijalizovanim testovima dato je u literaturi1.
Izuzetno, životinje koje pokazuju znakove toksičnosti u obimu koji značajno ometa funkcionalno ispitivanje mogu biti izostavljene iz tog ispitivanja. Daje se opravdanje za isključivanje tih životinja iz funkcionalnog ispitivanja.
1.6.2. Telesna masa i potrošnja hrane/vode
Za studije koje traju do 90 dana sve životinje se mere najmanje jednom nedeljno i meri se potrošnja hrane (potrošnju vode kada se ispitivana supstanca unosi tim putem) takođe najmanje jednom nedeljno. Za dugoročne studije sve životinje se mere najmanje jednom nedeljno prvih 13 nedelja, a potom najmanje jednom na svake 4 nedelje. Meri se potrošnja hrane (potrošnju vode kada se ispitivana supstanca unosi tim putem) takođe najmanje jednom nedeljno tokom prvih 13 nedelja, a kasnije u približno tromesečnim intervalima osim ukoliko zdravstveno stanje ili promena telesne mase ne nalažu drugačije.
1.6.3. Oftalmološka ispitivanja
Za studije koje traju duže od 28 dana obavlja se oftalmološki pregled uz korišćenje oftalmoskopa ili sličnog odgovarajućeg instrumenta, pre primene ispitivane supstance i po završetku studije, najbolje na svim životinjama, ali najmanje na onima iz grupa visoke doze i iz kontrolne grupe.
Ukoliko se primete promene u očima ili ukoliko klinički znaci ukazuju na potrebu, pregledaju se sve životinje. Kod dugoročnih studija oftalmološki pregled se obavlja u 13. nedelji. Oftalmološki pregledi se ne obavljaju ukoliko su ovi podaci već dostupni iz drugih studija sličnog trajanja i sličnih doznih nivoa.
1.6.4. Hematološka i medicinsko-biohemijska ispitivanja
Kada se izvodi studija neurotoksičnosti u kombinaciji sa studijom sistemske toksičnosti sa ponovljenom dozom, rade se hematološka ispitivanja i medicinsko-biohemijska određivanja kako je izloženo u metodi ispitivanja sistemske toksičnosti. Prikupljanje uzoraka se obavlja tako da bilo koji potencijalni efekti na neuropatologiju budu svedeni na minimum.
1.6.5. Histopatološka ispitivanja
Neuropatološki pregled je osmišljen tako da dopuni i proširi opažanja iz in vivo faze studije. Tkiva najmanje 5 životinja/pol/grupa (videti Tabelu 1. i sledeći pasus ovog odeljka) se fiksiraju in situ, korišćenjem opštepriznatih tehnika perfuzije i fiksacije (videti literaturu3, 4). Bilo koje uočljive promene se beleže. Kad se studija izvodi kao samostalna studija za proveru neurotoksičnosti ili za karakterizaciju neurotoksičnih efekata, preostale životinje mogu biti korišćene bilo za specifične neurobihevioralne10, 11, neuropatološke10, 11, 12, 13, neurohemijske10, 11, 14, 15 ili elektrofiziološke10, 11, 16, 17 postupke kao dopuna postupcima i ispitivanjima koji su ovde opisani ili za povećanje broja jedinki pregledanih za histopatologiju. Ovi dodatni postupci su od posebne koristi kad empirijska opažanja ili očekivani efekti ukazuju na specifični tip ili ciljno mesto neurotoksičnosti2, 3. Alternativno, preostale životinje mogu da se podvrgnu rutinskom patološkom ocenjivanju kako je opisano u metodi za studije sa ponovljenom dozom.
Opšti postupak bojenja kao što je hematoksilin i eozin (u daljem tekstu: H&E) obavlja se za sve uzroke tkiva u parafinu i izvodi se mikroskopski pregled. Ukoliko se uoče znaci periferne neuropatije ili ako se na iste sumnja, ispituju se uzorci perifernog nervnog tkiva u plastici. Klinički znaci takođe mogu naznačiti dodatna mesta za ispitivanje ili korišćenje posebnih postupaka bojenja. Uputstvo o dodatnim mestima dato je u literaturi3, 4. Odgovarajuće specijalne boje za pokazivanje specifičnih tipova patoloških promena mogu biti od pomoći18.
Na reprezentativnim presecima centralnog i perifernog nervnog sistema vrši se histološki pregled (videti u literaturi3,4). Ispitivana područja obično uključuju: prednji mozak, središte cerebruma, uključujući presek kroz hipokampus, srednji mozak, cerebelum, pons, produžena moždina, oko sa optičkim nervom i retinom, kičmenu moždinu i cervikalna i lumbalna zadebljanja, dorzalni koren ganglia, dorzalna i ventralna vlakna korenova, proksimalni išijasni nerv, proksimalni tibijalni nerv (u kolenu) i grane tibijalnog nerva za mišić lista. Preseci kičmene moždine i perifernih nerava uključuju i poprečne ili transverzalne i uzdužne preseke. Obraća se pažnja na vaskulaturu nervnog sistema. Uzorak skeletnog mišića, posebno mišića lista, takođe se pregleda. Posebna pažnja se obraća mestima sa celularnom ili fibroznom strukturom i uzorak CNS i PNS za koji se zna da je posebno pogođen neurotoksikantima.
Smernice o neuropatološkim promenama koje tipično proizilaze iz izlaganja toksikantu date su u literaturi3, 4. Preporučuje se postepeno ispitivanje uzoraka tkiva u kome se preseci grupe visoke doze prve upoređuju sa onima iz kontrolne grupe. Ukoliko se ne uoče neuropatološke promene u uzorcima iz ovih grupa, dalja analiza nije potrebna. Ukoliko se uoče neuropatološke promene u grupi visoke doze, uzorak svakog potencijalno pogođenog tkiva iz srednjih i nižih doznih grupa kodira se i redom ispituje.
Ukoliko se pronađu bilo kakve neuropatološke promene u kvalitativnoj analizi, obavlja se drugo ispitivanje na svim područjima nervnog sistema koji pokazuju takve promene. Preseci iz svih doznih grupa svih potencijalno zahvaćenih regija se kodiraju i ispituju nasumce bez poznavanja koda. Frekvenca i ozbiljnost svake lezije se beleže. Pošto se ocene sve regije iz svih grupa kod se može dešifrovati i može se obaviti statistička analiza kako bi se ocenio odnos doza-odgovor. Primeri različitih stepena ozbiljnosti svake lezije se opisuju.
Neuropatološki nalazi se ocenjuju u kontekstu bihejvioralnih posmatranja i merenja, kao i drugih podataka iz prethodnih i istovremenih studija sistemske toksičnosti ispitivane supstance.
2. PODACI
2.1. OBRADA REZULTATA
Navode se pojedinačni podaci. Svi podaci se navode tabelarno. Za svaku ispitivanu ili kontrolnu grupu navode se: broj životinja na početku ispitivanja, broj životinja koje su pronađene mrtve za vreme ispitivanja ili usmrćene iz humanih razloga, kao i vreme smrti ili humanog lišavanja života na human način, broj koji pokazuje znakove toksičnosti, opis znakova toksičnosti koji su uočeni, uključujući vreme nastanka, trajanje, vrstu i ozbiljnost bilo kojih toksičnih efekata, broj životinja koje pokazuju lezije, uključujući vrstu i ozbiljnost lezija.
2.2. PROCENA I TUMAČENJE REZULTATA
Nalazi studije se procenjuju u pogledu incidence, ozbiljnosti i korelacije neurobihevioralnih i neuropatoloških efekata (neurohemijskih ili elektrofizioloških efekata takođe, ukoliko su uključena dodatna ispitivanja) ili bilo kojih drugih uočenih štetnih efekata. Kada je moguće, numerički rezultati se procenjuju odgovarajućom pšteprihvaćenom statističkom metodom. Statističke metode se biraju prilikom osmišljavanja studije.
3. IZVEŠTAJ
Izveštaj o ispitivanju sadrži podatke o:
1) Ispitivanoj supstanci:
- fizička priroda (uključujući izomeriju, čistoću i fizička i hemijska svojstva);
- identifikacioni podaci.
2) Vehikulumu (ako odgovara):
- opravdanje za izbor vehikuluma.
3) Eksperimentalnim životinjama:
- korišćena vrsta/soj;
- broj, starost i pol životinja;
- izvor, uslovi smeštaja, aklimatizacija, ishrana, itd.;
- pojedinačne mase životinja na početku ispitivanja.
4) Uslovima ispitivanja:
- detalji o formulaciji ispitivane supstance/priprema ishrane, postignuta koncentracija, stabilnost i homogenost preparata:
- specifikacija primenjenih doza, uključujući detalje o vehikulumu, zapremini i fizičkom obliku primenjenog materijala;
- detalji o primeni ispitivane supstance;
- obrazloženje za izabrane nivoe doza;
- obrazloženje za put primene i trajanje izlaganja;
- konverzija koncentracije ispitivane supstance (ppm) iz ishrane/vode za piće u stvarnu dozu (mg/kg telesna masa / dan), ukoliko je primenjivo;
- detalji o kvalitetu hrane i vode.
5) Postupcima ispitivanja i posmatranja:
- detalji o svrstavanju životinja svake grupe u podgrupe za perfuziju;
- detalji o sistemu bodovanja, uključujući kriterijume i skale za svako merenje u detaljnim kliničkim posmatranjima;
- detalji o funkcionalnim ispitivanjima za senzornu reaktivnost na stimuluse različitih vrsta (npr. zvučni, vizuelni i proprioceptivni), za ocenjivanje snage stiska, za ocenjivanje motorne aktivnosti (uključujući detalje o automatskim spravama za detekciju aktivnosti), i drugim korišćenim postupcima;
- detalji o oftalmološkim pregledima i ako odgovara hematološkim ispitivanjima i medicinsko-biohemijskim ispitivanjima sa relevantnim osnovnim vrednostima;
- detalji specifičnih neurobihevioralnih, neuropatoloških, neurohemijskih ili elektrofizioloških postupaka.
6) Rezultatima:
- telesna masa/promene telesne mase, uključujući telesnu masu pri lišavanju života na human način;
- potrošnja hrane i vode, ukoliko je primenljivo;
- podaci o toksičnim efektima po polu i doznom nivou, uključujući znake toksičnosti ili smrtnost;
- priroda, ozbiljnost i trajanje (vreme nastanka i kasniji tok) detaljnih kliničkih nalaza (prolaznih ili ne);
- detaljan opis svih rezultata funkcionalnih ispitivanja;
- nalazi obdukcije;
- detaljan opis svih specifičnih neurobihevioralnih, neuropatoloških, neurohemijskih ili elektrofizioloških nalaza, ukoliko je primenljivo;
- podaci o apsorpciji i metabolizmu, ukoliko su dostupni;
- statistička obrada rezultata, kad je primenjivo.
7) Obrazloženju rezultata:
- podatke o efektu doze;
- odnos drugih toksičnih efekata do zaključka o neurotoksičnom potencijalu ispitivane supstance;
- doza bez štetnog efekta (NOAEL).
8) Zaključku:
- preporučuje specifičan izveštaj o celokupnoj neurotoksičnosti ispitivane hemikalije.
4. LITERATURA
1. OECD Giudance Document on Neurotoxicity Testing Strategies and Test Methods. OECD, Paris, InPreparation.
2. Test Guideline for a Developmental Neurotoxicity Study, OECD Guidelines for the Testing of Chemicals.In preparation.
3. World Health Organisation (WHO) (1986) Environmental Health Criteria document 60: Principles and Methods for the Assessment of Neurotoxicity associated with Exposure to Chemicals.
4. Spencer, P.S. and Schaumburg, H.H. (1980) Experimental and Clinical Neurotoxicology. Eds. Spencer, P.S. and Schaumburg, H.H. eds. Williams and Wilkins, Baltimore/London.
5. Tupper, D.E. and Wallace, R.B., (1980) Utility of the Neurological Examination in Rats. Acta Neurobiol. Exp., 40, p. 999-1003.
6. Gad, S.C., (1982) A Neuromuscular Screen for Use in Industrial Toxicology. J. Toxicol. Environ. Health, 9, p. 691-704.
7. Moser, V.C., McDaniel, K.M. and Phillips, P.M., (1991) Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of amitraz. Toxic. Appl. Pharmacol., 108, p. 267-283.
8. Meyer, O.A., Tilson, H.A., Byrd, W.C. and Riley, M.T., (1979) A Method for the Routine Assessment of Fore- and Hind- limb Grip Strength of Rats and Mice. Neurobehav. Toxicol., 1, p. 233-236.
9. Crofton, K.M., Haward, J.L., Moser, V.C., Gill, M.W., Reirer, L.W., Tilson, H.A. and MacPhail, R.C. (1991) Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol., 13, p. 599-609.
10. Tilson, H.A., and Mitchell, C.L. eds., (1992) Neurotoxicology Target Organ Toxicology Series. Raven Press, New York.
11. Chang, L.W., ed., (1995) Principles of Neurotoxicology. Marcel Dekker, New York.
12. Broxup, B., (1991) Neuopathology as a screen for Neurotoxicity Assessment. J. Amer. Coll. Toxicol., 10, p. 689-695.
13. Moser, V.C., Anthony, D.C., Sette, W.F. and MacPhail, R.C., (1992) Comparison of Subchronic Neurotoxicity of 2-Hydroxyethyl Acrylate and Acrylamide in Rats. Fund. Appl.Toxicol., 18, p. 343-352.
14. O‘Callaghan, J.P. (1988). Neurotypic and Gliotypic Proteins as Biochemical Markers of Neurotoxicity. Eurotoxicol. Teratol., 10, p. 445-452.
15. O‘Callaghan J.P. and Miller, D.B., (1988) Acute Exposure of the Neonatal Rat to Triethyltin Results in Persistent Changes in Neurotypic and Gliotypic Proteins. J. Pharmacol. Exp. Ther., 244, p. 368-378. L 142/428 EN Official Journal of the European Union 31.5.2008
16. Fox. D.A., Lowndes, H.E. and Birkamper, G.G., (1982) Electrophysiological Techniques in Neurotoxicology. In: Nervous System Toxicology. Mitchell, C.L. ed. Raven Press, New York, p. 299-335.
17. Johnson, B.L., (1980) Electrophysiological Methods in neurotoxicity Testing. In: Experimental and Clinical Neurotoxicology. Spencer, P.S. and Schaumburg, H.H. eds., Williams and Wilkins Co.,. Baltimore/ London, p. 726-742.
18. Bancroft, J.D. and Steven A., (1990) Theory and Pratice of Histological Techniques. Chapter 17, Neuropathological Techniques. Lowe, James and Cox, Gordon eds. Churchill Livingstone.
Tabela 1: Minimalni broj životinja po grupi kada se studija neurotoksičnosti izvodi odvojeno ili u kombinaciji s drugim studijama
|
STUDIJA NEUROTOKSIČNOSTI SPROVEDENA KAO |
|||
Posebna studija |
Kombinovana |
Kombinovana |
Kombinovana sa studijom hronične toksičnosti |
|
Ukupan broj životinja po grupi |
10 mužjaka i 10 ženki |
10 mužjaka i 10 ženki |
15 mužjaka i 15 ženki |
25 mužjaka i 25 ženki |
Broj životinja odabranih za funkcionalna ispitivanja uključujući detaljno kliničko posmatranje |
10 mužjaka i 10 ženki |
10 mužjaka i 10 ženki |
10 mužjaka i 10 ženki |
10 mužjaka i 10 ženki |
Broj životinja odabran za uzorkovanje in situ i neurohistopatologiju |
5 mužjaka i 5 ženki |
5 mužjaka i 5 ženki |
5 mužjaka i 5 ženki |
5 mužjaka i 5 ženki |
Broj životinja odabran za posmatranja toksičnosti ponovljene doze/subhronične/hronične, hematologiju, medicinsku biohemiju, histopatologiju, itd. kako je naznačeno u Vodiču |
|
5 mužjaka i 5 ženkiXVI |
10 mužjakaXVI |
20 mužjakaXVI |
Dodatna posmatranja, kada je odgovarajuće |
5 mužjaka i 5 ženki |
|
|
|
___________
XVI Uključuje pet životinja odabranih za funkcionalna ispitivanja i detaljno kliničko posmatranje kao deo studije neurotoksičnosti.
Tabela 2: Frekvenca kliničkog posmatranja i funkcionalnih ispitivanja
Vrsta posmatranja |
Trajanje studije |
||||
Akutno |
28-dana |
90-dana |
Hronično |
||
Kod svih životinja |
Opšte zdravstveno stanje |
dnevno |
dnevno |
dnevno |
dnevno |
Mortalitet /morbiditet |
Dva puta dnevno |
Dva puta |
Dva puta dnevno |
Dva puta dnevno |
|
Kod životinja odabranih za funkcionalna posmatranja |
Detaljna klinička posmatranja |
- pre prvog izlaganja |
- pre prvog izlaganja |
- pre prvog izlaganja |
- pre prvog izlaganja |
Funkcionalna ispitivanja |
- pre prvog izlaganja |
- pre prvog izlaganja |
- pre prvog izlaganja |
- pre prvog izlaganja |
|
B.44. APSORPCIJA PREKO KOŽE: IN VIVO METODA
1. METODA ISPITIVANJA
Ova metoda zasniva se na Uputstvu za ispitivanje OECD 427 (2004).
1.1. UVOD
Ekspozicija mnogim hemikalijama se dešava uglavnom putem kože dok se većina studija izvodi na laboratorijskim životinjama peroralnom primenom. In vivo ispitivanje perkutane apsorpcije navedeno u ovoj smernici obezbeđuje vezu koja je neophodna za ekstrapolaciju iz studija oralne toksičnosti kada se radi procena bezbednosti posle dermalne ekspozicije.
Supstanca prolazi veliki broj slojeva ćelija kože pre nego što dospe u cirkulaciju. Za većinu supstanci sloj koji ograničava brzinu prolaza kroz kožu je stratum corneum koji se sastoji od mrtvih ćelija. Permeabilnost kroz kožu zavisi kako od lipofilnosti hemikalije tako i od debljine spoljašnjeg sloja epidermisa, kao i od faktora kao što su molekulska masa i koncentracija supstance. Uglavnom je koža pacova i zečeva permeabilnija od ljudske, dok je permeabilonost kože zamorčića i majmuna sličnija ljudskoj.
Metode za merenje perkutane apsorpcije mogu da se podele u dve kategorije: in vivo i in vitro. In vivo metoda može da obezbedi dobre podatke o apsorpciji kroz kožu kod različitih vrsta.
Nedavno su razvijene in vitro metode. One koriste transport kroz ceo ili delimični sloj životinjske ili ljudske kože u rezervoar sa tečnošću. In vitro metoda se opisuje u posebnoj metodi ispitivanja1. Preporučuje se da se koristi OECD vodič2 kao pomoć u izboru odgovarajuće metode ispitivanja apsorpcije kroz kožu za datu situaciju s obzirom da se u ovom vodiču nalaze detalji o pogodnosti kako in vitro tako i in vivo metoda.
In vivo metoda opisana u ovoj metodi omogućuje određivanje penetracije ispitivane supstance kroz kožu u sistemski odeljak. Ova tehnika se široko koristi tokom više godina3, 4, 5, 6, 7. Iako u mnogim slučajevima in vitro studije perkutane apsorpcije mogu da budu pogodne, postoje mnoge situacije u kojima samo in vivo studije mogu da obezbede neophodne podatke.
Prednost in vivo metode je da koristi fiziološki i metabolički intaktan sistem, koristi vrste uobičajene za mnoge studije toksičnosti i može da se modifikuje za primenu na drugim vrstama. Nedostaci su korišćenje živih životinja, potreba za korišćenjem radioaktivno obeleženog materijala da bi se dobili pouzdani rezultati, teškoće u određivanju rane faze apsorpcije i razlike u permeabilnosti kože vrsta koja se najčešće koristi (pacova) i kože čoveka. Životinjska koža je uglavnom permeabilnija i zbog toga na osnovu ovih ispitivanje može da se preceni apsorpcija kroz kožu čoveka6, 8, 9. Kausitične/korozivne supstance se ne ispituju na živim životinjama.
1.2. DEFINICIJE
Neapsorbovana doza predstavlja dozu koja je isprana sa površine kože posle ekspozicije i deo koji je prisutan na neokluzivnom pokrivaču, uključujući i dozu za koju je pokazano da je isparila sa kože tokom ispitivanja.
Apsorbovana doza (in vivo) obuhvata dozu koja se nalazi u urinu, u ispirku kaveza, fecesu, izdahnutom vazduhu (ako je mereno), krvi, tkivima (ako su sakupljana) i u lešu životinje posle uklanjanja dela kože na koju je primenjena supstanca.
Apsorbabilna doza predstavlja dozu u ili na koži posle ispiranja.
1.3. PRINCIP METODE
Ispitivana supstanca (poželjno je da bude radioaktivno obeležena) primenjuje se na ošišanu kožu životinja u jednom ili više doznih nivoa u obliku reprezentativnih preparata u upotrebi. Ispitivani preparati se mogu ostaviti u kontaktu sa kožom određeno vreme pod odgovarajućim pokrivačem (ne-okluzivni, semi-okluzivni ili okluzivni) da bi se sprečila ingestija ispitivanog preparata. Na kraju ekspozicije pokrivač se uklanja i koža čisti odgovarajućim sredstvom za čišćenje, pokrivač i materijal za čišćenje se čuvaju za analizu, a na kožu se nanosi novi pokrivač. Životinje se smeštaju u pojedinačne metaboličke kaveze i ekskreti i izdahnuti vazduh se skupljaju za analizu, pre, tokom i posle perioda ekspozicije. Sakupljanje izdahnutog vazduha može da se izostavi ako postoji dovoljno podataka da je formiranje isparljivih radioaktivnih metabolita minimalno ili se uopšte ne javlja. Svaka studija obično uključuje nekoliko grupa životinja koje će biti izložene ispitivanom preparatu. Jedna grupa će biti lišena života na human način na kraju perioda ekspozicije. Potom će druge grupe biti lišene života na human način u planiranim intervalima2. Na kraju perioda sakupljanja uzoraka, ostatak životinja se lišava života, sakuplja se krv za analizu, uklanja se i čuva za analizu deo kože na koju je ispitivana supstanca primenjena, a leševi se analiziraju za svaki neizlučeni materijal. Uzorci se analiziraju na odgovarajuće načine i određuje se stepen perkutane apsorpcije6, 8, 9.
1.4. OPIS METODE
1.4.1. Izbor životinjske vrste
Obično se koristi pacov, ali sojevi bez dlake i vrste koje imaju brzine apsorpcije sličnije onoj kod ljudi mogu takođe da se koriste3, 6, 7, 8, 9. Uključuju se mlade, odrasle i zdrave životinje istog pola (obično muškog pola) uobičajenih laboratorijskih sojeva. Na početku studije odstupanje u telesnoj masi životinje ne treba da bude veće od ± 20% od prosečne mase. Na primer, mužjaci pacova od 200 g do 250 g, posebno na gornjoj polovini ovog raspona.
1.4.2. Broj i pol životinja
Grupa od najmanje četiri životinje istog pola koristi se za svaki ispitivani preparat i svako planirano vreme lišavanja života na human način. Svaka grupa životinja će biti lišena života na human način posle različitih vremenskih intervala, npr. na kraju perioda ekspozicije (obično 6 ili 24 sata) i u narednim prilikama (npr. 48 i 72 sata). Ako postoje podaci koji pokazuju suštinske razlike u dermalnoj toksičnosti između mužjaka i ženki, koristi se osetljiviji pol. Ako ne postoje takvi podaci, može da se koristi bilo koji od polova.
1.4.3. Uslovi smeštaja i ishrane
Temperatura u prostoru za čuvanje eksperimentalnih životinja je 22° C (± 3° C). Relativna vlažnost je najmanje 30% i da ne premašuje 70% osim za vreme čišćenja prostora. Ciljna vlažnost je 50% do 60%. Osvetljenje je veštačko sa periodom svetlosti od 12 sati i periodom mraka od 12 sati.
Za ishranu može da se koristi uobičajena hrana za eksperimentalne životinje, koja je slobodno dostupna životinjama uz neograničen pristup vodi za piće. Za vreme studije, a po mogućstvu i za vreme aklimatizacije, životinje se smeštaju u pojedinačne metaboličke kaveze. S obzirom da prosipanje hrane i vode mogu da kompromituju rezultate, verovatnoća za ovakve događaje se minimalizuje.
1.4.4. Priprema životinja
Životinje se označavaju da bi mogle da se pojedinačno identifikuju i čuvaju se u kavezima najmanje pet dana pre početka studije da bi se aklimatizovale na laboratorijske uslove.
Posle aklimatizacije i približno 24 sata pre doziranja, region ramena i leđa svake životinje se ošiša. Propustljivost oštećene kože je različita od one kod intaktne kože i zbog toga se izbegava abrazija kože. Posle šišanja i približno 24 sata pre primene ispitivane supstance na kožu (videti odeljak 1.4.7. ove metode), površina kože se obriše acetonom da bi se uklonio sebum. Dodatno pranje sapunima i vodom se ne preporučuje zbog toga što rezidue sapuna mogu da promovišu apsorpciju ispitivane supstance. Površina kože mora da bude dovoljno velika da obezbedi pouzdano izračunavanje apsorbovane količine ispitivane hemikalije po cm2 kože, poželjno je najmanje 10 cm2. Ova površina je praktična za pacove od 200 g do 250 g TM. Posle pripreme životinje se vraćaju u metaboličke kaveze.
1.4.5. Ispitivana supstanca
Ispitivana supstanca je entitet čije se penetracione ispituju. Idealno, ispitivana supstanca je radioaktivno obeležena.
1.4.6. Ispitivani preparat
Preparat ispitivane supstance (npr. čista, razblažena hemikalija ili formulisani materijal koji sadrži ispitivanu hemikaliju koja se primenjuje na kožu) je isti (ili realni surogat) kao onaj kojem će biti izloženi ljudi ili druga ciljna vrsta. Svako odstupanje od preparata u upotrebi se opravdava. Kada je neophodno, ispitivna supstanca se rastvara ili suspenduje u odgovarajućem vehikulumu. Za vehikulume koji nisu voda treba poznavati apsoprcione karakteristike i moguće interakcije sa ispitivanom supstancom.
1.4.7. Primena na kožu
Na koži se definiše određeni deo površine za aplikaciju. Poznata količina ispitivanog preparata se ravnomerno nanosi na to mesto. Ova količina obično imitira moguću ekpoziciju kod ljudi, tipično 1 mg/cm2 do 5 mg/cm2 za čvrste ili do 10 µl/cm2 za tečnosti. Sve druge količine se opravdavaju uslovima očekivane primene, ciljevima studije ili fizičkim svojstvima ispitivanog preparata. Posle aplikacije, tretirano mesto se štiti od lizanja. Primer tipične sprave dat je na Slici 1. Obično se mesto primene zaštiti neokluzivnim pokrivačem (npr. pokrivač od permeabilne najlonske gaze). Za dužu primenu mesto primene se pokriva. U slučaju isparavanja poluisparljivih ispitivanih supstanci, dolazi do neprihvatljivog smanjenja recovery vrednosti za ispitivanu supstancu (videti odeljak 1.4.10. prvi pasus ove metode), neophodno je da se isparena supstanca uhvati filterom od medicinskog uglja koji pokriva spravu za primenu (videti Sliku 1). Važno je da ni jedna sprava ne oštećuje kožu, niti da apsorbuje, niti da reaguje sa ispitivanim preparatom. Životinje se vraćaju u pojedinačne metaboličke kaveze da bi se sakupljali ekskreti.
1.4.8. Trajanje ekspozicije i uzorkovanje
Trajanje ekspozicije je vremenski interval između primene i uklanjanja pranjem ispitivanog preparata sa kože. Koristi se odgovarajući period ekspozicije (obično 6 ili 24 sata), što se zasniva na očekivanoj dužini ekspozicije kod ljudi. Posle perioda ekspozicije, životinje se zadržavaju u metaboličkim kavezima sve do unapred planiranog lišavanja života na human način. Životinje se posmatraju u redovnim intervalima tokom studije da bi se utvrdili znaci toksičnih/abnormalnih odgovora. Na kraju perioda ekspozicije, tretirana koža se pregleda da bi se proverilo da li postoje vidljivi znaci iritacije.
Metabolički kavezi omogućavaju odvojeno sakupljanje urina i fecesa tokom studije. Oni obezbeđuju i sakupljanje 14C-ugljendioksida i isparljivih 14C- ugljenikovih jedinjenja koja se analiziraju kada su proizvedena u dovoljnoj količini (više od 5%). Urin, feces i tečnost za hvatanje (npr. 14C- ugljendioksida i isparljivih 14C-ugljenikovih jedinjenja) se pojedinačno sakupljaju od svake grupe u svako vreme uzimanja uzoraka. Ako postoji dovoljno podataka da se formira malo ili nimalo isparljivog, radioaktivnog metabolita, mogu da se koriste otvoreni kavezi.
Ekskreti se sakupljaju za vreme perioda ekspozicije i do 24 sata posle inicijalnog kontakta sa kožom, a potom svakodnevno do kraja ispitivanja. Mada su tri intervala sakupljanja ekskreta obično dovoljna, predviđena namena ispitivanog preparata ili postojeći kinetički podaci mogu da ukažu na to da je za studiju pogodnije da se uključi dodatno vreme i intervali.
Na kraju perioda ekspozicije, zaštitna naprava se uklanja sa svake životinje i odvojeno zadržava za analizu. Tretirana koža svih životinja se pere najmanje tri puta odgovarajućim sredstvom za čišćenje koristeći pogodne ubruse. To se čini pažljivo da bi se izbegla kontaminacija drugih delova tela životinje. Sredstvo za čišćenje je deo uobičajene higijenske prakse, npr. vodeni rastvor sapuna. Na kraju se koža suši. Svi ubrusi i ispirci se čuvaju za analizu. Pre vraćanja u kaveze, primenjuje se nov pokrivač da bi se zaštitilo tretirano mesto kod životinja koje su predviđene za kasnije ispitivanje.
1.4.9. Postupci lišavanja života na human način
Za svaku grupu, pojedinačne životinje se lišavaju života na human način u predviđeno vreme i krv se sakuplja za analizu. Zaštitna naprava ili pokrivač se uklanjaju za analizu. Koža sa mesta aplikacije i sličnog dela nedozirane, ošišane kože se uklanja od svake životinje za odvojenu analizu. Mesto primene može da se razdeli da bi se odvojio stratum corneum od epidermisa kako bi se dobio podatak o dispoziciji ispitivane hemikalije. Određivanje ove raspodele tokom vremena, posle perioda ekspozicije ukazuje na sudbinu ispitivane hemikalije u stratum cornerumu. Da bi se olakšalo razdeljivanje kože (posle završenog pranja kože i lišavanja života na human način), svi zaštitni pokrivači se uklanjaju. Koža mesta aplikacije sa prstenom okolne kože se odvaja od pacova i pričvršćuje iglama za podlogu. Parče adhezivne trake se primenjuje na površinu kože uz blagi pritisak, a potom se traka uklanja zajedno sa delom stratum corneuma. Zatim se primenjuju novi komadi adhezivne trake sve dok se traka više ne lepi za površinu kože, kada je sav stratum corneum uklonjen. Za svaku životinju svi delovi adhezivne trake mogu da se čuvaju u jednom kontejneru kome je dodat tkivni digestant da bi se solubilizovao stratum corneum. Sva potencijalno ciljna tkiva mogu da se uklone za posebna merenja pre nego što se ostaci analiziraju za apsorbovanu lešnu dozu. Leševi pojedinačnih životinja se čuvaju za analizu. Obično je dovoljna analiza ukupnog sadržaja. Ciljni organi mogu da se uklone za odvojene analize (ako su na to ukazale druge studije). Urin koji se nalazi u mokraćnoj bešici pri lišavanju života na human način, dodaje se u prethodno sakupljen urin. Posle skupljanja ekskreta iz metaboličkih kaveza u vreme lišavanja životinja života na human način, kavezi i uređaji za sakupljanje se peru odgovarajućim rastvaračem. Drugi delovi opreme koji mogu biti kontaminirani takođe se analiziraju.
1.4.10. Analize
U svim studijama treba postići odgovarajuću recovery vrednost (npr. srednju vrednost od 100% ± 10% radiaoktivnosti). Recovery vrednosti van ovih se opravdavaju. Količina primenjene doze u svakom uzorku se alizira odgovarajućim validovanim postupcima.
Statistička razmatranja uključuju meru varijacije za ponavljanja za svaku primenu.
2. PODACI
Sledeća merenja se vrše za svaku životinju, za svako vreme uzorkovanja, za ispitanu hemikaliju i/ili metabolite (uz pojedinačne podatke, podaci grupisani prema vremenu uzorkovanja prikazuju se kao srednje vrednosti):
- količina udružena sa zaštitnim napravama;
- količina koja može da se ukloni sa kože;
- količina u/na koži koja ne može da se ispere sa kože;
- količina u uzorcima krvi;
- količina u ekskretima i izdahnutom vazduhu (ako je primenljivo);
- količina koja ostane u lešu ili u organima koji su uklonjeni za odvojenu analizu.
Količina ispitivane supstance i/ili metabolita u ekskretima, izdahnutom vazduhu, krvi i lešu omogućava određivanje ukupne apsorbovane količine u svakoj vremenskoj instanci. Može se izračunati i količina ispitivane hemikalije koja je apsorbovana po cm2 izložene kože za vreme perioda ekspozicije.
3. IZVEŠTAJ
Izveštaj o ispitivanju sadrži zahteve predviđene u protokolu, uključujući opravdanost sistema za ispitivanje koji je korišćen, a sadrži i podatke o:
1) Ispitivanoj supstanci:
- podaci za identifikaciju (npr. CAS broj ako je dostupan, izvor, čistoća (radiohemijska čistoća), poznate nečistoće, broj serije);
- fizička svojstva, fizička i hemijska svojstva (npr. pH, isparljivost, rastvorljivost, stabilnost, molekulska masa i log Pow).
2) Ispitivanom preparatu:
- formulacija i opravdanost primene;
- detalji o ispitivanom preparatu, primenjena količina, postignuta koncentracija, vehikulum, stabilnost i homogenost.
3) Eksperimentalnim životinjama:
- korišćena vrsta/soj;
- broj, starost i pol životinja;
- izvor životinja, smeštaj, ishrana i itd.;
- Individualne telesne mase životinja na početku testa.
4) Uslovima ispitivanja:
- detalji primene ispitivanog preparata (mesto primene, analitičke metode, okluzija/neokluzija, zapremina, ekstrakcija, detekcija);
- detalji o kvalitetu hrane i vode.
5) Rezultatima:
- svi znaci toksičnosti;
- tabelarni podaci o apsorpciji (izraženi kao brzina, količina ili procenat);
- ukupni recovery u eksperimentu;
- tumačenje rezultata, poređenje sa raspoloživim rezultatima perkutane apsorpcije ispitivanog jedinjenja.
6) Obrazloženju rezultata.
7) Zaključcima.
4. LITERATURA
1. Testing Method B.45. Skin Absorption: In vitro Method.
2. OECD (2002). Guidance Document for the Conduct of Skin Absorption Studies. OECD, Paris.
3. ECETOC, (1993) Percutaneous Absorption. European Centre for Ecotoxicology and Toxicology of Chemicals, Monograph No 20.
4. Zendzian R.P. (1989) Skin Penetration Method suggested for Environmental Protection Agency Requirements. J. Am. Coll. Toxicol. 8(5), p. 829-835.
5. Kemppainen, B.W., Reifenrath WG (1990) Methods for skin absorption. CRC Press Boca Raton, FL, USA.
6. EPA, (1992) Dermal Exposure Assessment: Principles and Applications. Exposure Assessment Group, Office of Health and Environmental Assessment.
7. EPA, (1998) Health Effects Test Guidelines, OPPTS 870-7600, Dermal Penetration. Office of Prevention, Pedsticides and Toxic Substances.
8. Bronaugh, R.L., Wester, R.C., Bucks, D., Maibach H.I. and Sarason, R., (1990) In vivo percutaneous absorption of fragrance ingredients in reshus monkeys and humans. Fd. Chem. Toxic. 28, p. 369-373.
9. Feldman, R.J. and Maibach, H.I., (1970) Absorption of some organic compounds through the skin in man. J. Invest Dermatol. 54, p. 399-404.
Slika 1: Primer dizajna tipične naprave koja se koristi da odredi i zaštiti mesto dermalne primene za vreme in vivo studija perkutane apsorpcije.
B.45. APSORPCIJA PREKO KOŽE: IN VITRO METODA
1. METODA ISPITIVANJA
Ova metoda zasniva se na Uputstvu za ispitivanje OECD 428 (2004).
1.1. UVOD
Ova metoda je namenjena da obezbedi podatke o apsorpciji ispitivane supstance koja je primenjena na odsečak kože. Ona može da se kombinuje sa in vivo metodom za apsorpciju kroz kožu1 ili da se izvodi odvojeno. Preporučuje se da se koristi OECD vodič za izvođenje ispitivanja apsorpcije kroz kožu2 kao pomoć u dizajniranju studije zasnovane na ovoj metodi. Vodič je pripremljen da olakša izbor odgovarajućih in vitro postupaka za korišćenje u specifičnim okolnostima, da bi se obezbedila pouzdanost rezultata dobijenih ovom metodom.
Metode za merenje apsorpcije kroz kožu i dermalnog transporta mogu da se podele u dve kategorije: in vivo i in vitro. In vivo metode mogu da obezbede dobar farmakokinetički podatak o apsorpciji kroz kožu kod različitih vrsta životinja. In vivo metoda je opisana u posebnoj metodi1. In vitro metode se godinama koriste za merenje apsorpcije kroz kožu. Mada formalne validacione studije in vitro metoda koje se nalaze u ovoj metodi ispitivanja nisu izvedene, OECD eksperti su se složili 1999 godine da postoji dovoljno evaluiranih podataka koji opravdavaju in vitro metodu3. Dalji podaci koji potvrđuju ovo, uključujući i značajan broj poređenja in vivo i in vitro metoda navedeni su u vodiču2. Postoje brojne monografije koje razmatraju ovu temu i obezbeđuju detaljnu pozadinu primene in vitro metode4, 5, 6, 7, 8, 9, 10, 11, 12. In vitro metode mere difuziju hemikalija u i kroz kožu do rezervoara tečnosti i mogu da koriste neživu kožu za merenje difuzije ili svežu, metabolički aktivnu kožu za istovremeno merenje difuzije i metabolizma kože. Ove metode su posebno pogodne kao skrining za poređenje transporta hemikalija u i kroz kožu iz različitih formulacija i mogu da obezbede korisne modele za procenu perkutane apsorpcije kod ljudi.
In vitro metoda nije primenjiva u svim situacijama i za sve klase hemikalija. Moguće je koristiti in vitro metodu ispitivanja za inicijalnu kvalitativnu evaluaciju penetracije kroz kožu. U određenim slučajevima može biti neophodno da se ovo isprati podacima dobijenim u in vivo ispitivanjima. Pogledati vodič2 za razjašnjenje situacija u kojima bi in vitro metoda bila pogodna. Dodatni detaljni podaci obezbeđeni su u literaturi3.
Ova metoda prikazuje opšte principe za merenje dermalne apsorpcije i transporta ispitivane supstance uz upotrebu isečka kože. Može da se koristi koža mnogih vrsta sisara uključujući i ljudsku. Karakteristika permeabilnosti kože se zadržava i posle isecanja zato što je glavna difuziona barijera mrtvi stratum corneum, a aktivni transport hemikalija kroz kožu nije do sada identifikovan. Za kožu je pokazano da može da metaboliše neke hemikalije tokom perkutane apsorpcije6, ali ovaj proces nije ograničavajući u smislu apsorbovane doze, mada može da utiče na prirodu materijala koji ulazi u cirkulaciju.
1.2. DEFINICIJE
Neapsorbovana doza jeste doza koja je isprana sa površine kože posle ekspozicije i deo koji je prisutan na neokluzivnom pokrivaču, uključujući i dozu za koju je pokazano da je isparila sa kože tokom ekspozicije.
Apsorbovana doza (in vivo) jeste količina ispitivane supstance koja je dospela u prijemnu tečnost ili sistemsku cirkulaciju tokom navedenog vremenskog perioda.
Apsorbabilna doza jeste doza na ili u koži posle ispiranja.
1.3. PRINCIP METODE
Ispitivana supstanca, najbolje radioaktivno obeležena, primenjuje se na površinu uzorka kože koja razdvaja dve komore difuzione ćelije. Hemikalija ostaje na koži određeno vreme sa kožom pod određenim uslovima, pre uklanjanja odgovarajućim postupkom čišćenja. Uzorci prijemne tečnosti se uzimaju u određenim vremenskim instancama tokom eksperimenta i analiziraju se na ispitivanu hemikaliju i/ili metabolite.
Kada se koriste metabolički aktivni sistemi, mogu da se analiziraju metaboliti ispitivane hemikalije pomoću odgovarajućih metoda. Na kraju eksperimenta kvantifikuje se distribucija ispitivane hemikalije i njenih metabolita kada to odgovara.
Koristeći odgovarajuće uslove, koji su opisani u ovoj metodi i u vodiču2, apsorpcija ispitivane supstance tokom datog perioda se meri analizom prijemne tečnosti i tretirane kože. Ispitivana supstanca koja ostaje u koži smatra se apsorbovanom, osim ako može da se pokaže da apsorpcija može da se odredi samo iz vrednosti u prijemnoj tečnosti. Analiza drugih komponenti (materijal ispran sa kože i onaj koji je ostao u slojevima kože) omogućuje dalju evaluaciju podataka, uključujući ukupnu dispoziciju supstance i recovery u procentima.
Da bi pokazali mogućnosti i pouzdanost test sistema u laboratoriji u kojoj se izvodi ispitivanje, rezultati za relevantne referentne hemikalije treba da budu dostupni i da budu u skladu sa podacima datim u literaturi za metodu koja se koristi. Ovaj zahtev može da se ispuni ispitivanjem odgovarajuće referentne supstance (poželjno je da lipofilnost bude bliska lipofilnosti ispitivane supstance), istovremeno sa ispitivanom supstancom ili obezbeđivanjem odgovarajućih istorijskih podataka o većem broju referntnih supstanci različite lipofilnosti (nrp. kofein, benzoeva kiselina i testosteron).