1.4. OPIS METODE
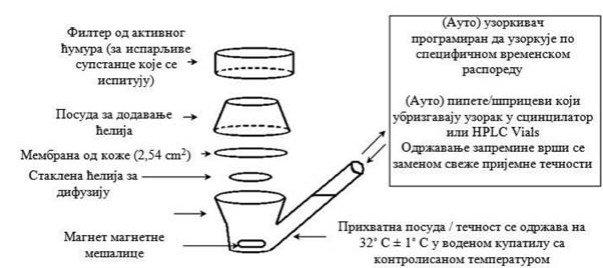
1.4.1. Difuziona ćelija
Difuziona ćelija se sastoji od donorske komore i prijemne komore između kojih se postavlja koža (primer tipičnog dizajna je dat na Slici 1). Ćelije treba da obezbede dobro zaptivanje oko kože, omoguće jednostavno uzorkovanje i dobro mešanje prijemnog rastvora u kontaktu sa donjom stranom kože kao i dobru kontrolu temperature ćelije i njenog sadržaja. Statične i protočne difuzione ćelije su jednako prihvatljive.
Obično se donorske ćelije ostavljaju neokludirana za vreme ekspozicije određenoj dozi ispitivanog preparata. Za neodređene aplikacije i pojedina scenarija za određene doze, donorske komore mogu da se okludiraju.
1.4.2. Prijemna tečnost
Preporučuje se korišćenje fiziološki pogodne prijemne tečnosti, mada mogu da se koriste i druge ako je to opravdano. Navodi se precizni sastav prijemne tečnosti. Pokazuje se odgovarajuća rastvorljivost ispitivane hemikalije u prijemnoj tečnosti tako da tečnost ne predstavlja barijeru za apsorpciju. Uz to, prijemna tečnost ne treba da utiče na integritet preparata kože. U protočnom sistemu brzina protoka ne sme da utiče na difuziju ispitivane supstance u prijemnu tečnost. U statičnom ćelijskom sistemu, prijemna tečnost se neprekidno meša i redovno uzorkuje. Ako se ispituje metabolizam, prijemna tečnost obezbeđuje da koža ostane živa tokom celokupnog eksperimenta.
1.4.3. Preparati kože
Može da se koristi koža ljudi ili životinja. Poznato je da je korišćenje ljudske kože predmet domaćih i međunarodnih etičkih razmatranja i uslovljavanja. Mada je živa koža bolja, neživa koža može da se koristi ako može da se pokaže integritet kože. Prihvatljive su epidermalne membrane (enzimski, toplotno ili hemijski odvojene), ili odvojeni slojevi kože (obično debljine 200-400 µm) pripremljeni sa dermatomom. Puna debljina kože može da se koristi ali prekomerna debljina (približno više od 1 mm) se izbegava osim u slučaju specifičnog zahteva da se odredi ispitivana hemikalija u slojevima kože. Izbor vrste, anatomskog mesta i tehnika pripreme se opravdava. Potrebni su prihvatljivi podaci od najmanje četiri ponavljanja po ispitivanom preparatu.
1.4.4. Integritet preparata kože
Suštinsko je da se koža dobro pripremi. Neodgovarajuće rukovanje može da ima za posledicu oštećenje stratus corneuma i zbog toga integritet pripremljene kože se proverava. Kada se ispituje metabolizam kože, svež isečak kože se koristi što je pre moguće u uslovima za koje se zna da održavaju metabolizam kože. Kao opšte pravilo, svež isečak kože se koristi u okviru 24 sata, ali prihvatljiv period čuvanja može da varira zavisno od enzimskog sistema koji je uključen u metabolizam i temperature čuvanja13. Kada se preparati kože čuvaju pre upotrebe, mora da postoji dokaz da je funkcija barijere očuvana.
1.4.5. Ispitivana supstanca
Ispitivana supstanca je entitet čije se penetracione karakteristike ispituju. Idealno, ispitivana supstanca je radioaktivno obeležena.
1.4.6. Ispitivani preparat
Preparat ispitivane supstance (npr. čista, razblažena ili formulisani materijal koji sadrži ispitivanu hemikaliju koja se primenjuje na kožu), je jednak (ili realna zamena) kao onaj kojem će biti eksponirani ljudi ili druga moguća ciljna vrsta. Svaka varijacija od preparata u upotrebi se opravdava.
1.4.7. Koncentracije ispitivane supstance i formulacije
Obično se više od jedne koncentracije ispitivane supstance koristi odražavajući gornju ili potencijalnu ekspoziciju ljudi. Razmatra se ispitivanje različitih tipičnih formulacija.
1.4.8. Primena na kožu
U uobičajenim uslovima ljudske ekspozicije hemikalijama sreću se određene doze. Količina koja se primenjuje imitira moguću ekspoziciju kod ljudi, tipično 1 mg/cm2 do 5 mg/cm2 kože za čvrste ili 10 µl/cm2 za tečnosti.
Količine se opravdavaju očekivanim uslovima primene, ciljevima studije ili fizičkim svojstvima ispitivanog preparata. Na primer, primene na površinu kože mogu biti neodređene u slučajevima gde se nanose velike zapremine po jedinici površine.
1.4.9. Temperatura
Na pasivnu difuziju hemikalija (i apsorpciju kroz kožu) utiče temperatura. Difuziona komora i koža se održavaju na konstantnoj temperaturi koja je bliska temperaturi kože od 32° C ± 1° C. Različiti dizajn ćelija ima različite uslove vodenog kupatila ili temperaturnog bloka za obezbeđivanje održavanja temperature prijemnika i kože u fiziološkim granicama. Vlažnost je između 30% i 70%.
1.4.10. Trajanje ekspozicije i uzorkovanje
Ekspozicija kože ispitivanom preparatu može biti tokom celokupnog eksperimenta ili kraćeg perioda (tj. da bi se imitirala specifična vrsta ekspozicije ljudi). Koža se ispere od viška ispitivanog preparata odgovarajućim sredstvom za čišćenje, a ispirak se sakupi za analizu. Postupak uklanjanja ispitivanog preparata zavisi od očekivanog uslova kod primene i opravdava se. Period uzorkovanja od 24 sata je uobičajen da bi se obezbedila adekvatna karakterizacija profila apsorpcije. S obzirom da se integritet kože posle 24 sata narušava, vremena uzorkovanja ne treba da budu duža od 24 sata. Za ispitivane supstance koje prodiru u kožu brzo, ovo možda nije neophodno, ali za supstance koje prodiru sporo može da bude potrebno duže vreme. Učestalost uzimanja uzoraka prijemne tečnosti obezbeđuje grafičko prikazivanje apsorpcionog profila ispitivane supstance.
1.4.11. Završni postupci
Svi delovi ispitivanog sistema se analiziraju i određuje se recovery. Ovo uključuje donorsku komoru, ispirak površine kože, preparat kože i prijemnu tečnost/komoru. U nekim slučajevima koža može da se razdvoji na izloženi deo i deo kože ispod ćelijskog oboda i na stratum corneum, epidermis i dermis radi zasebnih analiza.
1.4.12. Analiza
U svim studijama treba postići odgovarajući recovery (npr. 100% ± 10% radiaoktivnosti i svako odstupanje se opravdava). Količina ispitivane supstance u prijemnoj tečnosti, preparatu kože, ispicima površine kože i ispirak aparature se analiziraju korišćenjem odgovarajuće tehnike.
2. PODACI
Navode se: analiza prijemne tečnosti, distribucija ispitivane hemikalije u test sistemu i apsorpcioni profil u vremenu. Kada se koriste uslovi određene doze, izračunava se: količina isprana sa kože, količina združena sa kožom (i u različitim slojevima kože, ako se analizira) i količina prisutna u prijemnoj tečnosti (brzina, i količina ili procenat od primenjene doze). Apsorpcija kroz kožu može ponekad da se izrazi korišćenjem podataka dobijenih samo analizom prijemne tečnosti. Kada ispitivana supstanca ostane u koži na kraju studije, može da bude potrebno da se ta količina uključi u ukupnu apsorbovanu količinu (videti literaturu3). Kada se u ekspoziciji koriste uslovi neodređene doze, podaci će omogućiti izračunavanje konstante permeabilnosti (u daljem tekstu: Kp). Pod ovim uslovima, procenat koji je apsorbovan nije relevantan.
3. IZVEŠTAJ
Izveštaj o ispitivanju sadrži zahteve navedene u protokolu uključujući opravdanost sistema za testiranje koji je korišćen, a sadrži i podatke o:
1) Ispitivanoj supstanci:
- fizička svojstva, fizička i hemijska svojstva (najmanje molekulska masa i log Pow), čistoća (radiohemijska čistoća);
- podaci o identifikaciji (npr. broj serije);
- rastvorljivost u prijemnoj tečnosti.
2) Ispitivanom preparatu:
- formulacija i opravdanost primene;
- homogenost.
3) Uslovima ispitivanja:
- izvori i predeo kože, metod pripreme, uslovi čuvanja pre upotrebe, pretretman (čišćenje, tretman antibioticima, itd.), merenja integriteta kože, metabolički status, opravdanost upotrebe;
- dizajn ćelije, sastav prijemne tečnosti, brzina protoka prijemne tečnosti ili vremena uzorkovanja i postupci;
- detalji primene ispitivanog preparata i kvantifikacija primenjene doze;
- trajanje ekspozicije;
- detalji uklanjanja ispitivanog preparata sa kože, tj. ispiranje kože;
- detalji analize kože i tehnika frakcionisanja koje su korišćene da pokažu distribuciju u koži;
- postupci za pranje ćelija i opreme;
- metode za analizu, tehnike ekstrakcije, limiti detekcije i validacija analitičke metode.
4) Rezultatima:
- ukupan recovery eksperimenta (primenjena doza = ispirci kože + koža + prijemna tečnost + ispirci ćelija);
- tabeliranje individualnih recovery vrednosti ćelija za svaki kompartman;
- apsorpcioni profil;
- tabelirani podaci o apsorpciji (izraženi kao brzina, količina ili procenat).
5) Obrazloženju rezultata.
6) Zaključcima.
4. LITERATURA
1. Testing Method B.44. Skin Absorption: In vivo Method.
2. OECD, (2002) Guidance Document for the Conduct of Skin Absorption Studies. OECD, Paris.
3. OECD, (2000) Report of the Meeting of the OECD Extended Steering Committee for Percutaneous Absorption Testing, Annex 1 to ENV/JM/TG(2000)5. OECD, Paris.
4. Kemppainen B.W. and Reifenrath W.G., (1990) Methods for skin absorption. CRC Press, Boca Raton.
5. Bronaugh R.L. and Collier, S.W., (1991) Protocol for In vitro Percutaneous Absorption Studies, in In vitro Percutaneous Absorption: Principles, Fundamentals and Applications, RL Bronaugh and HI Maibach, Eds., CRC Press, Boca Raton, p. 237-241.
6. Bronaugh R.L. and Maibach H.I., (1991) In vitro Percutaneous Absorption: Principles, Fundamentals and Applications. CRC Press, Boca Raton.
7. European Centre for Ecotoxicology and Toxicology of Chemicals, (1993) Monograph No 20, Percutaneous Absorption, ECETOC, Brussels.
8. Diembeck W, Beck H, Benech-Kieffer F, Courtellemont P, Dupuis J, Lovell W, Paye M, Spengler J, Steiling W., (1999) Test Guidelines for In vitro Assessment of Dermal Absorption and Percutaneous Penetration of Cosmetic Ingredients, Fd Chem Tox, 37, p. 191-205.
9. Recommended Protocol for In vitro Percutaneous Absorption Rate Studies (1996). US Federal Register, Vol. 61, No 65.
10. Howes, D., Guy, R., Hadgraft, J., Heylings, J.R. et al. (1996). Methods for assessing Percutaneous absorption. ECVAM Workshop Report ATLA 24, 81 R10.
11. Schaefer, H. and Redelmeier, T.E., (1996). Skin barrier: principles of percutaneous absorption. Karger, Basel. (12) Roberts, M.S. and Walters, K.A., (1998). Dermal absorption and toxicity assessment. Marcel Dekker, New York.
13. Jewell, C., Heylings, J.R., Clowes, H.M. and Williams, F.M. (2000). Percutaneous absorption and metabolism of dinitrochlorobenzene in vitro. Arch Toxicol 74, p. 356-365.
Slika 1: Primer tipičnog dizajna stičke difuzione ćelije za in vitro studije perkutane apsorpcije.

V.46. IN VITRO IRITACIJA KOŽE: ISPITIVANJE NA MODELU REKONSTRUISANOG HUMANOG EPIDERMA
Deo prvi
1. METODA ISPITIVANJA
1.1. UVOD
Iritacija kože jeste izazivanje reverzibilnog oštećenja kože nakon primene ispitivane supstance u trajanju do najviše 4 sata (prema definiciji datoj u Globalno harmonizovanom sistemu za klasifikaciju i obeležavanje hemikalija (u daljem tekstu: GHS) Ujedinjenih nacija (u daljem tekstu: UN), u daljem tekstu: UN GHS)1. Ova metoda ispitivanja predviđa in vitro postupak koji u zavisnosti od zahtevanih podataka omogućava da se iritativno delovanje supstanci na kožu odredi nezavisnom zamenom za ispitivanje u okviru strategije ispitivanja, u skladu sa pristupom procene kvaliteta podataka2.
Procena iritacije kože do sada je uglavnom zahtevala korišćenje laboratorijskih životinja (videti metodu ispitivanja V.4. koja je data u ovom pravilniku)3. Vodeći računa o dobrobiti životinja metoda ispitivanja V.4. omogućava da se kod određivanja korozivnosti/iritacije kože primeni strategija višestepenog ispitivanja i koriste validirane metode in vitro i ex vivo, kako bi se izbegli bol i patnja životinja. Za ispitivanje korozivnosti u okviru strategije višestepenog ispitivanja iz metode V.4. korisne su tri validirane in vitro metode ispitivanja, odnosno smernice - V.40. in vitro ispitivanje korozivnog oštećenja kože: ispitivanje transkutanog električnog otpora (TER), V.40.bis. in vitro korozivno oštećenje kože: ispitivanje na modelu humane kože i metoda OECD: 4354,5,6.
Ova metoda ispitivanja zasniva se na modelima rekonstruisanog humanog epiderma koji u potpunosti (korišćenje keratinocita iz humanog epiderma kao izvora ćelija, reprezentativnog tkiva i citoarhitektura) imaju veoma slična biohemijska i fiziološka svojstva kao gornji delovi humane kože tj. epiderma. Postupak opisan u okviru ove metode ispitivanja omogućava da se utvrdi opasnost od iritativnih supstanci u skladu sa kategorijom 2 UN GHS.
Ova metoda ispitivanja obuhvata i niz referentnih standarda koji se koriste za procenu sličnih i modifikovanih metoda ispitivanja na osnovu rekonstruisanog humanog epiderma7.
Za dve in vitro metode ispitivanja8,9,10,11,12,13,14,15,16,17 u kojima se koriste modeli rekonstruisanog humanog epiderma, koji su dostupni na tržištu kao EpiSkinTM i EpiDermTM, završene su studije predvalidacije, optimizacije i validacije. Gore pomenuta literatura zasniva se na obeležavanju R 38. Za potrebe GHS obrađeni su i određeni aspekti preračunavanja25. Metode čije karakteristike odgovaraju metodi ispitivanja EpiSkinTM (validirana referentna metoda 1) preporučuju se kao nezavisna zamena za ispitivanje za in vivo ispitivanje na kunićima za potrebe klasifikacije iritativnih supstanci u kategoriju 2 GHS. Metode čije su karakteristike jednake sa metodom EpiDermTM (validirana referentna metoda 2), u odnosu na klasifikaciju iritativnih supstanci u kategoriju 2 GHS preporučuju se samo kao skrining test ili kao deo strategije višestepenog ispitivanja u okviru pristupa procene kvaliteta podataka. Da bi se predloženo in vitro ispitivanje iritacije kože na modelu rekonstruisanog humanog epiderma moglo koristiti u svrhu sprovođenja propisa, potrebno je odrediti njegovu pouzdanost, relevantnost (tačnost) i ograničenja u odnosu na predloženi način korišćenja i uporediti ga sa validiranom referentnom metodom 1, u skladu sa standardima izvođenja utvrđenim u ovoj metodi ispitivanja (videti Dodatak koji je dat u ovoj metodi).
Još dve in vitro metode ispitivanja na modelu rekonstruisanog humanog epiderma validirana su u skladu sa zahtevima ove metode ispitivanja i daju slične rezultate kao validirana referentna metoda 118. To su modifikovane metode ispitivanja EpiDermTM (varijanta referentne metode 2) i metode ispitivanja SkinEthic RHETM ("me-too" metoda 1).
1.2. DEFINICIJE
Pojedini izrazi upotrebljeni u ovoj metodi ispitivanja imaju sledeće značenje:
Tačnost jeste stepen ujednačenosti između rezultata metode ispitivanja i prihvaćenih referentnih vrednosti. Ona je merilo radnih karakteristika metode ispitivanja i jedan od aspekata relevantnosti. Ovaj termin se često koristi u istom značenju kao termin "usklađenost" kako bi se označio udeo tačnih rezultata metode ispitivanja.
Supstanca za kontrolu lota jeste referentna supstanca kod koje ćelije tkiva pokazuju srednji stepen vijabilnosti.
Vijabilnost ćelija jeste parametar za merenje ukupne aktivnosti populacije ćelija, npr. sposobnost ćelijskih mitohondrijalnih dehidrogenaza da redukuju vitalnu boju MTT (3 - (4,5 - dimetiltiazol-2-il) - 2,5 - difeniltetrazolijum bromid, tiazolil plavo;), koji je, u zavisnosti od efekta koji se meri i postavke ispitivanja, u korelaciji sa ukupnim brojem i/ili vitalnošću živih ćelija.
ET50 jeste vreme izlaganja u kojem se vijabilnost ćelija smanjuje za 50% nakon primene marker supstance u unapred određenoj fiksnoj koncentraciji, videti takođe IC50.
Udeo lažno negativnih jeste udeo svih pozitivnih supstanci koje su metodom ispitivanja pogrešno identifikovane kao negativne. Ona je jedan od pokazatelja radnih karakteristika metode ispitivanja.
Udeo lažno pozitivnih jeste udeo svih negativnih (neaktivnih) supstanci koje su metodom ispitivanja pogrešno identifikovane kao pozitivne. Ona je jedan od pokazatelja radnih karakteristika metode ispitivanja.
Beskonačna doza jeste količina ispitivane supstance nanesena na kožu koja prelazi količinu koja je potrebna da se potpuno i ravnomerno prekrije površina kože.
Globalno harmonizovani sistem za klasifikaciju i obeležavanje hemikalija (u daljem tekstu: GHS) jeste sistem koji predlaže klasifikaciju hemikalija (supstanci i smeša) prema standardizovanim vrstama i nivoima fizičkih opasnosti i opasnosti po zdravlje ljudi i životnu sredinu, koji obuhvata i odgovarajuće elemente komunikacije kao što su piktogrami, reči upozorenja, obaveštenja o opasnosti, obaveštenja o merama predostrožnosti i bezbednosni listovi, da bi se prenela informacija o njihovim štetnim efektima sa ciljem da se zaštiti zdravlje ljudi (uključujući poslodavce, radnike, prevoznike, potrošače i pružaoce pomoći u vanrednim situacijama) i životna sredina1, a koji je transponovan u domaće zakonodavstvo pravilnikom kojim se uređuju klasifikacija, pakovanje i obeležavanje hemikalija u skladu sa Globalno harmonizovanim sistemom za klasifikaciju i obeležavanje UN.
IC50 jeste koncentracija pri kojoj marker supstanca smanjuje vijabilnost tkiva za 50% (IC50) nakon fiksnog vremena izlaganja, videti takođe ET50.
Standardi izvođenja jesu standardi na osnovu validirane referentne metode koji čine osnovu za ocenjivanje uporedivosti predložene metode ispitivanja koja je po mehanizmu i funkcionalno slična proverenoj referentnoj metodi. Oni obuhvataju: 1) važne elemente metode ispitivanja, 2) minimalni spisak referentnih supstanci izabranih među supstancama koje su korišćene za dokazivanje prihvatljivih karakteristika validirane referentne metode i 3) uporedive nivoe tačnosti i pouzdanosti koje pokazuje predložena metoda ispitivanja kod ocenjivanja primenom minimalnog spiska referentnih supstanci u odnosu na validiranu referentnu metodu.
Pouzdanost pokazuje u kojoj meri metoda ispitivanja može ponovo da se primeni unutar jedne laboratorije i između više laboratorija u određenom vremenu uz primenu iste procedure. Ona se ocenjuje izračunavanjem ponovljivosti unutar jedne laboratorije i između više laboratorija.
Osetljivost jeste udeo svih pozitivnih/aktivnih supstanci koje su pravilno klasifikovane primenom ispitivanja. To je mera tačnosti metode ispitivanja koja daje precizne rezultate po kategorijama i predstavlja važan faktor za ocenu relevantnosti metode ispitivanja.
Specifičnost jeste udeo svih negativnih/neaktivnih supstanci koje su pravilno klasifikovane primenom ispitivanja. To je mera tačnosti metode ispitivanja koja daje precizne rezultate i predstavlja važan faktor za ocenu relevantnosti metode ispitivanja.
Iritacija kože predstavlja nastanak reverzibilnog oštećenja kože nakon primene ispitivane supstance u trajanju do najviše 4 sata. Iritacija kože je lokalna neimunogena reakcija koja se javlja ubrzo nakon stimulacije24. Njena glavna karakteristika je reverzibilan proces koji uključuje inflamatorne reakcije i većinu karakterističnih kliničkih znakova iritacije (eritem, edem, svrab i bol) koji se povezuju sa upalnim procesom.
1.3. PODRUČJE PRIMENE I OGRANIČENJA
Ograničenje ispitivanja sa rekonstruisanim humanim epidermom u skladu sa ovom metodom ispitivanja sastoji se u tome što se pomoću njih supstance mogu klasifikovati samo u kategoriju 2 iritacija kože u okviru sistema UN GHS. Budući da ova ispitivanja ne omogućavaju klasifikaciju supstanci u moguću kategoriju 3 prema definiciji UN GHS, sve ostale supstance će ostati neklasifikovane (izvan kategorije). Ova metoda ispitivanja se revidira u zavisnosti od propisanih zahteva i mogućeg uključivanja novih efekata, poboljšanja ili razvoja novih alternativnih "me-too" ispitivanja.
Ova metoda ispitivanja omogućava da se utvrdi opasnost monokonstituentnih iritativnih supstanci19, ali ne pruža odgovarajuće informacije o iritaciji kože. Gasovi i aerosoli ne mogu se ispitivati, a smeše još nisu procenjene u studiji validacije.
1.4. PRINCIP ISPITIVANJA
Ispitivana supstanca se topikalno nanosi na trodimenzionalni model rekonstruisanog humanog epiderma, koji čine obični humani epidermalni keratinociti uzgojeni radi dobijanja visoko izdiferenciranog modela humanog epiderma. Sastoji se od organizovanih bazalnih, nazubljenih i zrnastih slojeva i višeslojnog rožnatog sloja (stratum corneum) koji sadrži međućelijske lamelarne masne slojeve raspoređene analogno obrascu koji se nalazi in vivo.
Princip ispitivanja na modelu rekonstruisanog humanog epiderma zasniva se na pretpostavci da iritativne supstance mogu da difuzijom prodru u rožnati sloj i da su citotoksične za ćelije u nižim slojevima. Vijabilnost ćelija meri se pretvaranjem vitalne boje MTT [3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolijum bromid, tiazolil plava; EINECS broj 206-069-5, CAS broj 298-93-1)] u plavu so formazana delovanjem dehidrogenaze, koja se kvantitativno meri nakon ekstrakcije iz tkiva20. Iritativne supstance prepoznaju se po tome što snižavaju vijabilnost ćelija ispod definisanih pragova (tj. £ 50% za kategoriju 2 iritativnih supstanci UN GHS). Supstance koje prouzrokuju vijabilnost ćelija iznad definisanog praga se ne klasifikuju (tj. > 50%, izvan kategorije).
Sistemi koji se zasnivaju na modelu rekonstruisanog humanog epiderma mogu se koristiti za ispitivanje čvrstih supstanci, tečnosti, polučvrstih supstanci i voskova. Tečnosti mogu biti vodene i bezvodne; čvrste supstance mogu biti rastvorljive ili nerastvorljive u vodi. Kad god je moguće čvrste supstance se ispituju u obliku sitnog praha. Budući da je validacijom sistema ispitivanja na modelu rekonstruisanog humanog epiderma obuhvaćeno 58 pažljivo odabranih supstanci koje predstavljaju širok spektar hemijskih klasa, očekuje se da će metode biti opšte primenjljive u svim hemijskim klasama16. Validacijom je obuhvaćeno 13 iritativnih supstanci iz kategorije 2 u skladu sa GHS. U validaciju nisu uključene kiseline koje nisu korozivne, baze, soli i druge neorganske supstance kao i neke poznate klase organskih iritativnih supstanci, kao što su hidroperoksidi, fenoli i surfaktanti, ili su uključeni samo u ograničenoj meri.
1.5. DOKAZIVANJE OSPOSOBLJENOSTI
Poželjno je da laboratorije pre rutinske primene validiranog metoda koji ispunjava zahteve ove metode ispitivanja dokažu tehničku osposobljenost na deset preporučenih supstanci koje su navedene u Tabeli 1. U okviru ove metode ispitivanja, opciona kategorija 3 UN GHS ne smatra se kategorijom. Da bi se nove istovetne ("me-too") metode ispitivanja razvijene iz ove metode ispitivanja, pošto su strukturno i funkcionalno slične validiranim referentnim metodama, kao i modifikovane validirane metode, mogle koristiti u ispitivanjima za ispunjavanje propisanih zahteva, potrebno je dokazati uporedivu pouzdanost i tačnost nove metode primenom referentnih standarda navedenih u Dodatku koji je dat u Delu drugom ove metode.
Tabela 1. Supstance za proveru tehničke osposobljenosti, koje predstavljaju podskup referentnih supstanci iz Dodatka koji je dat u ovoj metodi
Supstanca |
CAS broj |
Skor in vivo |
Agregatno stanje |
Kategorija GHS |
naftalen-sirćetna kiselina |
86-87-3 |
0 |
čvrsto |
izvan kat. |
izopropanol |
67-63-0 |
0,3 |
tečno |
izvan kat. |
metil-stearat |
112-61-8 |
1 |
čvrsto |
izvan kat. |
heptil-butirat |
5870-93-9 |
1,7 |
tečno |
Opciona kat. 3 |
heksil-salicilat |
6259-76-3 |
2 |
tečno |
Opciona kat. 3 |
ciklamen-aldehid |
103-95-7 |
2,3 |
tečno |
kat. 2 |
1-bromheksan |
111-25-1 |
2,7 |
tečno |
kat. 2 |
butil-metakrilat |
97-88-1 |
3 |
tečno |
kat. 2 |
1-metil-3-fenil-1-piperazin |
5271-27-2 |
3,3 |
čvrsto |
kat. 2 |
heptanal |
111-71-7 |
4 |
tečno |
kat. 2 |
1.6. OPIS METODE
Dat je opis elemenata i postupaka u vezi sa ispitivanjem na modelu rekonstruisanog humanog epiderma za potrebe ocenjivanja iritacije kože. Model rekonstruisanog humanog epiderma može se izraditi, preparirati ili nabaviti na tržištu (npr. EpiSkinTM, EpiDermTM i SkinEthic RHETM). Standardni protokoli ispitivanja za EpiSkinTM, EpiDermTM i SkinEthic RHETM mogu se preuzeti sa interneta (http://ecvam.jrc.ec.europa.eu21,22,23). Ispitivanje se izvodi na sledeći način:
1.6.1. Elementi modela rekonstruisanog humanog epiderma
1.6.1.1. Opšti uslovi koje ispunjava model
Za izgradnju epitela koriste se normalni tipovi humanih keratinocita. Ispod funkcionalnog rožnatog sloja (stratum corneum) nalaze se višestruki slojevi vitalnih epitelnih ćelija (bazalni sloj, nazubljen sloj, zrnasti sloj). Rožnati sloj je višeslojan i sadrži esencijalni profil lipida da bi proizveo čvrstu funkcionalnu barijeru sposobnu da zaustavi brzi prodor citotoksičnih marker supstanci, npr. natrijum dodecil sulfat (SDS) ili Triton X-100. Funkcija barijere može se oceniti određivanjem koncentracije marker supstance koja smanjuje vijabilnost tkiva za 50% (IC50) nakon fiksnog vremena izlaganja ili određivanjem vremena izlaganja koje je potrebno da se vijabilnosti tkiva smanji za 50% (ET50) nakon primene marker supstance u unapred određenoj fiksnoj koncentraciji. Model mora biti dovoljno nepropustan da spreči prolazak materijala oko rožnatog sloja do vitalnog tkiva, jer bi to značilo loše modeliranje izlaganja kože. Model kože ne sme biti kontaminiran bakterijama, virusima, mikoplazmama ili gljivicama.
1.6.1.2. Funkcionalni uslovi koje ispunjava model
1.6.1.2.1. Vijabilnost
Poželjna analiza za određivanje stepena vijabilnosti je MTT ispitivanje20. Optička gustina (u daljem tekstu: OD) ekstrahovane (rastvorene) boje iz tkiva obrađivanog negativnom kontrolom (u daljem tekstu: NC) je najmanje 20 puta veća od vrednosti OD samog ekstrakcionog rastvarača. Potrebno je dokumentovati da je tkivo obrađivano negativnom kontrolom stabilno u kulturi (tj. daje slična merenja vijabilnosti) za vreme trajanja ispitivanog izlaganja.
1.6.1.2.2. Funkcija barijere
Rožnati sloj i njegov sastav lipida mora biti sposoban da zaustavi brzi prodor citotoksičnih marker supstanci, npr. SDS ili Triton X-100, procenjeno na osnovu IC50 ili ET50.
1.6.1.2.3. Morfologija
Histološki pregled rekonstruisane kože/epiderma vrše osposobljena lica, pri čemu ovaj pregled dokazuje da je struktura rekonstruisane kože/epiderma slična strukturi humane kože/epiderma (uključujući višeslojni rožnati sloj).
1.6.1.2.4. Ponovljivost
Dokazuje se da su rezultati metode kod primene određenog modela ponovljivi u vremenu, po mogućnosti pomoću odgovarajuće supstance za kontrolu lota (referentne supstance) (videti Dodatak koji je dat u ovoj metodi).
1.6.1.2.5. Kontrole kvaliteta (KK) modela
Svaka serija modela epiderma ispunjava definisane kriterijume za odobrenje proizvoda, među kojima su najvažniji vijabilnost (odeljak 1.6.1.2.1. ove metode) i funkcija barijere (odeljak 1.6.1.2.2. ove metode). Opseg prihvatljivosti (gornja i donja granica prihvatljivosti) za IC50 odnosno ET50 određuje snabdevač modela kože (ili istraživač, ako se koristi sopstveni model). Svojstvo barijere tkiva proverava laboratorija po prijemu tkiva. Za pouzdano predviđanje iritativnih efekata prihvatljivi su isključivo rezultati dobijeni sa tkivima koja ispunjavaju zadate kriterijume. Kao primer u daljem tekstu navedeni su opsezi prihvatljivosti za validirane referentne metode.
Tabela 2. Primeri kriterijuma za odobrenje lota u okviru kontrole kvaliteta
|
Donja granica prihvatljivosti |
Srednja vrednost područja |
Gornja granica prihvatljivosti |
Validirana referentna metoda 1 (18-časovna obrada SDS-om) |
IC50 = 1,0 mg/ml |
IC50 = 2,32 mg/ml |
IC50 = 3,0 mg/ml |
Validirana referentna metoda 2 (1% triton X-100) |
ET50 = 4,8 hr |
ET50 = 6,7 hr |
ET50 = 8,7 hr |
1.6.1.3. Primena ispitivanih i kontrolnih supstanci
U svakoj obradi i kontrolama upotrebljava se dovoljan broj replika tkiva (najmanje tri po ispitivanju). Bilo da se radi o tečnostima ili o čvrstim supstancama, nanosi se dovoljna količina ispitivane supstance da površina kože bude ravnomerno prekrivena, ali pazi se da se izbegne beskonačna doza (videti odeljak 1.2. ove metode), tj. najmanje 25 μL/cm2 ili 25 mg/cm2. U slučaju čvrstih supstanci površina epiderma se pre nanošenja navlaži dejonizovanom ili destilovanom vodom kako bi se obezbedilo dobro prijanjanje uz kožu. Kad god je to moguće čvrste supstance se ispituju u obliku sitnog praha. Na kraju perioda izlaganja, ispitivana supstanca se pažljivo opere sa površine kože vodenim pufer rastvorom ili 0,9%-tnom NaCl. Zavisno od modela rekonstruisanog humanog epiderma koji se koristi, period izlaganja može biti između 15 i 60 minuta, a temperatura inkubacije između 20° C i 37° C.
U svakoj studiji se paralelno koriste negativne kontrole (u daljem tekstu: NC) i pozitivne kontrole (u daljem tekstu: PC) kako bi se dokazalo da se vijabilnost (NC), funkcija barijere i rezultujuća osetljivost tkiva (PC) kreću u okvirima opsega prihvatljivosti ranijih ispitivanja. Predlaže se da se kao PC supstanca koristi 5%-tni vodeni rastvor SDS. Predložene NC supstance su voda ili rastvor soli puferisan fosfatom (PBS).
1.6.1.4. Merenja vijabilnosti ćelija
Najvažniji element postupka ispitivanja je da se merenja vijabilnosti ne vrše neposredno nakon izlaganja ispitivanoj supstanci, već nakon dovoljno dugog perioda inkubacije nakon obrade tokom koje se oprana tkiva drže u svežem medijumu. Ovaj period ostavlja dovoljno vremena da se tkivo oporavi od slabih iritativnih efekata, ali i da se pojave jasni znakovi citotoksičnih efekata. U fazi opitimizacije ispitivanja9,10,11,12,13 pokazalo se da je optimalni period inkubacije nakon obrade 42 sata i to je korišćeno i kod validacije referentnih metoda.
Test konverzije MTT je kvantitativni validirani metod za merenje vijabilnosti ćelija. Taj test odgovara za trodimenzionalni model tkiva. Uzorak kože se stavi u rastvor MTT odgovarajuće koncentracije (npr. 0,3 mg/mL - 1 mg/mL) i ostavi tri sata. Nataloženi plavi formazan se zatim ekstrahuje iz tkiva pomoću rastvarača (npr izopropanol, kiseli izopropanol) pa se koncentracija formazana izmeri određivanjem vrednosti OD na 570 nm uz propusnik opsega do najviše ± 30 nm.
Optička svojstva ispitivane supstance, odnosno njeno hemijsko delovanje na MTT mogu ometati analizu i dovesti do pogrešne procene vijabilnosti (budući da ispitivana supstanca može da spreči ili okrene proces nastajanja boje, ali i da ga izazove). To se može dogoditi kad se određena ispitivana supstanca ne spere u potpunosti s kože ili prodre u epiderm. Ako ispitivana supstanca direktno deluje na MTT ili je prirodno obojena ili se oboji tokom obrade tkiva, upotrebljavaju se dodatne kontrole kako bi se utvrdio i ispravio uticaj ispitivane supstance na mernu tehniku koja se koristi za merenje vijabilnosti. Detaljan opis ispitivanja direktne redukcije MTT može se naći u protokolu ispitivanja za validirane referentne metode21,22,23. Nespecifična boja (Non-specific colour - NSC) usled tih uticaja ne sme da pređe 30% NC (za ispravke). Ako je NSC > 30% smatra se da ispitivana supstanca nije odgovarajuća za ovu metodu.
1.6.1.5. Kriterijumi za prihvatanje ispitivanja
U svakom istraživanju sa dobrim serijama (videti odeljak 1.6.1.2.5. ove metode) vrednost OD tkiva obrađenih negativnom kontrolom ukazuje na kvalitet tkiva nakon što su završeni svi koraci isporuke i preuzimanja i čitav postupak u skladu s protokolom za ispitivanje iritacije. Vrednosti OD kontrola ne smeju biti ispod propisanih donjih granica. Isto tako, tkiva obrađena pozitivnom kontrolom tj. 5%-tnim vodenim rastvorom SDS pokazuju zadržanu osetljivost tkiva i sposobnost da reaguju na iritativne supstance u uslovima svakog pojedinačnog ogleda (npr. vijabilnost £ 40% za proverenu referentnu metodu 1 i £ 20% za validiranu referentnu metodu 2). Potrebno je definisati odgovarajuće mere varijabilnosti između uzoraka tkiva u ponavljanjima (npr. ako se koriste standardne devijacije, one su £ 18%).
2. PODACI I TUMAČENJE REZULTATA
2.1. PODACI
Podaci pojedinačnih uzoraka ponavljanja ispitivanja u svakoj obradi (npr. vrednosti OD i izračunati procenti vijabilnosti ćelija za svaku ispitivanu supstancu, zajedno sa klasifikacijom) prikazuju se u tabelarnom obliku, uključujući eventualne podatke iz ponovljenih ogleda. Osim toga, za svaki ogled se navode srednje vrednosti ± standardna devijacija. Za svaku ispitivanu supstancu se navode zapažene interakcije s MTT reagensom i obojenim ispitivanim supstancama.
2.2. TUMAČENJE REZULTATA
Na osnovu vrednosti OD za pojedinačne ispitivane uzorke može se izračunati procenat vijabilnosti u odnosu na NC, koja je određena kao 100%. Potrebno je jasno utvrditi i dokumentovati prelomnu vrednost procenta vijabilnosti ćelije koja se koristi za razlikovanje iritativne supstance od neklasifikovanih ispitivanih supstanci i statistički postupak ili postupke koji su korišćeni za vrednovanje rezultata i identifikaciju iritativnih supstanci i dokazati da su one odgovarajuće. Prelomne vrednosti za predviđanje iritacije u vezi s validiranim referentnim metodama:
Smatra se da je ispitivana supstanca iritativna za kožu kategorija 2 UN GHS ako je:
1) vijabilnost tkiva nakon izlaganja i inkubacije nakon obrade manja ili jednaka (≤) 50%.
Smatra se da je ispitivana supstanca van kategorije:
2) ako je vijabilnost tkiva nakon izlaganja i inkubacije nakon obrade viša od (>) 50%.
3. IZVEŠTAVANJE
3.1. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju sadrži podatke o:
1) Ispitivanim i kontrolnim supstancama:
- hemijski naziv, npr. naziv iz nomenklature IUPAC ili CAS naziv i CAS broj, ako su poznati;
- čistoća i sastav supstance (u masenom procentu/tima);
- fizička i hemijska svojstva važna za sprovođenje istraživanja (npr. agregatno stanje, stabilnost i isparljivost, pH, rastvorljivost u vodi, ako su poznati);
- obrada ispitivanih/kontrolnih supstanci pre ispitivanja, prema potrebi (npr. zagrevanje, usitnjavanje);
- uslovi skladištenja.
2) Obrazloženju modela kože i protokolu koji je primenjen.
3) Uslovima ispitivanja:
- ćelijski sistem koji je upotrebljen;
- informacije o kalibraciji mernog uređaja i talasnoj dužini koja je upotrebljena kod merenja vijabilnosti ćelija (npr. spektrofotometar);
- potpune propratne informacije o konkretnom kožnom modelu koji je korišćen, uključujući njegove performanse. To naročito uključuje podatke:
(1) vijabilnost;
(2) funkcija barijere;
(3) morfologija;
(4) ponovljivost i predvidljivost;
(5) kontrole kvaliteta (KK) modela;
- detalji postupka ispitivanja;
- doze ispitivanja, trajanje izlaganja i period inkubacije nakon obrade;
- opis mogućih izmena postupka ispitivanja;
- upućivanje na postojeće podatke o modelu; što naročito uključuje:
a) prihvatljivost podataka o kontroli kvaliteta sa upućivanjem na postojeće podatke o seriji;
b) prihvatljivost vrednosti pozitivnih i negativnih kontrola sa upućivanjem na srednje vrednosti i opsega za pozitivne i negativne kontrole,
- opis primenjenih kriterijuma vrednovanja, uključujući obrazloženje odabrane(ih) granične(ih) vrednosti modela predviđanja.
4) Rezultatima:
- tabelarni prikaz podataka za pojedinačne uzorke ispitivanja,
- opis drugih uočenih efekata.
5) Obrazloženju rezultata.
6) Zaključcima.
4. LITERATURA
1. United Nations (UN) (2007). Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Second revised edition, UN New York and Geneva, 2007. Available at: http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html.
2. REACH: Guidance on Information Requirements and Chemical Safety Assessment. Available at: http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1232447649.
3. Test Method B.4. ACUTE TOXICITY; DERMAL IRRITATION/CORROSION.
4. Test Method B.40. IN VITRO SKIN CORROSION: TRANSCUTANEOUS ELECTRICAL RESISTANCE TEST TER.
5. Test Method B.40 BIS. IN VITRO SKIN CORROSION: HUMAN SKIN MODEL TEST.
6. OECD (2006). Test Guideline 435. OECD Guideline for the Testing of Chemicals. In Vitro Membrane Barrier Test Method. Adopted July 19, 2006. Available at: http://www.oecd.org/document/22/0,2340,en_2649_34377_1916054_1_1_1_1,00.html.
7. ECVAM (2009) Performance Standards for applying human skin models to in vitro skin irritation. Available under Download Study Documents, at: http://ecvam.jrc.ec.europa.eu.
8. Fentem, J.H., Briggs, D., Chesné, C., Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Roguet, R., van de Sandt, J.J.M. & Botham, P. (2001). A prevalidation study on in vitro tests for acute skin irritation. Results and evaluation by the Management Team. Toxicology in Vitro 15, 57-93.
9. Portes, P., Grandidier, M.H., Cohen, C. & Roguet, R.(2002). Refinement of the EPISKIN protocol for the assessment of acute skin irritation of chemicals: follow-up to the ECVAM prevalidation study. Toxicology in Vitro 16, 765-770.
10. Kandárová, H., Liebsch, M., Genschow, E., Gerner, I., Traue, D., Slawik, B. & Spielmann, H. (2004). Optimisation of the EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests. ALTEX 21, 107-114.
11. Kandárová, H., Liebsch, M., Gerner, I., Schmidt, E., Genschow, E., Traue, D. & Spielmann H. (2005) The EpiDerm Test Protocol fort the Upcoming ECVAM Validation Study on In Vitro Skin Irritation Tests - An Assessment of the Performance of the Optimised Test. ATLA 33, 351-367.
12. Cotovio, J., Grandidier, M.-H., Portes, P., Roguet, R. & G. Rubinsteen. (2005). The In Vitro Acute Skin Irritation of Chemicals: Optimisation of the EPISKIN Prediction Model within the Framework of the ECVAM Validation Process. ATLA 33, 329-249.
13. Zuang, V., Balls, M., Botham, P.A., Coquette, A., Corsini, E., Curren, R.D., Elliot, G.R., Fentem, J.H., Heylings, J.R., Liebsch, M., Medina, J., Roguet, R., van De Sandt, J.J.M., Wiemann, C. & Worth, A.(2002). Follow-up to the ECVAM prevalidation study on in vitro tests for acute skin irritation. ECVAM Skin Irritation Task Force Report 2. ATLA 30,109-129.
14. Spielmann, H., Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. and Zuang, V. (2007) The ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Report on the Validity of the EPISKIN and EpiDerm Assays and on the Skin Integrity Function Test. ATLA 35, 559-601.
15. Hoffmann, S. (2006). ECVAM Skin Irritation Validation Study Phase II: Analysis of the Primary Endpoint MTT and the Secondary Endpoint IL1-α. 135 pp. + annexes. Available under Download Study Documents, at: http://ecvam.jrc.ec.europa.eu.
16. Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. & Zuang. V (2007) ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Selection of Test Chemicals. ATLA 35, 603-619.
17. J. Cotovio, M.-H. Grandidier, D. Lelièvre, R. Roguet, E. Tinois-Tessonneaud, J. Leclaire (2007). In vitro acute skin irritancy of chemicals using the validated EPISKIN model in a tiered strategy - Results and performances with 184 cosmetic ingredients, AATEX, Special Issue-proceedings from WC6. Vol.14, 351-358.
18. ESAC statement on updated EpiDerm and similar SkinEthic assays. 5 November 2008.
19. EC (2006). Regulation (EC) No 1907/2006 of the European Parliament and of the Council of 18 December 2006 concerning the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH), establishing a European Chemicals Agency, amending Directive 1999/45/EC and repealing Council Regulation (EEC) No 793/93 and Commission Regulation (EC) No 1488/94 as well as Council Directive 76/769/EEC and Commission Directives 91/155/EEC, 93/67/EEC, 93/105/EC and 2000/21/EC. Official Journal of the European Union L 396 of 30 December 2006, p. 1. OPOCE, Luxembourg.
20. Mosman, T. (1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods 65, 55-63.
21. EpiSkinTM SOP, Version 1.6 (January 2005). Validation of the EpiSkin Skin Irritation Test - 42 Hours Assay For The Prediction of Acute Skin Irritation of Chemicals. Available under Download Study Documents, at: http://ecvam.jrc.ec.europa.eu.
22. EpiDermTM SOP, Version 5.0 (October 2004). Draft Standard Operating Procedure. In Vitro Skin Irritation Test: Human Skin Model. Model: EpiDerm™- 200. Available under Download Study Documents, at: http://ecvam.jrc.ec.europa.eu.
23. SkinEthic RHETM SOP. Will be available under Download Study Documents, at: http://ecvam.jrc.ec.europa.eu.
24. Harvell, J.D., Lammintausta, K., Maibach H.I. (1995) Irritant contact dermatitis IN: Guin J.D. Practical Contact Dermatitis Mc Graw-Hill New York, pp 7-18
25. Griesinger C, Barroso J & Zuang V: ECVAM background document on the recent adaptations of the ECVAM performance standards for in vitro skin irritation testing in the context of the drafting process of an EU test method and an OECD draft test guideline. Ispra, November 13, 2008.
Deo drugi
DODATAK
Procena karakteristika predloženih in vitro modela rekonstruisanog humanog epiderma za ispitivanje iritacije kože
UVOD
Predloženi postupci u okviru ove metode ispitivanja se evaluiraju kako bi se odredila njihova pouzdanost i tačnost, koristeći supstance koje predstavljaju čitav opseg skora iritacije prema Drajzeu. Kod evaluacije predloženih postupaka korišćenjem 20 preporučenih referentnih supstanci (Tabela 2. ove metode) dobijaju se vrednosti pouzdanosti i tačnosti koje su uporedive sa vrednostima validirane referentne metode 1 (Tabela 3. ove metode)1. Standardi tačnosti i pouzdanosti se ispunjavaju dati su u tačkama (II) i (III) u daljem tekstu. Obuhvaćene su neklasifikovane i klasifikovane supstance (kategorija 2 UN GHS) koje predstavljaju relevantne hemijske klase, tako da se pouzdanost i karakteristike (osetljivost, specifičnost, udeo lažno negativnih, udeo lažno pozitivnih i tačnost) predložene metode ispitivanja mogu uporediti sa odgovarajućim vrednostima validirane referentne metode 1. Pre nego što se metoda ispitivanja upotrebi za ispitivanje novih supstanci određuje se njena pouzdanost kao i sposobnost da tačno identifikuje iritativne supstance kategorije 2 UN GHS.
STANDARDI IZVOĐENJA
Standardi izvođenja obuhvataju tri elementa: I) bitne elemente metode ispitivanja, II) referentne supstance i III) definisane vrednosti tačnosti i pouzdanosti2. Ovi referentni standardi zasnivaju se na standardima izvođenja koji su definisani po završetku validacione studije iritacije kože Evropskog centra za validaciju alternativnih metoda (ECVAM)3.
I. Bitni elementi metode ispitivanja
Opšti uslovi koje ispunjava model
Za izgradnju epitela koristi se normalan tip humanih keratinocita. Ispod funkcionalnog rožnatog sloja (stratum corneum) nalaze se višestruki slojevi vitalnih epitelnih ćelija (bazalni sloj, nazubljen sloj, zrnasti sloj). Rožnati sloj je višeslojan i sadrži esencijalni profil lipida da bi proizveo čvrstu funkcionalnu barijeru sposobnu da zaustavi brzi prodor citotoksičnih marker supstanci, npr. SDS ili Triton X-100. Funkcija barijere može se oceniti određivanjem koncentracije marker supstance koja smanjuje vijabilnost tkiva za 50% (IC50) nakon fiksnog vremena izlaganja ili određivanjem vremena izlaganja koje je potrebno da se vijabilnosti tkiva smanji za 50% (ET50) nakon primene marker supstance u unapred određenoj fiksnoj koncentraciji. Model mora biti dovoljno nepropustan da spreči prolazak materijala oko rožnatog sloja do vitalnog tkiva, jer bi to značilo loše modeliranje izlaganja kože. Model kože ne sme da bude kontaminiran bakterijama, virusima, mikoplazmama ili gljivicama.
Funkcionalni uslovi koje ispunjava model
Vijabilnost
Poželjna analiza za određivanje stepena vijabilnosti je MTT test4. OD ekstrahovane (rastvorene) boje iz tkiva obrađivanog negativnom kontrolom (NC) je najmanje 20 puta veća od vrednosti OD samog ekstrakcionog rastvarača. Potrebno je dokumentovati da je tkivo obrađivano negativnom kontrolom stabilno u kulturi (tj. daje slična merenja vijabilnosti) za vreme trajanja ispitnog izlaganja.
Funkcija barijere
Rožnati sloj i njegov sastav lipida mora biti sposoban da zaustavi brzi prodor citotoksičnih marker supstanci, npr SDS ili Triton X-100, procenjeno na osnovu IC50 ili ET50.
Morfologija
Histološki pregled rekonstruisane kože/epiderma vrši odgovarajuće osposobljeno osoblje, pri čemu dokazuje da je njena struktura slična strukturi humane kože/epiderma (uključujući višeslojni rožnati sloj).
Ponovljivost
Dokazuje se da su rezultati metoda kod primene određenog modela reproducibilni u vremenu, po mogućstvu pomoću odgovarajuće supstance za kontrolu šarže (referentne supstance) (videti definicije date u odeljku 1.2. ove metode).
Kontrole kvaliteta (KK) modela
Svaka serija modela epiderma ispunjava definisane kriterijume za odobrenje proizvoda, među kojima su najvažniji vijabilnost i funkcija barijere. Opseg prihvatljivosti (gornja i donja granica prihvatljivosti) za IC50 odnosno ET50 određuje snabdevač modela kože (ili istraživač, ako se koristi sopstveni model). Svojstvo barijere tkiva proverava laboratorija po prijemu tkiva. Za pouzdano predviđanje iritativnih efekata prihvatljivi su isključivo rezultati dobijeni sa tkivima koja ispunjavaju zadate kriterijume. Kao primer, navedeni su opsezi prihvatljivosti za validirane referentne metode.
Tabela 1. Primeri kriterijuma za odobrenje lota u okviru kontrole kvaliteta
|
Donja granica |
Srednja vrednost |
Gornja |
Validirana referentna metoda 1 (18-časovno tretiranje SDS-om) |
IC50 = 1,0 mg/ml |
IC50 = 2,32 mg/ml |
IC50 = 3,0 mg/ml |
Validirana referentna metoda 2 (1% triton X-100) |
ET50 = 4,8 hr |
ET50 = 6,7 hr |
ET50 = 8,7 hr |
II. Referentne supstance
Referentne supstance koriste se da se utvrdi da li je pouzdanost i tačnost predložene nove in vitro metode ispitivanja sa rekonstruisanim humanim epidermom, a za koju je dokazano da je strukturno i funkcionalno dovoljno slična validiranoj referentnoj metodi, ili predstavlja neznatno modifikovanu varijantu validirane referentne metode, uporediva sa pouzdanošću i tačnošću validirane referentne metode 11. Dvadeset referentnih supstanci datih u Tabeli 2. obuhvataju supstance iz različitih relevantnih hemijskih klasa kao i supstance iz kategorije 2 UN GHS. Lista sadrži 10 supstanci iz kategorije 2 UN GHS, 3 supstance iz opcione kategorije 3 UN GHS i 7 neklasifikovanih supstanci. U okviru ove metode ispitivanja, opciona kategorija 3. ne smatra se kategorijom. Ove referentne supstance predstavljaju minimalni broj supstanci koji se koristi kod ocenjivanja tačnosti i pouzdanosti predložene metode ispitivanja iritacije kože na modelu rekonstruisanog humanog epiderma. U slučajevima kad supstanca sa liste nije dostupna, mogu se koristiti i druge supstance za koje su dostupni odgovarajući referentni podaci in vivo. Ovoj listi referentnih supstanci po želji se mogu dodati još neke supstance koje predstavljaju druge hemijske klase i za koje su dostupni odgovarajući referentni podaci in vivo, kako bi se dodatno evaluirala tačnost predložene metode ispitivanja.
Tabela 2. Referentne supstance za određivanje tačnosti i pouzdanosti modela rekonstruisanih humanih epiderma koji se koriste kod ispitivanja iritacije kože
Supstanca * |
CAS br. |
EINECS br. |
Agregatno stanje |
Rezultat ocenjivanja in vivo |
Kat. GHS in vitro |
Kat. GHS in vivo |
1-brom-4-hlorbutan |
6940-78-9 |
230-089-3 |
tečno |
0 |
kat. 2 |
izvan kat. |
dietil-ftalat |
84-66-2 |
201-550-6 |
tečno |
0 |
izvan kat. |
izvan kat. |
naftalen-sirćetna kiselina |
86-87-3 |
201-705-8 |
čvrsto |
0 |
izvan kat. |
izvan kat. |
alil-fenoksiacetat |
7493-74-5 |
231-335-2 |
tečno |
0,3 |
izvan kat. |
izvan kat. |
izopropanol |
67-63-0 |
200-661-7 |
tečno |
0,3 |
izvan kat. |
izvan kat. |
4-metiltiobenzaldehid |
3446-89-7 |
222-365-7 |
tečno |
1 |
kat. 2 |
izvan kat. |
metil-stearat |
112-61-8 |
203-990-4 |
čvrsto |
1 |
izvan kat. |
izvan kat. |
heptil-butirat |
5870-93-9 |
227-526-5 |
tečno |
1,7 |
izvan kat. |
opciona kat. 3 |
heksil-salicilat |
6259-76-3 |
228-408-6 |
tečno |
2 |
izvan kat. |
opciona kat. 3 |
tri-izobutil-fosfat |
126-71-6 |
204-798-3 |
tečno |
2 |
kat. 2 |
opciona kat. 3 |
1-dekanol |
112-30-1 |
203-956-9 |
tečno |
2,3 |
kat. 2 |
kat. 2 |
ciklamen-aldehid |
103-95-7 |
203-161-7 |
tečno |
2,3 |
kat. 2 |
kat. 2 |
1-bromheksan |
111-25-1 |
203-850-2 |
tečno |
2,7 |
kat. 2 |
kat. 2 |
2-hlormetil-3,5-dimetil-4-metoksipiridin-hidrohlorid |
86604-75-3 |
434-680-9 |
čvrsto |
2,7 |
kat. 2 |
kat. 2 |
a-terpineol |
98-55-5 |
202-680-6 |
tečni |
2,7 |
kat. 2 |
kat. 2 |
di-n-propil-disulfid |
629-19-6 |
211-079-8 |
tečno |
3 |
izvan kat. |
kat. 2 |
butil-metakrilat |
97-88-1 |
202-615-1 |
tečno |
3 |
kat. 2 |
kat. 2 |
benzenetiol, 5-(1,1-dimetiletil)-2-metil |
7340-90-1 |
438-520-9 |
tečno |
3,3 |
kat. 2 |
kat. 2 |
1-metil-3-fenil-1-piperazin |
5271-27-2 |
431-180-2 |
čvrsto |
3,3 |
kat. 2 |
kat. 2 |
heptanal |
111-71-7 |
203-898-4 |
tečno |
4 |
kat. 2 |
kat. 2 |
* Ovih 20 referentnih supstanci predstavlja reprezentativni izbor od 58 supstanci koje su prvobitno korišćene u validaciji referentne metode 1 (EpiSkinTM). Potpun spisak ispitivanih supstanci i kriterijuma za njihov izbor dat je u literaturi5. |
||||||
Supstance navedene u Tabeli 2. predstavljaju reprezentativni izbor od 58 supstanci korišćenih u međunarodnoj validacijskoj studiji iritacije kože Evropskog centra za validaciju alternativnih metoda (u daljem tekstu: ECVAM)1. Njihov izbor se zasniva na sledećim kriterijumima:
- ove supstance su dostupne na tržištu,
- reprezentativne su za čitav opseg skora iritacije prema Drajzeu (od iritacije do jake iritacije),
- imaju dobro definisanu hemijsku strukturu,
- reprezentativne su za ponovljivost i predvidljivu sposobnost validirane metode, kako je utvrđeno u validacionoj studiji ECVAM,
- reprezentativne su za hemijsku funkcionalnost koja je korišćena u procesu validacije,
- nemaju ekstremno toksični profil (npr. karcinogeno ili toksično delovanje po reprodukciju) i nisu povezane sa previsokim troškovima odlaganja.
III. Definisane vrednosti tačnosti i pouzdanosti
Radne karakteristike (osetljivost, specifičnost, udeo lažno negativnih, udeo lažno pozitivnih i tačnost) predložene metode ispitivanja su uporedive sa odgovarajućim vrednostima validirane referentne metode 1 (Tabela 3), tj. osetljivost je jednaka ili viša (≥) od 80%, specifičnost je jednaka ili viša (≥) od 70% i tačnost je jednaka ili viša (≥) od 75%. One se izračunavaju na osnovu svih klasifikacija 20 supstanci dobijenih u različitim laboratorijama koji su učestvovale u istraživanju. Klasifikacija supstanci u svakoj od laboratorija određuje se na osnovu srednje vrednosti vijabilnosti iz različitih ispitivanja (najmanje tri valjana ispitivanja).
Tabela 3. Karakteristike validirane referentne metode 1 [XVII]
Metoda ispitivanja |
Broj supstanci |
Osetljivost |
Specifičnost |
Udeo lažno negativnih |
Udeo lažno pozitivnih |
Tačnost |
Validirana referentna metoda 1 [1] |
58 |
87,2% [2] |
71,1% [3] |
12,8% |
29,9% |
74,7% |
Validirana referentna metoda 1 [1] |
20 |
90% |
73,3% |
10% |
26,7% |
81,7% |
[1] EpiSkin™ [2] Na osnovu 13 iritativnih supstanci 2. kat. GHS. [3] Na osnovu 45 iritativnih supstanci 3. kat. GHS ili hemikalija izvan kategorija GHS. |
||||||
Pouzdanost predložene metode ispitivanja je uporediva sa pouzdanošću validirane referentne metode.
______________
XVII U Tabeli 3. prikazane su radne karakteristike validirane referentne metode 1 s obzirom na sposobnost tačnog identifikovanja iritativnih supstanci (kategorija 2 UN GHS) i neklasifikovanih supstanci (izvan kategorije, uključujući opcionu kategoriju 3) za 58 odnosno 20 referentnih supstanci (Tabela 2).
Ponovljivost u okviru laboratorije
Kod ocenjivanja varijabilnosti u okviru laboratorije podudarnost između klasifikacija (kategorija 2 / izvan kategorije) dobijenih u različitim nezavisnim ispitivanjima 20 referentnih supstanci u istoj laboratoriji mora biti3 90%.
Ponovljivost između laboratorija
Procena ponovljivosti između laboratorija nije potrebna ako se predložena metoda ispitivanja koristi samo u jednoj laboratoriji. Ako se metoda koristi u više laboratorija, podudarnost između klasifikacija (kategorija 2 / izvan kategorije) dobijenih u različitim nezavisnim ispitivanjima 20 referentnih supstanci, po mogućstvu u najmanje tri laboratorije, iznosi ≥ 80%.
LITERATURA
1. Spielmann, H., Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. and Zuang, V. (2007) The ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Report on the Validity of the EPISKIN and EpiDerm Assays and on the Skin Integrity Function Test. ATLA 35, 559-601.
2. OECD (2005) Guidance Document No. 34 on the validation and international acceptance of new or updated test methods for hazard assessment. OECD, Paris.
3. ECVAM (2007) Performance Standards for applying human skin models to in vitro skin irritation. Available under Download Study Documents, at http://ecvam.jrc.ec.europa.eu. Accessed on 27.10.2008.
4. Mosman, T. (1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods 65, 55-63.
5. Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. & Zuang. V (2007) ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Selection of Test Chemicals. ATLA 35, 603-619.
B.47. METODA ISPITIVANJA ZAMUĆENJA I PROPUSTLJIVOSTI ROŽNJAČE GOVEČETA RADI IDENTIFIKOVANJA HEMIKALIJA KOJE IZAZIVAJU TEŠKO OŠTEĆENJE I JAKU IRITACIJU OKA
Deo prvi
1. METODA ISPITIVANJA
1.1. UVOD
Metoda ispitivanja zamućenja i propustljivosti rožnjače govečeta (Bovine Corneal Opacity and Permeability, u daljem tekstu: BCOP) jeste metoda ispitivanja in vitro koji se pod određenim uslovima i uz određena ograničenja može koristiti za klasifikaciju supstanci i smeša kao onih koje izazivaju teško oštećenje i jaku iritaciju oka1,2,3. U ovoj metodi ispitivanja, jako iritativne hemikalije su one koje izazivaju oštećenja oka, koja se kod kunića održavaju najmanje 21 dan nakon primene. Iako se ne vrednuje kao potpuna zamena za in vivo ispitivanje na oku kunića, BCOP se preporučuje za upotrebu kao deo strategije višestepenog ispitivanja za regulatornu klasifikaciju i obeležavanje u okviru određene oblasti primene4,5. Ispitivane supstance i smeše6 mogu se klasifikovati kao one koje izazivaju teško oštećenje oka ili one koje su jako iritativne za oko, bez daljeg ispitivanja na kunićima. Supstanca sa negativnim rezultatom ispitivanja ispituje se na kuniću korišćenjem strategije "korak po korak", koja je definisana u Metodi V.5. koja je data u ovom pravilniku.
Svrha ove metode ispitivanja je da opiše postupke koji se koriste za procenu mogućih svojstava ispitivane hemikalije da izazove teško oštećenje ili jaku iritaciju oka što se meri njenom sposobnošću da izazove zamućenje i povećanu propustljivost izolovane rožnjače govečeta. Toksični efekti na rožnjači se mere na osnovu: 1) smanjenja prenosa svetlosti (neprozirnost, zamućenje) i 2) povećanja prolaza boje natrijum fluoresceina (propustljivost). Procene zamućenja i propustljivosti rožnjače nakon primene ispitivane supstance kombinuju se kako bi se izveo skor iritativnosti in vitro (Skor iritacije u in vitro uslovima, IVIS) koji se koristi za klasifikaciju prema stepenu iritativnosti ispitivana supstanca.
BCOP metodom ispitane su i iritativne supstance za oko koje izazivaju oštećenja koja nestaju za manje od 21 dana, i neiritativne supstance. Međutim, tačnost i pouzdanost BCOP metode za supstance koje pripadaju ovim kategorijama nisu formalno evaluirani.
1.2. POČETNA RAZMATRANJA I OGRANIČENJA
Ova metoda ispitivanja zasniva se na postupku metode BCOP Međuagencijskog koordinacionog odbora za validaciju alternativnih metoda (ICCVAM)8, koji je pripremljen nakon međunarodne validacione studije4,5,9, u kojoj su učestvovali Evropski centar za validaciju alternativnih metoda (ECVAM) i Japanski centar za validaciju alternativnih metoda (JaCVAM). Postupak je zasnovan na podacima dobijenim od Instituta za istraživanja In Vitro (IIVS) i Postupka INVITTOX 12410, koji je korišćen u pred-validacionoj studiji BCOP eseja, sprovedenoj u periodu od 1997. do 1998. godine pod pokroviteljstvom Evropske zajednice. Oba postupka su zasnovana na metodologiji ispitivanja BCOP, o kojoj su prvi put izvestili Gojteron i sar.11.
Ograničenja koja su prepoznata za ovu metodu ispitivanja zasnivaju se na velikom udelu lažno pozitivnih rezultata za alkohole i ketone i velikom udelu lažno negativnih rezultata za hemikalije u čvrstom stanju zapaženim u bazi podataka korišćenoj za validaciju (videti odeljak 2.2. ove metode)5. Ako se supstance iz tih klasa jedinjenja i tog agregatnog stanja isključe iz baze podataka, tačnost BCOP u sistemima za klasifikaciju supstanci EU, EPA (Environmental Protection Agnecy) i GHS znatno se poboljšava5. S obzirom na svrhu ovog ispitivanja (tj. da se identifikuju samo hemikalije koje izazivaju teško oštećenje oka i one koje su jako iritativne za oko), procenat lažno negativnih rezultata nije od ključnog značaja, jer se takve supstance zatim ispituju na kuniću, ili, u zavisnosti od normativnih zahteva, sa drugim odgovarajuće validiranim metodama in vitro, primenom strategije višestepenog ispitivanja na osnovu kvaliteta podataka. Sadašnja baza podataka za validaciju ne dozvoljava adekvatnu ocenu nekih grupa jedinjenjaili proizvoda (npr. smeša). Međutim, ispitivači mogu da razmotre upotrebu ove metode ispitivanja za sve vrste ispitivanih materijala (uključujući smeše), pri čemu je pozitivan rezultat prihvatljiv kao pokazatelj teškog oštećenja ili jake iritacije oka. Pozitivni rezultati dobijeni sa alkoholima ili ketonima, tumače se oprezno zbog rizika od lažno pozitivnih rezultata.
Kod svih postupaka sa goveđim očima i rožnjačama pridržavati se važećih pravila i postupaka za objekte u kojima se vrši ispitivanje za rukovanje materijalom životinjskog porekla, što uključuje između ostalog, tkiva i tkivne tečnosti. Preporučuju se opšte laboratorijske mere predostrožnosti12.
Ograničenje ove metode ispitivanja je u tome što iako uzima u obzir neke efekte na oku koji su ocenjeni metodom ispitivanja iritativnosti na oku kunića, i u izvesnoj meri, njenu jačinu, ne uzima u obzir oštećenja vežnjače i dužice. Takođe, iako se reverzibilnost oštećenja rožnjače u BCOP ne može proceniti sama po sebi, predloženo je, na osnovu studija na oku kunića, da se ocena početne dubine oštećenja rožnjače može koristiti za razlikovanje reverzibilnih i ireverzibilnih efekata13. BCOP metodom ispitivanja ne može da se proceni moguća sistemska toksičnost povezana sa izlaganjem preko oka.
Nastoji se da se detaljnije okarakterišu korisnost i ograničenja metode BCOP za identifikaciju hemikalija koje nisu jako iritativne ili nisu iritativne (videti odeljak 2.2. ove metode). Korisnici se takođe podstiču da daju organizacijama za validaciju uzorke i/ili podatke za formalnu ocenu mogućih budućih upotreba metode BCOP, uključujući i za identifikovanje hemikalija koje nisu jako iritativne i neiritativnih supstanci.
Svaka laboratorija koja ovu metodu uvodi po prvi put, treba da koristi hemikalije za proveru sposobnosti date u Dodatku 2. ove metode. Laboratorija može da koristi ove hemikalije da pokaže tehničku kompetentnost u izvođenju metode BCOP pre nego što dostavi podatke ispitivanja BCOP radi normativne klasifikacije opasnosti.
1.3. PRINCIP METODE
Metoda ispitivanja BCOP je organotipski model koji obezbeđuje kratkoročno održavanje normalne fiziološke i biohemijske funkcije rožnjače govečeta u in vitro uslovima. U ovoj metodi, oštećenje nastalo usled izlaganja ispitivanoj supstanci procenjuje se kvantitativnim merenjima promena u prozirnosti i propustljivosti rožnjače opacitometrom i spektrofotometrom u oblasti vidljive svetlosti. Oba merenja se koriste za izračunavanje IVIS, koji se se koristi za dodeljivanje kategorije u okviru klase opasnosti iritacija u in vitro uslovima za predviđanje potencijala za iritativno delovanje ispitivane supstance na oko in vivo (videti Kriterijume za odlučivanje).
U metodi ispitivanja BCOP koriste se izolovane rožnjače očiju sveže zaklanih goveda. Zamućenje rožnjače meri se kvantitativno kao količina svetlosti koja prolazi kroz rožnjaču. Propustljivost se meri kvantitativno kao količina boje natrijum fluoresceina, koja prodire kroz celu debljinu rožnjače i detektuje se u medijumu u zadnjoj komori. Ispitivane supstance se primenjuju na epitelnu površinu rožnjače tako što se dodaju u prednju komoru držača rožnjače. Dodatak 3. ove metode sadrži opis i dijagram držača rožnjače koji se koristi za BCOP. Držači rožnjače mogu se nabaviti na tržištu iz različitih izvora ili ih laboratorije mogu proizvoditi za sebe.
1.3.1. Poreklo i starost goveđih očiju i izbor životinjske vrste
Goveda u klanicama obično se ubijaju za ljudsku ishranu ili za druge komercijalne svrhe. Kao izvor rožnjača za ispitivanje BCOP koriste se samo zdrave životinje pogodne za ulazak u lanac ishrane ljudi. S obzirom da kod goveda postoji širok raspon telesne mase, zavisno od rase, starosti i pola, ne postoji preporučena telesna masa za životinju u vreme klanja.
Do razlika u veličini rožnjače može doći kada se koriste oči životinja različite starosti. Rožnjače horizontalnog prečnika > 30,5 mm i centralne debljine rožnjače (u daljem tekstu: CCT) ≥ 1.100 μm obično se dobijaju od stoke starije od osam godina, dok se one sa horizontalnim prečnikom < 28,5 mm i CCT < 900 μm uglavnom dobijaju od goveda mlađih od pet godina14. Zbog toga se obično ne koriste oči stoke starije od 60 meseci. Oči stoke starosti ispod 12 meseci takođe se obično ne koriste jer još nisu u potpunosti razvijene, debljina i prečnik rožnjače su znatno manji nego kod očiju odrasle stoke. Dozvoljena je upotreba rožnjača mladih životinja (tj. starosti između šest i 12 meseci) jer ima prednosti, kao na primer veću dostupnost, uži starosni opseg i manji rizik od eventualne izloženosti radnika goveđoj spongiformnoj encefalopatiji15. Korisna je dalja ocena uticaja veličine i debljine rožnjače na odgovor na supstance koje izazivaju teško oštećenje ili jaku iritaciju oka, te se korisnici podstiču da navode procenjenu starost i/ili telesnu masu životinja od kojih su dobijene rožnjače korišćene u studiji.
1.3.2. Sakupljanje i transport očiju u laboratoriju
Oči sakuplja osoblje klanice. Da bi se mehaničke i druge vrste oštećenja svele na minimum, oči se vade što je moguće pre posle smrti. Da bi se sprečilo izlaganje očiju potencijalnim iritativnim supstancama, osoblje klanice pri ispiranju glava životinja ne sme da koristi detergente.
Oči se potpuno potope u Hanksov izbalansirani rastvor soli (u daljem tekstu: HBSS) u posudi odgovarajuće veličine i transportovati u laboratoriju tako da se propadanje i/ili kontaminacija bakterijama svede na najmanju meru. Pošto se oči sakupljaju tokom procesa klanja, mogu da dođu u kontakt sa krvlju i drugim biološkim materijalom, uključujući bakterije i druge mikroorganizme. Zato je važno da se obezbedi da rizik od kontaminacije bude sveden na minimum (npr. držanjem kontejnera sa očima na mokrom ledu, dodavanjem antibiotika u HBSS koji je korišćen za skladištenje očiju tokom transporta (npr. penicilin 100 IU/mL i streptomicin 100 μg/mL)).
Vreme između sakupljanja očiju i upotrebe rožnjača u BCOP treba da bude što je moguće kraće (obično se sakupe i koriste istog dana) i pokazuje se da se ne umanjuje vrednost rezultata ispitivanja. Ovi rezultati su zasnovani na kriterijumima za izbor očiju, kao i odgovorima pozitivnih i negativnih kontrola. Sve oči koje se koriste u ispitivanju pripadaju istoj grupi očiju, sakupljenoj određenog dana.
1.3.3. Kriterijumi za izbor očiju koje se koriste u BCOP
Kada stignu u laboratoriju, oči je potrebno pažljivo pregledati kako bi se uočili oštećenja uključujući i smanjenu prozirnost, ogrebotine i neovaskularizaciju. Mogu se koristiti samo rožnjače očiju bez takvih defekata.
Kvalitet svake rožnjače ocenjuje se i u kasnijim fazama ispitivanja. Rožnjače sa zamućenjem preko sedam jedinica (napomena: opacitometer je kalibrisan sa standardima zamućenja koji se koriste za uspostavljanje jedinica zamućenja, videti Dodatak treći ove metode), posle početnog perioda od sat vremena uspostavljanja ravnoteže, odbacuju se.
Svaka ispitivana grupa (ispitivana supstanca, paralelne negativne i pozitivne kontrole) sastoji se od najmanje tri oka. Kod metode BCOP za negativnu kontrolu upotrebljavaju se tri rožnjače. Pošto su sve rožnjače isečene iz cele očne jabučice i smeštene u komore za rožnjače, postoji mogućnost da usled uticaja ljudskog faktora pri rukovanju dođe do uticaja na pojedinačne vrednosti zamućenja i propustljivosti rožnjače (uključujući i negativne kontrole). Vrednosti zamućenja i propustljivosti dobijene za rožnjače iz negativne kontrolne grupe koriste se za korigovanje vrednosti zamućenja i propustljivosti dobijene za grupe tretirane predmetom ispitivanja i grupe tretirane pozitivnom kontrolom u izračunavanju IVIS.
1.4. POSTUPAK
1.4.1. Priprema oka
Neoštećene rožnjače seciraju se tako da se održi 2 mm do 3 mm širok rub beonjače, što olakšava dalje rukovanje, vodeći računa da se epitel i endotel rožnjače ne oštete. Izolovane rožnjače se pričvršćuju na držače specijalno namenjene za to, koji se sastoje od prednjeg i zadnjeg odeljka, koji su, redom, u kontaktu sa epitelnim i endotelnim stranama rožnjače. Obe komore se do vrha ispunjavaju zagrejanim Iglovim minimalnim osnovnim medijumom (u daljem tekstu: EMEM) (prvo zadnja komora), vodeći računa da se ne stvaraju mehurići. Uređaj se potom dovodi u ravnotežu na 32° C ± 1° C najmanje jedan sat da rožnjače mogu da budu ujednačene sa medijumom i da se postigne normalna metabolička aktivnost što je više moguće (približna temperatura na površini rožnjače in vivo je 32° C).
Nakon perioda uspostavljanja ravnoteže u obe komore dodaje se svež, prethodno zagrejan medijum EMEM i očitava se bazna linija zamućenja za svaku rožnjaču. Rožnjače sa makroskopskim oštećenjem tkiva (na primer, ogrebotine, pigmentacija, neovaskularizacija) ili sa zamućenjem od više od sedam jedinica zamućenja se odbacuju. Izračunava se prosečno zamućenje svih rožnjača u ravnoteži. Za negativnu (ili rastvarač) kontrolu biraju se najmanje tri rožnjače sa vrednostima zamućenja blizu srednje vrednosti za sve rožnjače. Preostale rožnjače se zatim raspoređuju u grupu za dalje tretiranje i pozitivnu kontrolnu grupu.
Pošto je toplotni kapacitet vode veći nego za vazduh, voda obezbeđuje stabilnije temperaturne uslove za inkubaciju. Zbog toga se preporučuje korišćenje vodenog kupatila za održavanje temperature držača rožnjače i njegovog sadržaja na 32° C ± 1° C. Mogu se koristiti i vazdušni inkubatori, što podrazumeva mere predostrožnosti da se održi stabilnost temperature (npr. prethodnim zagrevanjem držača i medijuma).
1.4.2. Primena ispitivane supstance
Koriste se dva različita postupka tretiranja - jedan za tečnosti i surfaktante (u čvrstom ili tečnom stanju) i jedan za hemikalije u čvrstom stanju koji nisu surfaktanti.
Tečnosti se ispituju nerazblažene, dok se surfaktanti ispituju u koncentraciji od 10% w/v u 0,9% rastvoru natrijum hlorida, destilovanoj vodi ili nekom drugom rastvaraču, za koji je dokazano da nema štetni efekte na sistem za ispitivanje. Polučvrste hemikalije, kreme i voskovi se obično ispituju kao tečnosti. Ako se koriste druge koncentracije rastvora, na odgovarajući način se obrazlažu. Rožnjače se izlažu tečnostima i surfaktantima 10 minuta. Ako je vreme izloženosti drugačije, daje se odgovarajuće naučno obrazloženje.
Čvrste hemikalije koje nisu surfaktanti obično se ispituju kao 20% rastvori ili suspenzije pripremljeni u 0,9% rastvoru natrijum hlorida, destilovanoj vodi ili nekom drugom rastvaraču, za koji je dokazano da nema štetne efekte na sistem za ispitivanje. U određenim okolnostima i uz naučno opravdanje, hemikalije u čvrstom stanju mogu se ispitivati jednostavno neposrednim nanošenjem na površinu rožnjače, koristeći metodu otvorene komore (videti poslednji pasus ovog odeljka). Rožnjače se izlažu hemikalijama u čvrstom stanju četiri sata, ali kao i kod tečnosti i surfaktanata, može se koristiti drugačije vreme izlaganja, uz naučno obrazloženje.
Mogu se koristiti različite metode tretiranja u zavisnosti od fizičkih i hemijskih svojstava hemikalije (tj. hemikalije u čvrstom stanju, tečnosti, viskozne tečnosti ili neviskozne). Najvažnije je obezbediti da ispitivana supstanca adekvatno pokriva epitelnu površinu i da se na adekvatan način uklanja tokom ispiranja. Metoda zatvorene komore obično se koristi za neviskozne do malo viskozne ispitivane supstance, dok se metoda otvorene komore obično koristi za poluviskozne i viskozne tečne ispitivane supstance i čiste hemikalije u čvrstom stanju.
Kod metode zatvorene komore, preko otvora za doziranje na gornjoj površini prednje komore dodaje se toliko ispitivane supstance (750 μL) da prekrije epitelnu stranu rožnjače, a otvori se zatim za vreme izlaganja pečate sa zaptivnim čepovima. Neophodno je da se obezbedi da svaka rožnjače bude dovoljno dugo izložena ispitivanoj supstanci.
Kod metode otvorene komore, pre tretmana, sa prednje komore se uklanja prsten za zaptivanje prozora i staklo prozora. Kontrolna ili ispitivana supstanca (750 μL, ili dovoljno ispitivane supstance da potpuno prekrije rožnjače) nanosi se direktno na epitelnu površinu rožnjača koristeći mikropipete. Ako se ispitivana supstanca teško pipetira, ona se može naneti pod pritiskom u pipetu sa klipnim nastavkom radi lakše primene doze. Nastavak ove pipete stavlja se u vrh šprica tako da hemikalija može napuniti klipni nastavak pod pritiskom. Dok se klip šprica polako potiskuje, klip pipete se povlači na gore. Ako se u nastavku pipete pojave mehurići vazduha, predmet ispitivanja se uklanja (izbacuje) i postupak se ponavlja sve dok se nastavak ne napuni bez mehurića. Ako je potrebno, može se koristiti obični špric (bez igle), koji omogućava merenje tačne zapremine ispitivane supstance i lakše nanošenje na epitelnu površinu rožnjače. Nakon primene doze, na prednju komoru se ponovo namesti staklo prozora i ponovo se uspostavlja zatvoreni sistem.
1.4.3. Inkubacija posle izlaganja
Nakon perioda izlaganja ispitivana supstanca, supstanca za negativnu kontrolu ili supstanca za pozitivnu kontrolu uklanjaju se iz prednje komore, a epitel se ispira najmanje tri puta (ili dok se ispitivana supstanca više ne vidi) sa EMEM (koji sadrži fenol crveno). Za ispiranje se koristi medijum koji sadrži fenol crveno, jer se promena boje fenol crvenog može pratiti da se utvrdi da li je ispiranje kiselih ili alkalnih hemikalija bilo delotvorno. Ako je fenol crveno još uvek promenjene boje (žuta ili ljubičasta) ili ako je ispitivana supstanca i dalje vidljiva, rožnjače se ispiraju više od tri puta. Kada u medijumu više nema ispitivane supstance, rožnjače se konačno ispiraju sa EMEM (bez fenol crvenog). EMEM (bez fenol crvenog) se koristi za konačno ispiranje da se osigura uklanjanje fenol crvenog iz prednje komore pre merenja zamućenja. Zatim se prednja komora napuni svežim EMEM bez fenol crvenog.
Za tečnosti ili surfaktante, rožnjače se nakon ispiranja inkubiraju još dva sata na 32° C ± 1° C. U određenim okolnostima, korisna je duža inkubacija nakon izlaganja, ali to zavisi od svakog pojedinačnog slučaja. Rožnjače na kojima se ispituju čvrste supstance, posle četiri sata izlaganja se temeljno ispiraju, ali ne zahtevaju dalju inkubaciju.
Na kraju perioda inkubacije nakon izlaganja za tečnosti i surfaktante i nakon završetka četiri sata izlaganja za čvrste supstance koje nisu surfaktanti, beleže se zamućenje i propustljivost svake rožnjače. Osim toga, svaka rožnjača se vizuelno pregleda i evidentiraju se sva bitna zapažanja (na primer: ljuštenje tkiva, prisustvo ostataka ispitivane supstance, neujednačena zamućenja). Ova zapažanja mogu biti važna, jer mogu da se odraze na varijacije u očitavanju opacitometrom.
Kontrolne supstance
U svaki eksperiment uključuje se paralelna negativna kontrola ili kontrola rastvarača/nosača i pozitivna kontrola.
Kod ispitivanja supstance u tečnom stanju u koncentraciji 100% u metodi ispitivanja BCOP uključuje se paralelna negativna kontrola (npr. 0,9 % rastvor natrijum hlorida ili destilovana voda) da se otkriju nespecifične promene u sistemu za ispitivanje i da se obezbedi bazna linija za efekte koji se ispituju. Ovim se osigurava i da uslovi ispitivanja ne prouzrokuju iritativne reakcije.
Kod ispitivanja razblažene tečnosti, surfaktanta ili hemikalije u čvrstom stanju u metodi BCOP uključuje se paralelna kontrolna grupa rastvarača/nosača radi otkrivanja nespecifičnih promena u sistemu za ispitivanje i kako bi se obezbedila bazna linija za posmatrane efekte. Može se koristiti samo rastvarač/nosač za koji je dokazano da nema štetne efekte na sistem za ispitivanje.
U svaki eksperiment uključen je poznati iritans za oko kao paralelna pozitivna kontrola kako bi se proverilo da li je izazvan odgovarajući odgovor. Pošto se metoda BCOP koristi za identifikovanje supstanci koje dovode do teškog oštećenja ili jake iritacije oka, u idealnom smislu pozitivna kontrola je referentna supstanca koja u ovoj metodi ispitivanja izaziva jak odgovor. Da bi se obezbedila mogućnost ocenjivanja varijabilnosti odgovora pozitivne kontrole tokom vremena, stepen iritacije ne treba da bude prevelik.
Primeri pozitivnih kontrola za ispitivane supstance u tečnom stanju su dimetilformamid ili 1% natrijum hidroksid. Primer pozitivne kontrole za ispitivane supstance u čvrstom stanju je 20% (w/v) imidazola u 0,9% rastvoru natrijum hlorida.
Referentne supstance su pogodne za ocenu potencijala za izazivanje iritacije oka nepoznate hemikalije specifične hemijske ili proizvodne klase klase jedinjenja ili proizvoda, ili za ocenu relativnog iritativnog potencijala iritansa za oko u određenom rasponu iritativnih odgovora.
1.4.4. Merenje efekata
Zamućenje je određeno količinom svetlosti koja prodire kroz rožnjaču. Zamućenje rožnjače kvantitativno se meri pomoću opacitometra, tako da se vrednosti zamućenja mere na kontinuiranoj skali.
Propustljivost se određuje količinom boje natrijum fluoresceina koja prodire kroz sve slojeve ćelija rožnjače (tj. od epitela na spoljašnjoj površini rožnjače do endotela na unutrašnjoj površini rožnjače). U prednju komoru držača rožnjače koja se graniči sa epitelnom stranom rožnjače dodaje se 1 ml rastvora natrijum fluoresceina (4 mg/ml ili 5 mg/ml kod ispitivanja tečnosti i surfaktanata, odnosno supstanci u čvrstom stanju koje nisu surfaktanti), dok se zadnja komora ka endotelnoj strani rožnjače, ispunjava svežim EMEM. Držač se zatim inkubira u vodoravnom položaju 90 minuta ± 5 minuta na 32° C ± 1° C. Količina natrijum fluoresceina koja pređe u zadnju komoru se kvantitativno meri pomoću UV/VIS spektrofotometrije. Spektrofotometrijska merenja na 490 nm beleže se kao vrednosti optičke gustine (u daljem tekstu: OD490) ili apsorbancije, koje se mere na kontinuiranoj skali. Vrednosti propustljivosti fluorosceina se određuju pomoću vrednosti OD490 koje su izmerene spektrofotometrom u oblasti vidljive svetlosti pri standardnoj dužini puta od 1 cm.
Umesto spektrofotometra može se koristiti i čitač mikrotitarskih ploča sa 96-mesta, ako: 1) se može utvrditi linearni opseg čitača za određivanje vrednosti OD490 fluoresceina i 2) ako se u mikrotitarskim pločama sa 96-mesta koriste tačne zapremine fluorescina koje obezbeđuju da vrednosti OD490 odgovaraju onim dobijenim na standardnim dužinama puta od 1 cm (za ovo bi možda bio potreban potpuno pun bazenčić (obično 360 mL)).
2. PODACI I IZVEŠTAVANJE
2.1. Ocenjivanje podataka
Posle korigovanja vrednosti zamućenja i srednje vrednosti propustljivosti (OD490) za pozadinske vrednosti zamućenja i vrednosti propustljivosti negativne kontrole OD490, srednje vrednosti zamućenja i propustljivosti OD490 za svaku ispitivanu grupu sastavljaju se u empirijski izvedenu formulu kojom se izračunava skor iritacije u in vitro uslovima (IVIS) za svaku ispitivanu grupu, na sledeći način:
IVIS = srednja vrednost zamućenja + (15 × srednja vrednost propustljivosti OD490)
Po Sini i saradnicima16 ova formula je izvedena na osnovu laboratorijskih i međulaboratorijskih studija. Podaci prikupljeni tokom studije za 36 jedinjenja izvedene u više laboratorija, podvrgnuti su multivarijantnoj analizi kako bi se odredila najprikladnija formula za poređenje podataka in vivo i in vitro. Analizu su izvršili istraživači iz dve različite kompanije i izveli gotovo identične jednačine.
Vrednosti zamućenja i propustljivosti ocenjuju se nezavisno da se utvrdi da li je ispitivana supstanca izaziva teško oštećenje ili jaku iritaciju kroz samo jedan od dva efekta (videti Kriterijume za odlučivanje).
2.2. Kriterijumi za odlučivanje
Supstanca koja pokazuje IVIS ≥ 55,1 definiše se kao ona koja izaziva teško oštećenje oka ili kao jako iritativna. Kao što je navedeno u Uvodu ove metode, ako ispitivana supstanca nije određena kao ona koja izaziva teško oštećenje oka ili jako iritativna za oko, vrši se dodatno ispitivanje radi klasifikacije i obeležavanja. U poređenju sa podacima metode ispitivanja in vivo na oku kunića, klasifikovanim po sistemima klasifikacije EPA1, EU2 ili GHS3, ukupna tačnost metode ispitivanja BCOP je 79% (113/143) do 81% (119/147), udeo lažno pozitivnih rezultata, 19% (20/103) do 21% (22/103), a procenat lažno negativnih rezultata 16% (7/43) do 25% (10/40). Ako se iz baze podataka isključe supstance određenih klasa jedinjenja (npr. alkohol, ketoni) ili agregatnog stanja, tačnost ispitivanja BCOP u sistemima klasifikacije EU, EPA i GHS se kreće od 87% (72/83) do 92 odsto (78/85), udeo lažno pozitivnih rezultata, 12% (7/58) do 16% (9/56), a procenat lažno negativnih rezultata od 0% (0/27) do 12% (3/26).
Čak i ako za hemikalije koje izazivaju teško oštećenje oka i jako iritativne supstance za oko nije dobijena klasifikacija, združivanjem podataka dobijenih u BCOP i ispitivanju in vivo na oku kunića ili odgovarajuće validiranim in vitro ispitivanjem, može biti korisno za dalju ocenu korisnosti i ograničenja metode ispitivanja BCOP za identifikaciju supstanci koje nisu jako iritativne i koje nisu iritativne (u pripremi su smernice za upotrebu metoda ispitivanja za in vitro ispitivanje toksičnosti za oko).
2.3. Kriterijumi za prihvatljivost studije
Ispitivanje se smatra prihvatljivim ako se vrednost IVIS pozitivne kontrole kreće u okviru dve standardne devijacije od prosečne vrednosti ranijih ispitivanja koja se trenutno koristi i koja se ažurira najmanje jednom u tri meseca ili kad god ispitivanje vrše laboratorije koje ispitivanja vrše retko (tj. manje od jednom mesečno). Odgovori negativne kontrole ili kontrole rastvarača/nosača daju vrednosti zamućenja i propustljivosti koje su niže od utvrđenih gornjih granica pozadinskih vrednosti za zamućenje i propustljivosti rožnjača goveda tretiranih sa negativnim kontrolama ili kontrolama sa rastvaračem/nosačem.
3. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju sadrži podatke o (ako su relevantni za sprovođenje studije):
1) Ispitivanim i kontrolnim supstancama:
- hemijski naziv i to CAS naziv i ostali nazivi ako su poznati;
- registarski broj (RN) CAS, ako je poznat;
- čistoća i sastav supstanci ili smeša (u masenim procentima), ako je takva informacija dostupna;
- fizičko-hemijska svojstva relevantna za sprovođenje studije, npr. agregatno stanje, isparljivost, pH vrednost, stabilnost, klasa jedinjenja, rastvorljivost u vodi;
- obrada ispitivanih/kontrolnih supstanci pre ispitivanja, ako je potrebno (npr. zagrevanje, usitnjavanje);
- stabilnosti, ukoliko je poznata.
2) Sponzoru i ispitivanoj laboratoriji:
- ime i adresa sponzora, ispitivane laboratorije i rukovodioca ispitivanja;
- podaci o izvoru očiju (tj. objekat iz kojeg su uzeti);
- uslovi skladištenja i transporta očiju (tj. dan i vreme sakupljanja očiju, vremenski period pre početka ispitivanja, trensportni medijum i temperaturni uslovi, eventualna upotreba antibiotika);
- specifične karakteristike životinja od kojih su uzete oči, ako je poznato (npr. starost, pol, telesna masa životinje davaoca).
3) Opravdanosti metode ispitivanja i postupci koji su korišćeni:
- integritet metode ispitivanja
- postupak da se obezbedi integritet (tj. tačnost i pouzdanost) metode ispitivanja tokom vremena (npr. periodična ispitivanja referentnih supstanci za proveru sposobnosti, korišćenje podataka negativne i pozitivne kontrole iz ranijih ispitivanja).
4) Kriterijumima za prihvatanje ispitivanja:
- prihvatljivi opsezi za paralelne pozitivne i negativne kontrole na osnovu podataka iz ranijih ispitivanja;
- prihvatljivi opsezi za paralelne referentne kontrole na osnovu podataka iz ranijih ispitivanja.
5) Uslovima ispitivanja:
- opis korišćenog sistema za ispitivanje;
- vrsta upotrebljenog držača rožnjače;
- podaci o kalibraciji uređaja za merenje zamućenja i propustljivosti (npr. opacitometra i spektrofotometar);
- podaci o upotrebljenim goveđim rožnjačama, uključujući i izjave o njihovom kvalitetu;
- detalji o korišćenom postupku ispitivanja;
- koncentracije ispitivanih supstanci koje su primenjene;
- opis svake promene ispitivanog postupka;
- pozivanje na podatke iz ranijih ispitivanja modela (tj. negativnih i pozitivnih kontrola, supstanci za proveru sposobnosti, referentne supstance);
- opis korišćenih kriterijuma za ocenjivanje.
6) Rezultatima:
- tabelarni prikaz podataka za pojedinačne ispitivane uzorke (npr. vrednosti zamućenja i OD490 kao i izračunate vrednosti IVIS za ispitivane supstance i pozitivne, negativne i referentne kontrole (ako su uzete u obzir), uključujući i podatke za replikate iz ponovljenih eksperimenata, ako postoje, i srednje vrednosti ± standardna devijacija za svaki eksperiment);
- opis drugih uočenih efekata.
7) Tumačenju rezultata.
8) Zaključcima.
4. LITERATURA
1. U.S. EPA (1996). Label Review Manual: 2nd Edition. EPA737-B-96-001. Washington, DC: U.S. Environmental Protection Agency.
2. Regulation (EC) No 1272/2008 of the European Parliament and of the Council of 16 December 2008 on classification, labelling and packaging of substances and mixtures, amending and repealing Directive 67/548/EEC and 1999/45/EC, and amending Regulation (EC) No 1907/2006. OJ L 353, 31.12.2008, p. 1.
3. UN (2007). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). Second revised edition, New York & Geneva: United Nations Publications, 2007. Available: http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html
4. ESAC (2007). Statement on the conclusion of the ICCVAM retrospective study on organotypic in vitro assays as screening tests to identify potential ocular corrosives and severe eye irritants. Available: http://ecvam.jrc.it/index.htm
5. ICCVAM (2007). Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No: 07-4517. Available: http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm
6. Regulation (EC) No 1907/2006 of the European Parliament and of the Council of 18 December 2006 concerning the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH), establishing a European Chemicals Agency, amending Directive 1999/45/EC and repealing Council Regulation (EEC) No 793/93 and Commission Regulation (EC) No 1488/94 as well as Council Directive 76/769/EEC and Commission Directives 91/155/EEC, 93/67/EEC, 93/105/EC and 2000/21/EC. OJ L 396, 30.12.2006, p. 1.
7. OECD (2002). Test Guideline 405. OECD Guideline for Testing of Chemicals. Acute eye irritation/corrosion. Available: http://www.oecd.org/document/40/0,2340,en_2649_34377_37051368_1_1_1_1,00.html
8. ICCVAM (2007). ICCVAM Recommended BCOP Test Method Protocol. In: ICCVAM Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No: 07-4517. Available: http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm
9. ICCVAM. (2006). Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability Test Method. NIH Publication No: 06-4512. Research Triangle Park: National Toxicology Program. Available: http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_ice.htm
10. INVITTOX (1999). Protocol 124: Bovine Corneal Opacity and Permeability Assay - SOP of Microbiological Associates Ltd. Ispra, Italy: European Centre for the Validation of Alternative Methods (ECVAM).
11. Gautheron, P., Dukic, M., Alix, D. and Sina, J.F. (1992). Bovine corneal opacity and permeability test: An in vitro assay of ocular irritancy. Fundam. Appl. Toxicol. 18:442-449.
12. Siegel, J.D., Rhinehart, E., Jackson, M., Chiarello, L., and the Healthcare Infection Control Practices Advisory Committee (2007). Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings. Available: http://www.cdc.gov/ncidod/dhqp/pdf.
13. Maurer, J.K., Parker, R.D. and Jester, J.V. (2002). Extent of corneal injury as the mechanistic basis for ocular irritation: key findings and recommendations for the development of alternative assays. Reg. Tox. Pharmacol. 36:106-117.
14. Doughty, M.J., Petrou, S. and Macmillan, H. (1995). Anatomy and morphology of the cornea of bovine eyes from a slaughterhouse. Can. J. Zool. 73:2159-2165.
15. Collee, J. and Bradley, R. (1997). BSE: A decade on - Part I. The Lancet 349: 636-641.
16. Sina, J.F., Galer, D.M., Sussman, R.S., Gautheron, P.D., Sargent, E.V., Leong, B., Shah, P.V., Curren, R.D., and Miller, K. (1995). A collaborative evaluation of seven alternatives to the Draize eye irritation test using pharmaceutical intermediates. Fundam Appl Toxicol 26:20-31.
17. ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability (BCOP) Test Method. Available:http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm
18. ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Isolated Chicken Eye (ICE) Test Method. Available:http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm
Deo drugi
DODATAK 1.
DEFINICIJE
Tačnost jeste stepen ujednačenosti između rezultata ispitivanja i prihvaćenih referentnih vrednosti. Ona je merilo karakteristika metode ispitivanja i jedan od aspekata relevantnosti. Često se koristi u istom značenju kao "usklađenost" kako bi se označio udeo tačnih rezultata metode ispitivanja.
Referentna supstanca jeste supstanca koja se koristi kao standard za poređenje sa ispitivanom supstancom. Referentna supstanca ima sledeća svojstva: 1) stalan i pouzdan izvor; 2) strukturnu i funkcionalnu sličnost sa klasom jedinjenja koje se ispituje; 3) poznata fizička/hemijska svojstva; 4) podatke o poznatim efektima i 5) poznati potencijal u opsegu očekivanog odgovora.
Rožnjača jeste prozirni deo prednjeg dela očne jabučice koji pokriva vežnjaču i dužicu i propušta svetlost u unutrašnjost.
Zamućenje rožnjače jeste mera obima zamućenosti rožnjače nakon izlaganja ispitivanoj supstanci. Povećano zamućenje rožnjače ukazuje na oštećenje rožnjače. Zamućenje se može evaluirati subjektivno kao kod Drajzeove metode na oku kunića ili objektivno pomoću instrumenta kao što je opacitometar. Propustljivost rožnjače jeste kvantitativna mera oštećenja epitela rožnjače određivanjem količine boje natrijum fluoresceina koja prolazi kroz sve slojeve ćelija rožnjače.
EPA kategorija 1 jeste korozivno (ireverzibilno uništavanje tkiva oka) koje oštećuje rožnjaču ili izaziva iritaciju koja se održava više od 21 dan1.
EU kategorija R41 jeste oštećenje tkiva oka, ili ozbiljno fizičko propadanje vida, nakon nanošenja ispitivane supstance na prednju površinu oka, koja nije u potpunosti reverzibilna u roku od 21 dana od primene2.
Udeo lažno negativnih jeste udeo svih pozitivnih supstanci koje su metodom ispitivanja pogrešno identifikovane kao negativne. Jedan je od pokazatelja karakteristika metode ispitivanja.
Udeo lažno pozitivnih jeste udeo svih negativnih supstanci koje su metodom ispitivanja pogrešno identifikovane kao pozitivne. Jedan je od pokazatelja karakteristika metode ispitivanja.
GHS jeste Globalno harmonizovani sistem za klasifikaciju i obeležavanje hemikalija, odnosno sistem koji predlaže klasifikaciju hemikalija (supstanci i smeša) prema standardizovanim vrstama i nivoima fizičkih opasnosti i opasnosti po zdravlje ljudi i životnu sredinu, koji obuhvata i odgovarajuće elemente komunikacije, kao što su: piktogrami, znakovi opasnosti, pisana upozorenja, oznake rizika i bezbednosti i bezbednosni listovi, da bi se prenela informacija o njihovim štetnim efektima sa ciljem da se zaštite ljudi (uključujući poslodavce, radnike, prevoznike, potrošače i pružaoce pomoći u vanrednim situacijama) i životna sredina3.
GHS kategorija 1 jeste oštećenje tkiva oka, ili ozbiljno fizičko propadanje vida, nakon nanošenja ispitivane supstance na prednju površinu oka, koja nije potpuno reverzibilna u roku od 21 dana od primene3.
Opasnost jeste svojstvo agensa ili situacije koje može da dovede do štetnih efekata kada su organizam, sistem ili (sub)populacija izloženi tom agensu.
Skor iritacije u in vitro uslovima (In Vitro Irritancy Score, IVIS) jeste vrednost koja se računa prema empirijski izvedenoj formuli koja se koristi u metodi BCOP pomoću koje se srednje vrednosti zamućenja i propustljivosti za svaku ispitivanu grupu kombinuju u jedan jedinstveni skor in vitro za svaku tretiranu grupu. IVIS = srednja vrednost zamućenja + (15 × srednja vrednost propustljivosti).
Negativna kontrola jeste netretirani uzorak koji sadrži sve komponente sistema za ispitivanje. Ovaj uzorak se obrađuje sa uzorcima tretiranim ispitivanom supstancom i drugim kontrolnim uzorcima da utvrdi ima li interakcije između rastvarača i sistema za ispitivanje.
Hemikalija koja nije iritativna jesu supstance koje nisu klasifikovane kao supstance iritativne za oko ERA kategorije 1, 2, ili 3; EU kategorije R41 ili R36 ili GHS kategorije 1, 2A ili 2B.
Hemikalija koja izaziva teško oštećenje oka jeste: a) supstanca koja izaziva ireverzibilno oštećenje tkiva oka; b) supstance koje su klasifikovane kao iritativne za oko GHS kategorije 1, ERA kategorije 1, ili EU kategorije R411,2,3.
Iritativno za oko jeste: a) supstanca koja dovodi do reverzibilne promene u oku nakon nanošenja na prednju površinu oka; b) supstance koje su klasifikovane kao supstance iritativne za oko ERA kategorije 2 ili 3 EU kategorije R36 ili GHS kategorije 2A ili 2B1,2,3.
Jako iritativno za oko jeste: a) supstanca koja izaziva oštećenje tkiva oka nakon nanošenja na prednju površinu oka koje se ne povlači u roku od 21 dana od dana nanošenja ili izaziva ozbiljno fizičko propadanje vida, b) supstance koje su klasifikovane kao supstance iritativne za oko GHS kategorije 1, ERA kategorije 1, ili EU kategorije R411,2,3.
Opacitometar jeste instrument koji se koristi za merenje zamućenja rožnjače kvantitativnom evaluacijom prenošenja svetlosti kroz rožnjaču. Tipičan instrument ima dva odeljka, svaki sa sopstvenim izvorom svetlosti i fotoćelijom. Jedan odeljak se koristi za tretiranu rožnjaču, a drugi se koristi za kalibraciju i podešavanje instrumenta na nultu vrednost. Svetlost iz halogene lampe se šalje kroz kontrolni odeljak (prazna komora bez prozora ili tečnosti) u fotoćeliju i upoređuje sa svetlošću koja se šalje kroz eksperimentalni odeljak, u kome se nalazi komora sa rožnjačom, u fotoćeliju. Upoređuje se razlika u prenošenju svetlosti iz fotoćelija i na digitalnom ekranu se prikazuje numerička vrednost zamućenja.
Pozitivna kontrola jeste uzorak koji sadrži sve komponente sistema za ispitivanje i koji se tretira supstancom za koju se zna da izaziva pozitivni odgovor. Da bi se obezbedilo da varijabilnost u odgovoru pozitivne kontrole može da se ocenjuje tokom vremena, jačina odgovora ne sme da bude preterana.
Pouzdanost pokazuje u kojoj meri metoda ispitivanja može ponovljivo da se izvodi unutar jedne laboratorije i između više laboratorija tokom vremena uz primenu istog postupka. Ocenjuje se izračunavanjem ponovljivosti unutar jedne laboratorije i između više laboratorija.
Kontrola rastvarača/nosača jeste netretirani uzorak koji sadrži sve komponente sistema za ispitivanje, uključujući rastvarač ili nosač koji se obrađuje sa uzorcima tretiranim ispitivanom supstancom i drugim kontrolnim uzorcima kako bi se utvrdila bazna linija odgovora za uzorke tretirane ispitivanom supstancom rastvorenom u tom rastvaraču ili nosaču. Kada se ispituje sa paralelnom negativnom kontrolom, ovaj uzorak pokazuje i da li rastvarač ili nosač reaguje sa sistemom za ispitivanje.
Višestepeno ispitivanje jeste strategija ispitivanja korak po korak gde se određenim redosledom pregledaju sve postojeće informacije o ispitivanoj supstanci, pri čemu se na svakom koraku koristi postupak procene kvaliteta podataka da bi se utvrdilo da li postoji dovoljno informacija za odluku o klasifikovanju supstance kao opasne, pre prelaska na sledeći stepen. Ako se na osnovu postojećih informacija može pripisati iritativni potencijal ispitivanoj supstanci, nije potrebno dodatno ispitivanje. Ako se na osnovu postojećih informacija ne može pripisati iritativni potencijal ispitivane supstance, izvodi se postupak višestepenog ispitivanja korak po korak na životinjama dok ne bude moguće izvršiti nedvosmislenu klasifikaciju.
Validirana metoda ispitivanja jeste metoda ispitivanja kod koje su na osnovu izvršenih studija validacije utvrđeni relevantnost (uključujući i tačnost) i pouzdanost za određenu namenu. Važno je napomenuti da validirana metoda ispitivanja ne mora da ima zadovoljavajuće karakteristike u pogledu tačnosti i pouzdanosti da bi bila prihvatljiva za predloženu namenu.
Kvalitet podataka jeste postupak razmatranja prednosti i slabosti različitih informacija da se donese i podrži zaključak u pogledu potencijalne opasnosti supstance.
DODATAK 2.
SUPSTANCE ZA PROVERU SPOSOBNOSTI ZA IZVOĐENJE METODE ISPITIVANJA BCOP
Pre rutinskog korišćenja metode ispitivanja koja ispunjava zahteve ove metode ispitivanja, laboratorije će možda želeti da pokažu tehničku stručnost tako što će pravilno klasifikovati 10 supstanci preporučenih u Tabeli 1. koja je data u ovoj metodi u pogledu njihovog svojstva da izazivaju teško oštećenje oka. Ove supstance su izabrane da predstavljaju opseg odgovora za lokalnu iritaciju/teško oštećenje oka, na osnovu rezultata ispitivanja in vivo na oku kunića (TG 405) (tj. kategorije 1, 2A, 2B, ili ne ispunjavaju kriterijume za klasifikaciju i obeležene prema UN GHS3,7). Međutim, s obzirom da je potvrđena korisnost ovih ispitivanja (tj. da se identifikuju samo supstance koje izazivaju teško oštećenje/iritaciju oka), postoje samo dva ishoda ispitivanja za svrhu klasifikacije (izazivaju teško oštećenje oka i jako iritativne za oko ili ne izazivaju teško oštećenje oka i nisu jako iritativne) koja pokazuju osposobljenost. Drugi kriterijumi za izbor supstanci bili su da se one mogu naći u prometu, da postoje visokokvalitetni referentni podaci in vivo, a postoje i kvalitetni podaci iz dve metode in vitro za koje se izrađuju Smernice za ispitivanje. Iz tog razloga, iritativne supstance su izabrane sa preporučenog spiska ICCVAM od 122 referentne supstance za validaciju metoda ispitivanja in vitro za utvrđivanje toksičnosti za oko (videti literaturu5). Referentni podaci se mogu naći u ranijem pregledu metode ispitivanja BCOP i metode na izolovanom oku pileta (u daljem tekstu: ICE)17,18.
Tabela 1. Preporučene supstance za pokazivanje tehničke osposobljenosti za BCOP
Supstanca |
CAS br. |
klasa jedinjenja[1] |
agregatno stanje |
Klasifikacija In Vivo[2] |
Klasifikacija In Vitro[3] |
benzalkonijum hlorid (5%) |
8001-54-5 |
Onijum jedinjenje |
Tečno |
Kategorija 1 |
teško oštećenje oka/jako iritativno za oko |
hlorheksidin |
55-56-1 |
amin, amidin |
čvrsto |
Kategorija 1 |
korozivna/jako iritativna supstanca |
dibenzoil-L-vinska kiselina |
2743-38-6 |
karboksilna kiselina, estar |
čvrsto |
Kategorija 1 |
teško oštećenje oka/jako iritativno za oko |
imidazol |
288-32-4 |
heterociklično jedinjenje |
čvrsto |
Kategorija 1 |
teško oštećenje oka/jako iritativno za oko |
trihlorsirćetna kiselina (30%) |
76-03-9 |
karboksilna kiselina |
tečno |
Kategorija 1 |
teško oštećenje oka/jako iritativno za oko |
2,6-dihlorobenzoil hlorid |
4659-45-4 |
acil-halogenid |
tečno |
Kategorija 2A |
ne izaziva teško oštećenje oka/ ni jaku iritaciju oka |
etil-2-metilacetoacetat |
609-14-3 |
keton, estar |
tečno |
kategorija 2B |
ne izaziva teško oštećenje oka/ ni jaku iritaciju oka |
amonijum-nitrat |
6484-52-2 |
neorganska so |
čvrsto |
Kategorija 2A |
ne izaziva teško oštećenje oka/ ni jaku iritaciju oka |
glicerol |
56-81-5 |
alkohol |
tečno |
nije klasifikovana |
ne izaziva teško oštećenje oka/ ni jaku iritaciju oka |
n-heksan |
110-54-3 |
ugljovodonik (aciklični) |
tečno |
nije klasifikovana |
ne izaziva teško oštećenje oka/ ni jaku iritaciju oka |
Skraćenice (Chemical Abstracts Service Registry Number, CASRN) |
|||||
DODATAK 3.
DRŽAČ ROŽNJAČE ZA BCOP
Držači rožnjače za BCOP izrađeni su od inertnog materijala (npr. polipropilen). Držači se sastoje od dve polovine (prednje i zadnje komore) i imaju dve slična cilindrične unutrašnje komore. Svaka komora ima obim od 5 ml i završava se staklenim prozorom, kroz koji se beleže vrednosti zamućenja. Svaka od unutrašnjih komora ima 1,7 cm u prečniku i duboka je 2,2 cm1. O-prsten se nalazi na zadnjoj komori i koristi se za sprečavanje curenja. Rožnjače su postavljene endotelnom stranom na dole na o-prsten zadnjih komora, a prednje komore su postavljene na epitelnu stranu rožnjača. Komore se održavaju na mestu sa po tri šrafa od nerđajućeg materijala koji se nalaze na spoljnim ivicama komore. Na kraju svake komore nalazi se stakleni prozor koji se može ukloniti radi lakšeg pristupa rožnjači. O-prsten se takođe nalazi između stakla prozora i komore kako bi se sprečilo curenje. Dve rupe na vrhu svake komore omogućavaju unošenje i uklanjanje medijuma i ispitivanih jedinjenja. Tokom perioda ispitivanja i inkubacije one su zatvorene gumenim čepovima.
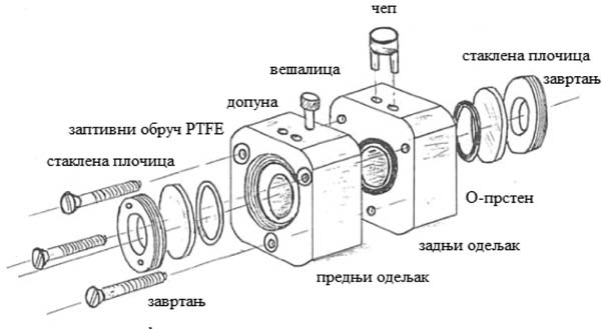
OPACITOMETAR
Opacitometar jeste uređaj za merenje prenosa svetlosti. Svetlo halogene lampe se šalje kroz kontrolni odeljak (prazna komora bez prozora ili tečnosti) u fotoćeliju i upoređuje sa svetlošću koja se šalje kroz eksperimentalni odeljak, u kome se nalazi komora sa rožnjačom, u fotoćeliju. Upoređuje se razlika u prenošenju svetlosti iz fotoćelija i na digitalnom ekranu se prikazuje numerička vrednost zamućenja. Utvrđene su jedinice zamućenja.
Opacitometar obezbeđuje linearni odgovor kroz niz očitavanja zamućenja koji pokrivaju granične tačke koje se koriste za različite klasifikacije opisane Modelom predviđanja (tj. do graničnih tačaka za određivanje teškog oštećenja i jako iritativnog svojstva). Da bi se obezbedila linearna i precizna očitavanja do 75 odnosno 80 jedinica zamućenja, neophodno je da se kalibriše opacitometer koristeći niz kalibratora. Kalibratori (neprozirni listovi od poliestera) se postavljaju u komoru za kalibraciju (komora za rožnjače namenjena da drži kalibratore) i očitavaju na opacitometru. Komora za kalibraciju je namenjena da drži kalibratore na približno istom rastojanju između svetlosti i fotoćelija kao što bi rožnjače bile postavljene tokom merenja zamućenja. Opacitometar se prvo kalibriše na 0 jedinica zamućenja pri čemu se koristi komora za kalibraciju bez kalibratora. Zatim se tri različita kalibratora stavljaju jedan po jedan u komoru za kalibraciju i meri se zamućenje. Kalibratori 1, 2 i 3 pokazuju vrednosti zamućenja koje su jednake njihovim unapred određenim vrednostima od 75, 150, odnosno 225 jedinica zamućenja ± 5%.
B.48. METODA ISPITIVANJA NA IZOLOVANOM OKU PILETA ZA IDENTIFIKOVANJE HEMIKALIJA KOJE IZAZIVAJU TEŠKO OŠTEĆENJE OKA I JAKU IRITACIJU OKA
Deo prvi
1. METODA ISPITIVANJA
1.1. UVOD
Metoda ispitivanja na izolovanom oku pileta (u daljem tekstu: ICE) je in vitro metoda koja se može koristiti pod određenim uslovima i uz određena ograničenja, u cilju klasifikacije supstanci i smeša kao onih koje izazivaju teško oštećenje oka i jaku iritaciju oka1,2,3. U ovoj metodi ispitivanja jako iritativne supstance su one supstance koje izazivaju povrede oka koje se kod zamorca zadržavaju najmanje 21 dan nakon primene. Iako ne može u potpunosti da zameni ispitivanje in vivo na oku zamorca ICE se preporučuje za upotrebu kao deo višestepene strategije ispitivanja za propisanu klasifikaciju i obeležavanje u okviru posebnog područja primene4,5. Ispitivane supstance i smeše6 koje u ovom ispitivanju daju pozitivan rezultat mogu se klasifikovati kao one koje izazivaju teško oštećenje oka ili su jako iritativne bez dodatnog ispitivanja na kuniću. Supstanca sa negativnim rezultatom ispitivanja ispituje se na kuniću korišćenjem strategije višestepenog ispitivanja, koja je definisana u metodi B.5. koja je data u ovom prilogu.
Svrha ove metode ispitivanja je da se opišu postupci koji se koriste za ocenu potencijalnog svojstva ispitivane supstance da izazove teško oštećenje ili jaku iritaciju oka u pogledu njene sposobnosti da u izolovanom oku pileta dovede do pojave toksičnog efekta. Toksični efekti na rožnjaču se mere: 1) kvalitativnim ocenjivanjem zamućenja, 2) kvalitativnim ocenjivanjem oštećenja epitela na osnovu nanošenja fluoresceina na oko (zadržavanje fluoresceina), 3) kvantitativnim merenjem povećane debljine (nadutosti) i 4) kvalitativnim ocenjivanjem makroskopskog morfološkog oštećenja površine. Zamućenje rožnjače, nadutost i procene oštećenja nakon izlaganja ispitivanoj supstanci ocenjuju se pojedinačno, a zatim u kombinaciji, kako bi se izvela klasifikacija prema iritativnosti za oko.
Metodom ICE ispitivane su i supstance iritativne za oko koje izazivaju lezije koje nestaju za manje od 21 dan i supstance koje nisu iritativne. Međutim, preciznost i pouzdanost metode ispitivanja ICE za supstance u ovim kategorijama nisu formalno ocenjene.
1.2. POČETNA RAZMATRANJA I OGRANIČENJA
Ova metoda ispitivanja zasniva se na postupku8 metode ICE Međuagencijskog koordinacionog odbora za validaciju alternativnih metoda (u daljem tekstu: ICCVAM), koji je sačinjen po međunarodnoj validacionoj studiji4,5,9, u kojoj su učestvovali Evropski Centar za validaciju alternativnih metoda, Japanski centar za validaciju alternativnih metoda i Odeljenje za toksikologiju i primenjenu farmakologiju holandskog Instituta za istraživanja kvaliteta života (u daljem tekstu: TNO). Postupak se zasniva na informacijama dobijenim iz objavljenih postupaka i sadašnjeg postupka koji koristi TNO10,11,12,13,14.
Utvrđena ograničenja za ovu metodu ispitivanja zasnivaju se na velikom udelu lažno pozitivnih rezultata za alkohole i velikom udelu lažno negativnih rezultata za supstance u čvrstom stanju i surfaktante (videti odeljak 2.1. ove metode)4. Kada se supstance iz ove klase jedinjenja i agregatnog stanja isključe iz baze podataka, tačnost ICE u sistemima za klasifikaciju EU, ERA i GHS se znatno poboljšava4. S obzirom na svrhu ove analize (tj. da se identifikuju samo supstance koje izazivaju teško oštećenje i jaku iritaciju oka), lažno negativni rezultati nisu od ključnog značaja, jer se takve supstance zatim ispituju na kuniću, ili, u zavisnosti od normativnih zahteva, sa drugim odgovarajuće validiranim ispitivanjima in vitro, primenom višestepene strategije ispitivanja na osnovu kvaliteta podataka. Osim toga, sadašnja baza podataka za validaciju nije dozvoljavala adekvatnu ocenu nekih klasa jedinjenja ili proizvoda (npr., smeše). Ispitivači mogu razmotriti korišćenje ove metode ispitivanja za ispitivanje svih vrsta materijala (uključujući smeše), pri čemu se pozitivan rezultat prihvata kao pokazatelj supstance koja izaziva teško oštećenje oka ili je jako iritativna za oko. Pozitivni rezultati dobijeni upotrebom alkohola oprezno se tumače zbog opasnosti od precenjivanja.
Kod svih postupaka sa okom pileta poštuju se važeći propisi i procedure za rukovanje materijalom humanog ili životinjskog porekla, u koje spadaju, između ostalog tkiva i tkivne tečnosti. Preporučuju se univerzalne mere predostrožnosti za laboratorije15.
Ograničenost ove metode ispitivanja je u tome što iako uzima u obzir neke okularne efekte koji su ocenjeni metodom ispitivanja za određivanje iritacije na oku kunića i u izvesnoj meri njihovu ozbiljnost, ne uzima u obzir oštećenja vežnjače i dužice. Takođe, iako se reverzibilnost oštećenja rožnjače kod metode ICE ne može proceniti sama po sebi, predloženo je, na osnovu studije na oku kunića, da se oceni početna dubina oštećenja rožnjače i tako utvrdi razlika između ireverzibilnih i reverzibilnih efekata16. Ispitivanom metodom ICE ne može da se proceni potencijalna sistemska toksičnost u vezi sa izlaganjem preko oka.
Trenutno se preduzimaju napori da se dodatno karakterišu korisnost i ograničenja metode ispitivanja ICE za određivanje slabije iritativnih i supstanci koje nisu iritativne (videti odeljak 2.1. ove metode). Korisnicima se preporučuje da obezbede organizacijama za validaciju uzorke i/ili podatke za formalnu evaluaciju mogućih korišćenja metode ispitivanja ICE u budućnosti, uključujući i za identifikaciju slabije iritativnih i supstanci koje nisu iritativne.
Svaka laboratorija koja ovu metodu uspostavlja po prvi put, koristi hemikalije za proveru sposobnosti date u Dodatku 2. ove metode. Laboratorija može da koristi ove hemikalije da pokaže tehničku kompeticiju za izvođenje metode ICE pre nego što se podaci ICE dostave radi normativne klasifikacije opasnosti.
1.3. PRINCIP METODE
Metoda ispitivanja ICE je organotipski model koji obezbeđuje kratkoročno održavanje oka pileta u uslovima in vitro. Kod ove metode ispitivanja, oštećenje koje izaziva ispitivana supstanca procenjuje se određivanjem nadutosti rožnjače, zamućenja i zadržavanja fluoresceina. Dok poslednja dva parametra uključuju kvalitativnu procenu, analiza nadutosti rožnjače omogućava kvantitativnu procenu. Svako merenje pretvara se u kvantitativan rezultat koji se koristi za izračunavanje ukupnog indeksa iritacije ili mu se dodeljuje kvalitativna kategorija koja se koristi za klasifikaciju u klasu teško oštećenje oka i jaka iritacija oka in vitro. Oba rezultata se mogu koristiti za predviđanje potencijala ispitivane supstance da izazove teško oštećenje ili jaku iritaciju oka in vivo (videti Kriterijume za odlučivanje).
1.3.1. Izvor i starost očiju pilića
Za ovu analizu obično se koriste oči pilića koji su zaklani u klanicama i namenjeni za ishranu ljudi, čime se eliminiše potreba za laboratorijskim životinjama. Koriste se samo oči zdravih životinja pogodnih za ulazak u lanac ishrane ljudi.
Iako nije sprovedena kontrolisana studija za procenu optimalne starosti pileta, u ovoj metodi ispitivanja koriste se mladi pilići starosti i telesne mase kakvi se obično obrađuju u živinarskim klanicama (tj. pilići stari približno 7 nedelja telesne mase 1,5 kg do 2,5 kg).
1.3.2. Sakupljanje i transport očiju u laboratoriju
Glave se uklanjaju neposredno po omamljivanju pilića, obično strujnim udarom i zasecanjem vrata radi iskrvavljenja. Trebalo da bude lociran lokalni izvor pilića (u blizini laboratorije) tako da njihove glave mogu da se prenesu iz klanice u laboratoriju dovoljno brzo kako bi se svelo na minimum propadanje i/ili kontaminacija bakterijama. Vremenski razmak između sakupljanja pilećih glava i upotrebe očiju u metodi ispitivanja ICE svodi se na minimum (obično u roku od dva sata), kako se ne bi umanjila vrednost rezultata ispitivanja. Ovi rezultati su zasnovani na kriterijumima za izbor očiju i odgovorima pozitivnih i negativnih kontrola. Sve oči upotrebljene u ispitivanju pripadaju istoj grupi očiju sakupljenoj u određenom danu.
Pošto se oči seciraju u laboratoriji, intaktne glave se transportuju iz klanice na sobnoj temperaturi u plastičnim kutijama i navlažene ubrusima natopljenim izotoničnim fiziološkim rastvorom.
1.3.3. Kriterijumi za izbor za očiju koje se koriste u ICE
Oči koje imaju visoku baznu liniju bojenja fluorescinom (tj. > 0,5) ili skor zamućenja rožnjače (tj. > 0,5) odbacuju se nakon izolacije.
Svaka ispitivana grupa i paralelna pozitivna kontrola se sastoji od najmanje tri oka. Za negativnu kontrolnu grupu ili kontrolu rastvarača (ako se umesto fiziološkog rastvora koristi neki drugi rastvarač) koristi se najmanje jedno oko.
1.4. POSTUPAK
1.4.1. Priprema oka
Očni kapci se pažljivo isecaju, vodeći računa da se ne oštetiti rožnjača. Celovitost rožnjače se brzo ocenjuje tako što se na njenu površinu na nekoliko sekundi nanese kap 2% (w/v) natrijum fluoresceina, a zatim se ispere izotoničnim fiziološkim rastvorom. Oči tretirane fluoresceinom se zatim pregledaju mikroskopom sa slit-lampom kako bi se proverilo da li je rožnjača neoštećena (tj. zadržavanje fluoresceina i skor zamućenje rožnjače mora biti ≤ 0,5).
Ako je neoštećeno oko se zatim iseca iz lobanje, vodeći računa da se ne oštetiti rožnjača. Očna jabučica se povuče iz očne duplje tako da se trepavica čvrsto uhvati hirurškom pincetom, i očni mišići iseku savijenim makazama sa tupim vrhom. Važno je da se izbegne oštećenje rožnjače zbog prekomernog pritiska (tj. predmeta za stezanje).
Kada se oko izvadi iz očne duplje, vidljivi deo optičkog nerva ostaje spojen. Kada se izvadi iz očne duplje, oko se stavlja na upijajuću podlogu, a treći očni kapak i drugo vezivno tkivo se odseku.
Izvađeno oko stavlja se u stezaljku od nerđajućeg čelika sa rožnjačom u vertikalnom položaju. Stezaljka se prenese u komoru uređaja za superfuziju16. Stezaljka je postavljena u uređaj za superfuziju tako da je cela rožnjača snabdevena kapima fiziološkog rastvora. Temperatura u komorama uređaja za superfuziju je kontrolisana na 32° C ± 1,5° C. U Dodatku 3. ove metode dat je dijagram tipičnog uređaja za superfuziju i stezaljke za oko, koji se mogu naći na tržištu ili napraviti. Uređaj se može prilagoditi potrebama pojedinih laboratorija (npr. da se napravi mesta za različit broj očiju).
Nakon što se stave u uređaj za superfuziju, oči se ponovo ispituju mikroskopom sa slit-lampom kako bi se proverilo da nisu oštećene tokom postupka seciranja. Debljina rožnjače se meri i u ovoj fazi na najvišoj tački rožnjače elementom za merenje dubine na mikroskopu sa slit-lampom. Zamenjuju se oči sa 1) skorom zadržavanja fluoresceina > 0,5; 2) zamućenja rožnjače > 0,5 ili 3) bilo kakvim dodatnim znacima oštećenja. Od očiju koje se ne odbace na osnovu bilo kojeg od ovih kriterijuma, odbacuju se pojedinačne oči sa rožnjačom čija debljina odstupa više od 10% od srednje vrednosti za sve oči. Mikroskopi sa slit-lampom mogu da pokažu različite vrednosti debljine rožnjače ako je širina proreza drugačije podešena. Širina proreza je podešena na 0,095 mm.
Kada se sve oči ispitaju i odobre, oči se inkubiraju od 45 minuta do 60 minuta da se pre primena doze dovedu u ravnotežu sa sistemom za ispitivanje. Nakon perioda uravnotežavanja, kao bazna linija za debljinu i zamućenje rožnjače beleži se nulta referentna vrednost (tj. vreme = 0). Skor fluorescina određen pri seciranju koristi se kao bazna linija za taj efekat.
1.4.2. Primena ispitivane supstance
Odmah nakon merenja nultih referentnih vrednosti, oko (u svom držaču) se uklanja iz uređaja za superfuziju, stavlja u horizontalan položaj, a ispitivana supstanca se nanosi na rožnjaču.
Ispitivane supstance u tečnom stanju se obično ispituju nerazblažene, ali po potrebi mogu da se razblaže (npr. kao deo dizajna ispitivanja). Najpogodniji kao rastvarač za razblažene supstance je fiziološki rastvor. Međutim, pod kontrolisanim uslovima mogu da se koriste i alternativni rastvarači, ali se prikazuje i prikladnost rastvarača, osim fiziološkog rastvora.
Ispitivane supstance u tečnom stanju nanose se na rožnjaču tako što se celokupna površina rožnjače ravnomerno prekrije ispitivanom supstancom; standardna zapremina je 0,03 mL.
Ako je moguće, supstance u čvrstom stanju se usitnjavaju što je više moguće tučkom u avanu ili sličnim sredstvom za drobljenje. Prašak se nanosi na rožnjaču tako da površina bude ravnomerno prekrivena ispitivanom supstancom; standardna količina je 0,03 g.
Ispitivana supstanca (u tečnom ili čvrstom stanju) ostavi se da deluje 10 sekundi, a zatim se ispere iz oka fiziološkim rastvorom (oko 20 mL) na sobnoj temperaturi. Oko (u držaču) se potom vrati u uređaj za superfuziju u prvobitni uspravni položaj.
1.4.3. Kontrole
Svaki eksperiment obuhvata paralelnu negativnu kontrolu ili kontrolu rastvarača/nosača i pozitivne kontrole.
Pri ispitivanju supstanci u tečnom stanju u koncentraciji 100% ili čvrstih supstanci, fiziološki rastvor se koristi kao paralelna negativna kontrola u metodi ICE da se otkriju nespecifične promene u sistemu za ispitivanje i da se proveri da li uslovi ispitivanja prouzrokuju iritativni odgovor.
Prilikom ispitivanja razblaženih tečnih hemikalija, u ispitivanje se uključuje paralelna kontrolna grupa rastvarača/nosača, da se otkriju nespecifične promene u sistemu za ispitivanje i da se proveri da li uslovi ispitivanja uzrokuju iritativni odgovor. Može se koristiti samo rastvarač/nosač za koji je dokazano da nema štetnih efekata na sistem za ispitivanje.
U svako ispitivanje, kao paralelna pozitivna kontrola, uključuju se supstance poznate kao iritativne za oko kako bi se proverilo da li dolazi do očekivanog odgovora. Kako se ICE koristi u ovoj metodi ispitivanja da se identifikuju supstance koje izazivaju teško oštećenje oka ili jaku iritaciju, pozitivna kontrola je referentna supstanca koja u ovoj metodi ispitivanja izaziva jak odgovor. Da bi se obezbedilo da varijabilnost u odgovoru pozitivne kontrole može da se ocenjuje u daljem vremenskom periodu, stepen jačine odgovora ne sme biti preteran. Za pozitivnu kontrolu se sakuplja dovoljno podataka in vitro kako bi se mogao izračunati statistički definisan prihvatljiv raspon pozitivne kontrole. Ako za određenu pozitivnu kontrolu ne postoje odgovarajuće podaci dobijeni metodom ICE iz ranijih ispitivanja, sprovode se studije u kojima će se ovi podaci prikupiti.
Primeri pozitivnih kontrola za ispitivane supstance u tečnom stanju su 10%-tna sirćetna kiselina ili 5%-tni benzalkonijum hlorid, dok su primeri pozitivne kontrole za ispitivane supstance u čvrstom stanju natrijum hidroksid ili imidazol.
Referentne supstance su pogodne za ocenu potencijala iritativnosti za oko koji nepoznate hemikalije specifične klase jedinjenja ili proizvoda imaju, ili za ocenu relativnog iritativnog potencijala iritanasa za oko u određenom opsegu iritativnih odgovora.
1.4.4. Merenje efekata
Tretirane rožnjače se evaluiraju pre ispitivanja i sa početkom u 30, 75, 120, 180 i 240 minuta (± 5 minuta) po ispiranju koje se vrši nakon tretmana. Ovi vremenski intervali obezbeđuju adekvatan broj merenja tokom četvorosatnog tretmana i ostavljaju dovoljno vremena između merenja da se sprovedu neophodna posmatranja svih očiju.
Efekti koji se evaluiraju su zamućenje rožnjače, nadutost, zadržavanje fluoresceina, i morfološki efekti (npr. udubljivanje ili opuštanje epitela). Svi efekti, izuzev zadržavanja fluoresceina (što se određuje samo pre tretmana i 30 minuta posle izlaganja ispitivanoj supstanci) određuju se u svakom od gore navedenih vremenskih intervala.
Preporučuje se fotografisanje radi dokumentovanja zamućenja rožnjače, zadržavanja fluoresceina, morfoloških efekata i, ako se sprovodi, histopatologija.
Posle završnog pregleda nakon četiri sata, preporučuje se da korisnici čuvaju oči u odgovarajućem fiksativu (npr. neutralni puferovani formalin) za eventualno histopatološko ispitivanje.
Nadutost rožnjače se određuje merenjem debljine rožnjače optičkim pahimetrom na mikroskopu sa slit-lampom. Izražava se kao procenat i izračunava se na osnovu merenja debljine rožnjače prema sledećoj formuli:
( |
debljina rožnjače u vremenu t - debljina rožnjače u vremenu = 0 |
) |
x 100 |
debljina rožnjače u vremenu = 0 |
Srednji procenat nadutosti rožnjače za sve ispitivane oči računa se za svako vreme posmatranja. Na osnovu najvišeg srednjeg skora nadutosti rožnjače, koja je zabeležena u bilo koje vreme, za svaku ispitivanu supstancu određuje se ukupni skor za kategoriju.
Kod procenjivanja zamućenja rožnjače koristi se površina rožnjače koja je najmanje zamućena. Srednja vrednost zamućenja rožnjače za sve ispitivane oči izračunava se za svako vreme posmatranja. Na osnovu najvišeg srednjeg skora zamućenja rožnjače, koji je zabeležen u bilo koje vreme, za svaku ispitivanu supstancu određuje se ukupni skor kategorije (Tabela 1).
Tabela 1. Skorovi zamućenja rožnjače
Skor |
Zapažanje |
0 |
Nije zamućena |
0,5 |
veoma malo zamućena |
1 |
Rasute ili difuzne oblasti; delovi dužice su jasno vidljivi |
2 |
lako uočljiva oblast koja propušta svetlost; delovi dužice malo mutni |
3 |
Veoma zamućena rožnjača; nisu vidljivi specifični delovi dužice, veličina zenice se jedva raspoznaje |
4 |
Potpuna zamućenje rožnjače; dužica se ne vidi |
Srednja vrednost zadržavanja fluoresceina za sve ispitivane oči se izračunava samo za vreme posmatranja od 30 minuta i za svaku ispitivanu supstancu se dodeljuje kao ukupni skor kategorije (Tabela 2).
Tabela 2. Skorovi zadržavanja fluoresceina
Skor |
Zapažanje |
0 |
Bez zadržavanja fluoresceina |
0,5 |
Veoma mala obojenost pojedinačnih ćelija |
1 |
Obojenost pojedinih ćelija rasutih širom tretirane oblasti rožnjače |
2 |
Fokusna ili konfluentna obojenost pojedinih ćelija |
3 |
Velike slivene oblasti rožnjače u kojima se zadržava fluorescein |
Morfološki efekti uključuju udubljivanje epitelnih ćelija rožnjače, opuštanje epitela, hrapavljenje površine rožnjače i lepljenje ispitivane supstance za rožnjaču. Ovi nalazi mogu da variraju u jačini i mogu se pojaviti istovremeno. Klasifikovanje ovih nalaza je subjektivno u zavisnosti od tumačenja ispitivača.
2. PODACI I IZVEŠTAVANJE
2.1. Ocenjivanje podataka
Rezultati za zamućenje rožnjače, nadutost i zadržavanje fluoresceina posebno se ocenjuju da se formira klasa ICE za svaki efekat. Klase ICE za svaki efekat se zatim kombinuju da daju klasifikaciju na osnovu iritativnosti za svaku ispitivanu supstancu.
2.1. Kriterijumi za odlučivanje
Kada se evaluiraju svi efekti, na osnovu unapred utvrđenih opsega mogu se dodeliti klase ICE. Debljina rožnjače (Tabela 3), zamućenje (Tabela 4) i zadržavanje fluoresceina (Tabela 5) tumače se pomoću četiri ICE klase prema sledećim skalama:
Tabela 3. Kriterijumi za ICE klasifikaciju debljine rožnjače
Srednja nadutost rožnjače (%) [*] |
Klasa ICE |
0 do 5 |
I |
> 5 do 12 |
II |
> 12 do 18 (> 75 min posle tretmana) |
II |
> 12 do 18 (≤ 75 min posle tretmana) |
III |
> 18 do 26 |
III |
> 26 do 32 (> 75 min posle tretmana) |
III |
> 26 do 32 (≤ 75 min posle tretmana) |
IV |
> 32 |
IV |
[*] Skorovi nadutosti rožnjače su primenljivi samo ako je merenje izvršeno pomoću mikroskopa sa Haag-Streit BP900 slit lampom, sa elementom za merenje dubine No I podešavanjem širine 9½ (0,095 mm). Mikroskopi sa ovakvom lampom mogu dati različite rezultate merenja za debljinu rožnjače ako je slit širina drugačije podešena. |
|
Tabela 4. Kriterijumi za ICE klasifikaciju zamućenja
Srednji najviši skor zamućenja [*] |
Klasa ICE |
0,0-0,5 |
I |
0,6-1,5 |
II |
1,6-2,5 |
III |
2,6-4,0 |
IV |
[*] Videti Tabelu 1. |
|
Tabela 5. Kriterijumi za ICE klasifikaciju srednji skor zadržavanja fluoresceina
Srednji skor zadržavanja fluoresceina 30 minuta posle tretmana [*] |
Klasa ICE |
0,0-0,5 |
I |
0,6-1,5 |
II |
1,6-2,5 |
III |
2,6-3,0 |
IV |
[*] Videti Tabelu 2. |
|
Opšta klasifikacija ispitivanih supstanci za iritativnost in vitro procenjuje se očitavanjem klasifikacije iritativnosti koja odgovara kombinaciji kategorija dobijenih za nadutost rožnjače, zamućenje rožnjače i zadržavanje fluoresceina i upotrebom formula iz Tabele 6.
Tabela 6. Ukupna klasifikacija za iritativnost in vitro
Klasifikacija |
Kombinacije tri efekta |
Teško oštećenje oka/jaka iritacija oka |
3 × IV |
[*] Manja verovatnoća da će se ovi efekti kombinovati |
|
Kao što je navedeno u odeljku 1.2. ove metode ako ispitivana supstanca nije identifikovana kao ona koja izaziva teško oštećenje ili jaku iritaciju oka, vrši se dodatno ispitivanje radi klasifikacije i obeležavanja. U primerima sa podacima iz metode in vivo na oku kunića za određivanje supstanci koje izazivaju teško oštećenje oka i koje su jaki iritansi za oko, klasifikovanih prema sistemima klasifikacije ERA1, EU2, ili GHS3, ukupna tačnost metode ispitivanja ICE je 83% (120/144) do 87% (134/154), udeo lažno pozitivnih rezultata 6% (7 / 122) do 8% (9 /116), a lažno negativnih rezultata 41% (13/32) do 50% (15/30). Kada se iz baze podataka isključe supstance iz određenih klasa jedinjenja (tj. alkoholi i surfaktanti) i agregatnih stanja (npr. čvrsto stanje), tačnost ispitivanja ICE prema sistemima klasifikacije EU, ERA i GHS kreće se od 91% (75/82) do 92% (69/75), udeo lažno pozitivnih rezultata kreću se od 5% (4/73) do 6% (4/70), a lažno negativnih kreće se od 29% (2/7) do 3% (3/9)4.
Čak i ako se supstance ne mogu klasifikovati u klasu teškog oštećenja oka ili jake iritacije oka, podaci dobijeni sa ICE u kombinaciji sa podacima iz ispitivanja in vivo na oku kunića ili odgovarajuće validiranim ispitivanjem in vitro korisni za dalju evaluaciju korisnosti i ograničenja metode ICE za utvrđivanje manje iritativnih i supstanci koje nisu iritativne (Smernice za upotrebu metoda ispitivanja in vitro za određivanje toksičnosti za oko su u pripremi).
2.2. Kriterijumi za prihvatljivost studije
Ispitivanje se smatra prihvatljivim ako paralelne negativne ili kontrole nosača/rastvarača i paralelne pozitivne kontrole daju klasifikaciju iritativnosti u nije iritativno, odnosno teško oštećenje/jaka iritacija oka.
3. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju sadrži podatke o (ako su relevantni za sprovođenje studije):
1) Ispitivanim i kontrolnim supstancama:
- hemijski naziv, npr. naziv iz nomenklature IUPAC ili CAS naziv i CAS broj, ako su poznati;
- registarski broj (RN) CAS, ako je poznat;
- čistoća i sastav supstanci ili smeša (u masenim procentima), ako je takva informacija dostupna;
- fizičko-hemijska svojstva, relevantna za sprovođenje studije, npr. agregatno stanje, isparljivost, pH vrednost, stabilnost, klasa jedinjenja, rastvorljivost u vodi;
- obrada ispitivanih/kontrolnih supstanci pre ispitivanja, ako je potrebno (npr. zagrevanje, usitnjavanje);
- stabilnost, ako je poznata.
2) Sponzoru i ispitivanoj laboratoriji:
- ime i adresa sponzora, ispitivane laboratorije i rukovodioca studije;
- podaci o izvoru očiju (npr. objekat iz koga su prikupljene);
- skladištenje i uslovi transporta očiju (npr. datum i vreme sakupljanja očiju, vremenski interval pre početka ispitivanja);
- ako je moguće, posebne karakteristike životinja od kojih su sakupljene oči (npr. starost, pol, telesna masa životinje davaoca).
3) Opravdanosti metode ispitivanja i postupak koji je korišćen.
4) Integritetu metode ispitivanja:
- postupak da se obezbedi ispravnost (tj. tačnost i pouzdanost) metode ispitivanja u tokom vremena (npr. periodična ispitivanja supstanci za proveru sposobnosti, korišćenje podataka o negativnim i pozitivnim kontrolama iz ranijih ispitivanja).
5) Kriterijumima za prihvatanje ispitivanja:
- ako je primenljivo, prihvatljivi opsezi referentne kontrole na osnovu podataka iz ranijih ispitivanja.
6) Uslovima ispitivanja:
- opis korišćenog sistema za ispitivanje;
- korišćeni mikroskop sa slit-lampom (npr, model);
- podešavanja za mikroskop sa slit-lampom;
- podaci o upotrebljenim očima pilića, uključujući izjave o njihovom kvalitetu;
- detalji o korišćenom postupku ispitivanja;
- korišćene koncentracije ispitivanih supstanci;
- opis svake izmene postupka ispitivanja;
- pozivanje na podatke iz ranijih ispitivanja modela (tj. negativnih i pozitivnih kontrola, supstance za proveru sposobnosti, referentne supstance);
- opis korišćenih kriterijuma za evaluaciju;
7) Rezultatima:
- opis drugih primećenih efekata;
- po potrebi, fotografije oka.
8) Tumačenju rezultata.
9) Zaključcima.
4. LITERATURA
1. U.S. EPA (1996). Label Review Manual: 2nd Edition. EPA737-B-96-001. Washington, DC: U.S. Environmental Protection Agency.
2. Regulation (EC) No 1272/2008 of the European Parliament and of the Council of 16 December 2008 on classification, labelling and packaging of substances and mixtures, amending and repealing Directive 67/548/EEC and 1999/45/EC, and amending Regulation (EC) No 1907/2006. OJ L 353, 31.12.2008, p. 1.
3. United nations (UN) (2007). Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Second revised edition, UN New York and Geneva, 2007. Available at: http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html
4. ICCVAM (2007). Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No: 07-4517. Available: http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm
5. ESAC (2007). Statement on the conclusion of the ICCVAM retrospective study on organotypic in vitro assays as screening tests to identify potential ocular corrosives and severe eye irritants. Available: http://ecvam.jrc.it/index.htm.
6. Regulation (EC) No 1907/2006 of the European Parliament and of the Council of 18 December 2006 concerning the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH), establishing a European Chemicals Agency, amending Directive 1999/45/EC and repealing Council Regulation (EEC) No 793/93 and Commission Regulation (EC) No 1488/94 as well as Council Directive 76/769/EEC and Commission Directives 91/155/EEC, 93/67/EEC, 93/105/EC and 2000/21/EC. OJ L 396, 30.12.2006, p. 1.
7. OECD (2002). Test Guideline 405. OECD Guideline for Testing of Chemicals. Acute eye irritation/corrosion. Available: http://www.oecd.org/document/40/0, 2340, en_2649_34377_37051368_1_1_1_1,00.html
8. ICCVAM (2007). ICCVAM Recommended ICE Test Method Protocol. In: ICCVAM Test Method Evaluation Report - In Vitro Ocular Toxicity Test Methods for Identifying Ocular Severe Irritants and Corrosives. Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and the National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). NIH Publication No: 07-4517. Available: http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_tmer.htm
9. ICCVAM. (2006). Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Isolated Chicken Eye Test Method. NIH Publication No: 06-4513. Research Triangle Park: National Toxicology Program. Available: http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_ice.htm
10. Prinsen, M.K. and Koëter, B.W.M. (1993). Justification of the enucleated eye test with eyes of slaughterhouse animals as an alternative to the Draize eye irritation test with rabbits. Fd. Chem. Toxicol. 31:69-76.
11. INVITTOX (1994). Protocol 80: Chicken enucleated eye test (CEET). Available: http://ecvam.jrc.it/index.htm
12. Balls, M., Botham, P.A., Bruner, L.H. and Spielmann H. (1995). The EC/HO international validation study on alternatives to the Draize eye irritation test. Toxicol. In Vitro 9:871-929.
13. Prinsen, M.K. (1996). The chicken enucleated eye test (CEET): A practical (pre)screen for the assessment of eye irritation/corrosion potential of test materials. Food Chem. Toxicol. 34:291-296.
14. Chamberlain, M., Gad, S.C., Gautheron, P. and Prinsen, M.K. (1997). IRAG Working Group I: Organotypic models for the assessment/prediction of ocular irritation. Food Chem. Toxicol. 35:23-37.
15. Siegel, J.D., Rhinehart, E., Jackson, M., Chiarello, L., and the Healthcare Infection Control Practices Advisory Committee (2007). Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings. Available: http://www.cdc.gov/ncidod/dhqp/pdf/isolation2007.pdf
16. Maurer, J.K., Parker, R.D. and Jester J.V. (2002). Extent of corneal injury as the mechanistic basis for ocular irritation: key findings and recommendations for the development of alternative assays. Reg. Tox. Pharmacol. 36:106-117.
17. Burton, A.B.G., M. York and R.S. Lawrence (1981). The in vitro assessment of severe irritants. Fd. Cosmet.- Toxicol.- 19, 471-480.
18. ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe Irritants: Bovine Corneal Opacity and Permeability (BCOP) Test Method. Available: http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm
19. ICCVAM (2006). Background review document, Current Status of In Vitro Test Methods for Identifying Ocular Corrosives and Severe IrritantsIsolated Chicken Eye (ICE) Test Method. Available: http://iccvam.niehs.nih.gov/methods/ocutox/ivocutox/ocu_brd_bcop.htm
Deo drugi
DODATAK 1.
DEFINICIJE
Tačnost jeste stepen ujednačenosti između rezultata ispitivanja i prihvaćenih referentnih vrednosti. Merilo je karakteristika metode ispitivanja i jedan od aspekata relevantnosti. Ovaj termin se često koristi u istom značenju kao "usklađenost" kako bi se označio udeo tačnih rezultata metode ispitivanja.
Referentna supstanca jeste supstanca koja se koristi kao standard za poređenje sa ispitivanom supstancom. Referentna supstanca ima sledeća svojstva: 1) stalan i pouzdan izvor; 2) strukturnu i funkcionalnu sličnost sa klasom jedinjenja koje se ispituje; 3) poznata fizička/hemijska svojstva; 4) podatke o poznatim efektima i 5) poznati potencijal u opsegu očekivanog odgovora.
Rožnjača jeste prozirni deo prednjeg dela očne jabučice koji pokriva vežnjaču i dužicu i propušta svetlost u unutrašnjost.
Zamućenje rožnjače jeste mera obima zamućenosti rožnjače nakon izlaganja ispitivanoj supstanci. Povećano zamućenje rožnjače ukazuje na oštećenje rožnjače. Zamućenje se može evaluirati subjektivno kao kod Drajzeove metode na oku kunića, ili objektivno pomoću instrumenta kao što je opacitometar.
Nadutost rožnjače jeste objektivno merenje u metodi ICE, da se utvrdi stepen nadutosti rožnjače nakon izlaganja ispitivanoj supstanci. Izražava se u procentima i izračunava se od bazne linije (vrednosti pre nanošenja) izmerenih vrednosti debljine rožnjače i debljina zabeleženih u ispitivanju ICE u redovnim intervalima nakon izlaganja ispitivanoj hemikaliji. Stepen nadutosti rožnjače ukazuje na oštećenje rožnjače.
ERA kategorija 1 jeste korozivno (ireverzibilno uništavanje tkiva oka) koje oštećuje rožnjaču ili izaziva iritaciju koja se održava više od 21 dan1.
EU kategorija R41 jeste oštećenje tkiva oka, ili ozbiljno fizičko propadanje vida, nakon nanošenja ispitivane supstance na prednju površinu oka, koja nije u potpunosti reverzibilna u roku od 21 dana od primene2.
Udeo lažno negativnih jeste udeo svih pozitivnih supstanci koje su metodom ispitivanja pogrešno identifikovane kao negativne. Jedan je od pokazatelja karakteristika metode ispitivanja.
Udeo lažno pozitivnih jeste udeo svih negativnih supstanci koje su metodom ispitivanja pogrešno identifikovane kao pozitivne. Jedan je od pokazatelja karakteristika metode ispitivanja.
Zadržavanje fluoresceina jeste subjektivno merenje pri ispitivanju ICE u kojem se određuje stepen natrijum fluorescina koji se zadržava u epitelnim ćelijama u rožnjači nakon izlaganja ispitivanoj supstanci. Stepen zadržavanja fluoresceina ukazuje na oštećenje epitela rožnjače.
GHS jeste Globalno harmonizovani sistem za klasifikaciju i obeležavanje hemikalija odnosno sistem koji predlaže klasifikaciju hemikalija (supstanci i smeša) prema standardizovanim vrstama i nivoima fizičkih opasnosti i opasnosti po zdravlje ljudi i životnu sredinu, koji obuhvata i odgovarajuće elemente komunikacije, kao što su: piktogrami, znakovi opasnosti, pisana upozorenja, oznake rizika i bezbednosti, i bezbednosni listovi, da bi se prenela informacija o njihovim štetnim efektima sa ciljem da se zaštite ljudi (uključujući poslodavce, radnike, prevoznike, potrošače i pružaoce pomoći u vanrednim situacijama) i životna sredina3.
GHS kategorija 1 jeste oštećenje tkiva oka, ili ozbiljno fizičko propadanje vida, nakon nanošenja ispitivane supstance na prednju površinu oka, koja nije potpuno reverzibilna u roku od 21 dana od primene3.
Opasnost jeste svojstvo agensa ili situacije koje može da dovede do štetnih efekata kada su organizam, sistem ili (sub)populacija izloženi tom agensu.
Negativna kontrola jeste netretirani uzorak koji sadrži sve komponente sistema za ispitivanje. Ovaj uzorak se obrađuje sa uzorcima tretiranim ispitivanom supstancom i drugim kontrolnim uzorcima da utvrdi ima li interakcije između rastvarača i sistema za ispitivanje.
Hemikalija koja nije iritativna jesu supstance koje nisu klasifikovane kao supstance iritativne za oko ERA kategorije 1, 2, ili 3 EU kategorije R41 ili R36; ili GHS kategorije 1, 2A ili 2B.
Hemikalija koja izaziva teško oštećenje oka jeste: a) supstanca koja izaziva ireverzibilno oštećenje tkiva oka; b) supstance koje su klasifikovane kao iritativne za oko GHS kategorije 1, ERA kategorije I ili EU kategorije R411,2,3.
Iritativno za oko jeste: a) supstanca koja dovodi do reverzibilne promene u oku nakon nanošenja na prednju površinu oka; b) supstance koje su klasifikovane kao supstance iritativne za oko ERA kategorije II ili III, EU kategorije R36 ili GHS kategorije 2A ili 2B1,2,3.
Jako iritativno za oko jeste: a) supstanca koja izaziva oštećenje tkiva oka nakon nanošenja na prednju površinu oka koje se ne povlači u roku od 21 dana od dana nanošenja ili izaziva ozbiljno fizičko propadanje vida, b) supstance koje su klasifikovane kao supstance iritativne za oko GHS kategorije 1, ERA kategorije I ili EU kategorije R411,2,3.
Pozitivna kontrola jeste uzorak koji sadrži sve komponente sistema za ispitivanje i koji se tretira supstancom za koju se zna da izaziva pozitivni odgovor. Da bi se obezbedilo da varijabilnost u odgovoru pozitivne kontrole može da se ocenjuje tokom vremena, jačina odgovora ne sme da bude preterana.
Pouzdanost pokazuje u kojoj meri metoda ispitivanja može da se ponavlja unutar jedne laboratorije i između više laboratorija tokom vremena uz primenu istog postupka. Ocenjuje se izračunavanjem ponovljivosti unutar jedne laboratorije i između više laboratorija.
Mikroskop sa slit-lampom jeste instrument koji se koristi za direktno ispitivanje oka pod uvećanjem binokularnog mikroskopa stvaranjem stereoskopske, uspravne slike. U metodi ispitivanja ICE, ovaj instrument se koristi za pregled prednjih struktura oka pileta, kao i da se objektivno izmeri debljina rožnjače sa dodatkom za merenje dubine.
Kontrola rastvarača/nosača jeste netretirani uzorak koji sadrži sve komponente sistema za ispitivanje, uključujući rastvarač ili nosač koji se obrađuje sa uzorcima tretiranim ispitivanom supstancom i drugim kontrolnim uzorcima kako bi se utvrdila bazna linija odgovora za uzorke tretirane ispitivanom supstancom rastvorenom u tom rastvaraču ili nosaču. Kada se ispituje sa paralelnom negativnom kontrolom, ovaj uzorak pokazuje i da li rastvarač ili nosač reaguje sa sistemom za ispitivanje.
Višestepeno ispitivanje jeste strategija ispitivanja korak po korak gde se određenim redosledom pregledaju sve postojeće informacije o ispitivanoj supstanci, pri čemu se na svakom stepenu koristi postupak procene kvaliteta podataka da bi se utvrdilo da li postoji dovoljno informacija za odluku o klasifikovanju supstance kao opasne, pre prelaska na sledeći stepen. Ako se na osnovu postojećih informacija može pripisati iritativni potencijal ispitivanoj supstanci, nije potrebno dodatno ispitivanje. Ako se na osnovu postojećih informacija ne može pripisati iritativni potencijal ispitivane supstance, izvodi se postupak višestepenog ispitivanja korak po korak na životinjama dok ne bude moguće izvršiti nedvosmislenu klasifikaciju.
Validirana metoda ispitivanja jeste metoda ispitivanja kod koje su na osnovu izvršenih studija validacije utvrđeni relevantnost (uključujući i tačnost) i pouzdanost za određenu namenu. Važno je napomenuti da validirana metoda ispitivanja ne mora da ima zadovoljavajuće karakteristike u pogledu tačnosti i pouzdanosti da bi bila prihvatljiva za predloženu namenu.
Kvalitet podataka jeste postupak razmatranja prednosti i slabosti različitih informacija da se donese i podrži zaključak u pogledu potencijalne opasnosti supstance.
DODATAK 2.
SUPSTANCE ZA PROVERU SPOSOBNOSTI ZA IZVOĐENJE METODE ISPITIVANJA ICE
Pre rutinskog korišćenja metode ispitivanja koja ispunjava zahteve ove metode ispitivanja, laboratorije će možda želeti da pokaže tehničku stručnost tako što će pravilno klasifikovati 10 supstanci preporučenih u Tabeli 1. koja je data u ovoj metodi u pogledu njihovog svojstva da izazivaju teško oštećenje oka. Ove supstance su izabrane da predstavljaju opseg odgovora za lokalnu iritaciju/teško oštećenje oka, na osnovu rezultata ispitivanja in vivo na oku kunića (Uputstvo za ispitivanje OECD 405) (tj. kategorije 1, 2A, 2B, ili neklasifikovane i obeležene prema UN GHS3,7. S obzirom da je potvrđena korisnost ovih ispitivanja (tj. da se identifikuju samo supstance koje izazivaju teško oštećenje/iritaciju oka), postoje samo dva ishoda ispitivanja u svrhu klasifikacije (izazivaju teško oštećenje oka i jako iritativne za oko ili ne izazivaju teško oštećenje oka i nisu jako iritativne) koja pokazuju osposobljenost. Drugi kriterijumi za izbor supstanci bili su da se one mogu naći u prometu, da postoje visokokvalitetni referentni podaci in vivo, a postoje i kvalitetni podaci iz dve metode in vitro za koje se izrađuju Smernice za ispitivanje. Iz tog razloga, iritativne supstance su izabrane sa preporučenog spiska ICCVAM od 122 referentne supstance za validaciju metoda ispitivanja in vitro za utvrđivanje toksičnosti za oko (videti literaturu5). Referentni podaci se mogu naći u ranijem pregledu metode ispitivanja BCOP i metode na izolovanom oku pileta (ICE)18,19.
Tabela 1. Preporučene supstance za pokazivanje tehničke osposobljenosti za ICE
Supstanca |
CAS br. |
klasa jedinjenja [1] |
agregatno stanje |
Klasifikacija In Vivo [2] |
Klasifikacija In Vitro[3] |
benzalkonijum hlorid (5%) |
8001-54-5 |
onijum jedinjenje |
Tečno |
Kategorija 1 |
teško oštećenje oka/jako iritativno za oko |
hlorheksidin |
55-56-1 |
amin, amidin |
čvrsto |
Kategorija 1 |
korozivna/jako iritativna supstanca |
dibenzoil-L-vinska kiselina |
2743-38-6 |
karboksilna kiselina, estar |
čvrsto |
Kategorija 1 |
teško oštećenje oka/jako iritativno za oko |
imidazol |
288-32-4 |
heterociklično jedinjenje |
čvrsto |
Kategorija 1 |
teško oštećenje oka/jako iritativno za oko |
trihlorsirćetna kiselina (30%) |
76-03-9 |
karboksilna kiselina |
tečno |
Kategorija 1 |
teško oštećenje oka/jako iritativno za oko |
2,6-dihlorobenzoil hlorid |
4659-45-4 |
acil-halogenid |
tečno |
Kategorija 2A |
ne izaziva teško oštećenje oka/ ni jaku iritaciju oka |
etil-2-metilacetoacetat |
| 609-14-3 |
keton, estar |
tečno |
Kategorija 2B |
ne izaziva teško oštećenje oka/ ni jaku iritaciju oka |
amonijum-nitrat |
6484-52-2 |
neorganska so |
čvrsto |
Kategorija 2A |
ne izaziva teško oštećenje oka/ ni jaku iritaciju oka |
glicerol |
56-81-5 |
alkohol |
tečno |
nije klasifikovana |
ne izaziva teško oštećenje oka/ ni jaku iritaciju oka |
n-heksan |
110-54-3 |
ugljovodonik (aciklični) |
tečno |
nije klasifikovana |
ne izaziva teško oštećenje oka/ ni jaku iritaciju oka |
Skraćenice (Chemical Abstracts Service Registry Number, CASRN): |
|||||
DODATAK 3.
DIJAGRAMI UREĐAJA ZA SUPERFUZIJU KOJI SE KORISTI U METODI ICE I STEZALJKE ZA OKO
Za dodatne generičke opise uređaja za superfuziju i stezaljke za oko videti literaturu17.
Metode ispitivanja svojstava hemikalija koja utiču na životnu sredinu
C.1. AKUTNA TOKSIČNOST PO RIBE
Deo prvi
1. METODA ISPITIVANJA
1.1. UVOD
Svrha ove metode je da se za ispitivanu supstancu utvrdi letalna akutna toksičnost po slatkovodne ribe. U ispitivanju se koristi sistem (statički, polustatički ili protočni) koji je najprikladniji za konstantno održavanje ispitivanih koncentracija supstance u vodi. Izbor je olakšan kada se raspolaže podacima o rastvorljivosti u vodi, naponu pare, hemijskoj stabilnosti, konstantama disocijacije i biorazgradljivosti supstance.
Dodatne podatke (npr. podaci o strukturnoj formuli, stepenu čistoće, vrsti i procentu značajnih nečistoća, prisustvu i količini aditiva, koeficijent raspodele u sistemun-oktanol/voda) uzeti u obzir pri planiranju ispitivanja i pri tumačenju dobijenih rezultata.
1.2. DEFINICIJE I MERNE JEDINICE
Akutna toksičnost jeste vidljivi štetan efekat koji nastaje u organizmu usled izlaganja supstanci u toku kratkog vremenskog perioda (dani). U ispitivanju, akutna toksičnost izražava se kao srednja letalna koncentracija (u daljem tekstu: LC50), odnosno koncentracija supstance u vodi koja dovodi do smrti 50% jedinki ispitivane grupe riba, koje su neprekidno izložene u toku unapred naznačenog vremenskog perioda.
Sve koncentracije supstanci koje se ispituju izražavaju se u jedinicama mase po zapremini (mg/l) ili u masenim koncentracijama (mg/kg).
1.3. REFERENTNE SUPSTANCE
Na osnovu rezultata ispitivanja sa referentnom supstancom može da se utvrdi da li je u laboratorijskim uslovima ispitivanja došlo do značajne promene osetljivosti vrste na kojoj se vrši ispitivanje.
Za ovu metodu ispitivanja nisu propisane referentne supstance.
1.4. PRINCIP METODE
Preliminarno ispitivanje supstance vrši se za koncentraciju od 100 mg/l, kako bi se utvrdilo da je vrednost LC50 viša od ove koncentracije.
Ispitivanje traje 96 sati. U toku ovog vremena ribe se izlažu ispitivanoj supstanci koja se dodaje u vodu u opsegu koncentracija. Na najmanje svaka 24 sata, beleži se smrtnost riba i pritom se, kad god je moguće, izračunava vrednost LC50.
1.5. KRITERIJUMI KVALITETA
Kriterijumi kvaliteta primenjuju se na čitavu metodu ispitivanja, uključujući i preliminarno ispitivanje.
Na kraju ispitivanja smrtnost u kontrolnim grupama ne sme da prelazi 10% (ili više od jedne ribe u kontrolnoj grupi sa manje od 10 jedinki).
U toku čitavog ispitivanja koncentracija rastvorenog kiseonika u vodi je viša od 60% zasićenja.
U toku trajanja ispitivanja, koncentracije ispitivane supstance održavati u granicama od 80% od početnih koncentracija.
Za supstance koje se lako rastvaraju u ispitivanom medijumu i obrazuju stabilne rastvore, odnosno rastvore koji u znatnoj meri ne isparavaju, ne raspadaju se, ne podležu hidrolizi ili se ne adsorbuju, može se uzeti da je početna koncentracija jednaka nominalnoj koncentraciji. Sve vreme trajanja ispitivanja trebalo bi da budu zadovoljeni kriterijumi kvaliteta i koncentracije supstance održane u okviru propisanih vrednosti, za šta se prilažu dokazi.
Za supstance koje su slabo rastvorljive u ispitivanom mediju ili imaju sposobnost obrazovanja stabilnih emulzija, ili disperzija, ili nisu stabilne u vodenim rastvorima, za početnu koncentraciju obavezno se uzima vrednost koncentracije koja je izmerena u rastvoru (ili ako ne postoji tehnička mogućnost, koncentracija izmerena u vodenom stubu) na početku ispitivanja. Koncentracija supstance se određuje nakon perioda stabilizacije i to pre uvođenja riba u sistem za ispitivanje.
U toku samog ispitivanja sprovode se dodatna merenja kako bi se potvrdile stvarne koncentracije izlaganja, kao i ispunjavanje kriterijuma kvaliteta.
Vrednost pH ne varira za više od 1.
1.6. OPIS METODE
U ispitivanju se koriste tri različita sistema:
1) statičan:
- u toku ispitivanja nema protoka ispitivanog rastvora (rastvori se ne obnavljaju u komorama za ispitivanje);
1) polustatičan:
- ispitivani rastvor ne protiče, ali se u komorama za ispitivanje rastvori redovno obnavljaju u dužim vremenskim intervalima (npr. na svaka 24 sata).
2) protočni:
- ispitivani rastvor se stalno obnavlja, čime se obezbeđuje stalna koncentracija rastvora i sprečava nagomilavanje kontaminenata u komorama za ispitivanje.
1.6.1. Reagensi
1.6.1.1. Rastvori ispitivane supstance
Za pripremu osnovnih rastvora u koncentracijama predviđenim za ispitivanje upotrebljava se dejonizovana voda ili obična voda u skladu sa specifikacijom iz odeljka 1.6.1.2. ove metode.
Koncentracije koje su određene za ispitivanje pripremaju se razblaživanjem osnovnog rastvora. Ako se ispituju visoke koncentracije, supstanca se može odmah rastvoriti u vodi koja se koristi za razblaživanje.
Supstance se ispituju dok se ne dostigne granica rastvorljivosti. Za neke supstance, npr. one supstance koje imaju nisku rastvorljivost u vodi ili visoku vrednost koeficijenta raspodele u sistemu n-oktanol/voda (u daljem tekstu: Pow) ili one supstance koje pre obrazuju stabilne disperzije nego prave vodene rastvore, prihvatljivo je da se izvrši ispitivanje koncentracije supstance koja je iznad granice rastvorljivosti, kako bi potvrdili da je postignuta koncentracija maksimalne rastvorljivosti, odnosno stabilna koncentracija. Treba imati u vidu da ova koncentracija na neki drugi način ne ometa sistem za ispitivanje (npr. obrazovanjem površinskog sloja koji sprečava oksigenaciju vode, itd.).
Ultrazvučna disperzija, organski rastvarači, emulgatori ili disperziona sredstva mogu se upotrebiti za pripremu osnovnog rastvora supstance čija je rastvorljivost u vodi niska ili da bi se pospešila disperzija u ispitivanom medijumu. U slučaju da se koriste, sve ispitivane koncentracije sadrže istu količinu pomoćnih supstanci. Istoj koncentraciji pomoćnih supstanci, koja se koristi u serijama ispitivanja, izlažu se i ribe u dodatnoj kontrolnoj grupi. Koncentraciju pomoćnih supstanci u ispitivanom medijumu svesti na minimum i ona ni u kom slučaju ne sme premašiti vrednost od 100 mg/l.
Ispitivanje se izvodi bez podešavanja pH vrednosti. Ako se utvrdi da je došlo do značajne promene pH vrednosti, prilažu se rezultati dobijeni u ponovljenom ispitivanju za koje je pH vrednost prethodno bila podešena. pH vrednost osnovnog rastvora se podešava prema pH vrednosti vode za razblaživanje, osim ako ne postoji konkretan razlog da se tako ne uradi. U tu svrhu prvenstveno se koriste HCl i NaOH. Podešavanje pH vrednosti se vrši na način kojim se neće u značajnijoj meri promeniti koncentracija ispitivane supstance. U izveštaju o ispitivanju navesti ukoliko usled podešavanja pH vrednosti dođe do bilo kakve hemijske reakcije ili precipitacije ispitivane supstance.
1.6.1.2. Voda za gajenje i razblaživanje
Za ovu namenu koristi se pitka voda (iz izvora koji nije zagađen potencijalno štetnim koncentracijama hlora, teških metala ili drugih supstanci), kvalitetna prirodna voda ili rekonstituisana voda (videti Deo drugi ove metode). Ukupna tvrdoća vode da bude između 10 mg/l CaCO3 i 250 mg/l CaCO3, a pH vrednost između 6,0 i 8,5.
1.6.2. Oprema
Oprema za ispitivanje sadrži:
- automatski sistem za razblaživanje (u ispitivanju sa protočnim sistemom);
- oksimetar;
- instrument za određivanje tvrdoće vode;
- odgovarajuću aparaturu za kontrolu temperature;
- pH metar.
Sva oprema je izrađena od hemijski inertnog materijala.
1.6.3. Ribe
Ribe koje se koriste u ispitivanju su zdrave i bez vidljivih deformacija.
Vrsta ribe se bira na osnovu praktičnih kriterijuma: dostupnost vrste u toku čitave godine, jednostavnost održavanja, prikladnost za obavljanje ispitivanja, relativna osetljivost na hemikalije itd. Uzimaju se u obzir ekonomski, biološki i ekološki faktori koji mogu da utiču na konačan ishod ispitivanja. Kod izbora prikladne vrste riba uzeti u obzir i mogućnost poređenja rezultata i usklađenost između različitih laboratorija u svetu (videti u literaturi1).
Spisak vrsta riba koje se preporučuju za ispitivanje dat je u Delu trećem ove metode. Najčešće se koriste zebrica i kalifornijska pastrmka.
1.6.3.1. Čuvanje
Ribe su iz istog legla, a jedinke, ako je moguće, slične veličine i starosti. Riba se najmanje 12 dana drži pod sledećim uslovima:
3) uvođenje riba:
- shodno sistemu u kom se vrši ispitivanje (recirkulacijski ili protočni) i vrsti ribe;
4) voda:
- videti odeljak 1.6.1.2. ove metode;
5) svetlost:
- 12 do 16 sati osvetljenja dnevno;
6) koncentracije rastvorenog kiseonika:
- najmanje 80% zasićenja;
7) ishrana:
- tri puta nedeljno ili jednom dnevno, sa pauzom od 24 sata pre početka ispitivanja.
1.6.3.2. Smrtnost
Nakon perioda stabilizacije od 48 sati, beleži se smrtnost riba primenom sledećih kriterijuma:
1) ako je smrtnost u prvih 7 dana viša od 10% ukupne populacije, čitava populacija se odbacuje;
2) ako je smrtnost između 5% i 10% ukupne populacije, populacija se čuva dodatnih 7 dana. Ako ne dođe do dodatnih uginuća, populacija se prihvata, u suprotnom, ako se zabeleži još koje uginuće, populacija se odbacuje;
3) ako je smrtnost niža od 5% ukupne populacije, populacija se prihvata.
1.6.4. Adaptacija
Voda u kojoj se gaje ribe i voda koja se koristi u ispitivanju imaju isti kvalitet i temperaturni režim i to najmanje sedam dana pre početka ispitivanja.
1.6.5. Postupak ispitivanja
U preliminarnom ispitivanju određuje se tačan opseg koncentracija za ispitivanje.
Zajedno sa čitavom serijom ispitivanih koncentracija, koristi se i jedna kontrola u koju se ne dodaje ispitivana supstanca, a po potrebi i jedna kontrola sa pomoćnom supstancom.
U zavisnosti od hemijskih i fizičkih svojstava ispitivane supstance, bira se odgovarajući sistem za ispitivanje: statički, polustatički ili protočni, kako bi se zadržali kriterijumi kvaliteta.
Ribe se izlažu ispitivanoj supstanci na sledeći način:
1) izlaganje traje 96 sati;
2) najmanje po 7 jedinki riba za svaku ispitivanu koncentraciju;
3) komore za ispitivanje su odgovarajuće zapremine za zadati nasad;
4) nasad:
- maksimalni nasad je 1 g/l za statični i polustatični sistem, a za protočni sistem nasad može biti i veći;
5) ispitivane koncentracije:
- najmanje pet koncentracija koje se razlikuju za faktor ne veći od 2,2 i odabranih tako da pokrivaju čitav opseg smrtnosti od 0% do 100%;
6) voda:
- videti odeljak 1.6.1.2. ove metode;
7) svetlost:
- 12 do 16 sati osvetljenja dnevno;
8) temperatura:
- je odgovarajuća za vrstu (videti Deo treći ove metode), ali unutar ± 1° C za bilo koji sistem za ispitivanje;
9) koncentracije rastvorenog kiseonika:
- ne manja od 60% zasićenja pri odabranoj temperaturi;
10) ishrana:
- hrana se ne daje.
Ribe se proveravaju nakon prva 2 do 4 sata, a kasnije u intervalima od 24 sata. Ribe se smatraju mrtvim, ako dodirivanjem uske površine ispred leđnog peraja ne dođe do bilo kakve reakcije i ako se ne vide pokreti disanja. Mrtve ribe se uklanjaju odmah po opažanju, a smrtnost se stalno beleži. Beleže se i vidljive abnormalnosti (npr. gubitak ravnoteže, promene u načinu plivanja, poremećaj respiratornih funkcija, pigmentacije i sl).
Svakodnevno se mere pH vrednost, koncentracija rastvorenog kiseonika i temperatura.
Granično ispitivanje
Uz pomoć postupaka opisanih u ovoj metodi može se izvesti granično ispitivanje sa koncentracijom od 100 mg/l, kako bi se pokazalo da je LC50 veća od ove koncentracije.
Ako je priroda supstance takva da se ne može postići koncentracija od 100 mg/l, granično ispitivanje se izvodi sa koncentracijom koja je jednaka rastvorljivosti supstance (ili sa maksimalnom koncentracijom koja formira stabilnu disperziju) u medijumu (videti odeljak 1.6.1.1. ove metode).
Granično ispitivanje se izvodi sa 7 do 10 riba i sa istim brojem riba u kontroli. (Na osnovu binomne teoreme predviđa se da je u grupi od 10 riba sa nultom stopom smrtnosti, sa 99,9% intervalom poverenja, vrednost LC50 viša od koncentracije koja se koristila u graničnom ispitivanju. Ako u grupi od 7, 8 ili 9 riba nema smrtnosti, tada je najmanje sa 99% intervalom poverenja, LC50 viša od koncentracije koja se koristila).
Ako dođe do uginuća, izvodi se potpuno ispitivanje. Beleže se i subletalni efekti.
2. PODACI I PROCENA
Za svaki vremenski interval u kom se beleže opažanja (nakon 24, 48, 72 i 96 sati), na logaritamskom papiru grafički se predstavlja procenat smrtnosti u funkciji koncentracije, za svako preporučeno vreme izlaganja.
Primenom standardnih postupaka, kada je to moguće, za svaki vremenski interval opažanja određuje se vrednost LC50 i interval poverenja (p = 0,05). Ove vrednosti se zaokružuju na jednu ili najviše dve decimale.
U slučajevima kada je nagib krive koncentracija/procenat prevelik da bi omogućio tačno izračunavanje vrednosti LC50, dovoljno je grafički proceniti vrednosti.
Kada dve uzastopne koncentracije, u opsegu faktora 2,2 daju samo 0% ili 100% smrtnost, ove dve vrednosti dovoljne su za određivanje opsega u kom će se naći vrednosti LC50.
Ako se ustanovi da se stabilnost ili homogenost ispitivane supstance ne može održavati, ovo se opažanje beleži sa posebnim osvrtom na tu činjenicu kod tumačenja rezultata.
3. IZVEŠTAJ
Izveštaj, ako je moguće, sadrži sledeće podatke:
- vrsta ribe koja se ispituje (latinski naziv vrste, soj, dobavljač, prethodni tretman, veličina i broj riba za svaku ispitivanu koncentraciju supstance);
- poreklo vode za razblaživanje i njena osnovna hemijska svojstva (pH, tvrdoća, temperatura);
- postupak pripreme osnovnog rastvora i ispitivanih koncentracija (u slučaju supstanci koje imaju nisku rastvorljivost u vodi);
- koncentracija svake pomoćne supstance;
- spisak svih ispitivanih koncentracija i sve dostupne informacije o stabilnosti ispitivane supstance u rastvoru;
- opis korišćenih metoda i dobijenih rezultata (u slučaju hemijske analize);
- rezultati graničnog ispitivanja (u slučaju da je izvedeno);
- razlozi izbora i detalji o korišćenom sistemu za ispitivanje (npr. statični, polustatični, protočni, da li se vrši aeracija, način uvođenja riba, itd);
- opis opreme korišćene u ispitivanju;
- režim osvetljenja;
- koncentracije rastvorenog kiseonika, pH vrednost i temperatura ispitivanih rastvora na svakih 24 sata;
- dokazi da su ispunjeni kriterijumi kvaliteta;
- tablica koja pokazuje ukupnu smrtnost pri svakoj koncentraciji ispitivane supstance i kontrole (zajedno sa kontrolom pomoćne supstance, ako je potrebno) na kraju svakog vremenskog intervala;
- kriva dozne zavisnosti procenta smrtnosti od ispitivane koncentracije na kraju ispitivanja;
- ako je moguće, vrednosti LC50 na kraju svakog vremenskog intervala (sa 95% intervalom poverenja);
- statističke metode korišćene za određivanje LC50 vrednosti;
- (u slučaju da je korišćena referentna supstanca) uporedni rezultati ispitivanja;
- najviša ispitivana koncentracija koja nije dovela do uginuća ribe za vreme trajanja ispitivanja;
- najniža ispitivana test koncentracija koja je dovela do 100% smrtnosti za vreme trajanje ispitivanja.
4. LITERATURA
1. OECD, Paris, 1981, Test Guideline 203, Decision of the Council C(81) 30 final and updates.
2. AFNOR - Determination of the acute toxicity of a substance to Brachydanio rerio- Static and Flow Through methods - NFT 90-303 June 1985.
3. AFNOR- Determination of the acute toxicity of a substance to Salmo gairdneri - Static and Flow Through methods - NFT 90-305 June 1985.
4. ISO 7346/1,/2 and/3 - Water Quality - Determination of the acute lethal toxicity of substances to a fresh water fish (Brachydanio rerio Hamilton-Buchanan-Teleostei, Cyprinidae). Part 1: Static method. Part 2: Semi-static method. Part 3: Flow-through method.
5. Eidgenössisches Department des Innern, Schweiz: Richtlinien fur Probenahme und Normung von Wasseruntersuchungsmethoden -Part II 1974.
6. DIN Testverfahren mit Wasserorganismen, 38 412 (11) und 1 (15).
7. JIS K 0102, Acute toxicity test for fish.
8. NEN 6506- Water -Bepaling van de akute toxiciteit met behulp van Poecilia reticulata, 1980.
9. Environmental Protection Agency, Methods for the acute toxicity tests with fish, macroinvertebrates and amphibians. The Committee on Methods for Toxicity Tests with Aquatic Organisms, Ecological Research Series EPA-660-75-009, 1975.
10. Environmental Protection Agency, Environmental monitoring and support laboratory, Office of Research and Development, EPA-600/4-78-012, January 1978.
11. Environmental Protection Agency, Toxic Substance Control, Part IV, 16 March 1979.
12. Standard methods for the examination of water and wastewater, fourteen edition, APHA-AWWAWPCF, 1975.
13. Commission of the European Communities, Inter-laboratory test programme concerning the study of the ecotoxicityof a chemical substance with respect to the fish. EEC Study D.8368, 22 March 1979.
14. Verfahrensvorschlag des Umweltbundesamtes zum akuten Fisch-Test. Rudolph, P. und Boje, R. Okotoxikologie, Grundlagen fur die okotoxikologische Bewertung von Umweltchemikalien nach dem Chemikaliengesetz, ecomed 1986.
15. Litchfield, J. T.and Wilcoxon, F., A simplified method for evaluating dose effects experiments, J. Pharm, tExp. Therap., 1949, vol. 96,99.
16. Finney, D.J. Statistical Methods in Biological Assay. Griffin, Weycombe, U.K., 1978.
17. Sprague, J.B. Measurement of pollutant toxicity to fish. Bioassay methods for acute toxicity. Water Res., 1969, vol. 3,793-821.
18. Sprague, J.B. Measurement of pollutant toxicity to fish. II Utilising and applying bioassay results. Water Res. 1970, vol. 4, 3-32.
19. Stephan, C.E. Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelink). American Society for Testing and Materials, ASTM STP 634,1977, 65-84.
20. Stephan, C.E., Busch, K.A., Smith, R., Burke, J. and Andrews, R.W. A computer program for calculating an LC50. US EPA.
Deo drugi
REKONSTITUISANA VODA
Primer prikladnog izvora vode za razblaživanje
Sve hemikalije su analitičke čistoće.
Voda je kvalitetna destilovana voda ili dejonizovana voda sa električnom provodljivošću manjom od 5 mS/cm.
Oprema za destilaciju vode ne sme da sadrži bakarne delove.
Osnovni rastvori
Rastvoriti 11,76 g CaCl2·2H2O (kalcijum-hlorid dihidrat) i dopuniti vodom do zapremine od 1 L.
Rastvoriti 4,93 g MgSO4·7H2O (magnezijum-sulfat heptahidrat) i dopuniti vodom do zapremine od 1 L.
Rastvoriti 2,59 g NaHCO3 (natrijum-hidrogenkarbonat) i dopuniti vodom do zapremine od 1 L.
Rastvoriti 0,23 g KCl (kalijum-hlorid) i dopuniti vodom do zapremine od 1 L.
Rekonstituisana voda za razblaživanje
Pomešati po 25 ml svakog osnovnog rastvora i dopuniti vodom do zapremine od 1 L. Aerisati sve dok se koncentracija rastvorenog kiseonika ne izjednači sa koncentracijom kiseonika u zasićenom vazduhu.
Vrednost pH podesiti na 7,8 ± 0,2.
Ako je potrebno, pH se podešava dodavanjem NaOH (natrijum hidroksida) ili HCl (hlorovodonične kiseline).
Ovako pripremljena voda za razblaživanje ostavi se da stoji oko 12 sati i dalje se ne aeriše.
Zbir Ca i Mg jona u ovom rastvoru iznosi 2,5 mol/l. Odnos Ca i Mg jona iznosi 4:1, a Na i K jona iznosi 10:1. Ukupan alkalitet rastvora iznosi 0,8 mmol/l.
Izmene u postupku pripreme vode za razblaživanje ne smeju da utiču na sastav ili svojstva vode.
Deo treći
VRSTE RIBA KOJE SE PREPORUČUJU ZA ISPITIVANJE
Preporučena vrsta |
Preporučeni temperaturni opseg (°C) |
Preporučena |
Brachydanio rerio (Teleostei, Cyprinidae) (Hamilton - Buchanan), zebrica |
20 do 24 |
3,0 ± 0,5 |
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) |
20 do 24 |
5,0 ± 2,5 |
Cyprinus carpio (Teleostei, Cyprinidae) (Linneaus 1758), šaran |
20 do 24 |
6,0 ± 2,0 |
Oryzias latipes (Teleostei, Poeciliidae) Cyprinodontidae (Tomminck and Schlege 1850) |
20 do 24 |
3,0 ± 1,0 |
Poecilia reticulata (Teleostei, Poeciliidae) (Peters 1859), gupi |
20 do 24 |
3,0 ± 1,0 |
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque Linneaus 1758) |
20 do 24 |
5,0 ± 2,0 |
Onchorhynchus mykiss (Teleostei, Salmonidae)(Walbaum 1988), kalifornijska pastrmka |
12 do 17 |
6,0 ± 2,0 |
Leuciscus idus (Teleostei, Cyprinidae) (Linneaus 1758), jaz |
20 do 24 |
6,0 ± 2,0 |
NABAVLJANJE RIBA
Navedene vrste riba lako se razmnožavaju i uzgajaju. U mnogim delovima sveta ove vrste riba mogu se nabaviti u toku cele godine. Kako su navedene vrste pogodne i za uzgajanje u laboratorijskim uslovima, zdravstveno stanje i poreklo jedinki koje se koriste za ispitivanje je, uz kontrolu prisustva parazita i bolesti, uvek poznato.
Deo četvrti
PRIMER ZAVISNOSTI KONCENTRACIJE OD PROCENTA SMRTNOSTI
Primer određivanja LC50 uz pomoć logaritamskog papira
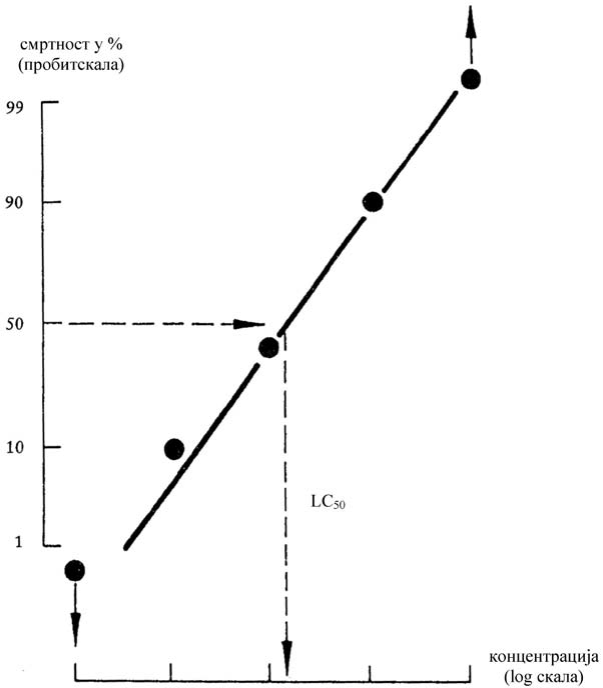
C.2. METODA ISPITIVANJA AKUTNE TOKSIČNOSTI: IMOBILIZACIJA Daphnia sp.
Deo prvi
1. METODA ISPITIVANJA
Metoda se zasniva na Uputstvu za ispitivanje OECD 202 (2004).
1.1. UVOD
Metoda opisuje ispitivanje akutne toksičnosti koje služi za procenu efekta supstanci na dafnije. Postojeće metode ispitivanja korišćene su u najvećoj mogućoj meri1, 2, 3.
1.2. DEFINICIJE
Pojedini izrazi upotrebljeni u ovoj metodi ispitivanja imaju sledeće značenje:
Efektivna koncentracija (EC50) jeste koncentracija supstance za koju je procenjeno da dovodi do imobilizacije 50% jedinki populacije koje su izložene dejstvu supstance u toku unapred definisanog perioda. Dozvoljeno je korišćenje druge definicije uz objašnjenje i navođenje literature.
Imobilisane životinje jesu životinje koje ne zaplivaju 15 sekundi nakon što je rastvor u posudi za ispitivanje lagano uzburkan (čak i u slučaju da i dalje pokreću antene).
1.3. PRINCIP METODE
Mlade dafnije (neonate), starosti do 24 sata na početku ispitivanja, neprekidno se izlažu ispitivanoj supstanci u seriji koncentracija u toku 48 sati. Broj imobilisanih jedinki beleži sena svaka 24 i 48 sati, a vrednosti se porede sa vrednostima u kontrolnoj grupi. Analizom rezultata izračunava se EC50 nakon 48 sata (videti definicije iz odeljka 1.2. ove metode). Izračunavanje EC50 nakon 24 sata nije obavezno.
1.4. PODACI O ISPITIVANOJ SUPSTANCI
Potrebno je imati podatke o rastvorljivosti u vodi i naponu pare ispitivane supstance. Treba da bude dostupna i pouzdana analitička metoda za kvantifikaciju supstance u ispitivanom rastvoru sa podacima o efikasnosti i granicama detekcije. Od koristi su i podaci o strukturnoj formuli, čistoći supstance, stabilnosti u vodi i na svetlu, koeficijent raspodele u sistemun-oktanol/voda (Pow) i rezultati ispitivanja biorazgradljivosti (videti metodu C.4. koja je data u ovom prilogu).
Napomena: Smernice za izvođenje ispitivanja na supstancama sa fizičkim i hemijskim svojstvima koja ih čine teškim za ispitivanje mogu se naći u uputstvu4.
1.5. REFERENTNE SUPSTANCE
Efektivna koncentracija (EC50) referentne supstance određuje se da bi se potvrdila pouzdanost uslova ispitivanja. Za ovu namenu preporučuje se upotreba toksičnih supstanciI koje su korišćene u međulaboratorijskim ispitivanjima1,5. Ispitivanja sa referentnom supstancom izvode se jednom mesečno, a najmanje dva puta godišnje.
____________
I Na osnovu rezultata međulaboratorijskih ispitivanja i Tehničke ispravke ISO 6341 standarda, opseg EC50 za kalijum-dihromat (K2Cr2O7) iznosi 0,6 mg/l do 1,7 mg/l.
1.6. KRITERIJUMI KVALITETA
Da bi ispitivanje bilo prihvaćeno, ispunjavaju se sledeći kriterijumi kvaliteta:
U posudama za ispitivanje u kojima su kontrolne grupe (uključujući i grupe koje sadrže rastvarač), procenat imobilisanih dafnija na kraju ispitivanja ne sme biti veći od 10%.
U posudama za ispitivanje, uključujući i posude u kojima su kontrolne grupe, koncentracija rastvorenog kiseonika na kraju ispitivanja je ≥ 3 mg/l.
Napomena: Da bi se zadovoljio prvi kriterijum, u kontrolnim grupama procenat imobilisanih dafnija ne sme biti veći od 10%. Pored toga, ne sme biti više od 10% jedinki koje pokazuju bilo kakve znake bolesti ili stresa, poput gubljenja boje, ili neko drugo nesvojstveno ponašanje.
1.7. OPIS METODE
1.7.1. Oprema
Posude za ispitivanje i ostala oprema koja dolazi u dodir sa ispitivanim rastvorom su od stakla ili nekog drugog hemijski inertnog materijala. Najčešće se kao posude za ispitivanje koriste epruvete ili čaše. Pre svake upotrebe posude se peru standardnim postupkom za pranje laboratorijskog posuđa. Isparavanje vode i upadanje prašine u rastvor tokom ispitivanja, preduprediti poklapanjem posuda, ali tako da poklopac ne prijanja u potpunosti. Lako isparljive supstance ispituju se u dobro zatvorenim posudama, koje su napunjene do vrha ispitivanim rastvorom, dovoljno velike zapremine da se izbegne da kiseonik nedostaje ili pad koncentracije rastvorenog kiseonika ispod kriterijuma kvaliteta (videti odeljak 1.6. i prvi pasus odeljka 1.8.3. ove metode).
Neophodna je i sledeća oprema (sva ili samo pojedini aparati):
- oksimetar (sa mikrokiseoničnom elektrodom ili neka druga oprema pogodna za merenje koncentracije kiseonika u maloj zapremini uzorka);
- pH metar;
- pogodna oprema za kontrolu temperature;
- oprema za određivanje koncentracije ukupnog organskog ugljenika (u daljem tekstu: TOC);
- oprema za određivanje hemijske potrošnje kiseonika (u daljem tekstu: HPK);
- oprema za određivanje tvrdoće vode, itd.
1.7.2. Ispitivani organizam
Za ispitivanje se koristi vrsta Daphnia magnaStraus, a pogodne su i ostale vrste roda Daphnia (npr. Daphnia pulex). Na početku ispitivanja, jedinke (neonate) moraju biti mlađe od 24 sata, a da bi se smanjila varijabilnost, izričito se preporučuje da se ne uzimaju iz prvog legla adulta. Poreklo jedinki je iz zdravog legla (u kom jedinke ne pokazuju bilo kakve znake stresa poput visoke smrtnosti, prisustva mužjaka, pojave omotača (ephippia), kašnjenja u dobijanju legla, obezbojene jedinke, itd.). Sve jedinke koje se koriste u konkretnom ispitivanju da potiču iz legla koje je ustanovljeno iz jednog matičnog legla. Matična legla se gaje u uslovima koji su u pogledu svetlosnog i temperaturnog režima i medijuma slični onim u toku ispitivanja. U slučaju da je medijum za gajenje dafnija drugačiji od onog koji se koristi u ispitivanju, uvodi se aklimatizacioni period. Adultne jedinke, od kojih će se dobiti neonate koje se koriste u ispitivanju, prebacuju se u medijum za razblaživanje najmanje 48 sati pre početka ispitivanja i drže, do samog početka ispitivanja, na temperaturi na kojoj će se izvoditi ispitivanje.
1.7.3. Voda za gajenje i razblaživanje
Prirodna voda (površinska ili podzemna), rekonstituisana voda ili dehlorisana vodovodna voda predstavljaju pogodnu vodu za gajenje dafnija i vodu za razblaživanje ispitivanog rastvora, pod uslovom da dafnije u njima preživljavaju u toku uzgoja, aklimatizacionog perioda i u toku ispitivanja, ne pokazujući znake stresa. Bilo koja voda koja zadovoljava svojstva prihvatljive vode za razblaživanje (videti Deo drugi ove metode) pogodna je za ispitivanje. Kvalitet vode je ujednačen u toku celog ispitivanja. Rekonstituisana voda se priprema tako što se u dejonizovanu ili destilovanu vodu dodaje tačna količina potrebnih sastojaka poznate analitičke čistoće. Primeri rekonstituisane vode mogu se naći u literaturi1,6 i u Delu trećem ove metode. Važno je napomenuti da medijume koji sadrže helatizirajuće supstance, poput medijuma M4 i M7 (videti Deo treći ove metode), ne koristiti kada se ispituju supstance koje sadrže metale. Vrednost pH da bude u opsegu od 6 do 9. Za ispitivanje sa vrstom Daphnia magna preporučuje se tvrdoća vode od 140 mg/lCaCO3 do 250 mg/lCaCO3, dok je za druge vrste roda Daphnia pogodnija niža tvrdoća vode. Voda za razblaživanje se aeriše pre korišćenja u ispitivanju, da bi koncentracija rastvorenog kiseonika dostigla zasićenje.
Ako se koristi prirodna voda, parametre kvaliteta meriti najmanje dva puta godišnje ili kad god se posumnja da je došlo do značajnih promena karakteristika (videti prethodni pasus i Deo drugi ove metode). Treba izmeriti i sadržaj teških metala (npr. Cu, Pb, Zn, Hg, Cd, Ni). Ako se koristi dehlorisana vodovodna voda, poželjno je svakodnevno meriti sadržaj hlora. Ako se koristi površinska ili podzemna voda, izmeriti elektroprovodljivost i TOC ili HPK.
1.7.4. Ispitivani rastvori
Ispitivani rastvori izabranih koncentracija najčešće se prave razblaživanjem osnovnog rastvora. Zbog toga se osnovni rastvor dobija direktnim rastvaranjem ispitivane supstance u vodi za razblaživanje. Treba, u najvećoj mogućoj meri, izbegavati upotrebu rastvarača, emulzifikatora i disperezionih sredstava. U nekim slučajevima ove pomoćne supstance su neophodne kako bi se uspešno napravio koncentrovani osnovni rastvor. Upotreba rastvarača, emulzifikatora i disperzionih sredstava opisana je u literaturi4. Koncentracija ispitivane supstance u rastvoru ne sme da pređe granicu rastvorljivosti supstance u vodi za razblaživanje.
Ispitivanje izvesti bez podešavanja pH vrednosti. Ako dođe da značajnije promene pH vrednosti, preporučuje se ponavljanje ispitivanja uz podešavanje pH vrednosti na vrednost koju je voda za razblaživanje imala pre rastvaranja ispitivane supstance. Podešavanje pH vrednosti izvodi se tako da se koncentracija ispitivane supstance u osnovnom rastvoru značajnije ne promeni, kao i da se izbegne bilo kakva hemijska reakcija ili precipitacija ispitivane supstance. Za podešavanje pH vrednosti uglavnom se koriste rastvori HCl i NaOH.
1.8. POSTUPAK
1.8.1. Uslovi
1.8.1.1. Ispitivane i kontrolne grupe
Posude za ispitivanje pune se odgovarajućim zapreminama vode za razblaživanje i ispitivanim rastvorima. Zapreminski odnos vazduh/voda da bude jednak u svim ispitivanim i kontrolnim grupama. Nakon toga se dafnije unose u posude za ispitivanje. U ispitivanju se za svaku koncentraciju, kao i kontrolnu grupu, koristi najmanje po 20 jedinki, podeljenih u 4 grupe (ponavljanja) od po 5 jedinki. Zapremina rastvora je dovoljna da obezbedi minimum 2 ml rastvora po jedinki, odnosno, minimalna zapremina po posudi za ispitivanje je 10 ml. Ispitivanje se odvija u polustatičnim (uz kompletno periodično obnavljanje ispitivanog rastvora) ili u protočnim sistemima, ako koncentracije ispitivane supstanca nisu stabilne.
U svakom ispitivanju, obavezno je postaviti po jednu kontrolnu grupu (4 posude sa po 5 jedinki) isključivo sa vodom korišćenom za razblaživanje. Ukoliko je korišćena i pomoćna supstanca pri pravljenju rastvora, postavlja se i dodatna kontrolna grupa sa pomoćnom supstancom rastvorenom u vodi za razblaživanje.
1.8.1.2. Određivanje koncentracije
Kada nisu dostupni podaci o toksičnosti ispitivane supstance, a u cilju određivanja opsega ispitivanih koncentracija, izvodi se preliminarno ispitivanje. Preliminarno ispitivanje se izvodi u širokom opsegu koncentracija ispitivane supstance, pa je dovoljno postaviti po 5 jedinki po kontrolnoj i ispitivanoj grupi (bez ponavljanja). Dužina preliminarnog ispitivanja može biti 48 sati, ali ako se potrebni podaci dobiju u kraćem roku, ispitivanje se može prekinuti nakon 24 sata.
Preliminarno ispitivanje se postavlja u 5 ispitivanih koncentracija, u geometrijskoj seriji sa faktorom od minimum 2,2. Obrazloženje je neophodno ako se koristi manje od 5 različitih ispitivanih koncentracija. U preliminarnom ogledu, izlaganje dafnija najvišoj primenjenoj koncentracija potrebno je da dovede do 100% imobilizacije, dok izlaganje najnižoj izabranoj koncentraciji ne treba da dovede do značajnijeg odgovora.
1.8.1.3. Uslovi u toku ispitivanja
Temperatura na kojoj se izvode ispitivanja za procenu akutne toksičnosti da bude u opsegu od 18° C do 22° C, a u toku jednog ispitivanja akutne toksičnosti, izabrana temperatura ne varira više od ± 1° C. Preporučuje se svetlosni režim od 16 sati svetla i 8 sati mraka, ali je kod fotonestabilnih supstanci dozvoljeno da se celo ispitivanje izvede u mraku.
U toku ispitivanja, nije dozvoljena aeracija rastvora u posudama. Ispitivanje izvesti bez podešavanja pH vrednosti. Životinje se ne hrane u toku trajanja ispitivanja.
1.8.1.4. Dužina ispitivanja
Ispitivanje traje 48 sati.
1.8.2. Posmatrani odgovor
Svaka posuda se proverava nakon 24 i 48 sati od početka ispitivanja (videti definicije iz odeljka 1.2. ove metode). Pored imobilizacije jedinki, prati se i beleži svako neuobičajeno ponašanje ili pojava.
1.8.3. Merenja
Koncentracija rastvorenog kiseonika i pH vrednost mere se na početku i na kraju ispitivanja u kontrolnoj i u ispitivanoj grupi u kojoj je primenjena najviša koncentracija ispitivane supstance. Koncentracija rastvorenog kiseonika u kontrolnim grupama ispunjava kriterijume kvaliteta (videti odeljak 1.6. ove metode). Ni u jednom ispitivanju pH vrednost ne varira za više od 1,5. Temperatura se obično prati u posudama iz kontrolnih grupa ili u prostoriji u kojoj je postavljen ogled. Preporuka je da se temperatura neprekidno prati, a najmanje na početku i na kraju ispitivanja.
Koncentracije supstance izmeriti u grupama sa najnižom i najvišom koncentracijom, na početku i na kraju ispitivanja4. Preporučuje se da se rezultati tumače na osnovu izmerenih koncentracija. Ako se dokaže da se koncentracija ispitivane supstance ne menja u odnosu na nominalnu ili početno izmerenu za više od ± 20%, rezultati se mogu iskazati na osnovu nominalnih ili početno izmerenih vrednosti.
1.9. GRANIČNA STUDIJA
Uz pomoć postupaka opisanih u ovoj metodi, može se izvesti granična studija sa koncentracijom ispitivane supstance od 100 mg/l ili sa vrednošću koncentracije rastvorljivosti supstance u medijumu (uvek se bira niža od ove dve vrednosti) kako bi se pokazalo da je LC50 viša od ove koncentracije. Granična studija se izvodi sa 20 jedinki dafnije, podeljenih u 4 grupe od po 5 jedinki po posudi i sa istim brojem i rasporedom jedinki u kontrolnoj grupi. Ako dođe do imobilizacije jedinki u ispitivanoj grupi, obavezno se izvodi potpuno ispitivanje. Beleži se svako neuobičajeno ponašanje jedinki.
2. PODACI
Svi podaci dobijeni ispitivanjem akutne toksičnosti navode se tabelarno. Za svaku ispitivanu i kontrolnu grupu navodi se broj jedinki na početku ispitivanja i broj imobilisanih jedinki za svaki posmatrani interval.
Procenat imobilisanih jedinki nakon 24 i 48 sati grafički se prikazuje u funkciji ispitivanih koncentracija. Podaci se analiziraju primerenom statističkom metodom (npr. probit analiza), izračunava se nagib krive i EC50 sa 95% intervalima poverenja (p = 0,05).
Ukoliko za dobijene rezultate standardne metode za izračunavanje EC50 nisu primenljive, za aproksimaciju EC50 uzima se geometrijska sredina između dve ispitivane koncentracije - najviše ispitivane koncentracije koja nije dovela do imobilizacije i najniže ispitivane koncentracije koja je dovela do imobilizacije 100% jedinki u ispitivanoj grupi.
3. IZVEŠTAJ
Izveštaj o ispitivanju sadrži podatke o:
1) ispitivanoj supstanci:
- fizička i najvažnija fizička i hemijska svojstva;
- podaci o hemijskim svojstvima, uključujući čistoću supstance;
2) ispitivanoj vrsti:
- podaci o poreklu i vrsti dafnija, dobavljač (ako je poznat), uslovi laboratorijskog gajenja kulture (uključujući poreklo, količine i vrstu hrane, dinamiku ishrane);
3) uslovima u toku ispitivanja:
- opis posuda: tip posude, zapremina rastvora, broj jedinki po posudi, broj posuda po ispitivanoj koncentraciji (grupi);
- način pripreme osnovnog i ispitivanog rastvor, uključujući i podatke o upotrebi pomoćne supstance (vrsta i koncentracije);
- opis vode korišćene za razblaživanje; poreklo i osnovne svojstva (pH, tvrdoća, odnos Ca/Mg, odnos Na/K, alkalitet, elektroprovodljivost), sastav rekonstituisane vode (ako je korišćena);
- uslovi inkubacije: temperatura, intenzitet svetla i svetlosni režim, koncentracija kiseonika, pH vrednost, itd;
4) rezultatima:
- broj i procenat imobilisanih jedinki ili jedinki koje su pokazale znake stresa (uključujući atipično ponašanje) u kontrolnim i svim ispitivanim grupama, u trenutku posmatranja, kao i opis uočenog odgovora;
- rezultate i datum ispitivanja sa referentom supstancom, ako su dostupni;
- nominalne koncentracije ispitivane supstance i rezultate svih merenja koncentracije ispitivane supstance u posudama, efikasnost analitičke metode korišćene za merenja i granice detekcije;
- rezultate svih merenja osnovnih fizičko-hemijskih parametara u toku ispitivanja (pH, koncentracija rastvorenog kiseonika);
- vrednost EC50 nakon 48 sati za imobilizaciju kao posmatrani parametar sa intervalom poverenja i grafički prikaz regresionog modela korišćenog za izračunavanje EC50 vrednosti; nagib krive dozne zavisnosti i standardna greška, statističke metode korišćene za izračunavanje EC50 vrednosti (ovi podaci se prilažu i ukoliko su izračunati za rezultate dobijene nakon perioda od 24 sata);
- objašnjenje za svako odstupanje od metode i da li je odstupanje uticalo na rezultate ispitivanja.
4. LITERATURA
1. ISO 6341. (1996). Water quality - Determination of the inhibition of the mobility of Daphnia magna Straus (Cladocera, Crustacea) - Acute toxicity test. Third edition, 1996.
2. EPA OPPTS 850.1010. (1996). Ecological Effects Test Guidelines - Aquatic Invertebrate Acute Toxicity Test, Freshwater Daphnids.
3. Environment Canada. (1996) Biological test method. Acute Lethality Test Using Daphnia spp. EPS 1/RM/11. Environment Canada, Ottawa, Ontario, Canada.
4. Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publication. Series on Testing and Assessment. No 23. Paris 2000.
5. Commission of the European Communities. Study D8369. (1979). Inter-laboratory Test Programme concerning the study of the ecotoxicity of a chemical substance with respect to Daphnia.
6. OECD Guidelines for the Testing of Chemicals. Guideline 211: Daphnia magna Reproduction Test, adopted September 1998.
7. Stephan C.E. (1977). Methods for calculating an LC50. In Aquatic Toxicology and Hazard Evaluation (edited by F.I. Mayer and J.L. Hamelink). ASTM STP 634 - American Society for Testing and Materials. p. 65-84
8. Finney D.J. (1978). Statistical Methods in Biological Assay. 3rd ed. London. Griffin, Weycombe, UK.
Deo drugi
HEMIJSKA SVOJSTVA PRIHVATLJIVE VODE ZA RAZBLAŽIVANJE
Supstanca |
Koncentracija |
Suspendovane materije |
< 20 mg/l |
Ukupni organski ugljenik |
< 2 mg/l |
Nejonizovan amonijak |
< 1 μg/l |
Rezidualni hlor |
< 10 μg/l |
Ukupni organofosforni pesticidi |
< 50 ng/l |
Ukupni organohlorni pesticidi plus polihlorovani bifenili |
< 50 ng/l |
Ukupni organski hlor |
< 25 ng/l |
Deo treći
PRIMERI REKONSTITUISANE VODE ISO VODA ZA ISPITIVANJE1
Osnovni rastvori (pojedinačne supstance) |
Zapremine osnovnih rastvora koje dodati i dopuniti do 1 L vodeII radi pripreme rekonstituisane vode |
|
Supstanca |
Konc. supstance u vodiII |
|
Kalcijum-hlorid |
11,76 g/l |
25 ml |
Magnezijum-sulfat |
4,93 g/l |
25 ml |
Natrijum-bikarbonat |
2,59 g/l |
25 ml |
Kalcijum-hlorid |
0,23 g/l |
25 ml |
_____________
II Voda prihvatljive čistoće, npr. dejonizovana, destilovana ili voda dobijena reverznom osmozom, sa električnom provodljivošću ispod 10 μS/cm
ELANDT M4 I M7 MEDIJUM
Adaptacija na Elandt M4 i M7 medijum
Laboratorije su imale poteškoće kod direktnog prebacivanja dafnija u Elandt M4 i M7 medijum. Bolji uspeh se postiže postepenom aklimatizacijom, na primer premeštanje dafnija iz sopstvenog u 30% Elandt, pa u 60% Elandt pa tek onda u 100% Elandt. Može biti potrebno i do mesec dana aklimatizacionog perioda.
Priprema
Mikronutrijenti
Posebni osnovni rastvori (I) pojedinih mikronutrijenata pripremaju se korišćenjem vode prihvatljive čistoće, npr. dejonizovane, destilovane ili vode dobijene reverznom osmozom. Od ovako pripremljenih osnovnih rastvora, pravi se sledeći osnovni rastvor (II), koji sadrži sve potrebne mikroelemente.
Osnovni rastvor (I): mikronutrijenti (pojedinačne supstance) |
Količina koja se dodaje u vodu |
Koncentracija (u odnosu na M4) |
Za pripremu kombinovanog osnovnog rastvora (II), dodati sledeće zapremine osnovnih rastvora (I) i dopuniti do 1L vode* |
|
M4 |
M7 |
|||
H3BO3 |
57.190 |
20.000 puta |
1 |
0,25 |
MnCl2·4H2O |
7.210 |
20.000 puta |
1 |
0,25 |
LiCl |
6.120 |
20.000 puta |
1 |
0,25 |
RbCl |
1.420 |
20.000 puta |
1 |
0,25 |
SrCl2·6H2O |
3.040 |
20.000 puta |
1 |
0,25 |
NaBr |
320 |
20.000 puta |
1 |
0,25 |
Na2MoO2·2H2O |
1.260 |
20.000 puta |
1 |
0,25 |
CuCl2 |
335 |
20.000 puta |
1 |
0,25 |
ZnCl2 |
260 |
20.000 puta |
1 |
1 |
CoCl2x6H2O |
200 |
20.000 puta |
1 |
1 |
KJ |
65 |
20.000 puta |
1 |
1 |
Na2SeO3 |
43,8 |
20.000 puta |
1 |
1 |
NH4VO3 |
11,5 |
20.000 puta |
1 |
1 |
Na2EDTA·2H2O |
5.000 |
2.000 puta |
- |
- |
FeSO4·7H2O |
1.991 |
2.000 puta |
- |
- |
Na2EDTA i FeSO4 pripremaju se pojedinačno, pomešaju i odmah autoklaviraju, što čini:
2 L rastvora Fe - EDTA |
|
1.000 puta |
20 |
5 |
Priprema Elandt M4 i M7 medijuma
M4 i M7 medijumi pripremaju se korišćenjem osnovnog rastvora (II), makronutrijenata i vitamina, na sledeći način:
|
Količina koja se dodaje u vodu (mg/l) |
Koncentracija (u odnosu na M4) |
Količina osnovnog rastvora (II) koja se dodaje pri pripremi medijuma (mg/l) |
|
M4 |
M7 |
|||
Osnovni rastvor (II) (kombinovani mikronutrijenti) |
|
20 puta |
50 |
50 |
Osnovni rastvori makronutrijenata (pojedinačne supstance) |
|
|
|
|
CaCl2·2H2O |
293.800 |
1.000 puta |
1,0 |
1,0 |
MgSO4·7H2O |
246.600 |
2.000 puta |
0,5 |
0,5 |
KCl |
58.000 |
10.000 puta |
0,1 |
0,1 |
NaHCO3 |
64.800 |
1.000 puta |
1,0 |
1,0 |
Na2SiO3·9H2O |
50.000 |
5.000 puta |
0,2 |
0,2 |
NaNO3 |
2.740 |
10.000 puta |
0,1 |
1,0 |
KH2PO4 |
1.430 |
10.000 puta |
0,1 |
1,0 |
K2HPO4 |
1.840 |
10.000 puta |
0,1 |
1,0 |
Kombinovani vitaminski rastvor |
|
|
0,1 |
0,1 |
Kombinovani vitaminski rastvor priprema se tako što se 3 vitamina dodaju u vodu na sledeći način:
Tiamin-hidrohlorid |
750 |
10.000 puta |
|
|
Cianokobalamin (B12) |
10 |
10.000 puta |
|
|
Biotin |
7,5 |
10.000 puta |
|
|
Kombinovani vitaminski rastvor se čuva u zamrzivaču, u malim porcijama. Vitaminski rastvor se dodaje u medijum neposredno pre upotrebe.
Napomena: Da se izbegne taloženje soli pri pripremi medijuma, pojedini rastvori se razblažuju u 500 ml do 800 ml dejonizovane vode i dopune do 1 L.
Napomena: Receptura za M4 je prvi put objavljena u "Elendt, B. P. (1990). Selenium deficiency in crustacea; an ultrastructual approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, 25-33".
C.3. ISPITIVANJE INHIBICIJE RASTA SLATKOVODNIH ALGI I CIJANOBAKTERIJA
Deo prvi
1. METODA ISPITIVANJA
Ova metoda zasniva se na Uputstvu za ispitivanje OECD 201 (2006)1.
1.1. UVOD
Metode ispitivanja se periodično preispituju i ažuriraju u cilju naučnog napretka. Metodu ispitivanja C.3. bilo je potrebno revidirati kako bi se uključile dodatne vrste i ispunili zahtevi procene opasnosti i klasifikacije hemikalija. Revizija je obavljena na osnovu širokog praktičnog iskustva, naučnog napretka u oblasti toksikoloških istraživanja na algama i široke regulatorne primene koja je usledila nakon njenog donošenja.
1.2. DEFINICIJE
Pojedini izrazi upotrebljeni u ovoj metodi ispitivanja imaju sledeće značenje:
Biomasa jeste suva masa žive materije sadržane u populaciji izražena u odnosu na datu zapreminu; npr. mg algi/l rastvora za ispitivanje. Biomasa se obično definiše kao masa, ali se u ovom ispitivanju ova reč odnosi na masu po zapremini. U ovom ispitivanju se po pravilu mere i alternativni parametri za biomasu, kao što je broj ćelija, fluorescencija itd, pa se izraz biomasa odnosi i na te alternative mere.
Koeficijent varijacije jeste bezdimenzionalna mera varijabilnosti parametra, definisana kao odnos standardne devijacije i srednje vrednosti. Ova vrednost može biti izražena i u procentima. Srednji koeficijent varijacije prosečne specifične brzine rasta u ponavljanjima kontrolnih kultura izračunava se na sledeći način:
1. Izračuna se koeficijent varijacije (u daljem tekstu: CV) prosečne specifične brzine rasta iz dnevnih/etapnih brzina rasta za odgovarajuće ponavljanje i izrazi u procentima.
2. Izračuna se srednja vrednost svih izračunatih vrednosti iz tačke 1. kako bi se dobio srednji koeficijent varijacije dnevne/etapne specifične brzine rasta u ponavljanjima kontrolnih kultura.
ECx jeste koncentracija ispitivane supstance rastvorene u podlozi za ispitivanje koja rezultira x%-tnim (npr. 50%) smanjenjem rasta ispitivanog organizma u okviru navedenog perioda izlaganja (koje izričito navesti ako odstupa od punog ili uobičajenog trajanja ispitivanja). Da se nedvosmisleno pokaže da li je vrednost EC dobijena iz brzine rasta (growth rate) ili iz prirasta (yield) koriste se simboli ErC i EyC.
Hranljiva podloga jeste kompletna sintetička podloga kulture u kojoj ispitivane alge rastu kad se izlože ispitivanoj supstanci. Ispitivana supstanca se po pravilu rastvara u podlozi koja se koristi tokom ispitivanja.
Brzina rasta (prosečna specifična brzina rasta) jeste logaritamsko povećanje biomase u periodu izlaganja.
Najniža koncentracija sa zapaženim efektom (u daljem tekstu: LOEC) jeste najniža ispitivana koncentracija kod koje je tokom određenog perioda izlaganja zapažen statistički značajan negativni efekat supstance na rast (pri r < 0,05) u poređenju sa kontrolom. Sve ispitivane koncentracije iznad LOEC imaju jednak ili veći štetan efekat od onoga koji je zabeležen pri LOEC. Ako se ova dva uslova ne mogu ispuniti, detaljno se objašnjava kako je odabran LOEC (a prema tome i NOEC).
Najviša koncentracija bez zapaženog efekta (u daljem tekstu: NOEC) jeste ispitivana koncentracija neposredno ispod LOEC.
Promenljiva odgovora jeste promenljiva za procenu toksičnosti izvedena iz bilo kojeg merenog parametra koji opisuje biomasu primenom različitih metoda izračunavanja. Kod ove metode brzina rasta i prirasta su promenljive odgovora dobijene direktnim merenjem biomase ili bilo kojeg navedenog zamenskog parametra.
Specifična brzina rasta jeste promenljiva odgovora definisana kao količnik razlike prirodnih logaritama posmatranog parametra (kod ove metode ispitivanja, biomasa) i odgovarajućeg vremenskog perioda.
Prirast jeste vrednost merne promenljive na kraju perioda izlaganja umanjena za vrednost merne promenljive na početku perioda izlaganja, kojom se izražava povećanje biomase tokom ispitivanja.
1.3. PRIMENJIVOST ISPITIVANJA
Ova metoda ispitivanja se najlakše primenjuje kod supstanci rastvorljivih u vodi za koje se može pretpostaviti da će u uslovima ispitivanja ostati u vodi. Kada se ispituju supstance koje su isparljive, jako adsorptivne, obojene, slabo rastvorljive u vodi i supstance koje mogu uticati na raspoloživost hranljivih materija ili minerala u podlozi za ispitivanje, možda će biti potrebno da se opisani postupak izmeni (npr. zatvoreni sistem, kondicioniranje sudova za ispitivanje). Smernice za neke izmene date su u literaturi2,3,4.
1.4. PRINCIP ISPITIVANJA
Svrha ispitivanja je da se odrede efekti supstanci na rast slatkovodnih mikroalgi i/ili cijanobakterija. Eksponencijalno rastući test organizmi izlažu se ispitivanoj supstanci u šaržnim kulturama, po pravilu tokom 72 sata. Iako ispitivanja relativno kratko traju mogu se oceniti efekti u nekoliko generacija.
Odgovor sistema sastoji se u smanjenju rasta niza kultura algi (ispitivane jedinice) koje su izložene različitim koncentracijama ispitivane supstance. Odgovor se ocenjuje kao funkcija koncentracije izlaganja u odnosu na prosečni rast ponovljenih, neizloženih kontrolnih kultura. Da bi se u punoj meri izrazio odgovor sistema na toksične efekte (optimalna osetljivost), kulturama se ostavlja dovoljno vremena da postignu neograničen eksponencijalni rast, uz dovoljno hranljivih materija i neprekidno osvetljenje kako bi se izmerilo smanjenje specifične brzine rasta.
Rast i inhibicija rasta kvantifikuju se merenjima biomase algi u zavisnosti od vremena. Biomasa algi definisana je kao suva masa po zapremini, npr. mg algi/l rastvora za ispitivanje. Suvu masu je teško meriti pa se koriste alternativni parametri. Od ovih alternativnih parametara najčešće se koristi broj ćelija. Ostali alternativni parametri su zapremina ćelija, fluorescencija, optička gustina, itd. Faktor konverzije između alternativnih parametara i biomase da bude poznat.
Praćeni parametari ispitivanja su inhibicija rasta, izražena kao logaritamsko povećanje biomase (prosečna specifična brzina rasta) u periodu izlaganja. Iz prosečnih specifičnih brzina rasta zabeleženih u seriji ispitivanih rastvora određuje se koncentracija koja izaziva određeno x%-tno smanjenje brzine rasta (npr. 50%), koja se izražava kao ErCx (npr. ErC50).
Da bi ova metoda ispitivanja mogla da se primeni, izračunavanje rezultata se zasniva na prosečnoj specifičnoj brzini rasta iz razloga navedenih u odeljku 2.2. ove metode. U ovoj metodi ispitivanja koristi se i dodatni promenljivi odgovor, prirast, koji je potreban da bi se ispunili određeni regulatorni zahtevi u nekim državama. Definiše se kao biomasa na kraju perioda izlaganja umanjena za biomasu na početku perioda izlaganja. Iz prirasta zabeleženog u seriji ispitivanih rastvora izračunava se koncentracija koja izaziva određeno x%-tno smanjenje prirasta (npr. 50%), koja se izražava kao EyCx (npr. EyC50).
Osim toga, može se statistički odrediti najniža koncentracija sa zapaženim efektom (LOEC) i najviša koncentracija bez zapaženog efekta (NOEC).
1.5. INFORMACIJE O ISPITIVANOJ SUPSTANCI
Informacije o ispitivanoj supstanci, koje mogu biti korisne za određivanje uslova ispitivanja obuhvataju strukturnu formulu, čistoću, stabilnost na svetlu, stabilnost u uslovima ispitivanja, svojstva apsorpcije svetla, rKa i rezultate istraživanja konverzije, uključujući biorazgradljivost u vodi.
Treba da budu poznati rastvorljivost u vodi, koeficijent raspodele oktanol/voda (Pow) i napon pare ispitivane supstance, i da bude na raspolaganju validirana metoda za kvantifikaciju supstance u rastvorima za ispitivanje sa dokumentovanim iskorišćenjem i granicom detekcije.
1.6. REFERENTNA SUPSTANCA
Jedna ili više referentnih supstanci kao npr. 3,5-dihlorfenol korišćen u međunarodnom međulaboratorijskom ispitivanju4, mogu se koristiti za proveru postupka ispitivanja. Kao referentna supstanca za zelene alge može se koristiti i kalijum dihromat. Poželjno je da se referentna supstanca ispituje najmanje dva puta godišnje.
1.7. VALIDNOST ISPITIVANJA
Da bi ispitivanje bilo validno ispunjavaju se sledeći kriterijumi:
- Biomasa u kontrolnim kulturama eksponencijalno se povećava najmanje za faktor 16 u periodu ispitivanja od 72 sata. To odgovara specifičnoj brzini rasta od 0,92 dana-1. Kod vrsta koje se najčešće koriste, brzina rasta je obično znatno viša (videti Dodatak prvi ove metode). Ovaj kriterijum možda neće biti zadovoljen ako se koriste vrste koje rastu sporije od onih koje su navedene u Dodatku 1. ove metode. U tom slučaju period ispitivanja produžiti koliko je potrebno da se u kontrolnim kulturama dobije najmanje 16-struki rast, uz eskponencijalni rast tokom celokupnog perioda ispitivanja. Period ispitivanja može se skratiti na najmanje 48 sati da bi se održao neograničeni eksponencijalni rast tokom ispitivanja, pod uslovom da je postignut minimalni faktor povećanja 16.
- Srednji koeficijent varijacije etapnih specifičnih brzina rasta (dan 0-1, 1-2 i 2-3, za ispitivanje koje traje 72 sata) u kontrolnim kulturama (videti odeljak 1.2. koeficijent varijacije) ne sme biti viši od 35%. Za izračunavanje etapne specifične brzine rasta videti odeljak 2.2.1. ove metode. Ovaj kriterijum važi za srednju vrednost koeficijenata varijacije izračunatih za ponavljanja kontrolnih kultura.
- Kod ispitivanja sa vrstama Pseudokirchneriella subcapitata i Desmodesmus subspicatus koeficijent varijacije prosečnih specifičnih brzina rasta u ponavljanjima sa kontrolnim kulturama tokom ukupnog perioda ispitivanja ne sme biti viši od 7%. Kod ostalih vrsta koje se ređe ispituju ta vrednost ne sme biti viša od 10%.
1.8. OPIS METODE
1.8.1. Aparatura
Sudovi za ispitivanje i ostala aparatura koja dolazi u dodir sa ispitivanim rastvorima za ispitivanje u potpunosti su izrađeni od stakla ili drugog hemijski inertnog materijala. Aparaturu temeljno oprati kako organski i neorganski zagađivači ne bi uticali na rast algi ili na sastav rastvora za ispitivanje.
Posude koje se koriste tokom ispitivanja će po pravilu biti stakleni sudovi dovoljnih dimenzija da se osigura potrebna zapremina kulture za merenja tokom ispitivanja i dovoljan prenos mase CO2 iz atmosfere (videti odeljak 1.8.9. ove metode). Zapremina tečnosti treba da bude dovoljna za analitička određivanja (videti odeljak 1.8.11. ove metode).
Potrebna je sledeća oprema, odnosno delovi opreme:
- Inkubator za gajenje: preporučuje se ormar ili komora u kojoj se može održavati odabrana temperatura inkubacije u granicama ± 2° C.
- Instrumenti za merenje svetla: važno je napomenuti da metoda koja se koristi za merenje intenziteta svetla, a naročito vrsta prijemnika (senzora), može uticati na mernu vrednost. Merenja, ako je moguće, sprovoditi uz pomoć sferičnog prijemnika (4 π) (koji reaguje na direktno i reflektovano svetlo iz svih uglova iznad i ispod merne ravni) ili prijemnika 2 π (koji reaguje na svetlo iz svih uglova iznad merne ravni).
- Aparat za određivanje biomase algi. Broj ćelija, najčešće korišćeni alternativni parametar za biomasu algi, može se odrediti pomoću elektronskog brojača čestica, mikroskopa sa komorom za brojanje ili protočnog citometra. Ostali se alternativni parametri za biomasu mogu se izmeriti pomoću protočnog citometra, fluorimetra, spektrofotometra i kolorimetra. Korisno je izračunati faktor konverzije broj ćelija - suva masa. Da bi se kod merenja spektrofotometrom dobile korisne merne vrednosti pri niskim koncentracijama biomase, ponekad je potrebno upotrebiti kivete sa dužinom svetlosnog puta od najmanje 4 cm.
1.8.2. Ispitivani organizmi
Može se koristiti nekoliko vrsta slobodno plivajućih mikroalgi i cijanobakterija. Za sojeve navedene u Dodatku 1. ove metode dokazano je da su podesni za postupak ispitivanja iz ove metode ispitivanja.
Ako se koriste druge vrste, navesti soj i/ili poreklo. Potrebno je uveriti se da se eksponencijalni rast odabranih ispitivanih algi može održati u preovlađujućim uslovima ispitivanja tokom celokupnog perioda ispitivanja.
1.8.3. Hranljiva podloga
Preporučuju se dve alternativne hranljive podloge, OECD i AAP. Sastav tih podloga prikazan je u Dodatku 2. ove metode. Treba napomenuti da te dve podloge imaju različitu početnu pH vrednost i puferski kapacitet (za regulaciju povećanja pH vrednosti). Stoga se kod ispitivanja mogu dobiti različiti rezultati u zavisnosti od podloge koja se koristi, naročito kad se ispituju jonizujuće supstance.
U određenim slučajevima je potrebno izmeniti hranljive podloge, npr. kad se ispituju metali i helatna sredstva, ili kad se ispitivanje sprovodi sa različitim pH vrednostima. Korišćenje izmenjene podloge detaljno se opisuje i obrazlaže3,4.
1.8.4. Početna koncentracija biomase
Početna biomasa u ispitivanim kulturama jednaka je u svim ispitivanim kulturama i dovoljno niska da se može postići eksponencijalni rast tokom čitavog perioda inkubacije bez bojazni da bi se mogle iscrpiti zalihe hranljivih materija. Početna biomasa ne treba da bude viša od 0,5 mg/l suve mase. Preporučuju se sledeće početne koncentracije ćelija:
Pseudokirchneriella subcapitata |
5 × 103-104 ćelija/ml |
Desmodesmus subspicatus |
2-5 × 103 ćelija/ml |
Navicula pelliculosa |
104 ćelija/ml |
Anabaena flos-aquae |
104 ćelija/ml |
Synechococcus leopoliensis |
5 × 104-105 ćelija/ml |
1.8.5. Koncentracije ispitivane supstance
Raspon koncentracija u kojem se mogu očekivati efekti supstance može se odrediti na osnovu rezultata ispitivanja za određivanje raspona. Za konačno glavno ispitivanje odabrati najmanje pet koncentracija raspoređenih u geometrijskom nizu uz faktor koji ne prelazi 3,2. Kod ispitivanih supstanci čija je kriva koncentracija-odgovor ravna, ponekad je opravdano koristiti viši faktor. Serija koncentracija obuhvata područje u kojem se javlja inhibicija rasta algi 5%-75%.
1.8.6. Ponavljanja i kontrole
U postavci ispitivanja predvideti po tri ponavljanja za svaku ispitivanu koncentraciju. Ako nije potrebno odrediti NOEC, postavka ispitivanja se može promeniti tako da se poveća broj koncentracija i smanji broj ponavljanja po koncentraciji. Broj kontrolnih ponavljanja je najmanje tri, a u idealnom slučaju dvostruko veći od broja ponavljanja za svaku ispitivanu koncentraciju.
Za analitička određivanja koncentracija ispitivane supstance može se pripremiti posebna serija rastvora za ispitivanje (videti odeljak 1.8.11. ove metode).
Ako se za rastvaranje ispitivane supstance koristi rastvarač, u postavku ispitivanja se uključuju dodatne kontrole koje sadrže istu koncentraciju rastvarača kao i kod ispitivane kulture.
1.8.7. Priprema kulture inokuluma
Da bi se test alge prilagodile uslovima ispitivanja i obezbedilo da alge budu u fazi eksponencijalnog rasta u trenutku kada se koriste za inokulaciju rastvora za ispitivanje, kulturu inokuluma u podlozi za ispitivanje pripremiti 2 do 4 dana pre početka ispitivanja. Biomasu algi podesiti tako da se omogući da preovlada eksponencijalni rast u kulturi inokuluma do početka ispitivanja. Kulturu inokuluma inkubirati u istim uslovima kao ispitivane kulture. Merenjem povećanja biomase u kulturi inokuluma uveriti se da je rast u granicama normale za ispitivani soj u uslovima gajenja. Primer postupka gajenja kulture algi opisan je u Dodatku 3. ove metode. Da bi se izbegla istovremena deoba ćelija za vreme ispitivanja, može biti potrebno sprovesti još jedan korak umnožavanja kulture inokuluma.
1.8.8. Priprema rastvora za ispitivanje
Svi rastvori za ispitivanje sadrže istu koncentraciju hranljive podloge i istu početnu biomasu ispitivanih algi. Rastvori za ispitivanje odabranih koncentracija obično se pripremaju mešanjem radnog rastvora ispitivane supstance sa hranljivom podlogom i kulturom inokuluma. Radni rastvori se po pravilu pripremaju rastvaranjem supstanci u podlozi za ispitivanje.
Rastvarači, npr. aceton, t-butil alkohol i dimetilformamid mogu da se koriste kao nosači za dodavanje supstanci slabo rastvorljivih u vodi u podlogu za ispitivanje2,3. Koncentracija rastvarača ne sme da pređe 100 µl/l i istu koncentraciju dodati svim kulturama (uključujući kontrole) u serijama ispitivanja.
1.8.9. Inkubacija
Sudovi za ispitivanje se zatvore vazdušno-propusnim čepovima. Posude se protresu i stave u inkubator za gajenje. Alge tokom ispitivanja držati u suspenziji da se olakša prenos CO2. To se postiže stalnim trešenjem ili mešanjem. Kulture držati na temperaturi u rasponu od 21° C do 24° C uz toleranciju ± 2 °C. Kod vrsta koje nisu navedene u Dodatku 1, npr. tropske vrste, mogu odgovarati više temperature, pod uslovom da se mogu ispuniti kriterijumi validnosti. Preporučuje se da se sudovi nasumično rasporede u inkubatoru i svakodnevno razmeštaju po inkubatoru.
pH vrednost kontrolne podloge se tokom ispitivanja ne sme povećati za više od 1,5 jedinica. Kod metala i jedinjenja koji delimično jonizuju pri pH vrednostima oko ispitivane vrednosti ponekad je nužno ograničiti pomak pH vrednosti kako bi se dobili obnovljivi i dobro definisani rezultati. Pomak od < 0,5 pH jedinica je tehnički izvodljiv i može se postići osiguravanjem odgovarajućeg prenosa mase CO2 iz okolnog vazduha u ispitivani rastvor, npr. povećanjem brzine tresenja. Druga mogućnost je da se smanji potrošnja CO2 smanjenjem početne biomase ili trajanja ispitivanja.
Na površini gde se kulture inkubiraju osigurati neprekidno i ravnomerno fluorescentno osvetljenje npr. tipa hladno belo (cool-white) ili dnevno svetlo (daylight). Različiti sojevi algi i cijanobakterija imaju različite potrebe za svetlošću. Intenzitet svetla prilagoditi ispitivanim organizmima. Za preporučene vrste zelenih algi, intenzitet svetla na nivou rastvora za ispitivanje odabrati u rasponu od 60 do 120 µE·m-2·s-1, mereno u fotosintetički efikasnom spektralnom rasponu od 400 nm do 700 nm primenom odgovarajućeg prijemnika. Neke vrste, posebno Anabaena flos-aquae, rastu dobro na svetlu slabijeg intenziteta i jako svetlo ih može oštetiti. Kod tih vrsta odabrati prosečni intenzitet svetla u rasponu od 40 µE·m-2·s-1 do 60 µE·m-2·s-1. (Kod instrumenata za merenje intenziteta svetla baždarenih u luksima, raspon od 4.440 lux do 8.880 lux za hladno belo svetlo približno odgovara preporučenom intenzitetu svetla od 60 µE·m-2·s-1 do 120 µE·m-2·s-1). Intenzitet svetla u prostoru inkubacije ne sme odstupati više od ± 15% od prosečnog intenziteta svetla.
1.8.10. Trajanje ispitivanja
Ispitivanje po pravilu traje 72 sata. Ipak, ispitivanje može trajati i duže ili kraće, pod uslovom da mogu da se zadovolje svi kriterijumi validnosti iz odeljka 1.7. ove metode.
1.8.11. Merenja i analitička određivanja
Biomasa algi se u svakom sudu određuje najmanje jedanput dnevno tokom ispitivanja. Ako se merenja sprovode na maloj zapremini pipetiranoj iz rastvora za ispitivanje, izvađeni rastvor ne zamenjivati.
Merenje biomase sprovodi se ručnim brojanjem ćelija pod mikroskopom ili elektronskim brojačem čestica (za broj ćelija i/ili biozapreminu). Mogu se koristiti i alternativne tehnike, npr. protočna citometrija, flourescencija hlorofila in vitro ili in vivo6,7, ili optička gustina, pod uslovom da se može dokazati zadovoljavajuća korelacija sa biomasom u okviru raspona biomasa koje se javljaju u ispitivanju.
pH vrednost rastvora meri se na početku i na kraju ispitivanja.
Ukoliko je na raspolaganju analitički postupak za određivanje ispitivane supstance u rasponu koncentracija koje se koriste u ispitivanju, analizirati rastvore za ispitivanje kako bi se proverile početne koncentracije i održavanje koncentracija izlaganja tokom ispitivanja.
Analiza koncentracije ispitivane supstance u jednoj niskoj i jednoj visokoj ispitivanoj koncentraciji na početku i kraju ispitivanja i koncentracije oko očekivane vrednosti EC50, može biti dovoljna ukoliko se očekuje da će koncentracije izlaganja tokom ispitivanja odstupati manje od 20% od nominalnih vrednosti. Ako nije verovatno da će koncentracije ostati u okviru 80% do 120% nominalne vrednosti, preporučuje se analiza svih ispitivanih koncentracija na početku i na kraju ispitivanja. U slučaju isparljivih, nestabilnih i jako adsorptivnih ispitivanih supstanci preporučuje se da se tokom perioda izlaganja obave dodatna uzorkovanja i analize u razmacima od 24 sata kako bi se mogao bolje odrediti gubitak ispitivane supstance. Kod takvih supstanci biće potrebna dodatna ponavljanja. U svim slučajevima, koncentraciju ispitivane supstance određivati samo iz jednog ponavljanja za svaki uzorak ispitivane koncentracije (ili u srednjem uzorku koji se dobija sjedinjavanjem sadržaja svih ponavljanja).
Sa podlogama za ispitivanje koje su posebno pripremljene za analizu koncentracija izlaganja tokom ispitivanja postupati jednako kao sa podlogama na kojima se sprovodi ispitivanje tj. inokulisati ih algama i inkubirati u jednakim uslovima. Ako je potrebno da se izvrši analiza koncentracije rastvorene ispitivane supstance, može biti neophodno da se odvoje alge od podloge. Odvajanje se ako je moguće vrši laganim centrifugiranjem gde je g-sila tek tolika da se postigne taloženje algi.
Ako se može dokazati da se koncentracija ispitivane supstance tokom ukupnog trajanja ispitivanja na zadovoljavajući način održava u granicama ± 20% nominalne ili izmerene početne koncentracije, analiza rezultata se može zasnivati na nominalnim ili izmerenim početnim vrednostima. Ako je odstupanje od nominalne odnosno izmerene početne koncentracije veće od ± 20%, analiza rezultata se zasniva na srednjoj geometrijskoj koncentraciji tokom izlaganja ili modelima koji opisuju opadanje koncentracije ispitivane supstance3,8.
Ispitivanje inhibicije rasta algi je dinamičniji sistem za ispitivanje u odnosu na većinu ispitivanja kratkotrajne toksičnosti u vodi. Stoga je ponekad teško odrediti stvarne koncentracije izlaganja, što naročito važi za ispitivanja adsorptivnih supstanci u niskim koncentracijama. U tom slučaju nestanak supstance iz rastvora adsorpcijom na rastuću biomasu algi ne znači da se ona izgubila iz sistema za ispitivanje. Kada se analizira rezultat ispitivanja, proveriti da li je smanjenje koncentracije ispitivane supstance tokom ispitivanja praćeno smanjenjem inhibicija rasta. Ako je to slučaj, može se razmotriti primena pogodnog modela koji opisuje opadanje koncentracije ispitivane supstance8. U protivnom, možda će biti potrebno da se izvrši analiza rezultata na osnovu početnih (nominalnih ili izmerenih) koncentracija.
1.8.12. Ostala posmatranja
Na kraju ispitivanja izvršiti mikroskopsko posmatranje da se potvrdi normalan i zdrav izgled kulture inokuluma i uoče eventualne promene u izgledu algi (koje mogu biti posledica izlaganja ispitivanoj supstanci).
1.8.13. Granično ispitivanje
U određenim okolnostima, npr. kad preliminarno ispitivanje ukazuje na to da ispitivana supstanca nema toksično delovanje u koncentracijama do 100 mg·l-1 ili do njene granice rastvorljivosti u podlozi za ispitivanje (zavisno od toga šta je manje), može se izvršiti granično ispitivanje koje podrazumeva poređenje odgovora u jednoj kontrolnoj grupi i jednoj ispitivanoj grupi (100 mg·l-1 ili koncentracija jednaka granici rastvorljivosti). Preporučuje se da se uz granično ispitivanje svakako izvrši analiza koncentracije izlaganja. Za granično ispitivanje važe svi gore pomenuti uslovi za ispitivanje i kriterijumi validnosti, s tim da broj ponavljanja u ispitivanoj grupi ne sme biti manji od šest. Promenljive odgovora u kontrolnoj i ispitivanoj grupi mogu se analizirati statističkim testom za poređenje srednjih vrednosti npr. Studentov t-test. Ako su varijanse dve grupe nejednake, izvršiti prilagođeni t-test za nejednake varijanse.
1.8.14. Modifikacija za jako obojene supstance
Zračenje (intenzitet svetla) treba da bude u gornjem delu raspona propisanog za ovu metodu ispitivanja: 120µE m-2 s-1 ili više.
Put svetla skratiti smanjenjem zapremine rastvora za ispitivanje (u rasponu od 5 ml do 25 ml).
Treba dovoljno promućkati (na primer umerenim trešenjem) kako bi se obezbedila visoka učestalost izlaganja algi visokom zračenju na površini kulture.
2. PODACI
2.1. GRAFIČKI PRIKAZ KRIVE RASTA
Biomasa u posudama za ispitivanje može da se izrazi u jedinicama merenog alternativnog parametra (npr. broj ćelija, fluorescencija).
Da bi se dobio grafički prikaz krivih rasta, izraditi tabelu procenjenih koncentracija biomase u ispitivanim i kontrolnim kulturama, zajedno sa koncentracijama ispitivanog materijala, koje se beleže sa rezolucijom od najmanje jednog celog sata, i vremenima merenja. U ovoj prvoj fazi mogu biti korisne i logaritamske i linearne skale, ali su logaritamske skale obavezne i uopšteno daju bolji prikaz promena uzorka rasta u periodu ispitivanja. Treba imati u vidu da kad se eksponencijalni rast prikaže na logaritamskoj skali, kao rezultat se dobije pravac, a nagib pravca pokazuje specifičnu brzinu rasta.
Na grafičkim prikazima proveriti da li kontrolne kulture rastu eksponencijalno i očekivanom brzinom tokom ispitivanja. Treba kritički preispitati sve tačke podataka i izgled grafika i proveriti sirove podatke i postupke kako bi se utvrdile eventualne greške. Posebno proveriti one tačke podataka kod kojih se čini da su odstupanja kao posledica sistemske greške. Ako je očigledno i/ili vrlo verovatno da se radi o greškama u postupku, konkretna tačka se obeležava kao vrednost koja se ne uklapa i isključuje se iz kasnije statističke analize. Nulta koncentracija algi u sudu sa jednim od dva ili tri ponavljanja može ukazivati na to da posuda nije pravilno inokulisana ili da nije bila dobro očišćena). U izveštaju o ispitivanju jasno navesti zašto je neka tačka odbačena kao vrednost koja se ne uklapa. Prihvatljivi razlozi su samo (retke) greške u postupku, ali ne i loša preciznost. Statistički postupci za utvrđivanje vrednosti koje se ne uklapaju imaju ograničenu primenu kod ove vrste problema i ne mogu zameniti stručno prosuđivanje. Vrednosti koje se ne uklapaju (označene kao takve) po mogućstvu zadržati među tačkama podataka koje se prikazuju u kasnijim grafičkim odnosno tabelarnim prikazima podataka.
2.2. PROMENLJIVE VELIČINE ODGOVORA
Svrha ispitivanja je da se utvrde efekti ispitivane supstance na rast algi. U ovoj metodi ispitivanja opisane su dve promenljive veličine odgovora, zbog različitog načina regulisanja u državama. Da bi rezultati ispitivanja bili prihvatljivi u svim državama, efekte ocenjivati primenom obe promenljive veličine odgovora:
a) Prosečna specifična brzina rasta: ova promenljiva veličina odgovora izračunava se na osnovu logaritamskog povećanja biomase u periodu ispitivanja, izraženog po danu;
b) Prirast: ova promenljiva veličina odgovora predstavlja razliku između biomase na kraju ispitivanja i početne biomase.
Da bi ova metoda ispitivanja mogla da se primeni izračunavanje rezultata treba da se zasniva na prosečnoj specifičnoj brzini rasta iz razloga navedenih u daljem tekstu. Treba napomenuti da vrednosti toksičnosti izračunate primenom te dve promenljive veličine odgovora nisu uporedive i tu razliku uzeti u obzir kod korišćenja rezultata ispitivanja. Ako su poštovani uslovi ispitivanja ove metode, vrednosti ECx koje se zasnivaju na prosečnoj specifičnoj brzini rasta (ErCx) uopšteno će biti više od rezultata zasnovanih na prirastu (EyCx) zbog razlike u matematičkoj osnovi ta dva pristupa. To ne tumačiti kao razliku u osetljivosti dve promenljive veličine odgovora, već prosto prihvatiti da su te vrednosti matematički različite. Pojam prosečne specifične brzine rasta zasniva se na opštem obrascu eksponencijalnog rasta algi u kulturama koje nisu izložene ograničavajućim faktorima, gde se toksičnost procenjuje na osnovu učinaka na brzinu rasta nezavisno od apsolutne vrednosti specifične brzine rasta u kontrolnoj grupi, nagiba krive koncentracija-odgovor ili trajanja ispitivanja. Za razliku od toga, rezultati koji se zasnivaju na promenljivoj veličini odgovora "prirast" zavise od svih tih drugih promenljivih veličina. EyCx zavisi od specifične brzine rasta vrsta algi koje se koriste u svakom ispitivanju i od maksimalne specifične stope rasta koja se može razlikovati između vrsta, pa čak i između sojeva algi. Ovu promenljivu odgovora ne koristiti za upoređivanje osetljivosti na otrove među vrstama algi, pa čak ni među različitim sojevima. Iako se, sa naučne tačke gledišta, proceni toksičnosti na osnovu prosečne specifične brzine rasta daje prednost, u ovu metodu ispitivanja uključene su i procene na osnovu prirasta kako bi se zadovoljili trenutni regulatorni zahtevi u nekim državama.
2.2.1. Prosečna brzina rasta
Prosečna specifična brzina rasta u određenom periodu izračunava se kao logaritamsko povećanje biomase u svakom kontrolnom i ispitivanom sudu primenom jednačine:
µi-j = |
lh Xj - ln Xi |
(dan-1) |
tj - ti |
pri čemu:
µi-j jeste prosečna specifična brzina rasta od vremena i do vremena j;
Xi jeste biomasa u vremenu i;
Xj jeste biomasa u vremenu j.
Za svaku ispitivanu i kontrolnu grupu izračunati srednju vrednost brzine rasta sa procenom varijanse.
Izračuna se prosečna specifična brzina rasta za ukupno vreme ispitivanja (obično 0-3. dan); pritom se umesto izmerene početne vrednosti kao početna vrednost uzima nominalna inokulisana biomasa, jer se na taj način po pravilu postiže veća preciznost. Ako oprema koja se koristi za merenje biomase omogućava dovoljno precizno određivanje biomase i kod male biomase inokuluma (npr. protočni citometar), može se koristiti izmerena početna koncentracija biomase. Osim toga, odrediti etapnu brzinu rasta, koja se izračunava kao specifična brzina rasta za svaki dan ispitivanja (0-1, 1-2. i 2-3. dan) i proveriti da li je kontrolna brzina rasta stalna (videti kriterijume validnosti, odeljak 1.7. ove metode). Ako je specifična brzina rasta prvoga dana znatno niža od ukupne prosečne specifične brzine, to može ukazivati na fazu prilagođavanja. Iako faza prilagođavanja u kontrolnim kulturama može da se smanji i gotovo eliminiše pravilnim razmnožavanjem predkulture, kad su u pitanju izložene kulture, faza prilagođavanja može biti znak oporavka nakon prvobitnog toksičnog šoka ili smanjenog izlaganja usled gubitka ispitivane supstance (uključujući sorpciju na biomasu algi) nakon početnog izlaganja. Stoga se može oceniti etapni rast kako bi se ocenili efekti ispitivane supstance koji se javljaju tokom perioda izlaganja. Značajne razlike između etapne brzine rasta i prosečne brzine rasta ukazuju na odstupanje od stalnog eksponencijalnog rasta i upozoravaju da je potrebno detaljno preispitivanje kriva rasta.
Procenat inhibicije brzine rasta za pojedina ponavljanja u ispitivanim grupama izračunava se pomoću jednačine:
%Ir = |
µC - µT |
x 100 |
µC |
pri čemu:
%Ir jeste procenat inhibicije prosečne specifične brzine rasta;
µC jeste srednja vrednost prosečne specifične brzine rasta (m) u kontrolnoj grupi;
µT jeste prosečna specifična brzina rasta ponavljanja u ispitivanoj grupi.
Ako se za pripremu rastvora za ispitivanje koriste rastvarači, za izračunavanje procenta inhibicije koristiti kontrole sa rastvaračem, a ne one bez rastvarača.
2.2.2. Prirast
Prirast se izračunava kao biomasa na kraju ispitivanja umanjena za početnu biomasu u svakom kontrolnom i ispitivanom sudu. Za svaku ispitivanu koncentraciju i kontrolu izračunati srednju vrednost prirasta sa procenom varijanse. Procenat inhibicije prirasta (% Iy) za pojedinačna ponavljanja u ispitivanoj grupi može se izračunati na sledeći način:
%Ir = |
YC - YT |
x 100 |
YC |
pri čemu:
%Iy jeste procenat inhibicije prirasta;
YC jeste srednja vrednost prirasta u kontrolnoj grupi;
YT jeste vrednost prirasta ponavljanja u ispitivanoj grupi.
2.3 PRIKAZ KRIVE KONCENTRACIJA - ODGOVOR
Napravi se grafički prikaz procenta inhibicije u odnosu na logaritam koncentracije ispitivane supstance i dobijeni grafik se detaljno pregleda, zanemarujući sve tačke podataka koje su u prvoj fazi izdvojene kao vrednosti koje se ne uklapaju. Kroz tačke podataka povuče se glatka kriva prostim okom ili računarskom interpolacijom, kako bi se dobio prvi utisak odnosa koncentracija-odgovor, i zatim se nastavlja sa detaljnijom metodom, po mogućstvu računarskom statističkom metodom. Zavisno od predviđene upotrebe podataka, kvaliteta (preciznosti) i količine podataka kao i raspoloživosti alata za analizu podataka, može se doneti odluka (koja je ponekad sasvim opravdana) da se u ovoj fazi prekine analiza podataka i jednostavno očitaju ključne vrednosti EC50 i EC10 (i/ili EC20) sa krive povučene prostim okom (videti i odeljak u nastavku o stimulatornim efektima). Neki od validnih razloga za nekorišćenje statističke metode su:
- s obzirom na raspoložive podatke, računarskim metodima ne mogu se dobiti pouzdaniji rezultati od onih koji se mogu dobiti stručnim prosuđivanjem - može se desiti da neki računarski programi uopšte ne daju nikakvo pouzdano rešenje (iteracije ne konvergiraju itd),
- raspoloživi računarski programi nisu podesni za obradu efekata stimulacije rasta (videti u daljem tekstu).
2.4. STATISTIČKI POSTUPCI
Cilj je da se dobije kvantitativni odnos koncentracija-odgovor regresionom analizom. Ako se izvrši linearna transformacija podataka odgovora - npr. u jedinice probit, logit ili Vejbulovog modela9 - može se izvršiti ponderisana linearna regresija; ipak, prednost se daje postupcima nelinearne regresije, koje bolje rešavaju problem neizbežnih nepravilnosti podataka i odstupanja od pravilnih raspodela. Približavanjem nultoj ili potpunoj inhibiciji te nepravilnosti mogu transformacijom i dodatno da se povećaju i tako otežaju analizu9. Standardne analitičke metode koje koriste probit, logit ili Vejbulove transformacije namenjene su kvantalnim podacima (npr. smrtnost ili preživljavanje) i posebno se prilagođavaju da bi se mogle primeniti na podatke o rastu i biomasi. Konkretni postupci za određivanje vrednosti ECx iz kontinuiranih podataka mogu se naći u literaturi10,11,12. Korišćenje nelinearne regresione analize detaljnije je opisano u Dodatku 4. ove metode.
Za svaku promenljivu odgovora koja se analizira iz odnosa koncentracija - odgovor izračunati tačke na osnovu kojih se procenjuju vrednosti ECx. Ako je moguće, za sve procene odrediti granice pouzdanosti od 95%. Valjanost podudaranja podataka odgovora sa regresionim modelom procenjuje se grafički ili statistički. Regresionu analizu vršiti na osnovu pojedinačnih odgovora u ponavljanjima, a ne na osnovu srednjih vrednosti ispitivanih grupa. Ukoliko je nelinearno podešavanje krive teško ili nemoguće zbog velike razuđenosti podataka, problem se može zaobići izračunavanjem regresije na srednjim vrednostima po grupama kao praktičnim načinom da se smanji uticaj mogućih vrednosti koje se ne uklapaju. Ako se koristi ova opcija, to navesti u izveštaju o ispitivanju kao odstupanje od uobičajenog postupka uz napomenu da prilagođavanje krive pojedinačnim ponavljanjima nije dalo dobar rezultat.
Ako raspoloživi regresivni modeli/metode nisu podesni za podatke, procene EC50 i granice pouzdanosti mogu se dobiti i linearnom interpolacijom sa metodom ponovnog uzorkovanja sa ponavljanjem (bootstrapping)13.
Za procenu LOEC, a time i NOEC, u vezi sa efektima ispitivane supstance na brzinu rasta potrebno je uporediti srednje vrednosti obrade primenom tehnika analize varijanse (u daljem tekstu: ANOVA). Zatim srednju vrednost za svaku koncentraciju uporediti sa kontrolnom srednjom vrednošću primenom odgovarajuće metode višestrukog poređenja ili ispitivanja trenda. Ovde može biti koristan Danetov ili Vilijamsov test14,15,16,17,18. Treba proveriti da li je pretpostavka homogenosti varijansi ANOVA realna. Procena se može izvršiti grafički ili formalnim testom18. Pogodni su Leveneov i Bartletov test. Ako pretpostavka homogenosti varijansi nije zadovoljena, to se ponekad može ispraviti logaritamskom transformacijom podataka. Ako je heterogenost varijanse prevelika da bi se mogla ispraviti transformacijom, razmotriti mogućnost analize metodama kao što su Jonkhereovi "step-down" testovi trenda. Dodatne smernice za određivanje NOEC mogu se naći u literaturi12.
Novija naučna saznanja dovela su do preporuke da se pojam NOEC napusti i zameni procenama tačaka ECx dobijenih regresijom. Za ovaj test sa algama nije utvrđena određena vrednost h. Izgleda da je raspon od 10% do 20% odgovarajući (zavisno od odabrane promenljive veličine odgovora), a poželjno je da se navedu obe vrednosti, EC10 i EC20.
2.5. STIMULACIJA RASTA
Ponekad se pri niskim koncentracijama može zapaziti stimulacija rasta (negativna inhibicija). To može biti posledica hormezisa (toksička stimulacija) ili unošenja stimulativnih faktora rasta sa ispitivanim materijalom u upotrebljenu minimalnu podlogu. Treba imati u vidu da dodavanje neorganskih hranljivih materija ne bi smelo da ima nikakav direktan uticaj budući da podloga koja se koristi tokom ispitivanja treba stalno da sadrži višak hranljivih supstanci. Stimulacija pri niskim dozama se po pravilu može zanemariti kod izračunavanja EC50 osim ako je ona ekstremno visoka. U slučaju ektremne stimulacije, ili kad je potrebno izračunati ECx za niske vrednosti h, ponekad je potrebno primeniti posebne postupke. Brisanje stimulativnih odgovora iz analize podataka izbegavati, a ako raspoloživi softver za prilagođavanje krive ne može da prihvati male vrednosti stimulacije, može se koristiti linearna interpolacija sa metodom ponovnog uzorkovanja sa ponavljanjem (bootstrapping). U slučaju ekstremne stimulacije može se razmotriti primena hormezis modela19.
2.6. NETOKSIČNA INHIBICIJA RASTA
Ispitivani materijali koji apsorbuju svetlo mogu izazvati smanjenje brzine rasta jer stvaranje senke smanjuje raspoloživu količinu svetla. Ove i druge slične fizičke efekte odvojiti od toksičnih efekata izmenom uslova ispitivanja i posebno ih navesti u izveštaju o ispitivanju. Smernice se mogu pronaći u literaturi2,3.
3. IZVEŠTAVANJE
3.1. IZVEŠTAJ O ISPITIVANJU
Izveštaj o ispitivanju sadrži podatke o:
1) Ispitivanoj supstanci:
- agregatno stanje i relevantna fizičko-hemijska svojstva, uključujući granicu rastvorljivosti u vodi,
- podaci za identifikaciju hemikalije, uključujući čistoću.
2) Ispitivanoj vrsti:
- soj, dobavljač odnosno izvor i uslovi gajenja.
3) Uslovima ispitivanja:
- datum početka i trajanje ispitivanja;
- opis ispitivanja: sudovi za ispitivanje, zapremine kulture, gustina biomase na početku ispitivanja;
- sastav podloge;
- ispitivane koncentracije i ponavljanja (npr. broj ponavljanja, broj ispitivanih koncentracija i primenjena geometrijska progresija);
- opis pripreme rastvora za ispitivanje, uključujući primenu rastvarača itd.;
- inkubator za gajenje;
- intenzitet i kvalitet svetla (izvor, homogenost);
- temperatura;
- ispitivane koncentracije: nominalne ispitivane koncentracije i rezultati analiza za određivanje koncentracije ispitivane supstance u posudama za ispitivanje. Treba navesti efikasnost metode i granicu kvantifikacije u ispitivanom matriksu;
- sva odstupanja od ove metode ispitivanja;
- metod određivanja biomase i dokaz korelacije između izmerenog parametra i suve mase.
4) Rezultatima:
- pH vrednosti na početku i kraju ispitivanja u svim obradama;
- biomasa svake tikvice u svakoj mernoj tački i metod merenja biomase;
- krive rasta (grafički prikaz biomase u zavisnosti od vremena);
- izračunate promenljive odgovora za svako ponavljanje, uključujući srednje vrednosti i koeficijent varijacije za ponavljanja;
- grafički prikaz odnosa koncentracija/efekat;
- procene toksičnosti za promenljive odgovora, npr. EC50, EC10, EC20 i odgovarajući intervali poverenja. Ako se izračunavaju LOEC i NOEC, njihove vrednosti i statističke metode koje su upotrebljene za određivanje;
- ako se koristi ANOVA, veličina efekta koji se može utvrditi (npr. najmanja značajna razlika);
- eventualna stimulacija rasta u bilo kojem uzorku;
- svi ostali zapaženi efekti, npr. morfološke promene algi;
- tumačenje rezultata, uključujući mogući uticaj odstupanja od metode ispitivanja na rezultate ispitivanja.
4. LITERATURA
1. OECD TG 201 (2006). Freshwater Alga and Cyanobacteria, Growth Inhibition Test.
2. ISO 1998: Water quality - Guidance for algal growth inhibition tests with poorly soluble materials, volatile compounds, metals and waster water. ISO/DIS 14442.
3. OECD 2000: Guidance Document on Aquatic Toxicity Testing of Difficult Substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment, no. 23.
4. ISO 1998: Water quality - Sampling - Part 16: General Guidance for Biotesting. ISO 5667-16.
5. ISO 1993: Water quality - Algal growth inhibition test. ISO 8692.
6. Mayer, P., Cuhel, R. and Nyholm, N. (1997). A simple in vitro fluorescence method for biomass measurements in algal growth inhibition tests. Water Research 31: 2525-2531.
7. Slovacey, R.E. and Hanna, P.J. In vivo fluorescence determinations of phytoplancton chlorophyll, Limnology & Oceanography 22,5 (1977), pp.919-925.
8. Simpson, S.L., Roland, M.G.E., Stauber, J.L. and Batley, G.E. (2003). Effect of declining toxicant concentrations on algal bioassay endpoints. Environ. Toxicol. Chem 22, 2073-2079.
9. Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713-718.
10. Nyholm, N. Sørensen, P.S., Kusk, K.O. and Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157-167.
11. Bruce, R.D., and Versteeg, D.J. (1992). A statistical procedure for modelling continuous toxicity data. Env. Toxicol. Chem. 11:1485-1494.
12. OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data.
13. Norberg-King T.J. (1988). An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05-88. USEPA, Duluth, MN.
14. Dunnett, C.W. (1955). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc. 50: 1096-1121
15. Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20: 482-491.
16. Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103-117.
17. Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28: 510-531.
18. Draper, N.R. and Smith, H. (1981). Applied Regression Analysis, second edition. Wiley, New York.
19. Brain P. and Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93-96.
Deo drugi
DODATAK 1.
SOJEVI KOJI SU SE POKAZALI POGODNIM ZA ISPITIVANJE
Zelene alge
- Pseudokirchneriella subcapitata, (ranije poznata kao Selenastrum capricornutum), ATCC 22662, CCAP 278/4, 61.81 SAG
- Desmodesmus subspicatus (ranije poznata kao Scenedesmus subspicatus) 86.81 SAG
Dijatomeje
- Navicula pelliculosa, UTEX 664
Cijanobakterije
- Anabaena flos-aquae, UTEX 1444, ATCC 29413, CCAP 1403/13A
- Synechococcus leopoliensis, UTEX 625, CCAP 1405/1
Izvori sojeva
Preporučeni sojevi raspoloživi su u kulturama jedne vrste algi iz sledećih zbirki (abecednim redom):
ATCC: American Type Culture Collection
10801 University Boulevard
Manassas, Virginia 20110-2209
SJEDINJENE AMERIČKE DRŽAVE
CCAP, Culture Collection of Algae and Protozoa
Institute of Freshwater Ecology,
Windermere Laboratory
Far Sawrey, Amblerside
Cumbria
LA22 0LP
UJEDINJENO KRALJEVSTVO
SAG: Collection of Algal Cultures
Inst. Plant Physiology
University of Göttingen
Nicholausberger Weg 18
3400 Göttingen
NEMAČKA
UTEX Culture Collection of Algae
Section of Molecular, Cellular and Developmental Biology
School of Biological Sciences
the University of Texas at Austin
Austin, Texas 78712
SJEDINJENE AMERIČKE DRŽAVE
Tabela: Izgled i svojstva preporučenih vrsta
|
P. subcapitata |
D. subspicatus |
N. pelliculosa |
A. flos-aquae |
S. leopoliensis |
Izgled |
Zakrivljene, uvijene, pojedinačne ćelije |
Duguljaste, većinom pojedinačne ćelije |
Štapićaste |
Lanci duguljastih ćelija |
Štapićaste |
Veličina (D × Š)* µm |
8-14 × 2-3 |
7-15 × 3-12 |
7,1 × 3,7 |
4,5 × 3 |
6 × 1 |
Zapremina ćelija (µm3/ćelija) |
40-60 [1] |
60-80 [1] |
40-50 [1] |
30-40 [1] |
2,5 [2] |
Suva masa ćelija (mg/ćelija) |
2-3 × 10-8 |
3-4 × 10-8 |
3-4 × 10-8 |
1-2 × 10-8 |
2-3 × 10-9 |
Brzina rasta [3] dan-1) |
1,5-1,7 |
1,2-1,5 |
1,4 |
1,1-1,4 |
2,0-2,4 |
[1] Mereno elektronskim brojačem čestica. |
|||||
Posebne preporuke za gajenje i rukovanje preporučenim ispitivanim vrstama
Pseudokirchneriella subcapitata i Desmodesmus subspicatus
Ove zelene alge generalno se lako održavaju u različitim podlogama kulture. Informacije o pogodnim podlogama mogu se dobiti u zbirkama kultura. Po pravilu se radi o pojedinačnim ćelijama i merenja gustine ćelija mogu se jednostavno obaviti uz pomoć elektronskog brojača čestica ili mikroskopa.
Anabaena flos-aquae
Za držanje radne kulture mogu se koristiti različite hranljive podloge. Posebno je važno da se ne dozvoli da šaržna kultura kod obnavljanja ne prođe logaritamsku fazu rasta jer je tada regeneracija teška.
Anabaena flos-aquae stvara skupine isprepletenih lanaca ćelija. Veličina skupina može biti različita, zavisno od uslova gajenja. Skupine ponekad razbiti ako se biomasa određuje brojanjem pod mikroskopom ili elektronskim brojačem čestica.
Da bi se smanjila varijabilnost rezultata brojanja, lanci se mogu razbiti ultrazvučnom obradom poduzoraka. Ultrazvučna obrada ne sme trajati duže nego što je potrebno da se lanci razbiju na kraće lance, jer se u protivnom ćelije mogu uništiti. Intenzitet i trajanje ultrazvučne obrade jednaki su kod svih uzoraka.
Na hemocitometru izbrojati dovoljan broj polja (najmanje 400 ćelija) da bi se smanjila odstupanja. Time se poboljšava pouzdanost mikroskopskih određivanja gustine.
Nakon što se lanci ćelija razbiju pažljivom ultrazvučnom obradom, za određivanje ukupne količine ćelija Anabaena može se koristiti elektronski brojač čestica. Ultrazvučnu energiju podesiti tako da se izbegne oštećenje ćelija.
Da bi se dobila dobro izmešana i homogena suspenzija algi za inokulaciju posuda za ispitivanje, koristiti mešalicu bez odbojnika ("vorteks") ili sličan odgovarajući postupak.
Sudove za ispitivanje staviti na rotacionu ili horizontalnu tresilicu na oko 150 obrtaja u minuti. Drugi način da se smanji tendencija stvaranja grudvica kod Anabaena je periodično mućkanje. Kod pojave grudvica paziti da se za merenje biomase dobiju reprezentativni uzorci. Ponekad je pre uzorkovanja potrebno snažno protresti sudove da bi se razbile grudvice algi.
Synechococcus leopoliensis.
Za držanje radne kulture mogu se koristiti različite hranljive podloge. Informacije o pogodnim podlogama mogu se dobiti u zbirkama kultura.
Synechococcus leopoliensis raste u obliku pojedinačnih štapićastih ćelija. Ćelije su veoma male, što otežava merenje biomase brojanjem pod mikroskopom. Ovde mogu da pomognu elektronski brojači čestica opremljeni za brojanje čestica do veličine od oko 1 µm. Osim toga, mogu se koristiti fluorometrijska merenja in vitro.
Navicula pelliculosa
Za držanje radne kulture mogu se koristiti različite hranljive podloge. Informacije o pogodnim podlogama mogu se dobiti u zbirkama kultura. Voditi računa o tome da podloga sadrži silikat.
Navicula pelliculosa može u određenim uslovima rasta da stvara naslage. Ćelije algi ponekad imaju tendenciju da se nakupljaju u površinskoj emulziji zbog proizvodnje lipida. U tim okolnostima kod uzimanja poduzoraka za određivanje biomase preduzimaju se posebne mere da bi se dobili reprezentativni uzorci. Ponekad je potrebno i snažno protresanje npr. uz pomoć mešalice bez odbojnika ("vorteks").
DODATAK 2.
HRANLJIVE PODLOGE
Može se koristiti jedna od dve hranljive podloge:
Podloga OECD TG 201 jeste izvorna podloga Uputstva za ispitivanje OECD 201, takođe je u skladu sa standardom ISO 8692.
Podloga AAP US. EPA takođe je u skladu sa standardom ASTM.
Kod pripreme ovih podloga koristiti hemikalije čistoće PA ("pro analysis") odnosno hemikalije analitičke čistoće i dejonizovanu vodu.
Tabela: Sastav podloge AAP (US. EPA) i podloge OECD TG 201
Sastojak |
EPA |
OECD |
||
mg/l |
mM |
mg/l |
mM |
|
NaHCO3 |
15,0 |
0,179 |
50,0 |
0,595 |
NaNO3 |
25,5 |
0,300 |
|
|
NH4Cl |
|
|
15,0 |
0,280 |
MgCl2·6(H2O) |
12,16 |
0,0598 |
12,0 |
0,0590 |
CaCl2·2(H2O) |
4,41 |
0,0300 |
18,0 |
0,122 |
MgSO4·7(H2O) |
14,6 |
0,0592 |
15,0 |
0,0609 |
K2HPO4 |
1,044 |
0,00599 |
|
|
KH2PO4 |
|
|
1,60 |
0,00919 |
FeCl3·6(H2O) |
0,160 |
0,000591 |
0,0640 |
0,000237 |
Na2EDTA·2(H2O) |
0,300 |
0,000806 |
0,100 |
0,000269 [*] |
H3BO3 |
0,186 |
0,00300 |
0,185 |
0,00299 |
MnCl2·4(H2O) |
0,415 |
0,00201 |
0,415 |
0,00210 |
ZnCl2 |
0,00327 |
0,000024 |
0,00300 |
0,0000220 |
MnCl2·4(H2O) |
0,00143 |
0,000006 |
0,00150 |
0,00000630 |
Na2MoO4·2(H2O) |
0,00726 |
0,000030 |
0,00700 |
0,0000289 |
CuCl2.2(H2O) |
0,000012 |
0,00000007 |
0,00001 |
0,00000006 |
pH |
7,5 |
8,1 |
||
[*] Molarni odnos EDTA - gvožđe je nešto veći od jedan. Time se sprečava taloženje gvožđa i istovremeno smanjuje heliranje teških metalnih jona. |
||||
Kod ispitivanja sa dijatomejom Navicula pelliculosa obe podloge dopuniti sa Na2SiO3·9H2O tako da se dobije koncentracija od 1,4 mg Si/l.
pH vrednost podloge određuje se kad se uspostavi karbonatna ravnoteža između podloge i CO2 u atmosferskom vazduhu. Približni odnos između pH na 25 °C i molarne koncentracije bikarbonata proizlazi iz formule:
pHeq = 11,30 + log [HCO3]
Kod 15 mg NaHCO3, pHeq = 7,5 (podloga U.S. EPA), a kod 50 mg NaHCO3/l, pHeq = 8,1 (podloga OECD).
Tabela: Elementarni sastav podloga za ispitivanje
Element |
EPA |
OECD |
mg/l |
mg/l |
|
C |
2,144 |
7,148 |
N |
4,202 |
3,927 |
P |
0,186 |
0,285 |
K |
0,469 |
0,459 |
Na |
11,044 |
13,704 |
Ca |
1,202 |
4,905 |
Mg |
2,909 |
2,913 |
Fe |
0,033 |
0,017 |
Mn |
0,115 |
0,115 |
Tabela: Priprema podloge OECD
Hranljiva materija |
Koncentracija u radnom rastvoru |
Radni rastvor 1: makronutrijenti |
|
NH4Cl |
1,5 g·l-1 |
Radni rastvor 2: gvožđe |
|
FeCl3·6H2O |
64 mg·l-1 |
Radni rastvor 3: elementi u tragovima |
|
H3BO3 |
185 mg·l-1 |
Radni rastvor 4: bikarbonat |
|
NaHCO3 |
50 g·l-1 |
Radni rastvori se sterilišu membranskom filtracijom (srednji prečnik pora 0,2 µm) ili obradom u autoklavu (120° C, 15 min). Rastvori se čuvaju u mraku na temperaturi od 4° C.
Radni rastvori 2 i 4 ne sterilišu se u autoklavu, već isključivo membranskom filtracijom.
Hranljiva podloga priprema se dodavanjem odgovarajuće zapremine radnih rastvora 1-4 u vodu, i to:
U 500 ml sterilisane vode doda se:
- 10 ml radnog rastvora 1,
- 1 ml radnog rastvora 2,
- 1 ml radnog rastvora 3,
- 1 ml radnog rastvora 4.
Dopuni se sterilizovanom vodom do 1000 ml.
Treba ostaviti dovoljno vremena za uspostavljanje ravnoteže između podloge i atmosferskog CO2, prema potrebi uduvavanjem sterilnog filtriranog vazduha u trajanju od nekoliko sati.
Priprema podloge AAP
1.1. U približno 900 ml dejonizovane ili destilovane vode doda se po 1 ml radnih rastvora iz A1.2.1. - A1.2.7. i razblaži do 1 l.
A1.2. Pripremi se radni rastvori sa makronutrijentima rastvaranjem sledećih količina supstance u 500 ml dejonizovane ili destilovane vode. Reagensi A1.2.1, A1.2.2, A1.2.3. i A1.2.4. se mogu objediniti u jedan radni rastvor.
A1.2.1. NaNO3 - 12,750 g.
A1.2.2. MgCL2·6H2O - 6,082 g.
A1.2.3. CaCl2·2H2O - 2,205 g.
A1.2.4. Radni rastvor sa mikronutrijentima - (videti napomenu A1.3. ove metode).
A1.2.5. MgSO4 7H2O - 7,350 g.
A1.2.6. K2HPO4 - 0,522 g.
A1.2.7. NaHCO3 - 7,500 g.
A1.2.8. Na2SiO3·9H2O - videti napomenu A1.1.
Napomena A1.1. - Koristiti samo kod ispitivanja s dijatomejama. Može se dodati direktno (202,4 mg) ili putem radnog rastvora tako da se dobije konačna koncentracija 20 mg/l Si u podlozi.
A1.3. Pripremi se radni rastvor sa makronutrijentima rastvaranjem sledećih količina supstance u 500 ml dejonizovane ili destilovane vode.
A1.3.1. H3BO3 - 92,760 mg.
A1.3.2. MnCl2·4H2O - 207,690 mg.
A1.3.3. ZnCl2 - 1,635 mg.
A1.3.4. FeCl3·6H2O - 79,880 mg.
A1.3.5. CoCl2·6H2O - 0,714 mg.
A1.3.6. Na2MoO4·2H2O - 3,630 mg.
A1.3.7. CuCl2·2H2O - 0,006 mg.
A1.3.8. Na2EDTA·2H2O - 150,000 mg.
[dinatrijum-etilendiamintetraacetat].
A1.3.9. Na2SeO4·5H2O-0,005 mg videti napomenu A1.2
Napomena A1.2 Koristiti samo u podlozi za radne kulture sa dijatomejama.
A1.4. pH podesiti na 7,5 ± 0,1 sa 0,1 N ili 1,0 N NaOH ili HCl.
A1.5. Podloga se profiltrira u sterilnu posudu kroz membranski filter 0,22 μm, ako se koristi brojač čestica, ili kroz membranski filter 0,45-μm, ako se ne koristi brojač čestica.
A1.6. Podloga se do upotrebe čuva u mraku na temperaturi od oko 4° C.
DODATAK 3.
PRIMER POSTUPKA ZA GAJENJE KULTURE ALGI
Opšte napomene
Gajenje kultura u skladu sa ovim postupkom sprovodi se radi dobijanja kultura algi za toksikološka ispitivanja.
Treba koristiti odgovarajuće metode kako se kulture algi ne bi kontaminirale bakterijama. Aksenične kulture mogu biti poželjne, ali se uspostavljaju i koriste kulture koje sadrže samo jednu vrstu algi.
Sve postupke obavljati u sterilnim uslovima kako bi se izbeglo zagađenje bakterijama i drugim algama.
Oprema i materijali
Videti Deo prvi ove metode, odeljak 1.8.1.
Postupci za dobijanje kultura algi
Priprema hranljivih rastvora (podloga)
Sve hranljive soli podloge pripremaju se kao koncentrovani radni rastvori i čuvaju na tamnom i hladnom mestu. Ovi rastvori se sterilišu filtracijom ili obradom u autoklavu.
Podloga se priprema dodavanjem odgovarajuće količine radnog rastvora u sterilnu destilovanu vodu, pazeći da ne dođe do infekcije. Kod čvrstih podloga dodaje se 0,8% agara.
Radna kultura
Radne kulture su male kulture algi koje se redovno presejavaju u svežu podlogu i koriste kao polazni ispitivani materijal. Ako se kulture ne koriste redovno, one se nanose na kosi agar. Kulture se presejavaju u svežu podlogu najmanje jedanput u dva meseca.
Radne kulture se gaje u erlenmajerima koji sadrže odgovarajuću podlogu (oko 100 ml). Kada se alge inkubiraju na 20° C uz neprekidno osvetljenje, potrebno je nedeljno presejavanje.
Kod presejavanja, određena količina "stare" kulture se prenese sterilnim pipetama u sud sa svežom podlogom tako da kod brzorastućih vrsta početna koncentracija bude oko 100 puta niža nego u staroj kulturi.
Brzina rasta vrste može se odrediti iz krive rasta. Ako je ona poznata, moguće je proceniti gustinu pri kojoj kulturu preneti u novu podlogu. To se čini pre nego što kultura dostigne fazu odumiranja.
Predkultura
Predkultura treba da da određenu količinu algi koje su pogodne za inokulaciju ispitivanih kultura. Predkultura se inkubira u uslovima ispitivanja i koristi dok još eksponencijalno raste, po pravilu nakon perioda inkubacije od 2 dana do 4 dana. Kulture algi koje sadrže deformisane ili abnormalne ćelije odbaciti.
DODATAK 4.
ANALIZA PODATAKA NELINEARNOM REGRESIJOM
Opšte napomene
Kod ispitivanja sa algama i drugih ispitivanja mikrobiološkog rasta - rasta biomase odgovor je po prirodi stvari kontinuirana ili metrička promenljiva: brzina procesa, ako se koristi brzina rasta, odnosno njen vremenski integral, ako je odabrana biomasa. Oba parametra se stavljaju u odnos prema odgovarajućem srednjem odgovoru ponavljanja neizloženih kontrola koje najjače reaguju na date uslove - u ispitivanju sa algama najvažniji faktori su svetlost i temperatura. Sistem je podeljen ili homogen, a biomasa se može posmatrati kao kontinuum bez razmatranja pojedinačnih ćelija. Raspodela varijanse za odgovore kakvi se javljaju kod ovakvih sistema zavisi isključivo od probnih faktora (koji se obično opisuju putem log-normalnih ili normalnih raspodela greške). To je u suprotnosti sa tipičnim odgovorima kod bioanalize sa kvantalnim podacima, gde se tolerancija (po pravilu sa binomnom raspodelom) pojedinačnih organizama često smatra dominantnom komponentom varijanse. Ovde su odgovori kontrola nula ili na nivou osnovne vrednosti.
U najjednostavnijem slučaju normirani odnosno relativni odgovor, r, ravnomerno opada od 1 (nulta inhibicija) do 0 (stopostotna inhibicija). Treba zapaziti da su svi odgovori povezani sa greškom i da se očigledne negativne inhibicije mogu izračunati samo kao rezultat slučajne greške.
Regresiona analiza
Modeli
Cilj regresione analize je da se kvantitativno opiše kriva koncentracija-odgovor u obliku matematičke regresione funkcije Y = f (C) ili češće F (Z), gde je Z = log C. Inverzna funkcija C = f-1 (Y) omogućava izračunavanje vrednosti ECx, uključujući EC50, EC10 i EC20 i njihove granice pouzdanosti od 95%. Pokazalo se da nekoliko jednostavnih matematičkih funkcija uspešno opisuju odnose koncentracija-odgovor koji se dobijaju u ispitivanjima inhibicije rasta algi. Te funkcije obuhvataju npr. logističku jednačinu, nesimetričnu Vejbulovu jednačinu i funkciju log-normalne raspodele, koje sve predstavljaju sigmoidne krive koje se asimptotski približavaju vrednosti 1 kad C → 0 i nuli kad C → beskonačno.
U poslednje vreme, kao alternativa asimptotskim modelima predlaže se korišćenje modela neprekinute funkcije s pragom (npr. Kojmanov model "inhibicije rasta populacije", Kooijman et al., 1996). Kod ovog modela polazi se od pretpostavke da u koncentracijama ispod određenog praga (EC0+) nema nikakvih efekata; EC0+ se procenjuje ekstrapolacijom odnosa koncentracija - odgovor sa presekom u osi koncentracije primenom jednostavne neprekinute funkcije, koja nije diferencijabilna u polaznoj tački.
Treba zapaziti da se analiza može pojednostaviti metodom najmanjih kvadrata (uz pretpostavku stalne varijanse) ili ponderisanih kvadrata, ako se ispravlja heterogenost varijanse.
Postupak
Postupak se može ukratko opisati na sledeći način: odabere se odgovarajuća funkcionalna jednačina, Y = f (C), i prilagodi podacima nelinearnom regresijom. Poželjno je da se umesto srednjih vrednosti ponavljanja koriste merenja pojedinačnih uzoraka/sudova kako bi se iz podataka izvuklo što je moguće više informacija. Sa druge strane, ako je varijansa visoka, praktična iskustva pokazuju da srednje vrednosti ponavljanja mogu dati pouzdaniju matematičku procenu uz manji uticaj sistemskih problema nego što je to slučaj kada se zadrže pojedinačne tačke.
Napravi se grafički prikaz podešene krive i izmerenih vrednosti i proveri da li je podešavanje ispravno obavljeno. Ovde se naročito korisnom može pokazati analiza reziduala. Ako funkcionalni odnos koji je odabran za prilagođavanje krive koncentracija-odgovor ne opisuje dobro čitavu krivu ili neki njen bitni deo, npr. odgovor pri niskim koncentracijama, za prilagođavanje krive izabrati neku drugu opciju - npr. nesimetrična kriva Vejbul funkcije umesto simetrične. Negativne inhibicije mogu da predstavljaju problem npr. kod funkcije log-normalne raspodele, i da zahtevaju da se upotrebi i alternativna regresiona funkcija. Nije preporučljivo da se tim negativnim vrednostima dodeli vrednost nula ili mala pozitivna vrednost jer se time iskrivljuje raspodela grešaka. Ponekad je primereno napraviti posebno prilagođavanje određenih delova krive, npr. deo krive sa niskom inhibicijom kako bi se dobila procena vrednosti EClow x. Iz prilagođene jednačine se izračunaju ("inverznom procenom" C = f-1 (Y)) karakteristične procene tačaka ECx i dokumentuje najmanje EC50 i jedna ili dve procene EClow x. Iskustva sa praktičnim ispitivanjima pokazuju da je test sa algama dovoljno precizan da se po pravilu može dobiti dovoljno tačna procena kod inhibicije od 10%, pod uslovom da su tačke podataka dovoljne - osim ako se pri niskim koncentracija javlja stimulacija rasta kao faktor prilagođavanja. Preciznost procene EC20 često je znatno veća od EC10 jer je EC20 obično smešten u približno linearnom delu centralne krive koncentracija-odgovor. Ponekad se EC10 teško tumači zbog stimulacije rasta. Prema tome, iako se EC10 po pravilu može dobiti sa dovoljnom tačnošću, preporučuje se da se uz njega uvek navede i EC20.
Ponderi
Varijansa eksperimenta uopšteno nije stalna i obično uključuje proporcionalnu komponentu; stoga je uvek dobro izvršiti ponderisanu regresiju.
Wi = 1/Var(ri)
Mnogi regresioni programi nude mogućnost ponderisane regresione analize primenom pondera koji su navedeni u tabeli. Ponderi se radi jednostavnosti normiraju množenjem sa n/S wi (n je broj tačaka podataka) tako da njihov zbir bude 1.
Normalizovanje odgovora
Normalizovanjem srednjeg odgovora kontrola javljaju se neki temeljni problemi i dobija prilično komplikovana struktura varijanse. Deljenjem odgovora sa srednjim odgovorom kontrola da bi se dobio procenat inhibicije uvodi se dodatna greška koja proizlazi iz greške srednje kontrolne vrednosti. Osim u slučaju kad je ta greška zanemarljivo mala, ponderi regresije i granice pouzdanosti ispravljaju se za kovarijansu sa kontrolom17. Ovde je važna preciznost procene srednje vrednosti kontrolnih odgovora kako bi se smanjila ukupna varijansa relativnog odgovora.
Napomena: indeks i se odnosi na koncentraciju i, a indeks 0 na kontrolu.
Yi = relativni odgovor = ri/r0 = 1 - I = ¦(Ci)
uz varijansu:
Var(Yi) = Var(ri / r0) @ (¶Yi / ¶ri)2× Var(ri) + (¶Yi / ¶r0)2 x Var(r0)
budući da je:
(¶Yi / ¶ri) = 1 / r0 i (¶Yi / ¶r0) = ri / r0
uz normalnu raspodelu podataka i ponavljanja mi i m0:
Var(ri) = σ2/mi
ukupna varijansa relativnog odgovora Yi je prema tome:
Var(Yi) = σ2/(r02 mi)+ri2 x σ2/ro4 m0
Greška srednje kontrolne vrednosti je obrnuto proporcionalna kvadratnom korenu broja prosečnih kontrolnih ponavljanja i stoga je ponekad opravdano uključiti podatke iz ranijih ispitivanja, čime se može znatno smanjiti greška. Alternativni postupak je da se umesto normiranja podataka i prilagođavanja apsolutnih odgovora uključujući podatke o kontrolnim odgovorima, kontrolni odgovor uvede kao dodatni parametar koji se prilagođava nelinearnom regresijom. Ova metoda uz uobičajenu jednačinu regresije sa 2 parametra zahteva prilagođavanje 3 parametra, tako da je potrebno više tačaka podataka nego što je to slučaj kod nelinearne regresije podataka normiranih korišćenjem unapred definisanog kontrolnog odgovora.
Inverzni intervali pouzdanosti
Izračunavanje intervala poverenja nelinearne regresije inverznom procenom je prilično složeno i ne predstavlja standardnu opciju u uobičajenim statističkim računarskim programskim paketima. Približne granice pouzdanosti mogu se dobiti standardnim programima nelinearne regresije sa reparametrizacijom (Brus i Versteeg, 1992), što podrazumeva preradu matematičke jednačine tako da se na mesto parametara za procenu uvrste željene procene tačaka, npr. EC10 i EC50. (Ako je funkcija I = f (α, β, koncentracija), funkciju f (α, β, koncentracija) zameniti identičnom funkcijom g (EC10, EC50, koncentracija), koristeći definicijske odnose f (α, β, EC10) = 0,1 and f (α, β, EC50) = 0,5.
Direktnije izračunavanje dobija se ako se zadrži izvorna jednačina i upotrebi Tejlorov razvoj oko srednjih vrednosti ri i r0.
U poslednje vreme postale su popularne metode ponovnog uzorkovanja sa ponavljanjem ("bootstrap" metode). Te metode uključuju procenu empirijske raspodele varijanse na osnovu izmerenih podataka i učestalog uzorkovanja primenom generatora slučajnih brojeva.
Literatura
1. Kooijman, S.A.L.M.; Hanstveit, A.O.; Nyholm, N. (1996): No-effect concentrations in algal growth inhibition tests. Water Research, 30, 1625-1632.
2. Bruce, R.D. and Versteeg, D.J.(1992) A Statistical Procedure for Modelling Continuous Ecotoxicity Data. Env. Toxicol. Chem.11, 1485-1494.
3. Andersen, J.S., Holst, H., Spliid, H., Andersen, H., Baun, A. & Nyholm, N. (1998): Continuous ecotoxicological data evaluated relative to a control response. Journal of Agricultural, Biological and Environmental Statistics, 3, 405-420
C.4. ODREĐIVANJE BRZE BIORAZGRADLJIVOSTI
Deo prvi
1. OPŠTA RAZMATRANJA
1.1. UVOD
Za trijažu hemikalija prema brzoj biorazgradljivosti u aerobnom vodenom medijumu koriste se sledeće metode ispitivanja:
1. Nestajanje DOC (Metoda C.4-A);
2. Modifikovana OECD trijaža - Nestajanje DOC (Metoda C.4-B);
3. Razvijanje metode C.4-B (Modifikovani Sturm test) (Metoda C.4-C);
4. Manometrijska respirometrija (Metoda C.4-D);
5. Ispitivanje u zatvorenoj boci (Metoda C.4-E);
6. MITI ispitivanje (Metoda C.4-F).
Opšta i zajednička razmatranja svih šest metoda data su u odeljku 1. U odeljku 2. do 7. dati su posebni detalji za pojedine metode. Prilozi sadrže definicije, formule i uputstva.
Međulaboratorijsko poređenje, koje je 1988. godine sproveo OECD, pokazalo je da metode daju postojane rezultate. Zavisno od fizičkih svojstava ispitivane hemikalije, prioritet ima jedna ili druga metoda.
1.2. DEFINICIJE
Rastvoreni kiseonik (Dissolved Oxygen, u daljem tekstu: DO) jeste koncentracija kiseonika rastvorenog u uzorku vode, izražava se u mg/l.
Biohemijska potrošnja kiseonika (u daljem tekstu: BPK) jeste količina kiseonika koju utroše mikroorganizmi pri razgradnji ispitivanog jedinjenja, izražava se u gramima. BPK se takođe izražava kao gram potrošenog kiseonika po gramu ispitivanog jedinjenja (videti Metodu C.5. koja je data u ovom prilogu).
Hemijska potrošnja kiseonika (u daljem tekstu: HPK) jeste količina kiseonika potrošenog u toku oksidacije ispitivanog jedinjenja sa vrućim, kiselim bihromatom; daje meru količine prisutne supstance koja oksidiše. Izražava se u gramima, i kao gram kiseonika potrošenog po gramu ispitivanog jedinjenja.
Rastvoreni organski ugljenik (Dissolved Organic Carbon, u daljem tekstu: DOC) jeste organski ugljenik prisutan u rastvoru ili onaj koji prolazi kroz 0,45 µ filter ili ostaje u supernatantu nakon centrifugiranja na 40.000 m/s2 (± 4000 g) u toku 15 minuta.
Teoretska potrošnja kiseonika (Theoretical Oxygen Demand, u daljem tekstu: ThOD) jeste ukupna količina kiseonika (u mg) potrebna da se hemikalija potpuno oksidiše. Izračunava se iz molekulske formule (videti odeljak 2.2. ove metode) i takođe se izražava u mg potrebnog kiseonika po mg ispitivanog jedinjenja.
Teoretski ugljen-dioksid (Theoretical Carbon Dioxide, u daljem tekstu: ThC.4-B) jeste izračunata količina CO2 (u mg), koja nastaje iz poznatog ili izmerenog sadržaja ugljenika u ispitivanom jedinjenju, kada se ono u potpunosti mineralizuje; takođe se izražava u mg ugljen-dioksida po mg ispitivanog jedinjenja.
Ukupni organski ugljenik (Total Organic Carbon, u daljem tekstu: TOC) uzorka jeste suma organskog ugljenika u rastvoru i onog u suspenziji.
IC (Inorganic Carbon) jeste neorganski ugljenik.
Ukupni ugljenik (Total Carbon, u daljem tekstu: TC) jeste suma organskog i neorganskog ugljenika prisutnog u uzorku.
MITI (Ministry Of International Trade And Industry, Japan) jeste Ministarstvo međunarodne trgovine i industrije Japana.
Primarna biorazgradnja jeste promena u hemijskoj strukturi supstance izazvana biološkim delovanjem, koja dovodi do gubitka specifičnog svojstva te supstance.
Potpuna biorazgradnja (aerobna) jeste nivo razgradnje koji se postiže kada ispitivano jedinjenje u potpunosti iskoriste mikroorganizmi, pri čemu nastaju ugljen-dioksid, voda, mineralne soli i nove ćelijske strukture (biomase).
Brzo biorazgradljiva supstanca jeste arbitrarna klasifikacija hemikalija koje su prošle određene specifične skrining testove za potpunu biorazgradljivost. Ovi testovi su toliko striktni da se smatra da se takva jedinjenja brzo i potpuno biorazgrađuju u vodenoj životnoj sredini pri aerobnim uslovima.
Inherentno biorazgradljiva supstanca jeste klasifikacija hemikalija za koje, na osnovu ispitivanja biorazgradljivosti, postoji nedvosmislen dokaz da podležu biorazgradnji (primarnoj ili potpunoj).
Uklonjivost jeste podložnost jedinjenja uklanjanju putem biološkog prečišćavanja otpadnih voda, bez negativnog uticaja na uobičajeni proces obrade otpadnih voda. Brzo biorazgradljiva jedinjenja se mogu ukloniti, ali ne i sva inherentno biorazgradljiva jedinjenja. Procesu uklanjanja mogu doprineti i abiotički procesi.
Vreme kašnjenja jeste vreme od inokulacije, u ispitivanju nestanka, pa do momenta kada razgradnja dostigne nivo od najmanje 10%. Vreme kašnjenja veoma često varira i teško se reprodukuje.
Vreme razgradnje nastupa nakon vremena kašnjenja i traje do momenta kada se dostigne 90% od maksimalnog nivoa razgradnje.
Desetodnevni period je period od 10 dana koji nastupa odmah pošto se dostigne nivo razgradnje od 10%.
1.3. IZBOR ODGOVARAJUĆE METODE
Za izbor najprikladnije metode, neophodni su podaci o rastvorljivosti, naponu pare i adsorpcionim svojstvima hemikalije. Treba poznavati hemijsku strukturu ili formulu da bi se izračunale teoretske vrednosti, odnosno proveriti izmerene vrednosti parametara, npr. ThOD, ThC.4-B, DOC, TOC i HPK (videti Deo drugi ove metode).
Hemikalije čija rastvorljivost nije niža od 100 mg/l mogu se ispitivati svim metodama ako nisu isparljive i ako se ne adsorbuju. Za one hemikalije koje su slabo rastvorljive u vodi, isparljive ili se adsorbuju, pogodne metode su naznačene u Tabeli 1. Mogući načini postupanja sa hemikalijama koje su slabo rastvorljive u vodi i koje su isparljive opisan je u Delu trećem ove metode. Srednje isparljive hemikalije mogu se ispitati pomoću metode Nestajanje DOC(Metoda C.4-A), ako u ispitivanim posudama (koje treba da budu adekvatno zapušene) ima dovoljno prostora za gas. U ovom slučaju, obavezno se postavlja abiotička kontrola kako bi se uzeo u obzir i bilo kakav fizički gubitak.
Tabela 1: Primenljivost metoda ispitivanja
Metoda ispitivanja |
Analitička metoda |
Prikladnost za supstance: |
||
koje su slabo rastvorljive |
koje su |
koje se |
||
Nestajanje DOC |
Rastvoreni organski ugljenik |
- |
- |
+/- |
Modifikovana OECD trijaža - Nestajanje DOC |
Rastvoreni organski ugljenik |
- |
- |
+/- |
Razvijanje C.4-B |
Respirometrija: |
+ |
- |
+ |
Manometrijska respirometrija |
Man. respirometrija: |
+ |
+/- |
+ |
Ispitivanje u zatvorenoj boci (Metoda C.4-E) |
Respirometrija: |
+/- |
+ |
+ |
MITI ispitivanje |
Respirometrija: |
+ |
+/- |
+ |
Za tumačenje dobijenih rezultata neophodni su podaci o stepenu čistoće ili relativnom udelu glavnih sastojaka ispitivanog materijala, posebno kad su vrednosti rezultata niske ili granične.
Podaci o toksičnom dejstvu ispitivane hemikalije na bakterije (videti Deo četvrti ove metode) mogu biti vrlo korisni pri izboru prikladnih koncentracija za ispitivanje. Navedeni podaci mogu biti od suštinske važnosti za ispravno tumačenje niskih vrednosti biorazgradnje.
1.4. REFERENTE SUPSTANCE
Za proveru postupka ispituju se referentne hemikalije koje ispunjavaju kriterijume brze biorazgradljivosti i to tako što se uporedo sa ispitivanim postave i posude sa referentnom supstancom.
Podesne hemikalije su anilin (sveže destilovan), natrijum acetat i natrijum benzoat. Referentne hemikalije razgrađuju se primenom ovih metoda čak i kad namerno nije dodat nikakav inokulum.
Sugerisano je da treba tražiti referentnu hemikaliju koja je brzo biorazgradljiva, ali zahteva dodavanje inokuluma. Predložen je kalijum hidrogen-ftalat, ali je neophodno da se pribavi još dokaza za ovu supstancu pre nego što se ona prihvati kao referentna supstanca.
U respirometrijskim ispitivanjima, jedinjenja koji sadrže azot mogu uticati na potrošnju kiseonika usled nitrifikacije (videti Deo drugi i peti ove metode).
1.5. PRINCIP METODE
Rastvor ili suspenzija ispitivane supstance u mineralnoj podlozi inokuliše se i inkubira u aerobnim uslovima u mraku ili pod difuznim osvetljenjem. Količina DOC u ispitivanom rastvoru koja je poreklom iz inokuluma je što niža u poređenju sa količinom DOC iz ispitivane supstance. Računa se i na endogenu aktivnost inokuluma. Uporedo se postavlja slepa proba sa inokulumom, ali bez ispitivane supstance, iako se endogena aktivnost ćelija u prisustvu supstance ne poklapa sa onom u endogenoj kontroli. Uporedo se ispituje i referentna supstanca, kako bi se proverilo izvođenje samog postupka.
Nakon razgradnje sledi određivanje parametara poput DOC, produkcija C.4-B i potrošnja kiseonika, a merenja se sprovode u dovoljno čestim vremenskim intervalima kako bi se omogućilo utvrđivanje početka i kraja biorazgradnje. Merenje se sprovodi kontinuirano automatskim respirometrima. DOC se ponekad meri uporedo sa nekim drugim parametrom, i to na početku ili na kraju ispitivanja. Procena primarne razgradnje ispitivane supstance, kao i utvrđivanje koncentracija međuproizvoda koji mogu nastati, može se utvrditi pomoću specifične hemijske analize (obavezno u MITI ispitivanju).
Ispitivanje obično traje 28 dana. Ispitivanje se može završiti i pre isteka 28 dana, odnosno čim kriva biorazgradnje dostigne plato u najmanje tri određivanja. Ispitivanje se može produžiti posle 28 dana kada se po krivoj može videti da je biorazgradnja započeta, ali plato nije dostignut 28. dana.
1.6. KRITERIJUMI KVALITETA
1.6.1. Ponovljivost
Zbog prirode biorazgradnje i mešanih populacija bakterija koje se koriste kao inokulumi, ispitivanje se sprovodi najmanje u duplikatu.
Što je veća početna koncentracija mikroorganizama koja se prvobitno dodaje u ispitivanu podlogu, to je manje odstupanje između replika. Međulaboratorijska ispitivanja su pokazala da mogu postojati velika odstupanja među rezultatima dobijenih u različitim laboratorijama, mada se dobro slaganje obično postiže sa lako biorazgradljivim jedinjenjima.
1.6.2. Prihvatljivost ispitivanja
Ispitivanje se smatra validnim ukoliko na kraju ispitivanja ili na kraju 10-dnevnog perioda, zavisno od slučaja, razlika između krajnjih vrednosti, dobijenih pri dostizanju platoa razgradnje ispitivane supstance u ponovljenim ispitivanjima, iznosi manje od 20% i ako je procenat razgradnje referentne supstance dostigao nivo za brzu biorazgradljivosti od 14 dana.
Ako ni jedan od ovih uslova nije ispunjen, ispitivanje se ponavlja. Usled isključivosti metode, niske vrednosti nužno ne znače da ispitivana supstanca nije biorazgradljiva u uslovima životne sredine, ali ukazuju da je potrebno još rada da se ustanovi biorazgradljivost.
Ako se u ispitivanju toksičnosti, koje uključuje i ispitivanu supstancu i referentnu hemikaliju, desi manje od 35% razgradnje (na osnovu DOC) ili manje od 25% (na osnovu ThOD ili ThC.4-B) u roku od 14 dana, za ispitivanu hemikaliju se može pretpostaviti da je inhibitorna (videti Deo četvrti ove metode). Serije ispitivanja se ponavljaju, ako je moguće korišćenjem niže koncentracije ispitivane hemikalije, odnosno više koncentracije inokuluma, ali ne više od 30 mg/l čvrste faze.